Universidade de Trás-os-Montes e Alto Douro
Estudo da Transição Epitélio-Mesênquima
nos Adenocarcinomas do Endométrio de Gata
Dissertação de Mestrado em Biologia Clínica
Laboratorial
EMILIE FREITAS ALVES
Orientadora: Professora Doutora Maria dos Anjos Clemente Pires
ii
Universidade de Trás-os-Montes e Alto Douro
Estudo da Transição Epitélio-Mesênquima
nos Adenocarcinomas do Endométrio de Gata
Dissertação de Mestrado em Biologia Clínica Laboratorial
EMILIE FREITAS ALVES
Orientadora:
Professora Doutora Maria dos Anjos Clemente Pires
Composição do Júri:
Professora Doutora Ana Margarida Calado Professora Doutora Rita Payan Carreira Professor Doutor Dario Loureiro dos Santos
Professora Doutora Maria dos Anjos Clemente Pires
iii
Agradecimentos
À Universidade de Trás-os-Montes e Alto Douro pela possibilidade de elaborar esta dissertação de mestrado.
Ao Laboratório de Histologia e Anatomia Patológica da Universidade de Trás-os-Montes e Alto Douro e ao CECAV pela cedência dos meios para a realização deste estudo e pela a cedência de imagens constantes nesta tese efetuadas no microscópio Nikon E-600 (projeto UID/CVT/00772/2013), e aquisição de imagem com o programa NIS elements D, da Nikon.
À Professora Doutora Maria dos Anjos Pires, por todos os conhecimentos transmitidos, por toda a disponibilidade e paciência demonstradas e principalmente pela oportunidade para desenvolver este estudo.
Á técnica Lígia Bento e á Vanessa pela disponibilidade e colaboração ao longo do trabalho. Á D.ª Glória Milagres e Dª. Ana Plácido pela boa disposição e prestabilidade.
Aos meus pais e irmão, pelo carinho e atenção dados incondicionalmente, apesar de longe.
Á minha irmã, por todo o carinho que me deu e continua a dar.
Ao Vítor, pela paciência que teve durante este período da minha vida. Pelo carinho e amor demonstrado sempre e incondicionalmente.
À minhas melhores amigas, pelo carinho, apoio e motivação que me deram na realização deste trabalho, bem como pela paciência nos momentos menos positivos.
A todas as pessoas que fizeram parte do meu percurso académico, por todos os momentos partilhados e pelas memórias que ficarão.
iv Resumo
O útero da gata é um local pouco comum para o desenvolvimento de neoplasias. O adenocarcinoma do endométrio é uma neoplasia epitelial maligna, rara em animais domésticos, exceto coelhos e vacas. Contudo, estudos recentes referem que, na gata, este tipo de adenocarcinoma possa ser mais comum do que até aqui descrito.
A ocorrência da transição epitélio-mesênquima (TEM) durante a progressão tumoral permite às células neoplásicas adquirirem a capacidade de infiltrar o tecido circundante e metastizar, formando um tumor secundário. Este processo está associado à perda ou baixa regulação dos marcadores epiteliais, tal como a caderina-E, que regula a adesão entre estas células.
As metaloproteinases de matriz (MMPs) estão envolvidas na degradação da MEC. Em neoplasias malignas, promovem a progressão e metastização tumoral, assim como a TEM, ao reprimir, indiretamente, a caderina-E.
Foi objetivo deste trabalho a identificação das MMP-1, -2 e -9 no endométrio cíclico e nas lesões uterinas da gata.
A expressão da MMP-1, -2 e -9 foi estudada em amostras de útero de gata normais, na fase proliferativa (n = 6) e secretora (n = 8) do ciclo éstrico, assim como em amostras com inflamação (n = 6), hiperplasia quística (n = 8/9/12) e em adenocarcinomas do endométrio da gata (AEG) (n = 21/22). Usou-se a técnica de imunohistoquímica indireta com o anticorpo anti-MMP-1 (diluição 1:100), anti-MMP-2 (1:100) e anti-MMP-9 (1:150). A intensidade de marcação foi avaliada como ausente (zero), fraca (+), moderada (++) ou intensa (+++).
Observou-se uma diminuição na expressão da MMP-1 e -9 com diferenças estatisticamente significativas (p < 0,05) em relação à fase estrogénica no caso das piómetras e hiperplasias quística, enquanto que esta diferença só se observou entre as AEGs e fase estrogénica para a MMP-1. Esta fase apresentou uma maior expressão da MMP-1 e -9 quando comparada a fase secretora. Contudo, não encontramos diferenças estatisticamente significativas na expressão da MMP-2 nos AEGs em relação ao útero normal, assim como para a piómetra e hiperplasia quística com o útero normal e também na comparação das fases normais.
Este estudo revelou que o útero cíclico fisiológico apresenta uma maior expressão da MMP-1 e -9 na fase proliferativa, o que poderá estar relacionado com a remodelação celular que precede a maior expressão glandular da fase secretora. Contudo, contrariamente ao
v
esperado, a expressão destas MMPs nos AEGs é significativamente menor que na fase proliferativa, contrastando com o descrito na literatura para esses tumores na mulher. Uma vez que a atividade das MMPs reprime, indiretamente, a caderina-E, quebrando as interações célula-célula e que esta pode ser modulada pelos seus inibidores (TIMPs) locais, são desejáveis estudos adicionais para esclarecer o papel das MMPs nos AEGs.
Palavras-chave: gata, adenocarcinoma do endométrio, metaloproteinases de matriz, piómetra, hiperplasia quística, transição epitélio-mesênquima
vi Abstract
The cat’s uterus is an uncommon location for the development of neoplasms. Endometrial adenocarcinoma is an epithelial malignant neoplasm, which is rare in domestic animals, except in rabbits and cows. However, recent studies show that, in the queen, this type of adenocarcinoma may be more common than described.
The occurrence of epithelial-mesenchymal transition (EMT), during tumor progression, allows cancerous cells to acquire the ability to infiltrate the surrounding tissue and metastasize, forming a secondary tumor. This process is associated to the loss or down regulation of epithelial markers, such as E-cadherin, which regulates epithelial cell-cell adhesion.
Matrix metalloproteinases (MMPs) are involved in the degradation of the extracellular matrix (ECM). In malignant neoplasms, they favor tumor progression and metastasis, as well as EMT, by indirectly suppressing E-cadherin.
The purpose of this study was to evaluate the expression of MMP-1, -2 and -9 in normal endometrium tissues and uterus lesions of the cat.
The expression of MMP-1, -2 and -9 were studied in the normal queen’s uterus, in the proliferative (n = 6) and secretory (n = 8) phases of the estrous cycle, as well as in pyometra (n = 6), cystic hyperplasia (n = 8/9/12) and feline endometrial adenocarcinoma (FEA) (n = 21/22). The samples were submitted to the indirect immunohistochemistry method with anti-MMP-1 (1: 100), anti-MMP-2 (1:100) and anti-MMP-9 (1:150) antibodies. The intensity of immunelabelling was evaluated as null, weak (+), moderate (++) or intense (+++)
We observed a decreased expression of MMP-1 and -9 with statistically significant differences (p < 0,05) in relation to the estrogenic phase with the pyometras and cystic hyperplasia, whereas this difference was only observed between FEA and estrogenic phase for MMP-1. This phase presented greater expression of MMP-1 and -9 when compared to the secretory phase. However, no statistically significant differences were found in the expression of MMP-2 in FEA in relation to the normal uterus as well as for pyometra and cystic hyperplasia with the normal uterus and for the comparison of the normal phases.
This study shows that the physiologic cyclic uterus presents a greater expression of MMP-1 and -9 in the proliferative phase, that may be related to the cellular remodeling that precedes the larger glandular expression of the secretory phase. In contrast, unlike expected, the expression of these metalloproteinases in FEA is significantly lower than in the
vii
proliferative phase, dissimilar to what was described in the literature for these tumors in the women. As the MMPs activity repress, indirectly, E-cadherin, which result in the dissolution of cell-cell interactions and can be modulated by its inhibitors (TIMPs) in the local, additional studies are needed to clarify the MMPs relevance in the FEA.
Keywords: cat, endometrial adenocarcinoma, matrix metalloproteinases, pyometra, cystic hyperplasia, epithelial-mesenchymal transition
viii Índice geral Agradecimentos ... iii Resumo ... iv Palavras-chave ... v Abstract ... vi Keywords ... vii Índice de figuras ... x
Índice de tabelas ... xiii
Abreviaturas ... xiv
Capítulo I – Revisão Bibliográfica ... 1
1. Introdução ... 1 2. Morfofisiologia 2.1. Ciclo éstrico... 2 2.1.1. Proestro ... 2 2.1.2. Estro ... 2 2.1.3. Interestro ... 3 2.1.4. Diestro ... 3 2.1.5. Anestro ... 3
2.2. Aparelho reprodutor da gata ... 4
3. Lesões uterinas na gata ... 6
3.1. Hiperplasia quística do endométrio ... 7
3.2. Piómetra ... 8
3.3. Adenocarcinoma do endométrio da gata ... 9
3.3.1. Sinais clínicos, diagnóstico e tratamento ... 12
3.3.2. Adenocarcinoma do endométrio na mulher ... 13
4. Metaloproteinases de matriz ... 14
4.1. MMP-1 ... 16
4.2. MMP-2 e MMP-9 ... 17
5. Transição epitélio-mesenquima ... 18
ix
Capítulo II – Objetivos ... 23
Capítulo III – Materiais e Métodos ... 25
1. Materiais ... 25 2. Métodos ... 26 2.1. Imunohistoquímica ... 26 3. Avaliação da marcação ... 27 4. Tratamento estatístico ... 28 Capítulo IV – Resultados ... 29 1. MMP-1 ... 29 2. MMP-2 ... 39 3. MMP-9 ... 47 Capítulo V – Discussão ... 59 Capítulo VI - Conclusões ... 65
x Índice de Figuras
Figura 1: Visão geral das fases do ciclo éstrico. ... 2
Figura 2: Aspeto microscópico da parede uterina da gata na fase progestagénica. 4 Figura 3: Hiperplasia quística do endométrio. Observe-se a presença de quistos (a) de várias dimensões e conteúdo seromucoso. ... 7
Figura 4: Piómetra no útero da gata. Observe-se a presença de exsudado purulento no lúmen uterino e no interior de quistos formado no epitélio hiperplásico. HE. ... 8
Figura 5: Aspetos morfológicos de AEG... 12
Figura 6: Transição epitélio-mesênquima. ... 19
Figura 7: Transição epitélio-mesênquima na progressão tumoral. ... 20
Figura 8: Método direto e indireto. ... 22
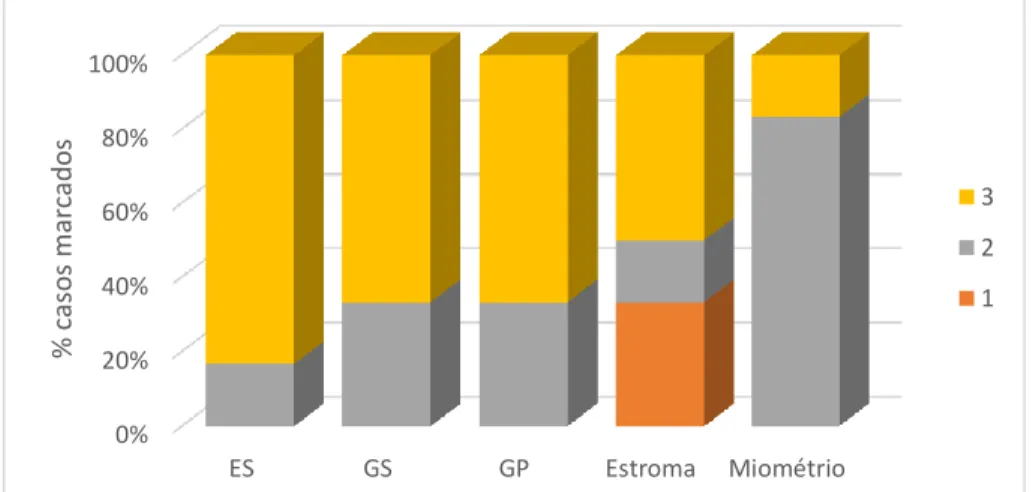
Figura 9: Intensidade de marcação da MMP-1 em úteros da fase estrogénica ... 29
Figura 10: Marcação imunohistoquímica para a MMP-1 na fase estrogénica. Observe-se a marcação forte de todos os epitélios e do miométrio ... 29
Figura 11: Intensidade de marcação da MMP-1 em úteros da fase progestagénica…... ... 30
Figura 12: Marcação imunohistoquímica para a MMP-1 na fase progestagénica. Marcação moderada de todos os epitélios ... 30
Figura 13: Intensidade de marcação da MMP-1 em úteros com piómetra. ... 32
Figura 14: Marcação imunohistoquímica para a MMP-1 na piómetra, com o exsudado purulento (p) no lume e o epitélio com marcação moderada ... 32
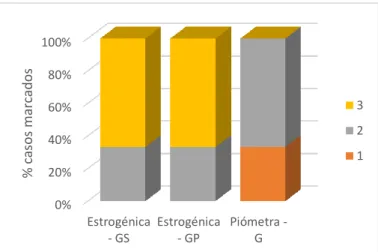
Figura 15: Intensidade de marcação da MMP-1 em úteros com piómetra e na fase estrogénica. ... 33
Figura 16: Intensidade de marcação da MMP-1 em úteros com HQE. ... 34
xi
Figura 17: Marcação imunohistoquímica para a MMP-1 na HQE. Observa-se um quisto (q) com epitélio de marcação forte e glândulas anexas com epitélio de marcação moderada. ... 34
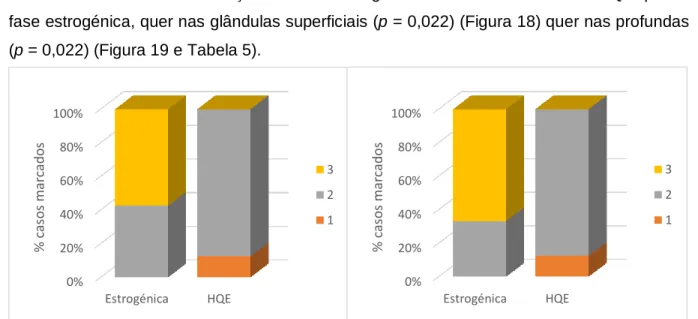
Figura 18: Intensidade de marcação da MMP-1 em úteros com HQE e na fase estrogénica nas glândulas superficiais ... 35
Figura 19: Intensidade de marcação da MMP-1 em úteros com HQE e na fase estrogénica nas glândulas profundas. ... 35
Figura 20: Intensidade de marcação da MMP-1 em úteros com HQE e na fase progestagénica no miométrio. ... 35
Figura 21: Intensidade de marcação da MMP-1 em úteros com AEG ... 37
Figura 22: Marcação imunohistoquímica para a MMP-1 no AEG apresentando epitélio de marcação moderada ... 37
Figura 23: Intensidade de marcação da MMP-1 no epitélio tumoral em úteros com AEG, e no epitélio de superfície nas fases normais. ... 38
Figura 24: Intensidade de marcação da MMP-1 no miométrio em úteros com AEG e na fase estrogénica. ... 38
Figura 25: Intensidade de marcação da MMP-2 em úteros na fase estrogénica. ... 39
Figura 26: Marcação imunohistoquímica para a MMP-2 na fase estrogénica apresenta marcação forte em todos os epitélios e no miométrio ... 39
Figura 27: Intensidade de marcação da MMP-2 em úteros na fase progestagénica……. ... 40
Figura 21: Marcação imunohistoquímica para a MMP-1 na fase progestagénica. Marcação moderada de todos os epitélios da fase progestagénica ... 40
Figura 29: Intensidade de marcação da MMP-2 em úteros com piómetra. ... 42
Figura 30: Marcação imunohistoquímica para a MMP-2 na piómetra. O epitélio apresenta marcação moderada ... 42
xii
Figura 32: Marcação imunohistoquímica para a MMP-2 na HQE com quistos e glândulas com epitélio apresentando marcação moderada ... 44
Figura 33: Intensidade de marcação da MMP-2 em úteros com AEG ... 46
Figura 34: Marcação imunohistoquímica para a MMP-2 em AEG cujo epitélio apresenta marcação moderada. ... 46
Figura 35: Intensidade de marcação da MMP-9 em úteros na fase estrogénica .... 48
Figura 36: Marcação imunohistoquímica para a MMP-9 na fase estrogénica com marcação forte de todos os epitélios e do miométrio ... 48
Figura 37: Intensidade de marcação da MMP-9 em úteros na fase progestagénica……. ... 49
Figura 38: Marcação imunohistoquímica para a MMP-9 na fase progestagénica com marcação moderada de todos os epitélios e do miométrio. ... 49
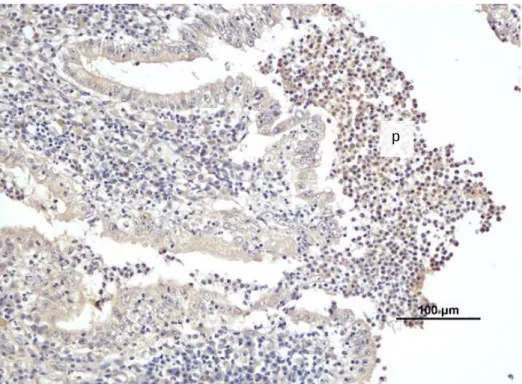
Figura 39: Intensidade de marcação da MMP-9 em úteros com piómetra ... 51
Figura 40: Marcação imunohistoquímica para a MMP-9 na piómetra onde se observa maior intensidade de marcação no epitélio de superfície. ... 51
Figura 41: Intensidade de marcação da MMP-9 em úteros na fase estrogénica e com piómetra. ... 52
Figura 42: Intensidade de marcação da MMP-9 em úteros com HQE. ... 53
Figura 43: Marcação imunohistoquímica para a MMP-9 na HQE, onde se observa maior intensidade de marcação no epitélio de superfície ... 53
Figura 44: Intensidade de marcação da MMP-9 em úteros na fase estrogénica e com HQE no epitélio de superfície ... 54
Figura 45: Intensidade de marcação da MMP-9 em úteros na fase estrogénica e com HQE nas glândulas superficiais ... 54
Figura 46: Intensidade de marcação da MMP-9 em úteros com AEG ... 56
Figura 47: Marcação imunohistoquímica para a MMP-9 num caso de AEG com marcação forte no epitélio tumoral, a invadir a camada muscular do miométrio ... 56
xiii Índice de Tabelas
Tabela 1: Número de casos utilizados. ... 25 Tabela 2: Anticorpos primários utilizados. ... 25
Tabela 3: Avaliação estatística da MMP-1 para o útero normal (fase estrogénica e fase progestagénica). ... 31
Tabela 4: Avaliação estatística da MMP-1 (entre úteros normais e os que apresentavam piómetra) ... 33
Tabela 5: Avaliação estatística da MMP-1 (entre úteros normais e os que apresentavam HQE) ... 36
Tabela 6: Avaliação estatística da MMP-1 (entre úteros normais e casos com AEG) ... 38
Tabela 7:Avaliação estatística da MMP-2 para os úteros normais (fase estrogénica e fase progestagénica). ... 41
Tabela 8: Avaliação estatística da MMP-2 (entre úteros normais e os que apresentavam piómetra) ... 43
Tabela 9: Avaliação estatística da MMP-2 (entre úteros normais e os que apresentavam HQE) ... 45
Tabela 10: Avaliação estatística da MMP-2 (entre úteros normais e casos de AEG). ... 47
Tabela 11: Avaliação estatística da MMP-9 para o útero normal (fase estrogénica e fase progestagénica). ... 50
Tabela 12: Avaliação estatística da MMP-9 (entre úteros normais e os que apresentavam piómetra). ... 52
Tabela 13: Avaliação estatística da MMP-9 (entre úteros normais e os que apresentavam HQE) ... 55
Tabela 14: Avaliação estatística da MMP-9 (entre úteros normais e casos de AEG) ... 57
xiv Abreviaturas
Ac(s) – Anticorpo(s)
AEG(s) – Adenocarcinoma(s) do endométrio da gata Ag(s) – Antigénio(s)
DAB – 3,3’-Tetracloreto de Diaminanobenzidina Eadj – Epitélio adjacente normal
EQ – Epitélio dos quistos ES – Epitélio de superfície ET - Epitélio tumoral G - Glândulas GS – Glândulas superficiais GP – Glândulas profundas H2O2 – Peróxido de hidrogénio HE – Hematoxilina eosina
HQE – Hiperplasia quística do endométrio IHQ – Imunohistoquímica
MEC – Matriz extracelular
MMP(s) – Metaloproteinase(s) de matriz (Matrix metalloproteinases) MO - Micro-ondas
OVH - Ovariohisterectomia PBS – Tampão fosfato salino
TEM – Transição epitélio-mesenquima
TIMPs - Inibidores tecidulares das MMPS (tissue inhibitors of metalloproteinases) TGF-β - Fator de transformação de crescimento β
1 Capítulo I – Revisão Bibliográfica
1. Introdução
A gata tem sido utilizada como modelo animal em estudos destinados não só à conservação de diferentes espécies de felídeos, mas também para o estudo de algumas doenças em humanos (Abreu, 2015).
Esta é descrita, em termos reprodutivos, como uma fêmea poliéstrica sazonal (Saraiva, 2015; Pires et al., 2016), em que a ovulação é induzida pelo coito, no entanto, uma ovulação espontânea poderá ocorrer (Johnston et al., 2001). A sazonalidade é um fator determinado pelo fotoperíodo (Saraiva, 2015; Pires et al., 2016), o que leva à ocorrência de ciclos de cio repetidos durante uma época de reprodução, a menos que este seja interrompido por gestação, ovulação induzida ou doença (Little, 2012).
Em média, as gatas atingem a puberdade ou exibem o seu primeiro ciclo éstrico entre os 5 e os 9 meses de idade (Burkholder et al., 2015; Saraiva, 2015), com um peso corporal de 2,3 a 2,5 quilogramas (kg). As gatas têm uma vida reprodutiva longa, excedendo muitas vezes os 14 anos, no entanto o tamanho das ninhadas diminui com o envelhecimento do animal (Johnston et al., 2001).
2 2. Morfofisiologia
2.1. Ciclo éstrico
O ciclo éstrico refere-se às mudanças fisiológicas cíclicas, orgânicas e comportamentais, induzidas por diferentes perfis de hormonas sexuais (Saraiva, 2015). Ocorre em intervalos de 4 a 30 dias em gatas expostas a um fotoperíodo constante (catorze horas de luz por dia) (Johnston et al., 2001). Este pode ser dividido em diferentes estadios, tais como, proestro, estro, interestro, anestro e diestro (Figura 1) (Little, 2012).
2.1.1. Proestro
A fase de proestro é observada num número reduzido de gatas, pois a maioria entra diretamente em estro após a fase de anestro ou proestro (Johnston et al., 2001). Esta dura em média 1 dia, sendo difícil de identificar, devido à sua curta duração (Little, 2012).
A fase de proestro na gata está associada ao aumento dos níveis séricos de estradiol excretados pelas células da granulosa dos folículos ováricos em crescimento (Johnston et al., 2001). Consiste no crescimento folicular e na síntese de estrogénio que entra na circulação em altas concentrações (Petersen, 2015).
2.1.2. Estro
A fase estro define-se por um comportamento recetivo ao acasalamento (Little, 2012). Tem uma duração de 2-10 dias e, grande parte do comportamento espontâneo característico
3
da fase de estro é observada durante a fase de proestro (Concannon, 1991). O comportamento do estro está intimamente relacionado com a fase folicular, que é definida como o período de tempo em que os folículos produzem e excretam altos níveis de estrogénios (Petersen, 2015).
Se a ovulação não for induzida durante a fase de estro, a gata entrará numa fase anovulatória, que dura aproximadamente 30 dias (Pires et al., 2016), muitas vezes referida como interestro, e prosseguirá para proestro novamente. Se a gata ovular durante o estro, ela ficará gestante ou pseudogestante (em que ovulou, mas não concebeu) (Petersen, 2015), entrando na fase de diestro.
2.1.3. Interestro
O período em que não houve ovulação, entre um estro e o próximo, é denominada de fase interestro (Little, 2012), esta pode demorar em média 7 dias (Concannon, 1991; Little, 2012). Os níveis de estrogénio e progesterona na circulação sanguínea permanecem baixos durante esta fase, já que os ovários estão inativos do ponto de vista hormonal (Petersen, 2015), não sendo as gatas afetadas pela progesterona nesta fase (Agudelo, 2005).
2.1.4. Diestro
A fase de diestro é definida como um período de dominância da progesterona, sendo a fase após o estro, se a ovulação for induzida (Johnston et al., 2001; Little, 2012). Uma gata em diestro pode estar gestante, com uma duração de 60 dias, ou pseudogestante, com uma duração de aproximadamente 50 dias (Pires et al., 2016).
Após a ovulação, a fecundação do oócito ocorre nos ovidutos, e os embriões entram no corno uterino 4 a 5 dias depois da ovulação. A implantação dos embriões ocorre 12 a 13 dias depois do acasalamento (Little, 2012).O corpo lúteo desenvolve-se 1-2 dias após a ovulação, começando a síntese e secreção de progesterona (Petersen, 2015).
No final do diestro, a gata irá prosseguir para proestro ou anestro, dependendo da época do ano (Petersen, 2015) e da zona geográfica.
2.1.5. Anestro
A fase de anestro refere-se geralmente a períodos prolongados de ausência de ciclo éstrico, e pode ser sazonal ou de lactação (Concannon, 1991). É uma fase de dormência reprodutiva onde as concentrações plasmáticas de estrogénios e progesterona permanecem no nível basal. Esta fase é, em termos hormonais, semelhante à fase de interestro e são por vezes referidos como a mesma fase (Petersen, 2015).
4
No hemisfério norte, a fase anestro sazonal ocorre de setembro a janeiro, quando o fotoperíodo é mais curto. O anestro pode ser mínimo ou inexistente em felinos domésticos, se mantidos com catorze horas de luz e temperaturas ambientais moderadas (Burkholder et al., 2015; Saraiva, 2015).
2.2. Aparelho reprodutor da gata
Os ovários, ovidutos, útero, cérvix, vagina e a vulva são os componentes do sistema reprodutivo feminino dos mamíferos (Bacha e Bacha, 2012).
O aparelho reprodutor da gata é constituído por dois ovários, dois ovidutos (ou trompas), um útero, a cérvix, uma vagina e a vulva. O útero comporta dois cornos uterinos bem desenvolvidos (pelo que é morfologicamente classificado como bicórneo), um corpo pouco desenvolvido e uma cérvix, que encerra a cavidade uterina (Zambelli e Cunto, 2005).
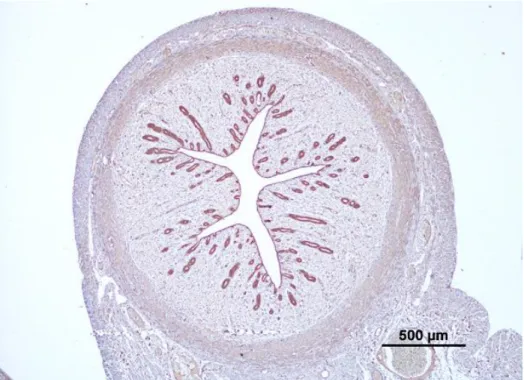
Do ponto de visto histológico, a parede do útero apresenta três camadas: o perimétrio (serosa), miómetrio e o endométrio (mucosa) (Figura 2). O perimétrio é composto por tecido conjuntivo denso e coberto por mesotélio peritoneal. O miómetro é dividido numa camada interna circular e numa camada externa mais fina longitudinal. Uma camada de grande conteúdo de vasos sanguíneos (estrato
vascular) separa as camadas musculares. O epitélio do endométrio da superfície é simples e cúbico ou colunar. (Bacha e Bacha, 2012; Solano-Gallego e Masserdotti, 2016). As células epitéliais do endométrio variam morfologicamente ao longo do ciclo reprodutivo (Solano-Gallego e Masserdotti, 2016).
As glândulas do endométrio estendem-se até à lâmina própria e têm um desenvolvimento e enrolamento distinto de acordo com a influência hormonal do ciclo éstrico (é mais intenso sob influência da progesterona). O cérvix é a estrutura que separa a genitália
a
c
Figura 2: Aspeto microscópico da parede uterina da gata na
fase progestagénica. (a) endométrio; (b) miométrio; (c) serosa. Hematoxilina e eosina (HE)
5
externa do útero e é uma barreira eficaz do ambiente externo (Solano-Gallego e Masserdotti, 2016).
6 3. Lesões uterinas na gata
A integridade do tracto reprodutivo é dependente de suporte hormonal apropriado. Em geral, os estrogénios e a progesterona são necessários para o crescimento e desenvolvimento normais do endométrio, que é muito variável ao longo do ciclo éstrico. Estas hormonas desempenham um papel principal no crescimento cíclico normal e na regressão do endométrio uterino (Perez et al., 1999).
O complexo HQE/piómetra descreve um espectro de alterações uterinas mais comuns em gatas inteiras de meia-idade e mais velhas (Crane, 2015; Jursza-Piotrowska e Siemieniuch, 2016). A piómetra e a HQE coexistem frequentemente, embora ambas as doenças possam representar um único processo patológico (Agudelo, 2005).
As ações conjuntas do estrogénio e progesterona resultam na hipertrofia celular e hiperplasia das glândulas do endométrio e do estroma (Perez et al., 1999), sendo descritos os efeitos da progesterona no útero como os principais agentes na patogénese da hiperplasia quística do endométrio (HQE) e na piómetra (Pires et al., 2016).
Tem sido geralmente assumido que a patogenicidade da HQE/piómetra envolve a progressão de eventos que começam com o desenvolvimento de hiperplasia do endométrio, que poderá estar diretamente relacionada com influências hormonais, que de alguma forma estimula uma reação inflamatória local. Por sua vez, o endométrio hiperplásico faz com que as secreções se acumulem, seguido pelo estabelecimento de uma infecção bacteriana ascendente, resultando em piómetra (Schlafer e Gifford, 2008).
Foram relatados vários casos de neoplasia uterina associada a piometra em gatas. É provável que as hormonas que estão associadas ao desenvolvimento de HQE e piómetra possam também influenciar a carcinogênese do endométrio e a progressão tumoral (Pires et
al., 2016).
Foi demonstrado que as metaloproteinases, conhecidas por terem um papel na remodelação endometrial em seres humanos, estão elevadas na HQE com piómetra em cadelas (Schlafer e Gifford, 2008).
7 3.1. Hiperplasia quística do endométrio
A HQE é uma patologia silenciosa (Pires et al., 2016) caracterizada pela proliferação e hipersecreção das glândulas do
endométrio, resultando na formação de quistos (Figura 3) (Crane, 2015), que levam a acumulação de secreções no endométrio, primeiro no lúmen das glândulas e depois no lúmen do útero, com quantidades variáveis de conteúdo seroso, mucoso ou purulento (Pires et al., 2016). É geralmente considerada o estadio iniciador que progride para piómetra após colonização bacteriana uterina (Crane, 2015).
Os quistos que se desenvolvem
a partir do endométrio variam muito em tamanho, número, distribuição, histomorfologia e relevância clínica (Schlafer e Gifford, 2008; Pires et al., 2016).
A doença é mais frequentemente observada em diestro, fase de dominância de progesterona (Hollinshead e Krekeler, 2016; Foster, 2017). Os efeitos desta hormona no útero são os principais agentes da patogénese do complexo HQE/piómetra. A exposição repetida a ciclos consecutivos de progesterona ou a administração exógena de fármacos para contraceção pode agravar esses efeitos e estimular a proliferação e dilatação quística das glândulas do endométrio, levando ao desenvolvimento de HQE (Agudelo, 2005; Pires et al., 2016).
Por si só, a HQE não está associada a quaisquer outros sinais clínicos além da infertilidade (Pires et al., 2016).
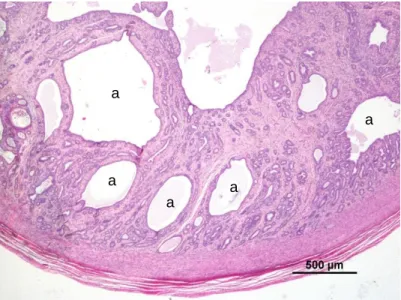
Figura 3: Hiperplasia quística do endométrio. Observe-se a
presença de quistos (a) de várias dimensões e conteúdo seromucoso. HE a a a a a
8 3.2. Piómetra
A piómetra é um dos distúrbios reprodutivos mais comum e importantes na gata (Figura 4) (Johnston et al., 2001). É uma doença potencialmente fatal caracterizada pela hiperplasia do endométrio com a dilatação quística das glândulas (Hollinshead e Krekeler, 2016; Foster, 2017), a acumulação de exsudado purulento (com elevado conteúdo em neutrófilos) no lúmen do útero e a infiltração de células inflamatórias nas camadas do endométrio e do miómetrio (Crane, 2015; Foster, 2017), assim
como bactérias (Pires et al., 2016). A acumulação de um fluido mucoso no útero predispõe à colonização do conteúdo uterino por bactérias, que aí chegam por via ascendente a partir da microbiota vaginal, originando a piómetra (Pires et al., 2016).
O lúmen uterino é geralmente livre de bactérias patogénicas, contudo, as partes inferiores do trato geniturinário são prontamente colonizadas por bactérias oportunistas. O fecho do cérvix normalmente protege o lúmen uterino contra as bactérias que invadem a vagina (Jursza et al., 2015), mas durante o estro há abertura do colo uterino com potencial subida de agentes e, sendo o ambiente propício (por exemplo por previa hiperplasia ou excesso de secreção de muco), há colonização e proliferação bacteriana.
Esta doença ocorre durante a fase de diestro quando o corpo lúteo está presente e as concentrações séricas de progesterona estão elevadas (Crane, 2015; Hollinshead e Krekeler, 2016). A progesterona é considerada a principal hormona implicada na piómetra, apesar dos estrogénios serem também considerados importantes na patogénese da HQE/piómetra. Os estrogénios causam dilatação da cérvix durante a fase de estro, predispondo o útero à colonização bacterial pela microbiota vaginal (Agudelo, 2005; Crane, 2015; Pires et al., 2016). A presença de progesterona (endógena ou exógena) facilita o desenvolvimento da piómetra (Hollinshead e Krekeler, 2016), ao diminuir a função imune, diminuindo a quimiotaxia e fagocitose dos neutrófilos (Crane, 2015).
Figura 4: Piómetra no útero da gata. Observe-se a
presença de exsudado purulento no lúmen uterino e no interior de quistos formado no epitélio hiperplásico. HE. (Cortesia da Profª Maria dos Anjos Pires)
9
A bactéria mais usualmente isolada do fluido uterino da gata com piómetra, é a E. coli (Johnston et al., 2001; Hollinshead e Krekeler, 2016), que é também um dos organismos mais comumente isolado da vagina de gatas saudáveis. Streptococcus sp. e Staphylococcus sp. também foram já isolados de úteros com piómetra e úteros normais (Johnston et al., 2001).
A cor e consistência do exsudato varia de acordo com a bactéria infetante e a quantidade de neutrófilos e sangue presentes. O exsudato é, tipicamente, viscoso e castanho com infeção da E. coli e cremoso e amarelo com Streptococcus sp.(Foster, 2017).
A piómetra é comumente associada a sintomas clínicos evidentes e as alterações detetadas nos exames complementares de diagnóstico variam com a gravidade da doença (Pires et al., 2016). Os sintomas clínicos mais comuns incluem desde secreção vulvar mucosa-purulenta a hemorrágica, anorexia, letargia, distensão abdominal, desidratação, útero palpável, febre e leucocitose (Hagman et al., 2014; Pires et al., 2016), poliúria (Johnston et
al., 2001), vómitos e polidipsia. O ocorrência de distensão abdominal em combinação com
esta doença, numa gata que não reproduz, é por vezes, suficiente para justificar um diagnóstico (Joshua, 1965).
O diagnóstico, em gatas intactas, é baseado em sinais clínicos, historial prévio de estros (espaçamento temporal e frequência por exemplo), exame físico, hemograma e presença de descarga purulento e/ou alargamento do útero em gatas não-gestantes (Johnston et al., 2001).
Uma vez diagnosticada, a piómetra pode ser tratada por ovariohisterectomia (OVH) e/ou terapia antibiótica (Johnston et al., 2001; Crane, 2015). Em fêmeas com valor reprodutivo, a eliminação do conteúdo uterina pelo estímulo com prostaglandinas, fármaco que provoca a contração do musculo liso, poderá ser usado, conjuntamente com a terapia antibiótica (Johnston et al., 2001).
3.3. Adenocarcinoma do endométrio da gata (AEG)
O útero felino é uma localização pouco comum para o desenvolvimento de neoplasias (Sontas et al., 2013). Os tumores uterinos representam 0,29% de todas as neoplasias felinas (Miller et al., 2003; Sapierzynski et al., 2009; Anderson e Pratschke, 2011; Saba e Lawrence, 2013; Sontas et al., 2013). Uma taxa de incidência tão baixa tem sido associada à prática recorrente de castração numa idade precoce das gatas (Cho et al., 2011; Sontas et al., 2013), e poderá, também, estar relacionada com a inadequada avaliação pós-cirúrgica ou
10
não garantir a ausência destas doenças (Payan-Carreira et al., 2013), dado que poderá ficar com o corpo uterino após OVH, local em que se pode desenvolver doença também.
Entre as neoplasias uterinas, os tumores epiteliais (adenoma, adenocarcinoma) e mesenquimatosos (leiomioma, fibroma, fibrossarcoma, leiomioma, leiomiossarcoma, lipoma e linfossarcoma) têm sido relatados como os mais frequentes em úteros felinos (Johnston et al., 2001; Klein, 2007; Sapierzynski et al., 2009; Taylor, 2010; Sontas et al., 2013).
O adenocarcinoma do endométrio é uma neoplasia maligna (Preiser, 1964; Cho et al., 2011; Payan-Carreira et al., 2013), que tem origem no epitélio do endométrio (Preiser, 1964; Klein, 2007; Pires et al., 2016). É o tumor epitelial mais comum neste órgão e é considerado raro em animais domésticos (Elsinghorst et al., 1984), para além de coelhos e vacas (Preiser, 1964; McEntee e Nielsen, 1976; Kennedy et al., 1998; Baba e Catoi, 2007; Gil da Costa et al., 2009; Cho et al., 2011; Pires et al., 2016). Estas neoplasias epiteliais são descritas como raras em gatas (Preiser, 1964; Miller et al., 2003; Klein, 2007; Saraiva et al., 2015b; Agnew e MacLachlan, 2016), e mais frequentes em fêmeas mais velhas (Preiser, 1964; Klein, 2007; Payan-Carreira et al., 2013; Saba e Lawrence, 2013).
No entanto, relatos recentes sobre o adenocarcinoma do endométrio na gata sugerem que a doença poderá ser mais comum do que previamente descrito (Pires et al., 2016; Saraiva
et al., 2016). As características histopatológicas do AEG, embora não constante, incluem
critérios reconhecidos de malignidade, tais como atipia nuclear, mitoses bizarras, necrose e invasão vascular, miométrio e/ou serosa (Saraiva et al., 2016).
O intercâmbio cíclico dos estrogénios e progesterona excretada pelos ovários determina mudanças cíclicas no padrão do endométrio – ciclo éstrico (Saraiva et al., 2012). Em termos gerais, o estrogénio estimula a proliferação de células glandulares e estromais, enquanto a progesterona inibe o crescimento de células glandulares e estimula a atividade secretora nas glândulas do endométrio. Uma interrupção no equilíbrio dos recetores destas hormonas, ou mutações nos genes que codificam estas moléculas, poderá interferir nos padrões normais de proliferação ou secreção e predispor o endométrio à doença (Saraiva et al., 2012).
Acredita-se que o AEG seja localmente invasivo, e a ocorrência de metástases é frequentemente relatada (Payan-Carreira et al., 2013), sendo que a maioria das gatas desenvolvem metástases nos 6 meses após diagnóstico (Taylor, 2010). Metástases no cérebro, olhos, ovários, glândulas adrenais, pulmões, fígado, rins, bexiga, cólon, diafragma, coração e nódulos linfáticos, já foram relatados em trabalhos anteriores nesta doença (Johnston et al., 2001; Klein, 2007; Taylor, 2010; Saraiva et al., 2012; Saba e Lawrence, 2013).
11
Podem ser definidas diferentes morfologias de AEG de acordo com critérios citológicos de malignidade, morfologia celular e invasão de tecidos adjacentes, que incluem o carcinoma papilar seroso (com a presença ou não de células claras), carcinoma de células claras (com mais de 50% de células de citoplasma clarificado) e carcinoma in situ (limitado à superfície do endométrio) (Saraiva et al., 2012; Saraiva et al., 2015b; Pires et al., 2016).
a. Adenocarcinoma papilar seroso
A maioria dos carcinomas do endométrio felino apresentam um padrão de crescimento de projeções papilares para o lúmen (Figura 5A). As papilas são suportadas por um estroma fibrovascular fino e revestido por mais de uma camada de células neoplásicas. As células são pleomórficas, colunares, com quantidade moderada de citoplasma eosinofílico, por vezes com zonas focais mais claras. Os núcleos são redondos a ovais, vesiculares ou hipercromáticos, e perdem a polaridade habitual. Grandes núcleolos são evidentes e às vezes são encontradas inclusões intranucleares claras. Figuras mitóticas bizarras são observadas frequentemente. Numerosas células multinucleadas podem ser encontradas dentro do tumor com núcleos muito basófilos e desorganizados (Saraiva et al., 2012).
b. Adenocarcinoma de células claras
O adenocarcinomas de células claras (Figura 5B) é composto quase inteiramente por células grandes, redondas a poligonais, com citoplasma espumoso e núcleo excêntrico ou ovoide, com um núcleolo eosinoflílico proeminente. As células são dispostas em papilas ou ninhos sólidos rodeados por um estroma fibrovascular. Células multinucleadas estão ausentes. Também pode ser encontrada necrose, no entanto, células inflamatórias são raras. A invasão do miométrio não é uma característica constante deste tipo de AEG (Saraiva et al., 2012).
c. Adenocarcinoma “in situ”
Os aspectos morfológicos do carcinoma in situ (Figura 5C) são muito semelhantes aos descritos para o carcinoma papilar seroso. As diferenças estão relacionadas com localização deste tumor que é muito superficial no endométrio e à falta de invasão do estroma profundo. Como o nome indica, aparentemente estes tumores não são invasivos (Saraiva et al., 2012).
12
3.3.1. Sinais clínicos, Diagnóstico e Tratamento
A AEG evolui como uma doença silenciosa (Payan-Carreira et al., 2013), não é detetada clinicamente, a menos que haja presença de grandes lesões, ruturas uterinas ou metástases (Baba e Catoi, 2007; Saraiva et al., 2012).
Os sinais clínicos dependem do tamanho do tumor (Johnston et al., 2001; Klein, 2007; Saraiva et al., 2012), e das metástases (Johnston et al., 2001). Estes poderão, portanto, incluir: distensão abdominal, presença de massa abdominal palpável, perda de peso, anorexia, apetite irregular, vómito, dores, descarga purulenta ou hemorrágica pela vagina, infertilidade, ascite, obstipação, disúria, ciclos éstricos anormais, piómetra, poliúria e polidipsia (Johnston et al., 2001; Klein, 2007; Sapierzynski et al., 2009; Anderson e Pratschke, 2011; Saraiva et al., 2012; Saba e Lawrence, 2013; Sontas et al., 2013). Clinicamente, o AEG não é distinguível de outras doenças não neoplásicas do útero da gata, tal como a piómetra e a HQE. O tipo de sintomatologia encontrada na generalização da doença está relacionado com a localização das metástases (Saraiva et al., 2012). Por exemplo, gatas com metástase na região torácica poderão apresentar períodos de tosse, mas as metástases que se localizam
Figura 5: Aspetos morfológicos dos AEG.
(A) Adenocarcinoma papilar seroso; (B) Adenocarcinoma de células claras; (C) Adenocarcinoma in situ. HE
A
B
13
no sistema nervoso, poderão apresentar cegueira e descoordenação motora (Johnston et al., 2001).
O diagnostico é baseado na palpação uterina, radiografia abdominal e torácica e exploração cirúrgica (Johnston et al., 2001). O diagnóstico definitivo é sempre obtido através de exames histopatológicos (Klein, 2007). Geralmente, tumores benignos são encontrados acidentalmente (Taylor, 2010; Saraiva et al., 2012)
O tratamento recomendado para neoplasias uterinas primárias sem metástases é a OVH (Johnston et al., 2001; Klein, 2007). O prognóstico é positivo para tumores benignos (Johnston et al., 2001), mas não tanto para tumores malignos, tal como no adenocarcinoma quando já há presença de metástase (Johnston et al., 2001; Taylor, 2010).
O conhecimento dos AEGs é muito restrito e maioritariamente baseado na descrição de casos e pequenas séries de lesões (Saraiva et al., 2012). Apesar do número crescente de estudos, pouco ainda se sabe sobre os eventos moleculares relacionados com o AEG. Além disso, a caracterização imunohistoquímica dos AEGs é limitada e realizada em pequenas séries (Saraiva et al., 2016).
3.3.2. Adenocarcinoma do endométrio na mulher
O adenocarcinoma do endométrio é o sexto cancro mais frequente na espécie humana, e o quarto mais comum nas mulheres (Honkavuori et al., 2007) e é a neoplasia ginecológica mais comum (Graesslin et al., 2006; Prat, 2012). Representam 90% dos tumores uterinos na mulher (Klein, 2007).
A doença afeta, principalmente, mulheres pós menopausa (Graesslin et al., 2006; Honkavuori et al., 2007). A idade média no diagnóstico é aproximadamente 60 anos, e o sinal clínico que o indica é o sangramento pós-menopausa (Klein, 2007). Apenas 8% dos tumores são diagnosticados em mulheres com menos de 50 anos de idade (Honkavuori et al., 2007). É uma doença tratável, com uma taxa de sobrevivência de, aproximadamente, 80% (Honkavuori et al., 2007; Klein, 2007), pois a maioria apresenta sintomas muito precocemente (Klein, 2007).
Vários fatores afetam o prognóstico, tais como o grau histológico, fase da doença, invasão do miométrio, envolvimento do espaço vascular, invasão do miométrio e metástases nos nódulos linfáticos (Graesslin et al., 2006).
14 4. Metaloproteinases da matriz
As mudanças observadas na morfologia e funcionalidade nos órgãos reprodutivos, durante a vida adulta, envolvem uma extensa remodelação do tecido conjuntivo e epitelial, processo levado a cabo por componentes que degradam a matriz extracelular (MEC), as metaloproteinases da matriz (matrix metalloproteinases), MMPs (Goffin et al., 2003; Santos et
al., 2011), sendo por isso as MMPs essenciais para um bom funcionamento fisiológico do
endométrio (Gottschal et al., 2002; Jana et al., 2016).
Nas mulheres, estas proteases permitem a remodelação do endométrio, que ocorre durante a fase proliferativa celular e também participa na descamação do endométrio e na hemorragia que ocorre durante a menstruação (Osteen et al., 1999; Gottschal et al., 2002; Shaco-Levy et al., 2008a).
As MMPs são um grupo de enzimas proteolíticas, dependentes do zinco, (Stamenkovic, 2000; Aglund et al., 2004; Graesslin et al., 2006; Honkavuori et al., 2007; Akkoc et al., 2012; Weigel et al., 2012; Lee et al., 2015b; An et al., 2016; Hu et al., 2016; Jana et al., 2016; Liu et
al., 2016b), que degradam vários componentes da MEC (Osteen et al., 1999; Stamenkovic,
2000; Curry e Osteen, 2003; Goffin et al., 2003; Graesslin et al., 2006; Honkavuori et al., 2007; Marcin et al., 2008; Shaco-Levy et al., 2008a; Akkoc et al., 2012; Weigel et al., 2012; Agaoglu
et al., 2015; An et al., 2016; Horejs, 2016; Liu et al., 2016b), tais como o colagénio, elastina,
laminina e proteoglicanos (Aglund et al., 2004; Santos et al., 2011), e da membrana basal (Shaco-Levy et al., 2008a; An et al., 2016).
Foram descritos até agora vinte e cinco MMPs nos vertebrados e vinte e dois homológos nos humanos (Marcin et al., 2008; Horejs, 2016). Dependendo da especificidade do alvo, estão categorizadas em vários grupos, inlcuindo as colagenases, gelatinases, estromalisinas (Stamenkovic, 2000), MMPs membranares (MT-MMPs) (Curry e Osteen, 2003; Goffin et al., 2003; Honkavuori et al., 2007; Marcin et al., 2008; Lee et al., 2015b; Leśniak-Walentyn e Hrabia, 2017), e matrilisinas (Gebhard et al., 2015; Liu et al., 2016b).
As MMPs são excretadas como zimogénios (Goffin et al., 2003; Marcin et al., 2008; Gebhard et al., 2015; Horejs, 2016) (MMPs 1-13 e 18-20), que requerem a clivagem de um dominio específico para a sua ativação (Jana et al., 2016; Leśniak-Walentyn e Hrabia, 2017), ou são ancoradas à membrana celular por um domínio transmembranar, também referidas como MT-MMPs (Stamenkovic, 2000; Horejs, 2016). As MMPs excretadas são ativadas extracelularmente por outras MMPs ou por várias proteinases, exceto para a MMP-2 que é ativada na superficie da célula por um processo que envolve as MT-MMPs e os inibidores
15
tecidulares das MMPs, tissue inhibitors of metalloproteinases (TIMPs) (Curry e Osteen, 2003; Horejs, 2016).
Todos os membros da família das MMPs são compostos por pelo menos um prodomínio, um domínio catalítico no qual se encontra um centro ativo altamente conservado. Contêm também um domínio de homologia com a hemopexina que se pensa estar envolvido na promoção de interações com o substrato contribuindo assim para a especificidade do substrato. A MMP-2 e a MMP-9 contêm, além disso, um domínio de ligação à gelatina do tipo da fibronectina (Stamenkovic, 2000).
A síntese de MMPs é estimulada por vários fatores, tais como fatores de crescimento do endotélio vascular (VEGF), fator de necrose tumoral alfa (TNF-α), interleucina-1 e prostaglandinas (Marcin et al., 2008). Alterações nas interacções célula-célula e célula-MEC poderão também induzir a expressão rápida de uma variedade de MMPs (Stamenkovic, 2000).
As MMPs apresentam um papel essencial na MEC, remodelando-a durante a morfogénese, embriogénese e na cicatrização de feridas (Curry e Osteen, 2003; Marcin et al., 2008; Akkoc et al., 2012; Shin et al., 2015). Participam no movimento de células durante o crescimento e estão envolvidas na restruturação ciclíca do endométrio, na angiogénese e na remodelação dos ossos (Marcin et al., 2008). A desregulação das MMPs leva a uma degradação extensiva e muitas vezes destrutiva da MEC (Curry e Osteen, 2003), podendo promover a angiogénese, a invasão e mestastização tumoral (Gottschal et al., 2002; Deryugina e Quigley, 2006; Honkavuori et al., 2007; Shaco-Levy et al., 2008a; Yoneda et al., 2010; Aresu et al., 2011; Lee et al., 2015b; Shin et al., 2015; An et al., 2016; Liu et al., 2016b) e estão também envolvidas na transição epitélio-mesênquima (TEM)(Jana et al., 2016).
A invasão e metastização que ocorre nas neoplasias malignas são processos complexos de várias etapas (Aresu et al., 2011). O processo físico da invasão e metastização tumoral envolve o desprendimento celular do microambiente local, seguido pela degradação da matriz circundante (Aresu et al., 2011; Akkoc et al., 2012), permeação de células tumorais e colonização destas células em locais específicos (Stamenkovic, 2000; Gilardoni et al., 2016). Este mecanismo é altamente organizado e envolve a ação das MMPs. Estas poderão, coletivamente, degradar a maior parte, senão todos, os componentes da MEC (Aresu et al., 2011). A sua participação na invasão e metastização de células tumorais foi largamente estudada tanto em humanos como em animais domésticos (Aresu et al., 2011; Akkoc et al., 2012).
16
Uma vez que as MMPs são enzimas potencialmente destrutivas, a sua expressão e ativação é altamente regulada em tecidos normais (Osteen et al., 1999), pelo menos, em três níveis: transcrição, activação proteolítica do zimogénio e inibição da enzima activa (Stamenkovic, 2000).
As MMPs são reguladas pelos seus inibidores endógenos (Jana et al., 2016), os TIMPs (Gottschal et al., 2002; Aresu et al., 2011), através da inibição da MMP ativa (Stamenkovic, 2000). Estes funcionam também como ativadores das mesmas (Aresu et al., 2011). As TIMPs são conhecidas por promover o crescimento celular e terem uma atividade anti-apoptótica (An
et al., 2016). Um desequilibrio entre as TIMPs e as MMPs poderá resultar na degradação
excessiva da MEC, o que está relacionado, de entre outras ações, com a invasão e metastização tumoral (Stamenkovic, 2000; Gottschal et al., 2002; Aresu et al., 2011).
A atividade das MMPs, também, é regulada por hormonas sexuais, fatores de crescimento e citocinas (Leśniak-Walentyn e Hrabia, 2017). A exposição à progesterona no endométrio e subsequente retirada apresenta um impacto profundo na expressão de múltiplas MMPs. Estudos in vitro mostraram que a progesterona é um potente inibidor das MMPs no endométrio, portanto esta claramente atua para suprimir a expressão de MMPs neste local, no entanto o mecanismo ainda não é completamente compreendido (Curry e Osteen, 2001). Quando a expressão e/ou a atividade das MMPs é inibida, há diminuição da migração e da invasão de células (Chiappini et al., 2016).
4.1. MMP-1
A MMP-1, uma colagenase intersticial (Shin et al., 2015; Liu et al., 2016b), é capaz de degradar fibras extracelulares de colagénio do tipo I, II e III (Schütz et al., 2015; An et al., 2016) e VII (Stamenkovic, 2000), no entanto, tem maior afinidade para clivar colagénio tipo II (Curry e Osteen, 2003). Esta protease cliva o colagénio num local específico e os produtos de clivagem resultantes são rapidamente desnaturados em gelatina à temperatura corporal, que é então ainda degradada por gelatinases, tais como a MMP-2 e -9 (Stamenkovic, 2000; Curry e Osteen, 2003).
Embora a transcrição da MMP-1 seja geralmente baixa no epitélio normal, esta aumenta em resposta a numerosos estímulos, incluindo fatores de crescimento, citocinas e hormonas (Shin et al., 2015)
.
Uma expressão aberrante da MMP-1 tem sido associada à progressão tumoral em neoplasias humanas, tal como cancro da bexiga, carcinoma da próstata e cancro gástrico (Liu
17
disseminação metastática, assim como facilita a invasão neoplásica (Deryugina e Quigley, 2006; Liu et al., 2016b).
As variantes genéticas de MMP-1, que levam a uma elevada expressão proteica, estão epidemiologicamente ligadas ao cancro de ovário, melanoma metastático e cancro de pulmão (Yoneda et al., 2010) e está demonstrado que a MMP-1 poderá funcionar como um oncogene (Liu et al., 2016b).
4.2. MMP-2 e MMP-9
A MMP-2 (gelatinase A) (Jana et al., 2016) e a MMP-9 (gelatinase B) (Weigel et al., 2012) são as únicas enzimas proteolíticas do grupo das gelatinases. Estas são capazes de degradar a membrana basal e várias macromoléculas especificas da MEC (Honkavuori et al., 2007) tais como o colagénio I, IV a X, elastina, laminina (Weigel et al., 2012; Kaneshiro et al., 2016) e fibronectina (Shaco-Levy et al., 2008a). Estas proteases são enzimas importantes que desempenham papéis críticos na degradação da MEC, e promovem a invasão de células tumorais (Lee et al., 2015b; Gilardoni et al., 2016) e a metastização (Aglund et al., 2004).
A MMP-2 desempenha um papel importante na gestação em seres humanos e animais, estando envolvida na implantação, placentação, invasão do trofoblasto e vascularização (Jana
et al., 2016). No entanto, os estudos sobre o papel destas MMPs nas neoplasias do
endométrio são limitados (Aglund et al., 2004).
Estudos recentes descrevem que as gelatinases 2 e 9, estão presentes não só na fase proliferativa fisiológica do endométrio, mas também no endométrio hiperplásico (Weigel et al., 2012) e em carcinomas do endométrio da mulher (Aglund et al., 2004). Deste modo, estas proteases parecem ser fatores especialmente importantes na progressão tumoral e na invasão deste tipo de lesão (Lee et al., 2015b). Também altos níveis de expressão destas gelatinases foram demonstrados estarem associados à agressividade tumoral e a disseminação metastática em vários tipos de tumores (Aglund et al., 2004; Gebhard et al., 2015; Lee et al., 2015b).
A MMP-9 é uma das MMPs mais estudadas. Tem sido mais associada e detetada em neoplasias malignas (Weigel et al., 2012) pelo seu potencial agressivo e metastático de tumores (Liu et al., 2016a). A sua maior expressão está relacionada com a progressão maligna, invasão (Lee et al., 2015b) e metastização (Liu et al., 2015), assim como a indução do switch angiogénico (indução da vascularização do tumor), ao libertar o VEGF, para que esteja disponível para interagir com o seu recetor (Bergers e Benjamin, 2003), bem como a inflamação associada ao tumor. Contudo, estudos recentes sugerem que possa também
18
desempenhar um papel anti-tumoral (Grünwald et al., 2016). A expressão de 2 e MMP-9 tem sido descrita em vários tumores malignos em humanos, incluindo carcinomas de mama, do cólon e gástricos, e noutras espécies, tais como em neoplasias mamárias felinas (Akkoc
et al., 2012), e osteossarcomas caninos e felinos (Gebhard et al., 2015).
5. Transição epitélio-mesênquima
A TEM foi primeiro observada em estudos de embriogénese em galinhas em 1908, apesar de só ter sido caracterizada em 1982 (Przybylo e Radisky, 2007). Desde então foi identificada como um mecanismo central tanto no desenvolvimento embrionário como em adultos em processos morfogénicos de cicatrização de feridas (Przybylo e Radisky, 2007; Li e Li, 2015; Abouhashem et al., 2016).
A TEM é um processo biológico no qual uma célula epitelial polarizada, que normalmente interage com a membrana basal através de sua superfície basal, experiencia múltiplas alterações bioquímicas que lhe permita assumir um fenótipo de célula mesenquimatosa, o que inclui uma maior capacidade migratória, de invasão, uma elevada resistência (Przybylo e Radisky, 2007; Kalluri e Weinberg, 2009; Klymkowsky e Savagner, 2009; Yoneda et al., 2010; Stadler e Allis, 2012; Wang e Shang, 2013; Aceto et al., 2015; Khan
et al., 2015; Lee et al., 2015a; Qin et al., 2017)
e
morfologia diferente (Figura 6). Este processo está associado à perda ou à baixa regulação dos marcadores epiteliais, tal como a caderina-E, resultando numa subsequente expressão de marcadores mesenquimatosos tais como a vimentina e a N-caderina (Abouhashem et al., 2016; Grassi et al., 2017). Esta mudança fenotípica das células epiteliais é considerada um passo importante na progressão e metastização dos tumores (Qin et al., 2017).19
Existem 3 tipos de TEM: tipo 1 - associado ao desenvolvimento de órgãos; tipo 2 – associado à regeneração dos tecidos e fibrose dos órgãos; tipo 3 – associado à progressão das neoplasias e formação de metástases (Kalluri e Weinberg, 2009; Kobayashi et al., 2016). A indução deste último ocorre devido à acumulação de alterações génicas adquiridas pelas células neoplásicas, gerando-se células com propriedades invasivas (Kalluri e Weinberg, 2009; Pectasides et al., 2014).
A metastização, isto é, a disseminação de célula neoplásicas do tumor primário para um local secundário, anatomicamente distinto e distante, continua a ser um dos eventos patogénicos mais ameaçadores e distintos das neoplasias malignas (Wang e Shang, 2013), sendo responsável por aproximadamente 90% da mortalidade por cancro em humanos (Mathias et al., 2013). Este processo envolve a dissociação de células neoplásicas do tumor primário; invasão para tecidos vizinhos; permeação para os vasos sanguíneos ou linfáticos; disseminação e, finalmente, extravasamento e crescimento num local secundário (Kalluri e Weinberg, 2009; Mathias et al., 2013; Wang e Shang, 2013; Abouhashem et al., 2016).
Para se dissociar do tumor primário e invadir o tecido circundante, as células neoplásicas devem regular de forma negativa as suas estruturas de adesão celular (Kalluri e Weinberg, 2009; Klymkowsky e Savagner, 2009), isto é, as interações célula e célula-MEC (Kalluri e Weinberg, 2009; Wang e Shang, 2013), reorganizar o citoesqueleto para a migração, e degradar e remodelar a MEC através das proteases (Kalluri e Weinberg, 2009; Mathias et al., 2013).
Durante a progressão tumoral, a TEM surge como um mecanismo crucial que aumenta a capacidade de invasão das células neoplásicas, induzindo a aquisição de um fenótipo mesenquimatoso mais móvel permitindo a separação do tumor primário, a invasão do estroma circundante, culminando em células que se destacam do tumor primário e que entram no sistema circulatório e se estabelecem em locais anatomicamente distantes formando um
20
tumor secundário (Figura 7) (Stadler e Allis, 2012; Mathias et al., 2013; Pectasides et al., 2014; Khan et al., 2015; Li e Li, 2015; Grassi et al., 2017; Jägle et al., 2017).
A caderina-E é uma proteína de adesão transmembranar que regula a adesão célula-célula. A perda da sua funcionalidade é uma característica importante na TEM, apresentando um papel crucial na progressão e invasão dos carcinomas (Przybylo e Radisky, 2007; Klymkowsky e Savagner, 2009; Shan et al., 2013; Lee et al., 2015a; Abouhashem et al., 2016). Fatores de transcrição, em particular o Snail, o Slug e o Twist, regulam a expressão da caderina-E (Kalluri e Weinberg, 2009; Klymkowsky e Savagner, 2009; Shan et al., 2013).
A expressão de Snail leva à regulação negativa de genes epiteliais e à indução de marcadores mesenquimatosos, como a vimentina e MMPs. Snail inibe diretamente a caderina-E (Przybylo e Radisky, 2007), resultando, consequentemente na dissolução das junções intercelulares (Przybylo e Radisky, 2007; Mathias et al., 2013)..
O fator de transformação de crescimento β (TGF-β) pode induzir a TEM na progressão tumoral, através da ativação de recetores (Przybylo e Radisky, 2007; Kalluri e Weinberg, 2009).
Estudos de Przybylo e Radisky (2007) referem que o tratamento de células epiteliais mamárias com MMPs, promove ativação do Snail (Przybylo e Radisky, 2007). As MMP2 e -9 foram descritas como potencializadoras da sinalização do TGF-β em queratinócitos, osteoblastos e melanomas. Estas proteases clivam formas latentes de TGF-β, promovendo a invasão tumoral e angiogénese (Mathias et al., 2013).
As MMPs podem ser excretadas diretamente das células neoplásicas e por quase todos os tipos de células inflamatórias e do sistema imunitário. Estas podem modificar o microambiente extracelular ao degradar proteínas da MEC (Mathias et al., 2013). A degradação da MEC mediada por MMPs, facilita a angiogénese, invasão tumoral e metastização (Przybylo e Radisky, 2007; Shan et al., 2013).
Figura 7: Transição epitélio-mesênquima na progressão tumoral. Baseado em Kalluri e Weinberg
21
Embora tenha sido demonstrado que as MMPs desempenham papéis fundamentais no crescimento e na formação de metástase de tumores malignos através da regulação da TEM, o mecanismo preciso continua sem estar completamente elucidado (Lee et al., 2015a).
6. Imunohistoquímica
A imunohistoquímica (IHQ) é uma técnica de rotina reconhecida e bem estabelecida em anatomia patológica, muito útil devido à sua facilidade, segurança e baixo custo em comparação com outras técnicas moleculares (Saraiva et al., 2012). Tornou-se uma ferramenta valiosa no diagnóstico e pesquisa de doenças infeciosas e neoplásicas numa grande variedade de tecidos e de espécies animais (Ramos-Vara, 2005).
É um método baseado na formação do complexo imune (reação antigénio-anticorpo) para identificar antigénios (Ag) específicos que se encontram nos tecidos, utilizando um anticorpo (Ac) direcionado para a sua identificação. A deteção ao microscópico ótico das interações Ag-Ac é conseguida ao marcar o Ac com uma substância que é visualizada, quer por conjugação com um marcador fluorescente ou enzima seguida por revelação colorimétrica da mesma (Drew e Shieh, 2015).
Esta é uma técnica de elevado potencial e diversidade, uma vez que permite, através da utilização de um Ac especifico para um determinado Ag, a identificação de inúmeras moléculas diferentes (Pires et al., 2010)
Embora simples, a metodologia do IHQ tornou-se mais complexa à medida que objetivos mais rigorosos de sensibilidade e especificidade são estabelecidos. Inicialmente, foram utilizados métodos simples (diretos) que produziram resultados rápidos, mas havia uma falta de sensibilidade (Ramos-Vara, 2005).
Este método direto é o mais simples dos métodos imunohistoquímicos. A reação é de um passo com Ag primário conjugado com um marcador (Figura 6). Utilizam-se diferentes marcadores, incluindo fluorocromos, enzimas, ouro coloidal e biotina. É rápido, mas carece de sensibilidade para a deteção da maioria dos Ags em tecidos processados rotineiramente para parafina (Ramos-Vara, 2005).
A necessidade de identificação de Ags com maior sensibilidade levou ao desenvolvimento de um método de dois passos (Ramos-Vara, 2005), onde um segundo Ac é utilizado para reconhecer o primeiro, Ac primário, que está ligado ao Ag (Taylor, 2013) sem qualquer tipo de identificação visível (Figura 8). A sensibilidade deste método é mais elevada do que um método direto porque i) o Ac primário não é marcado, retendo a sua atividade e
22
resultando num sinal forte e ii) o número de marcadores por molécula de Ag primário é mais elevado, aumentando a intensidade da reação e intensidade do sinal a ser visualizado (Ramos-Vara, 2005).
Este método indireto tem ainda a vantagem, comparativamente com o método direto, de o mesmo Ac secundário ter a capacidade de detetar diferentes Acs primários (Ramos-Vara, 2005).
23 Capitulo II – Objetivos
Foram objetivos desta tese:
• Adaptar o método indireto de imunohistoquímica para os anticorpos anti-MMP1, 2 e 9 aos tecidos de gata;
• Estudar a expressão das MMP-1, -2 e -9 em úteros normais de gata durante o ciclo éstrico;
• Estudar a expressão das MMP-1, -2 e -9 em hiperplasias quística e piómetra de gata; • Estudar a expressão das MMP-1, -2 e -9 em adenocarcinomas do endométrio de gata; • Comparar as alterações de expressão destas moléculas durante o ciclo éstrico, e nos
25 Capítulo III – Materiais e Métodos
1. Materiais
Para este trabalho foram usadas amostras do arquivo do Laboratório de Histologia e Anatomia Patológica da Universidade de Trás-os-Montes e Alto Douro (LHAP-UTAD), que consistem em tecidos fixados em formol tamponado a 10% e sujeitos ao processamento de rotina, para inclusão em parafina.
Este trabalho foi devidamente autorizado pela Comissão de Ética da UTAD com o número DOC22/CE/2014.
Os casos foram previamente diagnosticados com a coloração de hematoxilina e eosina (HE) por dois patologistas independentes, que classificaram as amostras controlo como fase proliferativa ou estrogénica (que envolve as fases do ciclo éstrico de proestro e estro) e em fase secretora ou progestagénica (a fase de diestro), assim como HQE, piómetra e casos de AEG (Tabela 1). Dos casos selecionados foram efetuados cortes seriados de 3 micra em lâminas revestidas com Silane® que foram usados na técnica de IHQ para todos os anticorpos em estudo.
Tabela 1: Número de casos utilizados.
CLASSIFICAÇÃO MMP-1 MMP-2 MMP-9 FASE ESTROGÉNICA 6 6 6 FASE PROGESTAGÉNICA 8 8 8 HQE 8 9 12 PIÓMETRA 6 6 6 AEG 22 21 21
Neste trabalho usámos o método indireto de IHQ com aplicação dos anticorpos anti-MMP-1, 2 e 9 (Tabela 2).
Tabela 2: Anticorpos primários utilizados.
ANTICORPO TIPO DE ANTICORPO DILUIÇÃO INCUBAÇÃO CLONE FABRICANTE
MMP-1 Policlonal Rabbit 1:100 Overnight RB-1536-P NeoMarkers®
MMP-2 Monoclonal Rabbit 1:100 Overnight RB-1537-P1 NeoMarkers®
26 2. Métodos
2.1. Imunohistoquímica
a) Preparação das amostras
A técnica de IHQ foi executada sobre lâminas de vidro revestidas com Silane®, um composto que permite uma maior adesão do tecido durante todo o processamento da técnica.
b) Hidratação das lâminas
Todo o processamento de IHQ foi feito em meio líquido, pelo que os tecidos aderidos às lâminas tiveram inicialmente de ser rehidratados. Assim, as lâminas contendo os cortes dos tecidos foram colocadas em xilol durante 10 a 15 minutos, e hidratadas em álcoois sucessivos de concentração decrescente [cerca de 5 minutos em cada passo, 100%, 95%, 80%, 70% (v/v)] e por fim passadas por água destilada.
c) Tratamento térmico
As lâminas foram colocadas em tinas de material passível de ir ao micro-ondas (MO) e cobertas com tampão citrato a pH 6 ± 0.2 sendo então sujeitas a ciclos de 5 minutos no MO a 750W (3 ciclos de 5 minutos para todos os anticorpos utilizados) para recuperação antigénica.
Terminado este passo, as lâminas foram deixadas a arrefecer lentamente no tampão citrato, à temperatura ambiente durante cerca de 30 minutos.
d) Inativação das peroxidases
De seguida as lâminas foram colocadas em peróxido de hidrogénio (H2O2) a 3% (v/v)
durante 30 minutos, para inativação das peroxidases endógenas. Findo este período, as lâminas foram lavadas em tampão fosfato salino (PBS, pH 7) durante 5 minutos.
e) Incubação com os anticorpos
As lâminas foram depois colocadas em câmara húmida horizontal e incubadas com soro normal universal Ultra V Block (Lab Vision Corporation®) (durante 5 minutos). A função deste soro é ocupar, de forma inespecífica, todos os locais de possível ligação no tecido.
Foi retirada o excesso de soro normal e procedeu-se a incubação com o anticorpo primário, overnight (17 a 18 horas), a 4ºC.
As lâminas foram, em seguida, lavadas com PBS, 3 vezes e fez-se a incubação com o soro Post Primary (NovoCastra®) durante 30 minutos. Lavaram-se novamente as lâminas em PBS seguindo o procedimento descrito anteriormente.