UNIVERSIDADE DE LISBOA
FACULDADE DE CIÊNCIAS
Cephalopods as vectors of harmful algal bloom toxins: a
toxicokinetic and ecophysiological approach
“Documento Definitivo”
Doutoramento em Ciências do Mar
Vanessa Sofia Madeira Lopes
Tese orientada por:
Professor Doutor Rui Afonso Bairrão da Rosa
Doutor Pedro José Conde Reis Costa
Documento especialmente elaborado para a obtenção do grau de doutor
UNIVERSIDADE DE LISBOA FACULDADE DE CIÊNCIAS
Cephalopods as vectors of harmful algal bloom toxins: a toxicokinetic
and ecophysiological approach
Doutoramento em Ciências do Mar
Vanessa Sofia Madeira Lopes
Tese orientada por:
Professor Doutor Rui Afonso Bairrão da Rosa
Doutor Pedro José Conde Reis Costa
Júri: Presidente:
● Doutora Maria Manuela Gomes Coelho de Noronha Trancoso, Professora Catedrática e Presidente do Departamento de Biologia Animal da Faculdade de Ciências da Universidade de Lisboa
Vogais:
● Doutor Alexandre Marnoto de Oliveira Campos, Investigador Auxiliar no Centro Interdisciplinar de Investigação Marinha e Ambiental (CIIMAR) da Universidade do Porto
● Doutor Mário Emanuel Campos de Sousa Diniz, Professor Auxiliar da Faculdade de Ciências e Tecnologia da Universidade Nova de Lisboa
● Doutor João Manuel de Figueiredo Pereira, Investigador Auxiliar do Instituto Português do Mar e da Atmosfera (IPMA)
● Doutora Ana de Jesus Branco de Melo de Amorim Ferreira, Professora Auxiliar da Faculdade de Ciências da Universidade de Lisboa
● Doutor Rui Afonso Bairrão da Rosa, Investigador FCT de nível de desenvolvimento da Faculdade de Ciências da Universidade de Lisboa
Documento especialmente elaborado para a obtenção do grau de doutor
Fundação para a Ciência e Tecnologia (FCT)
Agradecimentos
Ter chegado a este momento não foi certamente apenas trabalho meu. Devo agradecimentos incondicionais a tantas pessoas, e não só!
A palavra agradecimento não chega para expressar a minha profunda gratidão ao meu orientador e “mestre”, Doutor Rui Rosa. Obrigada por estes 8 anos, por teres acreditado no meu potencial, por ainda me contagiares com o “bichinho” da ciência, por nunca te acabarem as ideias sobre o que fazer a seguir, por todos os conselhos, ensinamentos e desabafos. Por me inspirares a querer ser mais e melhor, por mostrares o que é ser mais e melhor, pela jovialidade, pelos bons exemplos, pelos “raspanetes” merecidos, por seres mais do que cabe em ti.
Ao Doutor Pedro Costa, que não me conhecia de lado nenhum e que me aceitou como sua aluna. Por me teres mostrado o que este mundo da toxicologia tem para oferecer, por toda a motivação e conselhos que me deste, por seres sempre bem-disposto e aceitares todas as ideias que propus. Por me teres ensinado e guiado para que fosse autossuficiente.
Aos meus polvos, por mais vezes que me tenham fugido dos aquários e por mais dores de cabeça que me tenham proporcionado, encheram-me o coração naqueles dias menos bons, fizeram-me ver que há todo um mundo novo e inexplorado, são uma fonte inesgotável de conhecimento e inspiração. Por isso, fizeram-me querer ser melhor para os conhecer mais um pouco, ir um pouco mais além e fascinaram-me todos os dias com aqueles olhos lindos e fugas impossíveis! Obrigada por me deixarem entrar no vosso mundo.
Agradecer ao Laboratório Marítimo da Guia inclui também agradecer ao próprio edifício, por conter conhecimento centenário, por inspirar qualquer pessoa que lá entre, como aconteceu comigo, há “tantos” anos atrás. Foi o sítio que escolhi como segunda casa e no qual passei incontáveis momentos, bons e maus, como tudo na vida. Espero aqui continuar, por muitos anos.
Quatro anos é muito tempo, e muitas pessoas cruzaram a sua estadia na Guia comigo. Aos alunos de Erasmus que estiveram pouco tempo, mas ficaram tempo suficiente para deixar a sua marca. À “croatian woman” mais espectacular, Meri, por teres sido uma companhia tão presente, por teres entrado na minha família do coração, lindezas! Às minhas “awesome” espanholitas, Sara e Lídia, por terem sido tão preciosas, divertidas e por todos os momentos que passámos. To the “little Italian” Luanni, for all the insane car rides and countless laughs!
À Matilde Costa, a moça da mochila amarela, por me ter salvo a sanidade e ter incorporado uma parte considerável do trabalho em 2015, por partilhar o gosto dos polvinhos comigo.
À Catarina Vara, que foi um presente caído do céu, que veio para estudar imunologia e acabou por ser raptada para o mundo da toxicologia de polvos. Por toda a competência, desenrasque, mangas arregaçadas, alegria, motivação, ajuda e incentivo, por me fazer ter saudades dela quando se for embora, por estes últimos meses, tão críticos!
No IPMA, agradecimentos são devidos à Sara Costa e a todos do Laboratório das Biotoxinas Marinhas, por todas as vezes que perguntei onde estavam coisas e pacientemente me ajudaram.
Agora os agradecimentos aos residentes do “meu” forte à beira-mar. Toda a equipa com quem vivi o meu dia-a-dia, com quem desabafei os males e celebrei as alegrias.
À “minha” Catarina Santos, Cat, por me mostrar tantas vezes o lado cor de rosa da vida, pela voz doce e pela insanidade inata. Nunca a percas, por favor. Por ter sido sempre uma presença constante no meu percurso e por todas as gargalhadas descontroladas e viagens de ida e volta que nunca mais foram as mesmas. Por seres tão real, que é desarmante, obrigada. Ao Vasco, Baskins, que chegou tão calmamente, mas que mudou os dias na Guia, com uma presença tão positiva que tornou todos à sua volta felizes, o mundo precisa de mais Vascos.
Ao Francisco Carvalho, por seres a alegria de viver em pessoa. Por todos os momentos parvos partilhados, por estes anos de coexistência, que tornaram a minha existência mais feliz! Ao Francisco Borges, um pequeno génio, de aparência séria, mas que no fundo é tão louco como os demais. Obrigada pelas viagens, foram mais leves contigo por perto.
Ao Zé, que é um investigador brilhante, e que é como um miúdo numa loja de brinquedos, de olhos a brilhar com o mundo científico. Obrigada pela motivação e encorajamento, és um exemplo a seguir!
À Cátia e Tiago Grilo, que contribuem tanto para a alegria generalizada naquele laboratório. Por terem sempre conversas interessantes e por toda a genuinidade!
A todos os alunos de Mestrado neste momento na Guia, que tornam aquele espaço num sítio mais feliz, que nos renovam e nos tornam mais sábios, que permitem que observe o vosso percurso e que me orgulhe nos vossos sucessos, Cláudia, Érica, Ricardo.
A todos os outros membros do nosso grupo na Guia, Maria Rita (Maryland) obrigada pela tua simplicidade, genuinidade, e nossa partilha de memes e expressões tolas; Marta, que bom que as condições se proporcionaram para nos aproximarmos, sou mais feliz assim; Ricardo Cyrne, obrigada por todos os contributos para a boa disposição, Miguel e Tiago Repolho por terem estado lá no início e por saber que posso sempre contar convosco.
Ao Eduardo, por ser eu meu mano cefalopódico, por termos o mesmo tipo de humor e as mesmas horas de almoço. Por todas as correcções preciosas que fizeste, por teres tomado tanto do teu tempo, tão pacientemente e bem-disposto para me ajudar no último trabalho desta dissertação. Por me tranquilizares e ajudares a que tudo tivesse corrido bem, por todo o companheirismo e pela nossa honestidade um com o outro.
À Rita, a “minha” Pipoks, que percorreu este caminho comigo, que partilhou as alegrias e momentos menos bons, em quem me pude apoiar tantas vezes, que me ajudou com os prazos e burocracias, senão se calhar teria falhado algum prazo importante e não estaria aqui. Obrigada por teres sido como uma irmã para mim, através de todas as adversidades que passei, estamos quase!!
Ao Sr. Ramos, pois sem ele, conseguir os meus polvinhos teria sido uma tarefa muito complicada, obrigada por poder contar consigo há tanto tempo.
A ambas as instituições de acolhimento que tornaram possível a execução desta dissertação, Marine Environmental Sciences Centre (MARE – ULisboa) e Instituto Português do Mar e Atmosfera. À Fundação para a Ciência e Tecnologia (FCT) pelo financiamento da minha bolsa de Doutoramento (SFRH/BD/97633/2013).
À minha família, que me permitiu sempre sonhar mais alto, não encaixar no molde e ser eu própria. Por todas as vezes que tiveram curiosidade sobre o que estava a fazer, aqui está o resultado! Obrigada!
Ao Jorge, por teres aparecido tão inesperadamente na minha vida e teres mudado o meu mundo para melhor. Por todos os imensos incentivos que me deste, por todas as vezes que me ajudaste a “digerir” resultados, desenvolver o meu sentido crítico e pensar mais além. Por te orgulhares de todos os meus sucessos, pequenos e grandes. Por todo o amor incondicional e compreensão, por partilhares comigo esta experiência.
Às duas pessoas que foram a maior parte da minha vida, que sem as quais esta dissertação teria sido feita pois não estaria no percurso em que estou. Ao menino que vi nascer e que já está mais alto que eu, que orgulho imenso em ti. Obrigada por veres em mim um exemplo e por me teres feito crescer, por me perdoares as minhas falhas. Obrigada Mô. À pessoa mais forte que conheço, e que tenho a certeza que há poucas como tu, se é que há. Sem dúvida que sou o que sou hoje quase exclusivamente por tua causa. Por tornares possível eu enveredar por este caminho que é mais difícil do que fácil, pelo orgulho que sentes por mim, por perceberes quase tanto de cefalópodes como eu. Por todos os dias que fui menos do que podia ser, teres sido sempre tão tu. Esta dissertação também é tua. Obrigada Mamma.
TABLE OF CONTENTS
List of abbreviations and units 1
List of figures 5
List of tables 9
Abstract and Keywords 13
Resumo e palavras-chave 16
Resumo alargado 18
List of papers 25
Chapter One
General Introduction 29
1.1. Overview on Harmful Algal
Blooms 31
1.2. Routes of toxin exposure 32
1.3. Paralytic shellfish toxins 34
1.4. Amnesic shellfish toxins 35
1.5. HAB-toxin effects on marine
organisms 36
1.5.1. Paralytic shellfish
toxins 36
1.5.2. Domoic acid 46
1.6. Thesis objectives and outline 49
1.7. References 50
Chapter Two
Cephalopods as vectors of harmful algal bloom toxins in
marine food webs 69
Chapter Three
Uptake, transfer and elimination kinetics of paralytic
shellfish toxins in common octopus (Octopus vulgaris). 99
Chapter Four
Presence and persistence of the amnesic shellfish poisoning toxin, domoic acid, in octopus and cuttlefish
Chapter Five
Feeding behaviour and chromatophore activity of octopus paralarvae are not affected by the harmful algal toxin
domoic acid. 156
Chapter Six
- 1 -
LIST OF ABBREVIATIONS AND UNITS
α Net accumulation effiency
AIC Akaike information criterion
AMPA α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid
ANOVA Analysis of variance
ASP Amnesic shellfish poisoning
B1 Gonyautoxin 5, also designated as GTX5 B2 Gonyautoxin 6, also designated as GTX6 BrH/BH Branchial hearts
BW Body weight
C1+2 N-sulfocarbamoyl-gonyautoxin 1 and 2
Ca2+ Calcium
CDG Toxin concentration in digestive gland (DG)
Cfeed Toxin concentration in food
Ci Toxin concentration in the i-th compartment
CNS Central nervous system
CV Toxin concentration in octopus viscera
DA Domoic acid
dcNEO Decarbamoyl neosaxitoxin dcSTX Decarbamoyl saxitoxin
DG Digestive gland
DgT Digestive tract
DSP Diarrhetic shellfish poisoning
F Feeding rate
Gill/GL Gills
GLM Generalized linear model
Gon Gonad GPx Glutathione Peroxidase GST Glutathione-S-transferase GTX2+3 Gonyautoxin 2 and 3 GTX5 GTX 6
Gonyautoxin 5, also designated as B1 Gonyautoxin 6, also designated as B2
HAB Harmful algal bloom
- 2 - fluorescence detection
IC Intracoelomic
IP Intraperitoneal
IPMA Instituto Português do Mar e Atmosfera k el V Elimination rate from viscera
kel DG Elimination rate from digestive gland
kel i Elimination rate from i-th compartment
Kid/KD Kidney
KT i
Transfer coefficient from digestive gland to the i-th compartment
LC-MS/MS Liquid chromatography with mass spectrometry detection
LTP Long-term potentiation
Man/MT Mantle
mDG Wet mass of digestive gland
mKD Wet mass of kidney
ML Mantle length
MRI Magnetic resonance imaging
MS Maturity stage N North n Number of individuals nd Not detected NEO Neosaxitoxin NMDA N-methyl-D-aspartate NW Northwest
OCI Occurrence index
PSP Paralytic shellfish poisoning PST Paralytic shellfish toxin p-value Probability of statistic test q0
Toxin concentration at the initial conditions of the depuration period
qDG
Toxin concentration in digestive gland at initial conditions of depuration
qi
Toxin concentration in the i-th compartment at initial conditions of depuration
qKD
Toxin concentration in kidney at initial conditions of depuration
- 3 - ROS Reactive oxygen species Sal/SaG/SG posterior salivary glands
SD Standard deviation
SE Southeast
SPE Solid phase extraction
SPM Suspended particulate matter
St Stomach
St+Inst+Ce Pooled stomach, caecum and intestine
STX Saxitoxin
STX eq Saxitoxin equivalents
SW Southwest
t Time
UOM Unidentified organic matter
V Volt(s) W West WW Wet weight % Percentage ± Approximately °C Degrees Celsius µg Microgram(s) µl Microliter(s) µm Micrometer(s) cm Centimeter(s) g Gram(s) h Hour(s) kg Kilogram(s) L Liter(s) mg Miligram(s) ml Mililiter(s) ng Nanogram(s) nm Nanometer(s) pg Picogram(s)
- 4 -
LIST OF FIGURES
CHAPTER ONE – General introduction
Figure 1. Foodborne and waterborne exposure to HAB-toxins. Solid
lines illustrate the well documented route of dietary exposure; dashed lines illustrate the less studied routes of dissolved toxins exposure.
Figure 2. Schematic view of HAB-toxins food web transfer.
CHAPTER TWO – Cephalopods as vectors of harmful algal bloom toxins in marine food webs
Figure 1. Weight (%W) of prey in the stomach contents of jumbo
squid (Dosidicus gigas) from the Gulf of California during 1998– 1999 (data from Markaida and Sosa-Nishizaki, 2003). %W is defined as the weight of a certain prey relative to the total weight of all prey, expressed as a percentage. Legend: UOM - unidentified organic matter.
Figure 2. Cephalopod coastal diversity and respective life
strategies. A, B and C - nektobenthic common cuttlefish, Sepia officinalis; D - benthic common octopus, Octopus vulgaris, E and F - benthic sepiolid, Sepiola atlantica, G – semi-pelagic squid, Loligo vulgaris; H and I – planktonic paralarvae of common octopus, O. vulgaris. (photo credits: Rui Rosa).
Figure 3. Total concentration (median, 25 and 75 quartiles,
non-outlier range and non-outliers) of paralytic shellfish toxins (PSTs, µg STX equiv. kg-1) in the tissues of common octopus, Octopus
vulgaris (data from Monteiro and Costa, 2011) collected in the NW Portuguese coast. Abbreviations: DG- digestive gland; BrH –
- 5 -
branchial hearts; Gill – Gills; Kid – kidney; St+Inst+Ce – pooled stomach, caecum and intestine; Sal - posterior salivary glands.
Figure 4. Concentration of paralytic shellfish toxins (C1 + 2
N-sulfocarbamoyl-gonyautoxin-2 and -3; dcSTX dicarbamoyl saxitoxin; GTX2 + 3 gonyautoxin-2 and -3, B1 gonyautoxin-5 or GTX5; STX saxitoxin; NEO neosaxitoxin) in several tissues of common octopus, Octopus vulgaris (data from Monteiro and Costa, 2011) collected from the NW Portuguese coast. Abbreviations: DG- digestive gland; BrH – branchial hearts; Gill – Gills; Kid – kidney; St+Inst+Ce – pooled stomach, caecum and intestine; Sal - posterior salivary glands.
Figure 5. Concentrations of paralytic shellfish toxins detected
in Humboldt squids (Dosidicus gigas) from stranding events in British Columbia, Canada. *STX eq. = STX + dcSTX*0.51 (data from Braid et al. 2012). Abbreviations: DG – digestive gland; St – stomach; Man – mantle.
Figure 6. Schematic illustration of the maximum levels (µg g-1)
of amnesic shellfish toxin, domoic acid (DA) found in common octopus (Octopus vulgaris) tissues.
Figure 7. Domoic acid levels (DA, µg g-1; median, 25 and 75
quartiles, non-outlier range and outliers) detected in the tissues of: A) common octopus (Octopus vulgaris), collected in the NW and South Portuguese coast, B) common cuttlefish (Sepia officinalis), collected in the NW Portuguese coast, and C) Humboldt squid (Dosidicus gigas) collected in British Columbia, Canada (data from Braid et al., 2012; Costa et al., 2004; Costa et al., 2005b).
- 6 -
Figure 8. Domoic acid distribution in the DG cell fractions of
the common octopus (Octopus vulgaris; median, 25 and 75 quartiles, non-outlier range and outliers) collected in the NW Portuguese coast (data from Lage et al., 2012).
Figure 9. Domoic acid levels (DA; μg kg−1; median, 25 and 75
quartiles, non-outlier range and outliers) detected in the DG of Eledone cirrhosa (from NW, SW and South Portuguese coast) and E. moschata (from South Portuguese coast) (data from Costa et al., 2005a).
Figure 10. Stranded Humboldt squids (Dosidicus gigas) in
Californian (top panels, and bottom left and middle panels) and Mexican coasts (bottom right panel).
CHAPTER THREE - Uptake, transfer and elimination kinetics of paralytic shellfish toxins in common octopus (Octopus vulgaris) Figure 1. Schematic view for the five compartments of Octopus
vulgaris. The solid lines represent the transfer coefficients from the digestive gland to the other compartments. The dashed lines represent the elimination rates of the five compartments. The other parameters used are described in Table 2.
Figure 2 Concentration (µg g-1) of (a) GTX5, (b) dcSTX, (c) C
1+2, (d) dcGTX2+3, (e) GTX2+3 and (f) STX in octopus digestive gland throughout the experiment. Dots and error bars represent experimental data (mean based on three replicate samples). The dashed line represents the outputs of the best fit model.
Figure 3 Concentration (µg g-1) of (a) GTX5, (b) dcSTX and (c)
C1+2 in octopus kidney throughout the experiment. The dashed line represents the outputs of the best fit model.
- 7 -
CHAPTER FOUR - Presence and persistence of the amnesic shellfish poisoning toxin, domoic acid, in octopus and cuttlefish brains Figure 1. Domoic acid (DA) concentration in mg kg-1 in octopus
brain tissue (A), digestive gland (B) throughout the sample period, and Pseudonitzschia sp. abundance (C) between January and October 2016.
CHAPTER FIVE - Feeding behaviour and chromatophore activity of octopus paralarvae are not affected by the harmful algal toxin domoic acid
Figure 1. Box plot showing data distribution (median, 25 and 75
quartiles, non-outlier range and outliers) in all treatments used as a function of time. (A) The number of paralarval mantle contractions (jets, n=9 per each treatment at each sampling point) (B) the number of Artemia consumed (n= T1: 20; T4: 18; T8: 16; T24: 14) (C) paralarva dorsal area covered by chromatophores, expressed in percentage (n=6 per each treatment at each sampling point).
- 8 -
LIST OF TABLES
CHAPTER ONE – General introduction
Table 1. The most common toxins produced by marine
phytoplankton.
Table 2. Documented cases of bivalves exposed to and affected by
paralytic shellfish toxins (PSTs).
CHAPTER TWO – Cephalopods as vectors of harmful algal bloom toxins in marine food webs
Table 1. Diet of common octopus (Octopus vulgaris) in the
Portuguese coast, namely in Viana do Castelo (North region), Cascais (Centre region) and Tavira (South region). Occurrence index (OCI) of prey found in the octopods’ stomach contents. [data from Rosa et al. (2004)].
Table 2. Maximum levels of HAB-associated toxins in cephalopods.
CHAPTER THREE - Uptake, transfer and elimination kinetics of paralytic shellfish toxins in common octopus (Octopus vulgaris) Table 1. Toxin profile of Donax clams given to octopus (mean ±
SD).
Table 2. Parameters used in kinetics equations.
Table 3. Net accumulation efficiency (α, %), initial
concentration in digestive gland at beginning of depuration (qDG), elimination rate (kel DG d-1) (standard deviation) and
coefficient of determination R2 for each PST determined in
octopus digestive gland during uptake and depuration. Asterisks indicate values within the confidence limit (P < 0.05).
- 9 -
Table 4. Toxin transfer rate from digestive gland to kidney (KT.
d-1), elimination rate (k
el KD, d-1) (standard deviation) and
coefficient of determination R2 for each PST determined in
octopus kidney during uptake.
Table 5. Toxin concentration at initial depuration conditions
(qo), elimination rate (kel V, d-1) (standard deviation) and
coefficient of determination R2 for each PST determined
following one compartment model, asterisks indicate values within the confidence limit (P < 0.05).
CHAPTER FOUR - Presence and persistence of the amnesic shellfish poisoning toxin, domoic acid, in octopus and cuttlefish brains Table 1. Domoic acid concentrations (mg DA kg-1) in the brain and
digestive glands (DG) of other cephalopod species. (nd – not detected).
Table 2. Spearman’s rank order correlations between total weight
(g), mantle length (ML, mm), gender, maturity stage (MS), domoic acid concentrations (mg DA kg-1) in the brain and digestive
glands (DG) of Octopus vulgaris. Marked correlations in bold with asterisks are significant at p<0.05.
- 12 -
ABSTRACT
Harmful algal blooms (HABs) are natural occurrences that can severely impact coastal marine food webs. Depending on the species, they can produce a wide array of toxins, which may elicit devastating effects on marine life. Paralytic shellfish toxins (PSTs) and domoic acid (DA) are the most common neurotoxins occuring along the Portuguese coast. It is established that cephalopods accumulate these water-soluble toxins in their tissues, mostly in the digestive gland, through ingestion of contaminated prey. Here, the uptake and transfer kinetics of PSTs between octopus (Octopus vulgaris) body tissues is described. It was shown that octopuses present low toxin conversion (regarding toxin concentrations between the contaminated prey and cephalopod predator), transference between tissues and elimination rates. The uptake period was better characterized using an exponential growth model, suggesting swift biotoxin uptake. PSTs were found to be present in kidney tissue at much lower concentration than in the digestive gland. Throughout the experimental period (16 days) the specimens did not display outward signs of intoxication after ingestion of high dosages of a paralytic toxin (up to 1249.2 µgSTX eq kg-1 at
the end of the uptake period). In order to determine if HAB related neurotoxins reach cephalopod’s central nervous system, wild octopuses and cuttlefish were collected and brain tissue was analysed for DA. This neurotoxin causes amnesic shellfish poisoning in vertebrates and it is known to accumulate in cephalopods’ digestive gland. Here, it is also shown that octopus and cuttlefish accumulate this potent toxin in their brain tissue for at least four months (in octopus), suggesting that they can selectively retain and possibly tolerate this toxin. Concomitantly, there was no information on the effects of DA at cephalopod’s early stages of development when exposed to dissolved toxins in seawater. For that, 2-day-old paralarvae were exposed to ecologically relevant DA concentrations (150 µg DA L-1), and activity patterns, feeding behaviour and
chromatophore activity was determined. These results show that DA did not impair or alter the feeding behaviour or
- 13 -
chromatophore activity of octopus paralarvae. In conclusion, these studies show that cephalopods possess very high potential for HAB-toxins accumulation and may have developed mechanisms to protect them against potent neurotoxins that are frequently available in the marine environment.
Keywords: cephalopods, biotoxins, domoic acid, PSTs, central
- 14 -
RESUMO
Os “blooms” de algas tóxicas são fenómenos naturais que podem afetar distintamente vários níveis das teias tróficas marinhas. Dependendo da espécie, estas algas, tanto diatomáceas como dinoflagelados, podem produzir uma vasta gama de toxinas, que em casos extremos podem causar efeitos devastadores na vida marinha. As toxinas paralisantes (PSTs) do grupo saxitoxina e as toxinas amnesicas do grupo ácido domóico (AD) são as neurotoxinas mais comuns observadas ao longo da costa Portuguesa. Sabe-se que os cefalópodes acumulam estas toxinas hidrofílicas nos seus tecidos, com especial ênfase na glândula digestiva, através da ingestão de presas contaminadas. Na presente dissertação é examinada a cinética de “uptake”, transferência e eliminação de PSTs entre tecidos de polvo comum (Octopus vulgaris). Verificou-se que os polvos apresentam taxas de conversão (entre as toxinas presentes presa contaminada e no predador), transferência e eliminação reduzidas. Para além de se detectar elevadas concentrações na glândula digestiva, estas toxinas foram também encontradas no rim, mas em concentrações consideravelmente inferiores, o que evidência a lenta eliminação das toxinas. A exposição de polvos a alimento altamente contaminado (2665 ± 330 µg STX eq kg-1) durante 6 dias e apesar
das elevadas concentrações de toxina paralisante presentes nos seus tecidos não se observou qualquer efeito/alteração comportamental. Por forma a determinar se neurotoxinas derivadas de “blooms” de algas tóxicas atingem o sistema nervoso central, foram capturados polvos (O. vulgaris) e chocos (Sepia officinalis), e o seu tecido cerebral foi analisado para a quantificação de AD. Esta toxina actua ao nível dos recetores glutamatérgicos, inibindo a ligação normal do neurotransmissor glutamato, desencadeando a permanente ativação de recetores AMPA, cainato e NMDA, resultando na despolarização da membrana neural e a degeneração celular no sistema nervoso central de vertebrados e está documentada a sua acumulação na glândula digestiva de cefalópodes. A presente dissertação demonstra que esta potente neurotoxina ultrapassa a barreira hematoencefálica e atinge o tecido cerebral de polvos e chocos, podendo ser
- 15 -
acumulada no caso dos polvos por períodos de pelo menos quatro meses. Os resultados obtidos permitem inferir que os polvos retêm esta toxina e possivelmente toleram a sua presença. Concomitantemente, e até à data, eram desconhecidos os efeitos de biotoxinas em estados iniciais de desenvolvimento de cefalópodes, estados estes que são considerados como sendo fases mais vulneráveis a contaminantes externos, como as biotoxinas marinhas. Com vista a preencher esta lacuna, foram expostas paralarvas de polvo, dois dias após a sua eclosão, a 150 µg DA L-1 dissolvido na água, e foram determinadas as taxas de
atividade, alimentação e atividade cromatofórica. Os resultados aqui apresentados demonstram que a presença de AD na sua fração dissolvida não afeta nenhum dos parâmetros testados. Em suma, estes estudos revelam que os cefalópodes possuem um elevado potencial de acumulação de toxinas provenientes de blooms de algas tóxicas e poderão ter desenvolvido mecanismos que os protegem contra a ação destas potentes neurotoxinas.
Palavras-chave: cefalópodes, biotoxinas, ácido domóico, PSTs,
- 16 -
RESUMO ALARGADO
As comunidades fitoplanctónicas são tipicamente benéficas para o ecossistema, uma vez que constituem fonte de alimento para inúmeros organismos. De todas as espécies de fitoplâncton conhecidas, há uma pequena percentagem produz toxinas. No entanto, quando as condições do meio são consideradas ideais, estes organismos atingem elevadas taxas de crescimento e elevadas densidades, dando origem aos blooms de algas tóxicas. De um ponto de vista ecológico, as toxinas provenientes de blooms de algas tóxicas, podem causar efeitos devastadores nas comunidades marinhas, uma vez que, dependendo da espécie produtora, as toxinas podem atuar no sistema nervoso central, a vários níveis, ou no trato gastrointestinal. As biotoxinas, toxinas produzidas por microalgas, são principalmente acumuladas pela base da teia trófica, por organismos planctónicos filtradores, peixes planctívoros e bivalves. As toxinas produzidas por estas microalgas podem ser transferidas para níveis mais elevados da teia trófica marinha, como os cefalópodes. Os cefalópodes ocupam uma posição importante em todos os ecossistemas onde ocorrem, uma vez que são o alimento de predadores de topo, mamíferos e aves marinhas. Na dieta dos cefalópodes constam moluscos, crustáceos e pequenos peixes, podendo assim constituir um elo de ligação entre a acumulação por consumidores primários (e.g. bivalves), os predadores de topo, e até mesmo o Homem. Sabe-se que os cefalópodes são capazes de acumular grandes concentrações de ficotoxinas, no entanto, muitos fatores envolvidos nesta dinâmica permanecem incompreendidos. Assim, a presente dissertação teve como objetivo principal estudar a relação entre toxinas provenientes de blooms de algas tóxicas, nomeadamente toxinas paralisantes (PSTs) e ácido domóico (AD) e a sua subsequente acumulação em cefalópodes, mais concretamente em polvos (Octopus vulgaris). Em primeiro lugar examinou-se a cinética de acumulação e eliminação de PSTs. O principal órgão de acumulação foi a glândula digestiva (GD), seguido do rim, não se detectando PSTs em nenhum outro tecido. A reduzida taxa de eliminação calculada traduz a acumulação exponencial destas toxinas na GD. A transferência de
- 17 -
toxinas entre compartimentos (GD e rim) também se verificou reduzida, com uma taxa mais baixa do que a taxa de eliminação, sugerindo que na excreção destas toxinas estejam também envolvidas outras vias ou mecanismos. A acumulação, transferência e eliminação são processos simultâneos, logo, são inerentemente difíceis de quantificar. Assim, ao serem utilizados modelos de cinética de primeira ordem, podem ser inferidas as taxas a que cada processo é efetuado. Na presente dissertação é apresentado um modelo de crescimento exponencial, utilizando dois compartimentos (GD e rim) para caracterizar a fase de acumulação, enquanto que, na eliminação de toxinas, o modelo com melhor encaixe foi um modelo de decréscimo exponencial utilizando apenas um compartimento, o total da víscera. Um facto relevante observado no decorrer deste estudo foi a aparente falta de resposta comportamental, por parte dos polvos, apesar das elevadas concentrações de toxina presentes nos seus tecidos.
De forma a averiguar se estas toxinas causam algum tipo de efeitos comportamentais, foi necessário investigar a presença das mesmas em tecido cerebral de polvo, choco e lula. Foram capturados espécimes de polvo (O. vulgaris), choco (Sepia officinalis) e lula (Loligo vulgaris, L. forbesi e Todarodes sagittatus), cujo tecido cerebral e GD foram removidos para serem analisados para quantificação de AD, uma das neurotoxinas em estudo na presente dissertação. Verificou-se que apenas os polvos e os chocos apresentam AD no tecido cerebral. Este facto prende-se, possivelmente, com o estilo de vida dos diferentes cefalópodes e, por consequência, com as suas dietas. As lulas são predadores pelágicos, que se alimentam principalmente de pequenos peixes, que por sua vez poderão acumular toxinas durante curtos períodos de tempo. Por outro lado, cefalópodes bentónicos ou nectobentónicos, como os polvos e chocos, respetivamente, alimentam-se principalmente de bivalves e crustáceos, organismos mais passíveis de acumular toxinas. No caso dos polvos, onde foi feita a uma amostragem mais extensa, o AD foi detectado em todas as amostras de cérebro analisadas. No entanto, dados provenientes do programa de monitorização
- 18 -
implementado e executado pelo IPMA, de periodicidade semanal, mostram que a acumulação de AD em bivalves nas épocas coincidentes com a amostragem de polvos foi muito restrita no tempo e aconteceu em baixas concentrações. Os dados aqui apresentados demonstram, pela primeira vez, que cefalópodes, mais concretamente polvos e chocos, acumulam a neurotoxina AD, produzida por diatomáceas, no tecido cerebral e que retém esta toxina no seu sistema durante longos períodos de tempo (pelo menos 4 meses).
No entanto, os efeitos destas toxinas em estados iniciais de desenvolvimento de cefalópodes, fases essas consideradas por diversos autores como fases mais susceptiveis aos contaminantes ambientais incluindo contaminantes naturais como as biotoxinas marinhas, eram desconhecidos. Com o objetivo de determinar se os polvos são afetados pela presença desta toxina nas suas fases ontogenéticas iniciais, ao nível do comportamento, foram expostas paralarvas de polvo a AD na fração solúvel, com concentrações ecologicamente relevantes (150 µg DA L-1). No
decorrer da exposição aguda realizada (24 horas) foram monitorizadas e registadas as taxas de atividade, medidas através da quantificação do número de contrações do manto (propulsões), o número de presas ingeridas e a área da superfície dorsal das paralarvas coberta por cromatóforos. Ao final de 24 horas de exposição foi verificado que a presença de AD dissolvido na água dos tanques experimentais não causou efeitos alguns sobre os parâmetros analisados. Após o final do período experimental (24h), a água dos tanques foi recolhida para averiguar a concentração de AD presente e confirmar a exposição, e constatou-se que não houve degradação da toxina, uma vez que as concentrações da mesma se mantiveram semelhantes aos níveis inicialmente adicionados. Este estudo permite inferir que as paralarvas de polvo não são afetadas pela presença de uma neurotoxina dissolvida no meio, uma vez que, as taxas de atividade, número de presas ingeridas e atividade dos cromatóforos permaneceram semelhantes tanto no grupo de exposição como no grupo controlo.
- 19 -
Os estudos aqui apresentados constituem a primeira tentativa de compreender a relação entre cefalópodes e toxinas produzidas por microalgas. Na presente dissertação é descrita a acumulação e eliminação de um complexo de neurotoxinas hidrofílicas (derivados de saxitoxina), e é demonstrado que os polvos possuem baixas taxas de eliminação destas toxinas, que seriam, à partida, rapidamente eliminadas. As reduzidas taxas de eliminação permitem uma acumulação com tendência exponencial, e principalmente concentrada num tecido/orgão, a GD. Até à data, não se sabia se as neurotoxinas produzidas por blooms de algas tóxicas e acumuladas em cefalópodes poderiam atravessar a barreira hematoencefálica e atingir o sistema nervoso central. Na presente dissertação verificou-se que o AD atinge o tecido cerebral e, que esta acumulação ocorre durante, pelo menos, 4 meses. Este facto sugere uma retenção seletiva destas toxinas e enfatiza a aparente ausência de efeitos negativos na fisiologia destes organismos. De fato, após a exposição de paralarvas de polvo a uma neurotoxina na fração solúvel, este estado inicial do ciclo de vida, que é, por definição, mais sensível, uma vez que estes organismos ainda não possuem todo o corpo desenvolvido e são tipicamente mais vulneráveis a contaminantes externos, revelou ausência de efeitos negativos nos parâmetros testados. As paralarvas apresentaram padrões de atividade comparáveis ao grupo controlo, assim como o número de presas ingeridas e a atividade dos cromatóforos ao longo de 24 horas de exposição à toxina dissolvida no meio.
Os estudos aqui apresentados demonstram que em O. vulgaris o “uptake” de neurotoxinas ocorre em taxas elevadas, em contraste com a sua eliminação, que, sendo reduzida, permite a acumulação exponencial destes compostos. Adicionalmente, verificou-se, pela primeira vez, que neurotoxinas provenientes de blooms de algas tóxicas penetram na barreira hematoencefálica e são retidas durante longos períodos de tempo. Por fim, após a exposição de paralarvas de O. vulgaris à toxina dissolvida constatou-se que esta não altera nenhum dos parâmetros estudados. Assim, a presente dissertação evidencia que os cefalópodes são organismos “imunes” a biotoxinas marinhas, que podem em casos extremos
- 20 -
causar efeitos devastadores em muitos outros organismos marinhos e até em humanos.
Em estudos futuros, será crucial compreender os mecanismos de defesa que estes invertebrados excecionais poderão possuir, que os permite acumular concentrações elevadas destas neurotoxinas, assim como investigar se estas toxinas serão acumuladas na hemolinfa e em que zonas do cérebro ficam acumuladas.
- 23 -
LIST OF PAPERS
I hereby declare, as author of the present dissertation, that I participated and was responsible for the conception and experimental design of each chapter presented here. I was also responsible for sample collection, animal rearing, laboratory analysis, data analysis and writing of each manuscript. The other authors contributed in some of the tasks described above. The present dissertation is comprised of five scientific outputs, four scientific papers, of which 3 are published, and one book chapter accepted for publication, that can be found from Chapter One to Five.
Chapter One
Lopes, V.M., Costa, P.R., Rosa, R. (In press). Effects of
Harmful Algal Bloom Toxins on Marine Organisms. In Duarte, B., Caçador, I. (Eds.), Ecotoxicology of Marine Organisms, CRC Press, ISBN-13: 978-1138035492.
Chapter Two
Lopes, V.M., Lopes, A.R., Costa, P., Rosa, R., (2013).
Cephalopods as vectors of harmful algal bloom toxins in marine food webs. Marine Drugs 11, 3381-3409. doi:10.3390/md11093381.
Chapter Three
Lopes, V.M., Rosa, R., Costa, P.R. (2018) Presence and
persistence of the amnesic shellfish poisoning toxin, domoic acid, in octopus and cuttlefish brains. Marine Environmental Research 133, 45–48. DOI: 10.1016/j.marenvres.2017.12.001.
Chapter Four
Lopes, V.M., Baptista, M., Repolho, T., Rosa, R., Costa, P.R.,
2014. Uptake, transfer and elimination kinetics of paralytic shellfish toxins in common octopus (Octopus vulgaris). Aquatic Toxicology 146, 205-211. DOI: 10.1016/j.aquatox.2013.11.011.
- 24 -
Lopes, V.M., Sampaio, E., Vara, C., Costa, P.R., Rosa, R. (in
preparation). Feeding behaviour and chromatophore activity of octopus paralarvae are not affected by the harmful algal toxin domoic acid. Marine Environmental Research.
- 27 -
“I firmly believe that the art of storytelling will never change. If you tell a good story, people will hang on your words.” - Sir David Attenborough
- 28 -
- 29 -
GENERAL INTRODUCTION
The material in this chapter is adapted from:
Lopes, V.M., Costa, P.R., Rosa, R. (accepted) Effects of Harmful Algal Bloom
Toxins on Marine Organisms. In Duarte, B., Caçador, I. (Eds.), Ecotoxicology of Marine Organisms, CRC Press, ISBN-13: 978-1138035492.
- 31 -
1.1. Overview on Harmful Algal Blooms
Algal blooms are natural occurrences, defined as the sudden overgrowth of microscopic algae under optimal environmental conditions, reaching up to millions of cells per litre (Hallegraeff, 1993). These blooms are typically beneficial for the ecosystem, increasing feeding opportunities for countless organisms. However, if toxin-producing microalgae undergo this sudden overgrowth, it can lead to harmful algal blooms (HABs). Despite the fact that approximately 2% of microalgae species produce toxins (Hallegraeff, 2014; Smayda, 1997), HABs can significantly impact marine communities.
In the marine realm, the majority of HAB-toxins are produced by dinoflagellates and diatoms (Table 1). Biochemically, phycotoxins are secondary metabolites that can have a wide range of effects. They can act on the nervous system, which can induce permanent short-term memory loss (domoic acid) or cause sensorimotor impairment, leading to death (paralytic shellfish toxins) and act on the digestive tract, inducing gastrointestinal distress. During the last decades several new toxins and new toxin derivatives, such as gymnodimines, azaspiracids, pterotoxins, pinnatoxins and hydroxybenzoate saxitoxin, okadaic and domoic acid analogues have been described, mostly due to scientific and technological advances (Cruz et al., 2006; Miles et al., 2000; Negri et al., 2003; Satake et al., 1998; Takada et al., 2000; Zaman et al., 1997). In addition, changes on global climate conditions and anthropogenic pressures have been causing several tropical and subtropical endemic HAB-toxins, namely ciguatoxins, palytoxins
- 32 -
and brevetoxins to expand geographical range into temperate waters (Botana et al., 2015; Villareal et al., 2007).
Table 1. The most common toxins produced by marine phytoplankton Toxin Toxic species Mode of action family Toxin
Saxitoxins Alexandrium sp., Gymnodinium catenatum, Pyrodinium bahamense Inhibition of voltage-gated sodium channels in neural cells Paralytic shellfish toxins Domoic acid Pseudo-nitzschia spp. Amphora coffaeaiformis, Nitzschia sp., Binding to glutamate receptors in neural cells causing constant influx of Ca2+ Amnesic shellfish toxins Brevetoxins Karenia brevis, Karenia sp., Chatonella cf. verrucosa, C. antiqua, C. marina, Fibrocapsa japonica, Heterosigma akashiwo Binding to voltage-sensitive sodium channels causing membrane depolarization Neurotoxic shellfish toxins Okadaic acid and dinophysistox ins Dinophysis sp., Prorocentrum sp. Inhibition of activity of protein phosphatase 1 and 2 Diarrhetic shellfish toxins
1.2. Routes of toxin exposure
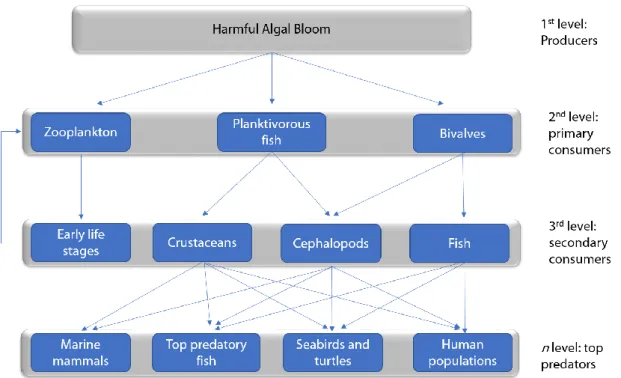
Toxin transfer can be foodborne or waterborne, i.e. via food web transfer or through exposure to toxins dissolved in the water after their excretion or cell release (Fig. 1). The most likely pathway of toxin transfer is when toxin-producing species bloom, thus achieving massive concentrations in the water column. However, there are many potential toxin vectors (Fig. 2), depending mostly on the ecology of the toxin producer (pelagic
- 33 -
or epibenthic) and the organism’s likelihood of exposure to the toxin.
Figure 1. Foodborne and waterborne exposure to HAB-toxins. Solid lines
illustrate the well documented route of dietary exposure; dashed lines illustrate the less studied routes of dissolved toxins exposure. Legend: SPM – Suspended Particulate Matter.
If an organism is exposed to a sudden bloom of toxin-producing microalgae, the toxin concentrations will certainly trigger immediate physiological and behavioural alterations and ultimately cause the death of the organism. In addition, the continuous exposure to low HAB-toxin concentrations can lead to chronic effects (Landsberg, 1995).
Here, the pathways of exposure will be divided into direct and indirect contact with the toxin-producer. Through ingestion of
- 34 -
toxic phytoplanktonic cells by filter-feeding organisms, such as bivalve molluscs, zooplankton and planktivorous fish, the toxins present inside the cell can accumulate in the predator’s viscera. This can create a chain of vectors throughout the food web, potentially eliciting adverse effects in marine communities. Depending on the vector, these toxins can be transferred to humans and cause a variety of shellfish poisonings, due to the ingestion of contaminated shellfish, such as Paralytic Shellfish Poisoning (PSP) or Amnesic Shellfish Poisoning (ASP), among other syndromes (Table 1).
Some microalgae species produce exotoxins, or exudates, that are released into the water column, causing other organisms to come inadvertently in contact with these compounds. Similarly, when the bloom becomes senescent, the cells lyse and release the toxins to the surrounding environment (Lefebvre et al., 2008), opening another possible pathway to the organisms’ direct contact with the toxins. Lastly, there are other HAB-species which segregate the toxin on the outer surface of their cells, potentially inducing damage upon contact (Matsuyama et al., 1997; Kamiyama and Arima, 1997).
The present dissertation is focused on paralytic shellfish toxins (PSTs) and domoic acid (DA) and their effects on marine organisms, due to the fact that these are hydrophilic neurotoxins and are the most relevant in Portugal’s socio-economic context (Sampayo et al., 1997; Vale and Sampayo, 2001).
- 35 -
PSTs are one example of phycotoxins produced by dinoflagellates, and one of the most abundant and toxic in oceans worldwide. Dinoflagellates from three genera, Alexandrium, Gymnodinium and Pyrodinium, produce saxitoxin or a suite of over 50 derivatives (Anderson et al., 2012), which the most frequent can be divided according to their chemical structure into carbamoyl, decarbamoyl and sulfamate toxins. These compounds block the conduction of electrical impulses in neural cells through the inhibition of voltage-gated sodium channels on these cell’s membranes. This leads to membrane hyperpolarization and results in paralysis in muscle cells as determined in laboratory animals (Kao and Nishiyama, 1965; Ritchie and Rogart, 1977). PSTs have shown to elicit a wide range of effects on marine organisms, from sublethal and recoverable effects to events of mass mortality in fish, marine mammals and seabirds (Gill and Harris, 1987; Ives, 1987; Reyero et al., 2000; Yan et al., 2001; 2003; Shumway et al., 2003; Lefebvre et al., 2005; Samson et al., 2008; Escobedo-Lozano et al., 2012).
- 36 -
Figure 2. Schematic view of HAB-toxins food web transfer.
1.4. Amnesic shellfish toxins
DA is a potent neurotoxin produced by some species belonging to two genera of diatoms, Pseudo-nitzschia and Nitzschia. This toxin is known to cause Amnesic Shellfish Poisoning (ASP), and the attention on this toxin and its possible consequences was focused after an incident involving the death of 3 people in 1987 following ingestion of mussels contaminated with DA (Quilliam and Wright, 1989). Afterwards, most coastal countries developed monitoring programs, analysing regularly bivalve tissue for DA and other phycotoxins in order to prevent foodborne illnesses. These monitoring programs have been successful at avoiding further human casualties.
DA acts in neural cells, competing for the same receptors as glutamate, an excitatory neurotransmitter. By having less affinity for these receptors, glutamate fails to bind normally, causing excessive concentrations of glutamate outside the
- 37 -
synapses, triggering AMPA, kainate and NMDA receptors’ activation, permanently opening the neural cell’s membrane, leading to excessive influx of Ca2+ (Berman and Murray, 1997).
This causes membrane depolarization and subsequent degeneration of neural cells. Being glutamate receptors directly involved in controlling synaptic regulation in memory and learning processes (Lynch and Baudry, 1984; Massicote and Baudry, 1991), it is the most likely cause for the memory loss.
1.5. HAB-toxin effects on marine organisms
1.5.1. Paralytic shellfish toxins
PSTs producers inhabit the pelagic realm, the same habitat as most planktonic species. Therefore, plankton species come in contact with PSTs through contact with PST-producing cells or their exudates. It has been shown that many planktonic organisms can be affected by these toxins. In some cases, PSTs induce disruptions in swimming behaviour leading to death and limited egg production in ciliates (Hansen, 1989; Hansen et al., 1992). Diatoms and haptophytes had reduced growth rates after being placed in water previously conditioned by PSTs producer A. lusitanicum, presumably releasing the water-soluble toxins into the culture medium (Blanco and Campos, 1988).
Regarding the effects of PSTs on planktonic grazers, there are several studies indicating that some species can selectively avoid ingestion of toxic dinoflagellates, while others do not (Teegarden, 1999; Teegarden et al., 2001; Turriff et al., 1995; Turner & Tester, 1997). The latter group can present different effects, with some species presenting lower fecundity rates
- 38 -
(Colin and Dam, 2004; Dutz, 1998; Gill and Harris, 1987), lower hatching success (Frangópulos et al., 2000), lower activity and feeding rates and high mortalities (Bagøein et al., 1996; Colin and Dam, 2004; Ives, 1987; Sievers, 1969).
Direct exposure of bivalve molluscs to PST-producers has been shown to elicit negative effects, as summarized in Table 2. Exposure to dinoflagellate cells increased shell valve closure in many bivalve species (e.g. Crassostrea virginica, Mytilus edulis), leading to decreased filtration rates, potentially impacting the animal’s normal feeding behaviour. A. minutum and purified saxitoxin (STX) exposure in C. gigas resulted in decreased phagocytic activity and ROS production in oyster hemocytes (Mello et al., 2013), leading to higher susceptibility of contracting an infection. Also, the presence of the toxic dinoflagellates decreased byssus production in M. edulis and Geukensia demissa. However, byssus production in mussels (M. edulis) that have been previously exposed to these toxins was less affected. Similar experiments performed on greenshell mussels (Perna canaliculus) showed that mussels presented oxygen consumption and clearance rates similar to the control group after 24h exposure to A. tamarense (Marsden and Shumway, 1992).
Table 2. Documented cases of bivalves molluscs exposed to and affected
by paralytic shellfish toxins (PSTs).
Target species PST source Route of exposure Levels of exposure Effects Reference s Larvae of Argopecten irradians concentricu s A. tamarense Exposure to A. tamarense cells Up to 11 pg STX eq cell-1 A. tamarense cultures Activity and growth inhibition, lower attachment rates and reduced (Yan et al., 2003)
- 39 - climbing rates Larvae of Chlamys farreri A. tamarense Exposure to A. tamarense cells Up to 5.9 x 109 g STX L-1 A. tamarense cultures High mortality rates, lower hatching rates (Yan et al., 2001) Crassostrea gigas G. washingtonen sis (now A. catenella) Exposure to A. catenella cells 5 x 104
cells L-1 Reduced pumping
activity, increased valve activity (Dupuy and Sparks, 1967) A. minutum Exposure to A. minutum cells Up to 12 x 104 cells L-1 Decreased valve activity, clearance and filtration rates (Lassus et al., 1999) A. tamarense and A. minutum Exposure to dinoflagell ate cells Up to 12 x 108 cells L-1 Reduced clearance rates (Laabir and Gentien, 1999) A. minutum Exposure to A. minutum cells 5 x106
cells L-1 diacylglyceroMono and
ls reduced in digestive gland, inflammation of gastrointesti nal tract, modified spermatozoa and mitochondria (Haberkor n et al., 2010) A. minutum Exposure to A. minutum cells 15 x 106
cells L-1 circadian Altered
rhythm (Tran et al., 2015) Larvae of C. gigas A. tamarense Exposure to A. tamarense cells Up to 108
cells -1 mortality High
rates (Matsuyam a, et al., 2001) A. taylori Exposure to A. taylori cells Up to 108 cells -1 High mortality rates (Matsuyam a, et al., 2001) C. virginica G. monilata (now A. monilatum) Exposure to A. monilatum cells Up to 1.2 x 106 cells L-1 Inhibition of byssus production and shell closure (Sievers, 1969) Brachiodont es recurvus G. monilata (now A. monilatum) Exposure to A. monilatum cells Up to 1.2 x 106 cells L-1 Inhibition of byssus production and shell closure (Sievers, 1969)
- 40 - Geukensia demissa P. tamarensis (now A. tamarense) Exposure to A. tamarense cells 2.5-5.5 x 105 cells L-1 Inhibited cardiac activity (Gainey & Shumway, 1988) A. tamarense Exposure to A. tamarense cells 105 cells L-1 Reduced clearance rates (Lesser and Shumway, 1993) P. tamarensis (now A. tamarense) Exposure to A. tamarense cells 5 x 105
cells L-1 clearance Reduced
rates, increased mucus production (Shumway & Cucci, 1987) P. tamarensis (now A. tamarense) Exposure to A. tamarense cells 106 cells L-1 Inhibition of byssus production (Shumway, et al., 1987) Mercenaria mercenaria A. tamarense Exposure to A. tamarense cells 105 cells L-1 Reduced clearance rates (Lesser and Shumway, 1993) Mya arenaria P. tamarensis (now A. tamarense) Exposure to A. tamarense cells 2.5-5.5 x 105 cells L-1 Inhibited cardiac activity (Gainey & Shumway, 1988) A. tamarense Exposure to A. tamarense cells Up to 77 x 104 µg STX eq kg-1 in viscera Naïve populations had higher toxicity and mortality, reduced clearance rates, oxygen consumption rates and burrowing capacity (MacQuarr ie and Bricelj, 2008) A. tamarense Exposure to A. tamarense cells 105 cells L-1 clearance Reduced rates (Lesser and Shumway, 1993) P. tamarensis (now A. tamarense) Exposure to A. tamarense cells 5 x 105
cells L-1 clearance Reduced
rates (Shumway & Cucci, 1987) A. excavata and A. tamarense Exposure to Alexandrium spp. cells Up to 30.4 x 104 µg STX eq kg -1 Burrowing incapacity (Bricelj, et al., 1996) Mytilus edulis P. tamarensis (now A. tamarense) Exposure to A. tamarense cells 2.5-5.5 x 105 cells L-1 Inhibited cardiac activity (Gainey & Shumway, 1988) Dissolved STX Intramuscul ar injection 3330 µg
STX kg-1 Higher GST activity (Gubbins,et al.,
2001) A. tamarense Exposure to A. tamarense cells 105 cells L-1 clearance Reduced rates (Lesser and Shumway, 1993)
- 41 - P. tamarensis (now A. tamarense) Exposure to A. tamarense cells 5 x 105 cells L-1 Increased mucus production (Shumway & Cucci, 1987) P. tamarensis (now A. tamarense) Exposure to A. tamarense cells 106 cells L-1 Inhibition of byssus production (Shumway et al., 1987) Ostrea edulis P. tamarensis (now A. tamarense) Exposure to A. tamarense cells 2.5-5.5 x 105 cells L-1 Decreased in heart rate (Gainey & Shumway, 1988)
P. viridis A. tamarense Exposure to A. tamarense cells 105 cells L-1 clearance Reduced rates (Lesser and Shumway, 1993) Placopecten magellanicu s P. tamarensis (now A. tamarense) Exposure to A. tamarense cells 5 x 105
cells L-1 Increased clearance
rates (Shumway & Cucci, 1987) Spisula solidissima A. tamarense Exposure to A. tamarense cells 105 cells L-1 clearance Reduced rates (Lesser and Shumway, 1993)
Exposure of M. chilensis to A. catenella for 21 days (Navarro and Contreras, 2010) resulted in lowered clearance rates, organic matter intake and absorption efficiency at the start of the experiment, followed by an increase to levels similar to the ones presented in the control group. STX uptake steadily increased throughout the experiment, similarly to mussel’s excretion rates. Oxygen consumption rates seemed unaffected by the ingestion of this toxic species, revealing that it may possess defence mechanisms that allow them to feed safely on this dinoflagellate.
On the other hand, some scallop and clam species presented negative effects when exposed to this toxin. The scallop Nodipecten subnodosus presented paralysis of the adductor muscle while maintaining the digestive tract functioning after receiving intramuscular injections of GTX 2+3. Also, hemocyte
- 42 -
number decreased and they presented mantle retraction and their shells remained open up to 40 days after the exposure (Estrada et al., 2010). In a different study on the same species (Estrada et al., 2007), exposure to G. catenatum cells resulted in increased production of mucus, pseudo-faeces, melanisation and hemocyte aggregation in gill tissue. Biochemically, an antioxidative stress response to the toxin was shown in gill tissue, being this tissue the first to come in contact with the toxin. There was an increase in glutathione peroxidase (GPx) activity and lipid peroxidation, along with a decrease in superoxide dismutase activity, indicating oxidative and cellular damage. Similar results were obtained when feeding G. catenatum cultures to scallops (Argopecten ventricosus) (Escobedo-Lozano et al., 2012). The scallops presented paralysis of the adductor muscle, lower feeding activity, increased pseudo-faeces production, increased number of hemocytes in gill, mantle and adductor muscle tissue and epithelial melanisation in gill and mantle tissue. These results indicate that scallops have efficient mechanisms that protect them against lethal effects from external toxicants. Studies conducted in Ruditapes phillipinarum feeding on A. tamarense cultures for 6 (Li et al., 2002) and 15 days (Choi et al., 2006) showed reduced scope for growth, decreased absorption efficiency, clearance and growth rates after 6 days of exposure, and increased activity of GPx in hepatopancreas and gill lipid peroxidation with increasing toxin burden after 15 days of exposure.
PST effects on bivalve early stages are comparatively less understood. Bricelj et al. (2010), addressed this issue by
- 43 -
exposing larvae, post-larvae and juveniles of Mya arenaria to A. tamarense. The authors showed that larvae were not significantly affected by the dinoflagellate due to the fact that the cells were too large for prey capture, thus the larvae did not accumulate the toxin or displayed any intoxication symptoms. On the other hand, the post-larvae presented decreased burrowing capacity, used as proxy of sensitivity to PSTs. Also, the post-larvae had increased mortality rates, especially in populations that are not usually exposed to A. tamarense blooms, while juvenile were less susceptible.
PST effects on bivalves are species-specific and seem to differ geographically within the same species and life stages. Species that are usually exposed to toxic dinoflagellate blooms seem to be more resistant and appear to have developed defence mechanisms that allow them to cope with high PST levels, unlike other species in areas less affected by blooms.
These studies reveal that bivalves are not immune to the effects of PST contamination, and there are some species with higher sensitivity to these toxins. This may pose additional concerns over the ecosystem’s health and elicit negative economic impacts, since some of these species are commercially farmed in shellfish aquacultures, and blooms may occur in farmed areas. PSTs have long been associated with fish kills. Fish can be directly exposed to the toxins, as is the case of planktivorous fish such as sardines, herring and anchovies, or indirectly through feeding on vectors, affecting many levels of the marine food web, from groupers and hake to sturgeons and artificially fed fish, such as farmed salmon.
- 44 -
Only a few events have been directly linked to PST contamination, since these events are unpredictable and sporadic, many times leading to inconclusive data. For a complete list of fish kills associated with PSTs refer to Costa (2016, Table 1).
When studying PST’s effect in fish, it is procedurally simpler to inject the toxin intracoelomically (IC) or intraperitoneally (IP), in order to closely control the given concentration. Standard STX is the toxin most commonly administered. However, despite the benefits, these methods are less ecologically relevant, since the toxins do not enter directly in the coelom, and STX is but a fraction of the toxins produced by the dinoflagellate species. Nevertheless, these studies provide windows into the symptoms presented by fish and insight into the effects of these neurotoxins.
STX effects in killifish (Fundulus heteroclitus) were quantified regarding the expression of c-Fos protein (Salierno et al., 2006), responsible for regulating neural cell’s survival, and is associated with long term memory (Sadananda and Bischof, 2002). It was shown that the expression of this protein decreased, and the fish presented behavioural alterations including paralysis, lethargy and loss of balance. STX most likely affects the neural pathways responsible for swimming. In Atlantic salmon (Salmo salar) it was shown that STX crosses the blood-brain barrier and that sublethal doses of this toxin affect the activity of brain subregions in the central nervous system (CNS), possibly affecting the organism’s cognitive abilities (Bakke & Horsberg, 2007). Intracoelomic injections of STX in white seabream