Pós-Graduação em Ciências Genômicas e Biotecnologia
“Estudo de Variabilidade Genética de
Aspergillus flavus
como Base para o
Desenvolvimento de PCR Multiplex para Detecção de Fungos Produtores
de Aflatoxinas em Castanha-do-brasil e Castanha de Caju”
Maria dos Reis Rodrigues Pinheiro
Universidade Católica de Brasília – UCB
Pós-Graduação em Ciências Genômicas e Biotecnologia
“Estudo de Variabilidade Genética de
Aspergillus flavus
como Base para o
Desenvolvimento de PCR Multiplex para a Detecção de Fungos Produtores
de Aflatoxinas em Castanha-do-brasil e Castanha de Caju”
Maria dos Reis Rodrigues Pinheiro
“Dissertação apresentada no Programa de
Pós-Graduação em Ciências Genômicas e Biotecnologia da Universidade Católica de Brasília, como requisito parcial para obtenção do grau de Mestre.”
Orientador: Dr. Robert Neil Gerard Miller
BANCA EXAMINADORA
____________________________________
Drª Marisa Álvares da Silva Velloso Ferreira
___________________________________________ Dr. Augusto Mello Simões Barbosa
___________________________________________ Dr. Robert Neil Gerard Miller
Agradecimentos
• A Deus, minha força.
• A minha família, meu esteio.
• Ao Professor Robert Miller, pela orientação efetiva, incentivo e apoio, um mestre
na orientação segura, meu muito obrigada.
• A todos os professores do Curso de Ciências Genômicas e Biotecnologia, mas de
uma maneira especial aos professores Rosane Garcia e Tatsuya Nagata por todo apoio no início dos trabalhos laboratoriais.
• A Eva Avelino Dias, presença sempre constante.
• A Alessandra Maria M. Reis, pela amizade e colaboração efetiva durante todo
trabalho de laboratório.
• Aos técnicos Márcia F. de Araújo, André Luiz C. Ramos e William B. Reis pelo
apoio e amizade.
• Aos estagiários Bruna Vidigal dos Santos, Felipe Ferreira da Costa e Rosa Maria
de A. dos Anjos pela valiosa colaboração.
• A todos os colegas, pelo apoio e incentivo mas de uma maneira especial a Suzana
N. Santos e Gutemberg D. de Sousa.
• As amigas Simone Vasconcelos, Clarissa Falcão e Letícia Fagundes.
• Ao professor Georgios Pappas, pelo apoio nos trabalhos de bioinformática.
• Ao professor Lúcio Flávio de A. Figueiredo e ao colega Alexandre M. Teles pelo
apoio e incentivo impressindíveis para que eu pudesse chegar até aqui.
• Ao Fábio Gomes da Costa pela presença sempre tranqüila a apoiar.
• A todos os funcionários da UCB pela presteza.
• Ao IBGE e a todos os meus colegas de trabalho e de uma maneira especial a
Antônio M. Leles, Walker R. Moura, Célia Maria Felisberto e Gisela R. de A. Vaz de Mello, por todo apoio e incentivo.
• Ao Dr. Francisco Freire (Embrapa – CNPAT) pelo fornecimento da coleção de A.
flavus.
Índice
Lista de Tabelas... 13
Resumo... 14
Abstract... 16
1. Introdução ... 18
1.1. Micotoxinas... 18
1.1.1. Impacto histórico ... 18
1.1.2. Toxicidade ... 19
1.1.3. Estratégias de controle ... 20
1.1.4. Metabolismo ... 23
1.2. Aflatoxina... 24
1.2.1. Organismos produtores e estrutura química ... 24
1.2.2. Ocorrência ... 25
1.2.3. Toxicidade ... 27
1.3. Castanha-do-brasil (castanha-do-pará), castanha de caju e legislação ... 29
2. Métodos de detecção e quantificação de micotoxinas ... 36
2.1. Métodos imunológicos ... 37
3. Métodos de detecção de fungos produtores de micotoxinas... 37
3.1. Contagem de esporos ... 37
3.2 Reação da Polimerase em Cadeia (PCR) ... 38
3.2.1.Vantagens da PCR... 38
4. Detecção e caracterização molecular... 39
4.1. DNA ribossomal nuclear (rDNA) ... 39
4.2. DNA mitocondrial (mtDNA) ... 43
4.3. Polimorfismo de DNA amplificado ao acaso – RAPD ... 44
4.4. Outros marcadores ... 45
5. Detecção molecular de fungos produtores de aflatoxinas ... 47
6. Hipótese... 53
7. Objetivos Gerais... 53
8. Objetivos Específicos ... 53
9. Materiais e Métodos... 54
9.1. Levantamento, cultivo, classificação e manutenção da coleção de fungos potencialmente produtores de aflatoxinas ... 54
9.4. Amplificação por PCR da região ITS do rDNA nuclear... 56
9.4.1. Sequenciamento do rDNA nuclear, região ITS e desenho de primers específicos para Aspergillus flavus... 57
9.4.2. Análisedasseqüências... 58
9.5. Polimorfismo de DNA amplificado ao acaso – RAPD ... 58
9.5.1. Análise fenética dos dados de RAPD ... 59
9.6. Amplificação por PCR do gene da subunidade menor (SSU) do rRNA presente no DNA mitocondrial (mtDNA) ... 59
9.7. Amplificação por PCR do gene da β-tubulina... 60
9.8. Amplificação da região IGS do rDNA nuclear... 60
10. Desenho de primers degenerados para genes da via biossintética das aflatoxinas .... 61
11. Resultados ... 63
11.1. Sequenciamento do rDNA e desenvolvimento de primers específicos ... 63
11.2. Caracterização molecular por polimorfismo de DNA amplificado ao acaso – RAPD... 66
11.3. Amplificações de outras regiões genômicas candidatas ao desenho de primers específicos para Aspergillus flavus... 68
11.4. Desenho de Primers para genes da via biossintética ... 70
12. Discussão ... 72
13. Conclusões ... 80
14. Trabalhos futuros... 81
15. Bibliografia ... 82
Lista de Figuras
Figura 1: Estrutura química das aflatoxinas... 25
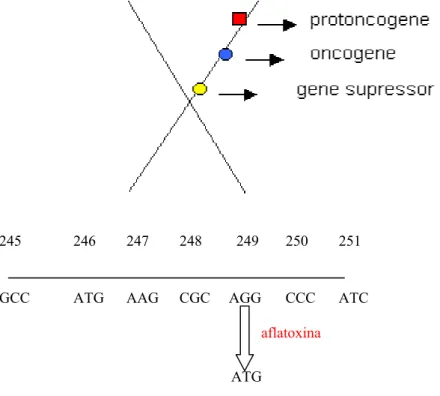
Figura 2: Esquema de genes no cromossomo e parte da seqüência de bases nitrogenadas indicando códon do gene supressor de tumor (gene p53) onde ocorre a alteração da base. ... 28
Figura 5: Cluster de genes e regiões espaçadoras do rDNA nuclear e o local onde anelam os primers universais para amplificações das regiões ITS e IGS. ... 40
Figura 6: Via biossintética para sterigmatocistin e aflatoxina B1 do fungo
Aspergillus flavus. A via biossintética está fora do perímetro, com os genes envolvidos na codificação das enzimas sobre as caixas e dentro das caixas, as setas indicam a direção da transcrição do gene. As setas que saem das caixas indicam a posição de cada enzima na via. Pks A, policetídeo sintase; nor 1, nor A, norsolorinic ácido redutase; fas1, fas2, ácido graxo sintase; aflR, fator de transcrição; afl J, desconhecido; adh A, álcool dehidrogenase; ver 1A , aflS, O-metiltransferase; avn A, versiconal hemiacetil acetato redutase; ver B, desaturase; ord 1, ord 2, omt A, O-metiltransferases; vbs, oxidase/dehidrogenase; avf 1 (afl B afl W), esterases. Adaptado de Woloshuk & Prieto (1998), por Edwards et al. (2002) ... 52
Figura 7: Região ITS do rDNA nuclear – Amplificação realizada com os primers
ITS5 e ITS4. Os números acima dos poços representam os isolados e as letras os marcadores utilizados (M = 1 kb plus DNA ladder; M1 =
λ 100 DNA; M2 = λ 200 DNA)... 64
gêneros comumente associados às espécies hospedeiras acima citadas... 65
Figura 9: Perfis de RAPD para os 48 isolados de A. flavus, gerados com o primer
RAPD-OPF13. Os números acima dos poços do gel indicam o isolado de A. flavus. A letra M indica o marcador 1kb plus DNA ladder e C o controle negativo (ausência de DNA na mistura)... 67
Figura 10: Perfis de RAPD para os 48 isolados de A. flavus, gerados com o primer
RAPD-O20. Os números acima dos poços do gel indicam o isolado de
A. flavus. A letra M indica o marcador 1kb plus DNA ladder e C o controle negativo (ausência de DNA na mistura)... 67
Figura 11: Fenograma UPGMA representando as relações genéticas dos isolados de A. flavus em castanha-do-brasil e castanha de caju, baseado na combinação dos perfis RAPD (11 primers). As similaridades foram obtidas utilizando-se o coeficiente de Jaccard que dividiu os isolados de A. flavus em cinco grupos conforme planta hospedeira e região de origem... 68
Figura 12: Região mtDNA SSU – Amplificação realizada com os primers MS1 e MS2. Os números acima dos poços representam os isolados e as letras os marcadores e o controle (M = 1 kb plus DNA ladder; C = controle negativo; M1 = λ 100 DNA; M2 = λ 200 DNA) ... 69
Figura 13: Gene β-tubulina – Amplificação realizada com os primers T22 e T1. Os números acima dos poços representam os isolados e as letras os marcadores e o controle (M = 1 kb plus DNA ladder; C = controle negativo; M1 = λ 100 DNA; M2 = λ 200 DNA) ... 69
Figura 14: Seqüências consensos geradas do rDNA ITS 1, 5.8S, e ITS2 de 48 isolados de A. flavus, e de outras espécies no gênero Aspergillus e de outros gêneros associados com Anacardium occidentale e Bertholletia excelsa no Brasil (dados do Genbank)... 107
indicam o isolado de A. flavus. A letra M indica o marcador 1kb plus
DNA ladder e C o controle negativo (ausência de DNA na mistura). ... 114
Figura 16: Perfis de RAPD para isolados de Aspergillus flavus 1 – 48, gerados com o primer RAPD-OPA04. Os números acima dos poços do gel indicam o isolado de A. flavus. A letra M indica o marcador 1kb plus
DNA ladder e C o controle negativo (ausência de DNA na mistura). ... 114
Figura 17: Perfis de RAPD para isolados de Aspergillus flavus 1 – 48, gerados com o primer RAPD-D10 Os números acima dos poços do gel indicam o isolado de A. flavus. A letra M indica o marcador 1kb plus
DNA ladder e C o controle negativo (ausência de DNA na mistura). ... 114
Figura 18: Perfis de RAPD para isolados de Aspergillus flavus 1 – 48, gerados com o primer RAPD-D20. Os números acima dos poços do gel indicam o isolado de A. flavus. A letra M indica o marcador 1kb plus
DNA ladder e C o controle negativo (ausência de DNA na mistura). ... 114
Figura 18: Perfis de RAPD para isolados de Aspergillus flavus 1 – 48, gerados com o primer RAPD-D20. Os números acima dos poços do gel indicam o isolado de A. flavus. A letra M indica o marcador 1kb plus
DNA ladder e C o controle negativo (ausência de DNA na mistura). ... 115
Figura 19: Perfis de RAPD para isolados de Aspergillus flavus 1 – 48, gerados com o primer RAPD-K20. Os números acima dos poços do gel indicam o isolado de A. flavus. A letra M indica o marcador 1kb plus
DNA ladder e C o controle negativo (ausência de DNA na mistura). ... 115
Figura 20: Perfis de RAPD para isolados de Aspergillus flavus 1 – 48, gerados com o primer RAPD-Q20. Os números acima dos poços do gel indicam o isolado de A. flavus. A letra M indica o marcador 1kb plus
DNA ladder e C o controle negativo (ausência de DNA na mistura). ... 115
Figura 22: Perfis de RAPD para isolados de Aspergillus flavus 1 – 48, gerados com o primer RAPD-V10. Os números acima dos poços do gel indicam o isolado de A. flavus. A letra M indica o marcador 1kb plus
DNA ladder e C o controle negativo (ausência de DNA na mistura). ... 116
Figura 23: Perfis de RAPD para isolados de Aspergillus flavus 1 – 48, gerados com o primer RAPD-OPF10. Os números acima dos poços do gel indicam o isolado de A. flavus. A letra M indica o marcador 1kb plus
DNA ladder e C o controle negativo (ausência de DNA na mistura). ... 116
Figura 24: Fenograma UPGMA representando as relações genéticas dos isolados de Aspergillus flavus em castanha-do-brasil e castanha de caju, baseado nos perfis RAPD do primer B10. As similaridades foram obtidas utilizando-se o coeficiente de Jaccard. ... 117
Figura 25: Fenograma UPGMA representando as relações genéticas dos isolados de Aspergillus flavus em castanha-do-brasil e castanha de caju, baseado nos perfis RAPD do primer D10. As similaridades foram obtidas utilizando-se o coeficiente de Jaccard. ... 117
Figura 26: Fenograma UPGMA representando as relações genéticas dos isolados de Aspergillus flavus em castanha-do-brasil e castanha de caju, baseado nos perfis RAPD do primer D20. As similaridades foram obtidas utilizando-se o coeficiente de Jaccard. ... 118
Figura 27: Fenograma UPGMA representando as relações genéticas dos isolados de Aspergillus flavus em castanha-do-brasil e castanha de caju, baseado nos perfis RAPD do primer K20. As similaridades foram obtidas utilizando-se o coeficiente de Jaccard. ... 118
Figura 28: Fenograma UPGMA representando as relações genéticas dos isolados de Aspergillus flavus em castanha-do-brasil e castanha de caju, baseado nos perfis RAPD do primer O20. As similaridades foram obtidas utilizando-se o coeficiente de Jaccard. ... 119
baseado nos perfis RAPD do primer Q20. As similaridades foram obtidas utilizando-se o coeficiente de Jaccard. ... 119
Figura 30: Fenograma UPGMA representando as relações genéticas dos isolados de Aspergillus flavus em castanha-do-brasil e castanha de caju, baseado nos perfis RAPD do primer T20. As similaridades foram obtidas utilizando-se o coeficiente de Jaccard. ... 120
Figura 31: Fenograma UPGMA representando as relações genéticas dos isolados de Aspergillus flavus em castanha-do-brasil e castanha de caju, baseado nos perfis RAPD do primer V10. As similaridades foram obtidas utilizando-se o coeficiente de Jaccard. ... 120
Figura 32: Fenograma UPGMA representando as relações genéticas dos isolados de Aspergillus flavus em castanha-do-brasil e castanha de caju, baseado nos perfis RAPD do primer OPA04. As similaridades foram obtidas utilizando-se o coeficiente de Jaccard. ... 121
Figura 33: Fenograma UPGMA representando as relações genéticas dos isolados de Aspergillus flavus em castanha-do-brasil e castanha de caju, baseado nos perfis RAPD do primer OPF10. As similaridades foram obtidas utilizando-se o coeficiente de Jaccard. ... 121
Figura 35: Seqüências protéicas da enzima oxidoredutase, alinhamento das seqüências, identificação dos blocos, e desenho de primers
Lista de Tabelas
Tabela 1: Agentes etiológicos, principais micotoxinas, substratos e regiões de ocorrência... 22
Tabela 2: Efeito das micotoxinas sobre os sistemas fisiológicos animais ... 23
Tabela 3 : Informações sobre a coleção de isolados de A. flavus (origem e identificação)... 55
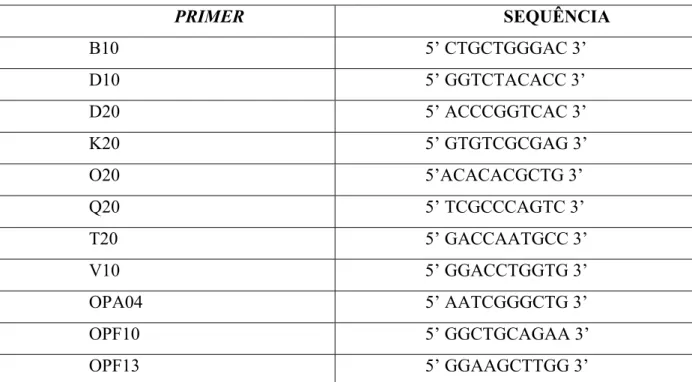
Tabela 4: Seqüências dos Primers RAPD utilizados ... 59
Tabela 5: Seqüências dos Primers utilizados nas amplificações das regiões ITS, mtDNA, IGS e β-tubulina. ... 61
Tabela 6: Primers desenhados para genes da via biossintética de aflatoxina em
Resumo
Aflatoxinas é a denominação dada a um grupo de substâncias muito semelhantes,
heterocíclicas e altamente oxigenadas, tóxicas ao homem e animais. São produtos do
metabolismo secundário de fungos filamentosos das espécies Aspergillus flavus, A.
parasiticus, A. pseudotamarii e A. nomius, desses, apenas A. flavus e A. parasiticus são economicamente importantes. Seus metabólitos são denominados B1, B2, G1 e G2. As letras
referem-se a cor que emitem (blue ou green) sob luz ultra violeta de comprimento de onda de
365 nanômetros (nm) e os números a sua toxicidade, sendo o nº 1 a forma mais tóxica.
As aflatoxinas são carcinogênicas, imunossupressivas, teratogênicas e
genotóxicas, objeto de preocupação em todo mundo, sendo de ocorrência mais frequente nos
países de clima tropical, embora também ocorram em todas as regiões, nas épocas e locais de
clima quente e úmido.
A castanha-do-brasil (Bertholletia excelsa H. B. K.) é o primeiro produto
extrativista em importância para as comunidades que vivem na Amazônia. É um produto
tipicamente de exportação, sendo que das 28.467 toneladas (t) produzidas em 2001, 20.000 t
tiveram como destino a Europa e os Estados Unidos. Ultimamente, o produto vem sofrendo
restrições nesses mercados devido a contaminação das castanhas por aflatoxinas, com níveis
acima dos permitidos, inclusive com devoluções do produto.
A técnica oficial de detecção da aflatoxina e outras micotoxinas é a cromatografia,
que detecta a toxina mas não o fungo, não sendo recomendada no monitoramento da cadeia
produtiva.
A Reação da Polimerase em Cadeia (PCR) potencialmente é uma poderosa
ferramenta no combate a aflatoxina podendo ser utilizada no monitoramento de toda cadeia
produtiva. É uma técnica rápida e versátil, para detecção, o organismo a priori não necessita
ser cultivado, é sensível, sendo capaz de detectar moléculas de DNA alvo em uma mistura
complexa sem uso de sondas radioativas. E comparada às análises por cromatografia, é uma
técnica relativamente barata.
Nenos de 50% dos isolados de Aspergillus flavus são de fato produtores de
aflatoxinas, razão da busca de um sistema PCR multiplex baseado na investigação de
variabilidades em regiões do rDNA (ITS e IGS do rRNA nuclear e no mtDNA SSU rRNA),
gene da β-tubulina, marcadores RAPD e genes da via biossintética de A. flavus objetivando
Da amplificação com os primers universais ITS5 e ITS4 (48 isolados de A. flavus
originários de castanha–do-brasil e castanha de caju - Anacardium occidentale L.),
sequenciamento dos fragmentos e análise das seqüências da região ITS do rDNA, obteve-se
um par de primers provalvemente específico para A. flavus (ASPITSF e ASPITSR). Foram
também desenhados 10 possíveis tipos diferentes de primers degenerados para genes da via
biossintética da aflatoxina totalizando 26 pares de primers.
A investigação de variabilidade utilizando-se marcadores RAPD (11 primers), 140
fragmentos de DNA, gerou um fenograma que dividiu os 48 isolados em 5 grupos distintos
conforme hospedeira e região geográfica de origem.
Mais investigações serão realizadas até a obtenção da PCR multiplex específica
para A. flavus produtor de aflatoxina em castanha-do-brasil e castanha-de-caju.
Abstract
Aflatoxins represent a group of similar heterocyclic and highly oxygenated
substances, which are toxic to man and animals. Products of secondary metabolism in the
filamentous fungi Aspergillus flavus, A. parasiticus, A. pseudotamarii and A. nomius, the
species A. flavus and A. parasiticus are of greatest economic importance. The most important
aflatoxins are grouped as B1, B2, G1 and G2, with letters refering to emitted colour (blue or
green) under UV light (365nm), and numbers referring to degree of toxicity. As aflatoxins are
carcinogenic, imunosupressive, teratogenic and genotoxic, they are cause for concern
worldwide, especially in tropical countries, as well as temperate regions with warm, humid
summers.
Brazil nut (Bertholletia excelsa H. B. K.) is the first extractivist product of
importance for communities living in the Amazon region, and is a product principally
destined for the export market, with, for example, 20000 tons of the 28467 tons produced in
2001 destined for Europe and the USA. Recently, however, exports have suffered serious
restrictions, as a result of contamination of nuts with aflatoxins, with detected levels
exceeding accepted levels in both markets.
The official methods for detection of aflatoxins and other mycotoxins are based on
chromatography, which can detect the toxin but not the mycotoxigenic fungus. Monitoring the
productive chain is not currenly required, as such detection methods for toxins are relatively
expensive. In order to resolve this problem, an additional method is required for detection of
not only the aflatoxin, but also the aflatoxigenic fungus, applicable for monitoring the entire
productive chain.
Genetic variability was assessed in 48 isolates of potentially aflatoxigenic and
non-aflatoxigenic isolates of A. flavus from B. excelsa and cashew nut (Anacardium
occidentale L.) from different geographic regions in Brazil, with phenetic analysis of 140 DNA fragments generated with 11 RAPD primers separating isolates according to host of
origin, and isolates from A. occidentale also according to geographic origin. A number of
candidate PCR products for the design of primers specific to A. flavus were amplified (nuclear
rDNA ITS regions, mtDNA SSU rRNA gene, and β-tubulin gene), and sequence analysis of
the amplified rDNA ITS regions, together with Genbank-derived sequences for the rDNA ITS
regions for other Aspergillus species and other fungal genera associated with B. excelsa and
aflatoxin biosynthetic pathway were also designed based upon conserved protein sequence
motifs in A. flavus, A. parasiticus and A. nomius.
Further research is planned for testing and adapting the designed primers in the
form of a multiplex PCR system, for molecular detection of aflatoxigenic isolates of A. flavus
1. Introdução
1.1. Micotoxinas
As micotoxinas são substâncias químicas produzidas por fungos filamentosos em
seus hospedeiros e podem causar doenças e até morte em animais, inclusive o homem, ao
consumirem alimentos que as contêm em quantidades acima dos níveis tolerados pelo
organismo. São produtos do metabolismo secundário, pertencentes a diferentes classes
químicas, principalmente policetídeos, isoprenos e aminoácidos (Martin, 1992). São
substâncias estáveis, passíveis de transferirem para a cadeia alimentar, podendo aparecer nos
alimentos que foram contaminados, mesmo após o seu processamento. Um exemplo prático
do processo de transferência para a cadeia alimentar é a ingestão de rações contendo
micotoxinas, o que provoca contaminação dos produtos desses animais, tais como carne, leite
e ovos (Rodricks & Stoloff, 1987).
Doenças crônicas de ocorrência em animais, inclusive no homem, talvez tenham
origem na ingestão de alimentos contaminados com micotoxinas dos quais desconhece-se o
efeito ou o metabólito, sabe-se entretanto que intoxicações por micotoxinas são bastante
complexas, uma vez que os efeitos observados não são normalmente únicos para uma dada
micotoxina.
Vale ressaltar que nem todos os fungos produzem efeito maléfico e que a presença
de um fungo produtor de micotoxina não significa que o alimento esteja contaminado, pois as
condições nas quais o fungo produz suas micotoxinas são muito específicas. Cole & Cox
(1981), listaram cerca de 300 metabólitos de fungos como micotoxinas. Porém, de todas as
micotoxinas relatadas, somente algo em torno de 20, produzidas por diferentes espécies
fúngicas, são relevantes para a saúde humana, como evidenciam os exemplos citados na
Tabela 1.
A nova dimensão para esses compostos tóxicos aconteceu no momento da
globalização dos mercados, acrescentando uma importância a mais para as micotoxinas, não
somente como substâncias tóxicas que de fato são, mas também como impedimento para o
livre mercado entre os países (barreira técnica).
1.1.1. Impacto histórico
O mais antigo caso de micotoxicose humana é o ergotismo, causado pelo fungo
(Barger, 1931; van Rensburg & Altenkirk, 1974). O ergotismo resulta do consumo de grãos
contendo esclerócios do fungo, cujo tecido possui em sua constituição alcalóides tóxicos. É,
portanto um dos raros casos cuja toxina não é proveniente do metabolismo secundário do
fungo.
O estudo das micotoxinas iniciou-se na Inglaterra, em 1960, quando cerca de
100.000 perus e um menor número de outras aves domésticas morreram em curto espaço de
tempo, após consumirem ração que possuía em sua constituição torta de amendoim importada
do Brasil. A confirmação do fato ocorreu quando, utilizando-se clorofórmio como solvente,
extraiu-se da torta uma substância, que foi administrada na ração dos perus jovens. Eles
morreram logo após a ingestão e reproduziram os sinais externos e os sintomas internos das
lesões hepáticas anteriormente observados (Allcroft & Carnagham, 1962).
Em 1974, surgiram na Índia 400 casos de hepatite dos quais 100 pessoas
morreram. Na época, suspeitou-se que a causa principal foi a contaminação por aflatoxina
(Krishnamachari et al., 1975). A rota foi traçada devido à alta contaminação do milho por
Aspergillus flavus, que continha acima de 15 mg/kg de aflatoxina. O consumo da toxina por alguns dos adultos afetados foi calculado ser de 2-6 mg por dia, por um período de um mês.
Dessa maneira, concluiu-se que a dose letal provável para humanos adultos seria da ordem de
10 mg (http://www.fao.org/inpho/vlibrary/x0036e/X0036E08.htm).
1.1.2. Toxicidade
A ingestão de micotoxina pode levar, a quadros de intoxicação aguda ou crônica,
aos quais dá-se o nome de micotoxicose (Sharma e Salumkhe, 1991). São também relevantes
a inalação e exposição dérmica, principalmente durante as fases de colheita e trilha das
culturas, além de outras fases do manuseio. No entanto, epidemias causadas por micotoxinas
são raras.
Devido às diferenças nas estruturas moleculares das micotoxinas, seus efeitos
sobre a saúde humana e dos animais variam de teratogênico, imunossupressivo, tremogênico,
nefratóxico, hepatóxico e carcinogênico (Bullerman, 1979, Tabela 2).
Fungos, principalmente dos gêneros Aspergillus, Penicillium e Fusarium (Tabela
1) são abundantes na natureza, contaminando alimentos frescos, secos e alimentos
processados. As micotoxinas são estáveis, permanecendo no substrato mesmo após a
destruição do fungo.
Vários fatores influenciam a contaminação por micotoxinas durante a fase de
substrato e o próprio substrato em si, concentração do inóculo, interações microbianas, danos
mecânicos e infestações por insetos (Ominski et al., 1994).
A contaminação dos alimentos pode ocorrer no campo, na colheita, no transporte,
no armazenamento e/ou na manufatura dos produtos (Smith & Henderson, 1991).
Micotoxinas causam, portanto, danos à saúde dos animais de uma maneira geral (Tabela 2),
danos econômicos como morte de animais e perda de peso, recusa do produto no mercado
externo, com quebras contratuais e suas implicações, gastos na remoção da toxina para
recuperar o produto rejeitado, comprometimento da saúde humana e suas implicações. Enfim,
cresce no mundo a preocupação com a saúde alimentar, refletida pela implantação, por muitos
países, de normas para o alcance deste objetivo.
A presença da maioria das micotoxinas pode ser prevenida ou reduzida com o
processo de secagem eficiente logo após a colheita, reduzindo as chances de contaminação
por fungos. Para manter uma armazenagem em condições de segurança quanto à produção de
micotoxina, a atividade da água (aw) deve estar em torno de 0,7, pois poucos fungos crescem
quando a atividade da água encontra-se abaixo desse valor. A manutenção de alimentos com
aw abaixo desse número é uma técnica eficiente para prevenir danos provocados por fungos e
conseqüente produção de micotoxina. Por exemplo, A. flavus requer uma atividade de água
mínima entre 0,78 a 0,80 para o crescimento e 0,83 a 0,87 para a produção de toxina
(Bullerman et al., 1984).
A Organização das Nações Unidas para Agricultura e Alimentação (FAO)
(http://www.fao.org/inpho/vlibrary/x0012s/X0012S00.htm) diz que: considerações sobre
micotoxinas deveriam ser parte essencial de um programa integrado de gestão de produtos de
base, colocando em foco a manutenção da qualidade do produto do campo ao consumidor.
Nessa linha de raciocínio é que as técnicas para identificação e quantificação das toxinas têm
evoluído. Hoje, os métodos de identificação e quantificação são rápidos e precisos, altamente
seletivos e confiáveis e a cada dia tornam-se mais acessíveis com a incorporação de novas
pesquisas desenvolvidas em todo o mundo.
1.1.3. Estratégias de controle
Várias pesquisas seguem na direção de tentar encontrar uma solução cultural para
o problema das micotoxinas. Nessa linha, trabalhos buscando genes de resistência ou
indivíduos dentro da mesma espécie que competem com as espécies toxicogênicas eliminando
Campbell & White (1995) e Huang et al. (1997) encontraram evidências de resistência a
aflatoxina em milho, e Mixon (1986) e Waliyar et al. (1994) em amendoim. Nessas culturas,
observou-se em certas variedades, reduzido grau de contaminação por aflatoxinas.
Dentre as estratégias de destoxificação dos produtos alimentares temos a remoção
manual ou eletrônica de grãos cujas características são coerentes com uma maior
contaminação por micotoxinas, como os grãos descoloridos do amendoim. Para esse fim, são
utilizadas as mesas gravitacionais que separam grãos de menor densidade. O tratamento
térmico é outra técnica empregada na redução da toxina, contudo, as aflatoxinas são
degradadas pelo calor úmido apenas parcialmente.
O controle químico é outra técnica empregada na degradação de micotoxinas
principalmente em farelos e grãos, mas além do alto custo, não é confiável. O método utiliza
substâncias químicas como os solventes isopropanol, etanol e acetonas aquosas e a amônia
gasosa, utilizadas a temperaturas e pressões elevadas. Têm o inconveniente de alterar o sabor
da ração. Esses tratamentos são vistos como adequados somente para rações para uso animal,
e nunca para consumo humano, pelo menos, por enquanto.
Na técnica físico-química de adsorção empregam-se as argilas vulcânicas, naturais
ou sintéticas. Algumas dessas argilas são eficientes na adsorção e outras apresentam baixa
capacidade.
Finalmente o método de biocontrole promove a degradação biológica da toxina
como no caso da utilização da bactéria Flavobacterium aurantiacum, que remove aflatoxinas
do leite, milho, óleo de milho e creme de amendoim. Nessa linha, temos ainda a pulverização
das culturas com indivíduos não aflatoxicogênicos (A. flavus e A. parasiticus), que são mais
efetivos na biocompetição e ocupam o mesmo nicho ecológico dos aflatoxicogênicos,
impedindo-os de proliferar.
Tais procedimentos apenas reduzem os danos econômicos e colocam o produto
contaminado em um padrão toxicologicamente aceitável (Council for Agricultural Science
and Technology, 2003; http://www.mold-help.org/fungi.mycotoxins.currentresearch.htm;
Tabela 1: Agentes etiológicos, principais micotoxinas, substratos e regiões de ocorrência.
ORGANISMO
MICOTOXINA SUBSTRATO PAÍSES OBSERVAÇÃO
Aspergillus flavus, A. parasiticus, A.. pseudotamarii A. nomius
Aflatoxinas (B1, B2, G1 e G2)
Amendoim, milho, castanhas, amêndoas, semente de algodão, frutos frescos e secos, arroz parboilizado, leite e seus derivados.
Países da América Latina, África, Ásia, partes da Austrália e dos Estados Unidos
Ocorre preferencialmente nas épocas e locais de clima quente e úmido. Tem efeito hepatóxico, carcinôgeno, e reduz a produção e o crescimento dos animais. Fusarium moniliforme, F. proliferatum, F. anthophillum, F. globosum Gibberella moniliformes
Fumonisina Milho e seus derivados África, China Argentina, Brasil, França, Indonésia, Itália, Filipinas, Polônia, Tailândia, E. Unidos e Europa.
Milho oriundo de todas as partes do mundo. Ocorre tanto em climas
temperados como em tropicais.
Causa edema pulmonar em eqüinos e suínos e suspeita-se de provocar câncer de esôfago em humanos.
Fusarium graminearum, Fusarium culmorum, e Fusarium crookwellense Tricotecenos (Deoxinivalenol, nivalenol, Toxina T2).
Trigo, milho, aveia e cevada.
Continente asiático, europeu e em países como E. Unidos, China, Nova Zelândia, Japão, Canadá, Israel e Coréia.
Regiões frias e úmidas. Causa vômitos
prolongados em animais. Rações com 5% de contaminação é suficiente para provocar recusa das mesmas pelos animais. Fusarium
graminearum, F. culmorum, F. crookwellense.
Zearalenona Milho, sorgo, aveia, cevada e trigo.
Estados Unidos, Canadá e Continente Europeu.
Ocorre em regiões mais frias e úmidas.
Em porcos, afeta o sistema reprodutivo e em humanos há suspeitas de ser cancerígeno.
Aspergillus ochraceus, Penicillium
verrucosum Ocratoxina A
Cevada, trigo, alfafa, cana-de-açúcar, milho, amendoim, café, arroz, frutas secas e vinhos entre outros. Balkãs, Europa Central, Suécia, Dinamarca, Itália, Reino Unido, Canadá, Estados Unidos e parte da América do Sul.
Ocorre em regiões mais frias e úmidas, mas também em regiões tropicais.
Tem efeito nefratóxico e hepatóxico.
Tabela 2: Efeito das micotoxinas sobre os sistemas fisiológicos animais E F E I T O
TOXINA Imuno-lógico
Hemato-poético
Hepa-tóxico
Nefra-tóxico
Repro-dutivo
Terato-gênico
Neuro-tóxico
Carcino- gênico
Dermone-crótico
Aflatoxina
X X X X X X
Tricotecenos
X X X X X
Ocratoxina A
X X X X X
Fumonisina
X X X
Zearalenona
X X
Ergot alcalóide
X
Toxina T-2
X X
Sterigmatocistina
X X
Fonte: Council for Agricultural Science and Technology, 2003
1.1.4. Metabolismo
O metabolismo, para efeito de entendimento, está dividido em primário e
secundário. No primário têm-se os produtos da via metabólica envolvidos nos processos
essenciais da vida do fungo (Campbell, 1991), como por exemplo os ciclos do ácido cítrico,
etanol, aminoácidos. No secundário, os metabólitos têm uma distribuição mais restrita e é
freqüentemente específico para gênero, espécie ou raça (Campbell, 1991). Os composto
formados durante o metabolismo secundário não formam uma categoria química e não
necessariamente têm estrutura molecular comum, por isso, são usualmente classificados pela
via metabólica, pelos quais são produzidos. Micotoxinas e antibióticos, como a penicilina, são
produtos da via metabólica secundária de fungos. A maioria dos metabólitos secundários é
produzido após o fungo ter completado sua fase inicial de crescimento e estar iniciando a fase
reprodutiva, representada pela formação de esporos.
Ambas as vias estão sujeitas ao controle fisiológico geral que responde a fatores
ambientais. Fatores que influenciam o crescimento de fungos, tais como composição do
substrato, temperatura, atividade da água, pH, atmosfera, potencial redox e competição
microbiológica, também influenciam a produção de micotoxinas (Frisvad & Samson, 1991).
Porém, há muitas evidências que o metabolismo secundário tem menor prioridade que o
crescimento na hierarquia da regulação. Quando um meio de cultura é rico, com nutrientes
balanceados, microrganismos do tipo selvagem não realizam o metabolismo secundário ou
seu potencial é reduzido (Vining, 1990). Assim, em meio de cultura deficiente, onde o fungo
citar a indução da produção de aflatoxina por açúcar simples (Buchanan & Stahl, 1984) ao
invés de uma fonte de carbono mais complexa.
Em fungos, o metabolismo secundário está comumente associado ao processo de
esporulação (Calvo, et al., 2002). Esse tipo de metabolismo associado com esporulação pode
ser classificado em três categorias: 1. Metabolismo que ativa a esporulação; 2. Estruturas de
esporulação que requerem pigmentos e 3. Metabólitos tóxicos secretados por colônias em
crescimento quando se aproxima o momento da esporulação, por exemplo, a biossíntese de
alguns produtos deletérios naturais como as micotoxinas (Hicks et al., 2001; Trail et al.,
1995).
De todos os produtos naturais o que mais afeta a saúde dos animais são as
micotoxinas. A relação entre produção de micotoxinas e esporulação é documentada em
vários gêneros de fungos micotoxigênicos (Calvo et al., 2002). Por exemplo, em A.
parasiticus produtos químicos que inibem a esporulação, também inibem a produção de
aflatoxina (Reiβ, 1982). Pesquisas têm mostrado que isolados mutante de Aspergillus,
deficientes em esporulação são também ineficientes na produção de aflatoxina (Bennett &
Papa, 1988).
1.2. Aflatoxina
1.2.1. Organismos produtores e estrutura química
Aflatoxina é a denominação dada a um grupo de substâncias muito semelhantes,
heterocíclicas e altamente oxigenadas, tóxicas ao homem e animais como as demais
micotoxinas. São metabólitos secundários, produzidos por fungos do gênero Aspergillus,
especialmente por indivíduos das espécies A. flavus, A. parasiticus, A. pseudotamarii e A.
nomius (Ito et al., 2001)sendo que das espécies citadas, somente A. flavus e A. parasiticus são economicamente importantes (Council for agricultural science and technology, 2003).
Existem duas formas de aflatoxinas conforme sua fluorescência, B (blue) e G
(green) por apresentarem fluorescência azulada e esverdeada, respectivamente, quando
observadas sob luz ultravioleta em 365 nm. Isolados de A. flavus produzem somente
aflatoxinas do grupo B e menos de 50% dos mesmos são toxicogênicos, ao passo que isolados
de A. parasiticus produzem aflatoxinas do grupo B e G e são invariavelmente toxicogênicos (Klich & Pitt, 1988). Seus metabólitos são denominados B1 e B2, G1 e G2 conforme sua
toxicidade, sendo que a aflatoxina que tem em sua nomenclatura o número 1 (um) é sempre a
Figura 1: Estrutura química das aflatoxinas.
1.2.2. Ocorrência
A produção de aflatoxina é afetada pelo tipo e quantidade de carbono, nitrogênio e
traços de metais (Luchese & Harrigan, 1993). Meio de cultura com açúcares simples como
meios com fontes mais complexas de carbono como amido e peptona (Buchanan & Stahl,
1984; YU et al., 2000). A adição de radicais livres gerados no meio de cultura resulta em
incremento da produção de aflatoxina produzida por A. flavus, sugerindo que a aflatoxina
protege o fungo contra os radicais livres associados com lipoperóxidos (Fabbri et al., 1983).
A. flavus e A. parasiticus têm particular afinidade por castanhas, como castanha-do-brasil e sementes oleaginosas. Amendoim, milho e semente de algodão são os três mais
importantes substratos além do trigo, girassol, sorgo e pimenta preta. Geralmente as
contaminações são primariamente em função de trilhagens e secagens inadequadas e/ou
armazenagens impróprias, embora os fungos possam também infectar as culturas ainda no
campo. Técnicas culturais adequadas evita a ocorrência dos fungos antes da colheita. Em
amendoim, a colonização ocorre como resultado de chuvas irregulares e fatores relacionados
(Cole et al., 1985). Plantas submetidas a qualquer tipo de estresse são mais suscetíveis à
ocorrência dos fungos em questão.
Vargas et al. (2001), investigando a ocorrência de aflatoxinas em milho colhido
em 1997-98, procedentes das diferentes regiões brasileiras, analisaram 214 (duzentos e
quatorze) amostras e constataram que 82 delas estavam contaminadas com aflatoxina, todas
com aflatoxina B1, com concentrações que variaram de 0,2 a 129 µg/kg. A aflatoxina B2
esteve presente em 20% das 82 amostras, com concentrações que variaram de 0,2 a 32 µg/kg e
G1 em apenas 5,1% das amostras contaminadas com concentração variando de 0,2 a 12
µg/kg. A análise também foi realizada para a presença das toxinas zearalenona e fumonisina e
constataram que 100% das amostras contaminadas com B1 também estavam contaminadas
com fumonisina B1 e 65% também contaminadas com zearalenona. Os dados mostram a
necessidade de maiores investigações na área de micotoxinas, buscando detectar se nesse caso
não ocorre um efeito sinergético entre essas toxinas, resultando em um tóxico muito mais
potente que as mesmas individualmente.
No perídodo de 1998 a 2003, o Laboratório de Controle de Qualidade e Segurança
Alimentar LACQSA do Laboratório Vegetal (LAV) do Ministério da Agricultura, Pecuária e
Abastecimento - MAPA, realizou análise para detecção de aflatoxinas em 491 amostras de
castanha-do-brasil, das quais 236 (48,10%) estavam contaminadas com teores que variaram
de 0,30 a 5000 µg/kg. No mesmo período, foram analisadas 134 amostras de amendoim,
constatando contaminação em 88 (65,70%), com teores de 0,30 a 1460 µg/kg. Altas
contaminações foram encontradas em milho e, em menor proporção, em feijão.
Saúde (DIRXXII), no comércio varejista de São José do Rio Preto/SP. De um total de 77
amostras de amendoim cru analisadas, 24 ou 13,5% apresentaram teor de contaminação por
B1+G1 acima de 30 µg/kg e 02 amostras com valor menor ou igual a 30 µg/kg e 16 amostras
com menos de 5 µg/kg. De um modo geral, das 178 amostras analisadas, 39,3% estavam
contaminadas com aflatoxinas, mostrando a grande necessidade de ações efetivas de controle
para os produtos sucetíveis a este tóxico natural. Oliveira et al. (2002), também investigaram
a ocorrência de aflatoxina em amendoim e seus derivados, além de outros produtos e outras
micotoxinas, em cidades do Estado de Minas Gerais, no período de 1998 a 2000. Das 120
amostras de amendoim e seus derivados investigados, 56 apresentaram níveis de aflatoxinas
totais acima do nível estabelecido pelo MAPA. A faixa de contaminação para aflatoxina total
encontrada foi de 3 a 2714 µg/kg.
Dos resultados observados, pode-se concluir que a população brasileira corre
sérios riscos de contrair câncer de fígado, ou ainda, de consumir alimentos cuja dosagem de
aflatoxina seja letal.
1.2.3. Toxicidade
As aflatoxinas são carcinogênicas, sendo que a B1 é a mais tóxica e carcinogênica
de todas as micotoxinas (Van Rensburg, 1977; Flaherty & Payne, 1997).
O gene p53, denominado o “guardião do genoma” é o mais importante quando se
refere ao processo de carcinogênese (Fett-Conte & Salles, 2002), sendo ativado em resposta a
danos celulares. Mutações nesse gene podem exercer um efeito negativo dominante, com o
alelo mutado interagindo e inativando o alelo normal, passando a atuar como um oncogênese,
que são os aceleradores da proliferação celular (Levine, 1997). É o que normalmente acontece
com a aflatoxina B1 após ser ingerida. No fígado a aflatoxina sofre alteração promovida pelo
citocromo P450 e interagindo com o DNA transforma na forma mais reativa, aflatoxina
N7-guanina. A substituição da base nitrogenada guanina por timina, no códon 249, substitui uma
arginina por uma serina no produto protéico. Esse códon faz parte do gene supressor de tumor
p53, que restringe o crescimento de células evitando que se tornem maligna, com a alteração
provocada pela aflatoxina sua atividade fica prejudicada. Com essa substituição (mutação do
tipo transversão), o gene supressor que inibe o oncogênese, passa a atuar como acelerador da
proliferação celular e da tumorogênese, iniciando assim, as lesões hepáticas
Figura 2: Esquema de genes no cromossomo e parte da seqüência de Bases nitrogenadas indicando o códon do gene supressor de tumor (gene p53) onde ocorre a alteração da base.
245 246 247 248 249 250 251
GCC ATG AAG CGC AGG CCC ATC
aflatoxina ATG
http://www.ciencianews.com.br/biologiadocancer.htm.
O consumo de rações contendo qualquer componente com aflatoxina, dependendo
da concentração da mesma, pode causar a morte de animais ou diminuir seu desempenho,
provocar câncer de fígado em várias espécies, reduzir a produção de leite, ovos e ainda
transmiti-la, ainda que parcialmente (até 3% da quantidade ingerida de aflatoxina), a carne,
ovos, leite, e seus subprodutos, podendo ser fator de risco principalmente para as crianças
(menor peso).
Acredita-se que a mutagenicidade da aflatoxina B1 para os animais, inclusive o
homem, envolve a ativação oxidativa por um citocromo P450 no fígado e no rim (Fakhoury &
Woloshuk, 1999), onde é convertida para metabólitos como aflatoxicol, aflatoxina Q1,
aflatoxina P1, aflatoxina M1 e aflatoxi 8,9 epoxi. A quantidade desses metabólitos decide a
suscetibilidade da espécie e como esses podem induzir mutações por intercalação no DNA
(Bommakanti & Walyar, 2000). A aflatoxina B1 inibe a síntese do DNA (Meneghini &
1984). A redução da síntese protéica afeta a formação de proteínas estruturais, transportadoras
e de coagulação. Ocorre também, perda de enzimas necessárias ao anabolismo protéico,
formação incorreta de anticorpos, diminuição da digestão de lipídios e, eventualmente,
necrose celular devido a decréscimo na função metabólica.
Como visto anteriormente, a toxicidade pode ser aguda ou crônica. Na toxicidade
aguda as aflatoxinas invadem o fígado onde promovem a infiltração de lipídios nas células
hepáticas, implicando em necroses ou morte de células do fígado. Metabólitos de aflatoxinas
reagem de uma maneira deletéria com diferentes proteínas celulares, inibindo o metabolismo
de lipídios e carboidratos e a síntese de proteínas. Ao mesmo tempo que reduzem as funções
do fígado promovem desordem no mecanismo de coagulação do sangue. Provoca ainda,
edema nas extremidades inferiores, dores abdominais e vômito. Os efeitos crônicos da
ingestão da aflatoxina no organismo animal, quando exposto por longos períodos à dosagens
de concentrações médias a baixas vão desde hemorragia, cirrose e necrose do fígado, rins
hemorrágicos e congestionados até o câncer do fígado ou hepatite. Causa redução na taxa de
crescimento, na produção de ovos e leite e imunosupressão. As células T reagem com a
aflatoxina diminuindo a atividade da vitamina K. O efeito da aflatoxina é mais danoso em
animais estressados, subnutridos e em estados de convalescença.
1.3. Castanha-do-brasil (castanha-do-pará), castanha de caju e legislação
A castanha-do-brasil pertence à família Lecythidaceae, gênero Bertholletia e
espécie Bertholletia excelsa H.B.K., árvore de 30 a 50 m de altura, tronco retilíneo de
100-180 cm de diâmetro, folhas simples, glabras de 25-35 cm de comprimento. Seu fruto (ouriço)
pesa de 500 a 1.500 gramas e contém de 15-24 sementes (castanhas). O período da safra
ocorre entre dezembro a junho (Figura 3).
Ocorrem em estado nativo em toda região amazônica, estando suas maiores
concentrações no planalto que separa a bacia formada pelos afluentes do Baixo Amazonas,
Alto Tocantins e Alto Moju e em terras altas ao norte do Rio Jarí, no Estado do Pará e nos
Estados do Amazonas, Acre, até o Alto Beni na Bolívia. Os Estados do Amazonas, Pará, Acre
e Rondônia são os principais estados produtores brasileiros.
Figura 3: Bertholletia excelsa H.B.K. (Família Lecythidaceae)
Fonte: Clube da semente do Brasil (http://clubedassementes.org.br/castanha.html)
A castanha-do-brasil é o primeiro produto extrativista em importância para as
comunidades que vivem na Amazônia Ocidental, onde só no Estado do Acre cerca de 6.000
famílias vivem do extrativismo da castanha-do-brasil. Por ser um produto do extrativismo, as
práticas de manejo da espécie são precárias, com os ouriços sendo abertos na floresta, o que
permite a contaminação do produto por fungos e coliformes. Ainda no local da coleta, as
castanhas boas são separadas das chochas por imersão em água (geralmente de um igarapé),
aumentando a contaminação. Os problemas agravam-se com os manejos subsequentes. A
escassez de melhoria tecnológica tem provocado a estagnação ou a involução de setores
agrícolas e extrativistas. É urgente a necessidade de melhoria do manejo, coleta,
beneficiamento, empacotamento e armazenamento da espécie, ressaltando que a manutenção
qualidade, principalmente por tratar-se de um produto de exportação. O Brasil corre o risco de
perder mercado para os produtos de origem boliviana e peruana, produtos nos quais, entidades
norte americanas e européias vêm investido em tecnologias nos setores extrativistas e de
processamento desses países. A produção oriunda do extrativismo de castanha-do-brasil no
ano de 2001 foram de 28.467 toneladas (PEVS/2001-Brasil – IBGE), sendo que desse total,
20.000 toneladas tiveram como destino a Europa e Estados Unidos.
No Estado do Amapá, por intermédio do Projeto Castanha-do-brasil, o governo
estadual do Amapá em conjunto com a sociedade civil, está criando um novo paradigma para
os extrativistas de castanha da região. Com a oferta de infra-estrutura o castanheiro agrega
valor a seu produto e rompe o ciclo de dependência em relação ao atravessador. Com a
inserção do projeto no Programa de Desenvolvimento Sustentável do Estado do Amapá
(PDSA), os castanheiros começaram a se organizar como comunidades e agentes de mercado
(Nélson & Fujiwara, 2002).
O funcionamento do projeto tem por base o trabalho associativista onde o
castanheiro vende seu produto para uma cooperativa, que verticaliza a produção da castanha e
de seus subprodutos. Cada cooperativa se especializou em uma fase da cadeia produtiva de
forma que suas atividades são complementares entre si. Duas delas em regiões distintas,
trabalham com a retirada da castanha do fruto, desidrata o produto, seleciona conforme o
tamanho da semente e embala para a exportação e com as castanhas menores produz a
farinha. Como os frutos não são abertos na floresta, reduz-se o problema da contaminação. A
outra cooperativa produz biscoitos e extrai óleo. Portanto, ao invés de vender a castanha in
natura (ainda dentro da casca), as cooperativas vendem-nas prontas para o consumo (desidratadas e embaladas para exportação, além de diversos derivados, como biscoitos,
farinha, paçoca e óleo, com o qual se produz uma vasta gama de cosméticos (Nélson &
Fujiwara, 2002).
Estudos realizados pela Embrapa, em parceria com a Secretaria Executiva de
Extrativismo e Florestal do Estado do Acre – SEFE; Comissão Pastoral da Terra – CPT;
Conselho Nacional dos Seringueiros – CNS; Universidade Federal do Acre – UFAC;
Fundação de Tecnologia do Acre – FUNTAC; e Grupo de Pesquisa Agroflorestal do Acre –
PESACRE, apontam como um dos principais problemas de ordem tecnológica ao manejo da
castanha-do-brasil o desconhecimento dos pontos críticos de contaminação por aflatoxinas
durante a fase de manejo florestal. Desse modo, o setor produtivo da castanha sofre restrições
por parte de autoridades sanitárias da União Européia (UE) e Estados Unidos em decorrência
fornecimento do produto para o mercado internacional, problema este já citado (Freire et al, 2000), quando detectou-se aflatoxina em castanha-do-brasil. O conhecimento dos pontos
críticos de contaminação possibilitará o estabelecimento do diferencial do produto frente aos
seus concorrentes, uma vez que a aflatoxina também constitui num sério problema para outros
tipos de produtos. Uma tecnologia segura para o controle da aflatoxina estabelecerá um forte
diferencial para o Brasil no mercado internacional de castanhas.
O MAPA vai implantar um laboratório na Embrapa Acre, para análise de
micotoxinas visando principalmente o controle da aflatoxina na castanha-do-brasil o qual fará
parte do Programa Nacional de Controle de micotoxinas em produtos e subprodutos de
origem vegetal.
O cajueiro pertence à família Anacardiaceae, gênero Anacardium, espécie
Anacardium occidentale L. O fruto do cajueiro (castanha) é um aquênio reniforme, constituído pelo pericarpo que é formado pelo epicarpo, mesocarpo (que contém o líquido da
casca da castanha - LCC, resina líquida, cáustica) e o endocarpo (amêndoa) comestível, de cor
branca quando crua. A parte carnosa é o pedúnculo floral, chamado hipocarpo ou pseudofruto,
rico em suco e tem formato variado (cilíndrico, piriforme, alongado, etc.).
O cajueiro é planta originária do Brasil (Figura 4), sendo o nordeste brasileiro o
centro de origem e disseminação do cajueiro comum e a Amazônia do cajueiro precoce. A
planta está difundida pela América do Sul, América Central, África e Ásia, sendo que os
principais produtores mundiais de castanha de caju são: Índia, Brasil, Moçambique, Tanzânia
e Quênia. No Brasil, os principais produtores são os estados do Ceará com 110.123
toneladas/ano, Rio Grande do Norte com 30.173 toneladas/ano e o Piauí com 24.986
toneladas/ano (IBGE - LSPA-nov./2002). Levando-se em conta a área plantada o Piauí
ocuparia o 2º lugar. No país, a área ocupada com a cultura gira em torno de 700.000 hectares,
sendo que destes, mais de 95% no nordeste brasileiro. Ainda segundo o IBGE, Pesquisa da
Extração Vegetal e da Silvicultura – PEVS/2001 – Brasil, a produção brasileira de castanha
oriunda do extrativismo no ano de 2001 foi de 6.266 toneladas. Segundo Pessoa et al. (1995),
a cultura do cajueiro desempenha grande importância sócio-econômica para o nordeste, e gera
recursos da ordem de 200 milhões de dólares, oferecendo aproximadamente 100.000
empregos.
Figura 4: Anacardium occidentale L. (Família Anacardiaceae)
Fonte: Clube da semente do Brasil (http://clubedassementes.org.br/cajueiro.html)
A castanha de caju é um produto tipicamente de exportação, com a maior parte da
produção destinada ao mercado internacional, especialmente Estados Unidos e União
Européia. São comercializadas no mercado interno apenas as castanhas que, por qualquer
razão, não foram aceitas no mercado externo.
Estudos conduzidos pela Embrapa Agroindústria Tropical (CNPAT) nos últimos
anos confirmaram a presença de diversos fungos, incluindo A. flavus, associados à
deterioração das amêndoas. Aproximadamente 10% das castanhas que aportam nas indústrias
de processamento não possuem amêndoas, por terem sido destruídas por fungos.
As normas regulamentares, determinando o limite permitido para o total de
aflatoxina presente nos alimentos, variam segundo o mercado, entre um nível máximo de 20
ppb (partes por bilhão) ou 20 µg/kg (micrograma/quilo) nos Estados Unidos e Austrália, para
todos os alimentos, e o nível de 4 ppb para o total das aflatoxinas, sendo 2 ppb para a
aflatoxina B1, imposto pela União Européia ao amendoim, nozes em geral e frutas secas para
consumo direto ou como ingrediente. Além do mais, Romênia, Honduras, Japão e Polônia
exigem para todos os alimentos zero ppb de aflatoxina do grupo B1. Com relação a presença
da micotoxina M1 no leite e seus derivados, as legislações dos vários países impõem um
limite variável de zero ppb (como Romênia) a 0,5 ppb (na República Tcheca). Os
com relação às aflatoxinas. Os exportadores reclamam da urgente necessidade de
harmonização internacional das medidas aplicáveis as micotoxinas
http://www.forumdecomercio.org/news/fullstory.php/aid/96/El-cacahuete-sano-;-control-de-las-aflatoxinas.html.
O Brasil possui legislação apenas para regular aflatoxina, sendo que o limite
máximo permitido em alimentos regulamentados pelo Ministério da Saúde, resolução RCD nº
274 da Anvisa, de 15 de outubro de 2002 (Diário Oficial da União de 16/10/2002), estabelece
em 20 ppb à presença de aflatoxina B1, B2, G1 e G2 para o amendoim, milho e subprodutos
de ambos. E para o leite fluido o total de aflatoxina M1 não deverá ultrapassar 0,5 ppb e para
o leite em pó 5 ppb, trabalhando assim, de maneira uniforme com o Ministério da Agricultura
(resolução 183 de 21/03/96, publicada no Diário Oficial da União de 25 de março de 1996,
seção I, página 4929), que por meio dessa resolução internalizou as normas do Mercosul
(GMC/RES. Nº 56/94). O Ministério da Agricultura já havia estabelecido na Resolução SGT
– 3 nº 56/94, internalizada pela portaria MA nº 183, 21/03/96 (Diário Oficial da União,
suplemento 43, 1996) os mesmos teores da Anvisa para o leite fluido e em pó. Ele estabeleceu
ainda, que para qualquer matéria prima a ser utilizada direta ou indiretamente em rações
destinadas ao consumo animal, o limite máximo de aflatoxina é de 50 ppb (resolução nº 7 de
9/11/88, publicada no Diário Oficial da União de 09 de novembro de 1988 – Seção I, página
21.968), coerente com as normas da maioria dos demais países.
Devido a constantes devoluções de lotes de castanha-do-brasil com destino ao
mercado europeu, por não se enquadrarem nos níveis de sanidade exigida pelo mercado,
desde maio de 2002, o Ministério da Agricultura está discutindo com a União Européia (UE)
a possibilidade de harmonização de procedimentos para o controle das micotoxinas na
castanha-do-brasil. No período de 25 de janeiro a 9 de fevereiro de 2003, esteve no Brasil
uma missão formada por três membros da UE para conhecer e avaliar o sistema brasileiro de
controle de aflatoxina, a fim de impedir a contaminação da castanha destinada àquele
mercado. A inspeção detectou falta de controle nos processos de coleta, seleção, manipulação,
tratamento, embalagem e transporte e revelou ainda que são inadequadas, a amostragem
oficial e os cuidados no envio das amostras para o laboratório; alguns laboratórios
credenciados para detecção de micotoxinas não apresentam resultados confiáveis, e em alguns
certificados emitidos por laboratórios privados não se consegue fazer a ligação entre a
amostra, o certificado e o lote a qual ambos referem. Detectou-se ainda que o controle oficial
estabeleceu condições especiais para a importação de castanha-do-brasil com casca
originárias e procedentes do Brasil. As condições impõem que cada lote seja acompanhado de
um informe sobre a amostragem e análise oficial, além de certificado conforme acordo
firmado com a comunidade e emitido apenas pelo LACQSA, do Ministério da Agricultura,
Pecuária e Abastecimento, localizado em Belo Horizonte/MG, que é a autoridade competente
para tal fim.
O Plano Nacional de Monitoramento e Controle de Contaminantes e Resíduos
Químicos e Biológicos nos produtos de Origem Vegetal – PNMCRV, instituído pela
Instrução Normativa n° 3 de 10 de janeiro de 2001, ressalta que o não cumprimento da atual
legislação da União Européia sobre níveis de contaminantes e resíduos, implicará na total
perda desse mercado para alguns produtos tais como castanha-do-brasil, frutas e outros. O
PNMCRV está dividido em dois programas básicos: Programa Nacional de Monitoramento e
Controle de Contaminantes em Produtos de Origem Vegetal – PNMCV e Programa Nacional
de Monitoramento e Controle de Resíduos Químicos e Biológicos em Produtos de Origem
Vegetal – PNMRV. Nota-se a necessidade de pesquisas sérias, que possam corroborar com os
objetivos do PNMCV, estando a busca para identificação segura de agentes produtores de
aflatoxina em castanha-do-brasil, como um dos trabalhos mais coerente com os objetivos do
programa, uma vez que pode ser usado no rastreamento e monitoramento de toda cadeia
produtiva e como ferramenta rápida e de baixo custo na certificação de produtos de origem
vegetal.
É de suma importância a utilização de métodos seguros de detecção de micotoxina
para dar ao consumidor final a segurança de que os alimentos por eles consumidos são de boa
2. Métodos de detecção e quantificação de micotoxinas
Cromatografia em camada delgada (CCD) e cromatografia líquida de alta
eficiência (CLAE) são as técnicas analíticas oficiais adotadas pelo Brasil na análise das
micotoxinas tais como aflatoxina, ocratoxina A, zearalenona, tricotecenos e fumonisina B1,
realizada no âmbito do Programa Nacional de Controle de Micotoxinas em Produtos,
Subprodutos e Derivados de Origem Vegetal – PNCMV, estabelecidas pelo Ministério da
Agricultura, Pecuária e Abastecimento, regulamentada na Instrução Normativa SDA/MAPA
nº 09 de 24 de março de 2000, Diário Oficial da União (DO) nº 62.
Na América do Sul, as análises de micotoxinas são na maioria realizadas em
CCD, por ser um método simples, rápido e econômico. Poucos são os laboratórios que
possuem equipamentos de cromatografia líquida, que apesar de ser mais sensível, tem custo
final mais elevado. Esse tipo de cromatografia requer pessoal altamente especializado, além
de exigir custos maiores, dos equipamentos aos reagentes.
Os procedimentos analíticos visando a quantificação das micotoxinas consistem
em extração com solvente orgânico, purificação em florisil ou octadecil (C18), seguido de
separação, detecção e quantificação. No caso das aflatoxinas, a quantificação é feita
visualmente, observação da placa sob luz ultravioleta a 366 nm, comparando-se a intensidade
de fluorescência das manchas das amostras com as do padrão. Realiza-se ainda a análise
densiométrica a λ = 366 nm. (Secretaria de Defesa Agropecuária (SDA) - Instrução
Normativa nº 9, de 24 de março de 2000).
A utilização da cromatografia de imunoafinidade (IAC), em que as colunas
contêm anticorpos seletivos imobilizados, é um método rápido e eficiente, usado em
associação com a CCD ou CLAE. A IAC fundamenta-se na interação fraca que envolve
apenas ligações covalentes e eletrostáticas entre um anticorpo e um antígeno. O IAC não é
uma técnica quantitativa. Ela é sensível e seletiva e possibilita extrair e purificar com rigor as
amostras ou seus extratos, antes da sua quantificação pelo método físico-químico. Quando se
utiliza a IAC no processo de purificação consegue-se detectar micotoxinas na concentração de
até 0,1 µg/kg (Santos e Vargas, 2002).
O laboratório oficial para análise e certificação para as micotoxinas é o
LACQSA-LAV/MG. O mesmo é subordinado a Coordenação do Laboratório Vegetal – CLAV. A
Portaria n° 1 de 22 de janeiro de 1997, DO nº 17, estabelece normas para credenciamento de
ou privada, que por decisão da CLAV e do Departamento de Defesa e Inspeção Vegetal –
DDIV da SDA do MAPA, forem credenciados para realizar análises de micotoxinas em
produtos, subprodutos e derivados de origem vegetal, bem como emitir o respectivo laudo
e/ou certificado de análise (SDA – Instrução Normativa nº 24 de 07 de junho de 2001).
2.1. Métodos imunológicos
Dos métodos imunológicos utilizados na dosagem de aflatoxina, os mais comuns
são o ELISA, da Association of Official Analytical Chemist’s (AOAC) para triagem de
aflatoxina e o IAC. O método ELISA é baseado na competição de ligação entre toxina não
marcada, proveniente da amostra, e a marcada sobre os locais específicos do anticorpo. A IAC
é uma técnica cromatográfica baseada diretamente na ligação antígeno (toxina) com o
anticorpo fixado numa coluna (Fremy & Chu, 1989). Utilizando-se das técnicas imunológicas,
vários kits para detecção de micotoxinas foram desenvolvidos por laboratórios europeus e
norte-americanos. Os mesmos proporcionam análises com custos que variam de $5 - 10 por
teste, bastante elevado para utilização em partidas de grande volume de produto a ser
analisado. Souza et al. (1999) constataram a baixa especificidade desses kits para detecção e
quantificação de aflatoxina M1. Eles investigaram 110 amostras de leite do Estado de Minas
Gerais e verificaram que das 27 amostras positivas para aflatoxina M1 na triagem com kit
ELISA, apenas 5 foram confirmadas como contaminadas quando quantificada por CCD.
3. Métodos de detecção de fungos produtores de micotoxinas 3.1. Contagem de esporos
Aspergillus flavus é um fungo filamentoso, pertencente a Classe Ascomycetes,
Subclasse Eurotiomycetidae; Ordem Eurotiales, Família Trichocomaceae e Gênero
Aspergillus (IndexFungorum – The CABI Bioscience and CBS Database of Fungal Names).
A. flavus quando cultivado em meio de cultura Czapek ágar (CZ) por 7 dias à 25º C e no escuro, produz colônias de 4 a 4,5 cm de diâmetro, de cor verde amarelada que se torna verde
com a idade e quando se inverte a placa, verifica-se uma cor amarela creme e cabeça radiada
que se afouxa com a idade tornando-se colunar, conidióforo longo, verrucoso e hialino,
vesícula em forma de abóboda totalmente prolífera, esterigma pequeno e ampuliforme e
conídios globosos a sub-globosos, geralmente ásperos e verde-amarelados (Singh et al. 1991).
O grau de infestação por fungos e a identificação das espécies envolvidas é ainda
um importante parâmetro na indicação da qualidade do produto, assim como do potencial para