UNIVERSIDADE FEDERAL DO CEARÁ
CENTRO DE CIÊNCIAS AGRÁRIAS
DEPARTAMENTO DE ZOOTECNIA
PROGRAMA DE DOUTORADO INTEGRADO EM ZOOTECNIA
UFC/UFPB/UFRPE
JÔSY MARIA ARRUDA DE ALENCAR
ZootecnistaPROTEÔMICA DO PLASMA SEMINAL E EXPRESSÃO GÊNICA
E LOCALIZAÇÃO DA NGF E SEUS RECEPTORES (TRK1 E
NGFR) NO SISTEMA GENITAL DE COELHOS
JÔSY MARIA ARRUDA DE ALENCAR
PROTEÔMICA DO PLASMA SEMINAL E EXPRESSÃO GÊNICA
E LOCALIZAÇÃO DA NGF E SEUS RECEPTORES (TRK1 E
NGFR) NO SISTEMA GENITAL DE COELHOS
Tese apresentada à Coordenação do Programa de Doutorado Integrado em Zootecnia, como pré-requisito para obtenção do título de Doutor em Zootecnia Área de Concentração: Reprodução Animal.
Orientador: Prof. Dr. Arlindo de A. A. N. Moura. Co-orientador: Prof. Dr. Jorge André M. Martins.
Esta tese foi submetida como parte dos requisitos necessários à obtenção do Grau de Doutor em Zootecnia, outorgado pela Universidade Federal do Ceará, e encontra-se à disposição dos interessados na Biblioteca de Ciências e Tecnologia da referida Universidade.
A citação de qualquer trecho desta tese é permitida, desde que seja feita em conformidade com as normas da ética científica.
__________________________________ Jôsy Maria Arruda de Alencar
Tese defendida e aprovada em __/__/____
BANCA EXAMINADORA
_________________________________________ Prof. Dr. Arlindo de Alencar Araripe N. Moura
ORIENTADOR
____________________________________________ Profa. Dra. Maria Gorete Flores Salles
CONSELHEIRA (UNILAB)
____________________________________________ Prof. Dr. Ainton Alencar de Araújo
CONSELHEIRO (UECE)
____________________________________________ Profa. Dra. Lúcia Daniel Machado da Silva
CONSELHEIRA (UECE)
____________________________________________ Prof. Dr. Ricardo Toniolli
Às minhas queridas tias Maria Alice (Licinha), Carmen (Cainha), Celina (Ina),Celene (Ceen), Claúdia (Lalá) e Coeli (Eli).
OFEREÇO
Aos meus pais Joathan e Célia (in memoriam) pelo amor e dedicação. Às minhas irmãs Josianne e Josilenne pelo apoio e carinho. Aos meus sobrinhos Sabrina, Yasmin, Leone Neto e Ian pela alegria e amor. À minha família pelo carinho e compreensão nos inúmeros momentos de ausência.
"
Guarda la luce e l'ombra ti cadrà alle spalle"AGRADECIMENTOS
Em primeiro lugar agradeço a Deus por ter sempre guiado meus passos e pelas inúmeras vezes em que me carregou no colo. No caminho apareceram muitas adversidades, mas Deus sempre colocou as pessoas certas e outras vezes, as retirou de minha vida no momento certo.
Agradeço também a Deus por ter me dado uma família tão amorosa, sempre presente nas horas mais importantes e unida nesse momento tão delicado para todos nós. Aos meus tios, tias e primos, o meu muito obrigado. Agradeço pelo apoio, carinho, união, cuidado e principalmente o amor de todos vocês. Esses 3 últimos meses foram muito difíceis e o carinho de vocês foi essencial para o nosso fortalecimento durante o período em que minha mãe esteve doente e depois da sua partida. É o amor que nos une que nos faz tão fortes.
Agradeço aos meus pais, Joathan e Célia (in memoriam), e às minhas irmãs Josianne (Jô) e Josilenne (Lenne) pelo amor, apoio e principalmente pela compreensão nos momentos de ausência. Nesse último período marcado por incertezas e dor, agradeço a Deus por ter nos mantido unidos, e era isso que mamãe mais presava. Ela permanece conosco e pode ser vista em cada olhar e sorriso de cada um de nós. Sem o apoio de vocês não teria sido possível chegar ao final dessa caminhada, que nunca imaginei que pudesse se tornar tão pesada.
Aos meus sobrinhos Sabrina, Yasmin, Leone Neto e Ian pelo amor incondicional. Vocês enchem minha vida de alegria e a fazem mais colorida.
À minha avó, Mamãezinha (Estela Bacelar - in memoriam), que sempre foi a minha inspiração de persistência.
Às minhas queridas tias Alice (Licinha), Carmen (Cainha), Celina (Ina), Celene (Ceen), Claúdia (Lalá) e Coeli (Eli), que sempre foram mais do que tias e sim, verdadeiras mães, por todo incentivo, apoio e amor incondicional. Agradeço a cada uma de vocês que à sua maneira contribui para minha formação pessoal e profissional. Amo todas vocês!
À minha querida Professora Elizimar Guerreiro (Zizi) que tem me acompanhado desde a graduação, agradeço por ter sempre acreditado no meu potencial, apoiando-me e incentivando em todas as etapas da minha vida acadêmica. Agradeço também pela sua amizade, carinho e por ser sempre presente na minha vida.
Ao Setor de Cunicultura/DZ/UFC pela concessão dos animais.
Ao meu orientador Prof. Dr. Arlindo Moura pela orientação e ensinamentos transmitidos durante o curso de doutorado.
Ao Dr. Jorge Martins pela co-orientação, amizade, apoio e motivação em todas as etapas do experimento e principalmente nesses últimos meses tão difíceis.
Ao amigo Dr. Carlos Eduardo de Azevedo Souza acima de tudo pela amizade, companheirismo, apoio e conhecimentos transmitidos no início dessa caminhada.
À minha querida amiga Alethéia Lima por ser sempre presente em minha vida. Agradeço pela amizade, carinho, disponibilidade, apoio, motivação, ombro amigo e pelos inúmeros momentos de descontração.
À minha amiga Ana Lia Lima pela amizade, carinho e apoio, especialmente no período em que minha mãe esteve doente. Não tenho palavras para descrever o quanto foi importante a sua presença.
Lima pela participação ativa na execução do experimento. Sem a ajuda de vocês não seria possível a realização desse projeto.
Aos meus colegas do Programa de Pós-graduação em Zootecnia da Universidade Federal do Ceará pelos momentos vividos juntos.
À UNIFOR, aqui representada pelos professores Renato Moreria e Ana Cristina Moreira pelo apoio, atenção e pela disponibilização do espectrômetro de massas.
Ao Programa de Pós-graduação em Zootecnia/UFC pela realização do curso de Doutorado.
Ao CNPQ pela concessão da bolsa no início do curso de doutorado.
À CAPES pela concessão da bolsas de Doutorado Sanduíche e pela bolsa no meu retorno ao Brasil.
A Università degli Studi di Perugia (Itália) pela realização do Doutorado Sanduíche, em especial às faculdades de Agrária, Medicina Veterinária e Medicina, locais onde tive a oportunidade de estagiar, onde fiz várias amizades e que levarei todos comigo.
Agradecimentos Faculdade de Agrária:
Ao meu orientador no exterior Prof. Dr. Cesare Castellini por ter me recebido em seu laboratório na faculdade de Agrária.
Aos professores Mariano Pauselli, Francesca Sarti, Luciano Morbidini e Francesco Panella, aos funcionários do Dipartimento di Scienze Agrarie Alimentari e Ambientali (DSA3) Bruna Battistini, Francesca Ricci e Francesca Bricchi e aos funcionários do galpão de cunicultura Giovanni Migni e Osvaldo Mandoloni.
Ao Prof. Dr. Alessandro Dal Bosco pelo apoio e atenção.
Ao pesquisador Giampiero Marconi pelo apoio e conhecimento devido.
À minha caríssima amiga Dra. Raffaella Cardinali, sem o seu apoio, disponibilidade e amizade, não teria sido possível a realização desse projeto. Obrigada por ter me recebido não só na Universidade, mas também na sua família. Uma amizade que levarei sempre comigo.
Aos colegas de laboratório e doutorandos: Silvia di Ruggeri, Valentina Roscini, Melania Martino, Piera di Lorenzo, Simone Ceccobelli, Simona Matioli, Luca Piottoli, Alice Cartoni e Paolo Lattaioli.
À Falcudade de Medicina Veterinária:
Ao Prof. Dr. Cristiano Boiti pelo apoio e por ter me recebido tão bem em seu laboratório.
Ao Professor Dr. Gabriele Brecchia pela amizade, disponibilidade e atenção durante o período em que permaneci na Itália.
À doutoranda Laura Menchetti pela amizade e carinho.
À Dra. Magherita Maranesi pelo apoio e conhecimento dividido. A Faculdade de Medicina:
Agradeço ao Prof. Dr. Mário Rende pela oportunidade de ter estagiado em seu laboratório, apoio e principalmente pelos conhecimentos transmitidos.
Às pesquisadoras Dra. Anna Stabile e Dra. Alessandra Pistillo pela atenção e disponibilidade.
À Pos-doc Dra. Lucia Crispoltoni pela amizade e apoio na execução do experimento.
Aos amigos:
Às minhas irmãzinhas italianas Rita e Giovanna Ciarnielo, o meu agradecimento sincero por todos os momentos juntas e principalmente pela amizade. Obrigada por ter me recebido na família de vocês e ter feito com que a distância de casa não fosse tão pesada.
Aos caríssimos amigos Mara Lacerda e Pasquale D'Agostino pela amizade, carinho e atenção no período em que estive com vocês. Agradeço pela companhia e pelos inúmeros sorrisos.
Ao meu caríssimo Davide Milia pela atenção, apoio, carinho e amizade. Que mesmo estando longe, se fez presente nesses últimos meses tão delicados. Agradeço pelo carinho em que me acolheu em sua casa e em sua família, minimizando a minha saudade de casa no período em que estive na Itália. Obrigada pela companhia e o ombro amigo sempre disponível. A você, a minha estima e reconhecimento.
E por fim, gostaria de agradecer a todos os amigos que deixei na Itália, que infelizmente não tenho como citar todos, mas que os trago no meu coração, sem o carinho de vocês teria sido impossível realizar o sonho de estudar um ano no exterior.
SUMÁRIO
Página
1.Considerações iniciais...
27
CAPÍTULO 1 2. Revisão de literatura... 31
2.1. Anatomia reprodutiva do macho... 31
2.2. Fisiologia reprodutiva do macho cunícula... 34
2.3. Sêmen de coelho e suas características... 36
2.3.1. Coleta de sêmen... 36
2.3.2. Características físicas e químicas do sêmen... 37
2.3.3. Célula espermática... 38
2.3.4 Gel... 39
2.3. 5. Prostassomas... 40
2.4. Constituintes do Plasma Seminal (PS)... 42
2.4.1. As proteínas do PS e seus efeitos sobre o metabolismo espermático.. 44
3. Referências bibliográficas... 47
CAPÍTULO 2 a Zelândia Branca e suas Resumo... 58
Abstract... 60
4. Introdução... 62
5. Objetivos... 63
5.1.Geral... 63
5.2.Especifico... 63
6. Material e métodos... 64
6.2. Animais experimentais e coleta de sêmen... 64
6.3. Avaliação do sêmen e obtenção do plasma seminal... 64
6.4. Eletroforese bidimensional do plasma seminal... 68
6.5. Análise computadorizada das imagens... 69
6.6. Digestão dos spots protéicos dos geis bidimensionais... 70
6.7. Identificação das proteínas por espectometria de massa e busca em banco de dados. 70 6.8. Análise de ontologia gênica... 72
6.9. Análise estatística... 72
7. Resultados ... 74
7.1. Parâmetros seminais... 74
7.2. Proteínas no plasma seminal... 74
7.3. Ontologia gênica das proteínas no plasma seminal de coelhos... 78
7. 4. Associações entre as proteínas do PS e os parâmetros seminais.... 80
8. Discussão ... 84
9. Considerações finais... 101
10. Referências bibliográficas... 103
CAPÍTULO 3 Expressão gênica e localização da NGF e seus receptores cognatos NTRK1 e NGFR nas gônadas e glândulas sexuais de coelhos Resumo... 124
Abstract... 124
11. Introdução... 126
12. Objetivo... 128
13. Material e métodos... 129
13.4. Extração de RNA e RT-PCR . 131 13.5. Determinação e concentração da NGF nos plasmas seminal e
sanguineo
134
12.6. Análise Estatística 134
14. Resultados... 127
14.1. Imuno-histoquímica para NGF 135 14.2. Imuno-histoquímica para os receptores NTRK1 e NGFR . 137 14.3. Expressão gênica da NGF, NTRK1 e NGFR . 140 14.4. NGF nos plasma sanguineo e seminal 142 15. Discussão... 143
16. Considerações finais... 146
17. Referências bibliográfica... 147
LISTA DE TABELA
CAPÍTULO 1
Página Tabela 1 - Composição bioquímica do plasma seminal de Coelhos 38
CAPÍTULO 2
Tabela 1 - Média ± erro padrão dos parâmetros espermáticos vigor, motilidade, concentração, morfologia, vitalidade , integridade do acrossoma e teste de integridade de membrana espermática do sêmen de coelhos... 74 Tabela 2 Modelos de regressão multipla dos parâmetros seminais de coelhos em funcão da expressão das proteínas do plasma seminal... 81 Tabela 3 - Proteínas aceitas no modelo da tabela 2... 82 Tabela 4 - Proteínas do PS de coelhos da raça NZB identificadas por eleforese de proteínas bidimensional e espectrometria de massa... 153 Tabela 5 - Proteínas do PS de coelhos da raça NZB identificadas por eleforese de proteínas bidimensional e espectrometria de massa com a média da intensidade dos spots... 1
CAPÍTULO 3
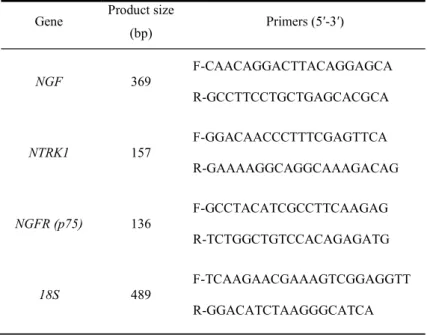
Tabela 1. Primers para NGF, NTRK, NGFR e 18S utilizada como controle
LISTA DE GRÁFICOS
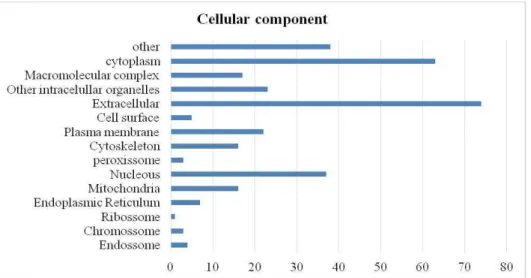
Página Gráfico 1 - Ontologia gênica processos biológicos... 78 Gráfico 2 - Ontologia gênica componentes celulares... 79 Gráfico 3 - Ontologia gênica função molecular... 79
LISTA DE FIGURAS
CAPÍTULO 1
Página Figura 1 - Aparelho reprodutor masculino de coelhos (Holtz e Foote, 1978)... 31 Figura 2 - Glândulas sexuais do coelho (Cardinalli, 2007)... 33 Figura 3 Separação das frações seminais (Castellini et al., 2005)... 41
CAPÍTULO 2
Página Figura 1 Morfologia espermática... 65 Figura 2 Tipos de espermatozoides encontrados no teste de funcionalidadeda membrana (Ducci et al., 2002)... 66 Figura 3 Tipos de células encontradas no teste de integridade da membrana acrossômica... 68 Figura 4 - Mapa bidimensional das proteínas do plasma seminal de coelhos da raça Nova Zelândia Branca. 1A gel referência (coelho 23), 1B, 1C e 1D: géis eu contribuíram para formação do gel máster... 76 Figura 5 Mapa representativo do plasma seminal de coelhos da raça Nova Zelândia Branca... 77
CAPÍTULO 3
de coelhos machos. Figura 1A: forte imunorreação localizada nas células glandular e stromal da glândula seminal. Figura 1B: Imunossinais positivos localizado nas células glandulares da prostate e em algumas células estromais. Figura 1C: Intensa imuno coloração evidenciada nos túbulos seminiferous
(ST) e células de Leyding. Escala 20
m 136
Figura. 2 Imuno-histoquímica da localização do NTRK1 nos órgãos reprodutivos de coelhos machos. Figura 2A: Imunossinal fortemente localizado nas células glandulares e estroma da glândula vesicular. Figura 2B: Forte imunorreatividade evidenciada nas células glandulares da prostate. Figura 2C: Intensa imunocoloração localizada nos túbulos seminais (ST) e
células de Leyding. Escala = 20 m 138
Figura 3. Imunohistoquímica da localização da NGFR nos órgão reprodutivos de coelhos machos. Figura 3A: Imunossinal fortemente localizado nas células glandulares e estromais da vesicular seminal. Figura 3B: Forte imunorreatividade evidenciada nas células glandulares da prostate e estromais. Figura 3C: Intensa imunocoloração intense localizada nos túbulos seminíferos (ST) e nas células de Leyding. Escalas = 20 m
139 Figura 4. Expressão do RNAm da NGF nos testículos e glândulas anexas de coelhos. A figura superior exibe os dados obtidos a partir da análise densitométricas dos géis. Diferentes letras acima das barras indicam valores significativamente diferentes (p < 0,01).Na figura inferior é possível observar a imagem do gel de agarose (2 %) corado com brometo de etídio reprsentativo utilizados para analisar os produtos da PCR. Legenda: T = Testículos, P =
Prostata, SV = Vesícula Seminal 140
densitométricas dos géis. Diferentes letras acima das barras indicam valores significativamente diferentes (p < 0,01). Na figura inferior é possível observar a imagem do gel de agarose (2 %) corado com brometo de etídio reprsentativo utilizados para analisar os produtos da PCR. Legenda: T = Testículos, P = Prostata, SV = Vesícula Seminal
141
Figura. 6 . Expressão do RNAm da NGFR nos testículos e glândulas anexas de coelhos. A figura superior exibe os dados obtidos a partir da análise densitométricas dos géis. Diferentes letras acima das barras indicam valores significativamente diferentes (p < 0,01).Na figura inferior é possível observar a imagem do gel de agarose (2 %) corado com brometo de etídio reprsentativo utilizados para analisar os produtos da PCR. Legenda: T = Testículos, P =
Prostata, SV = Vesícula
LISTA DE ABREVIATURAS
AMP Adenosina monofosfato
ANX Anexina
CEA Carcinoembryonic antigen
CEACAM10 Carcinoembryonic antigen-related cell adhesion molecule 10 CEACAM6 Carcinoembryonic antigen-related cell adhesion molecule 6-like
Céls. Células
CHAPS 3-[(3-Colamidopropil)-dimetilamônio]-propano-sulfonato CRISP- 2 Cysteine - rich secretory protein 2
CRISP-1 Cysteine - rich secretory protein 1
DDAHN (G), N (G) - dimethylarginine dimethylaminohydrolase 1
DTT Ditiotreitol
FAM 115 Family 115
GAL-1 Galetin - 1
GDI2 Rab GDP dissociation inhibitor 2 - like
HCl Ácido clorídrico
HOST Hypo-osmotic swelling test ICDH Isocitrato desidrogenase
IRRG International rabbit reproduction group
M Molar
mM Milimolar
NaCl Cloreto de sódio
NL Não linear
PCR Polymerase chain reaction
PNMA 1 - like Paraneoplastic Ma antigens 1
PS Plasma seminal
SOD Superóxido dismutase
ST Túbulos seminíferos
RT Real time
TFA Ácido trifluoroacético
Tm Tropomiosina
TRIS Tris(hidroximetil)aminometano
TRPM8 Transient receptor potencial melastatin 8 - NGF Fator de crescimento do nervo
RESUMO GERAL
SEMINAL PLASMA PROTEOMIC AND GENE EXPRESSION AND NGF LOCATION AND RECEPTORS (TRK1 and NGFR) IN RABBIT GENITAL
SYSTEM ABSTRACT
1. CONSIDERAÇÕES INICIAIS
A Cunicultura como atividade comercial, no Brasil ainda vem se desenvolvendo a passos lentos. Teve início no ano de 1950, no estado de São Paulo e segundo o IBGE (2011), a região Sul é a maior produtora de coelhos, que mantém 74,9 % do efetivo total. O Estado Rio Grande do Sul tem o maior efetivo com 40,3 %, seguido pelo Paraná com 17,9 % e por Santa Catarina com 16,7 %, enquanto que os principais municípios produtores no Brasil são Araricá (RS), Mogi das Cruzes (SP) e Paula Freitas (SP).
Segundo a FAO (1996), a cunicultura repesenta excelente alternativa para solucionar o problema da fome em países em desenvolvimento por ser atividade relativamente simples, podendo gerar renda e melhorar a dieta das famílias de baixa renda, seja na zona rural ou urbana. Para produtores que trabalham com monocultura, pode representar atividade alternativa para complementação da renda familiar.
Sob o ponto de vista nutricional, a carne de coelho é de qualidade indiscutível. É de fácil digestibilidade, sendo indicada na alimentação de crianças e idosos. Sua composição, quando comparada a de outras espécies, contém percentual de lipídios reduzido, baixo teor de gordura predominante nos ácidos graxos insaturados e proteína de alto valor biológico, características desejadas por quem busca qualidade de vida e alimentação saudável. Além da comercialização da carne, a atividade também permite a exploração de animais para produção de pêlos e pele para confecção de produtos industrializados, venda de animais vivos para área de pesquisas biomédica, venda do cérebro para indústra de fármacos, venda de esterco para produção agrícola e, atualmente, vem crescendo a venda como animais de companhia (Machado, 2012).
práticas de manejos intensivos, tais como o sistema de produção em ciclo, aliado a inseminação artificial tem sido utilizados para otimização do processo de produção de carne (Theau-Clément, 2003).
Sabe-se que o sucesso da inseminação artificial está relacionado a qualidade do sêmen e a utilização de sêmen conservado oferece resultados ainda restritos, pois diminui a fertilidade (Daader e Zeidan, 2008) e o conhecimento mais aprofundado das caracteríscas seminais em coelhos é de essencial importância. A maioria dos estudos realizados na área cunicultura com ênfase na eficiência reprodutiva tem se concentrado na fisiologia reprodutiva da fêmea, mas as características seminal pouco estudada.
No sêmen da espécie cunícula, também são encontrados grânulos e vesículas de origem prostática, que afetam o comportamento do espermatozoide durante o trânsito ao longo do trato reprodutivo da fêmea (Castellini, 2008). Muitas pesquisas tem sido desenvolvidas para se compreender como estes prostassomas influenciam na função espermática, entretanto pouco se conhece sobre as proteínas contidas no plasma seminal de coelhos e como essas influenciam na função reprodutiva desta espécie. Estudos preliminares conduzidos por Arruda-Alencar et al. (2012) identificaram a presença da anexina 5 no plasma semnal. Em coelhos, a anexina 5 tem sido relatada como fator decapacitante (Okabe et al.,1993). Pesquisas sugerem que a presença dessa proteína no plasma seminal desta espécie é de extrema importância, dada a fisiologia reprodutiva da coelha, que é uma espécie de ovulação reflexa, onde a ovulação é induzida pelo estímulo da cópula (Giojalas et al., 2004). Isto é, há carência de pesquisas nessa área, e novos trabalhos, buscando a caracterização proteíca do plasma seminal de coelhos, seriam interessantes para compreender como estas proteínas regulam a função espermática, e assim, servir de base para a busca de biomarcadores de eficiência reprodutiva, visando (Urtiaga et al., 2013), um aumento da produção.
2. REVISÃO DE LITERATURA
2.1. Anatomia reprodutiva do coelho macho
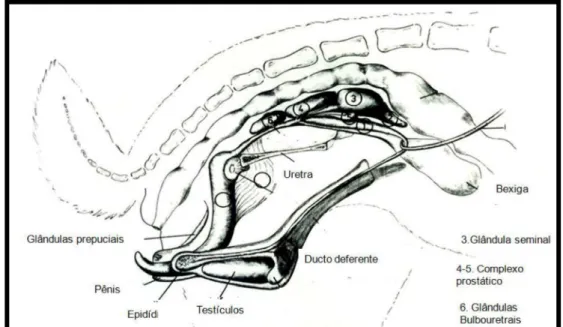
O aparelho reprodutor de coelhos machos (Figura 1) é composto pelos testículos ,epidídimos , ampolas, ductos deferentes, uretra, pênis, glândulas prepuciais e glândulas anexas. A anatomia urogenital de coelhos machos é única entre as espécies de mamíferos placentários, e comum nas espécies marsupiais (Capello et al., 2006). O pênis é o órgão copulador. Não apresenta glande e seu formato é cilíndrico com 40-50mm de comprimento, reduzindo o seu diâmetro até a sua extremidade. Durante o repouso sexual se situa no prepúcio, localizado ventralmente ao ânus (Alvariño, 1993) e caudal aos testículos (Capello et al., 2006).
As glândulas prepuciais estão inseridas na derme do prepúcio relacionadas ao seu orifício, são discretas e podem ser consideradas glândulas sebáceas aumentadas (Holtz e Foote, 1978a). Sua localização é caudal ao pênis e tem como função secretar uma substância de odor intenso que estimula o reflexo ovulatório da fêmea (Monaci, 2003).
Figura 1. Aparelho reprodutor de coelhos (Holtz e Foote, 1978a).
et al., 2006), localizados na bolsa escrotal, um de cada lado da linha inguinal, posicionados quase horizontalmente (Holtz e Foote, 1978a). Ao nascimento estão situados na cavidade abdominal, descendo para bolsa escrotal com aproximadamente 2 meses de vida (Alvariño, 1993). O canal inguinal é aberto, tornando os coelhos criptorquídeos funcionais. A posição dos testículos depende de muitos fatores, incluindo a posição do corpo, temperatura corporal, atividade reprodutiva, repleção do aparelho gastrointestinal e a quantidade de gordura abdominal (Capello et al., 2006).
A bolsa escrotal é formada pela túnica vaginal, túnica dartos e cremaster. Sua principal função é a de manter os testículos afastados da cavidade abdominal, permitindo que a temperatura testicular esteja entre 0,5 e 4 °C inferior à do corpo, que é uma condição necessária para uma espermatogênese normal (Alvariño, 1993). A bolsa testicular apresenta uma comunicação com o abdômen através do anel inguinal, por onde passam os ductos excretores que vem dos testículos. Durante os períodos de inatividade sexual ou estresse, os testículos retornam à cavidade abdominal através do anel inguinal, podendo descer novamente pela ação do músculo cremáster (Alvariño, 1993; Monaci, 2003; Capello et al., 2006).
O epidídimo é um tubo sinuoso que se encontra unido à gônada por tecido conjuntivo. É formado pelos ductos eferentes e o ducto epididimário (Holtz e Foot, 1978a).
As ampolas possuem 2 cm de comprimento (Monaci, 2003) e correspondem ao segmento distal do ducto deferente que forma um laço ao redor do ureter e se torna fusiforme (Holtz e Foote, 1978a).
A glândula vesicular localiza-se entre as duas ampolas e o complexo de glândulas que contém a próstata. É bilobular, com a terminação cranial oca e com as paredes espessas. Seu tamanho é extremamente variável e em algumas vezes bastante dilatada. A distensão da glândula depende da quantidade de fluido contido dentro da mesma. Esse fluido é claro, variando de viscoso a um gel consistente. Sua porção caudal tem a parede fina e seu formato assemelha-se a um saco (Holtz e Foote, 1978a).
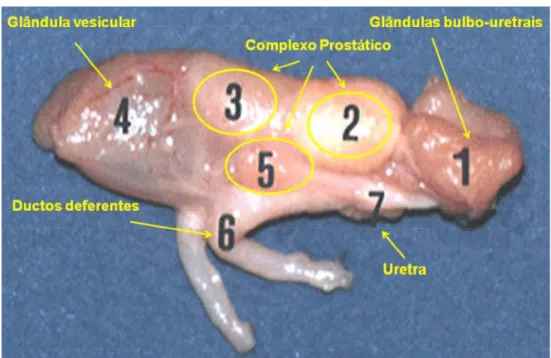
O complexo prostático é constituído pelas glândulas: propróstata (Figura 2 n° 3), próstata propriamente dita ou próstata caudal (Figura 2 n° 2) e glândulas paraprostáticas (Figura 2 n° 5) (Holtz e Foote, 1978a).
Figura 2 - Glândulas sexuais do coelho (Cardinalli, 2007).
A glândula prostática se localiza entre a propróstata e a glândula bulbouretral (Vásquez e Del Sol, 2002). Possui de 4 a 6 canais excretores que se abrem na parede do coletor seminal (Alvariño, 1993). Apresenta cor branca amarelada e compartilha a mesma cápsula de tecido conjuntivo que a propróstata e apenas uma pequena camada desse tecido separa essas duas glândulas (Holtz e Foote, 1978a).
As glândulas paraprostáticas são pequenas, apresentam uma superfície com relevo irregular e forma de martelo. Localizam-se nos dois lados da uretra, no nível da terminação dos ductos deferentes, ventralmente à próstata (Monaci, 2003). Está relacionada com a próstata, a propróstata e a ampola dos ductos deferentes (Vásquez e Del Sol, 2002). Histologicamente, apresenta dois tipos de epitélio, sendo um similar à próstata e outro à glândula prostática (Holtz e Foote, 1978a; Vásquez e Del Sol, 2002; Vásquez e Del Sol, 2009).
A glândula bulbouretral é uma pequena massa de tecido glandular, coberta por uma cápsula de tecido fibroso e rodeada pelo músculo bulbo-glandular, o qual divide a mesma em lóbulos, derivada da parede uretral. É única no coelho, ao contrário dos outros mamíferos, inclusive do homem. Localiza-se dorsal à uretra e caudal à próstata (Vásquez e Del Sol, 2001).
2.2. Fisiologia reprodutiva do macho cunícula
Entretanto, os dados da literatura mostraram que por volta de 60 a 70 dias de idade começam as tentativas de monta, e aos 100 dias eles realizam efetivamente as primeiras coberturas, porém, os primeiros espermatozoides só começam a aparecer no ejaculado aos 110 dias de idade (Della Porta et al., 1992). A coleta de sêmen já é possível a partir dos 4 meses de idade.
O que tem sido amplamente observado é que as coberturas realizadas por machos com 100 dias podem até ocorrer, contudo, os espermatozoides contidos nesse ejaculado apresentam uma baixa viabilidade, podendo esta ser escassa ou até mesmo nula.
Lebas et al. (1997) sugerem que o ideal é que as primeiras coberturas sejam realizadas a partir dos 135-140 dias de vida. O estímulo para a cobrição através de ensaios e da falsa monta momentos antes da realização desta, ajuda a aumentar a concentração espermática dos ejaculados. Geralmente, no segundo ejaculado se observa um menor volume, com uma maior concentração. A partir do terceiro ejaculado, tanto o volume, quanto a concentração espermática começam a decrescer, o que em muitos casos resulta em coberturas sem êxito (Alvarinõ, 1993).
A espematogênese tem a duração de 45 dias e a produção espermática diária da espécie é de aproximadamente 150 a 300 milhões de sptz/mL, não aumentando de acordo com o ritmo de ejaculações. Segundo Oshio et al. (1987), animais submetidos a um ritmo intenso necessitam de 3 semanas para que o sêmen volte a apresentar as suas características iniciais. Para Kirton et al. (1966) é possível realizar duas coletas consecutivas com 15 minutos de intervalo a cada dois dias sem que haja perda das características seminais, tais como, a concentração e o volume do ejaculado. No entanto, estudos realizados por Mocè et al. (2000) sugeriram que o segundo ejaculado apresenta qualidade superior em relação ao primeiro ejaculado coletado, desde que o intervalo entre as coletas sejam de 15 minutos.
2.3. Sêmen de coelho e suas características
O sêmen de coelho consiste de uma suspensão de espermatozoides no plasma seminal, que é constituído pelas secreções do epidídimo e das glândulas anexas, que se misturam no momento da ejaculação (IRRG, 2005) e de uma fração gelatinosa, cuja função é preencher o lúmen da vagina servindo de tampão biológico, após a ejaculação, evitando assim o refluxo do sêmen para o exterior do aparelho reprodutor feminino (Mukherjee et al., 1951).
As características seminais dos coelhos geralmente apresentam alta variabilidade (Moce, 2000), são influenciadas por diversos fatores como a idade, a raça (Salcedo et al., 2004), o indivíduo (Holtz e Foote, 1978b), a época do ano (Theau-Clément et al., 2009), a temperatura (Finzi et al., 1994; Marai et al., 2001), a freqüência e o ritmo de coleta (Nizza et al.2003a; Nizza et al.2003b), o programa de luz (Theau-Clément et al., 1994; Mousa-Balabel, 2011), a alimentação e a genética (IRRG, 2005; Castellini, 2008).
2.3.1. Coleta de sêmen
2.3.2. Características físicas e químicas do sêmen
O sêmen de coelho é caracterizados pela presençs um odor imperceptível, densidade 1,063 e pH variando de 6,5 6,8 (Mies Filho, 1987). O volume de ejaculado varia de 0,3 a 6 mL, em função da secreção das glândulas acessórias, porém normalmente se encontra entre 0,3 e 0,8 mL (Alvariño, 1993). Em estudos conduzidos no sul do Brasil os volumes médios relatados foram de 0,59 mL (Andreazzi et al., 2004) em coelhos da raça Nova Zelândia Branca e de 0,57 mL (Costa et al., 2002) na raça Califórnia.
Em coelhos, a cor do sêmen é esbranquiçada, podendo variar a sua intensidade de acordo com a concentração dos espermatozoides (Alvariño, 1993). Normalmente, as variações de cores encontradas são marfim, branco, branco perolado e branco amarelado. Entretanto, a presença de elementos anormais, como urina (amarelo), sangue (rosado), presença de precipitados, cristais e células epiteliais provenientes do tecido genital (cinza) podem modificar a cor do ejaculado (Della Porta et al., 1992). No que se refere ao aspecto, o mesmo apresenta-se de aquoso a cremoso, estando diretamente relacionado a concentração espermática. Os ejaculados com aspecto cremoso são indicativos de alta concentração, enquanto aqueles com aspecto aquoso são característicos de baixa concentração. Os ejaculados de baixa concentração, normalmente são claros, de aspecto aquoso e ligeiramente amarelado (Della Porta et al. 1991).
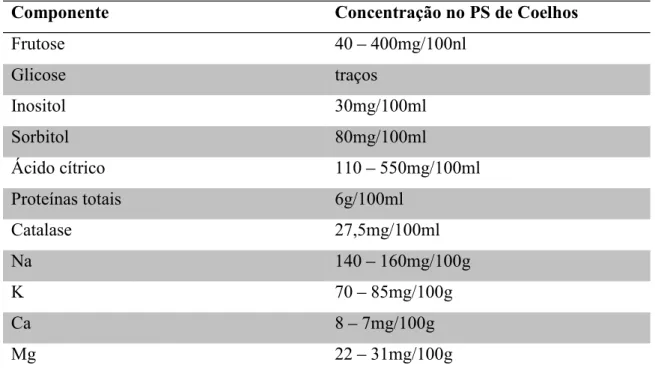
Tabela 1 - Composição bioquímica do plasma seminal de Coelhos*
Componente Concentração no PS de Coelhos
Frutose 40 400mg/100nl
Glicose traços
Inositol 30mg/100ml
Sorbitol 80mg/100ml
Ácido cítrico 110 550mg/100ml
Proteínas totais 6g/100ml
Catalase 27,5mg/100ml
Na 140 160mg/100g
K 70 85mg/100g
Ca 8 7mg/100g
Mg 22 31mg/100g
*Tabela adaptada Della Porta et al., 1991
2.3.3. Célula espermática
A concentração de espermatozoides em coelhos oscila entre 150 e 900x106sptz/mL, sendo considerada ótima a partir de 250 x 106sptz/mL (Alvariño, 1993). A câmara hematocitométrica, que é uma técnica de alta precisão, se realizada de forma adequada (Chemineau et al., 1991), sendo a mais apropriada para coelhos (Alvariño, 1993).
As células espermáticas de coelhos contêm uma maior quantidade de fosfolipídios (15 %), enquanto o plasma seminal, vesículas e grânulos representavam 49,8 % do total (Castellini et al., 2005). Os espermatozoides têm uma composição lipídica única, porque são células diferenciadas. O perfil lipídico dos espermatozoides durante sua diferenciação, a maturação epididimária e o trânsito no aparelho reprodutor feminino, sofrem modificações que causam alterações na fluidez da membrana e na capacidade de resposta ao ambiente exógeno. Essas modificações estão envolvidas em eventos fisiológicos, como hiperativação, capacitação e reação acrossômica, que são cruciais para penetrar a zona pelúcida e a capacidade de fertilização dos espermatozoides (Castellini et al., 2006a).
2.3.4 Gel
O gel é originado nas glândulas vesiculares (Del Jesus Niño et al., 1997) e sua produção e manutenção são dependentes da concentração sérica de testosterona. Em sua composição são encontradas uma quantidade significativa de substâncias estrogênicas (Mukherjee et al., 1951) além de alguns componentes seminais como o ácido cítrico e a frutose, sendo essa última em poucas quantidades (Parson, 1950).
2.3. 5. Prostassomas
De acordo com Minelli et al. (2003), no sêmen de coelho estão presentes grânulos e vesículas, de tamanho, origem e funções diferentes, parcialmente conhecidas que afetam o comportamento do espermatozoide durante o trânsito ao longo do trato reprodutivo da fêmea (Castellini, 2008). Pesquisas tem demonstrado que as vesículas também são encontradas no sêmen de outras espécies de mamíferos, desempenhando um importante papel na fisiologia reprodutiva. Tais vesículas são secretadas por diferentes glândulas anexas do aparelho reprodutor masculino, variando sua composição bioquímica e função de acordo com a espécie (Castellini, 2008). Em coelhos, a secreção é realizada pela próstata (prostassomas), nos humanos pela próstata e epidídimo, em ratos e carneiros pelo epidídimo e em bovinos, pelas glândulas vesiculares (Kravets et al., 2000; Ghaoui et al., 2004; Castellini et al., 2008).
Estudos realizados por Cardinali et al.(2008) com coelhos vasectomizados, constataram a presença dos grânulos, deduzindo-se portanto que tais secreções são de origem prostática e não do epidídimo ou mesmo do testículo. A concentração e a morfologia dessas partículas não diferiram quando comparadas com ejaculados de animais não vasectomizados. Entretanto, o tipo de partícula encontrada no sêmen indica que as glândulas próstata e propróstata, apresentam a principal atividade secretora (Castellini et al., 2012).
as menores, após submetidas a ultracentrifugação apresentam um volume de 20 50 µL (Castellini et al., 2008).
Figura 3 Separação das frações seminais (Castellini et al., 2005).
cleotidase dos espermatozoides de coelhos, produzindo adenosina (Minelli et al., 2003) e modulando a motilidade espermática (Collodel et al., 2011).
Estudos realizados por Castellini et al. (2013), demonstraram que o plasma seminal e os prostassomas agem sinergicamente sobre os espermatozoides. O primeiro atua como um fator decapacitante, enquanto o segundo age inibindo a reação acrossômica em espermatozoides já capacitados.
A presença dessas partículas é de extrema importância uma vez que os espermatozoides permanecem dentro do trato reprodutivo da fêmea por um período de 16 a 18 horas até que os oócitos estejam disponíveis no oviduto, mantendo assim a sua integridade de membrana (Giojalas et al., 2004; Castellini et al., 2008).
2.4. Constituintes do Plasma Seminal (PS)
do sêmen (Castellini et al., 2007) e algumas isoformas (3,1 ± 0,4; beta-, gamma- e delta- tocoferol) nos grânulos maiores, o que corresponde a 37 % do tocoferol total do sêmen (Muorvaki et al., 2008). Sabe-se que o alfa - tocoferol é um potente antioxidante e que em coelhos, o seu nível plasmático aumenta com idade. Estudos conduzidos por Castellini et al., -tocoferol é o principal antioxidante presente no sêmen de coelho e que os grânulos prostáticos representam uma fonte adicional de proteção aos espermatozoide de coelho contra o estresse oxidativo através do fornecimento do se -tocoferol endógeno (Mourvaki et al., 2010).
2.4.1. As proteínas do plasma seminal e seus efeitos sobre o metabolismo espermático
A composição protéica do PS de mamíferos varia entre as diferentes espécies, e tem importantes efeitos sobre a função espermática (Villemure et al., 2003). Algumas proteínas do PS têm influência sobre a motilidade espermática (Sánchez-Luengo et al., 2004; Henricks et al., 1998), viabilidade e fertilização (Brandon et al., 1999). Várias proteínas do PS tem sido descritas como fatores de infertilidade em equinos (Brandon et al., 1999) e suínos (Jonáková et al., 2007).
Alguns autores descreveram que a habilidade fertilizante do espermatozóide seria, em grande parte, determinada pelas proteínas espermáticas localizadas no acrossoma e peça intermediária, conhecidas como fonte de enzimas metabólicas especialmente ativas, cujas liberações em grandes quantidades podem indicar danos na membrana plasmática (Bittmar e Kosiniak, 1992). As proteínas do plasma seminal desempenham um importante papel na capacitação dos espermatozoides, traduzido por um complexo processo que habilita a célula espermática a penetrar, através da zona pelúcida, por meio da reação acrossômica (Calvete et al., 1994; Jonakova et al., 2000).
em 1 a3h, enquanto que os espermatozoides suspensos em PS puro ou diluídos em até 10 vezes, mantiveram a sua motilidade durante um período de 6h (Castellini et al., 2006a). Okab (2007), estudando coelhos da raça Nova Zelândia Branca criados em clima temperado, constatou que as concentrações de proteínas totais, albumina e globulina no plasma seminal foram influenciadas de maneira significativa pela estação do ano. As maiores concentrações desses metabólitos foram encontradas no verão, enquanto que na primavera foram observadas as menores, sugerindo portanto, que a qualidade do sêmen é melhor no verão devido ao aumento da concentração dessas proteínas na sua composição (Strezek, 1995; Okab, 2007).
Além de um fator decapacitante (Davis e Davis, 1983), apenas uma proteína foi encontrada e identificada: um inibidor da dineína ATPase (Lamirande et al., 1984) que impede o início da motilidade. Trabalhos conduzidos por Minelli et al. (2001a,b) identificaram a existência de um complexo protéico insulin-like growth factor (IGF), com peso molecular de 150 kDa, no sistema reprodutivo masculino (Lee et al., 1994).
3. REFERÊNCIAS BIBLIOGRÁFICAS
Alvariño, M. R. (1993). Control de la reproducción en el conejo. Ediciones Mundi Presa. Madrid.
Andreazzi, M. A., Scapinello, C., Moraes, G. V., Faria, H. G., Michelan, A. C., Georg, P. C. (2004). Avaliação da qualidade do sêmen em coelhos alimentados com rações contendo diferentes fontes de óleos vegetais. Acta Scientiarum Animal Sciences, v. 26, n. 1, p. 87 93.
Arruda-Alencar, J. M., Viana-Neto A. M., Souza, C. E. A., Martins, J. A. M., Moreno, F. B., Moreira, A. C. M., Guerreiro, E. F., Moura, A. (2012) Major proteins of the seminal plasma of New Zealand white rabbits and association with semen criteria. 10th World rabbit congress. Sharm El-Sheikh, Egypt: World Rabbit Science Association; p. 395 9.
Bittmar, A., Kosiniak, K. (1992). The role of selected biochemical components of equine seminal plasma in determining suitability for deep-freezing. Archivum Veterinarium Polonicum, v.32, p. 17 28.
Calvete, J. J., Nessau, S., Mann, K., Sanz, L., Sieme, H., Klug, E., Töpfer-Petersen, E. (1994). Isolation and biochemical characterization of stallion seminal plasma proteins. Reproduction Domestic Animal, Berlim, v. 29, p. 411-426.
Cardinali, R. Granuli e vesicole nel seme di conigli: aspetti morfologici e funzionali. (2007). Tesi. (Dottorado di ricerca in Biologia delle Cellule Germinali). Facoltà
.
Castellini, C., Lattaioli, P., Moroni, M., Minelli, A. (2000). Effect of seminal plasma on the characteristics and fertility of rabbit spermatozoa. Anim. Reprod. Sci., 63, 275-282.
Castellini, C., Cardinali, R., Dal Bosco, A. (2005). Lipid composition of the main fractions of rabbit semen. Theriogenology, v. 65, n. 4, p. 703-712.
Castellini, C., Lattaioli, P., Cardinali R., Dal Bosco, A. (2006a). Effect of collection rhythm on spermatozoa and droplets concentration of rabbit semen. World Rabbit Sci.14: 101 106.
Castellini, C., Besenfelder, U., Pizzi, F., Theau-Clement, M., Vicente, J., Renieri, T. (2006b). Developments in the investigation of rabbit semen and buck mangement. In: Recent Advances in Rabbit Science. Edited by L. Maertens and P. Coudert. COST. Belgium.
Castellini, C., Mourvaki, E., Dal Bosco, A., Galli, F. (2007). Vitamin E biochemistry and function: A case study in male rabbit. Reprod. Dom. Anim 42, 248 256. Castellini, C. (2008). Semen production and management of rabbit bucks. In: 9th World
Rabbit Congress. Anais: 9th World Rabbit Congress, p. 265 277, Verona, Itália.
Castellini, C., Mourvaki, E., Cardinali, R., Collodel, G., Lasagna, E., Del Vecchio, M. T., Dal Bosco, A. (2012). Secretion patterns and effect of prostate-derived granules on the sperm acrosome reaction of rabbit buck. Theriogenology, 78: 715 - 723.
Chemineau, P., Cagnié, Y., Guérin, Y.; Orgeur, P.; Vallet, J. C. (1991). Training manual on artificial insemination in sheep and goats. Food and Agriculture Organization of the United Nations (FAO). FAO Animal Production and Health Paper, Rome, p.222, 1991.
Collodel, G., Cardinalli, R., Moretti, E., Mattioli, S., Ruggeri, S., Castellini, C. (2012). Role of rabbit prostate on sperm viability and acrosome reaction evacuate with methods. Theriogenology. 77: 1021 - 1026.
Costa, L. L., Murgas, L. D. S., Milorini, A. B., Oliveira, S. L., Silva, F. P. C., Pereira, R. A. N. (2002)Influência do selênio sobre a qualidade do sêmen de coelhos da raça Califórnia. Revista Brasileira de Reprodução Animal, v. 26, n. 2, p. 117 - 118.
Daader, A. H., Zeidan, A. S. B. (2008). Motility and acrosomal integrity of frozen rabbit spermatozoa as affected by different extenders, cryoprotectants and packaging methods. Anais do 9th World Rabbit Congress, Verona Italia.
Davis, B. K., Davis, N. V. (1983). Binding by glycoproteins of seminal plasma membrane vesicles accelerates decapacitation in rabbit spermatozoa. Biochim. Biophys. Acta, 727, 70-76.
Del Niño Jesus, A., Muñoz Lopez, I., Josa, A., Espinosa, E., Gracia, M, Garcia Martinez, M. P. Leuza , A. (1997). Modifications of some parameters of the rabbit ejaculate after ablation of the vesicular gland. World Rabbit Science, v. 5, n. 1, p. 3 5.
Della Porta. P., Della Porta, P., Maccario, P., Borelli, A. (1991). Inseminazione Artificiale nei conigli. Edizione Grupo Azeta. Aprile.
Evans, G., Maxwell, W. M. C. (1990). Inseminação artificial em ovejas y cabras. España: Zaragoza, p. 192.
Farrell, P. B., Foote, R. H., Loomis, P. R. (1992). Elimination of granule interference facilitating accurate casa analysis of rabbit sperm. J. Andrology, abstract 108. Finzi, A., Morera, P. Macchioni, P. (1994) Modifications of some rabbit spermatic
parameters in relationship to high ambient temperatures. Cahiers Options Méditerranéennes, v. 8, p. 333 -336.
Ghaoui, R. E., Thomson, P. C., Evans, G., Maxwell, W.M.C. (2004). Characterization and localization of membrane vesicles in ejaculate fractions from the ram, boar and stallion. Reprod Biol Endocrinol; 39 : 173 80.
Giojalas, L. C., Rovasio, R. A., Fabro, G., Gakamsky, A., Eisenbach, M. (2004). Timing of sperm capacitation appears to be programmed according to egg availability in the female genital tract. Fertil. Steril., 82, 247-249.
Guerra, G., Evans, G., Maxwell, W. M. C. (2004). Papel de antioxidantes na andrologia. Revista Brasileira de Reprodução Animal, Belo Horizonte, v. 28, n. 4, p. 187-195, 2004.
Hafez, E. S. E., Hafez, B. (2000). Reproduction in Farm Animals. 7 ed. Philadelphia: Lippincott Williams e Wilkins, p.509.
Holtz, W., Foote, R., H. (1978a). The anatomy of the reproduction system in male dutch rabbits (Oryctolagus cuniculus) with special emphasis on the accessory sex glands. Journal of Morphology, v. 158, p. 1 20.
Holtz, W., Foote, R. H. (1978b). Composition of Rabbit Semen and the Origin of Several Constituents. Biology of Reproduction, v.18, n. 2, p.286 -292.
IRRG Internacional Rabbit Reproduction Group, (2005). Guidelines for the handling of rabbit bucks and semen. World Rabbit Science, v. 13, p. 71 91.
Jonakova, V., Manaskova, P., Kraus, M., Liberda, J., Tichá, M. (2000). Sperm Surfece Proteins in Mammalian Fertilization. Molecular Reproduction and Development, Praga, v. 56, p. 275-277.
Jonakova, V., Manaskova, P., Ticha, M. (2007). Separation, characterization and identification of boar seminal plasma proteins. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences v. 849 (1-2), p. 307-14.
Kershaw-Young, C. M., Druart, X., Vaughan, J., Maxwell, M. Nerve growth factor is a major component of alpaca seminal plasma and induces ovulation in female alpacas. Reproduction, Fertility and Development. Kirton, K. T, Desjardins, C., Hafs, H. D. (1966). Levels of some normal constituents of
rabbit semen during repetitive ejaculation. Fertil Stertil.;17:204 211.
Kravets, F. G, Lee, J., Singh, B., Trocchia, A., Pentyala, S. N. (2000) Prostasomes KS. Prostasomes: Current concepts. Prostate. 43: 169 74.
Lamirande, E., Belles-Isle, S. M., Gagnon, C. (1984). Characteristics of a seminal plasma inhibitor of sperm motility. Annals New York Academic Science, 438: 125-131
Lebas, F., Coudert, P., Rouvier, R. (1997). Rabbit husbandry, health and production. Animal Production and Health Series, FAO, Rome.
Machado, L. C., Ferreira, W. M. (2014). Organização e estratégia da cunicultura brasileira - A busca por soluções. V Congreso Americano de Cunicultura. México.
Machado, L. C. (2012) Opinião: Panorama da Cunicultura Brasileira. Revista Brasileira de Cunicultura, v. 2, n. 1. Disponível em http://www.rbc.acbc.org.br/index.php?option=com_content&view=article&id=6 3&Itemid=71
Marai, I. F. M., Ayyat, M. S., Abd El-Monem, U. M. (2001). Growth performance and reproductive traits at first parity of New Zealand White female rabbits as affected by heat stress and its alleviation under Egyptian conditions. Tropical Animal Health and Production, v. 33, n. 6, p. 451- 462.
Maxwell, W. M. C., Johnson, L. A. (1999). Physiology of spermatozoa at high dilution rates: the influence of seminal plasma. Theriogenology, v.52, p.1353-1362. Mies Filho, A. (1987). Inseminação Artificial. Editora Sulina, Porto Alegre. 6Ed. Vol.
2. p. 394 395.
Minelli, A., Moroni, M., Castellini, C., (2001). Isolation and purification of the IGF-I protein complex from rabbit seminal plasma: effects on sperm motility and viability. J. Exp. Zool., 290, 279-290.
Minelli A., Liguori L., Bellezza I., Renieri T., Castellini C. (2003). Effects of diadenosine polyphosphates and seminal fluid vesicles on rabbit sperm cells. Reproduction, 125, 827 835.
Miodrag L, Skibinski, G, Rodney K.W, Keith J. (1995). Immunomodulatory effects of extracellular secretory vesicles isolated from bovine semen. Vet Immunol and Immunopatology, 44, 237-250.
Mocè, E., Lavara, R., Lavara, F., Vicente, J. S. (2000). Effect of reproductive rhythm on seminal parameters from a rabbit line selected with high growth rate. In: Proc. 7th World Rabbit Congress. Valencia. July. Vol A: 197-201.
Monaci, M. (2003). In:Riproduzione e benessere in coniglicoltura: recenti acquisizione scientifiche e trasferibilità in campo. Fondazione Iniziative Zooprofilattiche e Zootecniche Brescia, Itália.
Mourvaki, E., Collodel, G., Moretti, E., Cosci, I., Castellini, C. (2008). Distribution of alpha-, gama (+beta) and delta-tocopherol in the seminal plasma, spermatozoa and seminal vesicles of rabbit. Andrologia, 40: 202 285.
Mourvaki, E., Cardinalli, R., Dal Bosco, A., Castellini, C. (2010). In vitro antioxidant activity of the prostatic secretory granule in rabbit semen after exposure to organic peroxides. Reproductive Biology and Endocrinology, 8:16.
Mousa-Balabel, T. M. (2011). Using light and melatonin in the management of New Zealand White rabbits. Open Veterinary Journal, v. 1, p. 1-6.
Mukherje, D. P., Johari, M. P., Bhattacharya, P. (1951). The gelatinous mass in rabbit semen. Nature, v. 168, p. 422 423.
Nizza, A., Di Meo, C., Taranto, S., Stanco, G. (2002). Effect of collection frequency on rabbit semen production. World Rabbit Science, v. 10, n. 2, p. 49 52.
Okab, A. B. (2007). Semen characteristics and plasma testosterone of New-Zealand male rabbits as affected by environmental temperatures. Slovak Jounal Animal Science, v. 40, n. 4, p. 161 167.
Okabe, M., Kishi, K., Ying, X., Kohama, Y., Mimura, T., Li, S.S., (1993). Characterization of capacitation inhibitory protein from rabbit seminal plasma: homology with human annexins. Biol. Pharm. Bull., 16, 453-456.
Oshio, S., Kaneko, S., Mohri, H. (1986). Characterization of rabbit sperm by equilibrium sedimentation in percoll during frequent ejaculation. Arch Androl. 17:189 194.
Parsons, U. (1950). Fructose in rabbit semen: a study of normal fluctuations, and changes evoked by testosterone and stilboestrol. Journal of Endocrinology, v. 6, p. 412 422.
Salcedo-Bacar, R., Pichardo-Reyes, M., Echagaray-Torres, J. L. (2004). Buck sêmen characteristics from a mexicam populations of the Californian, White New Zealand and Chinchila breeds. In: 8th World Rabbit Congress. Anais: 8th World Rabbit Congress, p. 343 348. Puebla, México.
Sanchez-Luengo, S., Aumuller, G., Albrecht, M., Sem, P. C., Rohm, K. H., Wilhelm, B. (2004). Interaction of PDC-109, the major secretory protein from bull seminal vesicles, with bovine sperm membrane Ca2+-ATPase. J Androl, v.25, p.234-244.
Silva, M., Niño, A., Guerra, M., Letelier, C., Valderrama, X. P., Adams, G. P., Ratto, M. H. (2011). In an ovulation-inducing factor (IOF) present inthe seminal plasma of rabbits? Animal Reproduction Science, 127: 213 221.
Urtiaga, G., Campos, V. F., Collares, T. F., Leon, P. M. M., Deschamps, J. C., Seixas, F. K., Collares, T. (2013). Associação entre proteínas do plasma seminal, motilidade e viabilidade espermática em coelhos submetidos a doping genético. Arq. Bras. Med. Vet. Zootec.v.65, 1: 75 - 81.
Theau-Clément, M. (2003). Preparation of the rabbit doe to insemination: A review. World Rabbit Sci. 2007, 15:61 80.
Theau-Clément, M., Sanchez, A., Duzert, R., Saleil, G., Brun, J. M. (2009). Estude de facteurs de variation de la production spermatique chez le lapin. In: 13ème Jourmées de la Recherche Cunicole. Anais: 13ème Jourmées de la Recherche Cunicole, Le Mans, France.
Vadnais, M. L., Althouse, G. C.(2011). Characterization of capacitation, cryoinjury, and the role of seminal plasma in porcine sperm. Theriogenology, 76, 1508-1516. Vásquez, B., Del Sol, M. (2001). Estudio morfológico de la glândula bulbouretral de
conejo (Oryctolagus cuniculus). Revista Chilena de Anatomia, v. 19, n. 2. Vásquez, B., Del Sol, M. (2002). Complejo prostático en el conejo (Oryctolagus cuniculus). Revista Chilena de Anatomia, v. 20, n.2, p. 175-180.
Vásquez, B., Del Sol, M. (2009). Estereología comparativa entre as glândulas del complejo prostático del conejo Oryctolagus cunniculus. International Journal Morphology, v. 27, n. 1, p. 205 210.
Vieira, M. I. (2008). Carne de Coelho. Rural News 2008. Diponível em http://www.abc.org.br/images/stories/Manual_pratico_de:cunicultura_2_partes. Acesso em: 15 jun. 2015.
Yamamoto, Y., Shimamoto, K., Sofikitis, N., Miyagawa, I. (1999). Effects of hypercholesterolaemia on Leydig and Sertoli cells secretory function and the overall sperm fertilizing capacity in the rabbit. Hum. Repr. 14: 1516-1521. Zaniboni, L., Gliozzi, T., Maldjian A., Luzi, F., Cerolin,i S. (2004). Fatty acid and
tocopherol composition of semen components in the rabbit. In Proc.: 8th World
CAPÍTULO 2
RESUMO
ABSTRACT
4. INTRODUÇÃO
5. OBJETIVOS
5.1 Geral
- Estudar o proteoma do plasma seminal de coelhos Nova Zelândia Branca criados em região tropical, e suas associação com parâmetros seminais.
5.2 Específicos
- Descrever o proteoma do plasma seminal de coelhos Nova Zelândia Branca utilizando eletroforese bidimensional e espectrometria de massas;
- Avaliar os parâmetros de qualidade seminal: motilidade, vigor, concentração espermática, morfologia espermática, integridade de membrana, integridade acrossomal e vitalidade;
6. MATERIAL E MÉTODOS 5.1. Local do experimento
O experimento foi conduzido no laboratório de Fisiologia Animal do
clima, segundo a classificação de Koeppen, é do tipo AW, quente e úmido, suas médias térmicas são de 26 a 27 °C, com máximas de 30 °C e mínimas de 19 °C, a umidade relativa do ar é de 82 % no litoral do estado do Ceará (Brasil).
6.3. Animais experimentais e coleta de sêmen
Foram utilizados 18 coelhos machos adultos da raça Nova Zelândia Branca, com peso médio de 3,200 kg. Os animais foram criados em sistema intensivo, alojados individualmente em gaiolas de arame galvanizado, dispostas em sistema flat-deck, e alimentados com ração comercial. As coletas foram realizadas utilizando-se uma vagina artificial de vidro temperado (Ghislandi & Ghislandi Covo Bg - Itália), com auxílio de uma fêmea, como manequim.Foram coletados 2 ejaculados por macho, com intervalo de 15 minutos entre as coletas, segundo Mocè et al. (2000). Somente o segundo ejaculado coletado foi utilizado. Os coelhos foram concedidos pelo Setor de Cunicultura do Departamento de Zootecnia/CCA/UFC.
6.4. Avaliação do sêmen e obtenção do plasma seminal
pela porcentagem de espematozoides móveis. No presente estudo, foram utilizados somente os ejaculados que apresentaram vigor e motilidade igual ou superior a 3 e 70 % (IRRG, 2005). Para determinação da concentração espermática foi utilizada a contagem de células em câmara de Neubauer, após diluição de 20 µL de sêmen em 2 mL de solução formol-salina (1:100), por intermédio de microscopia óptica sob aumento de 400x. Posteriormente, as amostras foram centrifugadas (700 g, 4 ºC, 15 min.) para separação do pellet espermático, e, o sobrenadante, centrifugado novamente (5000 g, 4 ºC, 60 min.) para remoção de debris e o plasma seminal armazenado em tubos eppendorff a 18 C até que se procedessem as análises. Para a determinação da concentração de proteínas no plasma seminal foi utilizado o método descrito por Bradford (1976).
6.4.1. Morfologia espermática
Para exame da morfologia espermática (Figura 1) foram confeccionados esfregaços corados com azul de bromofenol para quantificação de defeitos totais, maiores e menores, sendo contadas 200 células sob aumento de 1000x em objetiva de imersão (Blom, 1983).
Figura 1 Morfologia espermática
Cauda enrolada Macrocefalia
6.4.2. Teste de funcionalidade de membrana (HOST)
A funcionalidade de membrana foi avaliada utilizando-se uma solução hiposmótica contendo 1 % de eosina e nigrosina, onde foi possível avaliar as integridades das membranas tanto da cabeça como da cauda do espermatozóide, de acordo com a metodologia descrita por Ducci et al. (2002). Uma aliquota de semên (40
µL) foi diluí a em banho -
maria a 37 °C, por 15 minutos. Após o período de incubação, uma alíquota contendo 20 pensão foi adicionada a uma solução de fixação para posterior avaliação em microscópio óptico, sob o aumento de 400x. Foi contado um total de 200 células em cinco diferentes campos da lâmina. Foram observadas quatro categorias de células:
1. Cabeça não corada com cauda enrolada, espermatozoide viável; 2. Cabeça não corada com cauda reta, espermatozoide inviável; 3. Cabeça corada cauda enrolada, espermatozoide inviável; 4. Cabeça corada com cauda reta, espermatozoide inviável.
6.4.3. Teste de vitalidade
No que se refere ao teste de vitalidade, uma alíquota de 20 µL do sêmen foi diluída no corante azul de tripan 0,2 % (preparado a partir de uma solução estoque com 0,4 % de azul de tripan (Invitrogem) diluída com 0,9 % de NaCl, 1:1), de acordo com a metodologia descrita por Kovács e Foote (1992). As amostras foram incubadas em banho maria a 37 C, por 30 minutos e em seguida, os esfregaços confeccionados. Um total de 200 células foi avaliada, sendo identificadas como coradas (mortas) e não coradas (vivas).
6.4.4. Teste de integridade da membrana acrossômica
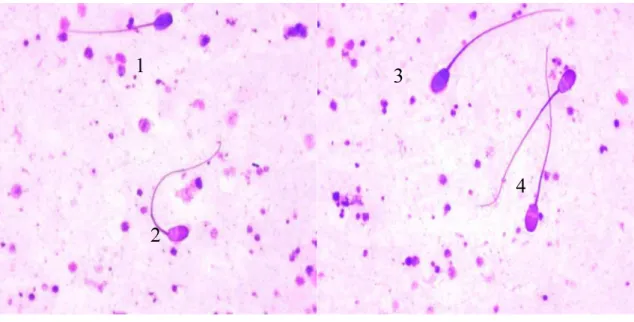
Para esse teste, foram utilizadas as lâminas confeccionadas no teste de vitalidade, fazendo uma associação de dois corantes, azul de tripan e giemsa, segundo a metodologia de Kovács e Foote (1992). Os esfregaços foram incubados em uma solução contendo 0,5 % do corante giemsa por 8 horas . Na manhã seguinte, as lâminas foram retiradas da solução, lavadas com água corrente e água destilada, permanecendo na água destilada por 2 minutos e, posteriormente, secadas à temperatura ambiente. A integridade acrossômica foi avaliada por meio da contagem de 200 células, utilizando-se microscopia óptica sob objetiva de imersão (1000). Foram contadas as células com acrossoma corado (membrana acrossômica danificada) ou não corado (membrana acrossômica intacta) (figura 3). Foram identificadas 6 categorias de células diferentes e agrupadas em:
1. Célula viva com acrossoma íntegro; 2. Célula viva com dano no acrossoma; 3. Célula viva sem acrossoma;
Figura 3 Tipos de células encontradas no teste de integridade da membrana acrossômica
6.5. Eletroforese bidimensional do plasma seminal
Amostras de plasma seminal cujo ejaculado apresentou um vigor 3 e motilidade 70 % foram misturadas, formando pools de diferentes coletas para cada animal, individualmente. Para preparação dos mapas protéicos, um volume desse "pool" misturado ao tampão de reidratação (7 M uréia, 2 M tiouréia, 2 % CHAPS, 10 % glicerol, 2 % de anfólitos na faixa de pH 3 a 10 NL, 25 mM DTT e 0,002 % de azul de bromofenol), perfazendo um volume total
de 340 das foram adicionada às canaletas incubada com
minutos cada, em solução de equilíbrio (6 M de uréia, 50 mM de Tris-HCl, 29,3 % de glicerol, 2 % SDS). A primeira, adicionada de 1 % de DTT, com o objetivo de reduzir as proteínas, enquanto na segunda, o DTT foi substituído por 2,5 % de iodocetamida, de forma a remover o DTT e alquilar as proteínas. As proteínas foram separadas em géis de poliacrilamida com malha de 17,5 %, com base em sua massa molecular. Em seguida, os géis foram fixados (ácido acético e etanol) por aproximadamente 15 horas e, em seguida, corados com Coomassie Blue Coloidal (G250) por 72 horas, de acordo com a técnica originalmente descrita por Candiano et al. (2004) e posteriormente modificada no laboratório digitalizados e analisados pelo programa PDQuest (Bio-Rad Laboratories), conforme metodologia descrita por Souza et al. (2012). Os géis foram fixados por 14 horas em uma solução contendo ácido fosfórico (2 %) e etanol (30 %). Na manhã seguinte, os géis foram lavados por 20 minutos (3X) em uma solução aquosa contendo 2 % de ácido fosfórico e posteriormente transferidos para uma solução com ácido fosfórico (2 %), etanol (18 %) e sulfato de amônio por 20 minutos. A essa solução, foram acrescentados 2 mL de Coomassie Blue G-250 (2 %) por gel. Os géis permaneceram em solução por 72 h, em seguida lavados e digitalizados. Os reagentes utilizados na eletroforese e coloração dos géis foram adquiridos da Bio-Rad Laboratories (USA), GE Lifesciences (USA) e/ou Sigma-Aldrich (USA).
6.6. Análise computadorizada das imagens
usadas como pontos de referência para que as proteínas fossem bem adaptadas em cada membro do match set. Para a quantificação dos spots as imagens foram normalizadas utilizando a intensidade total dos spots e as quantidades de proteínas foram apresentadas como parte por milhão (ppm) do total a densidade óptica integrada dos sopts de acordo com o PDQuest®.
6.7. Digestão dos spots protéicos dos geis bidimensionais
As proteínas separadas por eletroforese bidimensional foram submetidas à digestão com tripsina conforme descrito por Moura et al., (2010) e Santos et al. (2014). Os spots selecionados foram cortados individualmente de três géis em pedaços de aproximadamente 1 mm3 e transferidos para tubos limpos. Para remoção do corante e do SDS, os spots submetidos a lavagens com 400
bicarbonato de amônio (50 % a 25 mM, pH 8,0) ficando nesta solução por 16 horas. Os spots foram desidratados com 200
à temperatura ambiente. As proteínas foram incubadas por 20 horas, a 37 ºC, com solução contendo tripsina (Promega cat.# V5111, Madison, WI, USA), ácido acético 50
eptídeos foram extraídos com ácido trifluoroacético (TFA) 5 % acetonitrila 50 %, por 30 minutos e sendo submetidos a três lavagens. Os sobrenadantes foram acondicionados em micro tubos e concentrados a vácuo "speed m pedaço de gel em branco, sem spots, e um pedaço de albumina do marcador do peso molecular também foram submetidos ao mesmo procedimento e utilizados como controle positivo e negativo, respectivamente.
6.8. Identificação das proteínas por espectometria de massa (Electrospray ionization quadropole-time-of-flight) e busca em banco de dados.
respectivamente, por MS/MS de íons de busca. No entanto, as IDs dos peptídeos foram aceitos apenas se os valores.
observados estivessem dentro de 0,1 Da da massa teórica da ID do candidato, como determinado e revistos manualmente os resultados das pesquisas no MASCOT.
9.9. Análise de ontologia gênica
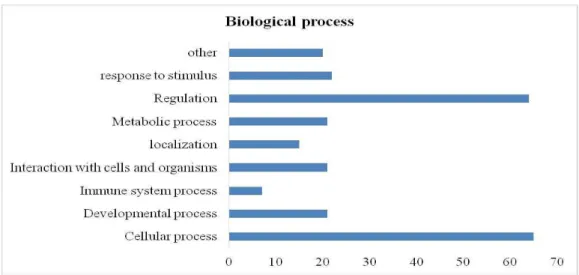
A lista de proteínas do plasma seminal obtidas através da busca no banco de dados MASCOT foram analisadas quanto as suas funções usando o software (STRAP), que é uma aplicação de códigos abertos (Bathia et al., 2009; Santos et al., 2014; Rego et al., 2014). Os termos para a ontologia gênica associado ao processo biológico, componente celular e função molecular foram obtidos a partir de bancos de dados da EBI GOA e UniProtKB.
6.10. Análise estatística
As associações entre os parâmetros dos espermatozoides ejaculados e a expressão das proteínas do plasma seminal dos coelhos foram estimadas por modelos de regressão múltipla usando o procedimento REG do aplicativo estatístico SAS (v.9.0, 2002) com a seleção STEPWISE, segundo NGO (2012); todos os modelos foram
1x1 2x2 kxk
y é a variável dependente. Estimativa do parâmetro espermático que varia em função das variações nas intensidades das proteínas seminais;
1 k são as estimativas de cada variável independente. São constantes que indicam o quanto cada variável independente influencia positiva ou
7. RESULTADOS
7.1. Parâmetros seminais
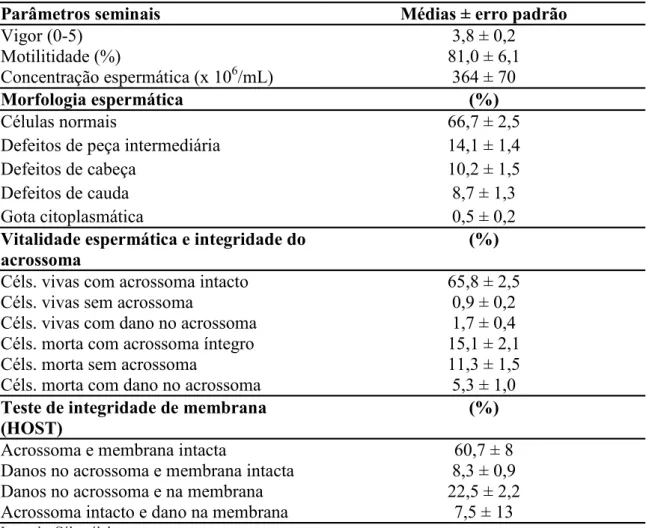
Os parâmetros seminais avaliados encontram-se sumarizados na tabela abaixo: Tabela 1. Média ± erro padrão dos parâmetros vigor, motilidade total, concentração espermática, morfologia espermática, vitalidade espermática e integridade do acrossoma e teste de integridade de membrana espermática do sêmen de coelhos.
Parâmetros seminais Médias ± erro padrão
Vigor (0-5) 3,8 ± 0,2
Motilitidade (%) 81,0 ± 6,1
Concentração espermática (x 106/mL) 364 ± 70
Morfologia espermática (%)
Células normais 66,7 ± 2,5
Defeitos de peça intermediária 14,1 ± 1,4
Defeitos de cabeça 10,2 ± 1,5
Defeitos de cauda 8,7 ± 1,3
Gota citoplasmática 0,5 ± 0,2
Vitalidade espermática e integridade do
acrossoma (%)
Céls. vivas com acrossoma intacto 65,8 ± 2,5
Céls. vivas sem acrossoma 0,9 ± 0,2
Céls. vivas com dano no acrossoma 1,7 ± 0,4 Céls. morta com acrossoma íntegro 15,1 ± 2,1
Céls. morta sem acrossoma 11,3 ± 1,5
Céls. morta com dano no acrossoma 5,3 ± 1,0 Teste de integridade de membrana
(HOST) (%)
Acrossoma e membrana intacta 60,7 ± 8
Danos no acrossoma e membrana intacta 8,3 ± 0,9
Danos no acrossoma e na membrana 22,5 ± 2,2
Acrossoma intacto e dano na membrana 7,5 ± 13
Legenda: Céls. células
7.2. Proteínas no plasma seminal
Em média, foram identificados 232 ± 69,5 spots (Figura 2) no plasma seminal de coelhos, dos quais 34 encontravam-se consistentemente presentes em todos os géis. Apesar desses 34 spots corresponderam a apenas 15 % do número total de spots, representaram 32 % da densidade óptica de todos os spots detectados nos mapas. Através da técnica de espectrometria de massa foi possível identificar 95 % de todos os spots detectados nos géis (220 spots em um total de 232 spots), o que correspondeu a 90 proteínas diferentes. Todas as proteínas identificadas encontram-se na tabela 2. As principais proteínas foram anexinas, zeta-globulina, lipocalinas, serpinas, aldose reductase, galectina 1, Fator de cescimento do nervo , glutationa S transferase, heat shock proteins 70 e 90 kDa, albumina, dentre outras.