centro de ciˆ
encias exatas e da terra
departamento de f´ısica te´
orica e experimental
programa de p´
os-graduac
¸˜
ao em f´ısica
CONDUC
¸ ˜
AO ELETR ˆ
ONICA E PROPRIEDADES
TERMODIN ˆ
AMICAS DA MOL´
ECULA DE DNA
RICARDO GONDIM SARMENTO
Orientador: Prof. Dr. Umberto Laino Fulco
Co-Orientador: Prof. Dr. Eudenilson Lins de Albuquerque
CONDUC
¸ ˜
AO ELETR ˆ
ONICA E PROPRIEDADES
TERMODIN ˆ
AMICAS DA MOL´
ECULA DE DNA
Tese de doutorado apresentada ao Departamento de F´ısica Te´orica e Experimental da Universidade Federal do Rio Grande do Norte como requisito parcial `a obten¸c˜ao do grau de Doutor em F´ısica.
Orientador: Prof. Dr. Umberto Laino Fulco
Co-Orientador: Prof. Dr. Eudenilson Lins de Albuquerque
CONDUC
¸ ˜
AO ELETR ˆ
ONICA E PROPRIEDADES
TERMODIN ˆ
AMICAS DA MOL´
ECULA DE DNA
Tese apresentada ao Departamento de F´ısica Te´orica e Experimental da Universidade Fe-deral do Rio Grande do Norte como parte dos requisitos para a obten¸c˜ao do t´ıtulo de Doutor em F´ısica
BANCA EXAMINADORA
Prof. Dr. Umberto Laino Fulco (UFRN)
Prof. Dr. Eudenilson Lins de Albuquerque (UFRN)
Prof. Dr. Rodrigo Andr´e Caetano (UFAL)
Prof. Dr. Ewerton Wagner Santos Caetano (IFCE)
Prof. Dr. Luciano Rodrigues da Silva (UFRN)
Deus, pela for¸ca concedida para alcan¸car os objetivos.
Aos Meus Pais, Albenes Gomes Sarmento
e Geracina Pinto Gondim Sarmento, que acreditam em mim.
A maior recompensa do nosso trabalho n˜ao ´e o que nos pagam por ele, mas aquilo em que ele nos transforma.
(John Ruskin).
Finalizando esta tese de doutorado, n˜ao poderia deixar de registrar o mais profundo agradecimento a todos aqueles que me apoiaram nesta longa jornada e colaboraram para a consolida¸c˜ao deste trabalho.
Ao Prof. Dr. Umberto Laino Fulco, o meu agradecimento por toda a disponibilidade e orienta¸c˜ao prestada.
Ao Prof. Dr. Eudenilson Lins de Albuquerque pela oportunidade, ensinamentos, ori-enta¸c˜oes durante as minhas p´os-gradua¸c˜oes e pela confian¸ca depositada. Acima de tudo, um profissional dedicado e apaixonado pela f´ısica, que mant´em seu compromisso em formar no-vos cientistas, compartilhando o seu conhecimento e sua experiˆencia, fornecendo os recursos imprescind´ıveis para forma¸c˜ao de um profissional de excelˆencia.
Aos professores participantes da banca examinadora.
Aos meus pais, Albenes Gomes Sarmento e Geracina P. Gondim Sarmento, por terem acreditado e fornecido condi¸c˜oes para que eu conclu´ısse mais uma etapa desta vida, s˜ao para vocˆes, minha gratid˜ao, meu reconhecimento e minhas conquistas.
A Teresa Cristina Ferreira da Silva, pelo companheirismo, dedica¸c˜ao e incentivo ofere-cido antes, durante e, seguramente, por toda a minha trajet´oria de vida e curso profissional.
A Renato Gondim Sarmento e Yasminie pela compreens˜ao e apoio, vocˆes foram muito importante na minha caminhada, meus sinceros agradecimentos.
A minha tia Lurdes Gondim Ferreira e fam´ılia pelo exemplo de vida, crescimento hu-mano, apoio e persistˆencia de colher um futuro melhor atrav´es dos estudos. A tia Lila pelo
A minha av´o, Maria P. Gondim (in memoriam), pelas palavras de carinho que sempre vieram nas horas certas. Um exemplo a ser seguido, pela bondade, justi¸ca e perseveran¸ca em acreditar que dias melhores viriam, com seu ’conhecimento de sabedoria’ - que ensinando-me a coragem de prosseguir, fazendo o ensinando-melhor poss´ıvel a mais profunda dedica¸c˜ao por suas s´abias li¸c˜oes de esperan¸ca; sempre repetindo palavras essenciais - como, por exemplo, amor, f´e, compreens˜ao, alegria - infundiram-me a confian¸ca necess´aria para realizar os meus sonhos. Que sua saudosa mem´oria, em seu ”querer bem”, ainda refletem tanta luz e gosto para minha vida, um amor especial.
A todos meus colegas que mesmo longe, ou de perto, incentivaram com a coragem em especial a Willian de Souza Santos, Walmir Belinato e Carla Fabiana Cerqueira Machado.
Aos amigos e colegas da p´os-gradua¸c˜ao Nilton Ferreira Fraz˜ao, Edvan Moreira, Edi Rozembergh Brasileiro Brand˜ao, Carlos Humberto Oliveira Costa, Gislene Micarla Borges de Lima, Lindon Johnson Freitas Rodrigues, Gabriel Alves Mendes, Antˆonio de Macedo Filho, Maur´ıcio Lopes de Almeida, Leonardo Mafra Bezerril e Ubiratan Correia Silva pela agrad´avel convivˆencia e contribui¸c˜oes sublimes em pesquisar e ensinar a F´ısica durante a trajet´oria de 4 anos na UFRN.
A secret´aria da p´os-gradua¸c˜ao Celina Pinheiro pela aten¸c˜ao e prontid˜ao.
A CAPES e o CNPQ pela concess˜ao da bolsa de doutorado.
Por fim agradecemos a todos que, de forma indireta, tamb´em contribu´ıram para a materializa¸c˜ao desta tese.
Nesta tese, estudamos as propriedades termo-eletrˆonicas da mol´ecula de DNA. Para tal prop´osito, fizemos uso de trˆes tipos de modelos com o DNA, todos assumindo uma geome-tria plana (2D), constru´ıdos cada um atrav´es das sequˆencias quase-peri´odicas (Fibonacci e/ou
Rudin-Shapiro) e de uma sequˆencia de DNA natural, parte do cromossomo humano Ch22 .
Os dois primeiros modelos apresentam dois tipos de componentes que s˜ao: as bases nitrogena-das (Guanina G, citosina C, Adenina A e Timina T) e um grupamento a¸c´ucar-fosfato (SP), enquanto o terceiro modelo apresenta somente as bases nitrogenadas. No primeiro modelo cal-culamos as densidades de estados utilizando o formalismo de Dyson e as transmitˆancias pela equa¸c˜ao de Schr¨odinger independente do tempo. No segundo modelo fizemos uso do processo de renormaliza¸c˜ao para obtemos os perfis das transmitˆancias e consequentemente as curvas I (corrente) × V (voltagem). No terceiro modelo calculamos as densidades de estados pelo for-malismo de Dean e utilizamos os resultados juntamente com a estat´ıstica de Fermi-Dirac para obtemos os potenciais qu´ımicos e os calores espec´ıficos quˆanticos. Finalmente, comparamos as propriedades f´ısicas encontradas para as sequˆencias quase-peri´odicas e para aqueles que utilizam um trecho da sequˆencia genˆomica do DNA (Ch22).
In this thesis, we study the thermo-electronic properties of the DNA molecule. For this purpose, we used three types of models with the DNA, all assuming a flat geometry (2D), each built by a sequence of quasi-periodic (Fibonacci and / or Rudin-Shapiro) and a sequence of natural DNA, part of the human chromosome Ch22. The first two models have two types
of components that are the nitrogenous bases (guanine G, cytosineC, adenine A and thymine
T) and a cluster sugar-phosphate (SP), while the third has only the nitrogenous bases. In the first model we calculate the density of states using the formalism of Dyson and transmittance for the time independent Schr¨odinger equation . In the second model we used the renormali-zation procedure for the profile of the transmittance and consequently the I (current) versus V (voltage). In the third model we calculate the density of states formalism by Dean and used the results together with the Fermi-Dirac statistics for the chemical potential and the quantum specific heat. Finally, we compare the physical properties found for the quasi-periodic sequences and those that use a portion of the genomic DNA sequence (Ch22).
Agradecimentos iv
Resumo vi
Abstract vii
Lista de Figuras xii
Lista de Tabelas xiii
1 Introdu¸c˜ao 1
2 A mol´ecula de DNA 4
2.1 Introdu¸c˜ao . . . 4
2.2 Breve hist´orico sobre a descoberta da estrutura do DNA . . . 5
2.3 A estrutura da mol´ecula de DNA . . . 10
2.4 O modelo da dupla h´elice do DNA . . . 11
2.5 O esqueleto de a¸c´ucar-fosfato . . . 14
3 Transporte eletrˆonico em dupla fita do DNA poly(dG)-poly(dC) 16 3.1 Introdu¸c˜ao . . . 16
3.3 Mecanismos de transporte de cargas . . . 19
3.4 Sequˆencias quase-peri´odicas . . . 20
3.5 Propriedades eletrˆonicas da mol´ecula de DNA . . . 23
3.5.1 Densidade de estado . . . 24
3.5.2 Resultados . . . 27
3.5.3 Transmitˆancia . . . 28
3.5.4 Resultados . . . 29
3.6 Conclus˜oes . . . 30
4 Uma abordagem da renormaliza¸c˜ao para descrever o transporte de carga na mol´ecula de DNA 33 4.1 Introdu¸c˜ao . . . 33
4.2 Resultados num´ericos . . . 39
4.3 Conclus˜oes . . . 40
5 Propriedades termodinˆamicas do DNA 44 5.1 Introdu¸c˜ao . . . 44
5.2 Modelo te´orico . . . 45
5.3 Densidade de estado . . . 47
5.3.1 Resultados . . . 48
5.4 Calor espec´ıfico quˆantico . . . 49
5.4.1 Resultados . . . 51
5.5 Conclus˜oes . . . 53
6 Conclus˜oes e Perspectivas 63 A Apˆendice A 68 A.1 Artigos Publicados e Submetidos . . . 68
2.1 Rosalind Franklin e o padr˜ao de difra¸c˜ao de raios-X do DNA . . . 7
2.2 Prˆemio Nobel de Medicina: James Watson, Francis Crick e Maurice Wilkins . . 9
2.3 As bases nitrogenadas e o nucleot´ıdeo . . . 10
2.4 Duas sequˆencias complementares de DNA . . . 11
2.5 Representa¸c˜ao da estrutura helicoidal do DNA . . . 12
2.6 Estrutura A-,B- e Z-DNA. . . 14
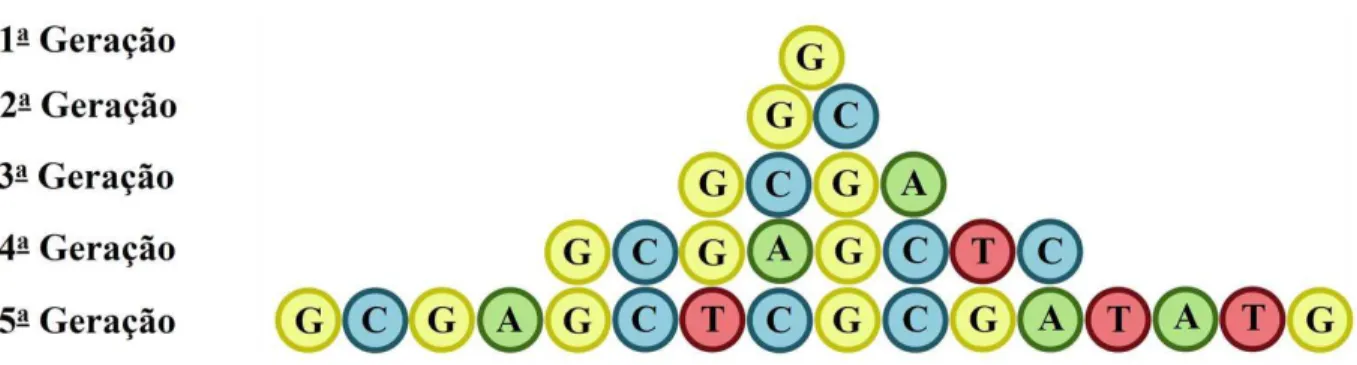
3.1 Esquema de trˆes poss´ıveis mecanismos para transferˆencia de carga no DNA: (a) Tunelamento coerente, (b) Tunelamento incoerente e (c) thermal hopping. O eixo vertical representa a energia E e o eixo horizontal representa a posi¸c˜ao espacial X. 20 3.2 A sequˆencia quase-peri´odica deFibonacci para as primeiras gera¸c˜oes, que crescem seguindo a regra de infla¸c˜ao G→GC e C→G . . . 21
3.3 A sequˆencia quase-peri´odica de Rudin-Shapiro para as primeiras gera¸c˜oes, que crescem seguindo a regra de infla¸c˜ao G→GC,C →GA, A→T C e T →T A. . 22
3.4 Representa¸c˜ao esquem´atica da fita dupla de DNA, incluindo a contribui¸c˜ao do a¸c´ucar-fosfato. . . 23
poly(dG)-poly(dC), correspondente ao n´umero de pares de nucleot´ıdeos NF B =
610 (linha cheia). Para efeito de compara¸c˜ao estamos mostrando tamb´em o DOS de um segmento do DNA natural, como parte do cromossomo humano Ch22
(linha tracejada). . . 31
3.6 O coeficiente de transmitˆancia TN(E) em fun¸c˜ao da energia E, em unidade de eV. 32
4.1 Esbo¸co ilustrando o processo de renormaliza¸c˜ao de uma etapa do mapeamento do modelo DBL da cadeia de DNA. (a) Modelo DBL-DNA para as sequˆencias de
Fibonacci, Rudin-Shapiro e Ch22; (b) Modelo de renormaliza¸c˜ao da mol´ecula de
DNA-DBL ap´os a primeira etapa da decima¸c˜ao. . . 35
4.2 Coeficiente de transmiss˜ao TN(E) em fun¸c˜ao da energia E (em unidade de eV)
para o modelo DBL-DNA considerando as sequˆencias quase-peri´odicas de Fibo-nacci e Rudin-Shapiro, cujos n´umeros de pares de nucleot´ıdeos s˜ao NF B = 34
(linha cheia) eNRS = 32 (linha tracejada), respectivamente. Para efeito de
com-para¸c˜ao, estamos mostrando um segmento de DNA natural, com uma parte do cromossomo humano Ch22, cujo o n´umero de par de nucleot´ıdeo ´e NCh22 = 32
(linha pontilhada). . . 42
4.3 As caracter´ısticas das correntes-voltagens do DBL-DNA para as sequˆencias de
Fibonacci (linha cheia), Rudin-Shapiro (linha tracejada) e do cromossomo hu-mano Ch22 (linha pontilhada). A inser¸c˜ao mostra a diferencial da condutˆancia
dI / dV versos a voltagem V do dispositivo. . . 43
5.1 Modelo de escada estendida para a fita dupla de DNA . . . 45
5.2 Espectro da densidade de estado para a sequˆencia de Fibonacci com 987 pares de nucleot´ıdeos. . . 54
5.3 Espectro da densidade de estado para a sequˆencia de Rudin-Shapiro com 1024 pares de nucleot´ıdeos. . . 55
5.4 Espectro da densidade de estado para a sequˆencia de Ch22 com 1024 pares de
nucleot´ıdeos. . . 56
5.5 Perfil do potencial qu´ımico para sequˆencia deFibonacci. . . 57
5.7 Perfil do potencial qu´ımico para sequˆencia deCh22. . . 59
5.8 Perfil do calor espec´ıfico a volume constante (em unidade de Ne) versos a tem-peratura para Fibonacci. . . 60
5.9 Perfil do calor espec´ıfico a volume constante (em unidade de Ne) versos a tem-peratura para Rudin-Shapiro. . . 61
5.10 Perfil do calor espec´ıfico a volume constante (em unidade de Ne) versos a tem-peratura para Ch22. . . 62
5.1 As energias de ioniza¸c˜ao das bases nitrogenadas e os termos dehopping dos pares de bases complementares (em eV), Ref. [84]. . . 46
5.2 Parˆametros de hopping (em eV) para o modelo de cadeia estendida, ver Fig. 5.1 (Ref. [84]). . . 47
Cap´ıtulo
1
Introdu¸c˜ao
As c´elulas constituem a unidade b´asica dos seres vivos, elas funcionam cooperativamente como parte de um tecido, ´org˜ao ou, independentemente, como um microorganismo unicelular. Nos seres vivos h´a distintos tipos de c´elulas, e cada tipo, desempenha fun¸c˜ao espec´ıfica visando a manuten¸c˜ao da vida no organismo [1].
No organismo as fun¸c˜oes vitais ocorrem precisamente no n´ucleo das c´elulas, nelas en-contramos as informa¸c˜oes gen´eticas necess´arias que s˜ao transmitidas de uma gera¸c˜ao a outra. Estas informa¸c˜oes est˜ao armazenadas em pequenos filamentos espiralados denominados de cro-mossomos. Estes s˜ao constitu´ıdos de ´acido desoxirribonucl´eico, tendo a fun¸c˜ao de coordenar a atividade celular e transmitir as caracter´ısticas heredit´arias. Os ´acidos nucl´eicos est˜ao classifica-dos de dois tipos: Desoxirribo Nucleic Acid (DNA) ou ´acido desoxirribonucl´eico e Ribo Nucleic Acid (RNA) ou ´acido ribonucl´eico, a primeira apresenta na sua composi¸c˜ao qu´ımica o a¸c´ucar denominado desoxirribose e o outro a ribose. A diferen¸ca entre ambos os a¸c´ucares esta na falta e na presen¸ca do ´atomo de oxigˆenio em sua estrutura.
Dentre as maiores descobertas da humanidade, a mol´ecula de DNA tem tanta im-portˆancia que ´e denominada a mol´ecula da vida, pois atrav´es dela conseguimos explicar como as informa¸c˜oes gen´eticas s˜ao copiadas e passadas da c´elula m˜ae para c´elula filha, como tamb´em o processo de muta¸c˜ao, entre outros [1].
Todas as informa¸c˜oes gen´eticas est˜ao armazenadas dentro da c´elula nos genes. Os genes s˜ao denominados as unidades fundamentais da hereditariedade, promovendo as fun¸c˜oes reguladoras ao articularem os aspectos evolutivos, gen´eticos e de desenvolvimento; organizando
informa¸c˜ao codificada para s´ıntese de prote´ına. Cada gene ´e formado por uma sequˆencia es-pec´ıfica mais ou menos longa, de ´acidos nucl´eicos [2].
As tentativas para desvendar os mist´erios do mecanismo desses ´acidos nucl´eicos, em particular o DNA, proporcionou avan¸cos cient´ıficos, principalmente relacionados a sua estrutura, permitindo entender o funcionamento da vida e da perpetua¸c˜ao da esp´ecie [3]. A heran¸ca gen´etica tem sua base molecular nos processos precisos de replica¸c˜ao e transmiss˜ao do DNA, constituindo desse modo as bases moleculares da heran¸ca gen´etica [4].
Os processos f´ısicos e rea¸c˜oes bioqu´ımicas que ocorrem nos organismos vivos s˜ao funda-mentais para seu funcionamento. Estes processos e rea¸c˜oes s˜ao regidos por instru¸c˜oes armaze-nadas em seu genoma, que ´e toda a informa¸c˜ao heredit´aria de um organismo que est´a codificada em seu DNA ou RNA [5].
A mol´ecula de DNA ´e um pol´ımero longo de elevada massa molecular relativa, cons-titu´ıda de quatro monˆomeros denominados de nucleot´ıdeos (guanina G, citosina C, adenina A e timina T) expostos de forma desordenada na mol´ecula. Por exemplo, o cromossomo hu-mano chamadoCh22 apresenta aproximadamente 6 mm de comprimento e 2×108 nucleot´ıdeos,
permanecendo constante em um volume igual a 500 m3 [6]. Essa mol´ecula ´e mensurada em
nanoescala, por ter diˆametro de cerca de 2 nm e a curvatura da h´elice possui cerca de 3,4 a 3,6 nm [7]. A quantidade de informa¸c˜ao armazenada no DNA ´e significante como objeto de pesquisa cient´ıfico-tecnol´ogico em diversas ´areas do conhecimento, pois essa caracter´ıstica da nanoestrutura do DNA permite trabalho na ´area da Nanociˆencia e Nanotecnologia (N & N).
A ascens˜ao do estudo relacionado ao DNA no final do ´ultimo s´eculo vem sendo marcada por descobertas intrigantes representadas pelos avan¸cos de pesquisas fascinantes a respeito da sua nanoestrutura, resultando em grandes progressos no estudo f´ısico e bioqu´ımico do DNA no campo da nanotecnologia.
As possibilidades de aplica¸c˜ao do DNA na ´area da nanotecnologia tˆem sido sugeridas por ser ideal na fabrica¸c˜ao de dispositivo nanoeletrˆonico, uma vez que o DNA possui a caracter´ıstica de autoduplica¸c˜ao. Esta particularidade permite a produ¸c˜ao da sua r´eplica sem a necessidade de utilizar equipamentos, desse modo minimiza investimentos na tecnologia de nanofabrica¸c˜ao [9].
Portanto nesta tese de doutorado, pretendemos estudar algumas propriedades eletrˆonicas da mol´ecula de DNA propondo, inicialmente, um modelo quase-peri´odico da sequˆencia de nu-cleot´ıdeos do DNA e comparando este resultado com as propriedades f´ısicas de uma sequˆencia de DNA encontrada na natureza, o cromossomo 22 do genoma humano Ch22.
No Cap´ıtulo 2 abordamos uma breve hist´orico sobre a descoberta da estrutura do DNA, considerando os seus aspectos bioqu´ımicos e f´ısicos, destacando a fun¸c˜ao do esqueleto a¸c´ ucar-fosfato.
No Cap´ıtulo 3 apresentamos uma s´ıntese dos resultados te´oricos e experimentais da con-dutividade do DNA, bem como os mecanismos de transporte dessa mol´ecula. Em seguida, ana-lisamos as sequˆencias quase-peri´odicas de Fibonacci e Rudin-Shapiro que est˜ao sendo aplicadas para efeito de compara¸c˜ao com a mol´ecula em quest˜ao. E por fim, obtemos duas propriedades eletrˆonicas da mol´ecula de DNA que s˜ao: a densidade de estado e a transmitˆancia.
No Cap´ıtulo 4 aplicamos o processo de renormaliza¸c˜ao para simplificar o sistema, que tamb´em foi modela em termos das sequˆencias j´a pronunciadas. Obtemos o coeficiente de trans-missividade e o perfil da corrente caracter´ıstica I×V da cadeia do DNA.
No Cap´ıtulo 5 investigamos as propriedades termo-eletrˆonicas da mol´ecula de DNA. Inicialmente, calculamos as densidades de estados pelo m´etodo de Dean e utilizamos os resul-tados juntamente com a estat´ıstica de Fermi-Dirac para obter o potencial qu´ımico e o calor especifico quˆantico.
Cap´ıtulo
2
A mol´ecula de DNA
2.1
Introdu¸c˜
ao
No s´eculo XX, as pesquisas sobre os seres vivos demonstraram que no n´ucleo da c´elula de um organismo encontram-se estruturas denominadas de cromossomo, este por sinal ´e constitu´ıdo de prote´ına e DNA. Nas c´elulas, as informa¸c˜oes gen´eticas respons´aveis para o desenvolvimento do seres vivos est˜ao localizadas principalmente na mol´ecula de DNA. Atualmente, o estudo sobre essa mol´ecula trouxe benef´ıcios significativos em ´areas como: a f´ısica, a biom´edica, a gen´etica, agricultura e entre outras; sobretudo, favorecendo o progresso da Nanotecnologia [10]. Nesse contexto, a F´ısica vem desenvolvendo trabalhos cient´ıficos juntamente com outras ciˆencias como; a Biologia e a Qu´ımica, buscando desvendar os mist´erios da mol´ecula da vida.
Neste ˆambito ´e relevante o conhecimento da trajet´oria hist´orica para relatar as in-forma¸c˜oes dos estudos envolvendo a gˆenese at´e os avan¸cos atuais dessa complexa mol´ecula. No s´eculo XIX, os estudos da gen´etica tiveram como seu pioneirismo o botˆanico austr´ıaco Gregor Mendel, em 1865, com os trabalhos dos genes das ervilhas. Posteriormente, foram realizadas investiga¸c˜oes sobre a constitui¸c˜ao qu´ımica, a estrutura e o funcionamento dos genes. Assim, constatou-se o interesse em conhecer a heran¸ca gen´etica, atrav´es do estudo envolvendo o controle gen´etico dos caracteres [11].
O estabelecimento da teoria celular, a descoberta do fator heredit´ario por Mendel e dos genes cromossˆomicos de Morgan [3] trouxeram o contexto necess´ario para a compreens˜ao do estudo gen´etico, proporcionando, no s´eculo XX, o desvendamento das fun¸c˜oes e estrutura
da mol´ecula de DNA. Na d´ecada de 1950, o bi´ologo norte-americano James Watson e o f´ısico britˆanico Francis Crick revelaram a estrutura helicoidal do DNA. O conhecimento da estru-tura ´ıntima do DNA representou um marco na biologia molecular, tendo como consequˆencia, atualmente, algumas aplica¸c˜oes biotecnol´ogicas como os processos de clonagem, os organismos transgˆenicos e o projeto Genoma Humano [5].
Na atualidade, as controv´ersias cient´ıficas relacionadas ao desvendamento e as v´arias pesquisas do DNA remetem ao estudo tanto bioqu´ımico quanto f´ısico, envolvendo o futuro dessa mol´ecula, levando-nos ao pr´ospero e atraente ramo nanotecnol´ogico. Portanto, neste cap´ıtulo procuramos apresentar um breve hist´orico descrevendo os conceitos bioqu´ımicos e f´ısicos envolvendo o DNA. Al´em disso, ser´a destacada a influˆencia do esqueleto a¸c´ucar-fosfato nessa mol´ecula.
2.2
Breve hist´
orico sobre a descoberta da estrutura do
DNA
A trajet´oria dos estudos cient´ıficos envolvendo a descoberta dos genes por Mendel at´e a divulga¸c˜ao da estrutura do DNA por Watson e Crick foi relevante para compreendermos as etapas do conhecimento da mol´ecula da vida. Assim, pretendemos recapitular os caminhos que levaram ao desvendamento da estrutura do DNA.
Os primeiros conceitos de gen´etica, publicados em 1865, foram desenvolvidos por um monge austr´ıaco, Gregor Mendel, que evidenciou atrav´es de cruzamento entre diferentes tipos de ervilhas que certas caracter´ısticas f´ısicas dessas plantas eram transmitidas de gera¸c˜ao para gera¸c˜ao. As distintas caracter´ısticas estariam localizadas e seriam transmitidas em unidades heredit´arias. Os estudos dos genes das ervilhas permaneceram por longo tempo ignorado pela comunidade cient´ıfica [3]. Por´em, ap´os a concep¸c˜ao da estrutura do DNA, foi necess´ario cerca de meio s´eculo a mais para serem descobertos os processos de decodifica¸c˜ao do DNA, a identifica¸c˜ao e reprodu¸c˜ao de genes isolados e, por fim, o projeto Genoma Humano. A seguir ser´a apresentado um esbo¸co sistem´atico da trajet´oria dos estudos envolvendo a mol´ecula de DNA.
e nitrogˆenio, essa combina¸c˜ao era uma substˆancia diferente das prote´ınas conhecidas ent˜ao, ao qual denominou de nucle´ına. Prosseguindo os estudos, em 1889, seu disc´ıpulo Richard Altmann obteve a nucle´ına com alto grau de pureza, comprovando sua natureza ´acida e dando-lhe, ent˜ao, o nome de ´acido nucl´eico [12].
Em 1910, o m´edico e bioqu´ımico russo-americano Phoebus Aaron Levene foi o pioneiro no estudo dos ´acidos nucl´eicos. Ele descobriu no ´acido nucl´eico a presen¸ca de um a¸c´ucar, a ribosa, uma pentose que tinha sido sintetizada por Emil Fischer. Vinte anos depois, Levene constatou que nem todos os ´acidos nucl´eicos continham ribosa, alguns continham um tipo de pentose que n˜ao apresentava um ´atomo de oxigˆenio e a denominou de desoxirribosa. Assim, averiguou-se que havia, portanto, dois ´acidos nucl´eicos: o ribonucl´eico (RNA) e o desoxirribo-nucl´eico (DNA). Albrecht Kossel descobriu que os compostos nitrogenados dos ´acidos desoxirribo-nucl´eicos s˜ao formados por dois tipos de bases: as purinas (composto por dois an´eis fundidos de cinco e seis ´atomos) e as pirimidinas (compostos por um anel de seis ´atomos). A mol´ecula de DNA continha duas purinas (adenina e guanina) e duas pirimidinas (citosina e timina). Na mol´ecula de RNA, a pirimidina (timina) era substitu´ıda por outra, denominada uracila. Durante os anos vinte, a opini˜ao generalizada, era de que o DNA era muito simples, formado de pequenas mol´eculas. Por esse motivo, Levene defendeu que a mol´ecula de DNA n˜ao podia carregar o c´odigo gen´etico.
Ainda em 1910, Thomas Hunt Morgan provou que os genes estavam localizados nos cromossomos, o que confirmou a teoria gen´etica da hereditariedade. Outras contribui¸c˜oes foram os estudos sobre a heran¸ca ligada ao sexo e a recombina¸c˜ao dos fatores relacionada `a influˆencia dos cromossomos e o trabalho de pesquisa com a mosca da fruta (Drosophila melanogaster), demonstrando como os genes poderiam sofrer muta¸c˜oes. No ano de 1913, Alfred Sturtevant da equipe de Morgan, iniciou o mapeamento dos cromossomos. E em 1915, Morgan, Sturtevant, Muller e Bridges publicaram The Mechanism of Mendelian Heredity (O Mecanismo da Heredi-tariedade Mendeliana), no qual relatam experimentos com dros´ofilas e mostram que os genes est˜ao linearmente dispostos nos cromossomas. Esses resultados, destacando a gen´etica, rendeu a Morgan o Prˆemio Nobel de Medicina, em 1933 [3].
letras dos amino´acidos das prote´ınas do que o alfabeto de quatro letras de nucleot´ıdeos do DNA. O fato do DNA de ser o material gen´etico b´asico da c´elula veio a ser confirmado por cientistas posteriores. O trabalho de Avery inspirou v´arias pesquisas sobre a estrutura do DNA, agora conhecida como c´odigo gen´etico.
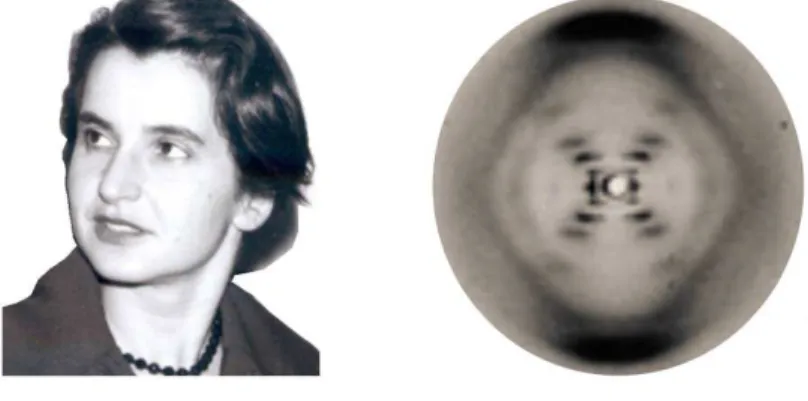
Nos anos 50 aconteceram novas investiga¸c˜oes sobre o DNA a n´ıvel molecular, destacando-se os estudos dos cientistas James Watson e Francis Crick sobre a dupla h´elice do DNA [14]. Contudo, a coopera¸c˜ao cient´ıfica entre outros pesquisadores foi relevante nos estudos do DNA. Os trabalhos paralelos, mas concomitante de cientistas como: Pauling no Institute of Technology na Calif´ornia; Maurice Wilkins, Rosalind Franklin no King’s College em Londres e Watson e Crick na Cambridge University, implicaram no promissor conhecimento do DNA. A contribui¸c˜ao crucial no desvendamento da estrutura do DNA foram `as difra¸c˜oes de raios-X e as medi¸c˜oes desta amostra realizada por Rosalind Franklin [15], ver Fig. 2.1.
Figura 2.1: Rosalind Franklin e o padr˜ao de difra¸c˜ao de raios-X do DNA
em raz˜ao dos desentendimentos [3]. Pauling principiou analisar o DNA com base na copia de imagens mais antigas da difra¸c˜ao dos raios-X, esfor¸cando para findar sua pesquisa sobe o DNA, propˆos uma estrutura helicoidal de trˆes h´elices [16], similar ao primeiro modelo de Watson e Crick.
Peter filho de Linus Pauling foi para Cambridge fazer doutorado com Kendrew. Por interven¸c˜ao dele, Watson e Crick teve conhecimento do artigo publicado por Pauling sobre a estrutura do DNA, no qual estes comentaram que o modelo de Pauling estava incorreto, pois existia um erro b´asico de qu´ımica, que o autor logo perceberia, sendo necess´ario reiniciar as pesquisas.
Em uma conversa com Maurice Wilkins no King’s College sobre o artigo de Pauling, Watson recebeu dele uma c´opia ilustrada do raio-X de uma forma hidratada do DNA (B-DNA), sem o conhecimento de Franklin, e ficou sabendo de sua conclus˜ao de que os fosfatos deveriam estar do lado de fora da h´elice. Esta era muito mais clara e mais n´ıtida que a anterior de Pauling. As imagens e as medi¸c˜oes por ela obtidas foram decisivas na constru¸c˜ao do modelo, pois Watson compreendeu visivelmente que o DNA somente podia ter uma estrutura helicoidal de duas cadeias, com as liga¸c˜oes fosfato-desoxirribosa na parte externa da mol´ecula, o que permitiu que as bases nitrogenadas mais hidrof´obicas se abrigassem no interior da mol´ecula, distante do meio aguoso [3, 14].
No dia 28 de fevereiro de 1953, Watson e Crick na tentativa de modelar a estrutura do DNA fez uso de peda¸cos de cart˜ao simulando as bases (A, C, G e T) para identificar os poss´ıveis modos de intera¸c˜ao. Observou que, os pares de bases A - T e C - G formavam pontes de hidrogˆenio, de modo que os pares tomassem dimens˜oes quase idˆenticas, isto permitiria que a estrutura helicoidal do DNA se mantivesse com o mesmo diˆametro, independente do pareamento de bases no interior. Essa acomoda¸c˜ao dos pares de bases atendeu `a regra proposta por Chargaff, pela qual A tem quantidades equivalentes a T e C tem quantidades equivalentes a G [17]. Depois de trabalharem sobre esse modelo por mais alguns dias, refinando o mesmo para que fosse coerente com os dados de difra¸c˜ao de raios X, eles chegaram ao modelo final.
No dia 25 de abril de 1953, a estrutura do ´acido nucl´eico descoberto por Watson e Crick foi anunciada na revista inglesa Nature, com o t´ıtulo A Struture for Deoxyribose Nucleic Acid, considerada a contribui¸c˜ao mais importante no campo da biologia depois da teoria da evolu¸c˜ao de Darwin e do estudo gen´etico de Mendel [18].
revelou a estrutura do DNA, sendo tamb´em de fundamental importˆancia e reconhecido os es-tudos de Franklin, que ´e mencionada pelos cientistas em seus livros [3]. ´E not´orio que Watson e Crick trabalharam juntos no inicio de suas carreiras na Universidade de Cambridge, aliando seus recursos interdisciplinares com o franco objetivo de ganhar o Prˆemio Nobel, solucionando o mist´erio do DNA. Eles descobriram a estrutura do DNA, a mol´ecula-chave respons´avel pelo milagre da diversidade de seres vivos, embora originados pelo mesmo processo gen´etico. Estes pesquisadores ainda afirmavam existir muitas permuta¸c˜oes numa mol´ecula longa e, portanto, parece admiss´ıvel que o sequenciamento preciso das bases constitui o c´odigo que cont´em a informa¸c˜ao gen´etica; destacando tamb´em que a estrutura proposta deve ser confirmada pela experimenta¸c˜ao [19].
Figura 2.2: Prˆemio Nobel de Medicina: James Watson, Francis Crick e Maurice Wilkins
O descobrimento da estrutura do DNA sinaliza a nova era dos estudos biotecnol´ogicos, pois foi poss´ıvel desvendar o c´odigo gen´etico. Analise da estrutura da prote´ına e os dados de cristalografia de raios-X do B-DNA tornaram-se poss´ıvel o desvendamento da estrutura do DNA e o arranjo covalente do pol´ımero de ´acido nucl´eico.
2.3
A estrutura da mol´
ecula de DNA
O DNA ´e uma macromol´ecula longa formada por seis componentes: uma mol´ecula de a¸c´ucar, um grupamento fosfato e quatro blocos estruturais denominados bases nitrogenadas: adenina, timina, citosina e guanina. Deste modo, constituem um alfabeto gen´etico de quatro letras, respectivamente A, T, C e G, codificando a estrutura prim´aria das prote´ınas. A adenina e a guanina possuem uma estrutura de anel duplo, caracter´ıstica de um composto qu´ımico denominado bases p´uricas (ou pur´ınicas). Enquanto, a timina e a citosina tˆem uma estrutura em anel ´unico, t´ıpico de um composto qu´ımico chamado bases pirim´ıdicas (ou pirimidinas). As quatro bases do DNA tamb´em podem ser colocadas em uma ordem ´unica para cada ser vivo. O esclarecimento deste c´odigo foi significativo para o desvendamento do DNA. A constitui¸c˜ao da mol´ecula de DNA por uma sequˆencia de nucleot´ıdeos - composto equipolar de pentose, um grupo fosfato e uma base (p´urica ou pirim´ıdica) permite a orienta¸c˜ao das liga¸c˜oes entre as trˆes mol´eculas constituintes dos nucleot´ıdeos, ver Fig. 2.3.
Figura 2.3: As bases nitrogenadas e o nucleot´ıdeo
de hidrogˆenio, onde as bases timina e adenina s˜ao sempre emparelhadas por duas pontes de hidrogˆenio e a guanina com a citosina s˜ao sempre emparelhadas por trˆes pontes de hidrogˆenio, veja Fig. 2.4.
Figura 2.4: Duas sequˆencias complementares de DNA
2.4
O modelo da dupla h´
elice do DNA
que os pares de bases deveriam ser formados por bases iguais, adenina-adenina, citosina-citosina, guanina-guanina e timina-timina. Estas forma¸c˜oes entre as bases apresentavam pares de bases de tamanhos distintos e a dupla h´elice tinha um diˆametro muito vari´avel. Ao ter em m˜aos os dados da difra¸c˜ao de raio-X do DNA do tipo B, eles puderam observar que o diˆametro externo da dupla h´elice ´e em torno de 2 nm e a distˆancia entre os a¸c´ucares ´e de 1.1 nm. Atrav´es desses dados deduziu-se que os pares de bases adenina-timina e citosina-guanina teriam os diˆametros exatos para encaixar perfeitamente dentro da dupla h´elice e, al´em disso, os pares de bases estava de acordo com a regra de Chargaff . Desse modo, pode-se observar que a h´elice d´a uma volta completa a cada 3,4 nm, que corresponde a cerca de 10 pares de bases e a distˆancia entre dois pares de bases vizinhos ´e de 0,34 nm, como pode ser visto na Fig 2.5.
Figura 2.5: Representa¸c˜ao da estrutura helicoidal do DNA
comparada a uma escada espiralada com dois corrim˜oes, sendo que os corrim˜oes correspondem `as liga¸c˜oes repetidas de a¸c´ucar-fosfato ao longo de todo o comprimento da mol´ecula.
Ainda com base nestes estudos, concluiu-se que na dupla h´elice as duas fitas est˜ao em dire¸c˜oes opostas, isto significa que s˜ao antiparalelas, ou seja, umas das fitas tem a dire¸c˜ao apropriada da sua s´ıntese 5’ para 3’, enquanto que a outra esta oposta 3’ para 5’[21]. Deste modo, a liga¸c˜ao do a¸c´ucar-fosfato ocorre de modo tal que a posi¸c˜ao 3’ da mol´ecula de a¸c´ucar liga-se ao agrupamento fosfato que, por sua vez, liga-se a posi¸c˜ao 5’ da mol´ecula de a¸c´ucar subsequente, sendo elas antiparalelas [22].
O grupo fosfato conecta-se com pentose atrav´es de uma liga¸c˜ao fosfodi´ester com a hidro-xila ligada ao carbono 5 da pentose. Para a forma¸c˜ao do DNA, ´e necess´ario que ocorra a liga¸c˜ao entre os nucleot´ıdeos, estes formam entre si pontes de fosfato, atrav´es de liga¸c˜oes fosfodi´ester. Essa circunstˆancia determina a forma¸c˜ao da cadeia de DNA. Isto motiva o crescimento do DNA se fa¸ca na dire¸c˜ao 5’ para 3’, como demonstra a Fig. 2.5. Assim, s˜ao feitas as liga¸c˜oes entre os nucleot´ıdeos formando a fita de DNA.
Na literatura existem duas formas de DNA com a h´elice girando para a direita, deno-minadas de A-DNA e B-DNA, e a outra forma de DNA gira para a esquerda e ´e conhecido como Z-DNA, ver Fig 2.6. As distin¸c˜oes das duas formam A-DNA e B-DNA est´a na distˆancia necess´aria para fazer uma volta completa da h´elice e no ˆangulo que as bases fazem com o eixo da h´elice. A forma B-DNA possui a dupla h´elice mais longa e mais fina e cada volta da h´elice possui 10 pares de bases. A forma A-DNA tem caracter´ıstica oposta e a cada volta da h´elice possui 11 pares de bases. Geralmente, o DNA assume a acomoda¸c˜ao B. Quando h´a pouca ´agua dispon´ıvel para interagir com a dupla h´elice, o DNA assume a acomoda¸c˜ao A-DNA. O Z-DNA difere das duas anteriores, j´a que esta configura¸c˜ao ´e mais alongada e mais fina do que o B-DNA. Para completar uma volta na h´elice s˜ao necess´arios 12 pares de bases. O DNA em solu¸c˜ao com altas concentra¸c˜oes de c´ations assume a conforma¸c˜ao Z-DNA [7].
Figura 2.6: Estrutura A-,B- e Z-DNA.
entre o empilhamento de base ajudam a estabilizar a dupla fita de DNA. Desse modo, ainda que as pontes de hidrogˆenio entre os pares de bases sejam liga¸c˜oes fracas, coletivamente elas estabilizam a mol´ecula de DNA [23].
2.5
O esqueleto de a¸c´
ucar-fosfato
O a¸c´ucar-fosfato ´e um componente constante nas mol´eculas de DNA e RNA ´e cons-titu´ıdo por uma pentose (ribose RNA e dexorribose DNA) e um agrupamento fosfato formando o corrim˜ao da h´elice. A sua fun¸c˜ao ´e unicamente estrutural, sendo considerado o esqueleto na mol´ecula de DNA e RNA. Para compreender a influˆencia da camada a¸c´ucar-fosfato nas pro-priedades de transporte no DNA, ´e interessante conceber o a¸c´ucar-fosfato como um suporte, composto alternadamente de a¸c´ucar e fosfato onde ambos s˜ao polares. O a¸c´ucar-fosfato ´e com-ponente na arma¸c˜ao da nanoestrutura do DNA, definindo tamb´em o sentido da fita. Deste modo, O DNA pode ser dividido estruturalmente em duas por¸c˜oes: o a¸c´ucar-fosfato e a base nitrogenada [5].
de DNA facilita observar a acomoda¸c˜ao ocupada pelo esqueleto a¸c´ucar-fosfato externamente na dupla h´elice, apresentando as bases nitrogenadas no interior.
Esse delineamento dos aspectos f´ısicos-qu´ımicos decorrentes da composi¸c˜ao do DNA permite apontar as caracter´ısticas hidrof´ılicas do fosfodi´ester pela presen¸ca da pentose e o car´ater ´acido conferido pelo grupo fosfato. A solubilidade externa do DNA relacionada com meio hidrof´ılico, ou seja, o esqueleto fosfodi´ester e a neutraliza¸c˜ao das regi˜oes eletricamente saturadas atrav´es de pareamentos entre as bases (A-T e C-G) permitiram a existˆencia da regi˜ao hidrof´obica, sem cargas el´etricas livres, localizada no interior do DNA [24].
Desde o descobrimento da estrutura do DNA por Watson e Crick na d´ecada de 1950 at´e os dias de hoje ´e grande a inquieta¸c˜ao envolvendo o desenvolvimento de pesquisas sobre a mol´ecula da vida. Recentemente, constatou-se fisicamente o transporte de el´etrons ao longo da cadeia de DNA, configurando-se em uma tem´atica importante, abrindo novas perspectivas de estudo. A id´eia de utilizar o DNA como um fio condutor molecular para o transporte de cargas ao longo da cadeia ´e um grande avan¸co na nanotecnologia, uma vez que ele tem a capacidade de automontagem. Isto fornece uma vantagem na produ¸c˜ao de dispositivos nanoeletrˆonicos [8], onde tal possibilidade instiga in´umeros trabalhos de pesquisadores delineando a era da nanoestrutura.
Cap´ıtulo
3
Transporte eletrˆonico em dupla fita do DNA
poly(dG)-poly(dC)
3.1
Introdu¸c˜
ao
A mol´ecula de DNA desempenha um papel fundamental como portadora de informa¸c˜oes gen´eticas utilizadas no desenvolvimento e funcionamento dos organismos vivos. Recentemente, os avan¸cos dos estudos a respeito das suas propriedades eletrˆonicas tˆem chamado aten¸c˜ao de v´arios pesquisadores como f´ısicos e qu´ımicos. A principal raz˜ao desse interesse ´e o uso potencial do DNA como dispositivo nanoeletrˆonico, tanto como modelo quanto elemento na montagem de nanocircuitos. Neste cap´ıtulo faremos uma s´ıntese dos resultados te´oricos e experimentais da condutividade do DNA, estudaremos os mecanismos de transporte da mol´ecula de DNA e analisaremos as sequˆencias quase-peri´odicas que est˜ao sendo aplicadas para efeito de compara¸c˜ao com a mol´ecula em quest˜ao e por fim apresentaremos duas propriedades eletrˆonicas da mol´ecula de DNA que s˜ao: a densidade de estado e a transmitˆancia.
3.2
Transporte de cargas no DNA
Os primeiros cientistas a sugerir que o DNA poderia servir como um condutor eletrˆonico foram Daniel Eley e D I Spivey isso ocorreu a mais de 40 anos ap´os a descoberta do DNA por
Watson e Crick. As id´eias desses pesquisadores eram que as intera¸c˜oes π−π entre os pares de base empilhados no DNA possibilitariam um caminho para as migra¸c˜oes das cargas el´etricas [8]. Desde ent˜ao, varias pesquisas foram realizadas no intuito de investigar sobre a dinˆamica de transportes de cargas no interior do DNA, mas para isso consideraram que as extremidades da mol´ecula seriam conectadas a dois el´etrodos um doador e outro receptor. No entanto, os trabalhos desenvolvidos sobre as propriedades eletrˆonicas do DNA permanecem contradit´orios, pois os resultados experimentais s˜ao inconsistentes em rela¸c˜ao a outros estudos que mostravam poss´ıveis comportamentos da referida mol´ecula como condutor [25, 26], isolante [27, 28] e semi-condutor [29, 30, 31, 32].
As primeiras medidas sobre a condutividade do DNA foram realizados por Fink e Schonenberger em 1999. No experimento, os dois pesquisadores aprisionaram a mol´ecula de DNA de 600 nm entre dois el´etrodos, no v´acuo. Ao aplicar uma diferen¸ca de potencial foi constatado que a mol´ecula se comportava como um condutor de resistˆencia de 2.5 MΩ. Neste caso, o DNA comporta-se como um condutor, este resultado traz a possibilidade de utiliza¸c˜ao da mol´ecula de DNA em dispositivos nanobioeletrˆonicos [25, 26].
Em 2000, Pablo e colaboradores mediram a resistˆencia do DNA [27]. A mol´ecula foi depositada em uma superf´ıcie de mica e posto em contato por dois el´etrodos de ouro, um deles fixa e o outro m´ovel. Eles relataram um baixo limite de resistividade de 104 Ω.cm em rela¸c˜ao
ao tamanho do DNA de acordo com o reajuste do el´etrodo m´ovel. Por outro lado, utilizando um m´etodo diferente obtiveram um menor limite de resistividade de 106 Ω.cm. Estes resultados
surgerem que o DNA seja um isolante, entrando em contradi¸c˜ao com os resultados do Fink de ser um bom condutor [25]. Pablo e colaboradores suspeitaram que a amostra do experimento de Fink foi contaminada pelos feixes de el´etrons de baixa energia no v´acuo ocasionando uma diminui¸c˜ao da resistˆencia do DNA. Al´em disso, a estrutura espacial e o estado eletrˆonico da mol´ecula de DNA foram grandemente influenciados pelos el´etrodos [28].
Em 2001, Watanabe e colaboradores tamb´em estudaram sobre a condutividade do DNA e relataram que a mol´ecula se comportava como um semicondutor [29]. Eles depositaram a mol´ecula de DNA em uma superf´ıcie de SiO2/Si (100) e sob um fluxo de g´as nitrogˆenio. As
correntes caracter´ısticas I ×V medidas `a temperatura ambiente por uma separa¸c˜ao de 25 nm entre os eletrodos indicaram que a dupla fita de DNA ´e um semicondutor com voltagem em torno de 2 V. Al´em disso, a tens˜ao de gate reduz esta voltagem significativamente.
os substratos SiO2 e os eletrodos de ouro. Eles observaram uma corrente caracter´ıstica I ×V
quase linear quando os eletrodos estavam separados por 30µm. No entanto, quando a distˆancia entre os eletrodos foram reduzidas para 20 nm, a corrente I×V exibiu caracter´ıstica clara de escadaria, que foi consistente com a previs˜ao te´orica baseado no c´alculo tight-binding.
Outro trabalho relevante foi realizado pelo grupo de Roy em 2008, que detectou o transporte de cargas do DNA de fita dupla, contendo 80 pares de bases, acoplada entre dois el´etrodos SWNT [32]. Eles obtiveram valores das resistˆencias do DNA nos intervalos 25-40 GΩ e 50-65 GΩ respectivamente, em condi¸c˜ao ambiente e a v´acuo (10−5 torr). Estes resultados
confirmam que o DNA ´e um semicondutor.
De acordo com os comportamentos sobre a condutividade do DNA, podem se verificar que a mol´ecula ´e sens´ıvel a qualquer diversifica¸c˜ao das condi¸c˜oes experimentais como: ambiente externo (ar, v´acuo e solu¸c˜ao l´ıquida), o contato entre a interface el´etrodo-DNA, a dopagem do oxigˆenio, a sequˆencia de nucleot´ıdeos da cadeia do DNA, e dentre outros. Em nosso estudo, vamos apresentar relatos de alguns fatores que podem interferir na condutividade.
Lee e colaboradores relataram em seu trabalho a influˆencia da umidade e do oxigˆenio no transporte de cargas no DNA [33]. Estes pesquisadores utilizaram os el´etrodos de Au/Ti em seus experimentos, onde as distˆancias entre eles variaram de 100-200 nm. Eles analisaram a dopagem do oxigˆenio no poly(dG)-poly(dC) e no poly(dA)-poly(dT) e poderam verificar que a dopagem no poly(dG)-poly(dC) aumenta a condutˆancia da mol´ecula de DNA efetuando um maior impacto sobre o transporte de cargas. No caso poly(dA)-poly(dT), o efeito da dopagem do oxigˆenio ocorre ao contr´ario fazendo diminui a condutividade da mol´ecula de DNA.
Kleine-Ostmann e colaboradores estudaram a influˆencia da mol´ecula da ´agua na con-dutividade em ambas as fitas simples e dupla do DNA [34]. Eles descobriram que a mol´ecula de DNA desidratada apresenta uma baixa condutividade que pode ser compar´avel ao de um semicondutor de gap largo. No caso, da mol´ecula de DNA hidratada foi verificado que a con-dutividade aumentava exponencialmente com o aumento da umidade. Este fato se atribu´ıa ao acumulo de ´agua na parte externa da estrutura do DNA, precisamente no fosfato.
3.3
Mecanismos de transporte de cargas
V´arios experimentos e estudos te´oricos tˆem demonstrado que as rea¸c˜oes de transferˆencia eletrˆonica dentro da mol´ecula de DNA podem ser explicadas por uma variedade de processos f´ısicos. Especificamente, escolhemos trˆes principais mecanismos de transporte de carga: tune-lamento coerente, tunetune-lamento incoerente e o thermal hopping.
O processo de tunelamento de el´etrons ocorre do doador para o receptor atrav´es das varia¸c˜oes das energias dos pares de bases. Este processo ocorre da seguinte forma: o buraco (carga positiva) ´e entendido como a menor varia¸c˜ao de energia entre os pares de bases e est´a localizado entre os pares G-C, j´a os pares A-T funcionam como barreiras de potencial para a passagem de buracos. Desse modo, os buracos podem tunelar entre pares de base G-C ao longo da cadeia. Numa situa¸c˜ao em que a carga positiva pode tunelar atrav´es do comprimento total do DNA, a fun¸c˜ao de onda respons´avel n˜ao perde a coerˆencia de fase e o el´etron n˜ao troca energia com a mol´ecula durante a transferˆencia [35, 36]. Este processo ´e conhecido como tunelamento coerente ou de ´unico passo Fig 3.1(a).
No entanto, se o processo de tunelamento ocorre sequencialmente entre pares de base G-C mais pr´oximos, a coerˆencia de fase da fun¸c˜ao de onda ´e perdida durante este processo devido a alguns efeitos de defasagem, tais como espalhamento e vibra¸c˜oes moleculares. O processo mencionado ´e denominado de tunelamento incoerente ou sequencial Fig 3.1(b). Assim como o tunelamento incoerente, othermal hopping´e um processo de v´arias etapas, no qual os portadores de carga saltam diversas barreiras de energia em vez de atravess´a-las, como mostrado na Fig 3.1(c). Geralmente, esse processo necessita de uma quantidade maior de energia t´ermica [37].
Berlin e colaboradores fizeram um estudo te´orico sobre o mecanismo de transportes de tunelamento coerente e de thermal hopping usando o modelotight-binding para os nucleot´ıdeos da cadeia unidimensional [38]. A sequˆencia de DNA foi descrita desta maneira (AT)m−GC−
(AT)n−GC −(AT)m de acordo com o modelo. Estes mecanismos foram analisados atrav´es
da taxa de transporte que s˜ao express˜oes de car´ater exponencial. No primeiro caso, a taxa de tunelamento ´e escrita dessa forma.
R =vtunexp(−βL) (3.1)
Figura 3.1: Esquema de trˆes poss´ıveis mecanismos para transferˆencia de carga no DNA: (a) Tunelamento coerente, (b) Tunelamento incoerente e (c) thermal hopping. O eixo vertical representa a energia E e o eixo horizontal representa a posi¸c˜ao espacial X.
pares de base A-T, a´e a distˆancia entre pares de base, β ´e o coeficiente de decaimento e o vtun
parˆametro de ajuste. No segundo caso, a taxa do thermal hopping deve ser da forma.
R=vthermexp(−kgBGT) (3.2)
Onde gG ´e a energia de separa¸c˜ao entre o n´ıvel de um buraco localizado no par G-C e
na parte inferior da banda de condu¸c˜ao A-T,kB ´e a constante de Boltzmann e T ´e temperatura
em Kelvin. Portanto, o n´umero n de pares de bases A-T tem um valor cr´ıtico N0, quando este
valor ´e superado o thermal hopping torna-se o mecanismo de transporte eletrˆonico dominante, j´a que no tunelamento a transferˆencia de carga decresce exponencialmente com o tamanho do DNA.
As sequˆencias quase-periodicas tˆem sido usadas em um vasto campo de pesquisa prin-cipalmente na nanobiotecnologia. Basicamente, essas sequˆencias constituem um sistema que envolvem dois ou mais blocos distintos que s˜ao empilhados por uma s´erie de gera¸c˜oes que obe-decem a uma regra particular. Na mol´ecula de DNA s˜ao os nucleot´ıdeos G, C, A e T que formam os blocos da sequˆencia quase-peri´odica.
Para estudar as sequˆencias quase-peri´odicas do DNA ´e preciso definir uma sequˆencia de substitui¸c˜ao. Inicialmente, consideramos um conjunto com quatro nucleot´ıdeos ξ (Aqui ξ = G, C, A, T) chamado de alfabeto gen´etico e denotemos por ξ∗ o conjunto de todas as palavras
finitamente longas que podem ser escritos neste alfabeto. Agora consideramos ζ sendo uma proje¸c˜ao de ξ para ξ∗ especificando que ζ atua sobre uma palavra, substituindo cada letra (por
exemplo, G) dessa palavra com a sua imagem correspondente ζ(G). Tal sequˆencia ´e chamada de sequˆencia de substitui¸c˜ao, se for um ponto fixo de ζ, ou seja, se este permanece invariante quando cada letra na sequˆencia ´e substitu´ıda por sua imagem em ζ. Em outra palavra, a sequˆencia ´e obtida simplesmente aplicando infinitas vezes uma regra de substitui¸c˜ao definida para um determinado caso [39]. Neste momento, apresentaremos as regras de constru¸c˜ao de algumas sequˆencias quase-peri´odicas que tˆem atra´ıdo aten¸c˜ao de v´arios campos de pesquisas que s˜ao as sequˆencias quase-peri´odicas de Fibonacci e de Rudin-Shapiro.
A sequˆencia quase-peri´odica de Fibonacci pode ser crescida pela justaposi¸c˜ao de dois nucleot´ıdeos G e C que obedecem a uma sequˆencia de substitui¸c˜ao conhecida na literatura como regra de infla¸c˜ao. Esta regra funciona da seguinte forma: o nucleot´ıdeo G ´e substitu´ıdo pelos elementos GC e o nucleot´ıdeo C ´e substitu´ıdo por G. Escrevendo em termos simb´olicos: G→GC eC →G (lˆe G vai para GC e C vai para G), ver Fig 3.2.
Figura 3.2: A sequˆencia quase-peri´odica de Fibonacci para as primeiras gera¸c˜oes, que crescem seguindo a regra de infla¸c˜ao G→GC e C →G.
Fn−2 (com F0 = 0 e F1 = 1). Observe que em cada gera¸c˜ao o n´umero de guaninas G equivale
ao n´umero deFibonacci para a mesma gera¸c˜ao, isto ´e, na sexta gera¸c˜ao deFibonacci temos que F6 = 8 o qual ´e o mesmo n´umero de guaninas nesta gera¸c˜ao. Al´em disso, a raz˜ao dos n´umeros
de guaninas e citosinas em cada gera¸c˜ao tende ´a raz˜ao ´aurea definida como
xn = FFn+1n = Fn+FFnn−1 = 1 + FFn−n1 = 1 + Fn1 Fn−1
= 1 + x1
n−1, (3.3)
como a sequˆencia xn ´e limitada e monotˆonica crescente ela ´e convergente, portanto,
limxn
n→∞ =
limxn−1
n→∞ = 1 (3.4)
de onde obtemos a seguinte equa¸c˜ao quadr´atica, cuja ´unica solu¸c˜ao positiva ´e denomi-nada de n´umero ´aureo
L2−L−1 = 0 → φ= 1+√5
2 ≈1,61803. (3.5)
A sequˆencia quase-peri´odica de Rudin-Shapiro tamb´em pode ser crescida, mas pela justaposi¸c˜ao de quatro nucleot´ıdeos G, C, A e T de tal forma que a regra de substitui¸c˜ao ´e dada por: G → GC, C → GA, A → T C e T → T A, ver Fig 3.3. Nesta sequˆencia o n´umero de nucleot´ıdeos correspondente a gera¸c˜ao ´e da ordem de 2n−1, onden ´e o n´umero da gera¸c˜ao, isto
´e, na quinta gera¸c˜ao temos 16 nucleot´ıdeos.
Figura 3.3: A sequˆencia quase-peri´odica de Rudin-Shapiro para as primeiras gera¸c˜oes, que crescem seguindo a regra de infla¸c˜ao G→GC, C→GA, A→T C e T →T A.
acordo com a regra que estudamos e a segunda fita segue a complementaridade dos pares de base de Watson e Crick.
3.5
Propriedades eletrˆ
onicas da mol´
ecula de DNA
Para tratar das quest˜oes relacionadas como o comportamento da condutividade do DNA, relatamos nesta se¸c˜ao duas propriedades eletrˆonicas de um segmento de DNA poly(dG)-poly(dC), considerando a sua geometria planar de fita dupla com a inclus˜ao do esqueleto a¸c´ ucar-fosfato (SP), que ´e representado na Fig 3.4.
O Hamiltoniano tight-binding do sistema ´e escrito em termos das bases localizadas.
H =P
n
∈n
SP |n,1i hn,1|+∈nα |n,2i hn,2|+∈nβ |n,3i hn,3|+∈nSP |n,4i hn,4|
+P
n
[V12(α→SP) [|n,1i hn,2|+|n,2i hn,1|]]
+P
n
[V23(α→β) [|n,2i hn,3|+|n,3i hn,2|]]
+P
n
[V34(β →SP) [|n,3i hn,4|+|n,4i hn,3|] +VSS(|n, Si hn, S|)]
+P
n
[V11(SP →S) (|n,1i hn−1,1|) +V44(SP →SP) (|n,4i hn±1,4|)],
(3.6)
onde∈n
SP representa a energia de ioniza¸c˜ao do a¸c´ucar-fosfato e∈nα(α= C ou G) ´e a
ener-gia de ioniza¸c˜ao da respectiva base α localizado no siten. Tamb´em V12(α →SP), V23(α→β)
eV34(β→SP) s˜ao as amplitude dehopping entre primeiros vizinhos na vertical da cadeia, com
α,β= C, ou G, enquantoVSS´e o termo dehoppingno substrato. Al´em disso,V11(SP →S) = VS
e V44(SP →SP) = VSP s˜ao as amplitudes de hopping na horizontal da cadeia. Aqui, a letraS
significa o substrato e SP significa o esqueleto a¸c´ucar-fosfato.
A densidade de estado, bem como a transmissividade eletrˆonica s˜ao calculadas conside-rando que a mol´ecula de DNA ´e colocada em contato entre dois eletrodos de platina. Al´em disso, a mol´ecula ´e organizada numa geometria poly(dG)-poly(dC) seguindo uma estrutura quase-peri´odica de Fibonacci. Os espectros s˜ao ent˜ao comparados com aqueles encontrados a partir de uma sequˆencia genˆomica do DNA, considerando-se o primeiro segmento sequenciado do cromossomo humano 22 (Ch22).
3.5.1
Densidade de estado
A densidade de estado pode ser obtido atrav´es da fun¸c˜ao de Green
(E−H)G(E) =I (3.7)
onde I ´e a matriz identidade eH ´e o Hamiltoniano dado por (3.6).
atrav´es da regra de infla¸c˜ao G → GC e C → G para a primeira fita de DNA. Para a segunda fita de DNA, temos bases complementares, de tal forma que sempre temos um GC ou um par de bases CG.
Para a primeira gera¸c˜ao da sequˆencia de FB, em que apenas a base guanina ´e ligada ao substrato, a fun¸c˜ao de Green leva a:
G(E)−1
=KG+ 2Γ (1), (3.8)
onde
Γ (1) =−LSP S[KS+LST]−1LSP S. (3.9)
AquiT ´e uma matriz de transferˆencia que liga a fun¸c˜oes de Green a dois s´ıtios vizinhos. Al´em disso, LS =−VSSI, I ´e uma matriz identidade 4×4, e KG, KC, KS, LSP S s˜ao matrizes
dadas por
KG =
E− ∈SP −V12(G→SP) 0 0
−V12(G→SP) E− ∈G −V23(G→C) 0
0 −V23(G→C) E− ∈C −V34(C →SP)
0 0 −V34(C →SP) E− ∈SP
(3.10)
KC =
E− ∈SP −V12(G→SP) 0 0
−V12(G→SP) E− ∈C −V23(G→C) 0
0 −V23(G→C) E− ∈G −V34(C →SP)
0 0 −V34(C →SP) E− ∈SP
(3.11)
KS =
E− ∈S −VSS 0 −VSS
−VSS E− ∈S −VSS 0
0 −VSS E− ∈S −VSS
−VSS 0 −VSS E− ∈S
LSP S =
−VS 0 0 0
0 0 0 0 0 0 0 0 0 0 0 −VS
(3.13)
Repetindo o procedimento para qualquer gera¸c˜ao de Fibonacci, observamos uma dife-ren¸ca entre a fun¸c˜ao de Green G(E) para gera¸c˜oes ´ımpares (sequˆencias da primeira fita com termina¸c˜ao G) e pares (sequˆencias da primeira fita com termina¸c˜ao C), ou seja,
G(E)−1 =K
G+ Γ (1) + ∆ (nF B), (3.14)
para as gera¸c˜oes ´ımpares, ondenF B ´e o n´umero de nucleot´ıdeo na fita. Para as gera¸c˜oes
pares temos
G(E)−1
=KG+ Γ (1) + Γ (nF B). (3.15)
aqui
∆ (nF B) = −LSP SP[Ki+ ∆ (nF B −1)]−1LSP SP (3.16)
cuja condi¸c˜ao inicial ´e:
∆ (1) =−LSP S[KS+LST]−1LSP S. (3.17)
A express˜ao para Γ (nF B) pode ser encontrado de forma similar. Vamos agora voltar
nossa discuss˜ao para a determina¸c˜ao da densidade de estado (DOS), definida por:
3.5.2
Resultados
As energias∈α,βs˜ao escolhidos a partir da energia de ioniza¸c˜ao das respectivas bases, ou
seja, ∈G = 7,77 eV (guanina) e ∈C = 8,87 eV (citosina) [22, 40]. Al´em disso, usamos a energia
do eletrodo de platina ∈S = 5,36 eV, que est´a relacionado com a fun¸c˜ao trabalho desse metal
[38], enquanto a energia do esqueleto a¸c´ucar-fosfato ´e ∈SP = 12,27 eV [41, 42]. Os potenciais
de hopping entre a base (G ou C) e o esqueleto a¸c´ucar-fosfato (SP) s˜ao V12(G→SP) =
V34(C →SP) = 1,5 eV [42], enquanto que no substrato (eletrodo de platina) ´e VSS = 12 eV
[42]. Al´em disso, o hopping entre o par de base ´e V23(G→C) = 0,90 eV [42]. O energia de
ioniza¸c˜ao na interface DNA-eletrodo ´e considerado como a diferen¸ca entre o n´ıvel de Fermi da platina e doHOMO (Orbital Molecular Mais Ocupado) do a¸c´ucar-fosfato que ´e dando porVS =
6,91 eV [42]. Finalmente, o potencial de hopping entre os esqueletos a¸c´ucar-fosfato ´e VSP =
0,02 eV [43].
Os espectros da densidade de estados (DOS) para uma mol´ecula de DNA moldada pela sequˆencia quase-peri´odica de Fibonacci, ´e mostrado na Fig 3.5 com fun¸c˜ao da energia (em eV), para o n´umero de gera¸c˜ao de Fibonacci NF B = 12 enF B = 610. O NF B aqui significa o n´umero
de gera¸c˜ao da sequˆencia, enquanto nF B corresponde ao n´umero de pares de nucleot´ıdeos numa
dada gera¸c˜ao da sequˆencia. Estamos mostrando apenas o caso de paridade, mesmo porque o DOS n˜ao ´e sens´ıvel a paridade da sequˆencia deFibonacci, como o seu espectro de calor espec´ıfico [44]. Para efeito de compara¸c˜ao, estamos mostrando a densidade de estado de um trecho do segmento natural do DNA extra´ıdo do cromossomo humano Ch22 (linha tracejada), cujo os
espectros mostram uma not´avel concordˆancia com aquela modelada pela sequˆencia deFibonacci. Embora o DOS para cada gera¸c˜ao como um todo, n˜ao mostra qualquer simetria, apresentamos para os espectros de Fibonacci e Ch22 duas regi˜oes sim´etricas, localizadas em torno da energia
de 7,03 eV (pico I) e 15,35 eV (pico III), respectivamente, al´em de uma assim´etrica em torno de 9,03 eV (pico II).
Embora o pico I n˜ao tem uma correla¸c˜ao direta com as energias de ioniza¸c˜ao das bases (guanina e citosina), o seu valor est´a pr´oximo do termo de hopping da interface eletrodo-DNA, sugerindo uma influˆencia importante para a escolha do substrato sobre a propriedade da densidade de estado do DNA.
na gera¸c˜ao FB, bem como no trecho do cromossomo humanoCh22 seja menor que a guanina, a
sua energia de ioniza¸c˜ao ∈C seja maior faz a diferen¸ca em rela¸c˜ao ao DOS de todo o sistema.
O terceiro pico (pico III) ocorre a um valor aproximadamente igual ao dobro da energia de ioniza¸c˜ao da guanina. Tamb´em podemos observar uma anomalia no espectro do DOS em torno de 10,6 eV, que ´e duas vezes o valor da energia de ioniza¸c˜ao do eletrodo ∈S. Al´em disso,
o DOS em cada n´ıvel de energia aumenta com a gera¸c˜ao de Fibonacci para os intervalos 5,36 < E < 15,98 (em unidade de eV), aproximadamente. Note que este intervalo ´e compreendido entre a energia de ioniza¸c˜ao do substrato ∈S e o dobro da energia de ioniza¸c˜ao do guanina∈G.
No entanto, em torno de 12.5 eV, observamos que o DOS ´e quase nulo para ambos os casos FB e Ch22. Esse resultado pode estar relacionado com o termo de hopping do substrato e /ou a
energia de ioniza¸c˜ao do a¸c´ucar-fosfato, que est˜ao em torno de 12 eV.
3.5.3
Transmitˆ
ancia
Tamb´em reportamos neste cap´ıtulo a condutividade da estrutura quase-peri´odica do DNA poly(dG)-poly(dC). Para este sistema, o coeficiente de transmiss˜ao TN(E) ´e dado pela
taxa de transmiss˜ao da cadeia e est´a relacionada com a resistˆencia de Landauer que ´e definida por [45].
TN(E) =
8 P i,j=1
PNij
16 2 , (3.19)
com PNij =X22−X21X11−1X12. Aqui X ´e a matriz 8×8, convenientemente escrita na
forma particionada com quarto matrizes quadradas Xij(i, j = 1 at´e 4) de ordem 4×4. Este ´e
definida como X =Q−1S−1℘(n)S, com:
Q=
"
e−ikaI 0
0 e−ikaI
#
, (3.20)
S=
"
e−ikaI eikaI
I I
#
, (3.21)
onde k ´e dada por k = cos−1
(E− ∈S)/(2VSS) +
√
5−1
/4
MnMn−1...M2M1, onde Mn ´e a matriz transferˆencia definida por
MN =
"
M(E) −I
I 0
#
, (3.22)
M(E) = (1/VSP)
(E− ∈n
SP) −V12(α→SP) 0 0
−V12(α→SP) (E− ∈nα) −V23(α →β) 0
0 −V23(α→β) E− ∈nβ
−V34(β →SP)
0 0 −V34(β →SP) (E− ∈nSP)
(3.23)
Na express˜ao acima I(0) ´e a matriz 4×4 identidade(nula). Para uma dada energia E, TN(E) mede o n´ıvel de eventos espalhados no transporte de el´etrons (ou buracos) na cadeia.
3.5.4
Resultados
Na Fig 3.6 mostra o espectro de transmitˆancia, em fun¸c˜ao da energia em unidade de eV, para a sequˆenciapoly(dG)-poly(dC)deFibonacci com o n´umero pares de nucleot´ıdeos (nF B)
´e igual a 610 (linha cheia). Para efeito de compara¸c˜ao estamos mostrando tamb´em o coeficiente de transmiss˜ao de um segmento de DNA natural, uma parte do cromossomo humano Ch22
(linha tracejada), cujo espectro est´a novamente de acordo com aquele modelado pela sequˆencia deFibonacci. O espectro de transmitˆancia mostra a energia com ressonˆancia de transmiss˜ao alta [TN (E) = 1] na regi˜ao pr´oxima a 12,9 eV, influenciado pela energia de ioniza¸c˜ao do esqueleto
a¸c´ucar-fosfato. As bandas de transmiss˜ao no espectro tornam-se mais fragmentada `a medida que aumenta o tamanho da cadeia de nucleot´ıdeos (n˜ao mostrado aqui). Esta caracter´ıstica est´a relacionada com a natureza localizada do autoestado do el´etron em cadeias desordenadas.
´
n˜ao correlacionada com algumas propriedades interessantes:
(a) Existem gaps de energias (regi˜oes proibidas) nas regi˜oes (em eV) E<6,3; 7,2 <E< 8,1; e 9,5 < E <12,15.
(b) A transmitˆancia ´e m´axima (pr´oximo de um) em E = 12,9 eV.
(c) Devido `a estrutura robusta a transmiss˜ao vai a zero em grande segmento de DNA.
3.6
Conclus˜
oes
Em resumo, com o objetivo de facilitar a compreens˜ao sobre as propriedades eletrˆonicas de um segmento de DNA, estudamos aqui as propriedades de transporte eletrˆonico das sequˆencias de nucleot´ıdeos finitas dentro de uma abordagem tight-binding da fita dupla de DNA poly(dG)-poly(dC). Embora relevantes, temos negligenciado neste trabalho a topologia da dupla h´elice e o efeito de vibra¸c˜ao fˆonon em nosso modelo. Os resultados est˜ao de acordo quando comparamos as densidades de estados (DOS) da sequˆencia quase-peri´odica de FB com o cromossomo humano Ch22. Al´em disso, estudamos os espectros que mostram al´em de outras propriedades f´ısicas, que
a correla¸c˜ao de longo alcance presente no Ch22 e na sequˆencia FB s˜ao respons´aveis pelo lento
Figura 3.5: Espectros da densidade eletrˆonica de estado (DOS), com fun¸c˜ao da energia (em eV), para a d´ecima quarta gera¸c˜ao de Fibonacci do modelo de fita dupla do DNApoly(dG)-poly(dC), correspondente ao n´umero de pares de nucleot´ıdeos NF B = 610 (linha cheia). Para efeito de
Cap´ıtulo
4
Uma abordagem da renormaliza¸c˜ao para
descrever o transporte de carga na mol´ecula de
DNA
4.1
Introdu¸c˜
ao
O transporte de carga em mol´ecula de DNA atrai consider´avel interesse entre a f´ısica, qu´ımica e a biologia n˜ao s´o devido `a sua relevˆancia, como portador do c´odigo gen´etico de todos os organismos vivos, mas tamb´em como um candidato promissor para a eletrˆonica molecular. Na verdade, o uso de mol´ecula como componente eletrˆonico tem tomado novas dire¸c˜oes na ciˆencia e tecnologia em sistema de escala nanom´etrica, devido `a sua aplica¸c˜ao cient´ıfica e de engenharia [47, 48]. Al´em disso, a mobilidade de carga no DNA tem sua importˆancia com base em contexto biol´ogico [49], bem como sobre os contextos tecnol´ogicos (por exemplo, o uso de DNA em sensores eletroqu´ımicos [50] e em nanotecnologias futuras [51, 52]). Na verdade, a condu¸c˜ao eletrˆonica na mol´ecula de DNA ´e uma investiga¸c˜ao de fronteira em eletrˆonica molecular [27, 53] devido ao seu uso potencial em dispositivos de nanoeletrˆonica, tanto como modelo para as montagens de nanocircuitos, e como elemento de tais circuitos [54, 55].
Embora o uso da mol´ecula de DNA em circuito nanoeletrˆonico ´e muito promissor, devido `a sua automontagem e habilidade de reconhecimento molecular, suas propriedades de condutividades est˜ao ainda sob intenso debate. Diferentes conclus˜oes s˜ao obtidas atrav´es de
v´arios experimentos. No lado te´orico, ambos os c´alculos ab initio [56, 57, 58, 59] e modelos baseados em Hamiltonianos [60, 61, 62, 63, 64, 65] s˜ao amplamente adotados para interpre-tar as diversidades dos resultados experimentais e verificar os mecanismos de transporte de carga. A primeira pode fornecer uma descri¸c˜ao detalhada, mas est˜ao atualmente limitadas as mol´eculas relativamente curtas. O ´ultimo ´e muito menos detalhado, embora permita trabalhar com sistemas com comprimentos maiores. No entanto, a abordagem baseada em modelo pode desempenhar um papel importante, porque agarra geralmente no fundamento f´ısico.
Modelos anteriores de transporte eletrˆonico em mol´ecula de DNA assumem que os canais de transmiss˜ao s˜ao ao longo de seu eixo longitudinal. As intera¸c˜oesπ−πde nucleobases do DNA, formada por uma sequˆencia simb´olica de quatro letra do alfabeto gen´etico: guanina (G), citosina (C), adenina (A), e timina (T) fornecem o caminho para promover a migra¸c˜ao de carga de longo alcance, que em sua vez, d˜ao pistas importantes sobre os mecanismos e fun¸c˜oes biol´ogicas de transporte de carga [66, 67, 68, 69, 70]. Outras melhorias incluem a estrutura do esqueleto a¸c´ucar-fosfato da mol´ecula de DNA de forma expl´ıcita, que reduz a arquitetura do par de bases do DNA em um ´unico site por par, o modelo ´e chamado de espinha de peixe [71, 72]. Mais tarde, Klotsa et al. [73] generaliza o modelo de fishbone do DNA considerando cada base como um s´ıtio distinto, fracamente acoplado por pontes de hidrogˆenio. Como consequˆencia, dois ramos centrais s˜ao assim obtidos, cujos locais interligados representam os pares de bases do DNA, que s˜ao acoplados aos s´ıtios superior e inferior dos esqueletos a¸c´ucares-fosfatos desconectados, dando origem ao chamado modelo (DBL) do DNA.
Neste cap´ıtulo, usamos um modelo Hamiltoniano dentro de uma abordagem da renor-maliza¸c˜ao de uma etapa para descrever as propriedades de transporte de carga numa mol´ecula de DNA-DBL (ver Fig. 4.1). Nossa descri¸c˜ao da mol´ecula de DNA leva em conta as contri-bui¸c˜oes do sistema nucleobase, bem como as mol´eculas do esqueleto a¸c´ucar-fosfato. Para este fim, usamos um modelo Hamiltoniano tight-binding, juntamente com o emprego de uma t´ecnica da matriz de transferˆencia para simplificar a ´algebra. Consideramos um modelo de DNA-DBL seguindo os arranjos de base quase-peri´odicas de Fibonacci (FB) e um deRudin-Shapiro (RS) [39, 74], bem como a sequˆencia de DNA da primeira sequˆencia do cromossomo humano (Ch22)
para efeito de compara¸c˜ao. As varia¸c˜oes resultantes da eficiˆencia do transporte de carga s˜ao analisadas, nessas sequˆencias, computando numericamente as principais caracter´ısticas de seus coeficientes de transmiss˜ao de el´etrons e suas curvas caracter´ısticas I-V.
Figura 4.1: Esbo¸co ilustrando o processo de renormaliza¸c˜ao de uma etapa do mapeamento do modelo DBL da cadeia de DNA. (a) Modelo DBL-DNA para as sequˆencias deFibonacci, Rudin-Shapiro eCh22; (b) Modelo de renormaliza¸c˜ao da mol´ecula de DNA-DBL ap´os a primeira etapa
da decima¸c˜ao. .
em movimento numa geometria composta por duas cadeias interligadas de sites sanduichadas por dois eletrodos met´alicos de platina (doador DN, receptor AC), ver Fig. 4.1a, produzindo
Htotal =HDN A+Heletrodo+Hcontato (4.1)
por [39, 73, 74, 75]:
εn
α,β =∈nα,β +
v(α→SP)2
(E−∈nSP) (4.2)
Aqui ∈n
α,β (α, β = G, C, A ou T) ´e a energia de ioniza¸c˜ao (em unidades de ~) da
respectiva base α, β; v(α →SP) ´e o termo de hopping entre a base α (G, C, A ou T) e o esqueleto a¸c´ucar-fosfato (SP), finalmente, ∈n
SP representa a energia de ioniza¸c˜ao no site n do
orbital a¸c´ucar-fosfato, tendo em conta a natureza da base vizinha, bem como a presen¸ca da mol´ecula de ´agua e/ou contra-´ıons ligado ao esqueleto a¸c´ucar-fosfato.
As energias ∈α,β s˜ao escolhidos a partir das energias de ioniza¸c˜ao de suas respectivas
bases, ou seja, ∈G = 7,77 eV (Guanina), ∈C = 8,87 eV (Citosina), ∈A = 8,25 (Adenina), e
∈T = 9,13 (Timina) [22]. N´os usamos a energia do eletrodo (platina) ∈S = 5,36 eV, que est´a
relacionado com a fun¸c˜ao trabalho desse metal [38], enquanto a energia do esqueleto a¸c´ ucar-fosfato ´e ∈SP = 11,0 eV. Tomamos os termos de hopping entre a base (G, C, A ou T) e o
esqueleto a¸cucar-fosfato (SP) como v = 0,7 eV, enquanto que o hopping entre o par de base vertical(horizontal) da cadeia ´e ω(α→β) = 0,05 eV e (t(α→α) = 0,5 eV), que est˜ao dentro dos intervalos dos valores obtidos por c´alculos de qu´ımica quˆantica [76]. Al´em disso, o hopping
do eletrodo ´e t0 = 12,0 eV [42].
Tendo em conta o procedimento de renormaliza¸c˜ao, o primeiro termo do Hamiltoniano (1) ´e descrito por
HDN A =P n
εn
α|n,1i hn,1|+εnβ|n,2i hn,2|
+P
n
ω(α→β) [|n,1i hn,2|+|n,2i hn,1|] +P
n
t(α →α) [|n,1i hn±1,1|] +P
n
t(β →β) [|n,2i hn±1,2|]. (4.3)
O segundo termo est´a relacionado com os dois eletrodos met´alicos semi-infinitos, lˆe-se:
Heletrodo =
0
P
n=−∞ 2
P
m=1
[∈n
S |n, mi hn, m|+t0|n, mi hn±1, m|]
+ P∞
n=N+1 2
P
m=1
[∈n
S |n, mi hn, m|+t0|n, mi hn±1, m|].