Produção, purificação e caracterização de uma lacase
de Phlebia rufa (Pers.) M. P. Christ.
Dissertação de mestrado em Biologia Clínica Laboratorial
Alice Liliana Alves
Este trabalho foi elaborado com vista à obtenção do Grau de Mestre em Biologia
Clínica Laboratorial apresentada à
Universidade de Trás-os-Montes e Alto Douro.
i
Quero agradecer a todos aqueles que contribuíram para a realização deste trabalho em especial:
-Ao meu orientador Prof. Doutor Rui Manuel Furtado Bezerra e ao meu co-orientador Prof. Doutor José Albino Gomes Alves Dias pelo tema desta dissertação, a ajuda, sugestões, disponibilidade, conhecimentos e esclarecimentos que me foram fornecendo ao longo deste trabalho. Assim como a disponibilidade para as correcções de ultima hora.
-Á técnica de laboratório Irene Fraga por toda a ajuda, disponibilidade, conhecimentos transmitidos, pela paciência e por todas as vezes que me “obrigou a desenrascar-me”, pela amizade e pelos bons momentos passados no laboratório.
-Aos meus colegas do laboratório de Bioquímica Carlos Pinto e Ederson Andrade por todas as discussões instrutivas que tivemos.
-Á Elvira Santos, minha amiga e colega de quarto na residência por toda a paciência, apoio e ajuda quando o computador deixava de funcionar e as coisas “não corriam bem”.
-A minha família por todo o apoio incondicional e força, especialmente a minha mãe Olga por nunca me deixar desistir e me ouvir durante horas, eu sei que as vezes não sou nada fácil. Não posso deixar também de agradecer a minha avó Maria que apesar de já não ver a finalização deste trabalho foi um grande apoio e exemplo a seguir.
-Por fim quero agradecer a todos que de alguma forma contribuíram para a realização deste trabalho.
ii
O objectivo deste trabalho produzir, purificar e caracterizar a lacase segregada pelo fungo
Phlebia rufa. Os seguintes suplementos foram adicionados ao meio basal líquido de Eggert et al.
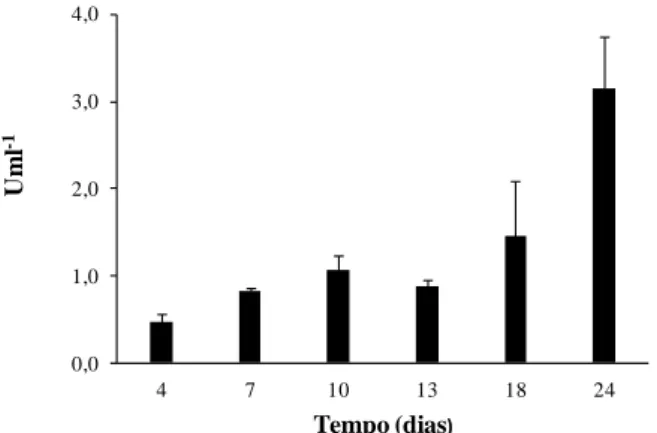
(1996) e testados: trigo, malte, ácido ferúlico e concentração adicional de sulfatos. A enzima foi produzida neste meio líquido com trigo por 24 dias. Durante a incubação a actividade da lacase foi determinada usando ácido 2,2’–azino-bis (3-etilbenzotiazolina-6-sulfonato) (ABTS) como substrato e foi verificada a existência de dois picos com a actividade máxima da lacase depois de 24 dias (3,1 Uml-1). O primeiro pico obtido depois de 10 dias foi recolhido e concentrado por ultrafiltração. O extracto bruto da lacase foi purificado por cromatografia líquida de proteína rápida (FPLC) com um factor de purificação de 8. O rendimento obtido foi de 6%, e a actividade total de 149 U foi determinada. Depois disto a lacase foi caracterizada e encontrado que o pH óptimo depende dos diferentes substratos usados no ensaio.Com ABTS, siringaldazina (SGZ) e 2,6-dimetoxifenol (DMP) o pH óptimo determinado foi de 3,0; 5,0; e 3,5 respectivamente. A massa molecular obtida para a lacase foi de 59 kDa e a energia de activação de 19,6 kj mol-1. Com ABTS como substrato a temperatura óptima foi obtida a 65ºC. O tempo de meia vida (t1/2)
da lacase determinada a 50ºC, 60ºC e 65ºC e os valores obtidos de 5 h, 11 min e 2,5 min respectivamente. A especificidade de 12 substratos foi estudada e os resultados apontam que o ácido ferúlico e o ABTS mostraram uma elevada actividade enzimática enquanto o ácido p-cumárico e o ácido protocatéquico mostraram baixa actividade (apenas 10% e 9% respectivamente, comparado com ácido ferúlico). As constantes cinéticas obtidas mostraram elevada afinidade da enzima para a SGZ (Km = 9,9 µM) seguida pelo ABTS (Km = 23,1 µM) e uma baixa afinidade para o DMP (Km = 555,4 µM). A eficiência catalítica (kcat/Km) tem a mesma ordem de grandeza (107) para o ABTS e SGZ enquanto o DMP tem baixa eficiência catalítica (105). O IC50 mostra que NaN3 é um inibidor mais potente que o NaF e NaCl com
ambos os substratos (ABTS e DMP). O inibidor NaF evidenciou uma inibição não competitiva com ABTS (Kic = Kiu = 46,9 µM) e inibição competitiva (Kic = 2,6 µM) com DMP. Com ABTS a inibição mista foi obtida com azida de sódio (Kic = 5,6 µM e Kiu = 3,4 µM) no entanto com DMP, a inibição não competitiva foi encontrada (Kic = Kiu = 2,5 µM). A inibição obtida com Cl- foi competitiva para ambos os substratos, ABTS (Kic = 1407,5 µM) e DMP (Kic = 375,1 µM).
iii
The aim of this work is to produce, purify and characterize a laccase secreted by the fungus Phlebia rufa. The following supplements added to the basal liquid medium of Eggert et
al. (1996) were tested: wheat, malt, ferulic acid and additional concentration of sulfates. The
higher laccase activity was obtained with wheat grain supplement. The enzyme was produced in this liquid medium with wheat grain for 24 days. During incubation the laccase activity was determined using 2,2' -azinobis(3-ethylbenzathiazoline-6-sulfonic acid) (ABTS) as a substrate and was verified the existence of two peaks with the maximum laccase activity after 24 days (3.1 Uml-1). The first peak obtained after 10 days was collected and concentrated by ultrafiltration. The crude extract of laccase was purified by fast protein liquid chromatography (FPLC) and an overall purification of about 8-fold was achieved. The yield was 6% and total activity of 149 U was determined. After this the laccase was characterized and it was found that the optimum pH depends on the different substrate used in the assay. With ABTS, syringaldazine (SGZ) and 2,6-dimethoxyphenol (DMP) the optimum pH determined was 3.0, 5.0, and 3.5 respectively. The molecular weight obtained for laccase was 59 kDa and the activation energy was 19.6 kJ mol-1. With ABTS as substrate the optimum temperature was obtained at 65ºC. The half-life (t1/2) of
laccase was determined at 50ºC, 60ºC and 65ºC and the values obtained were 5 h, 11 min and 2.5 min respectively. The specificity of the twelve substrates was studied and results pointed out that ABTS and ferulic acid showed higher enzyme activity while the p-coumaric acid and protocatechuic acid showed lower activity (only 10% and 9% respectively, compared with ferulic acid). The kinetic constants obtained showed a higher affinity for enzyme to SGZ (Km = 9.9 mM) followed by ABTS (Km = 23.1 µM) and a lower affinity for the DMP (Km = 555.4 µM). The catalytic efficiency (kcat/Km) had the same magnitude order (107) for ABTS and SGZ while DMP had a lower catalytic efficiency (105). The IC50 showed that NaN3 is a more potent
inhibitor than NaF and NaCl with both substrates (ABTS and DMP). The inhibitor NaF showed a non-competitive inhibition with ABTS (Kic = Kiu = 46,9 µM) and a competitive inhibition (Kic = 2,6 µM) with DMP. With ABTS the mixed inhibition was obtained with sodium azide (Kic = 5,6 µM e Kiu = 3,4 µM) however with DMP non-competitive inhibition was found (Kic = Kiu = 2,5 µM). The inhibition obtained with Cl- was competitive for both substrates, ABTS (Kic = 1407,5 µM) and DMP (Kic = 375,1 µM).
iv Agradecimentos i Resumo ii Abstract iii Indice Geral iv Índice de Figuras vi
Índice de Tabelas viii
Índice de Abreviaturas ix
1 - Introdução Geral 1
1.1 - Descoberta da lacase 1
1.2 - Centros de cobre 2
1.3 - Lacases atípicas 4
1.4 - Reacções características da lacase 5
1.5 - Potencial redox 6
1.6 - Substratos da lacase 6
1.7 - Mediadores da lacase 8
1.8 - Inibidores 10
1.9 - Indutores 13
1.10 - Factores que afectam a produção de Lacase 15
1.11 - Meios de cultura 16
1.12 - Espécies produtoras de lacase 17
1.13 - Phlebia rufa 19
1.14 - Funções da lacase 21
1.15 - Papel da lacase em patologias 22
1.16 - Características físico-químicas da lacase e parâmetros cinéticos 23
1.17 - Imobilização de enzimas 27
1.18 - Aplicações biotecnológicas 28
1.18.1 - Indústria alimentar 28
1.18.2 - Indústria têxtil e do papel 29
1.18.3 - Biorremediação 30
1.18.4 - Aplicações médicas 32
1.18.5 - Outras aplicaçções da lacase 33
1.18.6 - Patentes 34
1.19 - Determinação da actividade da lacase 35
1.20 - Técnicas de purificação da lacase 36
1.22 - Objectivo 37
2 - Material e Métodos 39
2.1 - Fungo 39
2.2 - Meios de cultura 39
2.3 - Determinação da actividade da lacase 41
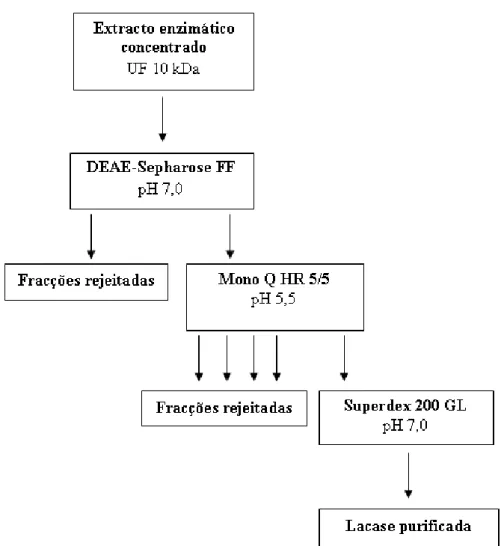
2.5 - Purificação da lacase 41
2.5.1 - Extracto enzimático 41
2.5.2 - Cromatogafia de troca iónica 42
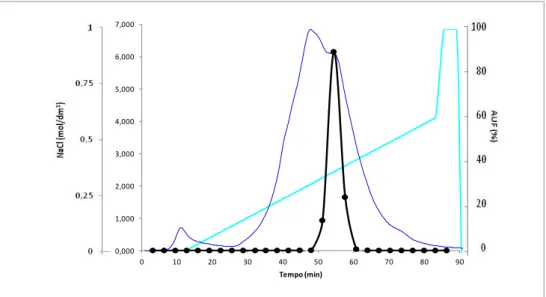
2.5.2.1 - Cromatografia de troca aniónica DEAE-Sepharose FF 42
2.5.2.2 - Cromatografia de troca aniónica MONO Q HR 5/5 43
2.5.3 - Cromartografia de exclusão molecular 43
2.6 - Determinação da temperatura óptima 44
2.7 - Determinação da estabilidade térmica 44
2.8 - Determinação do pH óptimo 44
2.9 - Determinação da proteína 44
v
2.11 - Determinação das constantes cinéticas e efeito dos inibidores 47
2.12 - Análise estatística e tratamento de dados 48
3 - Resultados e Discussão 49
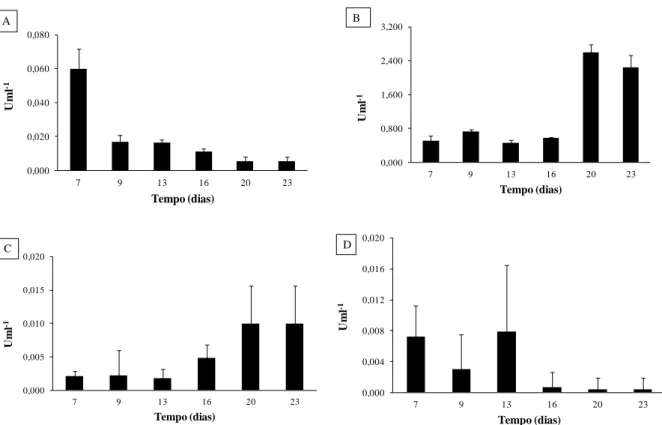
3.1 - Escolha do meio de cultura 49
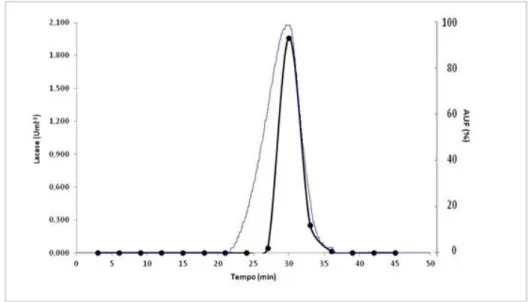
3.2 - Produção de lacase 51
3.3 - Purificação da lacase de P.rufa 52
3.4 - Determinação da massa molecular 58
3.5 - Determinação do pH óptimo 62
3.6 - Temperatura óptima 63
3.7 - Energia de activação 65
3.8 - Estabilidade térmica 66
3.9 - Especificidade do substrato 67
3.10 - Determinação de constantes cinéticas 69
3.10.1 - Determinação do IC50 69
3.10.2 - Cinética da lacase purificada com ABTS, DMP e SGZ. 71
3.10.3 - Estudo da inibição da oxidação do ABTS pelos iões F-, Cl- e N3- 75
3.10.4 - Estudo da inibição da oxidação do DMP pelos iões F-, Cl- e N3- 79
3.10.5- Comparação das constantes de inibição obtidas. 81
4 - Conclusão 85
5 - Perspectivas Futuras 86
vi
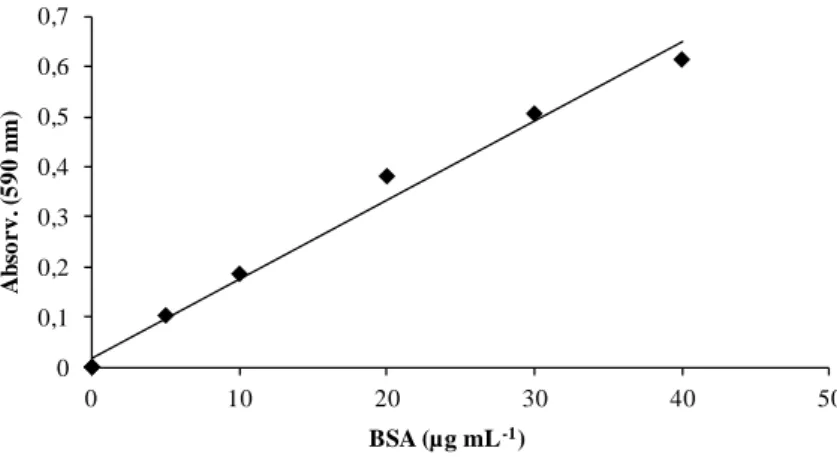
Figura 1 - Modelo do centro catalítico da lacase de Trametes versicolor composto por 4 atomos de cobre distribuídos em 3 centros catalíticos: T2 (a), T3 (b) e T1 (c) e ligados a diferentes ligandos (adaptado de Riva, 2006 e Arora e Sharma 2010). ... 3 Figura 2 - Mecanismo catalítico de acção da lacase: (a) sem a presença de mediador e (b) na presença de mediador (Riva, 2006). ... 9 Figura 3 - Estrutura do mediador ABTS (Gochev e Krastanov, 2007) ... 9 Figura 4 - Phlebia rufa na natureza (Online 1) ... 20 Figura 5 - Recta padrão usada para determinar a proteína solúvel. Equação da recta: proteína (µg ml-1) = 0,0158 x A590+ 0,019; R2 = 0,9877. Intervalo de validade: 5 a 40 µg.ml-1 de proteína. ... 45
Figura 6 - Actividade enzimática da lacase de P. rufa obtida durante 23 dias em meio basal de Eggert suplementado com malte (A), trigo (B), ácido ferúlico (C) e com sulfatos 10x (D). ... 50 Figura 7 - Actividade enzimática da lacase de P. rufa obtida durante 24 dias em meio basal de Eggert suplementado com trigo. ... 52 Figura 8 - Diagrama de purificação da lacase de P. rufa ... 53 Figura 9 - Cromatograma obtido por cromatografia de troca iónica DEAE-FF a pH 7,0 com gradiente linear de 0 a 1 M de NaCl e um caudal de 1 ml.min-1. Proteína: linha fina; actividade lacase: (●); gradiente de NaCl: (-). ... 54 Figura 10 - Cromatograma obtido por cromatografia de troca iónica Mono Q a pH 5,5 e gradiente linear de 0 a 1 M de NaCl e um caudal de 0,8 ml.min-1. Proteína: linha fina; actividade lacase: (●); gradiente de NaCl: (-). ... 55 Figura 11 - Cromatograma obtido por cromatografia de exclusão molecular Superdex 200 a pH 7,0 e caudal de 0,5 ml.min-1. Proteína: linha fina; actividade lacase: (●). ... 55 Figura 12 - Determinação da massa molecular com a coluna Superdex 200 10/30 GL. V0 = 8,0 ml e Ve = 15,0 ml. Recta padrão: Log (Mr) = - 1,5737 x Ve/V0+7,6905. r2 = 0,9889. ... 58 Figura 13 - Determinação da massa molecular da lacase por SDS-PAGE e corado com Comassie blue. Coluna: 1- padrões, 2- lacase sem purificar (ultrafiltração), 3- lacase purificada com a coluna Mono Q HR 5/5 e 4- lacase purificada com a coluna Superdex 200 10/300 GL ... 59 Figura 14 - Recta padrão obtida na determinação da massa molecular por electroforese desnaturante. Log (Mr) = -1,4215 x Rf + 5,1718. r2 = 0,9785 ... 59
Figura 15 - Influência do pH na actividade da lacase com diferentes substratos: (•) ABTS, (■) SGZ e (▲) DMP. ... 62 Figura 16 - Influência da temperatura na actividade da lacase determinada com ABTS e tampão citrato fosfato pH 4,0 ... 64 Figura 17 - Gráfico obtido a partir da transformação linear da equação de Arrhenius (•) dados experimentais, (-) regressão linear. Para a determinação da energia de activação usou-se a equação da recta: Ln v = -2,359 (1/T) + 7,160 (r2 = 0,995). ... 65 Figura 18 - Determinação dos tempos de meia vida a 50 ºC dados experimentais (•) e regressão linear (-) (r2 = 0,976), a 60 ºC dados experimentais (■) e regressão linear (-) (r2 = 0,988) e a 65 ºC dados experimentais (▲) e regressão linear (-) (r2
= 0,998). ... 66 Figura 19 - Representação gráfica da velocidade inicial da reacção de oxidação catalisada pela lacase (v0) em função da concentração do substrato ABTS (pH 4,0) (A), SGZ (pH 5,0) (B) DMP
vii
experimentais. ... 72 Figura 20 - Velocidades iniciais (V0) determinadas com ABTS. (A) inibição com NaN3
modelada com a equação de inibição mista, concentração de inibidor: 0 µM (♦), 2 µM (■) e 4 µM (▲). (B) inibição com NaF modelada com a equação de inibição não competitiva, concentração de inibidor: 0 µM (♦), 10 µM (■) e 30 µM (▲). (C) inibição com NaCl modelada com a equação de inibição competitiva, concentração de inibidor: 0 µM (♦), 2,5 mM (■) e 5 mM (▲). ... 78 Figura 21 - Velocidades iniciais (V0) determinadas com DMP. (A) inibição com NaN3 modelada
com a equação de inibição não competitiva, concentração de inibidor: 0 µM (♦), 2 µM (■) e 4 µM (▲). (B) inibição com NaF modelada com a equação de inibição competitiva, concentração de inibidor: 0 µM (♦), 10 µM (■) e 30 µM (▲). (C) inibição com NaCl modelada com a equação de inibição competitiva, concentração de inibidor: 0 µM (♦), 5 mM (■) e 10 mM (▲). ... 82
viii
Tabela 1 - Colunas de cromatografia utilizadas na purificação da lacase. ... 38
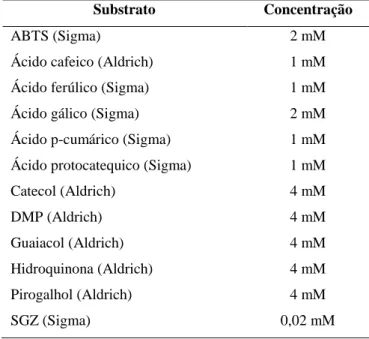
Tabela 2 - Substratos e concentrações usadas para avaliar a capacidade oxidativa da enzima purificada ... 47
Tabela 3 - Resumo da purificação da lacase. ... 56
Tabela 4 - Rendimento e factor de purificação obtido da purificação de várias lacases. ... 57
Tabela 5 - Massa molecular de diferentes lacases determinada por SDS-PAGE e filtração em gel. ... 61
Tabela 6 - Percentagens relativas de consumo de oxigénio associado a oxidação de diversos substratos catalisada pela lacase de Phlebia rufa. ... 67
Tabela 7 - Percentagens relativas de consumo de oxigénio associado a oxidação de diversos substratos catalisada por diferentes lacases. ... 69
Tabela 8 - IC50 determinado para a lacase de P. rufa com vários inibidores ... 70
Tabela 9 - Parâmetros cinéticos obtidos com a lacase de P. rufa ... 71
Tabela 10 - Resumo das constantes cinéticas determinadas por vários autores. ... 73
Tabela 11 - Comparação dos SSE obtidos para diferentes modelos cinéticos com o inibidor NaN3 usando ABTS como substrato. ... 76
Tabela 12 - Resumo dos valores de w e w-f 0,95 obtidos na discriminação dos modelos com o inibidor NaN3 e o substrato ABTS. ... 76
Tabela 13 - Comparação dos SSE obtidos para diferentes modelos cinéticos com o inibidor NaF usando ABTS como substrato. ... 76
Tabela 14 - Resumo dos valores de w e w-f0,95 obtidos na discriminação dos modelos com o inibidor NaF e o substrato ABTS. ... 77
Tabela 15 - Comparação dos SSE obtidos para diferentes modelos cinéticos com o inibidor NaCl usando ABTS como substrato. ... 77
Tabela 16 - Resumo dos valores de w e w-f0,95 obtidos na discriminação dos modelos com o inibidor NaCl e o substrato ABTS. ... 77
Tabela 17 - Comparação dos SSE obtidos para diferentes modelos cinéticos com o inibidor NaN3 usando DMP como substrato. ... 79
Tabela 18 - Resumo dos valores de w e w-f 0,95 obtidos na discriminação dos modelos com o inibidor NaN3 e o substrato DMP. ... 79
Tabela 19 - Comparação dos SSE obtidos para diferentes modelos cinéticos com o inibidor NaF usando DMP como substrato ... 80
Tabela 20 - Resumo dos valores de w e w-f 0,95 obtidos na discriminação dos modelos com o inibidor NaF e o substrato DMP. ... 80
Tabela 21 - Comparação dos SSE obtidos para diferentes modelos cinéticos com o inibidor NaCl usando DMP como substrato. ... 80
Tabela 22 - Resumo dos valores de w e w-f 0,95 obtidos na discriminação dos modelos com o inibidor NaCl e o substrato DMP. ... 81
ix
ABTS Ácido 2,2’–azino-bis (3-etilbenzotiazolina-6-sulfonato)
AUF Unidades de absorvância em escala completa
BSA Albumina do soro bovino
DMP 2,6-dimetoxifenol
Eo Potencial redox padrão
Ea Energia de activação
FPLC Cromatografia líquida rápida de proteínas
HBT 1-Hidroxibenzotriazole
HPLC Cromatografia líquida de alta pressão
IC50 Concentração máxima meia inibitória
Kic Constante de inibição (dissociação do complexo EI)
Kiu Constante de inibição (dissociação do complexo ESI)
Kcat Constante catalítica
Kcat/Km Eficiência catalítica
Km Constante de Michaelis-Menten
Ln Logaritmo natural de base e
Log Logaritmo decimal de base 10
LiP Lenhina peroxidase
Mr Massa molecular relativa
MnP Manganês peroxidase
n Número de pontos experimentais
PDA Potato dextrose agar
pH Escala logaritmica comum da concentração de hidrogénio
p Número de parâmetros do modelo
PVPP Polivinlpolipirrolidina
Rf Mobilidade relativa
R2 Coeficiente de determinação
rpm Rotações por minuto
SGZ Siringaldazina (4-hidroxi-3,5-dimetoxibenzoico)
SSE Soma dos quadrados dos erros
SDS Dodecil sulfato de sódio
SDS-PAGE Electroforese em gel de poliacrilamida com dodecil sulfato de sódio
x
Vmax Velocidade máxima
1
1 - Introdução Geral
1.1 - Descoberta da lacase
A lacase foi inicialmente estudada no Japão na seiva da árvore da laca japonesa Rhus
vernicifera (Morozova et al., 2007; Giardina et al., 2010) e foi descrita pela primeira por
Yoshida em 1883 (Mayer e Staples, 2002; Madhavi e Lele, 2009). A lacase foi uma das primeiras enzimas a ser descrita e estudada (Mayer e Staples, 2002; Morozova et al., 2007; Madhavi e Lele, 2009; Strong e Claus, 2011). Em 1896 foi referido por Bertrand e Laborde (Mayer e Staples, 2002; Madhavi e Lele, 2009) que a lacase era produzida por algumas espécies de fungos. A enzima foi caracterizada como uma oxidase contendo cofactores inorgânicos metálicos que na década de 30 se provou que eram átomos de cobre. O facto da actividade enzimática da lacase estar ligada a 3 centros de cobre sugere que esta enzima é muito antiga uma vez que estes centros metálicos estão evolutivamente relacionados com as primeiras reacções catalisadas (Mayer e Staples, 2002).
A lacase (benzenodiol: oxigénio oxidorredutase EC 1.10.3.2) é membro das oxidases azuis de cobre (proteínas azuis com cobre) também denominadas oxidases “multicopper” que catalisam uma reacção de transferência de electrões a partir de vários compostos e é incluída no grande grupo das polifenoloxidases (Mayer e Staples, 2002; Hildén et al., 2009; Madhavi e Lele, 2009). Este grupo inclui entre outros a ácido ascórbico oxidase e a ceruloplasmina (ferroxidase), para além da tirosinase (catecolase e cresolase) que são muitas vezes confundidas com as lacases no entanto pertencem a sub-grupos diferentes caracterizadas por diferentes especificidades para os substratos (Madhavi e Lele, 2009).
As polifenoloxidases são proteínas de cobre que estão associadas a 3 tipos de actividades (Madhavi e Lele, 2009): i) catecol oxidase ou o-difenolase como o nome sistemático de 1,2-benzenodiol: oxigénio oxidorredutase (EC 1.10.3.1); ii) lacase ou para-difenol: oxigénio oxidoreductase com o nome sistemático de benzenodiol: oxigénio oxidorredutase (EC 1.10.3.2);
iii) cresolase ou monofenol monooxigenase com o nome sistemático de monofenol, L-dopa:
oxigénio oxidorredutase (EC 1.14.18.1).
As polifenoloxidases são capazes de oxidar substâncias fenólicas para iniciar o processo de polimerização, sendo por isso classificadas como polifenoloxidases (Gianfreda et al., 1999). São também capazes de oxidar compostos aromáticos com o oxigénio molecular como aceitador final de electrões (Mayer e Staples, 2002). Entre mais de 200 enzimas que catalisam reacções de oxidases e oxigenases, somente um número muito restrito (Giardina et al., 2010) têm características semelhantes à lacase (eg. L-ascorbato oxidase EC 1.10.3.3, bilirubina oxidase EC
2
1.3.3.5, isofenoxazinona sintase EC 1.10.3.4, citocromo-c oxidase EC 1.9.3.1, ceruloplasmina ou ferroxidase EC 1.16.3.1 e a proteína Fet3). Destas seis enzimas só três têm os mesmos tipos de cobre da lacase (Dias, 2004) na sua estrutura (L-ascorbato oxidase, proteína Fet3 e a ferroxidase).
A lacase é um tipo de polifenol oxidase que cataliza a oxidação de compostos não fenólicos (Arora e Gill, 2000) polifenóis, ortho- e para- difenóis, aminofenóis, metoxi-fenóis, fenilenodiaminas, poliamidas e uma gama considerável de outros compostos bem como alguns iões inorgânicos mas não oxida a tirosina (Minussi et al., 2002; Giardina et al., 2010). As semiquinonas resultantes podem sofrer reacções tanto catalisadas por enzimas ou não, podendo resultar na destruição do anel aromático ou na polimerização. A oxidação de uma grande variedade de substratos aromáticos com redução do oxigénio molecular a água bem como a capacidade de oxidar compostos fenólicos levou a estudos intensivos destas enzimas (Madhavi e Lele, 2009; Giardina et al., 2010).
A maioria das lacases estudadas são proteínas extracelulares monoméricas glicosiladas, havendo também referências a homodímeros. As lacases também podem ser intracelulares, diméricas ou tetraméricas (Minussi et al., 2002; Riva, 2006; Hildén et al., 2009). As lacases diméricas obtidas de Phellinus ribis, Pleurotus pulmonaris e Trametes villosa são constituídas por duas subunidades idênticas com uma massa molecular típica de lacases monoméricas (Baldrian, 2006). Em fungos e bactérias a quantidade de hidratos de carbono existentes na lacase é habitualmente menor (10-25%) quando comparados com os presentes nas enzimas das plantas. É de referir, também, que foram detectadas lacases intracelulares em vários fungos e insectos (Madhavi e Lele, 2009).
1.2 - Centros de cobre
A lacase é uma glicoproteina dimérica ou tetramérica que geralmente possui no centro activo 4 átomos de cobre por monómero, classificados em três grupos de acordo com estudos realizados por ressonância paramágnetica (EPR) e espectroscopia UV/visível (Baldrian, 2006; Couto e Toca-Herrera, 2006; Gochev e Krastanov, 2007; Morozova et al., 2007a; Kunamneni et
al., 2008; Madhavi e Lele, 2009). As técnicas espectroscópicas têm proporcionado mais
informação sobre os mecanismos moleculares das proteínas de cobre (Mayer e Staples, 2002). A lacase possui um cobre tipo 1 (T1), um cobre do tipo 2 (T2) e dois cobres tipo 3 (T3) dispostos numa estrutura trinuclear formando um triângulo isósceles (Baldrian, 2006). A distância entre o centro T2 e T3 da enzima é de 4 e o ião cobre T1 está a uma dist ncia de 2
3
a 4 do centro T2 e T3 (Morozova et al., 2007 b; Strong e Claus, 2011). O cobre do tipo 1 com EPR detectável existe na forma oxidada e está covalentemente ligado a uma cisteína que é responsável pela intensa cor azul destas enzimas tendo uma forte absorção electrónica a 600 nm (Baldrian, 2006; Gochev e Krastanov, 2007; Madhavi e Lele, 2009; Strong e Claus, 2011).
Figura 1 - Modelo do centro catalítico da lacase de Trametes versicolor composto por 4 atomos de cobre distribuídos em 3 centros catalíticos: T2 (a), T3 (b) e T1 (c) e ligados a diferentes ligandos (adaptado de Riva, 2006 e Arora e Sharma 2010).
O cobre T1 tem como ligandos conservados duas histididinas e o grupo sufridilo da cisteína que formam uma estrutura triagonal (Figura 1c) e um ligando variável que pode ser a leucina ou fenilalalina em lacases fúngicas (Morozova et al., 2007a). Este cobre tipo 1 pode ser substituído por mercúrio ou cobalto e sempre que falte um ligando este torna-se relativamente instável (Morozova et al., 2007a; Madhavi e Lele, 2009).
O cobre tipo 2 é um centro de cobre mononuclear incolor, apresentando fraca absorção na região visível, não sendo detectado por absorção electrónica, mas tem EPR detectável (Baldrian, 2006; Gochev e Krastanov, 2007; Madhavi e Lele, 2009). O cobre tipo 2 localiza-se próximo do cobre 3 (Figura 1a), está ligado a 2 histidinas e uma molécula de água, funcionando como aceitador de um electrão (Min et al., 2001; Strong e Claus, 2011). Este cobre é fácil de eliminar durante os processos de purificação mas pode ser reconstituído tanto em condições aeróbias como em anaeróbias. A remoção selectiva do cobre 2 provoca uma elevada perda de actividade enzimática (Morozova et al., 2007a). O cobre 2 tem um papel importante na estabilização da ligação aniónica do cobre 3 no centro activo (Madhavi e Lele, 2009). Um estudo de derivados da lacase provou que o cobre tipo 2 está ligado a 3 átomos de azoto sendo uma molécula de água o quarto ligante de cobre (Madhavi e Lele, 2009). O cobre 3 é um centro de cobre binuclear, constituído por um par de átomos de cobre, não evidenciando sinal EPR e apresenta fraca absorvência a 600 nm, contudo apresenta um espectro UV com um rebordo a 330 nm (Gochev e Krastanov, 2007; Morozova et al., 2007a; Madhavi e Lele, 2009). Este cobre tem como ligandos 6 moleculas de histidina e funciona como aceitador de 2 electrões (Min et al., 2001). Os centros
a )
4
activos do cobre 2 e 3 (Figura 1b) estão juntos e formam um centro trinuclear que esta envolvido no mecanismo catalítico de acção da enzima (Gochev e Krastanov, 2007; Madhavi e Lele, 2009). Vários estudos sugerem que lacases de diferentes espécies têm características catalíticas diferentes ainda que o local catalítico da lacase seja bastante conservado evolutivamente (Gochev e Krastanov, 2007; Madhavi e Lele, 2009). Apesar da estrutura do centro activo ser conservada, o resto da molécula apresenta uma grande variabilidade tanto na estrutura proteica como nos glícidos (Mayer e Staples, 2002) podendo explicar essas diferencias cinéticas apontadas. No entanto, através do estudo de 100 sequências de lacases conseguiu-se identificar 4 regiões L1-L4 características das lacases permitindo-as distinguir das outras oxidases multi cobre. Os 12 resíduos de aminoácidos que servem como ligantes dos cobres (Figura 1) estão localizados nestas regiões conservadas.
1.3 - Lacases atípicas
Como referimos a maioria das lacases apresenta um pico de absorção de UV em torno de 600 nm e possuem 4 átomos de cobre agrupados em 3 tipos que formam o núcleo catalítico da enzima. No entanto nem todas as lacases possuem 4 átomos de cobre por molécula monomérica, assim quando falta o átomo de cobre 1 responsável pelo espectro de absorção azul característico das lacases, estas são chamadas de amarelas ou brancas (Baldrian, 2006; Madhavi e Lele, 2009). No entanto há alguns autores que não as consideram como verdadeiras lacases, ainda que apresentem um leque de substratos semelhantes (Mayer e Staples, 2002; Baldrian, 2006; Giardina et al., 2010).
As lacases amarelas não contem cobre tipo 1, não apresentam a banda de absorção típica de lacases azuis a 600 nm. Estas lacases amarelas, ao contrário das lacases azuis, são capazes de oxidar lenhina não fenólica e álcool veratrílico na ausência de mediadores (Baldrian, 2006; Morozova et al., 2007a; Madhavi e Lele, 2009; Strong e Claus, 2011). A presença de lacases amarelas foi comprovada em Gaeumannomyces graminis, Agaricus bisporus, Schizophyllum
commune, Panus tigrinus, Phlebia radiata, Coriolus versicolor e Phlebia tremellosus (Madhavi
e Lele, 2009; Giardina et al., 2010). A lacase de Phellinus ribis, é outro exemplo de uma lacase amarela, pois não contem cobre T1 e contém um átomo de manganês por molécula (Strong e Claus, 2011).
As lacases brancas à semelhança das lacases amarelas, também não apresentam o espectro de absorção a 600 nm. A presença das lacases brancas foi confirmada em Pleurotus
5
Madhavi e Lele, 2009; Giardina et al., 2010). Em algmas espécies, determinou-se por absorção atómica que esta lacase é constituída por um átomo de zinco, um átomo de cobre e dois átomos de ferro em vez dos típicos 4 átomos de cobre. Pelo contrário o centro activo da lacase branca de
Phlebia radiata possui 2 iões de cobre (centros T1 e T2) e um grupo prostético que parece agir
como centro T3 (Morozova et al., 2007b).
1.4 – Reacções características da lacase
A catálise da lacase ocorre em 3 etapas: i- redução do cobre tipo 1 pelo substrato, ii- transferência de electrões do cobre tipo 1 pelos aminoácidos da cadeia polipeptídica provavelmente através de sequências de tripeptídeos His-Cys-His para o cobre tipo 2 e cobre tipo 3, iii- redução do oxigénio a água no centro activo do cobre tipo 2 e tipo 3 (Baldrian, 2006; Madhavi e Lele, 2009; Brijwani et al., 2010). A reacção característica da lacase (1.10.3.2) é a seguinte:
4 benzenodiol + O2 4 benzoquinona + 2 H2O (Call e M cke, 1997)
Este processo catalítico envolve todos os iões cobre que formam o núcleo catalítico da enzima e resulta na redução de uma molécula de oxigénio a duas moléculas de água sem necessidade de produção de peróxido e acompanhado da oxidação simultânea de 4 moléculas de substrato para produzir quatro radicais (Palmieri et al., 1997; Baldrian, 2006; Riva, 2006; Brijwani et al., 2010; Strong e Claus, 2011). A redução do substrato pela lacase envolve a perda de um electrão e a formação de um radical livre (catião) que geralmente é instável e pode ser oxidado novamente pela lacase ou por reacções não enzimáticas (Minussi et al., 2002; Madhavi e Lele, 2009). Para a redução completa de uma molécula de oxigénio a duas moléculas de água são necessários quatro electrões (Hildén et al., 2009). A transferência de electrões do substrato para o cobre tipo 1 é provavelmente controlada pela diferença de potencial redox, assim um elevado potencial redox da lacase ou um menor potencial de oxidação do substrato pode resultar numa elevada taxa de oxidação do substrato (Madhavi e Lele, 2009).
6 1.5 - Potencial redox
O potencial redox dos 3 centros de cobre (T1, T2 e T3) é a principal característica das lacases. O centro T1 é o mais conhecido e estudado para muitas lacases enquanto os centros T2 e T3 são menos conhecidos (Morozova et al., 2007b).
O potencial redox de lacases fúngicas encontra-se compreendido entre 0,4 V e 0,8 V, no entanto, podem-se dividir a lacases naquelas que apresentam baixo potencial redox (0,4 a 0,6 V) como é o caso de Coprinus cinereus e Thermphila myceliophthora (ambas com 0,45 V), enquanto as que possuem potencial entre 0,6 e 0,8 V são referidos como alto potencial como é o caso de Trametes versicolor, Trametes villosa (0,79 V), Pycnoporus cinnabarinus (0,75 V) e
Botrytis cinerea (0,78 V). Para além destes dois tipos de potencial há autores que ainda
consideram lacases de potencial médio (Gianfreda et al., 1999; Gochev e Krastanov, 2007; Morozova et al., 2007b; Brijwani et al., 2010). O centro T1 na lacase tem um potencial redox de aproximadamente 470-790 mV mas o uso de mediadores permite oxidar moléculas com potencial redox padrão (Eº) acima de 1100 mV (Kunamneni et al., 2008). O cobre tipo 3 tem um potencial de 785 mV (Call e M cke, 1997).
A diferença de potencial redox entre o substrato fenólico e o cobre T1 pode aumentar a oxidação do substrato a valores de pH elevados, contudo a ligação do anião hidroxilo ao cobre T2 e T3 resulta na interrupção da transferência interna de electrões entre o cobre T1 e o cobre T2 e T3 o que resulta numa inibição da actividade da lacase (Madhavi e Lele, 2009). O álcool veratrílico é um substrato que a pH 3,0 tem um potencial redox de 1450 mV enquanto o n-hidroxibenzotriazole a pH 7,0 tem um potencial de 760 mV.
Segundo Palmieri e colegas (1997) o cobre T1 está ausente em lacases que apresentem pH óptimo mais neutro o que evidência a importância do cobre T1 no pH óptimo da enzima (Palmieri et al., 1997). A depleção de iões de cobre pode não só inactivar lacases como também dissociar os domínios da proteína. A libertação de cobre do tipo T2 que pode ocorrer a elevadas temperaturas pode resultar na perda acentuada da actividade (Hildén et al., 2009).
1.6 - Substratos da lacase
O centro de cobre T1 da enzima é o aceitador primário de electrões para a redução dos substratos e a ligação de hidrogénio entre Glu460 e Ser113 da lacase de T. versicolor aumenta a distância entre o cobre T1 e a His 458 tornando o átomo de carbono mais deficiente em electrões o que leva ao aumento do potencial redox (de 0,5 V para 0,8 V) aumentando consequentemente
7
o leque de substratos. O potencial do centro T1 da enzima também determina a eficiência catalítica na oxidação da maioria dos substratos da lacase. Os fenóis têm potenciais redox que variam entre 0,5 a 1,0 V o que permite a captação de electrões pelo cobre tipo 1 tornando-os substratos típicos da lacase (Morozova et al., 2007b; Giardina et al., 2010).
As lacases não são específica oxidando uma ampla gama de substratos orgânicos ou inorgânicos, incluindo fenóis, mono-, di- e polifenóis, aminofenóis, metoxifenóis substituidos, poliamidas, aminas aromáticas, diaminas aromáticas, ácido ascórbico, anilinas, benzenotiois, compostos biológicos, fenoxazina, ferrocitocromo, reveratrol, E-viniferina, 4-n-nonilfenol e compostos orto-substituidos como guaiacol, ácido cafeico, ácido gálico, dihidroxifenilalanina, pirogalhol e o-fenilenodiamina, ferrocianina e uma série de outros compostos. Para além de compostos orgânicos as lacases catalisam a oxidação de alguns iões inorgânicos: Mo(CN)8 4-,
Fe(CN)6 4-, Os (CN)6 4- e W(CN)84- (Call e M cke, 1997; Gianfreda et al., 1999; Mayer e
Staples, 2002; Mougin et al., 2002; Baldrian, 2006; Morozova et al., 2007a; Madhavi e Lele, 2009; Strong e Claus, 2011).
Os p-difenóis como a hidroquinona são melhores substratos que os m-difenóis (resorcinol, m-fenilenodiamina e orcinol) que são considerados maus substratos da lacase (Teerapatsakul et al., 2007; Strong e Claus, 2011). Os substratos para-substituidos como o p-cresol e p-fenilenodiamina tem uma baixa taxa de oxidação (Strong e Claus, 2011). O ABTS e SGZ são considerados os substratos específicos da lacase no entanto tem de ser usados com cuidado porque na presença de peróxido de hidrogénio tanto a SGZ como o ABTS são substratos da peroxidase (Baldrian, 2006; Dias et al., 2007). A SGZ, no entanto, é considerada um substrato com maior especificidade para a lacase do que o ABTS.
Numa experiência realizada por Teerapatsakul e colaboradores (2007), com Ganoderma
sp. foram produzidas 5 isoenzimas e testados vários substratos dos quais se concluiu que o
ABTS foi o melhor substrato para todas as isoenzimas enquanto que o guaiacol foi o pior e a tirosina não foi oxidada. Os seguintes resultados estão organizados do melhor para o pior substrato: ABTS ˃DMP ˃ -naftol˃ ,4 benzenodiol (hidroquinona) ˃ ácido 3,5-dimetoxicianico (ácido ferúlico) ˃ ácido 3,4-dihidroxicinâmico (ácido cafeico) ˃ alcool 4-hidroxi-3-metoxibenzil (álcool vanílico) ˃ ,3-benzenodiol (resorcinol) ˃ 2-naftol ˃ ácido abiético ˃ 4-clorofenol ˃ álcool 3,4-dimetoxibenzilico (álcool veratílico) ˃ 4-hidroxi-3-metoxibenzaldeido (vanilina) ˃ ácido 4-hidroxi-3-metoxibenzoico (ácido vanílico) ˃ 2-metoxifenol (guaiacol) ˃ ácido 4- hidroxicinâmico (p-cumárico). As isoenzimas mostraram maior selectividade para fenóis dimetoxi substituídos como DMP e ácido siríngico do que para fenóis metoxi substituídos (Teerapatsakul et al., 2007).
8
A gama de substratos que a lacase pode oxidar é muito grande variando conforme a espécie que a produz, dificultando, por isso, a definição de lacase (Mayer e Staples, 2002; Baldrian, 2006; Madhavi e Lele, 2009). Também a localização intracelular ou extracelular da lacase está relacionada com a sua função biológica e condiciona a gama de substratos disponíveis para a enzima (Baldrian, 2006; Strong e Claus, 2011).
Os substratos que envolvem a troca de protões quando oxidados apresentam um pH ideal que depende da lacase e não do substrato, enquanto os substratos que não envolvem a troca de protões a actividade da lacase muitas vezes diminui à medida que o pH aumenta. A especificidade do substrato e afinidade da lacase podem variar com a mudança de pH (Gianfreda
et al., 1999).
1.7 - Mediadores da lacase
A lacase está envolvida na degradação de um grande número de compostos como a lenhina que não pode ser oxidada pela lacase de forma convencional devido ao impedimento estérico o que impede a enzima de entrar em contacto directo com este composto e a reacção tem de ocorrer por via dos mediadores (Strong e Claus, 2011).
Os mediadores são um grupo de compostos orgânicos de baixo peso molecular que aumentam a especificidade do substrato e o potencial de alcance da lacase. Estes funcionam como intermediários entre os substratos com elevado potencial redox que normalmente não seriam um substrato da lacases, permitindo que esta oxide indirectamente moléculas grandes formando primeiro um catião com radicais altamente activos capazes de oxidar substratos não fenólicos que a lacase sozinha não pode oxidar (Bourbonnais e Paice, 1990; Kunamneni et al., 2008; Brijwani et al., 2010; Strong e Claus, 2011).
Também os substratos com elevado potencial redox não podem ser oxidados directamente por lacases como é o caso dos substratos não fenólicos. Contudo a gama de substratos oxidados pela enzima pode ser aumentada pela combinação da lacase com mediadores o que eleva a sua capacidade de oxidação permitindo a oxidação de compostos não fenólicos (Mayer e Staples, 2002; Madhavi e Lele, 2009; Brijwani et al., 2010; Giardina et al., 2010). Os mediadores redox são substratos da lacase que produzem intermediários de alto potencial redox como resultado da oxidação enzimática (Morozova et al., 2007b).
9
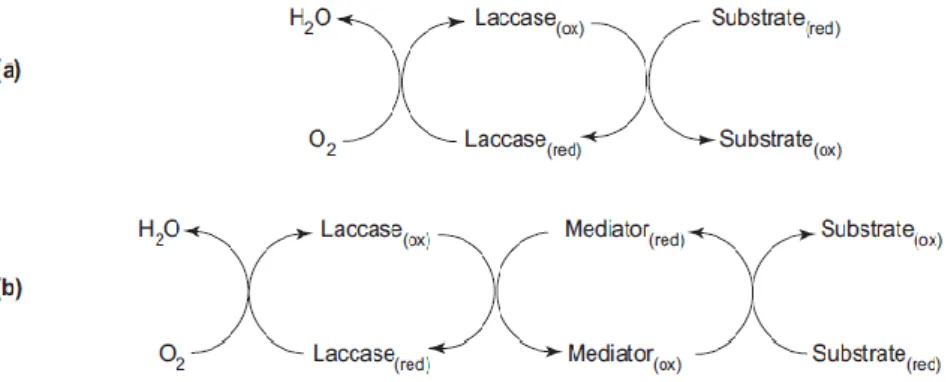
Figura 2 - Mecanismo catalítico de acção da lacase: (a) sem a presença de mediador e (b) na presença de mediador (Riva, 2006).
Vários autores sistematizaram as características que devem ter um bom mediador: ser um bom substrato da lacase; deve ser estável; não devem inibir a reacção enzimática; a sua forma oxidada deve ter uma meia vida suficientemente longa permitindo a sua difusão no substrato; possuir um potencial de oxidação alto (Figura 2) e a sua conversão redox deve ser cíclica (Johannes e Majcherczyk, 2000; Giardina et al., 2010).
O primeiro mediador usado (1990) para deslenhificação da celulose foi o ABTS (ácido 2,2’–azino-bis (3-etilbenzotiazolina-6-sulfonato)). Este mediador (Figura 3) é um substrato não fenólico que melhora a actividade da enzima permitindo aumentar a gama de substratos da lacase (Bourbonnais e Paice, 1990; Riva, 2006; Morozova et al., 2007a; Madhavi e Lele, 2009). O uso do ABTS como mediador da lacase para oxidação de estruturas não fenólicas de lenhina deu um impulso na busca de novos mediadores (Morozova et al., 2007a).
Figura 3 - Estrutura do mediador ABTS (Gochev e Krastanov, 2007)
Actualmente existem vários mediadores para a lacase mais ou menos eficientes que podem ser naturais ou sintéticos. A descoberta de muitos mediadores redox sintéticos aumentou a capacidade de oxidação e o potencial de aplicações da lacase a nível industrial apesar de terem restrições na sua aplicação, uma vez que são caros, podem gerar derivados tóxicos e podem inibir a actividade da enzima em altas concentrações (Kunamneni et al., 2008; Strong e Claus, 2011). O HAA (3- ácido hidroxiantranílico), foi o primeiro mediador natural da lacase a ser
10
descrito e os mediadores sintéticos ABTS e HBT (N- hidroxibenzotriazole) são considerados os mais efectivos actualmente (Call e M cke, 1997; Crestini et al., 2003; Strong e Claus, 2011).
No entanto existem muitos outros mediadores da lacase como o ácido 3-hidroxiantranílico, HOBT (1-hidroxibenzotriazole), NHPI (N-hidroxiftalimida), HPI (hidroxiftalimida), NHA (N-hidroxiacetanilida), VLA (ácido violúrico), ácido siríngico (metiléster de 4-hidroxi-3,5-dimetiltoxi-ácido benzóico), TEMPO
(2,2,6,6-tetrametil-1-piperidiniloxi), DMP (2,6-dimetoxifenol), HNNS (4-hidroxi-3-nitroso-1-ácido
naftalenosulfónico), NNDS (ácido 1-nitroso-naftol-3,6 dissulfónico), NHA (N-hidroxiacetanilida), PZ (promazina), SGZ (seringaldazina), vanilina, acetovanilina, metilvanilato, acetosiringona, 2,4,6-trimetilfenol, ácido p-cumárico, ácido ferúlico, ácido sináptico, guaiacol, ferrocianeto (K4Fe(CN)6) e polioxometalatos (SiW11MnIII(H2O)O39)-5
(Mayer e Staples, 2002; Wesenberg et al., 2003; Riva, 2006; Gochev e Krastanov, 2007; Morozova et al., 2007a; Kunamneni et al., 2008; Madhavi e Lele, 2009; Giardina et al., 2010; Strong e Claus, 2011).
1.8 - Inibidores
Um dos métodos mais usados para descrever a lacase tem sido o uso de inibidores principalmente os compostos capazes de formar complexos de cobre estáveis. A inibição da lacase ocorre geralmente por modificação dos resíduos de aminoácidos, quelação/perda de cobre ou mudança conformacional da enzima (Gianfreda et al., 1999; Johannes e Majcherczyk, 2000).
A actividade da lacase pode ser inibida por vários compostos orgânicos e inorgânicos e as lacases geralmente respondem de modo similar a vários inibidores de actividade. Os inibidores mais usados para este fim tem sido o ditiotreitol (TDT), o ácido tioglicólico (TGA), a cisteína, o ácido dimetiltiocarbónico (DDC), o ácido etilenodiamino tetra-acético (EDTA), o fluoreto de sódio (NaF) e a azida de sódio (NaN3) apesar de não serem específicos, pode-se também usar
iões metálicos, ácidos gordos, reagentes sulfidrílicos, detergentes catiónicos de amónio quaternário, e aniões pequenos como cianeto e hidrogenião. (Madhavi e Lele, 2009; Johannes e Majcherczyk, 2000).
A lacase pode ser inibida por aniões pequenos como fluoreto, cloreto, azida e hidróxido que ligam ao centro T2/T3 das lacases e perturbam a transferência interna de electrões do centro T1 para o cluster T2/T3 inibindo consequentemente a actividade enzimática (Gianfreda et al., 1999; Morozova et al., 2007b; Strong e Claus, 2011). O potencial T3 de Trametes versicolor é
11
de 785 mV e na presença do ião fluoreto o potencial T3 reduz para 210 mV por causa de uma forte interacção do ião fluoreto com o cluster T2/T3 (Morozova et al., 2007b).
A lacase tem uma sensibilidade intrínseca a halogenetos e a condições alcalinas e a sua inibição por haleto depende da acessibilidade do átomo de cobre e pode variar entre diferentes lacases e inibidores (Gianfreda et al., 1999; Abadulla et al., 2000; Strong e Claus, 2011).
A azida, cianeto, tiocianeto e o flúor são capazes de interagir com outros centros de cobre inibindo a lacase. A azida é um inibidor típico das metaloenzimas (Forooftanfar et al., 2011). O fl or é um inibidor eficaz de lacases que liga ao cobre tipo 2 e inibe a transferência intramolecular de electr es (Call e M cke, 1997), assim sendo o NaCl e NaF são considerados inibidores de fluxo de electrões (Strong e Claus, 2011). Para uma lacase de Trametes hirsuta o flúor provou ser um potente inibidor seguido do cloro e bromo (Abadulla et al., 2000), já o cloreto de sódio inibiu fortemente a actividade enzimática de Agaricus blazei apesar de ser uma inibição reversível, baixas concentrações do sal levaram a uma diminuição notável na actividade da enzima (Ullrich et al., 2005). Foi verificado que a oxidação do substrato pelos fungos
Ganoderma lucidum e Pleurotus ostreatus foi inibida eficazmente por azida de sódio (Kumari e
Sirst, 1972; Palmieri et al., 1997). Enquanto a lacase de Scytalidium thermophilium foi inibida por NaF, NaBr e NaN3 (Younes e Sayadi, 2011). Existem lacases que tem elevada sensibilidade
a iões metálicos, por exemplo a lacase de Sinorbizobium meliloti que foi inibida por Fe+3, Mn +2, Cu+2, β-mercaptoetanol e glutationa reduzida enquanto outras como a lacase de G. lucidum são completamente insensíveis a estes iões (Baldrian, 2006; Strong e Claus, 2011).
Outros inibidores da lacase incluem metais pesados (Hg+2), ou iões como cobalto, potássio, zinco crómio, cálcio e outros compostos como ácidos gordos, hidroxiglicina, ácido kojico, ácido p-cumárico, dithiothreitol, cisteína, ácido tioglicólico, dimetoxifenóis (ácido siríngico e ácido sináptico) e monometoxifenóis: (ácido ferúlico e ácido vanílico), substituintes nitro e reagentes sulfídricos (Bollag e Leonowicz, 1984; Gianfreda et al., 1999; Abadulla et al., 2000; Sadhasivam et al., 2007; Strong e Claus, 2011). As lacases também são inibidas por agentes quelantes de cobre como EDTA e dietilditiocarbamato, dimetil glioxina, N N- dimetilditiocarbamato que levam a uma perda de actividade catalítica (Call e M cke, 1997; Gianfreda et al., 1999; Abadulla et al., 2000; Sansone et al., 2011).
Geralmente quando o inibidor está presente em quantidade suficiente a degradação do substrato não ira ocorrer uma vez que este inibe a actividade da enzima, no entanto o uso de lacase imobilizada torna-a menos vulnerável aos inibidores que a enzima livre (Rogalski et al., 1995; Strong e Claus, 2011). O grau de inibição pode ser expresso pelo parâmetro IC50 que
significa a concentração de efector que inibe 50% da actividade enzimática. A inibição da enzima pode ser maior ou menor dependendo do tipo de inibidor e a concentração usada. Este
12
facto pode ser verificado num trabalho de Abadulla e colaboradores (2000) em que obteve uma perda de actividade de 50% (IC50) com uma lacase de Trametes hirsuta com os seguintes
inibidores e concentrações 50 mM de NaCl; 0,002 mM azida de sódio; 190 mM de NaBr; 80 µM de NaF; 500 µM de ácido tioglicólico e 1,2 mM dietilditiocarbamato.
Tem sido realizados vários trabalhos com azida de sódio verificando-se que o grau de inibição varia conforme a lacase. Usando como substrato o ABTS e 0,05 mM de NaN3 inibiu
totalmente a lacase de Fomes annosus, Pholiota mutabilis, Pleurotus ostreatus, Trametes
versicolor, Rhizoctonia praticola, Botrytis cinerea e Podospora anserina (Bollag e Leonowicz,
1984). Adicionando 0,1 mM de NaN3 verificou-se a inibição total da lacase de Trichophyton
rubrum (Jung et al., 2002), Fomes annosus, Pholiota mutabilis, Pleurotus ostreatus, Trametes versicolor, Rhizoctonia praticola, Botrytis cinerea e Podospora anserina (Bollag e Leonowicz,
1984). A adição de 1,0 mM de NaN3 inibiu 3,4% a lacase de Cladosporium cladosporioides
(Halaburgi et al., 2011), 13,2% a lacase de Paraconiothyrium variabile (Forooftanfar et al., 2011), 99% a lacase de Magnaporthe grisea (Iyer e Chatoo, 2003). A adição de 10,0 mM de NaN3 inibiu 16,3% a lacase de Cladosporium cladosporioides (Halaburgi et al., 2011). Com
outros substratos como a SGZ estes valores são diferentes com 0,01 mM de azida de sódio, inibe a lacase de Botrytis cinerea (51%), a de Fomes annosus (59%), a de Pholiota. mutabilis (37%), a de Pleurotus ostreatus (58%), a de Podospora anserina (61%), a de Rhizoctonia praticola e (55%) a de Trametes versicolor (Bollag e Leonowicz, 1984), 50% a lacase de Magnaporthe
grisea (62%) (Iyer e Chatoo, 2003), com 0,5 mM de azida de sódio inibe 94% da lacase de Magnaporthe grisea (Iyer e Chatoo, 2003), enquanto com 1 mM de azida de sódio inibe 99% da
lacase de Magnaporthe grisea (Iyer e Chatoo, 2003). A inibição da lacase por fluoreto foi estudada por Jung e colaboradores (2002) obtendo a inibição total da lacase de Trichophyton
rubrum com 1,0 mM de flureto de sódio. Enquanto a inibição por NaCl foi estudada por Ullrich
e colegas (2005) para a lacase de Agaricus blazei obtendo um decréscimo de 50% e 90% com 20 mM e 300 mM de inibidor respectivamente.
No trabalho de Eggert et al., (1996) as lacases de Pycnoporus cinnabarinus e T. hirsuta foram completamente inibidas com 0,1 mM de azida; 1,0 mM de L-cisteína e 1,0 mM de DTT enquanto o ácido p-cumárico e a tropolona causaram uma inibição ligeira. O ácido kójico, a acetilacetona e o EDTA não tiveram efeito inibitório. O EDTA também não teve qualquer efeito inibitório sobre a lacase de Ganoderma sp ao contrário dos solventes orgânicos, tais como metanol, etanol, acetonitrilo, acetona, isopropanol e o 1,4-dioxano que tiveram um efeito inibitório considerável (Teerapatsakul et al., 2007). Pelo contrário Bollag e Leonowicz (1984) obtiveram uma pequena inibição com EDTA para os fungos Botrytis cinerea, Fomes annous,
13
versicolor. Neste caso a hidroxilamina não teve efeito inibitório e a azida, o ácido tioglicolico e o
ácido dietilditiocarbâmico inibiram completamente as enzimas.
1.9 - Indutores
Os indutores podem influenciar a produção de enzimas linhoceluloliticas dependendo da sua concentração e do seu tempo de adição (Tekere et al., 2001; Strong e Claus, 2011). Indutores de síntese proteica têm sido utilizados para aumentar a produção de lacase em vários meios de cultura (Gianfreda et al., 1999).
A produção de lacase pode ser aumentada por adição de indutores à cultura de fungos (Baldrian, 2006). O cobre é um componente essencial da lacase e a sua suplementação aumenta a síntese de lacase numa grande variedade de fungos. O cobre inibe uma protease extracelular responsável pela degradação da lacase (Chen et al., 2003). O efeito de um indutor pode variar muito entre os géneros de fungos (Strong e Claus, 2011). Assim a adição de sulfato de cobre como indutor a uma cultura do fungo Magnaporthe grisea aumentou 8 vezes a actividade da lacase (Iyer e Chatoo, 2003) e também teve um efeito positivo sobre a produção de Pleurotus
florida (Palvannan e Sathishkumar, 2010) e Volvariella volvacea na qual induziu a produção de
2 isoformas de lacase (Chen et al., 2003). Para além do cobre outros metais como ferro e cálcio tem capacidade de induzir a actividade da lacase. Grandes quantidades de manganês também mostraram induzir a produção de lacase em Phlebia brevispora (Moilanen et al., 1996).
O ácido ferúlico é um indutor da lacase de Volvariella volvacea, P. radiata, Pleurotus
ostreatus, Trametes versicolor, Pycnoporus cinnabarinus, Cladosporium cladosporioides, Pholiota mutabilis, Pleurotus sajor-caju (Gianfreda et al., 1999; Mougin et al., 2002; Chen et al., 2003; Halaburgi et al., 2011; Strong e Claus, 2011; Zucca et al., 2011). Outro indutor muito
utilizado é o álcool veratrílico que foi usado com sucesso para induzir a lacase de Phlebia
radiata, Ganoderma sp, Pycnoporus cinnabarinus (Kantelinen et al., 1989; Rogalski et al.,
1995; Eggert et al., 1996; Gianfreda et al., 1999; Teerapatsakul et al., 2007). No entanto o indutor mais eficaz de lacases fúngicas é o xenobiótico 2,5-xilidina (um derivado das anilinas) que provou aumentar a actividade da lacase extracelular em Fomes annous, Pholiota mutabilis,
Botrytis cinerea, Pycnoporus cinnabarinus, Pleurotus ostreatus, Trametes versicolor, Volvariella volvacea e Podospora anserina (Bollag e Leonowicz, 1984; Gianfreda et al., 1999;
Leonowicz et al., 2001; Chen et al., 2003; Yeo et al., 2008; Strong e Claus, 2011). No entanto este indutor mostrou não ter qualquer efeito na produção de lacase por Botrytis cinerea e
14
tem sido usada para aumentar a produção de lacase induzida não diferenciando a indução de lacases intracelulares ou extracelulares (Bollag e Leonowicz, 1984). A ciclohexidina um composto com funções de antibiótico induz a produção de lacase por Nespora crassa o que não se verificou no caso do fungo Agaricus biporus (Bollag e Leonowicz, 1984; Gianfreda et al., 1999). O 4-hidroxibenzaldeido mostrou ser um fraco indutor da lacase de Volvariella volvacea, enquanto o ácido p-cumárico, ácido siríngico, ácido vanilico e catecol não apresentaram indução da lacase (Chen et al., 2003).
Existem muitos outros compostos que têm sido usados como indutores com bons resultados. Mougin e colegas (2002) avaliaram o efeito de vários compostos de origem orgânica na produção de lacase de Trametes versicolor obtendo um aumento significativo na produção de lacase (mais de 5x) com reveratrol, E-viniferina, diquox (herbicida), 4O5CIF (N´N´-dimetil-N-(5-cloro 2-hidroxifenil)), 4-n-nonifenol, 9-fluorenona e anilina. Outro composto testado por estes autores foi o ATAB (alquiltrimetil-amónio brometo), um sulfactante catiónico altamente tóxico que reduziu drasticamente o crescimento fúngico. No entanto estimulou a produção de lacase 5x depois de 3 dias de tratamento e aumentou o efeito potenciador (cerca de 20x) depois de 8 dias. Também com Trametes versicolor a adição de nonifenol (Mougin et al., 2002), BBP (benzibutilphathalate, 98%), DEP (dietilphathalate, 99,5%), p-anserina e 2,4,6-trinitrotuloeno (TNT) e dos seus intermediários catabólicos aumentou a expressão da lacase (Gianfreda et al., 1999; Yeo et al., 2008).
Uma série de outros compostos fenólicos são conhecidos como indutores da lacase por exemplo o ácido gálico aumentou a produção de lacase de B. cinerea (Bollag e Leonowicz, 1984), o etanol tem sido usado como indutor em Pycnoporus cinnabarinus (Strong e Claus, 2011), o ácido 4-hidroxibenzóico é bom indutor da lacase de Volvariella volvacea (Chen et al., 2003), o orcinol, ácido resorcinol, ácido salicílico e o ácido tânico induzem a produção de lacase em Cyathus bulleri, o p-anserina e o-toluidina induzem a lacase em Rhizoctonia praticola enquanto o álcool benzílico induz a lacase de Phlebia radiata (Gianfreda et al., 1999). Outros indutores incluem o ácido 3,5-dihidroxibenzóico (ácido resorcílico), ácido 2,4-dihidroxibenzoico, ácido p-cumárico (p-hidroxicinâmico), ácido vanílico (ácido 3-metoxi-4-hidroxibenzóico), ácido cafeico (ácido 3,4-hidroxicinamico) e ácido siringíco (Strong e Claus, 2011).
Existe ainda outra forma de obter grandes quantidades de lacase sem o uso de indutores através de expressão heterologa de um organismo adequado, assim genes da lacase foram clonados e expressos em leveduras recombinadas como Saccharomyces cerevisiae, Pichia
pastoris, Pichia methanolica e em fungos filamentosos como Tichoderma reesei, Aspergillus oryzae, Aspergillus níger, Coriolus versicolor e Coprinopsis cinerea (Strong e Claus, 2011).
15 1.10 - Factores que afectam a produção de Lacase
As lacases fúngicas são enzimas extracelulares secretadas para o meio pelo micélio de fungos filamentosos e produzidas geralmente durante o metabolismo secundário (Bollag e Leonowicz, 1984; Gochev e Krastanov, 2007; Brijwani et al., 2010). Os fungos da podridão branca podem produzir grandes quantidades de lacase desde que tenham as condições de cultivo e composição nutritiva do meio adequados, para tal torna-se necessário proceder-se à optimização dos meios de cultura e identificação dos melhores produtores de lacase (Gianfreda
et al., 1999; Ullrich et al., 2005; Couto e Toca-Herrera, 2007; Gochev e Krastanov, 2007;
Palvannan Sathishkumar, 2010).
Ao longo dos anos tem vindo a ser demonstrada a influência na produção de lacase de vários parâmetros de cultivo como tipo e concentração de fonte de carbono, níveis de azoto, fosfato, minerais, concentração de oxigénio e dióxido de carbono dissolvido, presença/ausência de indutores, pH, temperatura, tempo de incubação, agitação, tipo de cultivo, estirpe produtora e manipulação genética (Gayazov e Rodakiewicz-Nowak, 1996; Gianfreda et al., 1999; Gochev e Krastanov, 2007; Strong e Claus, 2011). Existe escassa informação sobre o efeito do pH e temperatura na produção de lacase mas a maioria dos autores está de acordo que o pH inicial (antes da inoculação) deve estar entre 4,5 e 6,0 (Thurston, 1994) e a temperatura óptima de incubação deve estar entre os 25ºC e os 30ºC. Culturas com temperaturas superiores a 30ºC apresentaram uma actividade enzimática reduzida (Gochev e Krastanov, 2007; Brijwani et al., 2010).
A produção de lacase em meio líquido também é influenciada pela agitação. A agitação suave favorece a produção de lacase enquanto a agitação excessiva reprime por stress mecânico a sua produção (Fenice et al., 2003; Wesenberg et al., 2003; Couto e Toca-Terrera 2007). Fenice e colaboradores (2003) provaram que a actividade da lacase de Panus tigrinus é fortemente afectada pela velocidade da agitação concluindo que velocidades superiores a 500 rpm levam a uma redução dos níveis de actividade enzimática (Fenice et al., 2003).
A espécie de fungo, evidentemente, também influencia a produção de lacase. As espécies
Phlebia fascicularia e Phlebia floridensis são melhores produtoras de lacase do que Dichomitus squalens e Trametes versicolor (Arora e Gill, 2000). Pelo contrário o fungo Phlebia radiata é
16 1.11 - Meios de cultura
Uma forma de diminuir os custos de produção de lacase associados ao meio é usar resíduos agrícolas como substrato. Actualmente já foram descobertos vários substratos com bons resultados no cultivo de fungos causadores da podridão branca da madeira nos quais se incluem: farelo e palha de trigo, farelo de cevada, palha de aveia, palha de arroz, bagaço de cana, polpa e licor de batata, sumo de tomate, casca de banana, casca de tangerina, resíduo de laranja e kiwis, águas residuais de destilarias de vinhos e resíduos da indústria cervejeira (Ullrich et al., 2005; Alexandrino et al., 2007; Gregori et al., 2008; Strong e Claus, 2011). Numa experiencia realizada por Lorenzo et al., 2002 com semente de uva, talos de uva e farelo de cevada como substrato foi demonstrado que o fungo Trametes versicolor quando cultivado em farelo de cevada aumenta a actividade da lacase em 10x quando comparada a um controlo (Lorenzo et al., 2002). Noutro estudo foi usando como meio de crescimento águas ruças para a produção de lacase pelo basidiomiceta Panus tigrinus (Fenice et al., 2003).
Existem muitos meios de cultura sintéticos usados para produção de lacase, como o meio de Eggert (Eggert et al., 1996), Kirk (Ullrich et al., 2005; Teerapatsakul et al., 2007), Crawford (Iyer 2003), Vogel (Iyer e Chatoo, 2003; Sharma e Arora, 2010), Lesage-Meesen (Mougin et al., 2002), e ADMS (asparagina-dimetillsuccinato) (Rogalski et al., 1995).
Yeo et al., 2008 conseguiu aumentar a actividade da lacase do fungo P. tremellosa num meio de PDA suplementado com vários compostos que imitam hormonas esteróides (Yeo et al., 2008). Enquanto a combinação de um meio rico em manganês e malonato resultou num aumento dos níveis de produção de lacase por Phlebia radiata (Moilanen et al., 1996). Arackiasamy et al. (2008) optimizou um meio de cultura para aumentar a produção de lacase de Coriolus versicolor verificando que o fenol foi o que teve o maior impacto na produção de lacase seguido do extracto de levedura, sulfato de magnésio, amido e sulfato de manganês (Arackiasamy et al., 2008).
Nos fungos da podridão branca a secreção de enzimas esta relacionada com a limitação de nutrientes como azoto e carbono (Kapdan et al., 2000). A produção de lacase geralmente é sensível a concentração de azoto no entanto também existem algumas espécias nas quais o azoto não tem efeito sobre a produção enzimática (Gochev e Krastanov, 2007; Brijwani et al., 2010). Geralmente obtêm-se maiores quantidades de lacase e esta é produzida mais rapidamente quando o fungo é cultivado em meios ricos em azoto (Gianfreda et al., 1999; Gochev e Krastanov, 2007; Brijwani et al., 2010). Os fungos Lentinus edodes, Phanerochaete chrysosporium e Rigidoporus
lignous incrementaram a produção de lacase quando cresceram num meio com elevada
17
produção máxima de lacase com os fungos Pycnoporus cinnabarinus e Phlebia radiata (Gianfreda et al., 1999; Tekere et al., 2001).
Vários estudos revelaram que se obtêm maior produção de lacase usando uma baixa relação carbono-azoto, enquanto outros mostraram que a maior produção de lacase é obtida com elevada proporção de carbono-azoto (Gochev e Krastanov, 2007; Brijwani et al., 2010). Pelo contrário, Tekere e colaboradores (2001) estudaram a produção de lacase por vários fungos da podridão branca com diferentes concentrações de carbono, azoto e Mn2+ concluindo que a produção foi maior em altas condições de azoto e carbono e pouco influenciada pelos níveis de Mn2+ (Tekere et al., 2001). Há, também, no entanto referências indicando que concentrações limitantes destes nutrientes induzem a produção de lacases (Wesenberg et al., 2003).
O fungo Pleurotus sajor-caju foi cultivado num meio definido com glucose como única fonte de carbono e a produção de lacase foi aumentada quando se adicionou azoto na forma de NH4NO3 e L-aspargina (Fu et al., 1997). A eficiência na produção de lacase em algumas culturas
com elevado quantidade de azoto está relacionada com o tipo específico de fonte de carbono (Gianfreda et al., 1999).
A concentração excessiva de glucose como fonte de carbono no meio de cultura é inibidora da produção de lacase resultando num atraso temporal na produção de lacase (Gochev e Krastanov, 2007; Brijwani et al., 2010). Com Ganoderma sp. a concentração inicial de glucose no meio de cultura permite controlar a produção da lacase e também das diferentes isoenzimas (Teerapatsakul et al., 2007).
Os fungos filamentosos podem produzir grandes quantidades de lacase mas tem de se ter em conta o crescimento incontrolado do fungo, formação de polissacáridos e secreção de proteases que ocorre quando elevadas concentrações de nutrientes são adicionadas ao meio de cultura (Strong e Claus, 2011). Também a sacarose em excesso no meio reduz a produção de lacase bloqueando a sua indução (Bollag e Leonowicz, 1984; Brijwani et al., 2010). Na obtenção de elevadas quantidades de lacase é necessário também ter em conta a técnica de cultura, o tipo de biorreactor a usar e as condições ambientais (indutores, composição do meio, aeração e sistema de agitação) adequadas (Couto e Toca-Herrera 2007).
1.12 - Espécies produtoras de lacase
As lacases comuns (Johannes e Majcherczyk, 2000) na natureza (Riva, 2006), podendo ser produzidas por plantas, fungos, bactérias e insectos. As funções desta enzima diferem de organismos para organismo (Madhavi e Lele, 2009). Assim, as lacases podem ser divididas,
18
quanto à sua origem, em quatro grupos: plantas superiores, fungos, bactérias e insectos (Mayer e Staples, 2002).
Nos fungos as lacases são produzidas por vários grupos taxonómicos como ascomicetas, deuteromicetas e basidiomicetas (Gianfrenda et al., 1999; Johannes e Majcherczyk, 2000; Mayer e Staples, 2002; Morozova et al., 2007; Madhavi e Lele, 2009; Giardina et al., 2010). Os fungos da podridão branca são os maiores produtores de lacase, tendo sido purificadas e caracterizadas a partir de culturas de mais de 100 espécies de fungos basidiomicetas e ascomicetas e o número continua a aumentar (Baldrian, 2006; Couto e Toca-herrera, 2007; Hildén et al., 2009; Strong e Claus, 2011). Os fungos da podridão branca pertencem principalmente aos basidiomicetas e são caracterizados por degradar eficientemente a lenhina deixando o substrato lenhinocelulósico enriquecido em celulose e por isso com uma cor branca (Alexandrino et al., 2007; Gochev e Krastanov, 2007; Madhavi e Lele, 2009). A maioria das lacases descritas na literatura foi isolada de fungos superiores (cogumelos), também denominados macrofungos (Madhavi e Lele, 2009). Existem diversos fungos que parecem não produzir lacase como é o caso dos fungos inferiores Zygomycetes e Chytridiomycetes (Morozova et al., 2007). A lacase também foi detectada em algumas espécies de leveduras (Dias et al., 2010b).
Nos fungos com capacidade lenhinocelulolítica, para além da lacase a lenhina peroxidase e a manganês peroxidase são as principais enzimas associadas à oxidação da lenhina. Alguns destes fungos produzem todas estas enzimas enquanto outros produzem apenas uma ou duas delas, sendo este último caso o mais vulgar (Arora e Gill, 2000).
Os fungos Agaricus bisporus, Botytis cinerea, Cerrena máxima, Coprinus cinereus,
Coriolopsis polyzona, Lentinus tigrinus, Neurispora crassa, Trametes gallica, Trametes hirsuta, Trametes ochracea, Trametes versicolores, Trametes villosa, Phlebia radiata, Picnoporus cinnabarius, Pleurotus eryngii e Pleurotus ostreatus são exemplos de fungos da podridão branca
da madeira produtores de lacase (Gochev e Krastanov, 2007; Morozova et al., 2007).
A presença de lacase em plantas superiores tem sido menos relatada devido a que a sua detecção e purificação em extractos brutos de plantas é difícil (Mayer e Staples, 2002; Strong e Claus, 2011), ainda que a sua existência esteja amplamente distribuída (Johannes e Majcherczyk, 2000; Madhavi e Lele, 2009), no entanto dados sobre outras lacases de plantas superiores são escassos (Morozova et al., 2007b). As lacases foram encontradas nas paredes celulares de várias plantas tanto de espécies herbáceas, arbustivas e arbóreas, onde participam na biossíntese da lenhina (Giardina et al., 2010). A lacase foi identificada em árvores como o pinheiro (Pinus
pinaster), em couve (Brassica oleracea), nabo (Brassica napus), beterraba (Beta vulgaris), maça
(Malus communis), manga (Mangifera indica), pêssego (Prunus persica), ameixa (Prunus