Isabel Cristina Vieira Bento Bastos
CRESCIMENTO DE CRISTAIS DE
L-ASPARAGINA MONOHIDRATADA
DOPADA COM METAIS DE TRANSIC
¸ ˜
AO
E PROPRIEDADES VIBRACIONAIS A
ALTAS TEMPERATURAS
Fortaleza - CE
Isabel Cristina Vieira Bento Bastos
CRESCIMENTO DE CRISTAIS DE
L-ASPARAGINA MONOHIDRATADA
DOPADA COM METAIS DE TRANSIC
¸ ˜
AO
E PROPRIEDADES VIBRACIONAIS A
ALTAS TEMPERATURAS
Tese apresentada ao Departamento de F´ısica da Universidade Federal do Cear´a, como parte dos requisitos para a obten¸c˜ao do t´ıtulo de Doutora em F´ısica.
Orientador:
Prof. Dr. Paulo de Tarso Cavalcante Freire
Fortaleza - CE
Isabel Cristina Vieira Bento Bastos
CRESCIMENTO DE CRISTAIS DE
L-ASPARAGINA MONOHIDRATADA
DOPADA COM METAIS DE TRANSIC
¸ ˜
AO
E PROPRIEDADES VIBRACIONAIS A
ALTAS TEMPERATURAS
Tese apresentada ao Departamento de F´ısica da Universidade Federal do Cear´a, como parte dos requisitos para a obten¸c˜ao do t´ıtulo de Doutora em F´ısica.
Aprovada em Agosto / 2006
BANCA EXAMINADORA
Prof. Dr. Paulo de Tarso Cavalcante Freire (Orientador)
Universidade Federal do Cear´a
Prof. Dr. Josu´e Mendes Filho Universidade Federal do Cear´a
Prof. Dr. Antˆonio Gomes de Souza Filho Universidade Federal do Cear´a
Prof. Dr. Antˆonio Jeferson de Deus Moreno Universidade Federal do Maranh˜ao
Dedico este trabalho `
Agradecimentos
As dificuldades enfrentadas no decorrer destes quatro anos de Doutorado tornaram este momento ainda mais prazeroso. Um desafio que exigiu esfor¸co, dedica¸c˜ao, perse-veran¸ca e acima de tudo f´e. Acreditar no que fazemos ´e fundamental para alcan¸carmos a conquista. Assim, eu s´o poderia come¸car agradecendo a Deus que me deu for¸cas para superar cada obst´aculo desta caminhada at´e a conclus˜ao deste trabalho.
Quero agradecer em especial aos meus pais e meus irm˜aos pelo apoio incondicional e pela paciˆencia. Pelos momentos de confraterniza¸c˜ao familiar que ado¸cam nossas vidas e fortificam nossos la¸cos.
Agrade¸co ao professor Paulo de Tarso Cavalcante Freire por aceitar este trabalho, pela orienta¸c˜ao e apoio. Pelas oportunidades de viagens, congressos e medidas experimentais realizadas em outras institui¸c˜oes.
Crescer cristais exige cuidados especiais e paciˆencia. Quero agradecer a minha sempre amiga Mayara e ao C´ıcero que me ensinaram a crescer os primeiros cristais. Ao grupo do Laborat´orio de Raios-x pelos materiais cedidos no laborat´orio de crescimento de cristais, em especial a amiga Juliana e ao Erandir.
Agrade¸co ao professor Paulo S´ergio Pizani do laborat´orio de Espectroscopia Raman da Universidade Federal de S˜ao Carlos que nos permitiu realizar as medidas de Espec-troscopia Raman e a sua estudante de doutorado Myrian Joya que nos ajudou durante as medidas.
Ao Laborat´orio de An´alise T´ermicas do Departamento de Qu´ımica Orgˆanica e Inor-gˆanica da UFC pelas medidas de TGA e DSC realizadas.
Aos professores Josu´e Mendes Filho e Antˆonio Gomes Souza Filho pelas sugest˜oes feitas a este trabalho e por participarem da banca.
Ao professor Antˆonio Jeferson de Deus Moreno pelas sugest˜oes e discuss˜oes para o nosso trabalho sempre que esteve em Fortaleza e por participar da banca.
Ao professor Alejandro Pedro Ayala com quem tive a oportunidade de trabalhar em medidas de Espectroscopia Raman.
Ao professor Jos´e Ramos Gon¸calves pelo apoio e amizade durante minha estadia em Trento-It´alia. Por estar sempre dispon´ıvel a ajudar e tirar minhas d´uvidas. Pelas dis-cuss˜oes e ensinamentos.
`
A Fam´ılia Pilla pela a acolhida, ajuda, apoio, amizade e por me proporcionar mo-mentos em fam´ılia durante minha estadia em Trento-It´alia.
Aos professores Gabriele Viliane e Aldo Fontana da Universita‘Degli Studi di Trento pelo apoio, discurss˜oes e trabalhos realizados.
Ao professor Antˆonio S´ergio Bezerra Sombra pelo uso da balan¸ca do Laborat´orio LONLCM para medir o soluto na prepara¸c˜ao das solu¸c˜oes.
Ao professor Jos´e Ossian Gadelha pela ajuda e discuss˜oes sobre as solu¸c˜oes qu´ımicas.
Ao professor Alexandre Magno Rodrigues Teixeira por participar da banca.
Muitas s˜ao as pessoas que passam pelo nosso caminho no decorrer de nossas vidas. Algumas simplesmente passam, outras deixam suas marcas boas ou n˜ao. Existem ainda aquelas que nos cativam de tal forma que passam a fazer parte de nossas hist´orias estejam perto ou longe. Assim s˜ao os amigos.
Quero agradecer aos amigos que iniciaram esta caminhada comigo Maria Aparecida, M´ario Henrique, Wally Mendon¸ca, Pedro Freitas, Felipe Cavalcante, Tarciro Nortason, Jo˜ao Jos´e, Carlos Handrey, S´ergio Barros. Nunca vou esquecer nossos grupos de estudo. A disponibilidade de cada um em ajudar o outro. Nossas conversas em momentos de descontra¸c˜ao. Sem d´uvidas, foram momentos ´ımpares.
Aos que chegaram para fazer parte desta hist´oria: Euzenil Oliveira, Lucilene Pereira, Joelma Monteiro, Waldeci Paraguassu, Cl´audio Rem´edios, por toda ajuda.
A amiga D´ebora que fui encontrar t˜ao longe. Sua amizade e companheirismo enquanto estive em Trento ajudaram a suportar a saudade que a distˆancia nos faz sentir. O apoio nos momentos mais dif´ıceis jamais esquecerei.
A amiga Ir. Maria Silmara pelas ora¸c˜oes e pelas palavras de carinho que transmitem t˜ao grande e boa energia.
As amigas Mayara, Juliana e Mylene. Quero dizer que n˜ao importa o tempo, a distˆancia, nem a falta de not´ıcias. Algo sempre nos unir´a porque firmamos bases fortes em nossa amizade. Estudamos e trabalhamos, conversamos e brincamos, ajudamos e apoiamos. Entre piadas e s´erios conselhos, choros e risadas, idas e vindas, partidas e reencontros. Fogo, Terra, ´Agua e Ar n˜ao podem deixar de existir.
A todos os alunos do grupo LASER com os quais dividi os computadores das esta¸c˜oes de trabalho e que estiveram sempre dispostos a ajudar.
Aos funcion´arios Ana Cleide, Rejane, Elias, Creuza, Joana, D. Luiza, sempre dispos-tos ajudar no que for poss´ıvel.
Ao professor Jos´e Soares de Andrade J´unior coordenador da p´os-gradua¸c˜ao.
A todos que fazem o Departamento de F´ısica da Universidade Federal do Cear´a.
Agradecimento Especial
Ao meu querido e amado esposo Wagner Ben´ıcio Bastos, companheiro de todos os momentos que me d´a ˆanimo e me faz acreditar que sempre ´e poss´ıvel. Sua dedica¸c˜ao, amizade, paciˆencia e cumplicidade tornaram o fardo da caminhada mais leve. Seu apoio incondicional me fortalece a alma. Seu amor faz minha vida mais feliz.
Teu olhar, ah esse teu olhar...
Me diz coisas que ningu´em imagina...
´
E tanto carinho que me estremece a alma.
Cada gesto, cada toque ´e pura paix˜ao.
Sorriso amigo, voz acolhedora, pura
cumplicidade de almas entrela¸cadas.
Amo ser tua e te ter para mim.
Amor t˜ao desejado, t˜ao esperado e agora sem limites.
Amor que cuida, protege, ajuda...
Amor que faz feliz.
Metade de mim ´e vocˆe,
a outra metade te ama sem fim...
Homenagem P´
ostuma
O mestre se eterniza nos seus ensinamentos...
“Ainda que eu falasse as l´ınguas dos homens e dos anjos, e ainda que tivesse o dom de profecia e conhecesse todos os mist´erios e toda a ciˆencia,
e n˜ao tivesse amor, eu nada seria.”
Resumo
Abstract
Sum´
ario
Lista de Figuras
Lista de Tabelas
1 Introdu¸c˜ao p. 21
2 Fundamentos Te´oricos p. 28
2.1 Espectroscopia Raman . . . p. 28
2.1.1 Teoria Cl´assica do Espalhamento Raman . . . p. 31
2.1.2 Dipolo El´etrico Induzido . . . p. 31
2.1.3 Polarizabilidade . . . p. 32
2.1.4 Teoria Cl´assica . . . p. 33
2.2 Fˆonons . . . p. 36
2.3 Modos Normais de Vibra¸c˜ao . . . p. 37
2.3.1 Tipos de Vibra¸c˜oes . . . p. 37
3 A L-Asparagina Monohidratada (LAM) p. 40
3.1 Caracter´ısticas . . . p. 40
3.2 Vibra¸c˜oes da L-Asparagina . . . p. 42
3.2.1 Vibra¸c˜oes Internas do NH+
3 . . . p. 43
3.2.2 Vibra¸c˜oes Internas do NH2 . . . p. 44
3.2.3 Vibra¸c˜oes Internas do CH . . . p. 44
3.2.5 Vibra¸c˜oes Internas do CO−
2 . . . p. 45
3.3 L-Asparagina Monohidratada Dopada com Metais de Transi¸c˜ao . . . . p. 46
4 Procedimentos Experimentais p. 48
4.1 Crescimento de Cristais . . . p. 48
4.2 Prepara¸c˜ao das Amostras . . . p. 49
4.3 Amostras de LAM Pura . . . p. 51
4.4 Amostras de LAM Dopadas . . . p. 52
4.5 Medidas de Espectroscopia Raman . . . p. 54
4.6 Medidas de ICP-AES . . . p. 56
4.7 Medidas T´ermicas . . . p. 57
5 Resultados e Discuss˜oes p. 58
5.1 Cristais de LAM Puros e Dopados com Metais de Transi¸c˜ao . . . p. 58
5.2 Espectroscopia Raman da LAM Pura e Dopada `a Temperatura Ambiente p. 60
5.3 Espectroscopia Raman da LAM Pura `a Alta Temperatura . . . p. 82
5.3.1 Resultados . . . p. 82
5.3.2 An´alise T´ermica da LAM Pura . . . p. 91
5.4 Espectroscopia Raman da LAM Dopada com Cr3+
`a Alta Temperatura p. 95
5.4.1 Defeitos e Impurezas em Cristais . . . p. 95
5.4.2 Resultados . . . p. 96
6 Conclus˜oes e Perspectivas p. 104
6.1 Perspectivas . . . p. 105
Lista de Figuras
1 Rela¸c˜ao especular entre dois ´atomos de carbono substitu´ıdos com quatro
ligantes diferentes. . . p. 22
2 Forma dipolar ou zwitterion do amino´acido. . . p. 24
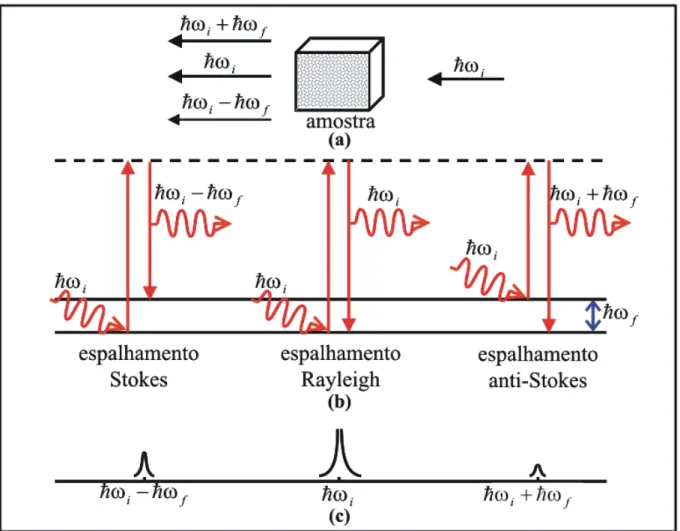
3 Representa¸c˜ao esquem´atica do efeito Raman de primeira ordem. (a) Radia¸c˜ao com uma ´unica freq¨uˆencia incidindo sobre a amostra e ra-dia¸c˜oes com diferentes freq¨uˆencias sendo reirradiadas pela amostra. (b) Esquema dos n´ıveis de energia para os espalhamentos Stokes, Anti-Stokes e Rayleigh. (c) Esquema de um espectro Raman t´ıpico mostrando, da esquerda para a direita as linhas Raman Stokes, Rayleigh e Raman
anti-Stokes. . . p. 30
4 Representa¸c˜ao esquem´atica dos vetores momento de dipolo e campo
el´etrico aplicado, para diversas situa¸c˜oes do tensor polarizabilidade. . . p. 33
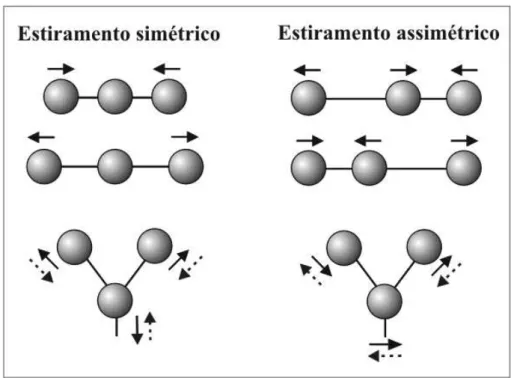
5 Modos de vibra¸c˜ao “stretching” sim´etrico e assim´etrico. . . p. 38
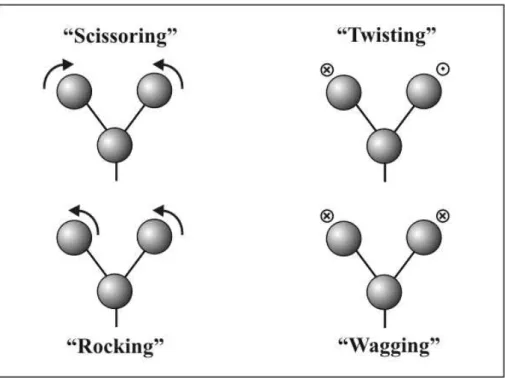
6 Modo de vibra¸c˜ao “bending” (encurvamento) e suas ramifica¸c˜oes: “scis-soring” (corte), “twisting” (tor¸c˜ao), “rocking” (oscila¸c˜ao) e “wagging” (balan¸co). Os s´ımbolos (⊙) e (⊗) representam o movimento do ´atomo
para fora e dentro do plano, respectivamente. . . p. 39
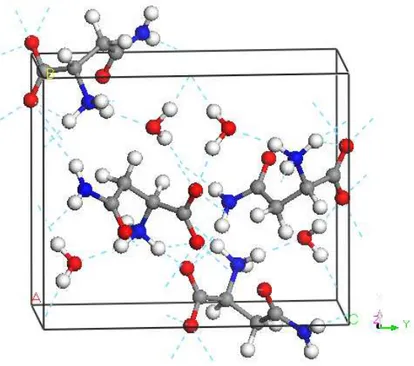
7 Representa¸c˜ao esquem´atica da c´elula unit´aria do cristal de L-asparagina
monohidratada. . . p. 41
8 Proje¸c˜ao da c´elula primitiva sobre o plano 100. . . p. 41
9 Proje¸c˜ao da c´elula primitiva da L-asparagina sobre o plano 010. . . p. 42
10 Mol´ecula do NH+
3. . . p. 43
11 Mol´ecula do NH2. . . p. 44
12 Mol´ecula do CH. . . p. 44
14 Mol´ecula do CO−
2. . . p. 45
15 Solu¸c˜oes aquosas de L-asparagina monohidratada com v´arios dopantes. p. 50
16 H´abito de crescimento mais encontrado quando da cristaliza¸c˜ao da
L-asparagina monohidratada. . . p. 51
17 Espectrˆometro de Raman Jobin-Yvon T64000. . . p. 55
18 Forno Linkam Scientific Instruments, modelo TS1500. . . p. 55
19 Espectrˆometro por Emiss˜ao Atˆomica. . . p. 56
20 (a) analisador termogravim´etrico da Shimadzu (TGA-50H) (b) calorimetro
diferencial de varredura da Shimadzu (DSC-50). . . p. 57
21 Cristais de L-asparagina monohidratada com diversas impurezas. . . p. 59
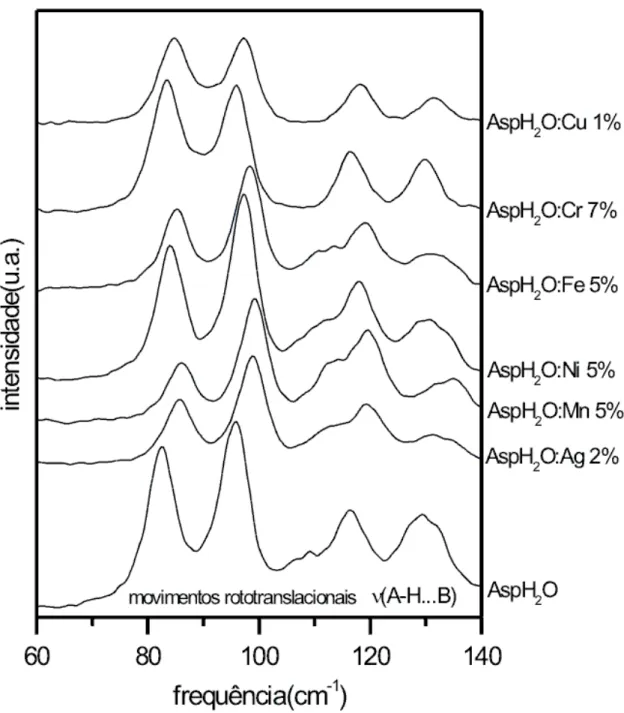
22 Espectros Raman de cristais de L-asparagina monohidratada pura e dopadas no intervalo espectral entre 60 e 220 cm−1
`a temperatura ambiente. p. 63
23 Espectros Raman de cristais de L-asparagina monohidratada pura e dopadas no intervalo espectral entre 60 e 140 cm−1
`a temperatura ambiente. p. 64
24 Espectros Raman de cristais de L-asparagina monohidratada pura e dopadas no intervalo espectral entre 140 e 220 cm−1
`a temperatura
am-biente. . . p. 65
25 Espectros Raman de cristais de L-asparagina monohidratada pura e dopadas no intervalo espectral entre 200 e 1000 cm−1
`a temperatura
ambiente. . . p. 67
26 Espectros Raman de cristais de L-asparagina monohidratada pura e dopadas no intervalo espectral entre 200 e 450 cm−1
`a temperatura
am-biente. . . p. 68
27 Espectros Raman de cristais de L-asparagina monohidratada pura e dopadas no intervalo espectral entre 450 e 750 cm−1
`a temperatura
am-biente. . . p. 69
28 Espectros Raman de cristais de L-asparagina monohidratada pura e dopadas no intervalo espectral entre 750 e 1000 cm−1
`a temperatura
29 Espectros Raman de cristais de L-asparagina monohidratada pura e dopadas no intervalo espectral entre 1000 e 1800 cm−1
`a temperatura
ambiente. . . p. 73
30 Espectros Raman de cristais de L-asparagina monohidratada pura e dopadas no intervalo espectral entre 1000 e 1200 cm−1
`a temperatura
ambiente. . . p. 74
31 Espectros Raman de cristais de L-asparagina monohidratada pura e dopadas no intervalo espectral entre 1200 e 1500 cm−1
`a temperatura
ambiente. . . p. 75
32 Espectros Raman de cristais de L-asparagina monohidratada pura e dopadas no intervalo espectral entre 1500 e 1800 cm−1
`a temperatura
ambiente. . . p. 76
33 Espectros Raman de cristais de L-asparagina monohidratada pura e dopadas no intervalo espectral entre 2800 e 3500 cm−1
`a temperatura
ambiente. . . p. 79
34 Espectros Raman de cristais de L-asparagina monohidratada pura e dopadas no intervalo espectral entre 2900 e 3000 cm−1
`a temperatura
ambiente. . . p. 80
35 Espectros Raman de cristais de L-asparagina monohidratada pura e dopadas no intervalo espectral entre 3000 e 3500 cm−1
`a temperatura
ambiente. . . p. 81
36 Evolu¸c˜ao dos espectros Raman do cristal de L-asparagina monohidratada com a temperatura na regi˜ao espectral entre 60 e 200 cm−1
. Os espectros foram obtidos aquecendo-se a amostra at´e 367 K (olhar de baixo para
cima) e depois resfriando-se novamente at´e 303 K (espectro superior). . p. 83
37 Freq¨uˆencia em fun¸c˜ao da temperatura do cristal de L-asparagina
mono-hidratada na regi˜ao dos modos externos. . . p. 85
38 Espectros Raman do cristal de L-asparagina monohidratada em fun¸c˜ao da temperatura no intervalo espectral entre 200 e 1000 cm−1
num ex-perimento de aquecimento da amostra. O espectro superior em 303K foi
39 Espectros da L-asparagina monohidratada em fun¸c˜ao da temperatura no intervalo espectral entre 1000 e 1800 cm−1
num experimento onde a amostra foi aquecida. O espectro superior em 303K foi obtido ap´os a
amostra ser novamente resfriada at´e a temperatura ambiente. . . p. 88
40 (a) Cristal de L-asparagina puro antes de ser submetido a alta tempe-ratura (b) Cristal de L-asparagina puro depois de ser submetido a alta
temperatura. . . p. 89
41 Espectros da L-asparagina monohidratada em fun¸c˜ao da temperatura no intervalo espectral entre 2800 e 3500 cm−1
num experimento onde a amostra foi aquecida. O espectro superior em 303K foi obtido ap´os a
amostra ser novamente resfriada a temperatura ambiente. . . p. 90
42 Curvas TGA da LAM pura sob atmosfera de N2. Massa da amostra
10g.Vaz˜ao de g´as 50mL/min. Raz˜ao de aquecimento 5oC/min. . . . p. 92
43 Gr´afico do DSC da L-asparagina monohidratada num intervalo de 20oC
a 120oC. sob atmosfera de N
2. Vaz˜ao de g´as 50mL/min. Raz˜ao de
aquecimento 2oC/min. . . . p. 94
44 (a) Cristal de L-asparagina dopado com Cr3+
antes de ser submetido a alta temperatura (b) Cristal de L-asparagina dopado com Cr3+
depois
de ser submetido a alta temperatura. . . p. 96
45 Espectros da L-asparagina monohidratada:Cr3+
em fun¸c˜ao da tempera-tura no intervalo espectral entre 60 e 200 cm−1
num experimento onde a amostra foi aquecida. O espectro superior em 303 K foi obtido ap´os a
amostra ser novamente resfriada at´e a temperatura ambiente. . . p. 98
46 Espectros da L-asparagina monohidratada:Cr3+
em fun¸c˜ao da tempera-tura no intervalo espectral entre 200 e 1000 cm−1
num experimento onde a amostra foi aquecida. O espectro superior em 303 K foi obtido ap´os a
amostra ser novamente resfriada at´e a temperatura ambiente. . . p. 100
47 Espectros da L-asparagina monohidratada:Cr3+
em fun¸c˜ao da tempera-tura no intervalo espectral entre 1000 e 1800 cm−1
num experimento onde a amostra foi aquecida. O espectro superior em 303 K foi obtido ap´os a amostra ser novamente resfriada da m´axima temperatura atingida no
48 Espectros da L-asparagina monohidratada:Cr3+
em fun¸c˜ao da tempera-tura no intervalo espectral entre 2800 e 3400 cm−1
num experimento onde a amostra foi aquecida. O espectro superior em 303 K foi obtido ap´os a
Lista de Tabelas
1 Radicais das estruturas dos amino´acidos mais comuns. . . p. 23
2 Distˆancias e ˆangulos das liga¸c˜oes de hidrogˆenio na LAM. . . p. 42
3 S´ıntese dos processos de crescimento de cristais. . . p. 49
4 Compostos dopantes. . . p. 52
5 Substˆancias utilizadas para a dopagem dos cristais de LAM, quantidade nominal de composto dopante adicionada `a solu¸c˜ao e quantidade
ab-sorvida do metal, de acordo com medidas de ICP-AES. . . p. 60
6 Modos normais de vibra¸c˜ao da LAM pura e dopadas no intervalo entre 60 e 200 cm−1
e sua classifica¸c˜ao tentativa. . . p. 66
7 Modos normais de vibra¸c˜ao da LAM pura e dopadas no intervalo entre 200 e 1000 cm−1
e sua classifica¸c˜ao tentativa. . . p. 71
8 Modos normais de vibra¸c˜ao da LAM pura e dopadas no intervalo entre 1000 e 1800 cm−1
e sua classifica¸c˜ao tentativa. . . p. 77
9 Modos normais de vibra¸c˜ao da LAM pura e dopadas no intervalo entre 2800 e 3500 cm−1
21
1
Introdu¸c˜
ao
Os amino´acidos s˜ao as unidades moleculares que se combinam para formar as prote´ınas. Em todas as esp´ecies vivas, as prote´ınas s˜ao constru´ıdas com o mesmo conjunto b´asico de vinte amino´acidos. Al´em de participarem na forma¸c˜ao das prote´ınas e enzimas, os amino´acidos tamb´em participam de uma ampla variedade de rea¸c˜oes qu´ımicas nos or-ganismos vivos, alguns deles sendo fundamentais nos processos produtores de energia e atividade muscular [1,2].
Nos ´ultimos anos tem crescido o interesse no estudo de materiais biol´ogicos, os quais al´em de terem um natural apelo por se tratar de sistemas relacionados a seres vivos, podem ter diversas aplica¸c˜oes tecnol´ogicas, incluindo a utiliza¸c˜ao em dispositivos ´opticos n˜ao-lineares (gera¸c˜ao de segundo harmˆonico para lasers de alta potˆencia, entre outros) [3-7].
Os amino´acidos encontrados nos organismos vivos s˜ao alfa amino´acidos. Apresenta um carbono central C, denominado carbono alfa, ao qual se ligam um agrupamento car-box´ılico (COOH), um agrupamento amina (NH2) e um ´atomo de hidrogˆenio. Apresentam
ainda um quarto ligante denominado radical R respons´avel pela distin¸c˜ao das diferentes esp´ecies. Este radical permite-nos definir algumas caracter´ısticas como polaridade e grau de ioniza¸c˜ao em solu¸c˜ao aquosa [8,1,2]. Portanto, os amino´acidos podem ser escritos na forma:
RCH(NH2)COOH
A partir da polaridade do radical R, os amino´acidos podem ser classificados em trˆes classes:
1 Introdu¸c˜ao 22
• Amino´acidos com Radical “R” Polar N˜ao-Carregado: Apresentam radicais R contendo hidroxilas, sulfidrilas e o grupo amida. S˜ao hidrof´ılicos. S˜ao eles: gli-cina, serina (R com fun¸c˜ao alco´olica), treonina (R com fun¸c˜ao alco´olica), ciste´ına (possui um radical sulfidrila), tirosina (R com agrupamento fenol), asparagina (R com agrupamento amida), glutamina (R com agrupamento amida).
• Amino´acidos com Radical “R” Polar Carregado:
Positivamente: diamino e monocarbox´ılicos: lisina, arginina, histidina.
Negativamente: monoamino e dicarbox´ılicos: ´acido asp´artico, ´acido glutˆamico.
A maioria dos amino´acidos s˜ao mol´eculas quirais [9,10]. O reconhecimento da exis-tˆencia de mol´eculas quirais e a sua importˆancia biol´ogica datam de mais de cem anos. Em torno de 1848, Pasteur verificou o car´ater assim´etrico de compostos com mesmas caracter´ısticas estruturais [11]. A primeira sugest˜ao quanto `a natureza desta diferen¸ca de arranjo espacial dos ´atomos de uma estrutura deve-se a van’t Hoff e, quase simultanea-mente, a Le Bell. Estes autores avan¸caram a hip´otese de que os ligantes num ´atomo de carbono tetrasubstituido disp˜oem-se na dire¸c˜ao dos quatro v´ertices de um tetraedro cujo centro ´e ocupado pelo ´atomo de carbono. Gera-se, deste modo, uma estrutura assim´etrica que conduz `a possibilidade de existˆencia de duas formas geom´etricas n˜ao sobrepon´ıveis que s˜ao a reflex˜ao especular uma da outra [10] (Figura 1). Os ´atomos de carbono respons´aveis pela assimetria s˜ao denominados centros de quiralidade.
Figura 1: Rela¸c˜ao especular entre dois ´atomos de carbono substitu´ıdos com quatro ligantes diferentes.
1 Introdu¸c˜ao 23
presentes nas prote´ınas. Os res´ıduos D-amino´acidos s˜ao componentes de polipept´ıdeos bacterianos (relativamente pequenos) [9,14]. Tais polipept´ıdeos s˜ao, talvez, grande parte integrante das paredes celulares bacterianas que impedem o ataque das enzimas produzi-das pelos outros organismos para digerir as bact´erias. S˜ao tamb´em componentes dos antibi´oticos antibacterianos. Os amino´acidos s˜ao ainda capazes de desviar o plano da luz polarizada para a direita ou para a esquerda, sendo denominados dextrogiro ou dextro-rotat´orio e lev´ogiro ou levo-dextro-rotat´orio, respectivamente [13].
Na Tabela 1 s˜ao apresentados os radicais das estruturas dos 20 amino´acidos mais co-muns, tamb´em conhecidos como amino´acidos fundamentais. O amino´acido L-asparagina, que ser´a estudado neste trabalho, pertence `a classe dos amino´acidos com radical R polar n˜ao carregado.
Tabela 1: Radicais das estruturas dos amino´acidos mais comuns.
Amino´acidos F´ormula
Alanina CH3
Arginina NH2C(NH)2(CH2)3
Asparagina NH2CO(CH2)
´
Acido Asp´artico COOOH(CH2)
Cisteina SH(CH2)
Glutamina NH2CO(CH2)2
´
Acido Glutˆamico COOH(CH2)2
Glicina H
Histidina (C3N2H4)CH2
Isoleucina (CH3)2CH2CH
Leucina (CH3)2CH(CH2)
Lisina NH2(CH2)4
Metionina CH3S(CH2)
Fenilanina (C6H5)CH2
Prolina 3CH2
Serina OH(CH2)
Treonina CH3(OH)CH
Tript´ofano (C6H4)HNC2HCH2
Tirosina (OHC6H4)CH2
Valina (CH3)2CH
1 Introdu¸c˜ao 24
negativa. No entanto, a mol´ecula pode ainda se apresentar neutra, onde o grupo amina est´a protonado e o grupo carbox´ılico n˜ao. Neste caso temos a forma de ´ıon dipolar tamb´em conhecida como forma zwitterion [15]. O valor do pH onde as cargas el´etricas dos amino´acidos se igualam e se anulam chama-se ponto isoel´etrico ou pH isoel´etrico. Na forma de ´ıon dipolar (zwitterion) o grupo carbox´ılico perde um pr´oton para ligar-se ao grupo amino, formando a amˆonia (Figura 2).
Figura 2: Forma dipolar ou zwitterion do amino´acido.
RCH(NH+ 3)CO
−
2 .
Esta forma bipolar produzir´a as condi¸c˜oes necess´arias para que uma s´erie de liga¸c˜oes de hidrogˆenio seja criada no cristal e este ´e um dos principais atrativos, do ponto de vista f´ısico, no estudo de cristais de amino´acidos.
As liga¸c˜oes de hidrogˆenio, na verdade, s˜ao vistas como um dos mais interessantes e ao mesmo tempo misteriosos mecanismos de liga¸c˜ao entre as mol´eculas. Elas desempenham um papel fundamental em v´arias propriedades da ´agua, destacando-se a imensa possibi-lidade de fases apresentada por ela [16-19]; na estabipossibi-lidade da dupla h´elice do ´acido deso-xirribonucl´eico [20]; em diversos fenˆomenos nos quais a orienta¸c˜ao de mol´eculas acontece atrav´es de intera¸c˜ao da substˆancia com fluidos hidrof´obicos (enovelamento de prote´ınas, forma¸c˜ao de membranas celulares) [21-25]; em materiais com importantes propriedades tecnol´ogicas, como em determinados ferroel´etricos [26,27]; entre outros.
No caso de polimorfos n˜ao hidratados dos cristais de amino´acidos as liga¸c˜oes de hidrogˆenio ocorrem entre ´atomos de hidrogˆenio de um grupo NH+
3 e ´atomos de oxigˆenio
do grupo CO−
2 de uma mol´ecula diferente. Os diversos tamanhos e ˆangulos das liga¸c˜oes
1 Introdu¸c˜ao 25
cristais tamb´em depender˜ao das liga¸c˜oes de hidrogˆenio bem como da caracter´ıstica polar e do tamanho da mol´ecula.
Para se investigar os cristais de amino´acidos, diversas t´ecnicas experimentais podem ser utilizadas. No que diz respeito `as propriedades vibracionais as t´ecnicas mais utilizadas s˜ao a espectroscopia Raman e o infravermelho. Com elas ´e poss´ıvel, al´em de se estudar a natureza das liga¸c˜oes de hidrogˆenio, obter-se informa¸c˜oes relacionadas `a conforma¸c˜ao molecular e inferir-se sobre a estabilidade de diversas estruturas cristalinas [6].
Por exemplo, no caso do mais simples amino´acido quirial, a L-alanina, diversos resulta-dos vˆem sendo publicaresulta-dos na literatura desde a d´ecada de 1970, esturesulta-dos estes devotaresulta-dos `a identifica¸c˜ao dos modos e aos efeitos de v´arios potenciais moleculares nas vibra¸c˜oes cristalinas [28,29], efeitos de temperatura sobre as propriedades vibracionais [30,31], com-portamento com a temperatura do modo torcional [32], localiza¸c˜ao dinˆamica de energia vibracional [33] e transi¸c˜ao de fase estrutural induzida por press˜ao [34], entre outros.
No caso de cristais de L-valina estudos de espalhamento Raman forneceram uma classifica¸c˜ao de diversos modos normais de vibra¸c˜ao do material, bem como mostraram que o material sofre uma transi¸c˜ao de fase em torno de 120 K [35].
Um outro cristal de amino´acido investigado por espectroscopia Raman foi a L-isoleuci-na, que ´e alif´atico (sem cadeias laterais) assim como a L-alanina e a L-valina. Semelhante-mente ao que ocorre com a L-alanina, a L-isoleucina n˜ao apresenta mudan¸cas estruturais com a temperatura, pelo menos no intervalo entre 10 e 300 K [36].
Um quarto cristal de amino´acido investigado por espalhamento de luz submetido a diversas condi¸c˜oes de temperatura e press˜ao foi a L-treonina [37]. Observou-se neste estudo que o material se mant´em est´avel a baixas temperaturas (da ambiente at´e cerca de 10 K) embora quando submetido a altas press˜oes ele sofra uma transi¸c˜ao de fase bastante evidente entre 20,3 e 22,4 kbar [38].
Transi¸c˜ao de fase induzida por press˜ao hidrost´atica tamb´em foi observada por es-palhamento de luz em cristais de taurina, que ´e um amino´acido de grande importˆancia para os processos bioqu´ımicos relacionados `a atividade das c´elulas nervosas, mas que est´a ausente nas prote´ınas. Aumentando-se o valor da press˜ao hidrost´atica observou-se que em aproximadamente 7 kbar o cristal de taurina sai da estrutura monocl´ınicaC5
2h e vai para
1 Introdu¸c˜ao 26
Esta ´e uma vis˜ao bem resumida e n˜ao exaustiva de alguns resultados existentes na literatura relacionados com as propriedades vibracionais de cristais de amino´acidos. O amino´acido que ser´a tratado nesta tese ´e a L-asparagina que, quando crescido em solu¸c˜ao aquosa, apresenta-se na forma monohidratada.
A asparagina ´e um amino´acido que desempenha um importante papel no controle do metabolismo de algumas fun¸c˜oes celulares em tecidos nervosos e cerebrais e ´e usado em v´arias plantas como reserva de nitrogˆenio [41,42]. A L-asparagina monohidratada ´e um material muito interessante para estudo porque a estrutura cristalina apresenta uma complexa rede de liga¸c˜oes de hidrogˆenio entre as mol´eculas de asparagina e as mol´eculas de ´agua. Alguns estudos realizados em cristais de L-asparagina monohidratada j´a foram reportados na literatura. Os primeiros deles tiveram como objetivo fazer uma identifica¸c˜ao dos modos normais de vibra¸c˜ao no p´o [43] e com luz polarizada em monocristais [41]. Tamb´em foi estudado o comportamento do cristal quando submetido `as baixas tempera-turas, tendo sido observado que ele sofre uma mudan¸ca estrutural entre 140 e 150 K [44]. Entretanto, o mais espetacular efeito de varia¸c˜ao de agentes externos sobre os espectros Raman do material acontece quando se aplica press˜ao hidrost´atica. Observa-se que entre 0 e 13 kbar o cristal de L-asparagina sofre trˆes diferentes transi¸c˜oes de fase [3], resultando este que foi confirmado por medidas de difra¸c˜ao de raios-X com radia¸c˜ao s´ıncroton [45].
Neste trabalho apresentamos um estudo sistem´atico do crescimento de cristais de L-asparagina monohidratada (LAM) dopadas com os seguintes metais de transi¸c˜ao: Ag, Cr, Cu, Fe, Mn, Ni. Com este tipo de dopagem focamos os seguintes objetivos:
(i) favorecer determinadas taxas direcionais de crescimento das amostras;
(ii) introduzir os ´ıons de metais de transi¸c˜ao num ambiente cristalino com uma variada gama de possibilidades de intera¸c˜oes.
Tamb´em apresentamos e discutimos resultados de espalhamento Raman nos seguintes cristais e condi¸c˜oes:
(i) LAM pura `a temperatura ambiente;
(ii) LAM dopadas com v´arios metais `a temperatura ambiente;
(iii) LAM pura a altas temperaturas;
(iv) LAM:Cr3+
1 Introdu¸c˜ao 27
28
2
Fundamentos Te´
oricos
Neste cap´ıtulo ser´a feita uma breve discuss˜ao dos fundamentos te´oricos deste tra-balho. Apresentaremos uma abordagem cl´assica do fenˆomeno do espalhamento Raman onde discutiremos os princ´ıpios fundamentais do processo e tamb´em os modos de vibra¸c˜ao da mol´ecula.
2.1
Espectroscopia Raman
Quando um feixe de luz proveniente de um meio material incide em um outro meio com diferente ´ındice de refra¸c˜ao, parte do feixe ´e refletida na interface entre os meios, parte ´e absorvida e o restante ´e transmitido. Tal intera¸c˜ao da luz com a mat´eria resulta no seu espalhamento. A luz poder´a ent˜ao se espalhar de forma el´astica ou inel´astica. No espalhamento el´astico, tamb´em conhecido como espalhamento Rayleigh, a luz espa-lhada tem o mesmo comprimento de onda da luz incidente. No espalhamento inel´astico, tamb´em conhecido como espalhamento Raman, a luz espalhada tem comprimentos de ondas diferentes da luz incidente.
O fenˆomeno do espalhamento inel´astico da luz pela mat´eria foi previsto e estudado teoricamente em 1922 por Brillouin e em 1923 por A. Smekal. Em 1928 foi observado experimentalmente pela primeira vez pelo indiano Chandrasekhara Vankata Raman e foi explicado utilizando-se a teoria corpuscular da luz. Em julho do mesmo ano os rus-sos Landsberg e Mandelstam publicaram um artigo informando sobre a observa¸c˜ao do fenˆomeno em cristais de quartzo [46]. Em meios gasosos esse efeito praticamente n˜ao ´e observado devido `a rarefa¸c˜ao das mol´eculas de g´as, mas em meios l´ıquidos ou s´olidos ´e intenso o suficiente para ser observado em aparatos experimentais relativamente simples.
2.1 Espectroscopia Raman 29
temos o efeito Raman de primeira ordem. Se dois ou mais fˆonons s˜ao envolvidos no processo temos o efeito Raman de segunda ordem [4].
Seja~ωi a energia incidente em um meio. Essa energia ´e compensada pela diminui¸c˜ao
ou aumento da freq¨uˆencia da luz espalhada~ωs. Considerando~ωf a freq¨uˆencia do fˆonon
temos que,
ωs =ωi±ωf.
Se a luz espalhada possui freq¨uˆencia menor que a da luz incidente, o sistema ab-sorve energia da radia¸c˜ao excitando um fˆonon e temos o espalhamento Raman Stokes (ωs = ωi −ωf). Quando a luz espalhada tem freq¨uˆencia maior que a luz incidente, o
2.1 Espectroscopia Raman 30
2.1 Espectroscopia Raman 31
2.1.1
Teoria Cl´
assica do Espalhamento Raman
De acordo com a teoria cl´assica da radia¸c˜ao eletromagn´etica, multipolos el´etricos e magn´eticos oscilam com a freq¨uˆencia da radia¸c˜ao eletromagn´etica. O fenˆomeno do espalhamento da luz pode ser explicado classicamente em termos da radia¸c˜ao eletro-magn´etica produzida por multipolos induzidos em um sistema espalhador pelo campo eletromagn´etico da radia¸c˜ao incidente [50].
2.1.2
Dipolo El´
etrico Induzido
As mol´eculas de um diel´etrico podem ser classificadas como polares (possuem mo-mento de dipolo permanente mesmo na ausˆencia de um campo polarizante Em) ou n˜ao polares (os centros de gravidade das distribui¸c˜oes de cargas positivas e negativas geral-mente coincidem). Mol´eculas lineares como H2, N2 e O2, ou mol´eculas monoatˆomicas
como He, Ne e Ar situam-se nesta ´ultima categoria.
A aplica¸c˜ao de um campo el´etrico produz um deslocamento relativo das cargas posi-tivas e negaposi-tivas nas mol´eculas n˜ao polares e os dipolos moleculares assim criados s˜ao de-nominados dipolos induzidos. O tipo mais simples de mol´ecula que pode ser visualizado ´e o formado por um s´o ´atomo neutro. Podemos construir um modelo cl´assico simples para o ´atomo e a partir desse modelo, derivar uma express˜ao para o momento de dipolo induzido e, por conseguinte, para sua polarizabilidade. Embora seja um modelo espec´ıfico para tratar de mol´eculas monoatˆomicas, podemos us´a-lo para mol´eculas diatˆomicas sim´etricas, aplicando-o separadamente a cada um dos ´atomos da mol´ecula para obtermos as polari-zabilidades atˆomicas. A polarizabilidade molecular ser´a, ent˜ao, a soma destas, ou o dobro da polarizabilidade atˆomica [51]. Assim, para a maioria dos sistemas necessitamos apenas considerar um momento de dipolo el´etrico induzido definido para um campo el´etrico da radia¸c˜ao por meio de s´eries de potˆencia,
~
P =P~ +P~2+P~3, (2.1)
onde
~
P = a·E~ (2.2)
~ P2
= 1 2β:E~
2
(2.3)
~ P3
= 1 3γ ...E~
3
2.1 Espectroscopia Raman 32
~
P e E~ s˜ao vetores dados em unidades de Cm e Vm−1
, respectivamente, e a, β e γ s˜ao os tensores polarizabilidade. Em geral, a dire¸c˜ao do dipolo induzido n˜ao ´e a mesma do campo el´etrico que o produziu, isto ´e, cada componente de ´e uma combina¸c˜ao linear diferente dos componentes deP~, cada componente deP~2
´e uma combina¸c˜ao linear diferen-te dos componendiferen-tes de E~2
, e assim por diante. No tratamento cl´assico, as equa¸c˜oes (2.2) a (2.4) indicam que os tensores s˜ao reais e sim´etricos. a ´e o tensor polarizabilidade de segundo rank com unidade CV−1
m2
,β´e um tensor hiperpolarizabilidade de terceiro rank com unidade CV−1
m3
e γ ´e o tensor hiperpolarizabilidade de quarto rank com unidade CV−1
m4
. Esses tensores podem ser dependentes do tempo, portanto, os dipolos induzidos e os campos el´etricos podem ter dependˆencias temporais diferentes.
2.1.3
Polarizabilidade
Considere a equa¸c˜ao (2.2) em queP~ eE~ s˜ao vetores ea´e um tensor. Esta equa¸c˜ao im-plica que a magnitude das componentes deP~ ´e definida pela magnitude das componentes deE~ pelas trˆes seguintes equa¸c˜oes lineares,
Px=αxxEx+αxyEy+αxzEz
Py =αyxEx+αyyEy +αyzEz (2.5)
Pz =αzxEx+αzyEy+αzzEz
Os nove coeficientes s˜ao chamados componentes do tensor polarizabilidade e podem ser escritos como:
αxx αxy αxz
αyx αyy αyz
αzx αzy αzz
(2.6)
Considerando o tensor polarizabilidade sim´etrico, a equa¸c˜ao (2.5) poder´a ser repre-sentada na forma matricial:
Px Py Pz =
αxx αxy αxz
αyx αyy αyz
αzx αzy αzz
Ex Ey Ez (2.7)
pode-2.1 Espectroscopia Raman 33
mos representar a equa¸c˜ao (2.7) da seguinte forma:
[P] = [α][E] (2.8)
Das equa¸c˜oes (2.5) vemos facilmente que a dire¸c˜ao do dipolo induzido poder´a ser diferente da do campo el´etrico que o originou. Assim, em geral, cada componente de P~
´e determinada por contribui¸c˜oes vindas de todas as trˆes componentes de E~. Caso exista somente uma componente deE~ ´e poss´ıvel produzir trˆes componentes de P~.
Figura 4: Representa¸c˜ao esquem´atica dos vetores momento de dipolo e campo el´etrico aplicado, para diversas situa¸c˜oes do tensor polarizabilidade.
Na Figura 4 ´e apresentada a dependˆencia do dipolo induzido P~ na forma do tensor polarizabilidade. (a) tensor diagonal (αij = 0; com i6=j); (b) αxy =αxz = 0; (c) nenhuma componente nula.
2.1.4
Teoria Cl´
assica
A teoria cl´assica nos permite tratar quantitativamente propriedades como a polari-za¸c˜ao e a dire¸c˜ao do espalhamento, a dependˆencia da freq¨uˆencia e alguns aspectos das regras de sele¸c˜ao, as quais definem a possibilidade ou n˜ao do espalhamento ou absor¸c˜ao da radia¸c˜ao.
Seja um sistema molecular interagindo com um campo el´etrico que oscila harmonica-mente e est´a associado com a radia¸c˜ao eletromagn´etica de freq¨uˆencia angularω0.
Inicial-mente esta mol´ecula ´e livre para vibrar, mas n˜ao para girar, ou seja, o centro de massa se encontra fixa no espa¸co em uma configura¸c˜ao de equil´ıbrio, mas os n´ucleos podem vibrar em torno de suas posi¸c˜oes de equil´ıbrio.
compo-2.1 Espectroscopia Raman 34
nente αij do tensor polarizabilidade em uma s´erie de Taylor com rela¸c˜ao `as coordenadas
normais de vibra¸c˜ao, ent˜ao temos,
αij = (αij)0+
Xµ∂αij
∂Qk
¶
0
Qk+1 2 X k,l µ ∂2 αij ∂Qk∂Ql ¶ 0
QkQl+. . . , (2.9)
onde (αij)0 ´e o valor deαij na configura¸c˜ao de equil´ıbrio,Qk,Ql s˜ao coordenadas normais
de vibra¸c˜ao associadas com as freq¨uˆencias vibracionais ωk, ωl, . . .. O somat´orio ´e feito sobre todas as coordenadas normais de vibra¸c˜ao. O ´ındice “0” nas derivadas indica que estas s˜ao tomadas nas configura¸c˜oes de equil´ıbrio.
Considerando somente os termos de primeira ordem em temos,
(αij)k= (αij)0+ ( ˙αij)kQk, (2.10)
onde
( ˙αij)k =
µ ∂αij ∂Qk ¶ 0 . (2.11)
( ˙αij)ks˜ao as componentes de um novo tensor chamado derivada do tensor polarizabilidade,
sendo todas as componentes derivadas em rela¸c˜ao `a coordenada normal dada.
Seja a derivada do tensor polarizabilidade associado com o modo k dada por a˙k.
Definindoak ea0 como os tensores componentes (αij)k e (αij)0 respectivamente, ent˜ao a
equa¸c˜ao (2.10) ´e v´alida para todas as componentes do tensor,
ak =a0+a˙kQk, (2.12)
onde Qk, a k-´esima coordenada normal ´e uma quantidade escalar que multiplica todos as componentes de a˙k. Assumindo movimento harmˆonico simples, isto ´e, harmonicidade
mecˆanica, a dependˆencia do tempo deQk ´e dada por,
Qk=Qk0cos(ωkt+δk), (2.13)
ondeQk0´e a amplitude da coordenada normal eδk´e um fator de fase. Inserindo a equa¸c˜ao
(2.13) na equa¸c˜ao (2.12) obtemos,
ak=a0+a˙kQk0cos(ωkt+δk), (2.14)
2.1 Espectroscopia Raman 35
o dipolo el´etrico induzido linear ser´a dado pela equa¸c˜ao (2.2),
~
P =ak·E,~
onde P~ ´e o vetor dipolo linear induzido no tempo t, ak ´e o tensor polarizabilidade
de-pendente do tempo definido na equa¸c˜ao (2.14) e E~ ´e o vetor campo el´etrico no tempo t.
A varia¸c˜ao da intensidade do campo el´etrico com o tempo ´e dada por
~
E =E~cosω0t; (2.15)
assim, podemos escrever,
~
P =ak·E~cosω0t; (2.16)
onde cosω0t ´e uma quantidade escalar que multiplica todos os termos da equa¸c˜ao linear
impl´ıcita na equa¸c˜ao (2.16).
Introduzindo a rela¸c˜ao (2.14) para ak obtemos,
~
P =a0·E~0cosω0t+a˙k·EQk~ 0cosω0tcos(ωkt+δk). (2.17)
Usando a identidade trigonom´etrica cosAcosB = 1
2{cos(A+B) + cos(A −B)} o
segundo termo na equa¸c˜ao (2.17) pode ser rearranjado e podemos escreverP~ na forma:
~
P =P~(ω0) +P~(ω0−ωk) +P~(ω0+ωk), (2.18)
onde
~
P(ω0) =P~(ω0){cosω0t} (2.19)
~
P(ω0) =ak·E~0 (2.20)
~
P(ω0−ωk) =P~(ω0−ωk){cos(ω0−ωk)t−δk} (2.21)
~
P(ω0−ωk) =
1
2Qk0a˙k·E~0 (2.22)
~
P(ω0+ωk) =P~(ω0+ωk){cos(ω0+ωk)t+δk} (2.23)
~
P(ω0+ωk) =
1
2Qka˙k·E~0 (2.24)
2.2 Fˆonons 36
equa¸c˜oes (2.22) e (2.24) e assim subseq¨uentemente.
Vemos que o dipolo induzido tem trˆes componentes distintas de freq¨uˆencia: P0(ω0),
que mant´em a radia¸c˜ao emω0e assim contribui para o espalhamento Rayleigh;P0(ω0−ωk),
que diminui a freq¨uˆencia da radia¸c˜ao para (ω0 −ωk) e contribui para o espalhamento
Raman Stokes eP0(ω0+ωk), que eleva a freq¨uˆencia da radia¸c˜ao para (ω0+ωk) e contribui
para o espalhamento Raman anti-Stokes. Observe que, tendo o dipolo induzido P0(ω0)
a mesma fase do campo incidente, os dipolos induzidos P0(ω0 ±ωk) variam as fases em
rela¸c˜ao ao campo incidente por ±δk. Esta quantidade define a fase da vibra¸c˜ao normal em rela¸c˜ao ao campo e ser´a diferente para diferentes mol´eculas.
2.2
Fˆ
onons
Fˆonon ´e um modo quantizado de vibra¸c˜ao que ocorre em uma estrutura cristalina r´ıgida. Podemos dizer que ´e a vers˜ao quˆantica dos modos normais de vibra¸c˜ao j´a co-nhecidos da mecˆanica cl´assica, sendo que este ´ultimo n˜ao carrega polariza¸c˜ao, ou seja, a oscila¸c˜ao ´e localizada na polariza¸c˜ao sem se propagar pela estrutura cristalina. Em um fˆonon a oscila¸c˜ao tende a se propagar por toda a estrutura cristalina e ´e caracterizado por uma velocidade de fase discretaν, uma freq¨uˆencia de oscila¸c˜aoω e um vetor de onda
~k [52]. Este vetor aponta na dire¸c˜ao da propaga¸c˜ao da onda no espa¸co rec´ıproco, tendo espectro discreto sem limites definidos. A rela¸c˜ao entre a freq¨uˆencia do fˆonon e seu vetor de onda ´e chamada de rela¸c˜ao de dispers˜ao e possui dois tipos de modos, denominados ac´usticos e ´oticos. Esses modos podem ainda ter vibra¸c˜ao longitudinal ou transversal. Quando a vibra¸c˜ao ´e longitudinal o deslocamento dos ´atomos a partir de sua posi¸c˜ao de equil´ıbrio coincide com a dire¸c˜ao de propaga¸c˜ao da onda. Quando a vibra¸c˜ao ´e transversal, o movimento dos ´atomos ´e perpendicular `a propaga¸c˜ao da onda. Em geral, para N ´atomos por c´elula unit´aria teremos trˆes ramos ac´usticos (1 longitudinal e 2 transversais) e (3N-3) ramos ´oticos ((N-1) longitudinais e (2N-2) transversais).
2.3 Modos Normais de Vibra¸c˜ao 37
atrav´es de uma an´alise de teoria de grupos, pode-se determinar os fˆonons ativos no Raman e suas simetrias [52].
2.3
Modos Normais de Vibra¸c˜
ao
Considere uma mol´ecula poliatˆomica composta de N ´atomos. O movimento completo desses ´atomos pode ser descrito com 3N graus de liberdade. Vamos supor que todos os N ´atomos de uma mol´ecula se movem simultaneamente na mesma quantidade na dire¸c˜ao x. Isto deslocar´a o centro de massa da mol´ecula inteira na dire¸c˜ao x sem causar qualquer altera¸c˜ao das dimens˜oes internas da mol´ecula. Isto ´e an´alogo para movimentos singulares nas dire¸c˜oes y e z. Assim, dos 3N graus de liberdade da mol´ecula, 3 n˜ao s˜ao exatamente vibra¸c˜oes mas somente transla¸c˜oes. Igualmente, considerando o movimento de todos os ´atomos em caminhos circulares sobre os eixos x, y e z, n˜ao constituem vibra¸c˜oes, mas rota¸c˜oes moleculares. Assim, de 3N graus de liberdade, somente 3N-6 s˜ao considerados movimentos vibrat´orios.
Para o caso especial de uma mol´ecula linear, a sua rota¸c˜ao pode ocorrer apenas em torno dos 2 eixos perpendiculares ao eixo molecular. Assim, uma mol´ecula linear com N ´atomos tem 3N-5 modos normais.
2.3.1
Tipos de Vibra¸c˜
oes
Os modos vibracionais em uma mol´ecula podem ser classificados como [53]:
• “Stretching” (ou estiramento): tamb´em denominados modo de valˆencia, s˜ao ca-racterizados como movimentos vibracionais peri´odicos de estiramento e relaxamento entre os ´atomos da mol´ecula (Figura 5). Neste tipo de modo vibracional s˜ao iden-tificadas duas ramifica¸c˜oes:
1. Modo sim´etrico: os ´atomos extremos, conforme apresentado na Figura 5, movimentam-se para dentro e para fora do plano molecular, estando ambos em fase.
2.3 Modos Normais de Vibra¸c˜ao 38
• “Bending”(ou dobramento): s˜ao identificados como movimentos vibracionais cuja dire¸c˜ao ´e perpendicular `a liga¸c˜ao entre os ´atomos em uma mol´ecula (Figura 6). Neste modo existem quatros ramifica¸c˜oes:
1. “Scissoring”(ou corte): caracteriza-se como um movimento dos ´atomos na dire¸c˜ao da mudan¸ca de ˆangulo, por´em mantendo-se no mesmo plano;
2. “Wagging”(ou balan¸co): define o movimento dos ´atomos para cima e para baixo do plano, sem que haja mudan¸ca de ˆangulo;
3. “Twisting”(ou tor¸c˜ao): movimento an´alogo ao “wagging”, no entanto, neste caso existe diferen¸ca de fase dos ´atomos em movimento;
4. “Rocking”(ou oscila¸c˜ao): os ´atomos extremos oscilam em fase no mesmo plano. No caso dos cristais de amino´acidos, na maioria das vezes, a vibra¸c˜ao do tipo “rocking” do grupo carbox´ılico produz bandas ativas no Raman com altas intensidades.
2.3 Modos Normais de Vibra¸c˜ao 39
40
3
A L-Asparagina Monohidratada
(LAM)
A asparagina foi o primeiro amino´acido a ser isolado, a partir de produtos naturais no ano de 1886. Apesar disso, somente em 1932 foi poss´ıvel encontrar este amino´acido em prote´ınas. Neste cap´ıtulo apresentaremos uma discuss˜ao do amino´acido L-asparagina monohidratada estudado neste trabalho bem como suas vibra¸c˜oes e principais carac-ter´ısticas.
3.1
Caracter´ısticas
A L-asparagina monohidratada, NH2CO(CH2)CH(NH2)COOH·H2O (LAM),
apre-senta estrutura zwitteriˆonica numa complexa rede cristalina constitu´ıda por sete liga¸c˜oes intermoleculares envolvendo todos os ´atomos de hidrogˆenio. `A temperatura ambiente, a LAM apresenta estrutura ortorrˆombica, pertencendo ao grupo espacial P212121 (D
4 2)
com 4 mol´eculas por c´elula unit´aria ocupando s´ıtios C1. Seus parˆametros de rede s˜ao
a= 5,588(1), b = 9,774(1) ec= 11,721(2)˚A. As quatro mol´eculas est˜ao localizadas em
A(x, y, z), B(1 2 +x,
1
2 −y, z), C(x, 1 2 +y,
1
2 −z) eD( 1
2 −x, y, 1
2 +z) [4,54]. Na Figura 7 ´e
apresentada uma vista da c´elula unit´aria do cristal de L-asparagina monohidratada.
3.1 Caracter´ısticas 41
Figura 7: Representa¸c˜ao esquem´atica da c´elula unit´aria do cristal de L-asparagina mono-hidratada.
3.2 Vibra¸c˜oes da L-Asparagina 42
Figura 9: Proje¸c˜ao da c´elula primitiva da L-asparagina sobre o plano 010.
As distˆancias e os ˆangulos das liga¸c˜oes de hidrogˆenio s˜ao apresentados na Tabela 2 [55].
Tabela 2: Distˆancias e ˆangulos das liga¸c˜oes de hidrogˆenio na LAM.
X-H...Y dx−H dH...Y dX...Y ∠H-X...Y
O4-H1...O1 1,029(14) 1,851(14) 2,866(10) 7,4(0,7)
O4-H2...Oi1 0,986(13) 1,854(13) 2,803(9) 12,6(0,8)
N1-H3...Oii4 1,043(11) 1,925(12) 2,839(7) 23,2(0,7)
N1-H4...Oiii2 1,055(10) 1,815(12) 2,809(7) 15,6(0,7)
N1-H5...Oiv3 1,042(13) 1,751(14) 2,784(8) 6,0(0,7)
N2-H6...Ov1 0,992(11) 1,949(13) 2,935(8) 5,1(0,6)
N2-H7...Oi2 1,002(12) 2,235(13) 3,050(7) 29,7(0,7)
3.2
Vibra¸c˜
oes da L-Asparagina
De acordo com Moreno [4], a mol´ecula da L-asparagina pode ser dividida em 6 sub-grupos, CO−
2, NH +
3, CH, CH2, CO e NH2. Todos esses subgrupos ocupam simetria
lo-cal C1 na estrutura D 4
vibra-3.2 Vibra¸c˜oes da L-Asparagina 43
cionais ´oticos distribu´ıdos nas representa¸c˜oes irredut´ıveis do grupo fator D4
2 na forma:
Γ = 60A+ 59B1+ 59B2+ 59B3, onde os modos da representa¸c˜ao As˜ao ativos no Raman
e os modos das representa¸c˜oes B1, B2 e B3 s˜ao ativos no Raman e no infravermelho.
Destes modos, 81 s˜ao modos de baixa freq¨uˆencia e s˜ao caracterizados como modos de vi-bra¸c˜oes da rede correspondendo a vivi-bra¸c˜oes de grupos moleculares contra outros grupos. Os 156 modos restantes s˜ao divididos entre os modos de m´edia e de alta-freq¨uˆencia sendo chamados de modos internos.
A mol´ecula livre da ´agua pertence ao grupo pontual C2v. Esse sistema apresenta
quatro opera¸c˜oes de simetria que s˜ao{E, C2, σv, σ
′
v} com nove graus de liberdade. Tem
trˆes modos normais de vibra¸c˜oes, dois que se transformam segundo a representa¸c˜ao irre-dut´ıvelA1 e um de acordo com a representa¸c˜ao irredut´ıvel B2. Os trˆes modos rotacionais
transformam-se de acordo com A2, B1 e B2, respectivamente. Consideraremos o
estira-mento sim´etrico comoν1, o “bending” H-O-H comoν2 e o estiramento assim´etrico como
ν3. As freq¨uˆencias destes modos s˜ao ν1 = 3,652; ν2 = 1,595 e ν3 = 3,576 cm
−1
; Ob-viamente, quando a ´agua entra na estrutura cristalina da LAM, estas freq¨uˆencias ser˜ao modificadas. Na LAM, as mol´eculas de ´agua encontram-se em s´ıtios de simetria C1.
3.2.1
Vibra¸c˜
oes Internas do NH
+3A estrutura livre da amˆonia (Figura 10) pertence ao grupo de simetria C3ve
apresenta-se na forma tetragonal com apresenta-seis modos normais de vibra¸c˜ao distribu´ıdos nas repreapresenta-senta¸c˜oes irredut´ıveis do grupo C3v como Γ = 2A1 + 2E. Na asparagina, todos os hidrogˆenios do
grupo NH+
3 formam liga¸c˜oes de hidrogˆenio com os oxigˆenios da ´agua e do grupo
car-box´ılico da asparagina. Tais liga¸c˜oes distorcem o s´ıtio da estrutura levando-a para o grupo de simetria C1 com conseq¨uente levantamento da degenerescˆencia dos modos da
representa¸c˜aoE. Essas liga¸c˜oes de hidrogˆenio produzem uma redu¸c˜ao nas freq¨uˆencias de vibra¸c˜aoν1 e ν3 de aproximadamente 250 cm
−1
[4].
3.2 Vibra¸c˜oes da L-Asparagina 44
3.2.2
Vibra¸c˜
oes Internas do NH
2No interior da asparagina, situada em s´ıtio C1, encontramos a estrutura do amino que
apresenta trˆes modos normais de vibra¸c˜ao, dois estiramentos e uma deforma¸c˜ao, seme-lhante `a mol´ecula da ´agua (Figura 11). O amino apresenta simetria C2h. Os ´atomos de
hidrogˆenio do grupo amino formam liga¸c˜oes de hidrogˆenio com os oxigˆenios do grupo car-box´ılico. Tais liga¸c˜oes tamb´em produzem redu¸c˜ao nas freq¨uˆenciasν1eν3, correspondentes
aos estiramentos sim´etrico e anti-sim´etrico respectivamente. Essa redu¸c˜ao ´e de aproxi-madamente 300 cm−1
com rela¸c˜ao `as freq¨uˆencias dos modos vibracionais da mol´ecula livre [4].
Figura 11: Mol´ecula do NH2.
3.2.3
Vibra¸c˜
oes Internas do CH
A estrutura CH (Figura 12) pertence ao grupo Cs, possui um eixo C1 e um plano h.
Possui um ´unico modo interno que ocorre por volta de 2900 cm−1
, sendo este um modo de estiramento. Os ´atomos vizinhos interagem pouco com o hidrogˆenio desta estrutura, conseq¨uentemente, espera-se que esta banda apresente pequena largura de linha sendo considerado um modo duro, isto ´e, quando submetido a varia¸c˜oes de temperatura e press˜ao ocorrem pequenas altera¸c˜oes em suas freq¨uˆencias Raman [4].
3.2 Vibra¸c˜oes da L-Asparagina 45
3.2.4
Vibra¸c˜
oes Internas do CO
O grupo CO (Figura 13) ´e linear e apresenta apenas um modo interno de vibra¸c˜ao. Este modo corresponde a um estiramento e sua freq¨uˆencia encontra-se no intervalo entre 1600 e 1800 cm−1
[4].
Figura 13: Mol´ecula do CO.
3.2.5
Vibra¸c˜
oes Internas do CO
−2
As mol´eculas de CO−
2 (Figura 14) s˜ao do tipo ABC, onde os ´atomos A e C s˜ao idˆenticos.
Isto garante que este composto pertence ao grupo de simetria D∞d. Seus modos internos
correspondem a dois estiramentos e a duas deforma¸c˜oes [4].
Para concluir esta se¸c˜ao destaca-se que num cristal as v´arias sub-unidades n˜ao est˜ao vibrando isoladamente do restante da mol´ecula e, como conseq¨uˆencia, cada banda Raman tem a contribui¸c˜ao de v´arias partes da mol´ecula embora, certamente, uma certa sub-unidade contribua mais do que as outras. Assim, por exemplo, quando se classifica a banda em aproximadamente 391 cm−1
como sendo uma tor¸c˜ao do NH+
3, est´a sendo dito
que a principal contribui¸c˜ao para aquela banda seja uma vibra¸c˜ao do grupamento amˆonia, embora outras partes da mol´ecula, como o esqueleto de carbonos tamb´em contribua.
Figura 14: Mol´ecula do CO−
3.3 L-Asparagina Monohidratada Dopada com Metais de Transi¸c˜ao 46
3.3
L-Asparagina Monohidratada Dopada com Metais
de Transi¸c˜
ao
Os metais, apesar de n˜ao serem os elementos qu´ımicos dominantes nos seres vivos, desempenham um papel de extrema importˆancia na mat´eria animada, haja vista que todos os processos qu´ımicos nos organismos biol´ogicos envolvem de uma forma ou de outra aquelas substˆancias. Como exemplo podemos citar a troca permanente de ´ıons K+
e Na+
que ocorre dentro das c´elulas dos seres humanos, um processo que s´o cessa na morte do indiv´ıduo; ou a entrada de ferro na constitui¸c˜ao da hemoglobina, possibilitando o transporte de oxigˆenio de um ponto a outro do organismo e a conseq¨uente produ¸c˜ao de energia.
Isto mostra que quando a vida foi formada no planeta praticamente todos os elementos qu´ımicos dispon´ıveis foram utilizados na complexa malha de processos bioqu´ımicos carac-ter´ısticos. A maior parte dos elementos presentes nos seres vivos s˜ao hidrogˆenio, oxigˆenio e carbono (´agua, prote´ınas, gorduras, etc.) mas algumas outras mol´eculas biol´ogicas possuem em menor escala o ferro, o zinco e o cobre, por exemplo.
Complexos de amino´acidos com metais constituem um importante modelo de sistema para o entendimento de propriedades eletrˆonicas de ´ıons metais em macromol´eculas bio-logicamente relevantes. Fe, Cu e Zn s˜ao colocados entre os mais importantes ´ıons de metais de transi¸c˜ao que entram na constitui¸c˜ao da mat´eria viva. Estudos da estrutura e compara¸c˜oes entre compostos que diferem pelo ´ıon metal ajudam a entender os diferentes pap´eis destes ´ıons nos complexos e as diferentes intera¸c˜oes que eles possam apresentar [56].
As pesquisas realizadas at´e a presente data, relacionando algumas propriedades f´ısicas de metais com cristais de amino´acidos, estiveram restritas `a substˆancia L-alanina. Estas investiga¸c˜oes concentram-se principalmente em medidas de ressonˆancia paramagn´etica eletrˆonica (EPR) e medidas de espalhamento Raman ressonante e transmiss˜ao ´otica [57,58]. Destes estudos foi poss´ıvel observar-se fracas absor¸c˜oes na regi˜ao do vis´ıvel devido a transi¸c˜oes eletrˆonicas mediadas por fˆonons e intensa absor¸c˜ao no ultravioleta, envolvendo orbitais 3d das impurezas (do Cu2+
e do Fe3+
). Como tamb´em foi observado um aumento ressonante da intensidade de vibra¸c˜oes classificadas como modos da rede e como modos do grupo carboxil, acredita-se que as impurezas estejam diretamente ligadas ao cristal, embora a maneira como isto aconte¸ca n˜ao seja perfeitamente entendida.
3.3 L-Asparagina Monohidratada Dopada com Metais de Transi¸c˜ao 47
48
4
Procedimentos Experimentais
Neste cap´ıtulo apresentamos os procedimentos experimentais (crescimento de cristais, espectroscopias Raman, ICP-AES e medidas t´ermicas de TGA e DSC) utilizadas no de-senvolvimento deste trabalho, dando-se uma ˆenfase particular na metodologia para o crescimento dos cristais puros e dopados com v´arios metais.
4.1
Crescimento de Cristais
A cristaliza¸c˜ao tem se desenvolvido significativamente durante os ´ultimos anos [60]. Os processos de prepara¸c˜ao podem ser vistos como uma mudan¸ca de estados de equil´ıbrio de um sistema [61]. O melhor m´etodo para a prepara¸c˜ao de um cristal depende tanto das propriedades f´ısicas e qu´ımicas dos elementos que entram na composi¸c˜ao da solu¸c˜ao quanto das propriedades que se deseja obter dos cristais. Dentre as v´arias t´ecnicas utilizadas para o crescimento de cristais, podemos destacar trˆes grandes categorias: fus˜ao, solu¸c˜ao e fase de vapor.
Na fus˜ao o processo predominante ´e quase sempre o transporte de calor e de massa. Na solu¸c˜ao ou fase de vapor predomina a cin´etica de adsor¸c˜ao (fixa¸c˜ao de duas mol´eculas de uma substˆancia na superf´ıcie de outra substˆancia).
4.2 Prepara¸c˜ao das Amostras 49
Tabela 3: S´ıntese dos processos de crescimento de cristais.
Parˆametros Fus˜ao Solu¸c˜ao Vapor
Temperatura de Crescimento
Temperatura de Fus˜ao
Menor que a Temperatura de Fus˜ao
Menor que a Temperatura de Fus˜ao)
Composi¸c˜ao en-tre as fases
Similar Diferente Similar ou Dife-rente
Velocidade de Crescimento
Alta(mm/hora) Baixa(mm/dia) Baixa(mm/dia)
Forma geom´etrica dos Cristais Determinada pela t´ecnica utilizada
Faces Naturais Faces Naturais
Pureza e per-fei¸c˜ao estrutural dos Cristais
Alta pureza e baixa perfei¸c˜ao estrutural
Alta Perfei¸c˜ao Estrutural e Baixa Pureza
Alta Pureza e Alta Perfei¸c˜ao Estrutural
O m´etodo de crescimento de cristais em solu¸c˜ao pode ser praticado atrav´es de v´arios processos dentre os quais podemos destacar:
• Convec¸c˜ao da concentra¸c˜ao
• Convec¸c˜ao For¸cada
• Resfriamento da Solu¸c˜ao
• Evapora¸c˜ao Lenta do Solvente
Neste trabalho, os cristais foram crescidos pelo m´etodo da evapora¸c˜ao lenta do sol-vente.
4.2
Prepara¸c˜
ao das Amostras
4.2 Prepara¸c˜ao das Amostras 50
Figura 15: Solu¸c˜oes aquosas de L-asparagina monohidratada com v´arios dopantes.
fazendo com que a evapora¸c˜ao da solu¸c˜ao seja mais r´apida do que a evapora¸c˜ao do soluto. A taxa de evapora¸c˜ao ´e calculada em fun¸c˜ao da superf´ıcie da solu¸c˜ao, a qual ´e mantida em contato com o meio ambiente.
A velocidade de crescimento dos cristais depende da taxa de varia¸c˜ao da super-satura¸c˜ao ∆sat. Essa varia¸c˜ao ´e diretamente proporcional `a superf´ıcie S em contato com
o meio externo e inversamente proporcional ao volume V da solu¸c˜ao [4]. Assim, temos que a taxa de varia¸c˜ao da supersatura¸c˜ao pode ser resumidamente expressa como:
∆sat ∝ ·VS
4.3 Amostras de LAM Pura 51
4.3
Amostras de LAM Pura
Na prepara¸c˜ao das solu¸c˜oes de L-asparagina monohidratada pura foram dilu´ıdos 1,425 g de p´o de L-asparagina da Vetec, em 50 ml de ´agua destilada `a temperatura ambiente, a aproximadamente 300 K. As solu¸c˜oes foram levadas ao repouso na mesa de crescimento de cristais a uma temperatura ambiente de aproximadamente 297 K. Os cristais obtidos foram transparentes, possuindo dimens˜oes de aproximadamente 7x2x2mm3
, apresentando um grande n´umero de faces.
Figura 16: H´abito de crescimento mais encontrado quando da cristaliza¸c˜ao da L-asparagina monohidratada.
Em uma outra prepara¸c˜ao, foram dilu´ıdos 2,2 g de p´o de L-asparagina monohidratada, de mesma marca, em 100 ml de ´agua destilada. Estas solu¸c˜oes foram levadas ao repouso na geladeira, a uma temperatura de aproximadamente 277 K. Os cristais crescidos na geladeira eram transparentes, por´em, apresentaram tamanhos mais reduzidos, com di-mens˜oes de aproximadamente 4x3x1 mm3
4.4 Amostras de LAM Dopadas 52
4.4
Amostras de LAM Dopadas
Na prepara¸c˜ao das solu¸c˜oes de L-asparagina dopadas com metais de transi¸c˜ao foram utilizados diversos compostos, os quais est˜ao indicados na Tabela 4.
Tabela 4: Compostos dopantes.
Elemento Composto F´ormula
Cr Cloreto de Cromo III CrCl3·6H2O
Mn Cloreto de Manganˆes(II) M nCl2·4H2O
Fe Sulfato de Ferro II F eSO4·7H2O
Fe Sulfato de Ferro III F e2(SO4)3·xH2O
Fe Sulfato de Amˆonio Ferroso(II) (N H4)2F e(SO4)2·6H2O
Fe Cloreto F´errico F eCl3·6H2O
Ni Cloreto de N´ıquel N iCl2·6H2O
Cu Sulfato C´uprico CuSO4·5H2O
Ag Nitrato de Prata AgN O3
A seguir, faz-se uma r´apida descri¸c˜ao de como os v´arios cristais dopados foram preparados.
• L-asparagina monohidratada:Ag
Na prepara¸c˜ao das solu¸c˜oes de L-asparagina monohidratada dopada com prata foram dilu´ıdos 0,855 g de p´o de L-asparagina fabricado pela Vetec em 30 ml de ´agua destilada. Foi adicionado 0,017 g de nitrato de prata (AgN O3), fabricado pela Vetec, correspondendo
a 2% do soluto L-asparagina monohidratada. A solu¸c˜ao apresentou pH = 6 e foi levada ao repouso na mesa de crescimento a uma temperatura de aproximadamente 297 K.
• L-asparagina monohidratada:Fe
Na prepara¸c˜ao das solu¸c˜oes de L-asparagina monohidratada dopada com ferro foram dilu´ıdos 1,425 g de p´o de L-asparagina fabricado pela Vetec em 50 ml de ´agua destilada. Foi adicionado 0,071 g de sulfato de amˆonio ferroso hexahidratado (N H4)2F e(SO4)2 ·
6H20, fabricado pela Merck, correspondendo a 5% do soluto L-asparagina monohidratada.
4.4 Amostras de LAM Dopadas 53
• L-asparagina monohidratada:Cr
Na prepara¸c˜ao das solu¸c˜oes de L-asparagina monohidratada dopada com cromo foram dilu´ıdos 0,570 g de p´o de L-asparagina fabricado pela Vetec em 20 ml de ´agua destilada. Foi adicionado 0,040 g de cloreto de cromo III CrCl3, fabricado pela Sigma,
correspon-dendo a 7% do soluto L-asparagina monohidratada. A solu¸c˜ao apresentou pH = 5 e foi levada ao repouso na geladeira a uma temperatura em torno de 277 K.
• L-asparagina monohidratada:Mn
Na prepara¸c˜ao das solu¸c˜oes de L-asparagina monohidratada dopada com manganˆes foram dilu´ıdos 0,855 g de p´o de L-Asparagina fabricado pela Vetec em 30 ml de ´agua destilada. Foi adicionado 0,040 g de cloreto de manganˆes (II) M nCl2 ·4H2O, fabricado
pela Merck, correspondendo a 5% do soluto L-asparagina monohidratada. A solu¸c˜ao apresentou pH = 6 e foi levada ao repouso na mesa de crescimento a uma temperatura de aproximadamente 297 K.
• L-asparagina monohidratada:Ni
Na prepara¸c˜ao das solu¸c˜oes de L-asparagina monohidratada dopada com n´ıquel foram dilu´ıdos 0,855 g de p´o de L-asparagina fabricado pela Vetec em 30 ml de ´agua destilada. Foi adicionado 0,042 g de cloreto de n´ıquel N iCl2 ·6H2O, fabricado pela Sigma,
corres-pondendo a 5% do soluto L-asparagina monohidratada. A solu¸c˜ao apresentou pH = 4 e foi levada ao repouso na mesa de crescimento a uma temperatura de aproximadamente 297 K.
• L-asparagina monohidratada:Cu
Na prepara¸c˜ao das solu¸c˜oes de L-asparagina monohidratada dopada com cobre foram dilu´ıdos 1,425 g de p´o de L-asparagina fabricado pela Vetec em 50 ml de ´agua destilada. Foi adicionado 0,0285 g de sulfato c´uprico CuSO4·5H2O, fabricado pela Vetec,
4.5 Medidas de Espectroscopia Raman 54
• L-Asparagina monohidratada:Fe
Na prepara¸c˜ao de uma outra solu¸c˜ao de L-asparagina monohidratada dopada com ferro foram dilu´ıdos 1,425 g de p´o de L-asparagina fabricado pela Vetec em 50 ml de ´agua destilada. Foi adicionado 0,0285 g de sulfato de amˆonio ferroso (II) (N H4)2F e(SO4)2 ·
6H2O, fabricado pela Vetec, correspondendo a 2% do soluto L-asparagina monohidratada.
A solu¸c˜ao apresentou pH = 6 e foi levada ao repouso na mesa de crescimento a uma temperatura em torno de 297 K.
• L-Asparagina monohidratada:Fe
Na prepara¸c˜ao de uma terceira solu¸c˜ao de L-asparagina monohidratada dopada com ferro foram dilu´ıdos 0,855 g de p´o de L-asparagina fabricado pela Vetec em 30 ml de ´agua destilada. Foi adicionado 0,042 g de sulfato de amˆonio ferroso (II) (N H4)2F e(SO4)2 ·
6H2O, fabricado pela Merck, correspondendo a 5% do soluto L-asparagina monohidratada.
A solu¸c˜ao apresentou pH = 5 e foi levada ao repouso na mesa de crescimento a uma temperatura pr´oxima de 297 K.
4.5
Medidas de Espectroscopia Raman
As medidas de espectroscopia Raman foram realizadas, utilizando-se um espectrˆometro triplo, modelo T64000 da Jobin-Yvon (Figura 17) equipado com redes de difra¸c˜ao de 1800 linhas/mm e com detetor CCD refrigerado a nitrogˆenio l´ıquido, usado em modo subtra-tivo. A fonte de excita¸c˜ao usada foi a linha 514,5 nm proveniente de um laser de argˆonio. O feixe do laser foi focalizado utilizando um microsc´opio da OLYMPUS BH-2 e spot com diˆametro da ordem de 2 µm.
Os dados obtidos foram aquisicionados por um computador acoplado ao espectrˆometro e em seguida transferidos para outro computador onde foram tratados com a ajuda dos
softwares PeakFit e Origin. Os espectros foram ajustados por soma de picos, usando uma fun¸c˜ao lorentziana e em seguida foram extra´ıdos dados como posi¸c˜ao, intensidade e largura de linha das bandas Raman observadas.
4.5 Medidas de Espectroscopia Raman 55
e o espa¸co da amostra, sob a janela de quartzo, recebia durante os experimentos um pe-queno fluxo de g´as argˆonio.
Figura 17: Espectrˆometro de Raman Jobin-Yvon T64000.
4.6 Medidas de ICP-AES 56
4.6
Medidas de ICP-AES
A Espectroscopia de Emiss˜ao Atˆomica ´e uma t´ecnica utilizada para an´alise qu´ımica de solu¸c˜oes aquosas de rochas e outros materiais. Determina quantitativamente o n´ıvel de concentra¸c˜ao de metais, como P, Ca, K, Na, Fe, Mn, Al, Mg e metais de transi¸c˜ao, em amostras geol´ogicas, ambientais e ´agua, a¸cos e ligas, materiais orgˆanicos e alimentos.
O princ´ıpio fundamental desta t´ecnica consiste na ioniza¸c˜ao dos elementos a serem analisados pelo plasma indutivo de argˆonio. No plasma as amostras transportadas em forma de aerosol passam pelos processos f´ısico-qu´ımicos de dessolvata¸c˜ao, vaporiza¸c˜ao, dissocia¸c˜ao e ioniza¸c˜ao. Em seguida, a luz emitida ´e filtrada e separada por regi˜ao do espectro (difratada pelas redes de difra¸c˜ao). Cada regi˜ao do espectro est´a associada a uma transi¸c˜ao eletrˆonica e as intensidades luminosas s˜ao medidas, uma vez que s˜ao proporcionais `a concentra¸c˜ao do elemento. A an´alise qu´ımica ´e baseada em uma curva de calibra¸c˜ao feita com o padr˜ao do elemento de interesse, utilizando o m´etodo da compara¸c˜ao entre a intensidade da luz emitida pelo material analisado e a intensidade emitida pelo padr˜ao. Na Figura 19 ´e apresentado o espectrˆometro por emiss˜ao atˆomica.
4.7 Medidas T´ermicas 57
4.7
Medidas T´
ermicas
Foram realizadas medidas de an´alise t´ermica nos cristais de LAM pura pelas t´ecnicas de an´alise termogravim´etrica (TGA) e calorimetria diferencial de varredura (DSC).
As medidas de TGA foram realizadas no Laborat´orio de An´alise T´ermicas do De-partamento de Qu´ımica Orgˆanica e Inorgˆanica da UFC, utilizando-se um analisador termogravim´etrico da Shimadzu (TGA-50H) (Figura 20(a)) com as seguintes especi-fica¸c˜oes: faixa de temperatura da ambiente a 1500oC; taxa de aquecimento program´avel
de 0,1oC/hora a 50,0oC/min; tempo de reten¸c˜ao de 0 a 999 min, 0 a 999 hora; formato
de programa¸c˜ao de temperatura m´aximo 99 passos; arquivo de programa¸c˜ao de tempera-tura de at´e 100 arquivos; m´etodo de esfriamento a ar; sinal de sa´ıda anal´ogico e digital; atmosfera controlada por flux´ımetro de g´as embutido (m´ax 250 ml/min).
As medidas de DSC foram realizadas no Laborat´orio de An´alise T´ermicas do Departa-mento de Qu´ımica Orgˆanica e Inorgˆanica da UFC, utilizando-se um calor´ımetro diferencial de varredura da Shimadzu (DSC-50) (Figura 20(b)) com as seguintes especifica¸c˜oes: faixa de temperatura da ambiente a 725oC; faixa de fluxo de calor de 0,01mW a 100 mW;
tempo de reten¸c˜ao de 0 a 999 min, hora; Taxa de programa de 0,1 a 99,9oC/min ou 0,1
a 99,9oC/h; atmosfera controlada a g´as inerte ou ar; sinal de sa´ıda anal´ogico e digital.
(a) (b)