CENTRO DE CIÊNCIAS TECNOLÓGICAS – CCT DEPARTAMENTO DE ENGENHARIA MECÂNICA –DEM
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS - PGCEM
GISELE MARIA LEITE DALMÔNICO
ELABORAÇÃO E CARACTERIZAÇÃO DE BIOMATERIAIS GRANULADOS MICROPOROSOS DE FOSFATOS DE CÁLCIO:
TESTE IN VIVO EM OVINOS
GISELE MARIA LEITE MARIA LEITE DALMÔNICO
ELABORAÇÃO E CARACTERIZAÇÃO DE BIOMATERIAIS GRANULADOS MICROPOROSOS DE FOSFATOS DE CÁLCIO:
TESTE IN VIVO EM OVINOS
Tese de Doutorado apresentada ao Programa de Pós Graduação em Ciência e Engenharia de Materiais - PGCEM da Universidade do Estado de Santa Catarina – UDESC (CCT), como requisito parcial para obtenção do título de doutora em Ciência e Engenharia de Materiais.
Orientador: Prof. Dr. Nelson Heriberto Almeida Camargo.
D148e Dalmônico, Gisele Maria Leite Elaboração e caracterização de biomateriais
granulados microporosos de fosfatos de cálcio: teste in vivo em ovinos / Gisele Maria Leite Dalmônico. – 2015.
211 p. : il. ; 21 cm
Orientador: Nelson Heriberto Almeida Camargo Bibliografia: p. 197-211
Tese (doutorado) – Universidade do Estado de Santa Catarina, Centro de Ciências Tecnológicas, Mestrado em Ciência e Engenharia de Materiais, Joinville, 2015.
1. Fosfatos de Cálcio. 2. Bifásicos de fosfatos de cálcio. 3. Substitutos ósseos. 4. Regeneração óssea. I. Camargo, Nelson Heriberto Almeida. II. Universidade do Estado de Santa Catarina. Programa de Pós-Graduação em Ciência e Engenharia de Materiais. III. Título
Ao meu ídolo e pai José Dalmônico (in memoriam) À minha doce inspiração e mãe Helenice do Carmo Leite Dalmônico Aos sábios ensinamentos de meu pai José Dalmônico (in memoriam): "Vanitas vanitatum et omnia vanitas"
[Eclesiastes, 12, 8]
"Nolite iudicare…"
AGRADECIMENTOS
H averá um tempo de saudade E m suspiro de amor presente
L evando consigo momentos de eternidade E fundo a gente sente no silêncio a ausência N a distância a veemência do pranto I magem viva e pura no entanto C om sabor de felicidade...
E esta saudade como brinca e como doi.
RESUMO
DALMÔNICO, Gisele Maria Leite. Elaboração e caracterização de biomateriais granulados de fosfatos de cálcio: teste in vivo em ovinos, 2015. 232 p. Tese (Doutorado em Ciência e Engenharia de Materiais – Área: Cerâmica) – Universidade do Estado de Santa Catarina. Programa de Pós Graduação em Ciência e Engenharia de Materiais, Joinville, 2015.
Os tratamentos de perdas ósseas são temas de pesquisa que envolve diferentes áreas do conhecimento científico, engenharia, física, química, biologia e biomédica. Os biomateriais que se destacam como substitutos em tratamentos da estrutura óssea são a hidroxiapatita, os fosfatos de cálcio-β e α, os bifásicos hidroxiapatita/fosfato de cálcio-β, α e os
biomateriais nanocompósitos de matriz hidroxiapatita. O destaque destes biomateriais como substitutos ósseos, se deve, por apresentarem cristalografia similar à da apatita óssea do esqueleto humano, por serem bioativos e biocompatíveis. As biocerâmicas bifásicas nanoestruturadas são pesquisadas e demonstram ser promissoras como substitutos ósseos em procedimentos cirúrgicos de reparação e reconstrução do tecido ósseo. Este projeto se desenvolveu com base na investigação de biomateriais de fosfatos de cálcio, envolvendo a síntese de duas matrizes de fosfatos de cálcio: Fosfato de cálcio-β (TCP-β) e hidroxiapatita (HA)
e elaboração de biomateriais granulados microporosos de TCP-β, HA e
cálcio, demonstraram capacidade de reparação e reconstrução óssea para os dois tempos de teste in vivo avaliados, revelando a osseointegração e a neoformação óssea semelhante entre as composições.
ABSTRACT
DALMÔNICO, Gisele Maria Leite. Elaboration and synthesis of granulates biomaterials of calcium phosphates: in vivo test in sheep, 2015. 232 p. Thesis (Doctorate in Science and Materials Engineering - Area: Pottery) - Universidade do Estado de Santa Catarina. Materials Engineering and Science Program, Joinville, 2015.
Å – Angstrom Al2O3– alumina
Ca/P – razão cálcio/fósforo Ca10(PO4)6(OH)2–
hidroxiapatita estequiométrica Ca3(PO4).H2O – fosfato de
cálcio hidratado
CaCO3– carbonato de cálcio
CaHPO4– monetita
CaO – óxido de cálcio CaPO3(OH).2H2O – brushita
cm-1– centímetros-1
CO2– grupamento dióxido de
carbono
CO32- – grupamento carbonato
DCP – mono-hidrogênio fosfato de cálcio
DCPD – mono-hidrogênio fosfato de cálcio dihidratado DRX – difração de Raios X FTIR – Infravermelho por Transformada de Fourier g – grama
H2O – água
H3PO4– ácido fosfórico
HA – hidroxiapatita
HPO42- – grupamento hidrogeno
fosfato
IHA – intensidade do pico
principal do DRX da composição hidroxiapatita ITCP – intensidade do pico
principal do DRX da composição de fosfato tricálcico.
JCPDS – Joint Committee on Powder Diffraction Standards kV – Kilovolt
mA – miliampère
MCPM – fosfato monocálcico mono-hidratado
MEV – Microscopia Eletrônica de Varredura
Mg – Magnésio min – minutos mL – mililitro nm – nanômetro ºC – graus Celsius OCP – fosfato octacálcico OH-– grupamento hidroxila
pH – potencial hidrogêniônico PO43-– grupamento fosfato
SE – elétrons secundários TCP – fosfato tricálcico TTCP – Fosfato tetracálcico
SUMÁRIO
INTRODUÇÃO ... 26
OBJETIVO GERAL ... 27
OBJETIVOS ESPECÍFICOS ... 27
CAPITULO I. REVISÃO DA LITERATURA ... 30
I.1. BIOMATERIAIS ... 30
I.1.1. CLASSIFICAÇÃO DOS BIOMATERIAIS ... 30
I.1.2. BIOCOMPATIBILIDADE E BIOFUNCIONALIDADE ... 33
I.1.3. TECIDO ÓSSEO ... 34
I.2. CLASSIFICAÇÃO DAS BIOCERÂMICAS DE FOSFATO
DE CÁLCIO ... 35
I.2.1. FOSFATO DE CÁLCIO (TCP) ... 39
I.2.2. HIDROXIAPATITA ... 41
I.2.3. BIOMATERIAIS BIFÁSICOS DE FOSFATOS DE CÁLCIO ... 43
I.2.4. MÉTODOS DE SÍNTESE DE FOSFATOS DE CÁLCIO ... 46
I.2.5. SINTERABILIDADE DE PÓS CERÂMICOS ... 47
I.3. TECNICAS DE CARACTERIZAÇÃO DE BIOMATERIAIS.. 48
I.3.1. Difração de Raios X (DRX)... 49
I.3.2. Espectroscopia de Infravermelho por Transformada de Fourier ... 51
I.3.3. Espectroscopia Raman ... 53
I.3.4. Área Superficial Específica pelo método (BET).... 55
I.3.5. Tamanho de Partícula por Difração a Laser ... 57
I.3.6. Técnicas de medidas de densidade e porosidade de biomateriais... 58
I.3.7. Análise do Comportamento Térmico ... 61
I.3.8. Microscopia Eletrônica de Varredura (MEV) ... 65
I.3.9. Microscopia de Força Atômica (AFM) ... 68
I.3.10. Microscópio Confocal (MC) ... 69
I.3.11. Microscopia Óptica (MO) ... 70
I.3.12. Microscopia de Luz Polarizada (MLP)... 72
... 75
CAPÍTULO II. METODOLOGIA EXPERIMENTAL ... 78
II.1. MATÉRIA PRIMA UTILIZADA ... 78
II. 1.1. CARBONATO DE CÁLCIO ... 78
II. 1.2. ÓXIDO DE CÁLCIO ... 78
II. 2.3. ÁGUA DESTILADA ... 80
II. 2.4. ÁCIDO FOSFÓRICO (H3PO4) ... 80
II.2. MÉTODO DE SÍNTESE POR VIA ÚMIDA ... 80
II. 3. ELABORAÇÃO DOS PÓS NANOESTRUTURADOS E OS
BIOMATERIAIS ... 82
II. 4. CARACTERIZAÇÃO ... 83
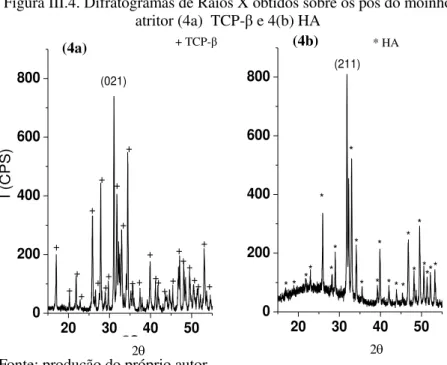
II. 4.1. DIFRAÇÃO DE RAIOS X (DRX) ... 83
II. 5.2. ANÁLISE PELA ESPECTROMETRIA DE INFRAVERMELHO (FTIR) ... 84
II. 5.3. ANÁLISE PELA ESPECTROMETRIA DE RAMAN ... 84
II.5.4. ÁREA SUPERFICIAL ESPECÍFICA POR ADSORÇÃO GASOSA (BET) ... 85
II. 5.5. TAMANHO DE PARTÍCULAS ... 85
II.5.6. DETERMINAÇÃO DA DENSIDADE REAL DE PÓS POR PICTOMETRIA DE HÉLIO ... 85
II.5.7. ANÁLISE DE POROSIDADE POR POROSIMETRIA DE MERCÚRIO ... 86
II.5.8. POROSIDADE ABERTA E DENSIDADE HIDROSTÁTICA PELO MÉTODO DE ARTHUR ... 86
II.6. CARACTERIZAÇÃO DO COMPORTAMENTO
TÉRMICO ... 87
II.6.1 CALORIMETRIA EXPLORATÓRIA DIFERENCIAL (DSC) ... 87
II.6.2. DILATOMETRIA ... 88
II.7. CARACTERIZAÇÃO MORFOLÓGICA E
MICROESTRUTURAL ... 88
II.7.1. MICROSCOPIA ELETRÔNICA DE VARREDURA ... 88
II.7.2. MICROSCOPIA ELETRÔNICA EFEITO DE CAMPO (FIELDS EMISSION GUN - FEG) ... 89
II.7.4. MICROSCOPIA CONFOCAL... 90 II.7.5. MICROSCOPIA ÓPTICA ... 90 II.7.6. MICROSCOPIA ÓPTICA DE LUZ POLARIZADA ... 90
II.8. ANÁLISE GRANULOMÉTRICA DOS GRÂNULOS ... 91
II.9. PROCEDIMENTO CIRÚRGICO ... 92
II.9.1. TESTE IN VIVO ... 92
II.9.2. METODOLOGIA CIRÚRGICA ... 94
II.10. PREPARO DOS FRAGMENTOS ÓSSEOS PARA
CARACTERIZAÇÃO ... 95
PARTE III. RESULTADOS E DISCUSSÕES ... 96
III.1. CURVAS REPRESENTATIVAS DO VALOR DO PH DA
SUSPENSÃO COLOIDAL ... 97
III.2. CARACTERIZAÇÃO POR DIFRATOMETRIA DE
RAIOS X (DRX) ... 99
III.3. ANÁLISE PELA ESPECTROMETRIA DE
INFRAVERMELHO (FTIR)... 105
III.4. ANÁLISE PELA ESPECTROMETRÍA DE RAMAN ... 109
III.5. ANÁLISE POR ESPECTROSCOPIA DE RAMAN DOS
FRAGMENTOS ÓSSEOS COM 90 DIAS DE TESTE IN VIVO .. 112
III.6. ANALISE POR ESPECTROSCOPIA DE RAMAN DOS
FRAGMENTOS ÓSSEOS COM 180 DIAS DE TESTE IN VIVO 122
III.7. ÁREA SUPERFICIAL ESPECÍFICA POR BET ... 128
III.8. ANÁLISE DO TAMANHO DE PARTÍCULAS ... 129
III.9. ANÁLISE DA DENSIDADE REAL POR PICNOMETRIA
DE HÉLIO ... 132
III.10. ANÁLISE DE POROSIDADE ABERTA ... 133
III.11. ANÁLISE TÉRMICA POR CALORIMETRIA
III.12. DILATOMETRIA ... 134
III.13. CARACTERIZAÇÃO MORFOLÓGICA DOS PÓS
NANOESTRUTURADOS (FEG) ... 136
III.14. CARACTERIZAÇÃO MICROESTRUTURAL DOS
BIOMATERIAIS GRANULADOS (FEG)... 139
III.15. CARACTERIZAÇÃO MICROESTRUTURAL DOS
FRAGMENTOS ÓSSEOS COM TEMPO DE 90 DIAS (MEV) .... 142
III.16. CARACTERIZAÇÃO MICROESTRUTURAL DOS
FRAGMENTOS ÓSSEOS COM TEMPO DE 180 DIAS (MEV) . 150
III.17. CARACTERIZAÇÃO POR MICROSCOPIA DE FORÇA
ATÔMICA (AFM) DOS FRAGMENTOS ÓSSEOS COM 90
DIAS ... 155
III.18. CARACTERIZAÇÃO POR MICROSCOPIA DE FORÇA
ATÔMICA (AFM) DOS FRAGMENTOS ÓSSEOS COM 180
DIAS ... 161
... 163
III.19. CARACTERIZAÇÃO POR MICROSCOPIA
CONFOCAL PARA OS FRAGMENTOS ÓSSEOS COM 90
DIAS ... 164
III.20. CARACTERIZAÇÃO POR MICROSCOPIA
CONFOCAL PARA OS FRAGMENTOS ÓSSEOS COM 180
DIAS ... 166
III.21. CARACTERIZAÇÃO POR MICROSCOPIA ÓPTICA
PARA OS FRAGMENTOS ÓSSEOS COM 90 DIAS ... 168
III.22. CARACTERIZAÇÃO POR MICROSCOPIA ÓPTICA
PARA OS FRAGMENTOS ÓSSEOS COM 180 DIAS ... 170
III.23. CARACTERIZAÇÃO POR MICROSCOPIA DE LUZ
III.24. CARACTERIZAÇÃO POR MICROSCOPIA DE LUZ
POLARIZADA PARA OS FRAGMENTOS ÓSSEOS COM 180
DIAS ... 175
III.25. ANÁLISE GRANULOMÉTRICA DOS GRÂNULOS
INTRODUÇÃO
O desenvolvimento científico e tecnológico nas engenharias, na área biomédica e advento da nanotecnologia, proporcionaram a inovação de métodos e técnicas de produção de novos biomateriais, com novas características microestruturais, nanoestruturais, de superfície e de bioatividade. Estas novas características demonstram melhores condições de molhabilidade, capilaridade, de reparação e reconstrução do tecido ósseo, como também da osseointegração do biomaterial pelo tecido ósseo neoformado. A inovação tecnológica, a nanotecnologia, a engenharia de materiais e de tecidos são destaques nas pesquisas e revelam o desenvolvimento de biomateriais nanoestruturados com propriedades mecânicas, elétricas, magnéticas, químicas, ópticas e biológicas, diferenciadas dos biomateriais convencionais. Estes novos biomateriais são capazes de oferecer melhores condições de adesão e proliferação celular em suas superfícies promovendo a formação óssea.
A elaboração de biomateriais granulados microporosos de fosfatos de cálcio despertam interesses científicos, políticos, industriais e comerciais. Isto está associado às novas características que estes biomateriais oferecem, como microestruturas microporosas interconectadas, elevada área superficial de grãos e microporos. Além de serem bioativos e biocompatíveis, estes ainda possuem uma estrutura mineralógica e cristalográfica bastante similar ao do tecido ósseo humano, fazendo com que os biomateriais de fosfatos de cálcio e nanocompósitos de matriz fosfato de cálcio se destaquem como biomateriais de substituição óssea em aplicações biomédicas.
Os biomateriais bifásicos hidroxiapatita/fosfato de cálcio-β na
forma de biomateriais granulados microporosos são pesquisados e demonstram um importante papel no desempenho da neoformação e reparação óssea. Sendo aplicados em cirurgias maxilofacial, na fixação de implantes e também como elemento matricial na liberação controlada de medicamentos. Dentre as composições bifásicas de fosfatos de calcio a que mais se destaca é 60%HA/40%TCP-β.
Mesmo sendo conhecidos os potenciais destes em aplicações médicas-cirúrgicas, o desenvolvimento e aplicações dos fosfatos de cálcio ainda é incipiente, se comparados com o uso do osso autógeno e biomateriais de origem natural. Não se têm o conhecimento de qual composição de fosfato de cálcio e bifásicos apresentam melhores resultados e qual o real desempenho destes.
através do método via úmida e caracterização de duas composições de pós nanoestruturados de fosfatos de cálcio hidratados. Posteriormente a elaboração e caracterização de duas matrizes de pós nanoestruturados de fosfatos de cálcio: hidroxiapatita (HA) e fosfato tricálcio-β (TCP-β), utilizadas na elaboração dos pós nanoestruturados bifásicos HA/TCP-β. A seguir foram elaborados os biomateriais granulados microporosos e sinterizados a temperatura de 1100ºC/2h. Por fim foi realizado o teste in vivo em tíbia de ovinos para os tempos de 90 e 180 dias. Aqui o interesse foi avaliar o desempenho dos biomateriais granulados microporos em relação à neoformação óssea e a osseointegração.
Na primeira parte deste estudo se encontra uma revisão da literatura sobre os biomateriais, métodos de síntese e de produção de pós e biomateriais. Também se encontram algumas técnicas de caracterização e algumas aplicações clínicas dos fosfatos de cálcio.
Na segunda parte são apresentados os métodos e técnicas de caracterização dos biomateriais e a metodologia para realização dos estudos in vivo.
A terceira parte contém os resultados e discussões dos estudos de caracterização dos biomateriais nanoestruturados, assim como os resultados dos testes in vivo referente a formação óssea e osseointegração.
OBJETIVO GERAL
Sintetizar e caracterizar duas matrizes nanoestruturadas de fosfatos de cálcio: hidroxiapatita e fosfato de cálcio-β, com interesse de
elaboração de biomateriais bifásicos para aplicações biomédicas na reparação do tecido ósseo
OBJETIVOS ESPECÍFICOS
Síntese e caracterização de duas composições de pós nanoestruturados de fosfatos de cálcio hidratados e produção das matrizes: fosfato de cálcio-β e hidroxiapatita.
Elaboração e caracterização dos pós nanoestruturados de fosfato de cálcio-β, hidroxiapatita e bifásicos HA/TCP-, nas seguintes composições 80/20%, 20/80%, 70/30%, 30/70%, com o uso do processo em moinho atritor.
Caracterização dos biomateriais nanoestruturados por diferentes técnicas e esterilização para os testes in vivo.
Avaliação dos fragmentos ósseos recuperados dos testes in vivo
nos períodos de 90 dias, 180 dias com o uso de diferentes técnicas: RAMAN, Microscopia Eletrônica de Varredura, Microscopia de Força Atômica, Microscopia Confocal, Microscopia Óptica, Microscopia de Luz Polarizada.
CAPITULO I. REVISÃO DA LITERATURA
I.1. BIOMATERIAIS
É conhecido da bibliografia que desde épocas passadas o ser humano se preocupa com sua saúde, bem estar e qualidade de vida. A evolução científica e tecnológica e a nanotecnologia têm contribuído para o desenvolvimento de novos biomateriais e técnicas, oferecendo melhores condições de diagnósticos e de conforto ao paciente, promovendo melhor qualidade da saúde e longevidade do homem
[DOROZHKIN, 2013; SOUZA, 2009].
Os biomateriais podem ser definidos como toda substância (exceção drogas e fármacos) ou combinação de substâncias de origem sintética ou natural, que durante um período de tempo indeterminado, é empregado como um todo ou parte integrante de um sistema para tratamento, ampliação ou substituição de quaisquer tecidos, órgãos ou funções corporais [WILLIAN, 1987].
Estes são desenvolvidos ou modificados com interesse de proporcionarem melhor desempenho quando aplicados em um sistema biológico. Um biomaterial para que possa ser aplicado clinicamente deve ser biocompatível, ou seja, não apresentar toxicidade com os tecidos vizinhos [MOREJÓN-ALONSO, 2011; DOROZHKIN, 2010; WILLIAMS, 2009].
Os biomateriais são elementos de apoio na manutenção e preservação do corpo humano, principalmente em situações de traumas, doenças e/ou problemas congênitos, que podem levar a disfunções e comprometimento do bom desempenho do esqueleto e da qualidade de vida. Para que um biomaterial possa ser utilizado no corpo humano, este deve apresentar duas condições básicas, de modo a desempenharem bons resultados: a Biocompatibilidade e a Biofuncionalidade [BELLINI, 2007].
I.1.1. CLASSIFICAÇÃO DOS BIOMATERIAIS
nanocompósitos [DALMÔNICO, 2011; SOUZA, 2009; PARK E BRONZINO, 2003]. De acordo com a composição química, os biomateriais podem ser classificados conforme segue:
a)
Metálicos e suas ligas: possuem ligações metálicas, apresentam mobilidade atômica, ductilidade e tenacidade elevada. Estes são utilizados como biomateriais estruturais de sustentação de próteses ortopédicas, implantes dentários, parafusos, placas, grampos e pinos. Dentre estes se encontram os biomateriais como: aço inoxidável austenítico, liga cobalto-cromo-molibdênio, titânio e suas ligas [JESUS, 2014, GRANJEIRO, 2011; KÖNING-JR, B. 2010].b)
Cerâmicos: Estes possuem ligações iônicas e/ou covalentes. São biomateriais que não apresentam mobilidade atômica, portanto materiais frágeis, com baixa ductilidade e tenacidade a fratura. As biocerâmicas podem ser de alta densidade e/ou de baixa densidade [BELLINI, 2007]. As de alta densidade apresentam microestruturas compactas com densidade hidrostática próximo da teórica do biomaterial. As de baixa densidade, apresentam microestruturas microporosas e densidade hidrostática inferior ao da teórica [BELLINI, 2007]. As cerâmicas de alta densidademais conhecidas são: alumina, zircônia, biovidro e hidroxiapatita estequiométrica sinterizada a altas temperaturas. Estes são utilizados como biomateriais de implantes, pinos e placas guias e/ou de sustentação. As cerâmicas de baixa densidade mais conhecidas são: os fosfatos de cálcio, nanocompósitos a matriz de fosfatos de cálcio e alguns biovidros microporosos, com aplicações no preenchimento e reparação de defeitos do tecido ósseo [CAMARGO, 2014, GRANJEIRO, 2011; KÖNING-JR, B. 2010].
c)
Poliméricos: Estes são moleculares com base em cadeias carbônicas e apresentam ligações ionicas e covalentes. Os polímeros utilizados na área biomédica podem ser de origem natural ou sintética. Podem ser utilizados como próteses de articulação, cimento ortopédico, cartilagem, vasos, sutura, substituição de tecidos moles e placas de sustentação óssead)
Compósitos: são biomateriais constituídos por duas ou mais fases distintas micrométricas, que formam um biomaterial chamado também de hibrido [SOUZA, 2009, BELLINI, 2007]. Já um biomaterial nanocompósito é formado por uma fase micrométrica e outra nanométrica ou ainda duas fases nanométricas, sendo chamados de biomaterial hibrido ou nanocompósito. As propriedades dos biomateriais compósitos e/ou nanocompósitos estão associadas diretamente as fases presentes no biomaterial, suas concentrações e da qualidade de interface entre matriz e segunda fase [SANTOS, 2009, SOUZA, 2009, CAMARGO, 1995].e)
Bifásicos: As composições bifásicas são formadas pela mistura de duas fases físicas de estruturas cristalinas ou amorfas diferentes pertencentes a uma mesma família de materiais. Os biomateriais bifásicos mais conhecidos são os de fosfatos de cálcio, sendo a composição mais conhecida a de HA/TCP-β. O interesse na elaboração de biomateriais bifásicos está associado à obtenção de biomateriais com características diferenciadas de microestrutura, solubilidade e de propriedades mecânicas[SILVA, 2012; DALMÔNICO, 2011; OLIVEIRA, 2010; RAVAGNA, 1999]. Estas biocerâmicas bifásicas, HA/TCP-β, se mostram promissoras como biomateriais de substituição óssea, isto se deve, por estes biomateriais apresentarem melhor desempenho de solubilidade quando em meio biológico ou simulado, o que proporciona a reparação e formação óssea, como também a osseointegração do biomaterial por um novo tecido ósseo
[REGALIN, 2015; LEVANDOWSKI, 2014; HEUGHEBAERTE, 1998; LEGEROS, 1991; DACULSI, 1989].
Os biomateriais podem ainda serem classificados de acordo com a resposta quando em contato com o meio biológico, estes podem ser divididos em três classes conforme seu comportamento fisiológico
[KÖNING-JR, B. 2010; PARK, 2008; R. SASTRE, 2004]:
porcelanas, zircônia estabilizada, platina, ouro e algumas formas de carbono.
(b) Bioativos: Provocam uma resposta favorável de ligação estável na interface biomaterial-tecido vivo. Esses são considerados de superfície ativa e promovem a interação com os tecidos adjacentes de forma natural auxiliando no processo de união e fixação de implantes. Exemplo: hidroxiapatita, biovidros, vitro-cerâmica, pinos de titânio.
(c) Bioabsorvíveis: São biomateriais degradáveis ou fagocitados pelo organismo após certo período de tempo. A taxa de degradação pode ser controlada mediante o uso de modificadores químicos ou com o uso de outro tipo de biomaterial, que permita um controle da sua degradação. Exemplos: hidroxiapatita deficiente de cálcio, fluorapatita, biomateriais bifásicos e nanocompósitos de matriz fosfato de cálcio e alguns biovidros.
A figura 1 apresenta o fluxograma representativo de algumas biocerâmicas em relação suas caracterísitcas de bioatividade quando em meio biológico.
Figura I.1. Fluxograma repersentativo da atividade das biocerâmicas em relação ao meio biológico
Fonte: produção do próprio autor.
I.1.2. BIOCOMPATIBILIDADE E BIOFUNCIONALIDADE
Para que um biomaterial possa cumprir todos os requisitos necessários para o qual ele foi desenvolvido, este deve ser avaliado
Biomateriais
Bioinertes Bioativos Bioabsorvíveis
Alumina Zircônia de Cálcio Fosfatos Biovidros cerâmicas Vitro Fosfatos de Cálcio, Bifásicos e Nanocompósitos
criteriosamente em diversos aspectos, apresentando essencialmente características como biocompatibilidade e biofuncionalidade [KÖNING, 2010; YASUHIKO, 2009; COSTA 2009; PARK, 2008]:
a) A biocompatibilidade compreende a capacidade que um biomaterial apresenta de exercer todas as funções de interface com o meio biológico, permitindo que os fluidos corpóreos e os tecidos adjacentes exerçam suas funções naturalmente, sem danos ao meio biológico.
b) A biofuncionalidade está associada às funções que biomaterial deve desempenhar dentro do local onde foi aplicado, podendo estas ser mecânicas, físicas, químicas, elétricas, permitindo que fluidos corpóreos e os tecidos adjacentes possam agir naturalmente.
I.1.3. TECIDO ÓSSEO
O osso é uma formação tecidual mineralizada composta principalmente por matriz orgânica, minerais e células (osteoblastos, osteoclastos e osteócitos) [MARINHO, 1995]. O tecido ósseo é responsável pela sustentabilidade do esqueleto, proteção dos órgãos vitais e possui função metabólica de armazenar minerais na estrutura óssea. É nela que se encontra em média 99% do cálcio contido no corpo humano, onde este realiza a manutenção dos níveis de cálcio no corpo. A liberação do cálcio realizada pelo tecido ósseo é dependente da ação do osteoclasto que têm como função reabsorver a matriz óssea calcificada, liberando cálcio e outros elementos como fósforo, magnésio e sais minerais que participam da manutenção do equilíbrio ácido-básico
[CORONHO, 2001].
As células que compõem a estrutura óssea exercem funções diferentes, conforme apresentação feita por diferentes autores
[MURUGAN & RAMAKRISHNA, 2005; GIANNOBILE, 2009; KATCHBURIAN, 2004; JUNQUEIRA, 2004; GARANT, 2003; BACHA, 2003; CURREY 2002; WATKINS, 2001]:
Osteócitos - células provenientes dos osteoblastos que ficam retidos na matriz óssea durante o processo de reparação e formação óssea. Estas células regulam a quantidade de minerais no tecido ósseo através da difusão de nutrientes dentro da estrutura óssea.
Osteoclastos - células gigantes multinucleadas, geralmente se encontram na superfície e regiões de um novo tecido ósseo formado. Têm como função modelar o novo tecido ósseo formado, através liberação de enzimas, que ajudam dissolver os sais minerais, bem como o colágeno.
De revestimento - Encontrados na superfície do osso maduro e não apresentam atividade de síntese. Possuem a finalidade de regular e transportar os minerais do tecido ósseo. Estas células recobrem 80% de todo o tecido ósseo.
I.2. CLASSIFICAÇÃO DAS BIOCERÂMICAS DE FOSFATO DE CÁLCIO
Existem diversos politipos de fosfatos de cálcio, que são normalmente classificados em relação a sua razão Ca/P molar. A tabela 1 mostra a classificação dos fosfatos de cálcio em relação à razão Ca/P. Dentre todos os fosfatos de cálcio, os mais conhecidos são os fosfatos de cálcio-β e α na razão Ca/P = 1,5 molar com fórmula química Ca3(PO4)2
e a hidroxiapatita estequiométrica na razão Ca/P = 1,67 molar de fórmula química Ca10(PO4)6(OH)2, um composto inorgânico muito
Tabela I.1. Classificação dos Fosfatos de Cálcio em relação à razão Ca/P molar
Nome Abreviação Fórmula Ca/P
Fosfato tetracálcio TTCP Ca4O(PO4)2 2,0
Hidroxiapatita HA Ca10(PO4)6(OH)2 1,67
Fosfato de cálcio
amorfo ACP Ca10-xH2x(PO4)6.5H2O 1,50
Fosfato de cálcio
(β, α, α’) TCP Ca3(PO4)2 1,50
Fosfato octacálcio OCP Ca8H2(PO4)6.5H2O 1,33
Fosfato dicálcio dihidratado
(brushita)
DCPD CaHPO4.2H2O 1,0
Fosfato tricálcico
(monetita) DCP CaHPO4 1,0
Fosfato de cálcio
(β, α, ɣ) CPP Ca2P2O7 1,0
Pirofosfato de
cálcio dihidratado CPPD Ca2P2O7.2H2O 1,0
Fosfato de heptacálcio
HCP Ca7(P5O16)2 0,7
Fosfato tetracálcio
diácido TDHP Ca4H2P6O2 0,67
Fosfato de cálcio
mono-hidratado MCPM Ca(H2PO4)2.H2O 0,5
Metafosfato de cálcio
CMP Ca(PO3)2 0,5
As biocerâmicas de fosfatos de cálcio podem ainda ser classificadas em relação a seus constituintes: monolíticas, bifásicas e nanocompósitos. As biocerâmicas de fosfato de cálcio monolíticas são formadas por uma única fase, podendo ser um biomaterial denso ou microporoso. O biomaterial microporoso é formado por nanoestruturas que dependem dos constituintes iniciais, composição, da temperatura e tempo de sinterização do biomaterial. A estabilidade destas biocerâmicas está associada à estrutura cristalina e sua razão Ca/P molar.
As biocerâmicas de fosfatos de cálcio bifásicas são constituídas por duas fases de fosfatos de cálcio, sendo que a composição bifásica mais conhecida é a mistura de hidroxiapatita e fosfato de cálcio-β
(HA/TCP-β). Quando produzidas a partir de pós nanométricos,
normalmente são formadas por nanoestruturas microporosas interconectadas [DALMÔNICO, 2011; OLIVEIRA, 2010]. A estabilidade destas biocerâmicas vai depender das concentrações de cada fase presente no biomaterial bifásico.
Os biomateriais nanocompósitos de matriz fosfatos de cálcio: são normalmente desenvolvidos com uma matriz do tipo hidroxiapatita ou fosfato de cálcio-β. Estes biomateriais podem apresentar
microestruturas densas ou microporosas que dependem da segunda fase incorporada na matriz, da temperatura e tempo de sinterização do biomaterial [CORRÊA, 2013; CAMARGO, 2012; SOUZA, 2009; SANTOS, 2009].
As pesquisas relacionadas aos biomateriais nanocompósitos de matriz fosfatos de cálcio, mostram que estes biomateriais apresentam microestruturas microporosas formadas por finos grãos com volume de microporos chegando a 54% [CORRÊA, 2013, PASSONI, 2011; SOUZA, 2009; SANTOS, 2009]. Estes biomateriais também se destacam na bibliografia como biomateriais de reparação e reconstrução óssea
[LEVANDOWSKI, 2014; LEVANDOWSKI, 2009; WEBESTER, 2003].
constataram que existe uma ordem decrescente de solubilidade destes biomateriais, conforme segue ACP > TTCP >> TCP-α >>TCP-β>> HA. Esta mesma observação também já feita por outros autores que realizaram testes de solubilidade de fosfatos de cálcio [DACULSI, 1998; BROWN, 1994]:
As biocerâmicas de fosfato de cálcio, obtidas por processos sintéticos apresentam estruturas cristalinas semelhantes as da estrutura do esqueleto humano. Os fosfatos de cálcio, principalmente a hidroxiapatita e o fosfato de cálcio-β exercem uma função direta entre
tecido adjacente/biomaterial. Esta interação intima na interface promove a troca de íons, favorecendo a reparação, a reconstrução e a osseointegração do biomaterial pelo novo tecido ósseo formado
[CAMARGO, 2014; WEBSTER, 2003; LEGEROS, 1988].
Figura I.2. Dissolução de Ca em solução tampão pH=7 para alguns fosfatos de cálcio
Fonte: PARK, 2008.
(2). O contato da superfície do biomaterial modificado com as soluções fisiológicas entra em equilíbrio (3), ocorrendo a adsorção de proteínas e de matéria orgânica (4). Isto ocasiona a adesão e proliferação celular na superfície do biomaterial (5 e 6). Iniciando assim, a produção de células ósseas (7) formando nova estrutura óssea na superfície do biomaterial (8)[BERTAZZO, 2010].
Figura I.3. Solubilização e mineralização óssea na superfície da hidroxiapatita, quando aplicadas in vivo
Fonte:BERTAZZO, 2010.
I.2.1. FOSFATO DE CÁLCIO (TCP)
Existem três fases conhecidas de fosfatos de cálcio Ca3(PO4)2-β,
α e α' utilizados em aplicações biomédicas. Estas fases são normalmente
obtidas por tratamento térmico em altas temperaturas, através da decomposição de fosfatos de cálcio hidratados ou pela decomposição da fase hidroxiapatita, quando submetida a temperaturas acima de 1180ºC
[CAMARGO, 2014; CORRÊA, 2013].
As formas polimórficas dos fosfatos de cálcio Ca3(PO4)2
dependem da sua temperatura de obtenção. Em temperaturas abaixo de 1180°C a fase alotrópica estável é o fosfato de cálcio-β (TCP-β), em
temperaturas que vão de 1180°C a 1430°C, encontra-se a fase estável fosfato de cálcio-α (TCP-α) e a temperaturas acima de 1430ºC a fase
fosfato de cálcio α´ (TCP- α´) [BELLINI, 2007].
DELIMA, 2008; JUN, 2003]. A figura 4 ilustra um esquema representativo da célula unitária e estrutura cristalina do fosfato de cálcio-β no sistema
romboedral.
Figura I.4. Célula unitária e estrutura cristalina do fosfato de
cálcio β (TCP-β) - Ca3(PO4)2
Fonte: Adaptado de RABELO NETO, 2009
O fosfato de cálcio-β é pesquisado e utilizado na fabricação de
biomateriais de substituição óssea, em razão deste biomaterial (TCP-β)
apresentar boa taxa de reabsorção e promover a formação e crescimento ósseo em testes in vivo [LEVANDOWSKI, 2014; REGALIN, 2015].
Entretanto, existem pesquisas, que mostram que os fosfatos de cálcio nanoestruturados obtidos por processos sintéticos e sinterizados a temperaturas inferiores ou iguais a 1100ºC, fornecem biomateriais de fosfatos de cálcio com microestruturas microporosas formadas por finos grãos, inferiores ao um mícrom [CAMARGO, 2014, DALMÔNICO, 2011; LEVANDOWSKI, 2014; KUMITA, 2005; ZHANG, 2005; RAYNAUD, 2002].
Estas novas microestruturas microporosas interconectadas com área superficial de grãos e microporos da ordem de 3m2/g, são inovadoras e se destacam nas pesquisas, por apresentarem boa capacidade de solubilidade quando aplicados dentro de um meio biológico [REGALIN, 2015; CAMARGO, 2014; LEVANDOWSKI, 2014]. A facilidade de
cinética catiônica de adsorção e biodegradação do biomaterial para formação de um novo tecido ósseo [LEVANDOWSKI, 2014; CORRÊA, 2013; LIN, 1998].
Numerosas pesquisas realizadas por diferentes autores sobre a síntese e elaboração de biomateriais de fosfatos de cálcio nanoestruturados, [CAMARGO, 2014; DALMÔNICO, 2011; KUMITA, 2005; ZHANG, 2005; RAYNAUD, 2002; YOSHICO, 1993], revelam que os
biomateriais de fosfatos de cálcio obtidos a partir de pós nanoestruturados são formados por microestruturas microporosas formadas por finos grãos elevada área superficial de grãos e microporos. Estes biomateriais demonstram melhor desempenho de molhabilidade, capilaridade e solubilidade. Testes realizados in vivo por diferentes autores mostraram que estes biomateriais contribuem com osseointegração e a formação do tecido ósseo precocemente
[LEVANDOWSKI, 2014; REGALIN, 2015; LEVANDOWSKI, 2009, WEBESTER, 2003].
I.2.2. HIDROXIAPATITA
A hidroxiapatita, também conhecida como apatita é um mineral do grupo dos fosfatos. O nome apatita é um nome genérico utilizado para vários minerais a base de fosfatos que podem ser representados pela fórmula química M10(XO4)6Z2. A substituição de íons nas apatitas pode
levar a mudanças nas propriedades fisco-química, na estrutura cristalina e na morfologia do cristal. Essas mudanças acarretam em modificações de propriedades mecânicas, bioatividade e de solubilidade do biomaterial [CHULA 2004, LEGEROS 1991].O tipo de apatita é definido através das substituições das variáveis M, X e Z:
M: cátion alcalino = Ca, Pb, Sr, Na, ...
X: ânion trivalente = P, Si, S, C, As,...
Z: ânion monovalente = F, Cl, OH, ...
A hidroxiapatita biológica, chamada de hidroxiapatita deficiente em cálcio, está presente em grande parte do corpo humano. Esta faz parte de aproximadamente 98% no esmalte dental, 77% na dentina e nos ossos entre 60% e 70% [BUSER, 2010; CONZ, 2010; GUASTALDI, 2010].
1,67molar e fórmula química com 39% em peso de Ca, 18,5% de P e 3,38% de OH [BUSER 2010, CONZ 2010, GUASTALDI 2010, PEREIRA 2009].
A figura 5 apresenta a célula unitária da hidroxiapatita estequiométrica vista de cima, apresentando os eixos a e c paralelos ao plano e eixo b perpendicular ao plano e as posições do Ca1, Ca2, P, OH e
O. Sua célula unitária é composta por 10 íons de cálcio que estão localizados nos sítios, quatro deles estão em posições tetraédricas e seis em posições octaédricas. Nos sítios tetraédricos os átomos de oxigênio do PO4, estão ligados aos cátions e a outros três átomos de oxigênio.
Este material é altamente capaz de trocar seus íons por outros elementos químicos, permitindo substituições de Ca e P [GUERRA-LÓPEZ, 2015,
LEGEROS, 1993].
Figura I.5. Estrutura da hidroxiapatita vista de baixo de c, apresentando as posições do Ca1, Ca2, P, OH e O
Fonte: Adaptado de GUERRA-LÓPEZ, 2015
A hidroxiapatita estequiométrica é tema de pesquisas e se destaca como matriz de substituição óssea. São utilizados em aplicações cirúrgicas ortopédicas, traumatológicas e odontológicas, em tratamentos maxilofaciais, enchimento e reparação de tecido ósseo.
I.2.3. BIOMATERIAIS BIFÁSICOS DE FOSFATOS DE CÁLCIO
As composições de biocerâmicas bifásicas são formadas pela mistura de duas fases físicas cristalinas ou amorfas diferentes, que formam um biomaterial bifásico ou também chamado de hibrido
[DALMÔNICO, 2011].
Pesquisas indicam que as biocerâmicas bifásicas de fosfatos de cálcio utilizadas como substitutos ósseos, demonstram ter melhor desempenho de solubilidade, de reparação e formação óssea, se comparados com as biocerâmicas de hidroxiapatita e o fosfato de
cálcio-β isoladamente [SUNGTAE KIM, 2011; GARRIDO, 2011; OLIVEIRA, 2010;
RIBEIRO, 2003].
Estudos motram que a mistura das fases HA/TCP-β, conduz a
formação de biomateriais bifásicos com novas características microestruturais, de bioatividade, solubilidade, são promissoras como biomateriais de substituição óssea. Isto vem sendo explicado por estas biocerâmicas apresentararem uma solubilidade diferenciada das biocerâmicas monolíticas de HA e TCP-β. Outro ponto que vem sendo
levado em consideração está relacionado à sua capacidade de permitirem a mineralização óssea na superficie do biomaterial como para seu interior, através do prolongamento das células de osteoblatos pela microporosidade do biomaterial [REGALIN, 2014; LEVANDOWSKI, 2014]. Outra constatação feita na bibliografia, é que estes biomateriais também contribuem em sistemas de liberação controlada de medicamentos, assim como na cicatrização óssea [COPATTI, 2014; GHANAATI, 2010, JINGDI CHEN, 2011; HAILUO, 2011; SUNGTAE KIM, 2011; EMADI, 2010; BING-HUNG, 2009].
mecânicas, físicas e biológicas [DALMÔNICO, 2011, OLIVERA, 2010].
Estes biomateriais quando elaborados a partir de pós nanométricos podem oferecer biomateriais formados por nanoestruturas microporosas com elevada área superficial de grãos e microporos. Estas novas características demonstram melhorar a molhabilidade, a capilaridade, a adesão e proliferação de células de osteoblastos na superfície de grãos e de microporos do biomaterial granulado quando aplicado in vivo [REGALIN, 2014, CAMARGO, 2014, LEVANDOWSKI, 2014].
Tabela I.2. Resultados comparativos de testes in vivo realizados por diferentes autores em função do tempo de aplicação do biomaterial
Material Autor Aplicação Tempo de teste
Resultados
HA/TCP-β
(60/40) HENKEL, 2006 Mandíbula de porcos semana32 s Formação óssea com poucas partículas remanescentes
TCP- β YAMADA,
2007 Calvária de Coelhos 8 semana s Menor dissolução HA/TCP- β (85/15) FARINA,
2008 Mandíbula de cães semana26 s
4,25% de degradação
HA/TCP-
β (15/85) FARINA, 2008 Mandíbula de cães semana26 s Formação óssea em maior quantidade 12,49% de degradação Grânulos de HA nanocristal ina CANULLO e DELLAVI A, 2009 Seio maxilar de homens 24 semana s Formação
óssea ≈ 48%
do volume Grânulos de HA/TCP-β (60/40) REGALIN,
2014 Tíbia de ovinos semana10 s
Formação
óssea ≈ 40%
I.2.4. MÉTODOS DE SÍNTESE DE FOSFATOS DE CÁLCIO
Existem diferentes métodos e técnicas utilizados na síntese de pós de fosfatos de cálcio, conforme descritos a seguir:
a) O método de via úmida (coprecipitação): É um método usual na síntese de pós nanoestruturados de fosfatos de cálcio hidratados. Este parte da dissolução da fase sólido/líquida através da reação exotérmica de dissociação e precipitação de nanopartículas de fosfatos de cálcio com tamanho inferior a 50nm a temperatura ambiente [CAMARGO, 2014; DELIMA, 2008]. Este fornece pós nanoestruturados de fosfatos de cálcio hidratados semi-amorfos formados por nanopartículas na forma de agregados e aglomerados. É um método vantajoso por apresentar baixo custo, não gerar subproduto nocivo ao meio ambiente. Como produto final são obtidos o pó nanoestruturado de fosfato de cálcio hidratado e água [BORBA, 2014; FRANCZAK, 2014; CORREA, 2013].
b) Reação em estado sólido: Este método é realizado com ajuda de fornos e dentro da câmera de reação dos reagentes, pode-se variar a temperatura entre 900°C e 1500°C. Este método fornece pós de fosfatos de cálcio cristalinos. A vantagem deste método é a capacidade de obtenção de pós de fosfatos de cálcio cristalinos, como: hidroxiapatita, fosfato de cálcio-β ou ainda
composições bifásicas HA/TCP-β, dependendo dos reagentes
utilizados durante o processo de síntese.
c) Método hidrotérmico: a síntese hidrotérmica ocorre a partir de uma solução contendo os regentes de interesse dentro de um sistema fechado sob alta pressão, em torno de 1 a 2 Kbar a temperaturas acima de 100°C, fornecendo pós de fosfatos de cálcio cristalinos.
I.2.5. SINTERABILIDADE DE PÓS CERÂMICOS
A sinterabilidade de pós cerâmicos consiste de um processo termodinâmico, onde o pó compactado é submetido a um tratamento térmico a temperatura inferior à temperatura de fusão do constituinte principal do pó. A sinterização é uma etapa importante na obtenção de biocerâmicas, pois fornece um biomaterial sólido coerente. Durante a sinterização de um pó cerâmico, ocorre à redução da energia livre de superfície do pó compactado. Isto ocorre devido à diminuição das superfícies através da liberação de água absorvida nas partículas e aproximação das superfícies de contato entre partículas. A redução das superfícies livres e aproximação entre as partículas conduz a sinterabilidade do biomaterial. O mecanismo de sinterização de um pó cerâmico compactado, ocorre pela modificação das interfaces gás/sólido e sólido/sólido de energia livre. Isto ocorre através da coalescência de grãos, fechamento da porosidade aberta e maior área de contato entre contornos de grãos. Durante este processo de sinterização podem ocorrer transformações de fase, cristalizações e formação de fases amorfas. Ao final de um ciclo térmico de sinterização obtém-se um material sólido único e coerente [SANTOS, 2009,BICALHO, 2009].
As etapas de sinterabilidade de uma biocerâmica podem ser divididas em três etapas [SANTOS, 2009, BICALHO, 2009; BITTENCOURT, 1997]:
1)
Na primeira etapa, ocorre um rearranjo das partículas de pó, com forte ligação ou formação de pescoços nas regiões de contato entre partículas.2)
Na etapa seguinte, a região de contato aumenta, reduzindo a porosidade significativamente e as partículas aproximam-se, ocorrendo assim à retração. Os contornos de grãos são formados e ocorre um crescimento lento. O final dessa etapa é concluído quando os poros ficam isolados.A figura 6 mostra o esquema representativo das modificações do pó durante a sinterabilidade de biocerâmicas.
O mecanismo de sinterabilidade de pós cerâmicos compactados pode ser verificado pela equação 1. Esta representa a relação entre a entalpia livre do sistema, a energia de superfície do sólido, a área de interface sólido/gás, a energia da interface sólido/gás e a área de interface sólido/sólido [BICALHO, 2009; JORAND, 1991].
G =s . As + j Aj < 0 (equação 1)
Onde:
G = Entalpia livre de transformação
s = Energia de superfície do sólido
As = Área de interface solida gás
j = Energia de interface sólida
Aj = Área de interface solido sólidoFigura I.6. Ilustra a modificação das interfaces de um pó compactado durante sua sinterabilidade do biomaterial
Fonte: produção do próprio autor.
I.3. TECNICAS DE CARACTERIZAÇÃO DE BIOMATERIAIS
características dos biomateriais em relação à cristalografia e arranjos estruturais dos biomateriais. Também auxiliam na identificação da composição química, suas interações, nanoestruturas, microestruturas, defeitos, inclusões, área superficial e microporosidade. Também contribuem na avaliação de estudos sobre a adesão e proliferação celular, osseointegração e formação óssea sobre biomateriais.
I.3.1. Difração de Raios X (DRX)
A técnica de difratometria por raios-X é conhecida e utilizada na caracterização de pós e materiais. Esta técnica consiste na análise qualitativa e quantitativa da(s) fase(s) presentes no material, capaz de gerar informações quanto à cristalinidade, parâmetros da rede cristalina e sistema estrutural cristalino. A identificação das fases presentes em um pó ou biomaterial é realizada através da comparação com o banco de dados de padrões de difração de raios-X JCPDS (Joint Committee on Power Diffraction Standards) [GRANJEIRO, 2011; KÖNIG-JR, 2010].
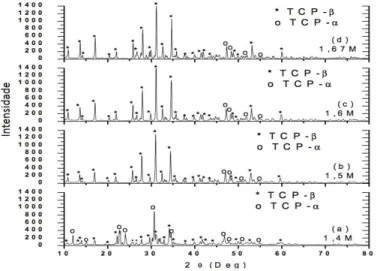
O interesse pela técnica de difratometria se encontra em conhecer a estrutura cristalina e fase que compõe o pó ou biomaterial e sua composição química. Estudos de caracterização por difratometria de raios X foram realizados por Silva [2012], com interesse de avaliar as fases presentes nos biomateriais obtidos da sinterização a temperatura de 1200ºC/2h. Os biomateriais analisados foram pós nanoestruturados de fosfatos de cálcio obtidos de conchas calcárias fossilizadas pelo processo via úmida nas razões Ca/P = 1,4, 1,5, 1,6 e 1,67 molar. A figura 7 mostra os difratogramas de raios X obtidos sobre as diferentes composições de biomateriais conforme apresentado por [SILVA, 2012].
Constata-se nos difratogramas a presença de picos de difração representativos das fases fosfato de cálcio-β (TCP-β) e fosfato de cálcio
-α (TCP-α) para todas as composições de biomateriais.
Figura I.7. Difratometria de raios-X dos biomateriais de fosfato de cálcio sinterizados a 1200°C/2h
Fonte:D.F.SILVA, 2014.
Figura I.8. Difratometria de Raios-X obtidos sobre os biomateriais de hidroxiapatita sinterização a diferentes temperaturas
I.3.2. Espectroscopia de Infravermelho por Transformada de Fourier
A espectroscopia de infravermelho é uma técnica de análise quantitativa e qualitativa não destrutiva de materiais, que trabalha com um feixe de luz na região do infravermelho. Esta técnica fornece informações sobre os comprimentos de ondas vibracionais dos grupamentos funcionais das moléculas, através do sistema de absorbância ou transmitância. É uma técnica rápida e simples de análise química baseada na interação de um feixe de luz infravermelha com a matéria [FEDDES, 2009].É um método muito utilizado na caracterização de matérias primas de carbonatos de cálcio e de biocerâmicas de fosfatos de cálcio. A técnica baseia-se nas bandas vibracionais de grupamentos químicos, estas possuem frequências de vibração específicas, as quais correspondem a níveis vibracionais de energia da molécula. A espectroscopia de infravermelho permite identificar algumas substituições ou alterações importantes na presença de grupos funcionais próprios dos fosfatos de cálcio, particularmente os grupamentos PO43-,
H2O e OH-. Essas informações são obtidas pela excitação dos modos de
energia vibracionais destes grupos moleculares dentro da estrutura de um biomaterial no estado sólido [SILVERSTEIN, 2006; ELLIOT, 1994].
Estudos de caracterização com uso da espectrometria de infravermelho foram realizados por Silva [2014], sobre pós de fosfatos de cálcio hidratados nas razões Ca/P = 1,4; 1,5; 1,6; 1,67 molar, obtidos pelo método via úmida. O autor mostra uma sobreposição dos espectrogramas obtidos para as diferentes composições de fosfatos de cálcio hidratados, onde se observa os modos vibracionais representativas do grupamento OH- e/ou da molécula de H2O em 3700cm-1, 3570cm-1 e
2600cm-1 (figura 9). Também observou-se nos espectrogramas os modos vibracionais em aproximadamente 1637cm-1 indicando o grupamento
OH- e/ou da molécula de H
2O e em 2916cm-1 associado ao grupamento
C-H. Observam-se ainda entre as regiões de 1500-1400cm-1 e em
875cm-1, os modos vibracionais atribuídos a C-O e CO32-, incorporados
à rede cristalina de fosfatos. Foram ainda observados em 1090cm-1, 1030cm-1 , 963 m-1 e 605cm-1 os modos de vibração associados ao grupamento PO43-. Nas regiões em aproximadamente em 566cm-1 e
478cm-1, foi constatado a presença do grupamento HPO42-, caso também
observado por outros autores que caracterizaram fosfatos de cálcio
razão Ca/P molar, as bandas vibracionais dos fosfatos de cálcio se apresentaram mais intensas nos espectrogramas.
Figura I.9. Espectro de FTIR obtido sobre pós de fosfatos de cálcio hidratados nas razões Ca/P = 1.4, 1.5, 1.6 and 1.67molar
Fonte:D.F.SILVA, 2014 (2).
Estudos de caracterização por espectrometria de infravermelho realizado por Camargo [2014], sobre biomateriais granulados microporosos de fosfato de cálcio-β e bifásico 60%HA/40%TCP-β,
mostraram que esta técnica permite obter informações sobre a química dos biomateriais.
A figura 10 mostra o espectrograma obtido sobre o biomaterial granulado microporoso de fosfato de cálcio-β. Constata-se no espectrograma os modos vibracionais representativos dos principais grupamentos PO4 em 1083cm-1, 1080cm-1, 976cm-1, 943cm-1 e 600cm-1,
típicos para os fosfatos de cálcio-β. Estes mesmos modos vibracionais
também foram constatados por outros autores que avaliaram biomateriais de fosfatos de cálcio [SILVA, 2012; DAIWON, 2007].
A figura 10 revela o espectrograma obtido sobre o biomaterial granulado microporoso bifásico 60%HA/40%TCP-β. Constatam-se no espectrograma os modos vibracionais do grupamento OH- em 3575cm-1 e 632cm-1 e do grupamento PO4 em aproximadamente 1080cm-1,
(a)
(b)
observada em estudos que avaliaram composições bifásicas de fosfatos de cálcio [LEVANDOWSKI, 2014; SILVA, 2012, DALMÔNICO, 2011].
Figura I.10. Espectrograma obtido sobre os biomateriais granulados: Fosfato de Cálcio-β (a) e biomaterial bifásico
60%HA/40%TCP-β
Fonte:CAMARGO, 2014.
I.3.3. Espectroscopia Raman
A técnica espectroscopia Raman é um método usual na caracterização de materiais e permite uma microanálise não destrutiva do biomaterial. Possui versatilidade e simplicidade em termos de manipulação da amostra, não possui interferência de umidade além da alta resolução dos novos equipamentos. Oferece condições de análise qualitativa de biomateriais em nível da estrutura molecular de composições orgânicas e/ou inorgânicas.
utilizou esta técnica na caracterização do fragmento ósseo obtido de testes in vivo em tíbia de ratos. O biomaterial de teste foi um fosfato de cálcio bifásico HA/TCP-β=70/30%, de uso comercial, marca Biogenphos. Os resultados obtidos pelos autores foram relacionados com do osso cortical. Estes revelaram nos espectrogramas os modos vibracionais dos grupamentos PO43- em 1070cm-1, 1046cm-1, 1037cm-1,
957cm-1, 961cm-1, 586cm-1 e 430cm-1, 453cm-1. O modo vibracional em
1072cm-1 foi associado ao tecido mineralizado e/ou ao grupamento
funcional CO32- que está associado a apatita óssea. Os autores revelam
também em seus espectrogramas a presença dos modos vibracionais em 586cm-1, 854cm-1, 881cm-1, 924cm-1, 1002cm-1 e de 1100cm-1 a 1200cm
-1 indicando os grupamentos de diferentes tipos de colágeno [ CAMBRA-MOO, 2014; SOARES, 2014].
Um outro estudo de caracterização por Raman, realizado por Tolga [2015] sobre uma hidroxiapatita sintética, foi constatado pelo espectrograma, os modos vibracionais representativos dos grupamentos PO43- em 1070cm-1, 961cm-1, 429cm-1 e 591cm-1 indicando a presença
da hidroxiapatita,conforme observado na figura 12.
Figura I.11. Espectrogramas de Raman obtidos sobre o biomaterial comercial de Biogenphos e osso cortical
Figura I.12. Espectrograma de Raman obtido sobre o biomaterial de HA
Fonte:TOLGA, 2015.
I.3.4. Área Superficial Específica pelo método (BET)
A análise superficial de um sólido pode ser determinada pelo método desenvolvido por Brunauer-Emmett-Teller (BET), que consiste da adsorção gasosa normalmente N2, H2 ou He a baixa temperatura. O
gás envolve a superfície de grãos e microporos, fornecendo informações como a área superficial específica do biomaterial. É conhecido da bibliografía, que tamanho de grãos, volume de microporos e área superficial influenciam diretamente sobre a solubilidade, molhabilidade e hidratação dos biomateriais de fosfatos de cálcio [CAMARGO, 2014; LEVANDOWSKI, 2014; FRANCZAK, 2014].
superficial. Os resultados encontrados para os biomateriais granulados se apresentaram bastante semelhantes observando melhor resultado para o biomaterial hidroxiapatita que apresentou área superficial em torno de 3,62m2/g (tabela 3). Conforme os dados obtidos na literatura, acredita-se que a área superficial de um biomaterial e sua microporosidade acima de 1m2/g, e o volume de microporos acima de 20%, contribuem com a formação de um novo tecido ósseo e osseointegração do biomaterial
[LEVANDOWSKI, 2014; COATHUP 2012; HING 2005].
Tabela I.3. Resultados de Análise de BET obtidas por diferentes autores sobre pós e biomateriais de fosfatos de cálcio
Autor Biomaterial BET (m2/g)
CAMARGO, 2014 HA* Biomaterial granulado TCP* Biomaterial
HA/TCP=60/40* Biomaterial granulado
*Sinterizados a 1100ºC
3,62 2,67 2,78
LEVANDOWSKI, 2014
HA* Biomaterial granulado TCP* Biomaterial granulado HA/TCP=60/40* Biomaterial
granulado *Sinterizados a 1100ºC
3,06 2,05 2,78
RANDORN, 2015 HA (Síntese a 20ºC)* pó HA (Síntese a 30ºC)* pó
HA (Síntese a 40ºC)* pó *Calcinados a 800ºC
14,31 12,56 21,39
XIAO, 2015 Nano HA* pó
*Obtida da síntese
9,00
GHANAATI, 2010 Cerasorb (500-1000 μm) Cerasorb (150-500 μm)
Cerasorb (50-150 μm) Cerasorb (63-250 μm)
0,0087 0,1000 0,1590 0,1770
I.3.5. Tamanho de Partícula por Difração a Laser
A difração laser é um método de análise granulométrica de partículas conhecido e muito utilizado em análise de pós cerâmicos. Este método se baseia no princípio de difração de um feixe de luz que passa por uma suspensão coloidal, fornecendo a distribuição do tamanho das partículas. Sendo também muito utilizado em análise de pós nanoestruturados de fosfatos de cálcio [BORBA,2014; CORRÊA, 2013; PASSONI, 2011]. Sabe-se que a granulometria de pós cerâmicos exercem influência direta, na sinterabilidade de pós compactados. Além disto, influenciam na atividade celular quando aplicados em meios biológicos e sobre a neoformação óssea e osseointegração [BORBA, 2014; CAMARGO, 2010]. Estudos de análise granulométrica de pós biocerâmicos nanoestruturados, podem contribuir para compreensão da sinterabilidade, da interface de grãos e microporos. Estes também auxiliam na metodologia de elaboração de biomateriais e no seu desenvolvimento com características específicas ou diferenciadas dos convencionais.
Tabela I.4. Resultado do tamanho de partícula de alguns tipos de fosfatos de cálcio através da análise por difração a laser
Autor Composição Diâmetro médio
de partícula (nm)
CAMARGO,
2014 (2) Hidroxiapatita Ca/P=1,67 50nm
BORBA, 2014 Fosfato hidratado Ca/P=1,67 Hidroxiapatita 900ºC/2h 100nm 20nm
FRANCZAK, 2014
Fosfato hidratado Ca/P=1,5 Fosfato hidratado Ca/P= 1,6 Fosfato hidratado Ca/P=1,67
50,00 20,00 20,00
CORRÊA, 2013 Fosfato obtido da síntese Hidroxiapatita
30,00 50,00 Fonte: produção do próprio autor.
I.3.6. Técnicas de medidas de densidade e porosidade de biomateriais
Existem diferentes técnicas usuais para medidas de densidade e porosidade de pós e biomateriais. Estas técnicas podem ser relacionadas conforme segue:
a) Pictometria a gás: Este método consiste da absorção física de um gás normalmente He a baixa temperatura, através da variação da pressão do gás dentro de uma câmara de volume conhecido. Este gás envolve a superfície de grãos e microporos do biomaterial, fornecendo informações sobre a densidade do pó ou biomaterial. A principal vantagem deste método reside na sua capacidade de medir apenas o volume útil do pó ou do biomaterial, descontando a porosidade e humidade da amostra. As amostras analisadas devem conter um volume máximo de 10cm3 para que seja possível realizar a medida [MOURA, 2002].
superfície de grãos e de microporos do material. Pode também fornecer resultados sobre o tamanho de poros a partir da pressão registrada. Este método têm como vantagem a facilidade de realização do ensaio.
c) Densidade Hidrostática e Porosidade Aberta por método de Arthur: o método consiste em medir o peso da amostra ao ar (Par), em seguida embebida em xileno ao ar (Pxa) e depois embebida xileno imerso em água destilada (Pxe). Após obtidas as medidas pode-se determinar os valores de porosidade aberta e densidade hidrostática através da equação 2 e equação 3
[PENNING, 1989].
Porosidade aberta:
Densidade Hidrostática:
Onde:
Par – peso ao ar (g);
Pxa – peso embebido em xileno ao ar (g);
Pxe – peso embebido em xileno imerso em água (g);
dx – densidade do éter (0,712 g/cm3) ou densidade do
xileno (0,8802 g/cm3);
de – densidade da água (g/cm3); P.A – porosidade aberta em %.
Algumas pesquisas realizadas por diferentes autores determinaram a densidade hidrostática e porosidade aberta de diferentes biomateriais de fosfatos de cálcio utilizando o método de Arthur
[PENNING, 1989]. Os resultados obtidos estão relacionados aos
biomateriais sinterizados a temperatura de 1100ºC/2h na forma de grânulos e de blocos. A tabela 5 ilustra os resultados de porosidade aberta e densidade hidrostática encontrados para as diferentes composições de biomateriais de fosfato de cálcio. Constatou-se nos resultados obtidos, que os biomateriais granulados apresentaram uma microporosidade importante. Estes valores estão relacionados a
(Equação 2)
Pxe
Pxa
de
Par
dh
.
. .100porosidade total do biomaterial granulado, ou seja, valores que correspondem a medida intra-intergranular. Já para os biomateriais na forma de blocos, os valores são referentes somente da porosidade intra-granular. Conforme visto na bibliografia, a microporosidade está diretamente relacionada ao desempenho do biomaterial na formação óssea [DAVISON, 2014; ZHANG, 2014; WANG, 2014; COATHUP, 2012; CHAN 2012].
A microporosidade interconectada pode ser um sistema favorável na adesão, distribuição e migração celular, na superfície e para o interior do biomaterial. Tais características fornecem condições favoráveis a formação óssea e sustentação do novo tecido ósseo
[DAVIES 2014; DOROZHKIN 2010].
Tabela I.5. Porosidade aberta e densidade hidrostática para diferentes composições de fosfato de cálcio na forma de grânulos e blocos
Biomaterial Autor PA
(%) (g/cmdh 3)
HA granulado (1100ºC)
TCP-β granulado (1100ºC)
HA/TCP-β granulado (1100ºC) CAMARGO [2014] 77,64 73,67 77,96 1,96 2,33 2,33
HA bloco (1100ºC)
TCP-β bloco (1100ºC)
HA/TCP-β bloco (1100ºC)
HA/SiO
2 5% bloco
(1100ºC) HA/TiO
2 5% bloco
(1100ºC) LEVANDOWSKI [2014] 41,77 26,02 40,67 54,03 22,02 1,84 2,33 1,87 1,38 2,31
Cerasorb (500-1000 μm)
Cerasorb (150-500 μm)
Cerasorb (50-150 μm)
Cerasorb (63-250 μm)
I.3.7. Análise do Comportamento Térmico
As técnicas de caracterização do comportamento térmico de materiais mais usuais são análise térmica diferencial (ATD) e termogravimetria (TG) e/ou calorimetria exploratória diferencial (DSC). Estas técnicas são utilizadas, na avaliação de curvas representativas de picos endotérmicos de absorção de energia e exotérmico de liberação de energia. Os picos endotérmicos representam as transformações de fase, ou fusão dos biomateriais (ATD ou DSC). Já para o caso da curva (TG), esta fornece informações sobre a perda de massa em função da temperatura e do tempo [FELISBERTI, 2010].
As aplicações da análise térmica diferencial (ATD), termogravimetria (TG) e calorimetria exploratória diferencial (DSC) são técnicas que podem contribuir na avaliação da adsorção, desidroxilação e decomposição térmica de materiais. Fornecendo também resultados referentes a degradação térmica oxidativa e liberação de gases. E ainda informações sobre a cinética das reações que ocorrem através da desidratação, sublimação e oxidação [RODRIGUES, 2005].
O estudo de caracterização realizado por Camargo [2014],
utilizando o método de análise térmica diferencial, sobre pó nanoestruturado de hidroxiapatita e de nanocompósitos de matriz hidroxiapatita/Al2O3-α nas concentrações de 1, 2, 3 e 5%, estão
apresentados na figura 13. Constata-se nos resultados obtidos pelo autor, que tanto para a matriz HA, como para os nanocompósitos HA/Al2O3-α dois picos endotérmicos. O primeiro a uma temperatura de
111°C, indicando perda de massa, a qual esta associado à eliminação de
água absorvida na superfície das partículas, sem haver modificação da estrutura cristalina. O segundo pico endotérmico ocorreu em aproximadamente 520°C indicando modificação da estrutura cristalina em razão da desidroxilação da hidroxiapatita. Verifica-se para o caso do pó da HA, um segundo pico exotérmico em aproximadamente 1150°C, indicando transformação de fase da hidroxiapatita, para a fase fosfato de cálcio-β. Já para os pós nanocompósitos, observou-se esta modificação aproximadamente 1080°C, caracterizada pelo segundo pico exotérmico.
O terceiro pico exotérmico representados pelas curvas (ATD) ocorreu em 1275°C, 1252°C, 1265°C e 1240°C para os nanocompósitos nas
composições 1%, 2%, 3% e 5% em volume de Al2O3–α
respectivamente. Estes picos indicaram a mudança da fase do fosfato de cálcio–β, para a fase do fosfato de cálcio–α. É conhecido da literatura,
cálcio-α se encontra em aproximadamente 1180°C, isto também pode ser influenciado pelos constituintes do pó nanocompósito. O autor constatou nas curvas de ATD para os pós nanocompósitos, a formação alotrópica do fosfato de cálcio a 1200°C. O autor explica que isto pode ser referente a modificação da cinética de difusão superficial de grãos da fase HA, em razão da presença de uma pequena concentração de Al2O3–
α, que estão dispersas em posição inter-intragranular na matriz
hidroxiapatita.
Figura I.13. Curvas de análise térmica diferencial (ATD) obtidas sobre pós nanoestruturados
Fonte: CAMARGO, 2014.
O estudo de caracterização realizado por Oliveira [2010],