DISSERTAÇÃO DE MESTRADO
Clonagem e expressão do cDNA codificante para a toxina do veneno de Lasiodora sp, LTx2, em vetor de expressão pET11a.
Alexandre A. de Assis Dutra Ouro Preto, Julho de 2006
Universidade Federal de Ouro Preto Núcleo de Pesquisa em Ciências Biológicas
Universidade Federal de Ouro Preto Núcleo de Pesquisa em Ciências Biológicas
Programa de Pós-graduação em Ciências Biológicas
Clonagem e expressão do cDNA codificante para a toxina do veneno de Lasiodora sp, LTx2, em vetor de expressão pET11a.
Alexandre A. de Assis Dutra
ORIENTADOR: PROF. DR. IESO DE MIRANDA CASTRO
D978c Dutra, Alexandre A. Assis.
Clonagem e expressão do DNA codificante para a toxina do veneno de Lasiodora sp, LTx2, em vetor de expressão pET11a: [manuscrito]. / Alexandre A. Assis Dutra. - 2006.
xi, 87f.: il., color; graf.; tabs.
Orientador: Prof. Dr. Ieso de Miranda Castro.
Área de concentração: Biologia molecular.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas em Ciências Biológicas.
1. Clonagem - Teses. 2. Biologia molecular -Teses. 3. Toxinas - Teses. 4. Aranha - Veneno - Teses. I.Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas em Ciências Biológicas. II. Título.
Agradecimentos
Agradeço ao professor Ieso pela oportunidade de trabalho, pela confiança depositada em mim e pela orientação séria e comprometida;
Lucas, Milene e André, por dividirem as dúvidas, frustrações e as conquistas nesse trabalho; Aos professores Juliana Fietto e Luciano Fietto por todos os conselhos e sugestões para sempre contornar, com serenidade, os problemas que surgiam;
À Maria José Trópia, por estar sempre pronta e disposta para me tirar do sufoco com boa vontade e bom humor;
Aos amigos do LBCM que fizeram os momentos difíceis parecerem até um pouco cômicos, especialmente Aninha, Lisvane, Mel, Fernanda, Luiza, Renata, Gil, Ju, Ronny, Murilo;
Aos amigos dos outros laboratórios que foram de importância indispensável para a conclusão deste trabalho. Dentre os quais: LIP e Laboratório de Bioquímica e Biologia Molecular;
Um agradecimento especial aos amigos do Laboratório de Venenos e Toxinas Animais – ICB – UFMG; pela ajuda nas análises de dados e purificações, além de sempre me ajudar a manter o bom humor;
Aos professores Adriano Pimenta e Milton Guerra pelas sugestões e discussões sempre muito proveitosas;
À minha família em BH por sempre estar presente, mesmo quando eu não sabia que precisava tanto deles ou não dava o devido valor;
Aos amigos que, mesmo não estando envolvidos diretamente na realização do trabalho, me ajudaram a manter a calma e esquecer dos problemas, quando estes pareciam maiores do que realmente eram;
Resumo
O veneno de cobras, escorpiões, aranhas e outros animais venenosos é uma fonte rica em toxinas.
Uma característica importante de algumas toxinas é o fato de serem espécie específicas. Neste
trabalho, nós realizamos a clonagem da seqüência codificante para a toxina LTx2 da aranha
Lasiodora sp. no vetor de expressão pET11a. Esta toxina foi previamente identificada, através da
varredura de uma biblioteca de cDNA da glândula de veneno desta aranha. A análise de
similaridade, feita com o programa de alinhamento local BLAST, mostrou que esta toxina
apresenta similaridade com as toxinas huwetoxina-II e huwetoxina-VII da aranha Selenocosmia
huwena, bem como com as toxinas LTx1 e LTx3 da Lasiodora sp. Após a clonagem no vetor de
expressão, nós sequenciamos o produto da clonagem pelo método de Sanger e verificamos que o
mesmo foi inserido no frame correto. A indução da expressão da toxina recombinante foi feita
usando IPTG na concentração de 0,6 mM, por 3-4 horas. Através de ensaios imunoquímicos, nós
constatamos que neste sistema a proteína recombinante é expressa sobretudo na forma de corpos
de inclusão. Definimos então, uma estratégia para obter a toxina solúvel renaturada. Utilizando
uma solução contendo uréia na concentração de 6 M realizamos a desnaturação dos corpos de
inclusão, e procedemos a renaturação da proteína recombinante através de diálise em um tampão
de renaturação. A amostra foi então submetida a uma cromatografia líquida de alta pressão em
coluna de fase reversa. Através de eletroforese e Western Blotting, nós observamos que a
estratégia de purificação foi eficiente. Realizamos então um ensaio antimicrobiano, onde
observamos que a toxina recombinante, na concentração de 400 mg/mL. inibiu o crescimento
dos microrganismos Escherichia coli, Salmonella Agona e Staphylococcus epidermidis. A
expressão e recuperação da proteína recombinante em maior quantidade permitirá a realização de
Abstract
The venom from snakes, scorpions, spiders and other venomous animals is a very rich source of
potent toxins. An interesting feature of some toxins is their remarkable species specificity. In the
present work we cloned a sequence which codifies for the toxin LTx2 from the venom of the
spider Lasiodora sp, in the expression vector pET11a. This toxin was previously identified in the
screening of the cDNA library of the total venom. This toxin, when submitted to the local
alignment tool, BLAST, shown similarity with the toxins huwetoxina-II and huwetoxina-VII,
from the venom of the spider Selenocosmia huwena, as well as with the toxins LTx1 and LTx3
from Lasiodora sp. venom. After cloning in expression vector we verified if the fragment was
inserted in the correct frame using the Sanger DNA sequencing method. The expression of the
target protein was made by adding 0,6 mM IPTG to the media followed by a 3 to 4 hours
incubation. With the assistance of immunochemical assays, we were able to detect that the target
protein was been expressed in the form of inclusion bodies. Then we defined a strategy to
recover the soluble refolded protein. Using a solution containing 6 M urea we proceed the
solubilization of the inclusion bodies. The refolding of the soluble protein was made by the
dialysis method in refolding buffer. The sample was, then, submitted to high pressure liquid
chromatography, in a reversed phase column, to purify the protein. The purifying process was
efficient, as shown by the Western Blotting and electrophoresis results. After that, we made an
anti microbial assay, where we could see that the target protein, in the concentration of 400
mg/mL, inhibited the growth of the organisms used in the test. The expression and recovery of
larger amounts of the target protein will allow tests with this toxin in other organisms and
Índice
Resumo………...…….………….. III
Abstract………..….….…….. IV
Abreviaturas importantes………..….…………IX Lista de Figuras………...…………. X Lista de Tabelas... XI Apêndice...XII
1 – Introdução... 1
1.1 – Aspectos gerais...1
1.2 – Estudo de venenos animais ...4
1.3 – Estudo de venenos de aranhas...6
1.3.1 – Composição dos venenos de aranhas...6
1.3.2 – Ação dos venenos em canais iônicos...9
1.3.2.1 - Toxinas de aranha e canais de Ca2+...10
1.3.2.2 - Toxinas de aranha e canais de Na+...13
1.3.2.3 - Toxinas de aranha e canais de K+...17
1.3.2.4 - Toxinas de aranha e receptores de glutamato...19
1.3.3 – Toxinas inseticidas...21
1.3.4 - Atividade bactericida de venenos de aranhas...22
1.4 – Varredura de uma biblioteca de cDNA preparado a partir do mRNA obtido da glândula de veneno da aranha Lasiodora sp...23
2 – Objetivos...25
2.1 – Objetivo geral...25
2.2 – Objetivos específicos...25
3 – Materiais e Métodos...26
3.1 – Microrganismos, vetores e condições de cultivo utilizados nos experimentos...26
3.1.2 – Vetores utilizados nos experimentos...26
3.1.3 – Meios de cultura...27
3.1.3.1 - Meio LB...27
3.1.3.2 - LB agar...27
3.1.3.3 – Meio SOC...27
3.1.4 – Condições de cultivo...28
3.2 - Extração de DNA plasmidial em pequena escala (Método CTAB)...28
3.3 – Reações da polimerase em cadeia (PCR)...29
3.4 - Clonagem da seqüência codificante para LTx2 no vetor pBluescript II SK (+/-)...29
3.5 - Clonagem da seqüência codificante para LsTx2 no vetor de expressão pET11a...31
3.5.1 – Excisão do plasmídeo pBluescript II SK – LTx2...31
3.5.2 - Recuperação do inserto correspondente à seqüência codificante para LTx2...32
3.5.3 - Corte e defosforilação do vetor pET11a...33
3.5.4 – Recuperação do vetor excisado em gel de agarose...35
3.5.5 – Ligação do fragmento codificante para LTx2 no vetor pET11a...35
3.6 - Transformação das bactérias...36
3.6.1 - Preparo de células competentes – Método de Cloreto de Cálcio...36
3.6.2 - Transformação das células competentes...36
3.7 - Obtenção de DNA plasmidial e análise dos transformantes...37
3.8 – Sequenciamento...37
3.8.1 - Reação de sequenciamento...37
3.8.2 - Precipitação da reação de sequenciamento...38
3.8.3 – Análise das seqüências de nucleotídeos obtidas...38
3.9 - Transformação das células BL21 (DE3)...39
3.10 – Análise dos plasmídeos extraídos das células BL21 (DE3)...39
3.11 - Indução da LTx2 recombinante e análise do perfil eletroforético dos extratos livres de células...39
3.11.2 - Lise das células...40
3.11.3 – Preparo e coloração dos géis SDS – PAGE...40
3.11.3.1 – Preparo dos géis de poliacrilamida...40
3.11.3.2 - Coloração dos géis de poliacrilamida pelo método da prata...41
3.12 - Western Blotting - Método ECL...41
3.13 – Desnaturação dos corpos de inclusão e renaturação das proteínas...42
3.13.1 - Solubilização dos corpos de inclusão...42
3.13.2 - Renaturação das proteínas...43
3.14 - Purificação da proteína recombinante LTx2...43
3.15 - Western Blot...43
3.16 - Dosagem de proteínas...44
3.17 - Análise da seqüência de aminoácidos da LTx2 no programa BLASTp...44
3.18 - Análise da conformação secundária da LTx2...44
3.19 - Ensaios Biológicos...44
3.20 – Reagente e soluções...45
4 – Resultados...47
4.1 - Clonagem da seqüência codificante para LTx2 no vetor de expressão pET11a...46
4.2 - Análise da seqüência...49
4.3 – Transformação de células BL21(DE3) competentes e indução da toxina recombinante LTx2...49
4.3.1 – Análise das células competentes BL21(DE3) transformadas com a construção pET11a – LTx2 ...49
4.3.2 - Análise do perfil eletroforético dos extratos livres de células...51
4.3.3 – Confirmação da presença da LTx2 recombinante por Western Blotting - Método ECL...53
4.4 – Purificação da toxina recombinante LTx2 em sistema HPLC...54
4.5 – Análise da fração eluída da coluna de fase reversa...56
4.5.1 – Eletroforese da fração eluída da coluna de fase reversa...56
4.5.2 – Western Blotting da fração eluída na coluna de fase reversa...57
4.7 - Análise da conformação secundária da LTx2...58
4.6 – Ensaios biológicos...60
4.6.1 – Teste de atividade antimicrobiana...60
5 – Discussão...63
6 – Conclusões...73
7 – Perspectivas...74
Abreviaturas importantes
Aah: Toxinas isoladas do veneno do escorpião Androctonus australis hector
AMPA: α-amino-3-hidroxi-5-metil-D-aspartato
BLAST: Basis Local Alignment Search Tool
cDNA: DNA complementar
dNTP: Desoxiribonucleotídeos
D.O.: Densidade Óptica
EDTA: EthyleneDiamineTetrAcetic acid (ácido etilenodiamino tetra-acético)
ELISA: Enzyme Linked Immunosorbent Assay (Ensaio de Imunoabsorvente ligado à enzima)
GABA: Gamma-aminobutyric acid (Ácido Gama-aminobutírico)
HPLC: High Pressure Liquid Chromatography (Cromatografia Líquida de Alta Performance)
HWTX: Huwetoxina. Toxina isolada da aranha Selenocosmia huwena.
ICK: Inhibitor Cistine Knot (Nó-de-cistina inibidor)
iGlur: Receptores ionotrópicos de glutamato
IPTG: Isopropil- β- D-thiogalactopyranoside
Kda: Kilo Dáltons
Lqh: Toxinas isoladas do veneno do escorpião Leiurus quinquestriatus hebraeus
mRNA: RNA mensageiro
nAChr: Receptores nicotínicos de acetilcolina
NMDA: N-metil-D-aspartato
PAGE: Polyacrilamide Gel Electrophoresis (Eletroforese em gel de poliacrilamida)
PCR: Polymerase Chain Reaction (Reação em cadeia da polimerase)
PhTx: Toxinas isoladas da aranha Phoneutria nigriventer
PMSF: Phenylmethylsulphonylfluoride (Fenil-Metil-Sulfonil-Fluorido)
TTX: tetrodotoxina
VWF: Von Willebrand Factor (Fator de Von WIllerand)
T.E: Tris / EDTA
TFA: Trifluor acetic acid (ácido trifluoracético)
Lista de figuras
Figura 1 - Esquema representando o motivo estrutural “nó-de-cistina”...8
Figura 2 – Modelo de canais de Ca2+ dependentes de voltagem...11
Figura 3 – Organização transmembrana das subunidades dos canais de Na+...14
Figura 4 – Estrutura dos canais de potássio...18
Figura 5: Tradução da seqüência de nucleotídeos que codifica para a toxina LTx2 utilizando o programa SIXFRAME...30
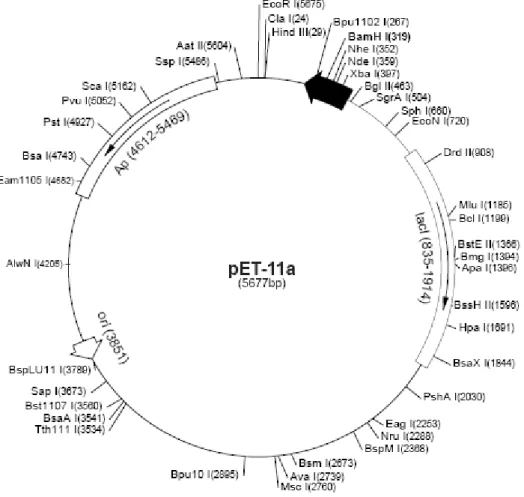
Figura 6 – Mapa do vetor de expressão pET11a...34
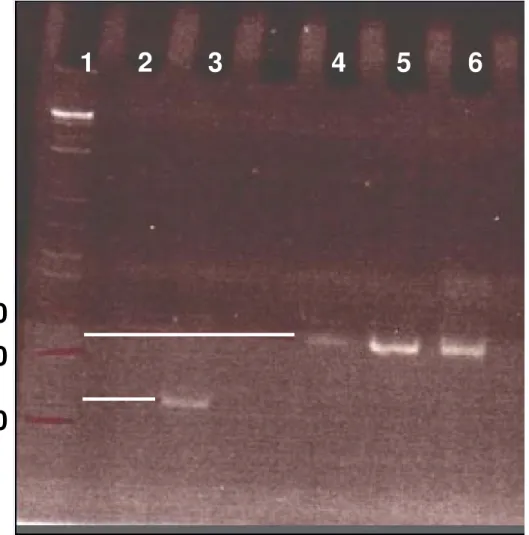
Figura 7: Eletroforese em gel de poliacrilamida dos produtos de PCR mostrando a inserção de um fragmento de aproximadamente 150 pares de bases...48
Figura 8 – Eletroforese em gel de agarose com o PCR de colônia dos DNAs plasmidiais extraídos das células competentes BL21(DE3) transformadas com a construção pET11a – LTx2...50
Figura 9: Eletroforese em gel SDS-PAGE, mostrando os níveis de expressão da proteína recombinante (LTx2) após indução com IPTG...52
Figura 10 - Resultado do Western Blotting método ECL...53
Figura 11 – Perfil cromatográfico obtido com a purificação da toxina LTx2 recombinante...55
Figura 12 - Eletroforese com o material recolhido do HPLC...56
Figura 13 - Resultado do Western Blotting do pico recolhido do HPLC...57
Figura 14 – Alinhamento das seqüências de aminoácidos das toxinas LTx2, LTx3, LTx1, HWTX-II e HWTX-VII...58
Figura 15 – Predição da estrutura secundária adotada pela LTx2, segundo o programa PELE...59
Figura 16 – Predição de estrutura secundária para a LTx2 segundo o programa GOR4...59
Figura 17 - Ensaio antimicrobiano...61
recombinante pelo promotor T7 lac...67
Lista de tabelas
1 - Introdução
1.1 - Aspectos gerais
As aranhas pertencem ao filo Artropoda, subfilo Chelicerata, classe Aracnida, ordem
Aranea (Ruppert 1994). A ordem Aranea pode ainda ser dividida em 2 subordens: Mesothelae,
que compreende uma única família de aranhas primitivas (Liphistiidae) com 85 espécies
documentadas. As aranhas da subordem Mesothelae são caracterizadas por apresentarem o
abdômen segmentado, enquanto que as aranhas da outra subordem, Opisthothelae, não
apresentam segmentação externa do abdômen. A subordem Opisthothelae é dividida em duas
Infra-ordens: Labdognatha e Orthognatha. A maioria das Labdognathas respira através de um par
de pulmões libriformes e um par de traquéias, que permitem uma troca gasosa mais eficiente,
permitindo que sejam menos sedentárias que as Orthognathas. As Labdognathas possuem
quelíceras diaxiais, que se movimentam de um lado para o outro e sintetizam a seda para a
construção de teias. As Orthognathas possuem quelíceras paraxiais, que se movimentam de cima
para baixo, e normalmente sintetizam a seda apenas para construir a ooteca e linhas de reboque.
Com algumas poucas exceções, não constroem teias elaboradas (King 2000). Este grupo inclui as
maiores aranhas conhecidas.
Hoje são conhecidas cerca de 40.000 espécies de aranhas e estima-se que existam
aproximadamente 100.000 espécies ainda não caracterizadas. Entretanto, somente a minoria
dessas representa algum perigo para o homem (Escoubas et. al. 2000, Lucas 1988). Em geral as
aranhas têm de 0,5 mm a 9,0 cm de comprimento corporal, podendo atingir um tamanho de 25
cm da ponta de uma perna à outra, como no caso das caranguejeiras gigantes (King 2004). A
diferença mais evidente entre os machos e as fêmeas está no pedipalpo. Os da fêmea são curtos e
se assemelham com as pernas; já os do macho possuem o último segmento modificado em órgão
copulador, apresentando uma forma dilatada na ponta (Platnick 1971).
Uma das características mais distinta das aranhas é a produção de seda. Uma única espécie
pode conter até oito fiandeiras, cada uma produzindo seda com uma característica diferente
(King 2004). As aranhas construtoras de teias produzem uma variedade de fibras com
propriedades mecânicas ímpares na natureza e comparáveis com as melhores fibras produzidas
pelo homem, em termos de resistência mecânica (Gosline 1999). Já foram encontradas espécies
fósseis do Devoniano com fiandeiras perfeitamente identificáveis (Shear et. al. 1989). A seda das
As aranhas, como a maioria dos outros aracnídeos, são predadoras e se alimentam
principalmente de insetos. De acordo com uma avaliação de Bristowe (1958) as espécies que
habitavam a Grã-Bretanha naquela época devoravam por ano uma quantidade de insetos maior
que o peso da população humana da ilha, o que ilustra também a importância das aranhas no
equilíbrio ecológico. Entretanto, as aranhas são também presas de alguns insetos e vertebrados.
Como exemplo alguns grupos de vespas, que utilizam aranhas como alimentos para suas larvas,
paralisam a aranha com um ferrão e põem os ovos (Evans & Eberhard 1970, Steiner 1986).
No Brasil as aranhas que causam acidentes de maior gravidade são as Araneomorphas do
gênero Phoneutria Perty 1833, Loxosceles (Heinecker and Lowe, 1833) e Latrodectus Walckenaer 1805 (Lucas 1987). O gênero Phoneutria Perty 1833, que pertence à família
Ctenidae, tem os olhos distribuídos em três fileiras. A primeira mais próxima às quelíceras com
dois olhos, a segunda com quatro olhos e a terceira com dois olhos (Lucas 1987). As aranhas
desse gênero são popularmente conhecidas pelo nome de “Armadeira” ou
“aranha-das-bananeiras”. Elas apresentam hábitos crepusculares, erráticos e não constroem teias, caçando
suas presas ativamente dominando-as com o veneno. A Phoneutria pica com freqüência e é
bastante agressiva. Não costumam fugir quando provocadas e acompanham o movimento do
agressor sempre tentando ficar na frente do mesmo. O veneno possui efeito neurotóxico
periférico e central causando dor imediata e intensa. A maioria dos casos de acidente com
aranhas deste gênero é de evolução benigna e não costuma ser fatal em adultos (Secretaria de
Estado da Saúde, Ins. Butantan 1982).
As aranhas do gênero Loxosceles são pequenas, com no máximo três centímetros de
comprimento de uma perna à outra. Possuem seis olhos dispostos em três pares. São conhecidas
popularmente como “aranha-violino” ou “aranha-marrom”. Normalmente elas não chamam a
atenção e podem até ser confundidas com outras espécies menos perigosas (Lucas 1987). Elas
aparecem em ambientes domésticos, porões, sótãos, garagens e entulhos (Lucas 1987). Não são
aranhas agressivas e normalmente só picam quando comprimidas contra o corpo, situação que,
normalmente, causa a morte das mesmas. O veneno tem ação hemolítica e proteolítica. Na
maioria das vezes a picada não é percebida pela vítima e após 24 horas aparecem edemas no
local da picada, indisposição e algumas vezes febre. A ulceração da pele, apesar da soroterapia,
evolui vagarosamente e deixa cicatrizes.
As aranhas do gênero Latrodectus são caracterizadas por um abdômen dilatado em forma
de globo, exibindo no lado ventral uma cor vermelho-alaranjada. Os olhos são distribuídos em
duas fileiras com quatro olhos cada uma. São conhecidas popularmente como “Viúvas-negras”.
mm de comprimento. Estes, normalmente morrem após o acasalamento. A fêmea faz de 3 a 5
ootecas em um intervalo de poucos dias. Os filhotes são espalhados pelo vento e podem se
dispersar por quilômetros. As aranhas deste gênero não são agressivas e quando perturbadas
deixam-se cair da teia e fingem-se de mortas. Picam somente quando comprimidas contra o
corpo (Lucas 1987). O veneno desta aranha é, provavelmente, um dos venenos naturais mais
tóxicos. O quadro clínico da picada é caracterizado por espasmos musculares dolorosos. Pode ser
de alto risco para crianças, idosos e pessoas com doenças cardiovasculares. O tratamento, quando
necessário, é feito com anti-soro específico (Rauber 1983). Os venenos de todas as aranhas deste
gênero apresentam modo de ação semelhante e parecem ser compostos das mesmas toxinas
(Escoubas et. al. 2000).
Quanto às caranguejeiras, pensava-se que estas eram aranhas perigosas por causa do seu
tamanho (Bücherl 1971). Mas não há, no Brasil, relatos de acidentes graves causados pelas
aranhas da infraordem Orthognatha (Lucas 1987). Em recentes casos de picadas de
Theraphosiideos na América do Sul (Lucas et. al. 1994) e Ásia/África (Schmidt 1989) e
Austrália (Isbister et. al. 2003) ficou provado que o veneno desta aranha é inócuo para humanos,
resultando, na maioria dos casos, apenas em dores locais moderadas, coceiras e rigidez no local
da picada. Em casos mais severos podem ocorrer espasmos musculares que podem persistir por
várias horas (Escoubas & Rash 2004). A dor causada pela picada desta aranha é resultante
principalmente pelo ferimento provocado pelas quelíceras, pelo pH baixo do veneno, efeitos das
histaminas, serotoninas e ATP (Schanbacher et. al. 1973 a,b; Chan et. al. 1975; Odell et. al.
1985, 1987). A principal forma de defesa dos Theraphosideos não é o veneno, e sim os pêlos
urticantes presentes no abdômen dessa aranha, em uma concentração de 10 mil a 20 mil pêlos
por mm (Pickard-Cambridge 1897). Quando o animal se sente ameaçado ele raspa as pernas
posteriores no abdômen e lança esses pêlos urticantes no agressor, causando irritação na pele e
mucosas. Entretanto, os casos de acidentes com a Mygalomorpha australiana Atrax robustus, da
família Hexathelidae, são normalmente graves e antes do desenvolvimento de um anti-veneno
eficiente podiam causar até a morte da vítima, como já foi relatado na literatura médica (Hartman
1.2 – Estudo de venenos animais
Os animais que possuem ou que utilizam toxinas, como cobras, escorpiões, Conus, insetos
e aranhas contam com a maquinaria genética para a produção destes compostos (Mebs 2001,
Escoubas & Rash 2004). A síntese de toxinas envolve a expressão de um gene que acarreta
diretamente na toxina e a síntese de compostos secundários com atividade biológica envolve vias
metabólicas constituídas de numerosas etapas (Mebs 2001).
Já a algum tempo os venenos de origem animal têm sido alvo de grande atenção. O que
inicialmente despertou atenção foi o modo de ação desses venenos e a importância médica
relativa aos danos que estas substâncias podem causar ao organismo. Recentemente, o interesse
por moléculas de origem animal aumentou devido ao fato de elas apresentaram um potencial
valor econômico, relacionado ao desenvolvimento de novos fármacos e/ou inseticidas e como
sondas específicas úteis para o estudo de canais iônicos e receptores de membranas, fornecendo
ferramentas para a investigação de funções celulares bem como drogas úteis no estudo de
neuropatologias (Jovem et. al. 1980a, Courad et. al.1982, Budd et. al. 1988, Jackson &
Usherwood 1988, Cruz et. al. 1985, Grishin et. al. 1986, DeLima & Martin-Eauclaire 1995,
Pimenta et. al. 2001a).
O estudo do mecanismo de ação de venenos de origem animal mostrou que moléculas
isoladas destes venenos podem revelar muito acerca do processo fisiológico nos quais elas
interferem (Escoubas & Rash 2004). Uma das propriedades mais importantes das toxinas de
origem animal é a alta especificidade por certos subtipos de canais iônicos ou receptores de
membrana. Esta propriedade, quando combinada com a alta potência que geralmente as toxinas
possuem, faz delas uma ferramenta de valor inestimável em experimentos para elucidar o papel
fisiológico ou patologias relacionadas aos receptores ou canais, já que poucas drogas têm ação
específica sobre os mesmos (Harvey 1998).
As picadas de serpente causam cerca de 2,5 milhões de acidentes anualmente em todo o
mundo, dos quais mais de 100.000 levam à morte (White 2005). A importância clínica dos
venenos de serpente é, em parte, responsável pela atenção que já vem sendo dada há muito
tempo a este veneno, o que resultou na descoberta de drogas importantes sintetizadas com base
na composição do mesmo. Para citar um exemplo de sucesso, o potenciador de bradicinina,
captopril, foi desenvolvido a partir do veneno de Jararaca (Harvey et. al. 1998) e hoje é usado
como anti-hipertensivo em todo o mundo.
Outro exemplo da utilidade das toxinas está no estudo de receptores muscarínicos no
disponíveis até então só eram capazes de distinguir três subtipos: M1, M2 e M3. Além de não
serem seletivos o bastante para cada subtipo, as ferramentas farmacológicas disponíveis não
permitiam estudar o envolvimento de cada um desses subtipos em um processo particular
(Harvey et. al. 1998). Entretanto, no veneno da serpente Mamba Negra (Dendroapsis polylepis)
foram encontradas toxinas que, por experimentos de competição, se mostraram específicas para
certos tipos de receptores muscarínicos (Jerusalinsky et. al. 1992). De forma que se pôde
demonstrar, por exemplo, que o bloqueio do receptor M4 causa amnésia em camundongos. No
veneno desta mesma serpente também foi encontrada uma das poucas toxinas com ação
específica para canais de cálcio do tipo-L, a calciseptina.
Outra utilidade prática encontrada para o estudo de venenos animais tem sido a pesquisa
com inibidores de agregação plaquetária. O fator Von Willebrand (VWF) não interage com
plaquetas em condições normais. Entretanto, certos componentes de venenos de serpente, como
botrocetina e bitiscetina induzem a aglutinação plaquetária in vitro, mesmo em condições
normais (Matsui & Hamako 2005). Para superar as limitações dos indutores de coagulação
disponíveis na prática clínica, Read et.al. (1978) procuraram e encontraram, em 5 dos 73
venenos estudados, atividade de agregação plaquetária mediada pelo VWF.
Bem como os venenos de aranhas e escorpiões, os venenos de vespas possuem várias
substâncias bioativas (Konno et. al. 2001). Não obstante, eles têm sido negligenciados nos
estudos de venenos animais e são pouco conhecidas as substâncias que os compõem. Os venenos
de vespa são peculiares por possuírem um efeito paralítico, não-letal, de longa duração (Hisada
et. al. 2005), uma vez que elas utilizam a presa paralisada para alimentar suas larvas (Konno et. al. 2001). No veneno da vespa Philantes triangulum foram encontradas philantotoxinas, que são moléculas bloqueadoras do receptor pós-sináptico do glutamato (Piek & Spanjer 1986, Piek et al.
1988, Eldefrawi et. al. 1988). Konno e colaboradores (2001) encontraram no veneno das vespas
solitárias Anoplius samariensis e Batozonellus maculifrons uma série de toxinas peptídicas a que
denominaram pompilidotoxinas (PMTXs). Esses peptídeos apresentaram ação tanto em sistema
nervoso de invertebrados como em sistema nervoso central de mamíferos. Também no veneno da
vespa solitária Anoplius samariensis, Konno e colaboradores (2001) encontraram o peptídeo
anoplina. Esse peptídeo, composto por apenas 10 resíduos de aminoácidos, apresentou atividade
antimicrobiana, e é o primeiro relato de substância com esse tipo de ação encontrada em veneno
de vespas.
Os venenos de escorpião possuem grupos de neurotoxinas que agem em mamíferos ou
insetos. São toxinas polipeptídicas de cadeia longa, com 61 – 76 resíduos de aminoácidos,
(Karbat et. al. 2004). Estas toxinas peptídicas podem ser classificadas em duas categorias principais, toxinas α e β, com base no modo de ação e nas propriedades de ligação em sítios dos
canais de sódio dependentes de voltagem (Gurevitz et. al. 1998, Wu et. al. 2000, Cestèlle &
Catterall 2000, Karbat et. al. 2004). As toxinas α, o grupo que foi mais estudado, causam
principalmente um retardo na inativação dos canais de sódio, prolongando o potencial de ação
(Catterall 1995, Catterall 2000, Denac et. al. 2000, Gordon & Gurevitz 2003, Sun et. al. 2003).
Este grupo pode ainda ser dividido em três subgrupos: Grupo α clássico, ativo em cérebro de
mamíferos, como a Aah2 (isolada do veneno do escorpião Androctonus australis hector) e a
Lqh2 (isolada do veneno do escorpião Leiurus quinquestriatus hebraeus), que se ligam com alta
afinidade em canais de sódio dependentes de voltagem de cérebro de rato, mas que praticamente
não são tóxicas em insetos (Karbat et. al. 2004); inseto-toxina α, como a LqhαIT, que tem alta
afinidade em canais de sódio dependentes de voltagem de insetos (Karbat et. al. 2004), e o grupo
α-like, ativo em sistema nervoso central de mamíferos e insetos (Gordon & Gurevitz 2003, Karbat et. al. 2004) mas incapaz de se ligar em preparação sinaptossomal de rato (Sun et. al. 2003). As toxinas β tornam mais negativa a voltagem necessária para a ativação do canal de
sódio, diminuindo a amplitude do pico de potencial de ação (Cestèlle & Catterall 2000).
1.3 – Estudo de venenos de aranhas
1.3.1 - Composição dos venenos de aranhas
Dentre os diferentes grupos de animais venenosos, o das aranhas é provavelmente o menos
explorado no aspecto relativo a composição do veneno (Escoubas et. al. 2000). Tal como
venenos de outros animais, venenos de aranhas são uma rica fonte de toxinas de complexidade
ainda não completamente elucidadas, incluindo peptídeos neuroativos, que são capazes matar ou
paralisar a presa através de mecanismos moleculares variados. Os venenos de aranha são uma
mistura de peptídeos de baixo peso molecular, neurotoxinas, toxinas dermonecróticas, enzimas
(Hash & Hodgson 2002). Também fazem parte da composição de venenos de aranhas uma
variedade de fatores humorais com propriedades inflamatórias, poliaminas livres, nucleotídeos,
sais inorgânicos, aminoácidos livres, polipeptídeos com mais de 1000 resíduos de aminoácidos e
fatores que podem modificar vários componentes da circulação sangüínea, acilpoliaminas e
neurotransmissores. (Welsh & Batty 1963, Hash & Hodgson 2002). A função desses
estar relacionados com a ação das neurotoxinas ou que sejam produtos da degradação de outros
constituintes do veneno (Escoubas et. al. 2000).
As acilpoliaminas, junto com as proteínas e os peptídeos, são os componentes mais
estudados e diversificados dos venenos de aranha (Beleboni et. al. 2004). Acilpoliaminas e
peptídeos podem ser separados por cromatografia líquida de fase reversa, sendo que as
acilpoliaminas são eluídas antes que os peptídeos. Este padrão de eluição já foi demonstrado
outras vezes na literatura e parece ser apresentado por todos os venenos de caranguejeiras
(Escoubas et. al.1995).
As acilpoliaminas, derivados naturais de poliaminas, são moléculas pequenas e potentes
que antagonizam várias classes de receptores, como receptores nicotínicos de acetilcolina
(nAChr) e receptores ionotrópicos de glutamato (iGlur). Esses componentes possuem também a
capacidade de interagir com canais iônicos dos sistemas nervosos, central e periférico (Olsen et.
al. 2004). Elas podem ser divididas em dois grupos: acilpoliaminas que contêm aminoácidos e acilpoliaminas que não contêm aminoácidos. Os dois grupos agem de maneira semelhante
bloqueando o receptor de glutamato, receptores nicotínicos e incorporam a mesma família de
grupos acil aromáticos terminais (para revisão ver McCormik e Meinwald 1995 e Blagbrough et.
al. 1994). Em um estudo com a acilpoliamina AR636, isolada do veneno da aranha Argiope aurantia, Herold & Yaksh (2005) observaram que a AR636 provoca paralisia flácida dose-dependente bem como efeito anestésico, quando injetada em ratos através de um cateter espinhal.
As acilpoliaminas agem também em canais de Ca2+ (McCormick et. al. 1993), e parecem ser
também os responsáveis pela rápida paralisia observada em insetos durante a predação (Osborne
1996).
Os principais componentes dos venenos de aranha são polipeptídeos com massa
molecular de 3000 a 8000 Da que dependem de várias pontes de disulfeto para manter sua
conformação. Esses polipeptídeos possuem também modificações amino ou carboxi terminais,
ou mesmo ambas, que mantêm a estabilidade da molécula in vivo (Norton & Pallaghy, 1998).
Essas toxinas têm essencialmente como alvo os vários tipos de canais iônicos de membrana e
podem bloquear a liberação de neurotransmissores interrompendo a exocitose dos mesmos
pelas membranas pré-sinápticas (Escoubas et. al.2000). Muitas das toxinas que agem em canais
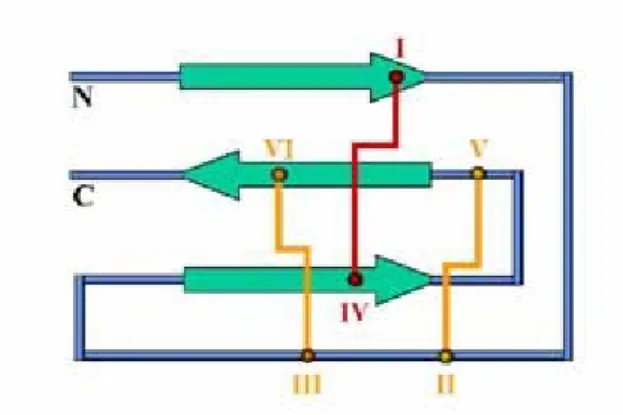
iônicos possuem um motivo estrutural chamado de cistina” (Figura 1). O
“nó-de-cistina” é um motivo em que um “anel”, sustentado por duas pontes disulfeto, é cruzado por
uma terceira ponte disulfeto (Craik et. al. 2001). Em 1994 uma conformação, encontrada em
inibidores de proteases de plantas e neurotoxinas de Conus e aranhas, foi caracterizada por dois
chamado de “Nó-de-cistina Inibidor” (ICK) é formado por uma folha-β tripla antiparalela
estabilizada por um nó de cistina (Zhu et. al. 2003). Os dados encontrados por Escoubas &
Rash (2004) sugerem que as toxinas com o motivo ICK possuem um espectro de ação
farmacológica muito ampla, podendo exercer atividade em várias classes de canais iônicos.
Até o momento aproximadamente 400 proteínas e peptídeos (1,2 – 27 Kda) já foram
isoladas e purificadas, dentre as quais mais de 100 já tiveram a seqüência de aminoácidos
determinada completa ou parcialmente (Richardson 2006). Essas toxinas têm essencialmente
como alvo os vários tipos de canais iônicos de membrana e podem bloquear a liberação de
neurotransmissores interrompendo a exocitose dos mesmos pelas membranas pré-sinápticas
(Escoubas et. al.2000).
Figura 1. Esquema representando o motivo estrutural
“nó-de-cistina”. O “anel” estabilizado pelas pontes
disulfeto representadas em amarelo (VI - III e V – II) é
cortado por uma terceira ponte disulfeto, mostrada em
vermelho (I – IV).
Fonte: http://knottin.cbs.cnrs.fr
Entre as proteínas encontradas nos venenos de aranha estão incluídas neurotoxinas de alto
peso molecular e enzimas como proteases, hialuronidases, esfingomielinases, fosfolipases e
isomerases. Entretanto, com exceção do veneno da aranha Loxosceles, que possui uma ação
dermonecrótica peculiar, a presença de enzimas em venenos de aranha deve ser observada com
cautela (Schanbacher et. al. 1973a, Schanbacher et. al. 1973b), principalmente quando a extração
anteriores, podendo levar a uma contaminação do veneno com saliva ou fluidos digestivos
(Escoubas et. al. 2000).
Em um estudo recente, Pimenta et. al. (2005) utilizaram de técnicas de espectrometria de
massa para caracterizar estruturalmente peptídeos lineares com atividade antimicrobiana e
vasoativas presentes no veneno da aranha Phoneutria nigriventer. Neste estudo foram
encontradas 15 isoformas contendo de 7 a 15 resíduos de aminoácidos. São peptídeos
normalmente negligenciados nos estudos de veneno em detrimento àqueles com mais
toxicidade e presentes em maior quantidade, mas que entretanto podem possuir importantes
aplicações em biotecnologia. O fato de não dependerem de pontes disulfeto para manter a
conformação nativa favorece a expressão de proteínas ativas tanto por hospedeiros procariotas
como eucariotas (Pimenta e De Lima 2005).
1.3.2 – Ação dos venenos em canais iônicos
As toxinas peptídicas de venenos de aranha têm sido de grande utilidade no estudo da
eletrofisiologia e farmacologia de canais iônicos. Canais iônicos são proteínas de membrana que
permitem o fluxo de íons através da membrana celular, regulando o potencial de membrana e
balanço iônico da célula. Como moduladores do potencial de membrana os canais podem regular
funções importantes como contração, secreção de hormônios e neurotransmissores e expressão
gênica. Com o avanço nos estudos de toxinas, os pesquisadores ganharam uma importante
ferramenta que permite uma investigação mais refinada do papel fisiológico dos canais iônicos,
permitindo também o mapeamento de sítios específicos nos receptores que podem ser de
interesse como alvos para novas drogas (Escoubas et. al. 2000).
Vários estudos de caracterização dos venenos de outras aranhas já foram descritos, mas
pouco se sabe a respeito das toxinas que compõem o veneno das aranhas do gênero Lasiodora.
Recentemente foram descritas ações farmacológicas do veneno dessa aranha, tais como bloqueio
do canal de Ca2+ do Tipo-L e alteração da cinética e voltagem de canais de Na+ (Kushmerick et.
al. 2001).
A interação entre as toxinas peptídicas de caranguejeiras e seus respectivos receptores
ainda não é muito bem compreendida em nível molecular. Faltam estudos que definam o papel
de determinados resíduos de aminoácidos na afinidade ou seletividade da toxina para
determinados subtipos de canal. Seletividade esta que não é sempre absoluta. Uma toxina que
classes de canais permeáveis a outros íons. Essa não distinção por certas toxinas reforça o
conceito de um sítio de ligação conservado no sensor de voltagem dos canais de cálcio, sódio e
potássio (Escoubas & Rash 2004).
1.3.2.1 - Toxinas de aranha e canais de Ca2+
A importância dos níveis de Ca2+ em vários processos celulares já foi apontada por vários
autores. Os canais de Ca2+ dependentes de voltagem permitem a entrada do Ca2+ na célula, em
resposta à despolarização da membrana, de forma que esses íons possam exercer suas funções
sobre processos fisiológicos tais como a secreção de hormônios e neurotransmissores, regulação
da atividade de canais iônicos, controle da secreção de enzimas, expressão gênica, proliferação e
morte celular e apoptose (Beleboni et. al. 2004). Uma variedade de canais iônicos dependentes
de voltagem estão envolvidos na homeostase de cálcio. Esses canais são membros de uma
superfamília de proteínas transmembrana que incluem também canais de K+ e Na+ dependentes
de voltagem (Ertel et. al. 2000).
Os canais de Ca2+ que dependem de altos níveis de despolarização para serem ativados e
não apresentam inativação estão envolvidos essencialmente na liberação de neurotransmissores e
são divididos em canais do tipo-L, tipo-N, tipo-P, tipo-Q e tipo-R. Os canais de Ca2+ do tipo-L
são encontrados nos músculos liso, esquelético e cardíaco e células endócrinas, onde são
responsáveis pelo início da secreção. Esse tipo de canal é o alvo de drogas usadas no tratamento
de patologias cardiovasculares e são bloqueados por antagonistas orgânicos de canais de Ca2+ do
tipo-L, como dihidropiridinas, fenilalquilaminas e benzotiazepinas (Ertel et. al. 2000). Canais de
Ca2+ do Tipo-N, Tipo-P e Tipo-Q são encontrados em dendritos e terminais nervosos; e canais do
Tipo-R são encontrados em neurônios. Estes não podem ser bloqueados por antagonistas de
canais de Ca2+ do tipo-L, mas o são por toxinas polipeptídicas de Conus e aranhas (Ertel et. al.
2000).
Os canais de Ca2+ tipo-T são ativados por pequenas despolarizações, apresentam inativação
rápida e são encontrados em uma grande variedade de células, onde são responsáveis pelos
disparos repetitivos (Bean 1898, Caterral 2000, Ertel et. al.2000).
Todos os canais de Ca2+ ativados por voltagem são heterômeros formados por uma
subunidade α1 tetramérica, que é a subunidade formadora do poro, e por várias subunidades
reguladoras (α2, β, γ e a δ que é encontrada apenas no músculo esquelético) que são responsáveis
a responsável pelo transporte do íon e pela sensibilidade do canal à voltagem. É nesta subunidade
que se ligam drogas e toxinas (Beleboni 2004, Escoubas 2000). A grande diversidade de
correntes de cálcio é resultado principalmente da quantidade de genes que codificam para
isoformas distintas da subunidade α1 (Catterall 2000).
Figura 2 – Modelo de canais de Ca2+ dependentes de voltagem. Este modelo é uma modificação do modelo original de canais de Ca2+ dependentes de voltagem de músculo esquelético. As α-hélices estão representadas como cilindros.
FONTE: Catterall et. al. 2005.
Algumas toxinas de aranha permitiram a caracterização e classificação de diferentes
correntes de Ca2+ em células do sistema nervoso, bem como a descoberta, por Newcomb e
colaboradores (1998), dos canais de Ca2+ do Tipo-R, que eram insensíveis a todas as toxinas
conhecidas até então. Várias toxinas polipeptídicas provenientes de venenos de aranha
apresentam ação inibidora nas funções dos canais de Ca2+ dependentes de voltagem. Essas
toxinas foram inicialmente denominadas de forma genérica como ω-toxinas (Grishin 1999).
As ω-Agatoxinas e acilpoliaminas FTX foram as primeiras moléculas isoladas da aranha
Ca2+ nos canais dos tipos L, N e P, respectivamente. A ω-Agatoxina do tipo III é menos seletiva
e bloqueia tanto canais de Ca2+ do tipo-N quanto do tipo-L, com a mesma potência (Escoubas
2000).
Outro exemplo da especificidade em canais de Ca2+ se refere a acilpoliamina CNS2103 da
aranha Dolomedes akefinokesis, que bloqueia reversivelmente canais de Ca2+ do tipo-L e tipo-R,
sem afetar canais do Ca2+ do tipo-T ou qualquer canal de Na+ ou K+ (Kobayashi et. al. 1992,
Stromgaard et. al. 2001). A toxina peptídica SNX-325, da aranha asiática Segestria florentina se
mostrou seletiva no bloqueio de canais de Ca2+ do tipo-N, na concentração de 10nM (Newcomb
et. al. 1995).
A ação mais evidente do veneno total das aranhas do gênero Phoneutria é em canais de
Na+. Entretanto, o fracionamento do veneno permitiu observar a ação de toxinas isoladas em
outros canais iônicos. De fato, o segundo alvo principal do veneno total da aranha Phoneutria
nigriventer são os canais de Ca2+ dos vários tipos. O bloqueio desses canais é responsável pela paralisia flácida causada por esse veneno (Cassola et. al. 1998, Leão et. al. 2000, Revisão por
Gomez et. al. 2002). Seis diferentes toxinas, Tx3-1 a Tx3-6, foram isoladas da fração PhTx3 do
veneno de P. nigriventer. Dentre essas toxinas, três apresentaram atividade de bloqueio do
influxo de Ca2+ em terminais nervosos. São elas a Tx3-3, Tx3-4 e Tx3-6, que foram classificadas
como ω-toxinas devido ao seu efeito em canais de Ca2+ (Gómez et. al. 2002).
Kushmerick e colaboradores (2001) testaram o efeito do veneno total de Lasiodora em
células GH3 na presença de tetrodotoxina (TTX), que bloqueia canais de Na+ sensíveis a TTX,
para observar o efeito desde veneno em canais de Ca2+. O veneno bloqueou as oscilações dos
níveis intracelulares de Ca2+. Quando testado na ausência de TTX, o veneno causou lento
aumento do Ca2+ intracelular. Esse efeito sugere que o veneno bloqueie os canais de Ca2+ do
Tipo-L. Neste mesmo trabalho foi testado o efeito do veneno na presença de nifedipina ou Cd2+,
ambos bloqueadores de canais de Ca2+ do Tipo-L. Como não houve aumento de Ca2+
intracelular, foi sugerido que esse aumento depende da disponibilidade de canais de Na+ e canais
de Ca2+ do Tipo-L. Kushmerick e colaboradores (2001) sugeriram, então, que o veneno causa
aumento de Ca2+ intracelular através da abertura de canais de Na+. Essa abertura causa uma
despolarização da membrana e a entrada de Ca2+ através dos canais de Ca2+
voltagem-dependentes.
Uma toxina isolada do veneno da caranguejeira Grammostola spatula, a ω-grammotoxina,
bloqueia os canais de Ca2+ dos tipos N, P e Q, mas não tem efeito nos canais do Tipo-L (Sutton
1.3.2.2 - Toxinas de aranha e canais de Na+
Canais de Na+ dependentes de voltagem estão presentes nas membranas da maioria das
células excitáveis, onde são responsáveis pela geração e propagação do potencial de ação
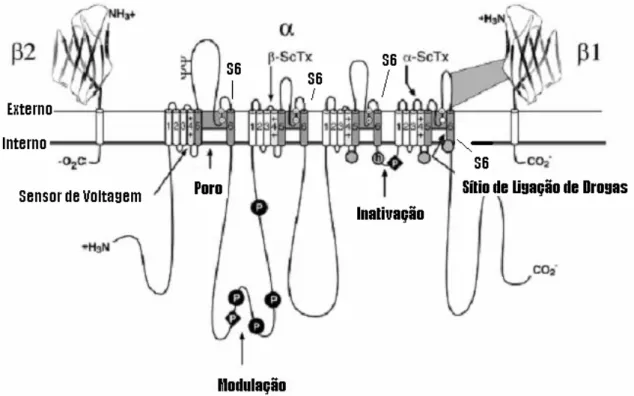
(Beleboni et. al. 2004). Os canais de Na+ são proteínas transmembrana compostas de uma subunidade α de aproximadamente 260 KDa e de pelo menos 3 subunidades β auxiliares. As
subunidades β são responsáveis pela cinética de abertura e dependência de voltagem do canal. A
subunidade α é composta de quatro domínios homólogos, nomeados de I a IV, cada um deles
composto de seis regiões transmembrana nomeadas de S1 a S6 (Figura 3). Todos os agentes
farmacológicos que agem em canais de sódio possuem sítios receptores na subunidade α (Cestèle
& Catterall 2000). A região S6 é a responsável pela ativação do canal, funcionando como um
sensor de voltagem. Entre os domínios III e IV existe uma região com a função de inativação do
Figura 3 – Organização transmembrana das subunidades dos canais de Na+. Os cilindros representam as α-hélices preditas e as linhas representam as cadeias polipeptídicas de cada subunidade. Os sítios prováveis de N-glicosilações
estão marcados com Ψ. O P está mostrando os sítios onde ocorrem fosforilações por proteína cinase A (círculos) e proteína cinase C (losango). O motivo isoleucina-fenilalanina-metionina-treonina (IFMT), que é crucial para a inativação,
está representado por um h em um círculo sombreado. Sítios de ligação para toxinas α e β de escorpião estão indicados. FONTE: Catterall et. al. 2005.
Uma variedade de isoformas de canais de Na+ dependentes de voltagem foi caracterizada
com a ajuda de técnicas de eletrofisiologia e bioquímica (Goldin 2001). Para auxiliar na
identificação dos canais de sódio dependentes de voltagem já caracterizados, uma nomeclatura
foi desenvolvida. Esta nomeclatura utiliza um sistema numérico para definir as subfamílias e
subtipos com base em similaridades nas seqüências de aminoácidos dos canais. Neste sistema o
nome individual do canal é o símbolo químico do principal íon a que ele é permeável (Na); o
no subscrito (NaV1) se refere à subfamília do gene que codifica para o canal. Atualmente existe
somente uma subfamília para os canais de sódio. O número após o ponto representa a isoforma
específica do canal, por exemplo, NaV1.1. Com base em sua seqüência de aminoácidos e
sensibilidade à tetrodotoxina, os canais de sódio podem ser classificados em dois grupos:
isoformas do grupo Nav1, que são 9 homólogos sensíveis à tetrodotoxina e denominados de
NaV1.1 a NaV1.9, e o grupo NaX, que é insensível à tetrodotoxina e difere estruturalmente do
primeiro grupo em regiões críticas do canal, como na região S4, a região responsável pela
inativação, e na região formadora do poro (Goldin et. al. 2000). Os canais do grupo NaV1
encontram-se principalmente nos neurônios, coração, gânglios nervosos e músculo esquelético.
Os canais do tipo NaX são provavelmente responsáveis pelo transporte e absorção de Na+,
dependem da concentração de Na+ no meio (Watanabe et. al. 2000), e são encontrados
principalmente no coração e neurônios sensoriais (Escoubas et. al. 2000).
Catterall e Beneski (1980) observaram que os sítios de ligação das neurotoxinas em canais
de Na+ apresentavam comportamento alostérico, podendo haver uma alteração conformacional
no canal e no balanço entre os estados fechado / inativo, o que também acarretaria mudanças na
afinidade da ligação de toxinas com outros sítios onde elas também podem se ligar.
Já foram descobertas diversas toxinas que bloqueiam ou alteram as funções dos canais de
Na+ dependentes de voltagem. Algumas delas já estão sendo utilizadas como ferramenta para o
estudo destes canais (Strichartz et. al. 1987, Catterall 1995). As principais moléculas ativas em
canais de Na+ são isoladas dos venenos de Agelenopsis aperta, Phoneutria nigriventer, Atrax robustus e Hadroniche versuta. O veneno de A. aperta foi o primeiro veneno no qual foram encontradas toxinas ativas em canais de Na+. Um grupo de toxinas peptídicas com ação em
canais de Na+ foi isolado do veneno desta aranha, as quais foram denominadas μ-agatoxinas (μ
-Aga I a μ-Aga VI) (Skinner et. al.1989). As μ-agatoxinas possuem ação semelhante às toxinas de
escorpião com ação em insetos, induzindo a uma mudança na cinética de ativação do canal de
Na+ de insetos para potenciais mais negativos (Grishin 1999, Beleboni et. al. 2004, revisão). A
hainatoxina-IV (HnTx-IV) isolada do veneno da aranha Seleconosmia hainana não exerceu
nenhum efeito na cinética das correntes de sódio. Entretanto esta toxina bloqueou as correntes de
sódio sensíveis à TTX em neurônios de mamíferos, sugerindo que a mesma age de forma
diferente da μ-Agatoxina (Xiao & Liang 2003). Outras duas toxinas (HwTxIV e HnTxV) foram
isoladas do veneno da aranha Selescomia huwena e S. hainana. Essas duas últimas toxinas se
mostraram seletivas para os canais de Na+ neuronais sensíveis à TTX, porém apresentaram um
modo de ação diferenciado, bloqueando o poro sem alterar a cinética das correntes de sódio. Foi
entrada do poro, e desta forma bloqueiam a passagem do íon. Se confirmado esse modo de ação,
poder-se-á concluir que estas toxinas atuam de forma distinta de todas as outras toxinas de
aranha com atividade em canais Nav descritas até o momento (Peng et. al. 2002, Liu et. al. 2003,
Xiao & Liang 2003). Essas três toxinas são, também, as primeiras com motivo ICK isoladas do
veneno de caranguejeira que não modificam a cinética do canal, mostrando uma diversidade
adicional desses venenos (Escoubas & Rash 2004).
A fração PhTx2 do veneno da aranha Phoneutria nigriventer diminuiu a inativação dos
canais de Na+ e facilitou a sua ativação (Araújo et. al. 1993). A PhTx2 também aumentou a
entrada de Na+ em sinaptosomas, aumentou o influxo de Ca2+ e a liberação de glutamato
(Romano-Silva et. al. 1993).
Quatro peptídeos inseticidas foram isolados por Corzo e colaboradores (2000) do veneno
de Paracoelotes luctuosus e foram denominados δ-palutoxinas IT1 – IT4. A δ-palutoxina IT1 é a
mais seletiva e potente dentre as δ-palutoxinas e age interferindo na inativação dos canais de
Na+.
O veneno total de Lasiodora não afetou a ativação dos canais Na+, mas retardou a cinética
de despolarização e causou o surgimento de uma corrente que permanecia mesmo após o
processo de despolarização. Ao contrário das tetrodotoxinas, isoladas do peixe Baiacu (Tetrodon
sp), as toxinas de aracnídeos não interferem com a abertura dos canais, mas retardam a inativação ou alteram a voltagem de ativação, inativação ou ambos. O principal efeito do veneno
de Lasiodora foi retardar e tornar incompleta a inativação dos canais de Na+. O veneno tornou
mais negativa a voltagem necessária para a ativação. Dessa forma, essas toxinas abrem os canais
de Na+ em condições que eles estariam normalmente fechados ou inativos (Escoubas et. al.
2000). Em coração de rato, o veneno da Lasiodora causou um aumento na liberação de
acetilcolina na extremidade dos nervos parassimpáticos por ativar canais de Na+ insensíveis a
TTX. O veneno, em uma dose de 100μg, causou bradicardia, distúrbios rítmicos e parada
cardíaca transitória. Kalapothakis e colaboradores (2003) sugeriram então que o veneno de
Lasiodora provavelmente age sobre canais de Na+ insensíveis à TTX já que 200 nM desta substância não foi suficiente para suprimir os efeitos do veneno.
Os canais de Na+ dependentes de prótons são a forma mais simples de canal dependente de
ligante. Eles estão presentes nos neurônios e possuem um papel importante na transdução de
sinal e em patologias como isquemia cerebral ou epilepsia. A toxina peptídica PcTx1, isolada do
veneno bruto da caranguejeira Psalmopoeus cambridgei, exerce um bloqueio seletivo em
1.3.2.3 - Toxinas de aranha e canais de K+
Os canais de K+ são os canais iônicos mais abundantes e ubíquos, e possuem papéis
importantes em neurônios e células musculares. O potássio atua em processos de sinalização,
participa na geração do potencial de membrana, na excitabilidade dos neurônios e na secreção de
neurotransmissores (Beleboni et. al. 2004, Escoubas et. al. 2000).
Até o momento três classes principais de canais de K+ foram identificadas: uma delas inclui
os canais de K+ retificadores do potencial de repouso através de correntes que saem da célula
para o meio externo (outward-rectifier) e, portanto dependentes de voltagem (Kv) e os canais de
K+ ativados por Ca2+ (KCa). Os canais de K+ dependentes de voltagem regulam o potencial de
repouso da membrana, a duração e freqüência do potencial de ação e a secreção de
neurotransmissores. Estes canais são constituídos de tetrâmeros, cada um formado de seis
segmentos transmembrana (Figura 4). A outra classe de canais de K+ é composta pelos
retificadores do potencial de repouso através de correntes que entram na célula (inward-rectifier)
ou Kir. A função destes canais é a estabilização do potencial de repouso da membrana próximo
ao potencial de equilíbrio do K+ (Nichols & Lopatin 1997, Terlau & Stuhmer 1998). Estes canais
são constituídos de tetrâmeros compostos por subunidades que possuem apenas dois segmentos
Figura 4 – Estrutura dos canais de potássio. A - Estrutura aberta e fechada dos poros dos canais de potássio. A região responsável pela seletividade está em laranja, a hélice externa (M1) se encontra adjacente à
bicamada lipídica. A hélice interna (M2) tem o seu resíduo de glicina conservado marcado em vermelho. Este
resíduo é importante para permitir o dobramento da hélice M2 na conformação aberta do poro. B - Estrutura tridimensional de um canal Kv1.2 tetramérico. No centro está a região do poro S5-P-S6 das subunidades 1 e 3.
À esquerda, S1 a S4 da subunidade 4 formando o lado proximal do poro e que se projetam para frente do
plano da figura. Na direita, S1 a S4 da subunidade 2 formam o lado distal do poro e se projetam para trás do
plano da figura. O domínio sensor de voltagem composto pelos segmentos S1 a S4 está posicionado de forma
Uma série de toxinas animais já foi utilizada para elucidar os subtipos, funções e estrutura
dos canais de K+. Dois subtipos de canais outward-rectifier (Kv2 e Kv4) foram caracterizados
graças ao uso de toxinas de aranha (Dolly & Parcej 1996, Kukuljan et. al. 1995). Ao contrário
das toxinas de escorpião, que agem bloqueando o poro do canal, as toxinas de aranha se ligam a
sítios localizados fora do poro do canal para afetar suas propriedades.
Uma acilpoliamina, isolada da aranha Argiope sp., denominada Argiotoxina636 (Arg636),
é um inibidor de canais de K+ dependentes de ligantes e inibe também canais dependentes de
voltagem (Lee et. al. 1999). Hanatoxinas (HaTx 1 e HaTx2) isoladas do veneno da aranha
Grammostola spatulata bloqueiam canais de K+ Kv2.1 alterando a dependência de voltagem do canal (Swartz & MacKinnon 1997). Essa foi a primeira toxina isolada de venenos de aranha que
é ativa em canais de K+ Kv2.1 dependentes de voltagem (Escoubas et. al. 2000). Uma toxina
peptídica denominada stromatoxina (ScTx1) foi isolada por Escoubas e colaboradores (2002) do
veneno da caranguejeira africana Stromatopelma calceata, e foi caracterizada como um potente
inibidor dos canais de K+ dos subtipos Kv4.2 e Kv2.2. Dois inibidores dos canais de K+ foram
isolados do veneno da caranguejeira Heteroscodra maculata. A heteroscodratoxina 1 inibe o
subtipo Kv4 e foi o primeiro peptídeo com ação nos canais Kv4.1. A heteroscodratoxina 2 é
específica para os canais do subtipo Kv2 (Escoubas et. al. 2002).
1.3.2.4 - Toxinas de aranha e receptores de glutamato
O L-glutamato é considerado o neurotransmissor mais importante em sistemas nervoso
central de mamíferos e em sistemas periféricos de insetos (Beleboni et. al. 2004). O glutamato
está envolvido em várias funções importantes do cérebro de mamíferos, como cognição,
memória e aprendizado (Fonnum 1984, Collingridge & Lester 1989).
Os receptores de glutamato estão agrupados em duas classes de acordo com o seu
mecanismo de transdução de sinal, sendo elas: receptores metabotrópicos (mGluRs) e receptores
ionotrópicos (iGluRs) (Ozawa et. al. 1998, Coutinho & Knopfel 2002). Os receptores de
glutamato metabotrópicos utilizam a proteína G para mediar suas funções e são divididos em oito
classes funcionalmente distintas: mGluRs1 a mGluRs8 (Pin & Duvoisin 1995, Conn & Pin
1997). Os receptores de glutamato ionotrópicos utilizam íon para exercer suas funções e são
subdivididos em N-metil-D-aspartato (NMDA), α-amino-3-hidroxi-5-metil-D-aspartato (AMPA
ou receptor quisqualato) e o receptor de kainato. Cada uma dessas proteínas é um canal iônico
kainato tem sido um desafio à parte devido à dificuldade de estudar suas subunidades e à falta de
drogas que o distingam do receptor AMPA (Bear et. al. 1996). Até o momento não foram
relatadas ações de toxinas em receptores metabotrópicos.
A liberação do glutamato envolve a síntese, empacotamento em vesículas sinápticas,
secreção por exocitose e reabsorção do glutamato. Não há evidência de enzimas que degradem
ou inativem o glutamato na fenda sináptica, logo, a única forma de findar a sua ação é através da
reabsorção. O contato prolongado do glutamato com os neurônios resulta em ativação excessiva
dos receptores de glutamato, que estão envolvidos em várias doenças neuro-degenerativas
crônicas, como Alzheimer, Parkinson, isquemia e epilepsia (Reis et. al. 1999). O
desenvolvimento de antagonistas de subtipos específicos de receptores de glutamato pode ser de
grande importância no desenvolvimento de terapia para essas doenças (Beleboni et. al. 2004).
Os venenos das aranhas Argiope trifasciata e Araneus gemma foram caracterizados por
Usherwood e colaboradores, que encontraram substâncias que agem como antagonistas do
receptor de glutamato em junção neuromuscular de gafanhotos. Os resultados encontrados
demonstram que as toxinas só agem quando o receptor do canal de glutamato está ativado por
um agonista (Usherwood et. al. 1984).
Adams e colaboradores (1987) encontraram no veneno da aranha Argiope aurantia uma
mistura de componentes de baixo peso molecular, denominadas argiotoxinas, que bloqueiam a
transmissão neuromuscular causando paralisia reversível em insetos (Adams et. al. 1987). Os
componentes foram identificados como um resíduo de arginina e uma asparagina ligadas a uma
acilpoliamina. Jackson e Parks (1989) demonstraram que acilpoliaminas com aminoácidos em
sua estrutura possuem modo de ação similar em junções neuromusculares de invertebrados,
causando uma inibição não-competitiva dos receptores sensíveis a AMPA. A acilpoliamina
argiotoxina-636 é capaz de bloquear receptores NMDA (Draguhn et. al. 1991). Essa mesma
toxina também bloqueia a abertura dos canais AMPA (Herlitze et. al. 1993).
A toxina peptídica PnTx4(5-5) isolada do veneno da aranha Phoneutria nigriventer inibe
reversivelmente as correntes geradas pelo receptor NMDA em neurônios do hipocampo de
cérebro de ratos. Esta toxina é também tóxica para insetos (De Figueredo et. al. 2001).
Reis et. al. (1999), em um trabalho com a toxina Tx3-4, isolada do veneno da aranha Phoneutria nigriventer, demonstraram que esta toxina progressivamente inibe a liberação de glutamato estimulada por KCl. Os autores também concluíram que esta toxina inibe a liberação
de glutamato independente de Ca2+ e exerce inibição não competitiva na reabsorção de
1.3.3 – Toxinas inseticidas
Após a Segunda Guerra Mundial os principais programas de erradicação de pragas
agrícolas contavam com a utilização de inseticidas químicos. O DDT em especial foi utilizado
tanto em lavouras como em programas bem sucedidos de erradicação da malária (Attaran et. al.
2000). Entretanto, o fato de a maioria destes inseticidas químicos agirem em apenas um, de um
total de quatro alvos do sistema nervoso de insetos – canais de sódio dependentes de voltagem,
receptor nicotínico de acetilcolina, canal dependente de GABA e acetilcolinesterase – facilitou,
por parte das pragas alvo, o desenvolvimento de tolerância sítio específica. Como conseqüência
houve o surgimento de resistência cruzada a vários tipos de inseticidas (Brogdon & MacAllister
1998). Este fato levou os agricultores e outros usuários de inseticidas a aumentar a dosagem
utilizada, agravando os problemas de resistência e agravando os riscos de contaminação
ambiental e de saúde pública. Como resultado, o DDT e outros organoclorados, foram banidos
do uso agrícola nos anos setenta. O desenvolvimento de resistência aos inseticidas pelas pragas
agrícolas, somado à proibição do uso de algumas famílias de inseticidas químicos, aumentou a
necessidade da identificação de novas substâncias eficientes e seguras tanto no combate às
pragas agrícolas como a vetores de doenças (Tedford et. al. 2004).
Os venenos de aranha são misturas complexas especializadas em matar ou paralisar suas
presas. Como a grande maioria das aranhas não apresenta risco ao homem, é grande a
possibilidade da descoberta de componentes nesses venenos com ação específica em insetos
(Tedford et. al. 2004). Dentre os componentes, com possível ação sobre insetos, estão as poliaminas, que são inibidoras pós-sinápticas capazes de bloquear reversivelmente canais de
cálcio, canais sensíveis ao glutamato e canais de músculos locomotores, levando a paralisia
(Atkinson et. al. 1992). Já os polipeptídios constituintes desses venenos agem
pré-sinapticamente, quase sempre de maneira irreversível, induzindo ou inibindo a liberação de
neurotransmissores (Atkinson et. al. 1992).
Uma toxina com atividade inseticida foi isolada do veneno da aranha Segestria florentina e
foi denominada SIT. Esta toxina causou paralisia irreversível em baratas (Periplaneta
americana) (Lipkin et. al. 2002). Figueredo e colaboradores (1995) isolaram uma toxina neurotóxica da fração PhTx4 do veneno da aranha Phoneutria nigriventer, a qual denominaram
Tx4(6-1). Esta toxina é um polipeptídeo de cadeia simples com 48 resíduos de aminoácidos e
apresentou atividade específica para mosca (Musca domestica) e baratas (P. americana).
Toxinas inseticidas ativas em canais de Ca2+ também foram isoladas dos venenos das
(Branton et. al. 1987). Posteriormente, em um trabalho com uma nova toxina chamada PnTx4-3,
isolada da fração PhTx4 do veneno de Phoneutria nigriventer, Oliveira et al (2003) observaram
que esta toxina exercia efeito excitatório imediato quando injetada em tórax de mosca doméstica
(Musca domestica) e barata (Periplaneta americana). A toxina também inibiu de maneira
dose-dependente a reabsorção de glutamato em preparação sinaptosomal de rato.
A principal vantagem no uso de inseticidas biológicos é a capacidade de algumas toxinas
animais serem seletivas entre canais iônicos de insetos ou mamíferos e mesmo entre diferentes
classes de canais iônicos (Karbat et. al. 2004), o que resulta em uma especificidade para a praga
alvo, não atuando em outros insetos polinizadores, bem como em plantas e outros animais
(Bergmann et. al. 2001). Vários peptídeos neurotóxicos com atividade exclusiva em insetos têm
sido estudados a fim de tornar mais claro o modo de ação dessas substâncias, o que possibilitaria
uma melhor avaliação do uso potencial dessas toxinas para o controle de pragas.
1.3.4 - Atividade bactericida de venenos de aranhas
A busca por peptídeos com atividade bactericida em veneno de aranhas tem sido
impulsionada pelo surgimento de bactérias resistentes a antibióticos. O mecanismo de ação
desses peptídeos, mais bem conhecido, é através de sua inserção na membrana celular causando
destruição ou permeabilização da mesma, levando o microrganismo à morte. Alternativamente,
os peptídeos antimicrobianos podem se ligar a um receptor de membrana levando a uma perda
específica de sua função. Além disso, ao se translocarem através da membrana, essas moléculas
com propriedade antibiótica podem atuar intracelularmente, impedindo a síntese de metabólitos
importantes para o microrganismo (Lohner, 2001).
Em 1989, Xu & Qu encontraram um peptídeo antibiótico no veneno da aranha Lycosa
singoriensis. Recentemente, Yan & Adams (1998) descreveram a existência de peptídeos com ação inseticida e bactericida no veneno da aranha Lycosa carolinensis, denominados licotoxinas.
Kuhn-Nentwig et. al. (1998) publicaram a estrutura de um peptídeo com ação inseticida e bactericida, denominado CSTX-4, do veneno da aranha errante Cupiennius salei. Dois anos
depois, Haeberli et. al.. (2000) caracterizaram com maiores detalhes a atividade microbiana dos
peptídeos do veneno desta mesma aranha. Budnik et. al. (2004) encontraram no veneno da
aranha Lycosa singoriensis 3 peptídeos com atividade antimicrobiana aos quais denominaram lycocitina 1, 2 e 3. As lycocitinas 1 e 2 apresentaram estruturas que ainda não haviam sido