UNIVERSIDADE FEDERAL DO CEARÁ
FACULDADE DE FARMÁCIA, ODONTOLOGIA E ENFERMAGEM PROGRAMA DE PÓS-GRADUAÇÃO EM ODONTOLOGIA
JIOVANNE RABELO NERI
EFEITO DO FLAVONÓIDE EPIGALOCATEQUINA-3-GALATO NA RESISTÊNCIA DE UNIÃO DE SISTEMA ADESIVO DE CONDICIONAMENTO TOTAL À
DENTINA
JIOVANNE RABELO NERI
EFEITO DO FLAVONÓIDE EPIGALOCATEQUINA-3-GALATO NA RESISTÊNCIA DE UNIÃO DE SISTEMA ADESIVO DE CONDICIONAMENTO TOTAL À
DENTINA
Dissertação apresentada ao Programa de Pós-Graduação em Odontologia da Faculdade de Farmácia, Odontologia e Enfermagem da Universidade Federal do Ceará, como um dos requisitos para a obtenção do título de Mestre em Odontologia.
Área de Concentração: Clínica Odontológica
Orientador: Prof. Dr. Sérgio Lima Santiago
N445e Neri, Jiovanne Rabelo
Efeito do flavonóide epigalocatequina-3-galato na resistência de união de sistema adesivo de condicionamento total à dentina / Jiovanne Rabelo Neri. – Fortaleza-Ce, 2011. 44f.
Orientador: Prof. Dr. Sérgio Lima Santiago
Dissertação (Mestrado) - Universidade Federal do Ceará. Programa de Pós-Graduação em Odontologia; Fortaleza-Ce, 2011.
1. Adesivos Dentinários 2. Camellia Sinesis 3. Metaloproteinases da Matriz I. Santiago, Sérgio Lima (Orient.) II. Título.
JIOVANNE RABELO NERI
EFEITO DO FLAVONÓIDE EPIGALOCATEQUINA-3-GALATO NA RESISTÊNCIA DE UNIÃO DE SISTEMA ADESIVO DE CONDICIONAMENTO TOTAL À DENTINA
Dissertação apresentada à Coordenação do Programa de Pós-Graduação em Odontologia da Universidade Federal do Ceará como requisito parcial para a obtenção do Título de Mestre em Odontologia. Área de concentração: Clínica Odontológica.
Aprovada em:___/___/___
BANCA EXAMINADORA
_______________________________________________ Prof. Dr. Sérgio Lima Santiago (Orientador)
Universidade Federal do Ceará – UFC
_______________________________________________ Prof. Dr. Vicente de Paulo Aragão Saboia
Universidade Federal do Ceará – UFC
_______________________________________________ Dra. Adriana Pigozzo Manso
AGRADECIMENTOS ESPECIAIS
A Deus, que em todo a sua GLÓRIA nunca me abandonou. Foi minha acolhida nos momentos tempestuosos, a minha fortaleza nas angústias e a paz nas ocasiões de medo. Quem confia em ti não teme as derrotas.
Aos meus irmãos Niskiêr, Eugenie e Pascoal, minhas sobrinhas Isadora, Cecília e Sabrina e meu cunhado Paulo Robson, por todos os ótimos momentos vividos juntos. Esse momento de felicidade também é de vocês. Obrigado, por fazerem parte do meu convívio. Amo todos vocês.
A minha namorada, Eliza, por estar comigo em todos os momentos desta jornada, compartilhando as ansiedades, dúvidas e alegrias, e SEMPRE me apoiando. ADMIRO-TE E TE AMO TODOS OS DIAS.
Ao meu orientador, Prof. Dr. Sérgio Lima Santiago, uma pessoa a qual admiro pela dedicação, inteligência e, principalmente, pela paciência. Que me deu a oportunidade de ingressar no meio científico e assim expandir meus conhecimentos. Fico lisonjeado em tê-lo, hoje, não só como um MESTRE, mas como um AMIGO DE VERDADE. Muitíssimo Obrigado.
Ao Prof. Dr. Vicente de Paulo Aragão Saboia, pelos seus ensinamentos e prestatividade. A principal virtude dos grandes sábios é a SIMPLICIDADE! Obrigado!
Aos meus irmãos INOXIDÁVEIS Yuri, Ricardo, Andrezão, Naninha, Gledson, Therence, Jarlécyo, Kelly e Ilana, por serem assim INOXIDÁVEIS como só vocês são.
AGRADECIMENTOS
À Universidade Federal do Ceará, na pessoa do seu Magnífico Reitor Prof. Dr. Jesualdo Pereira Farias.
À Faculdade de Farmácia, Odontologia e Enfermagem, em nome da Prof. Dra. Neiva Francenely Cunha Vieira.
Aos professores do Programa de Pós-Gradação em Odontologia da Universidade Federal do Ceará, em nome dos Professores Dr. José Jeová Siebra Moreira Neto e Dra. Cristiane de Sá Roriz Fonteles.
Aos meus colegas e “irmãos” de mestrado, Lívia de Oliveira Barros, Márcia Viana Bessa Nogueira, Yuska Nascimento Castelo Branco, João Paulo Veloso Perdigão, Caio Santiago Dutra e Janaína Rocha de Sousa Almeida, por todos os ótimos momentos vividos. É uma honra pra mim, fazer parte de uma turma com tantos expoentes na Odontologia. Sucesso a todos vocês.
Aos colegas doutorandos Vanara Florêncio Passos, Mary Anne Sampaio de Melo, Francisco Cláudio Fernandes Alves e Silva, Rebecca Bastos Araújo Rocha, Juliana Paiva Marques Lima e Fabianni Magalhães Apolonio, pela convivência salutar nos laboratórios da Pós-Graduação e pela oportunidade de realizar trabalhos em conjunto.
Ao Prof. Dr. Alessandro Dourado Loguercio, que gentilmente e pacientemente realizou os procedimentos para obtenção das imagens dos espécimes através de Microscopia Eletrônica de Varredura. Obrigado por tudo!
À Universidade de Granada, em nome do Prof. Dr. Manuel Toledano e Profa. Dra. Raquel Osório, que cedeu suas instalações e equipamentos o que proporcionou a realização desta pesquisa.
RESUMO
O objetivo desse estudo in vitro foi avaliar o efeito do flavonóide epigalocatequina-3-galato (EGCG) na resistência de união à dentina nos períodos imediato e após 6 meses de armazenamento. Trinta terceiros molares humanos recém-extraídos tiveram o esmalte oclusal removidos, obtendo-se uma superfície plana de dentina. Os dentes foram divididos em 5 grupos (n=6) de acordo com a solução de re-hidratação da dentina. As superfícies expostas de dentina foram condicionadas com ácido fosfórico a 35% por 15s, lavadas por 30s, e secas com jatos de ar. Os dentes dos grupos G1, G2, G3, G4 e G5 foram re-hidratados, respectivamente, com água destilada, EGCG a 0,02%, 0,1%, 0,5% e clorexidina a 2%. Cada solução de re-hidratação foi mantida em contato coma superfície dentinária por 60s. O sistema adesivo - Adper Single Bond 2 (3M ESPE) foi aplicado de acordo com a instruções do fabricante. Cinco incrementos de 1 mm de espessura de resina composta foram aplicados e fotoativados individualmente por 20 segundos. Os dentes foram armazenados em água destilada a 37°C por 24h. Em seguida, foram confeccionados cortes seriados perpendiculares entre si, através da interface de união, para obter espécimes em forma de palito com a área de secção transversal de aproximadamente 1 mm2. Metade dos espécimes foi testada imediatamente enquanto a outra metade foi armazenada em solução de azida de sódio a 0,3 mMol/l a 37°C por seis meses. Cada espécime foi tracionado a velocidade de 0,5mm/minuto em uma máquina universal de ensaios. Os valores de resistência de união foram estatisticamente avaliados por ANOVA a dois critérios e Student-Newman-Keuls, com nível de significância de 95%. A média (desvio padrão) dos valores de resistência de união (em MPa) foram os seguintes: No período imediato - G1= 34,17 (7,75); G2= 31,39 (7,82); G3= 34,74 (9,14); G4= 27,11 (7,78); G5= 34,68 (7,30). No período de 6 meses - G1= 27,67 (6,98); G2= 31,75 (10,58); G3= 35,99 (10,91); G4= 31,18 (9,29); G5= 31,62 (5,78). O EGCG a 0,02 % e a 0,1% não afetou a resistência de união, no período imediato (p>0,05). Após 6 meses de armazenamento, o EGCG em diferentes concentrações manteve a resistência de união. EGCG pode ser usado como uma alternativa para melhorar a durabilidade das restaurações adesivas, pois preserva a resistência de união das interfaces.
ABSTRACT
The aim of this in vitro study was to evaluate the effect of epigallocatechin-3-gallate (EGCG) on resin-dentin bond strength in the periods immediately and after 6 months of storage. Thirty human third molars extracted had their occlusal enamel removed, resulting in a flat dentin surface. Teeth were divided into 5 groups (n=6) according to the rewetting solution of dentin. Exposed dentin surfaces were etched with 35% phosphoric acid for 15s, rinsed for 30s, and dried with air jets. Teeth in groups G1, G2, G3, G4 and G5 were rewetted, respectively, with distilled water, EGCG at 0.02%, 0.1% and 0.5%, and 2% chlorhexidine. Each rewetted solution was kept in contact with dentin for 60 seconds. The adhesive system - Adper Single Bond 2 (3M ESPE) was applied according to manufacturer's instructions. Five increments of 1 mm thickness of composite resin were applied individually and light-cured for 20s. The teeth were stored in distilled water at 37 ° C for 24h. The bonded teeth were longitudinally sectioned in both the “x” and “y” directions across the bonded interface to obtain bonded sticks with a cross-sectional area approximately 1.0 mm2. Half of those specimens were immediately tested, while the remaining specimens were stored in sodium azide at 0,3 mMol/l at 37°C for six months. Each specimen was subjected to a tensile strength of the speed of 0.5 mm / minute in a universal testing machine. The values of bond strength were statistically evaluated by testing two-way ANOVA and Student-Newman-Keuls with significance level of 95%. The mean (SD) values of bond strength (MPa) were as follows: In immediate period - G1 = 34.17 (7.75), G2 = 31.39 (7.82), G3 = 34.74 (9.14), G4 = 27.11 (7.78 ) G5 = 34.68 (7.30). In the period of 6 months - G1 = 27.67 (6.98), G2 = 31.75 (10:58), G3 = 35.99 (10.91) G4 = 31.18 (9.29), G5 = 31.62 (5.78).EGCG at 0.02% and 0.1% did not affect the bond strength in the immmediate period (p> 0.5). After 6 months of storage, EGCG at different concentrations maintained the bond strength. EGCG can be used as a tool to improve the durability of adhesive restorations, because it preserves the bond strength of the interfaces.
SUMÁRIO
1. INTRODUÇÃO...12
2. PROPOSIÇÃO...15
2.1 Objetivo Geral...15
2.2 Objetivos Específicos...15
3. CAPÍTULO...16
4. CONCLUSÃO GERAL...32
REFERÊNCIAS...33
APÊNDICES...41
1 INTRODUÇÃO GERAL
A utilização de sistemas adesivos como forma de união efetiva entre os materiais restauradores resinosos e os substratos dentais tem proporcionados grandes avanços à odontologia restauradora (Van Meerbeek et al., 2003; Van Meerbeek et al., 2010). Isto torna possível que dentes cariados ou fraturados possam ser restaurados de forma simples, rápida e com mínima perda de tecidos dentais, obtendo-se restaurações praticamente imperceptíveis (Manhart et al., 2004).
O princípio fundamental da união entre os sistemas adesivos e substratos dentais é baseado na substituição dos materiais inorgânicos do dente por resinas sintéticas (Van Meerbeek et al., 2001). Esse processo ocorre em duas fases: Na primeira, há a remoção do fosfato de cálcio da hidroxiapatita dental, promovendo o aparecimento de microporosidades no esmalte e aumento da embocadura dos túbulos dentinários. A segunda fase envolve a infiltração e posterior polimerização in situ dos monômeros resinosos nos espaços criados na superfície desmineralizada (Van Meerbeek et al., 2003). Entretanto, a união entre os sistemas adesivos à dentina não é tão simples e previsível como observado no esmalte (Perdigão, 2007). Alguns fatores como o alto percentual de água (12%) e elementos orgânicos (18%), presença de túbulos dentinários e variações de tipo e composição da dentina contribuem para essa imprevisibilidade. (Perdigão 2007; Van Meerbeek et al., 2003).
À medida que a dentina é tratada com ácido fosfórico, torna-se menos mineralizada e ocorre a exposição das fibrilas colágenas. Essa rede de colágeno, intrinsecamente úmida, atua como uma barreira à penetração dos adesivos odontológicos fluidos, essencialmente hidrofóbicos (Vaidyanathan & Vaidyanathan, 2009). O uso de sistemas adesivos contendo moléculas bifuncionais, ou seja, grupos hidrofílicos e hidrofóbicos melhoram a infiltração dos monômeros resinosos nas fibras colágenas (Nakabaiashy et al., 1991). Apesar da resistência de união imediata entre os sistemas adesivos atuais e os tecidos dentais ser bastante favorável (Inoue et al., 2001), quando os adesivos são avaliados em relação a sua durabilidade clínica, os resultados são bastante desanimadores (Van Dijken, 2000; Brackett et al., 2002). Sinais clínicos como descoloração marginal, desadaptação marginal e deslocamento de restauração são frequentemente observados (Breschi et al., 2008), demonstrando assim, que o grande problema dos procedimentos adesivos contemporâneos é a sua limitada durabilidade clínica (Van Meerbeek et al., 1998).
heterogêneo e a complexa morfologia dentinária dificultam a difusão dos monômeros resinosos entre os componentes dentinários (Pashley & Carvalho, 1997), o que torna o procedimento adesivo em dentina extremamente instável ao longo do tempo (Lehmann et al., 2009). As áreas incompletamente infiltradas por monômeros resinosos dentro da camada híbrida são susceptíveis à degradação através de dois mecanismos: hidrólise dos seus componentes resinosos e proteólise das fibras colágenas (Hashimoto et al. 2000; Hashimoto et al. 2002; Sano et al., 1999).
A hidrólise é um processo químico que promove a quebra das ligações covalentes entre os polímeros através da adição de água às ligações éster, resultando em uma perda na massa de resina, contribuindo para redução da longevidade da camada híbrida (Tay et al., 2005; Breschi et al., 2008). O processo de simplificação dos adesivos, tentando reduzir o número de passos clínicos, agravou ainda mais o problema da redução da resistência mecânica ao longo do tempo, pois a quantidade de moléculas iônicas e polares hidrofílicas contidas nestes adesivos simplificados é maior, o que acarreta em uma maior absorção de água pela camada híbrida (Vaidyanathan & Vaidyanathan, 2009). Além disso, a presença de monômeros resinosos não polimerizados em contato com fluidos orais também acelera o processo de degradação da camada híbrida (Loguercio et al., 2009). A perda de estabilidade das interfaces de união está diretamente relacionada com a redução da estabilidade dos componentes hidrofílicos que compõem a camada híbrida (Tay et al., 2002; De Munck et al., 2005; Breschi et al., 2010).
O emprego de substâncias com capacidade de inibir a expressão e ação de MMPs associadas ao procedimento adesivo tem se intensificado muito nos últimos anos. O digluconato de clorexidina é o principal inibidor de MMPs estudado na odontologia adesiva e tem apresentado resultados promissores em estudos in vivo e in vitro, confirmando a manutenção da resistência de união ao longo do tempo (Carrilho et. al, 2007; Carrilho et al., 2007; Loguercio 2009; Breschi et al., 2009; Campos et al.,2009; Stanislawczuk et al., 2009). Entretanto, há uma nova tendência na área médica pela pesquisa de inibidores de MMPs à base de substâncias naturais, como alguns polifenóis encontrados em plantas e frutos(Strek et al, 2007; Zhang et al., 2010; Lin et al., 2009; Sem et al., 2009).
O flavonóide epigalocatequina-3-galato (EGCG) é o principal polifenol encontrado no chá verde (Camellia sinesis), e apresenta ação antioxidante, antimicrobiana, antimutagênica, anticancerígena e anti-inflamatória, sendo considerado pouco tóxico, mesmo em altas concentrações (Ostersburg et al., 2009; Isbrucker et al., 2006; Kaneko et al., 2001; Hirasawa & Takada 2003; Rasheed at al., 2009). Além disso, o EGCG possui uma comprovada capacidade de inibir a expressão e a ação das MMP-2 e MMP-9 (Garbisa et al., 2001; Dell'aica et al., 2007; Demeule at al., 2000). A inibição da atividade das MMPs pelo EGCG é dose e tempo dependente, não é competitiva e não envolve quelação com íons metálicos cálcio (Ca2+) e zinco (Zn2+), que são fundamentais para a atividade das MMPs. (Yun et al., 2004; Sem et al., 2009).
2 PROPOSIÇÃO
Os objetivos do presente trabalho foram:
2.1 Objetivo Geral
Analisar o efeito do flavonóide epigalocatequina-3-galato na resistência de união de sistema adesivo de condicionamento total à dentina.
2.2 Objetivos Específicos
• Comparar o efeito de soluções de EGCG de diferentes concentrações (0,02%, 0,1% e 0,5%) na resistência de união à dentina através ensaios de microtração, nos períodos imediato e após 6 meses de armazenamento.
3 CAPÍTULO
Esta dissertação está baseada no Artigo 46 do Regimento Interno do Programa de Pós-Graduação em Odontologia da Universidade Federal do Ceará que regulamenta o formato alternativo para dissertações de Mestrado e teses de Doutorado e permite a inserção de artigos científicos de autoria ou co-autoria do candidato (Anexo A). Por se tratarem de pesquisas envolvendo seres humanos, ou partes deles, o projeto de pesquisa deste trabalho foi submetido à apreciação do Comitê de Ética em Pesquisas da Universidade Federal do Ceará, tendo sido aprovado sob o protocolo COMEPE nº 279/09, conforme o Ofício nº 286/09 de 18 de Setembro de 2009 (Anexo B). Assim sendo, esta dissertação é composta de um capítulo contendo um artigo científico submetido para publicação no periódico “The Journal of Adhesive Dentistry” (Anexo C), conforme descrito abaixo:
Influence of the flavonoid epigallocatechin-3-gallate on the bond strength of adhesive system to dentin.
Influence of the flavonoid epigallocatechin-3-gallate on the bond strength of adhesive system to dentin
Sérgio Lima Santiagoa Jiovanne Rabelo Neria
Carlos Augusto de Oliveira Fernandesa Juliano Sartori Mendonçab
Ricardo Marins de Carvalhoc Raquel Osóriod
Manoel Toledanod
a Department of Restorative Dentistry, Federal University of Ceará, Fortaleza, Ceará, Brazil.
b Department of Dentistry, University of Fortaleza, Fortaleza, Ceará, Brazil.
c Department of Prosthodontics, University of São Paulo, Bauru School of Dentistry.
d Department of Dental Materials, School of Dentistry, University of Granada, Spain.
Correspondence:
Dr. Sérgio Lima Santiago
Rua Monsenhor Furtado
S/Nº. CEP 60430-350
Fortaleza, CE
Brazil
ABSTRACT
Purpose: The aim of this in vitro study was to evaluate the effect of EGCG on resin-dentin bond strength, immediately and after 6 months of specimen preparation.
Materials and Methods: Thirty third molars were divided into 5 groups according to the rewetting solution. The dentin surfaces were etched with 35% phosphoric acid for 15 s, rinsed for 30 s with distilled water, and dried with air. The teeth in G1, G2, G3, G4 and G5 were rewetted with 5 µ L of distilled water, EGCG at 0.02%, 0.1% and 0.5%, and 2% chlorhexidine respectively. Solutions were remained in contact for 60 s. The adhesive system Adper Single Bond 2 was applied according to manufacturer's instructions. Five increments of 1 mm-thick of composite resin were build-up. Teeth were stored in distilled water for 24 h. The bonded teeth were longitudinally sectioned to obtain bonded sticks with a cross-sectional area approximately 1.0 mm2. Half of those specimens were immediately tested, while the remaining specimens were stored for six months. Bonded sticks were subjected to a tensile force of 0.5mm/minute. MTBS values were statistically analyzed with ANOVA and Student– Newman–Keuls test. Statistical significance was set at p< 0.05.
Results: EGCG at 0.02% and 0.1% did not affect the in vitro immediate bond strength tested (p>0.05). After six-month storage, EGCG in the different concentrations resulted in stable resin-dentin.
Conclusion: EGCG can be a useful tool for improve the durability of adhesive restorations since preserves the resin-dentin bonds.
INTRODUCTION
The major shortcoming of contemporary adhesive restoratives is their limited durability. The loss of bond strength has been attributed mainly to the degradation of the hybrid layer at the dentin-adhesive interface6,7,12. This decline is the result of hydrolytic degradation of the resin and proteolysis of the collagen fibrils13,17,26.
MMPs are a class of zinc- and calcium-dependent endopeptidases34 that are trapped within the mineralized dentin matrix during tooth development32,33. The release and the subsequent activation of these endogenous enzymes during dentin bonding procedures25,28,31 are thought to be responsible for the in vitro manifestation of thinning and disappearance of collagen fibrils from incompletely infiltrated hybrid layers in aged, bonded dentin 1,2. It has been recently demonstrated that MMP-2 and MMP-9 are present in dentin, and likely to be largely involved in this degradation process in dentin13,17,22.
The epigallocatechin-3-gallate (EGCG) is the main polyphenol found in green tea (Camellia sinesis), comprising up to 65% of the total catechin, and has several qualities, among them the proven ability to inhibit the expression and action of MMP-2 and MMP-99,15. Inhibition of the activity of MMPs by EGCG is noncompetitive, since there is no interaction with the metal ions, which are critical for the activity of MMPs. Moreover, the inhibitory effect is dose and time dependent30. However, little is known about the use of EGCG as MMP-inhibiting potential in resin-dentin bonding.
The aim of this study was to evaluate the effect of EGCG on resin-dentin bond strength. It was hypothesized that all the concentrations of EGCG would be sufficient to prevent reductions in resin-dentin bond strength after 6 months of storage.
MATERIALS AND METHODS
Tooth Preparation
dentin surface. Additionally, the dentin surface was prepared with a #500-grit SiC paper for 60 seconds to create a uniform smear layer in all teeth.
Microtensile Bond Strength Test (µTBS)
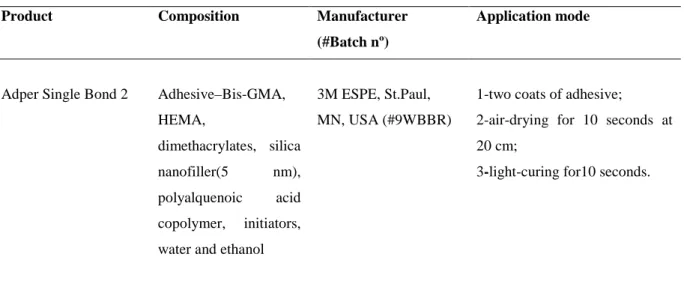
Teeth were divided into 5 groups (n=6) according to the rewetting solution. The exposed dentin surfaces were etched with 35% phosphoric acid gel (3M ESPE, St. Paul, MN, USA - batch #9KN) for 15 s, rinsed for 30 s with distilled water, and vigorously dried with oil-/water-free air. Six teeth were rewetted with 5 µ L of distilled water (control G1), aqueous solution of the EGCG (Sigma-Aldrich, Saint Louis, USA - batch #108K 1564) at 0.02% (G2), 0.1% (G3) and 0.5% (G4), and 2% chlorhexidine digluconate (CHX) (G5) (FGM, Joinville, SC, Brazil - batch #031109).
Each rewetteing solution was left in contact with surface for a period of 60 s, and excess was removed with absorbent paper leaving the dentin surface visibly moist. The ecth-and-rinse adhesive system - Adper Single Bond 2 (3M ESPE, St. Paul, MN, USA) - was applied according to manufacturer's instructions (Table 1). After light-curing of the adhesive system, five increments of 1 mm-thick of composite resin were build-up (Filtek Z250; 3M ESPE, St. Paul, MN, USA - batch #N111777). Each increment was light-cured with a halogen light-curing unit (Bluephase; Ivoclar Vivadent, Schaan, Liechtenstein) for 20s, with power density of 600 mW/cm2. The bonded teeth were stored in distilled water at 37°C for 24 h.
After storage, the bonded teeth were longitudinally sectioned in both the “x” and “y” directions across the bonded interface using a diamond saw in a Accutom-50 machine (Struers, Copenhagen, Denmark) under water cooling to obtain bonded sticks with a cross-sectional area approximately 1.0 mm2. The cross-sectional area of each stick was measured with the digital caliper to the nearest 0.01 mm and recorded for subsequent calculation of the microtensile bond strength (Absolute Digimatic, Mitutoyo, Tokyo, Japan).
Evaluation of fracture modes / Scanning Electron Microscopy
The failure modes were evaluated at 60x (StereoZoom® Leica S8 APO, Leica Microsystems, Wetzlar, Germany) and classified as: 1) adhesive failure, if the fracture site was located entirely between the adhesive and dentin (A); 2) mixed failure (M); 3) cohesive failure in resin (CR); 4) cohesive failure in dentin (CD). Ten percent of fractured specimens of each group were dried at room temperature for 24h in desiccators, and sputter-coated with gold (Sputter Coater IC 50; Shimadzu, Tokyo, Japan). Dentin surfaces of each fracture site were observed under a scanning electron microscope (SSX-550; Shimadzu, Tokyo, Japan) with 60x and 500x magnification at 15 kV.
Statistical Analysis
MTBS values were statistically analyzed with two-way ANOVA (treatments and storage), Student–Newman–Keuls test was used for post hoc comparisons. Statistical significance was set at p< 0.05. The number of prematurely debonded specimens per each tested group was also recorded but not included in the statistical.
RESULTS
EGCG at 0.02% and 0.1% did not affect the in vitro immediate bond strength tested right after the beams preparation to serve as baseline results (p>0.05). Six-month storage resulted in significant reductions in resin–dentin bond-strength values for control group rewetted with distilled water (p<0.05). By contrast, rewetting with EGCG in the different concentrations and 2% chlorexidine digluconate resulted in stable resin-dentin bonds after 6 months of storage. However, only group rewetted with EGCG 0.1% obtained resin-dentin bond-strength values significantly higher than control group, in 6-month period (p<0.05) (Table 2).
chlorexidine group (Table 3). In six month period, adhesive failures were more prevalent than cohesive failures (resin and dentin) for specimens of all groups, with exception for 2% chlorexidine group (Table 3).
DISCUSSION
The decrease of bond strength resin-dentin interfaces bonded with two steps etch-and-rinse adhesive system after short periods of time, reported by several researches3,11,13,20,21, was confirmed by results of this study. The bond degradation can be generally attributed to two mechanisms: hydrolytic degradation of the bonding resin within the hybrid layer and hydrolytic degradation of the collagen matrix17,18,29. Action of the endogenous enzymes known as matrix metalloproteinases (MMPs), mainly MMP-2 and MMP-9, activated by adhesive procedures, degrade the incompletely resin-infiltrated collagen fibrils and the hybrid layer12,28. Mazonni et al.22 suggested that the inhibition of MMP-2 and -9 proteolytic activity increase the durability of resin-dentin bonds. Therefore, the research and use of substances that may inhibit the action of the MMPs in the degradation of collagen exposed and not involved by resin monomers is beneficial for the preservation of the hybrid layer and increase of the durability of restorations that involve dentin bonding.
Chlorexidine (CHX) is an excellent inhibitor of activity of MMP-2, -8 and -9. Gendron et al.16 proposed two different mechanisms of action of CHX: a chelating mechanism for the inhibition of MMP-2 and MMP-9; and the interaction with the essential sulfhydryl groups and/or cysteine present in MMP-active sites in the case of MMP-8. Use of CHX at 2% as dentin pretreatment associated with etch-and-rinse adhesive systems was first described by Carrilho et al.6,7 and resulted in significantly less reduction in bond strength over time in comparison with non-treated specimens. These findings are confirmed by the results of this study (Table 3). New studies showed that stable bonds were maintained for up to 6 months after the use of other concentrations of CHX (0.002, 0.02, 0.2 and 4%)3,4,21 and different application time (15 s and 60 s)21. Loguercio et al.21 proposed the use of 0.002% chlorhexidine for 15 s seems to be sufficient to preserve resin-dentin interfaces over a 6-month period.
instrumental to angiogenesis, then perhaps the effect described could be attributed to inhibition of the MMPs by the EGCG5. Garbisa et al14,15 demonstrated in their studies through zymography, Western blotting, that EGCG was a strong inhibitor of the gelatinolytic activities of human MMP-2 and MMP-9, and differs from other MMP-inhibitors being a natural product, extracted from green tea (camellia sinesis).
Very little is known about the molecular mechanisms by which EGCG blocks gelatinolytic activities. It has been suggested that the inhibition of gelatinases by EGCG is due to zinc chelation22; polyphenols do, in fact, have high complexation affinity to metal ions, and zinc is essential for enzymatic activity24. However, Garbisa et al.15 suggest that chelation between EGCG and metal ions is unlikely. There appear to be two possible explanations for the reduction of the gelatinolytic activity of EGCG-pretreated MMP-2 in gelatin zymography: EGCG led to the irreversible degradation of the 2 molecule, or EGCG bound to MMP-2, leading to reversible conformational changes in MMP-2 molecules or to masking the catalytic region of MMP-2, either of which may be essential for proteolytic activity8. MMP inhibition exerted by EGCG is noncompetitive, is time-dependent and dose-dependent. The lowest registered values of IC50 were 8 µM and 13 µM for MMP-2 and MMP-9, respectively 15, 30
.
The use of EGCG as dentin pretreatment may also be indicated to perform cleaning cavity because it is an effective antimicrobial agent against a variety of pathogenic microorganisms27. Another possible advantage of EGCG is that it could be used in cavities of any depth, even in deep cavities and risk pulp micro-exposure, because it is low toxic, even at high concentrations and has anti-inflammatory effect19. These data encourage the introduction of EGCG in dental practice, since that low concentrations of EGCG were also sufficient to promote the maintenance of bond strength after 6 months of storage (Table 2 and Table 3). However, further studies should be conducted to assess whether variations in the composition of total etch adhesives can interfere with the action of EGCG. Another aspect that can be studied to evaluate the effect of EGCG on the one-step and two-steps self-etching adhesives and variations of time of application.
CONCLUSION
The application of EGCG for 60s as rewetting solution prior bonding procedures on two-step etch-and-rinse adhesives may preserve resin-dentin bond-strength over time.
Clinical Relevance:
EGCG can be a useful tool for improve the durability of adhesive restorations since preserves the resin-dentin bonds.
ACKNOWLEDGEMENTS
REFERENCES
1. Armstrong SR, Vargas MA, Chung I, Pashley DH, Campbell JA, Laffoon JE, Qian F. Resin-dentin interfacial ultrastructure and microtensile Resin-dentin bond strength after five-year water storage. Oper Dent 2004;29:705-712.
2. Brackett WW, Ito S, Tay FR, Haisch LD, Pashley DH. Microtensile dentin bond strength of self-etching resins: effect of a hydrophobic layer. Oper Dent 2005;30:733-738.
3. Breschi L, Cammelli F, Visintini E, Mazzoni A, Vita F, Carrilho M, Cadenaro M, Foulger S, Mazzoti G, Tay FR, Lenarda R, Pashley D. Influence of chlorhexidine concentration on the durability of etch-and-rinse dentin bonds: A 12-month in vitro study. J Adhes Dent 2009;11:191-198.
4. Campos EA, Correr GM, Leonardi DP, Barato-Filho F, Gonzaga CC, Zielak JC. Chlorhexidine diminishes the loss of bond strength over time under simulated pulpal pressure and thermo-mechanical stressing. J Dent 2009;37:108 -114.
5. Cao Y, Cao R. Angiogenesis inhibited by drinking tea. Nature 1999;398:381.
6. Carrilho MRO, Carvalho RM, de Goes MF, di Hipolito V, Geraldeli S, Tay FR, Pashley DH, Tjaderhane L. Chlorhexidine preserves dentin bond in vitro. J Dent Res 2007;86:90-94.
7. Carrilho MRO, Geraldeli S, Tay FR, de Goes M, Carvalho RM, Tjaderhane L, Reis AF, Hebling J, Mazzoni A, Breschi L, Pashley DH. In Vivo Preservation of the hybrid layer by chlorhexidine. J Dent Res 2007,86:529-533.
9. Dell'aica I, Caniato R, Biggin S, Garbisa S. Matrix proteases, green tea, and St. John's wort: Biomedical research catches up with folk medicine. Clin Chem Acta 2007;38:69-77.
10.Demeule M, Brossard M, Page M, Gingras D, Be¨liveau R. Matrix metalloproteinase inhibition by green tea catechins. Bio et Biophysica Acta 2000;1478:51-60.
11.De Munck J, Shirai K, Yoshida Y, Inoue S, Van Landuyt K, Lambrechts P, Suzuki K, Shintani H, Van Meerbeek B. Effect of water storage on the bonding effectiveness of 6 adhesives to Class I cavity dentin. Oper Dent 2006;31:456-65.
12.De Munck J, Van den Steen PE, Mine A, Van Landuyt KL, Poitevin A, Opdenakker G , Van Meerbeek B. Inhibition of Enzymatic Degradation of Adhesive-Dentin Interfaces. J Dent Res 2009, 88: 1101-1106.
13.De Munck J, Van Meerbeek B, Yoshida Y, Inoue S, Vargas M, Suzuki K, Lambrechts P, Vanherle G. Four-year water degradation of total-etch adhesives bonded to dentin. J Den Res 2003;82:136-140.
14.Garbisa S, Biggin S, Cavallarin N, Sartor L, Benelli R, Albini A. Tumor invasion: molecular shears blunted by green tea. Nature Med 1999;5:1216.
15.Garbisa S, Sartor L, Biggin, S.; Salvato, B.; Benelli, R.; Albini, A. Tumor gelatinases and invasion inhibited by the green tea flavanol epigallocatechin-3-gallate. Cancer 2001; 91:822-832.
16.Gendron R, Greiner D, Sorsa T, Mayrand D. Inhibition of the activities of matrix metalloproteinases 2, 8, and 9 by chlorhexidine. Clin Diagn Lab Immunol 1999;6:437-439.
18.Hashimoto M, Ohno H, Sano H, Tay FR, Kaga M, Kudo Y, Oguchi H, Araki Y, Kubota M. Micromorphological changes in resin-dentin bonds after 1 year of water storage. J Biomed Mater Res 2002;63:306-311.
19.Isbrucker RA, Bausch J, Edwards JA, Wolz E. Safety studies on epigallocatechin gallate (EGCG) preparations. Part 1: genotoxicity. Food Chem Toxicol 2006;44:626-635.
20.Koshiro K, Inoue S, Sano H, De Munck J, Van Meerbeek B. In vivo degradation of resin– dentin bonds produced by a self-etch and an etch-and-rinse adhesive. Eur J Oral Sci 2005;113:341-348.
21.Loguercio AD, Stanislawczuk R, Polli LG, Costa JA, Michel MD, Reis A. Influence of chlorhexidine digluconate concentration and application time on resin–dentin bond strength durability. Eur J Oral Sci 2009;117:587-596.
22.Maeda-Yamamoto M, Kawahara H, Tahara N, Tsuji K, Hara Y, Isemura M. Effects of tea polyphenols on the invasion and matrix metalloproteinases activities of human fibrosarcoma HT1080 cells. J Agric Food Chem 1999;47:2350-2354.
23.Mazzoni A, Mannello F, Tay FR, Tonti G, Papa S, Mazzotti G, Di Lenarda R, Pashley DH, Breschi L. Zymographic analysis and characterization of MMP-2 and -9 isoforms in human sound dentin. J Dent Res 2007;86:436-440.
24.Morgunova E, Tuuttila A, Bergmann U, Isupov M, Lindqvist Y, Schneider G, et al. Structure of human pro-matrix metalloproteinase- 2: activation mechanism revealed. Science 1999;284:1667-70.
25.Nishitani Y, Yoshiyama M, Wadgaonkar B, Breschi L, Mannello F, Mazzoni A, Carvalho RM, Tjaderhane L, Tay FR, Pashley DH. Activation of gelatinolytic/ collagenolytic activity in dentin by self-etching adhesives. Eur J Oral Sci 2006;114:160-166.
27.Osterburg A, Gardner J, Hyon SH, Neely A, Babcock G. Highly antibiotic-resistant Acinetobacter baumannii clinical isolates are killed by the green tea polyphenol (–)-epigallocatechin-3-gallate (EGCG). Clin Microbiol Infect 2009;15: 341-346.
28.Pashley DH, Tay FR, Yiu CKY, Hashimoto M, Breschi L, Carvalho R, Ito S. Collagen degradation by host-derived enzymes during aging. J Dent Res 2004;83:216-221.
29.Sano H, Yoshikawa T, Pereira PNR, Kanemura N, Morigami M, Tagami J, Pashley DH. Long-term durability of dentin bonds made with a self-etching primer, in vivo. J Dent Res 1999;78:906-911.
30.Sen T, Moulik S, Dutta A, Choudhury PR, Banerji A, Das S, Roy M, Chatterjee A. Multifunctional effect of epigallocatechin-3-gallate (EGCG) in downregulation of gelatinase-A (MMP-2) in human breast cancer cell line MCF-7. Life Sci 2009; 84: 194-204.
31.Tay FR, Pashley DH, Loushine RJ, Weller RN, Monticelli F, Osorio R. Self-Etching adhesives increase collagenolytic activity in radicular dentin. J Endod 2006;32: 862-868.
32.Tjaderhane L, Larjava H, Sorsa T, Uitto VJ, Larmas M, Salo T. The activation and function of host matrix metalloproteinase in dentin matrix during breakdown in carious lesions. J Dent Res 1998;77:1622-1629.
33.Van Strijp AJ, Jansen DC, Degroot J, ten Cate JM, Everts V. Host-derived proteinases and degradation of dentine collagen in situ. Caries Research 2003; 37: 58-65.
TABLES
Table 1 – Tested bonding agent and used bonding procedures
Product Composition Manufacturer
(#Batch nº)
Application mode
Adper Single Bond 2 Adhesive–Bis-GMA,
HEMA,
dimethacrylates, silica
nanofiller(5 nm),
polyalquenoic acid
copolymer, initiators,
water and ethanol
3M ESPE, St.Paul,
MN, USA (#9WBBR)
1-two coats of adhesive;
2-air-drying for 10 seconds at
20 cm;
3-light-curing for10 seconds.
Bis-GMA: bisphenol A diglycidyl methacrylate, HEMA: 2-hydroxyethyl methacrylate
Table 2 – Overall microtensile bond strength values, the respective standard deviations (MPa) and number of specimens tested in each experimental condition, as well as, statistical significance*.
Groups Adper Single Bond 2
Immediate 6 months
G1 – EGCG 0 % 34.17 ± 7.75 (26) A, a 27.67 ± 6.98 (23) B, b
G2 – EGCG 0.02% 31.39 ± 7.82 (21) AB, a 31.75 ± 10.58 (26) AB,a
G3 – EGCG 0.1% 34.74 ± 9.14 (24) A, a 35.99 ± 10.91 (28) A, a
G4 – EGCG 0.5% 27.11 ± 7.78 (16) B, a 31.18 ± 9.29 (21) ABa
G5 – CHX 2% 34.68 ± 7.30 (27) A,a 31.62 ± 5.78 (15) AB,a
*Different superscript upper case letters in column and different superscript lower case letters in row indicate
Table 3 – Number and percentage of specimens (%) according to fracture pattern mode and the premature debonded specimens from each experimental condition*.
Groups
Adper Single Bond 2
Immediate 6 months
A M CR CD D A M CR CD D
G1 1
(3.4) 25 (86.3) 2 (6.9) 1 (3.4) 0 (0) 4 (14.3) 19 (67.9) 3 (10.7) 0 (0) 2 (7.1)
G2 2
(8.3) 19 (79.2) 2 (8.3) 1 (4.2) 0 (0) 5 (16.1) 21 (67.8) 3 (9.7) 1 (3.2) 1 (3.2)
G3 2
(6.2) 22 (68.8) 4 (12.5) 4 (12.5) 0 (0) 5 (15.7) 23 (71.9) 1 (3.1) 2 (6.2) 1 (3.1)
G4 1
(4.0) 15 (60.0) 4 (25.0) 1 (4.0) 4 (25.0) 6 (23.1) 15 (57.7) 2 (7.7) 1 (3.8) 2 (7.7)
G5 7
(20.6) 20 (58.9) 4 (11.7) 2 (5.9) 1 (2.9) 2 (9.1) 13 (59,1) 4 (18.2) 2 (9.1) 1 (4.5)
A: adhesive failure; M: mixed failure; CR: cohesive failure in resin; CD: cohesive failure in dentin; D:
FIGURES
Figure 1. Representative scanning electron micrographs (SEM) of the dentin side of fractured specimens in
different groups, in immediate period, demonstrating mixed failures of specimens. Micrographs with lower
magnification (60x) (a - e). Micrographs with higher magnification (500x) of the areas limited by rectangle (a -
e’). A = adhesive system; BHL = bottom of hybrid layer; THL = top of hybrid layer; RC = resin composite;
asterisk = dentinal tubules.
Figure 2. Representative scanning electron micrographs (SEM) of the dentin side of fractured specimens in
different groups, in 6 months period, demonstrating mixed failures of specimens. Micrographs with lower
magnification (60x) (a - e). Micrographs with higher magnification (500x) of the areas limited by rectangle (a -
e’). A = adhesive system; BHL = bottom of hybrid layer; THL = top of hybrid layer; RC = resin composite;
4 CONCLUSÃO GERAL
Da avaliação dos resultados obtidos, pode-se concluir que:
• O EGCG a 0,02 % e 0,1% não interfere na resistência de união de sistema adesivo de condicionamento total à dentina no período imediato.
• Todas as concentrações de EGCG (0,02%, 0,1% e 0,5%) utilizadas foram eficientes em manter a resistência de união à dentina após 6 meses de armazenamento.
REFERÊNCIAS
ARMSTRONG, S. R.; VARGAS, M. A.; CHUNG, I.; PASHLEY, D. H.; CAMPBELL, J. A.; LAFFOON, J. E.; QIAN, F. Resin-dentin interfacial ultrastructure and microtensile dentin bond strength after five-year water storage. Operative Dentistry, v. 29,n. 6, p.705-712, 2004.
BRACKETT, W. W.; COVEY, D. A.; ST-GERMAIN, H. A. JR. One-year clinical performance of a self-etching adhesive in class V resin composites cured by two methods. Operative Dentistry, v. 27, n. 3, p. 218-222, 2002.
BRACKETT, W. W.; ITO, S.; TAY, F. R.; HAISCH, L. D.; PASHLEY, D. H. Microtensile dentin bond strength of self-etching resins: effect of a hydrophobic layer. Operative Dentistry, v. 30, n. 6, p. 733-738, 2005.
BRESCHI, L.; CAMMELLI, F.; VISINTINI, E.; MAZZONI, A.; VITA, F.; CARRILHO, M.; CADENARO, M.; FOULGER, S.; MAZZOTI, G.; TAY, F. R.; LENARDA, R.; PASHLEY, D. Influence of chlorhexidine concentration on the durability of etch-and-rinse dentin bonds: A 12-month in vitro study. The Journal of Adhesive Dentistry, v. 11, n. 3, p. 191-198, 2009.
BRESCHI, L.; MARTIN, P.; MAZZONI, A.; NETO, F.; CARRILHO, M.; TJÄDERHANE, L.; VISINTINI, E.; CADENARO, M.; TAY, F. R.; DORIGO, E.; PASHLEY, D. Use of a specific MMP-inhibirot (Galardin) for preservation of hybrid layer. Dental Materials, v. 26 n. 6, p. 571-578, 2010.
BRESCHI, L.; MAZZONI, A.; RUGGER, A.; CADENARO, M.; DI LENARDA, R.; DE STEFANO DORIGO, E. Dental adhesion review: Aging and stability of the bonded interface. Dental Materials, v. 24, n. 1, p. 90-101, 2008.
CAO, Y.; CAO, R. Angiogenesis inhibited by drinking tea. Nature, v. 398, n. 6726, p. 381, 1999.
CARRILHO, M. R.O.; CARVALHO, R. M.; DE GOES. M. F.; DI HIPOLITO, V.; GERALDELI, S.; TAY, F. R.; PASHLEY, D. H.; TJADERHANE, L. Chlorhexidine preserves dentin bond in vitro. Journal of Dental Research, v. 86, n. 1, p. 90-94, 2007.
CARRILHO, M. R. O.; GERALDELI, S.; TAY, F. R.; DE GOES, M.; CARVALHO, R. M.; TJADERHANE, L.; REIS, A. F.; HEBLING, J.; MAZZONI, A.; BRESCHI, L.; PASHLEY, D. H. In Vivo Preservation of the hybrid layer by chlorhexidine. Journal of Dental Research, v. 86, n. 6, p. 529-533, 2007.
CHAUSSAIN-MILLER, C.; FIORETTI, F.; GOLDBERG, M.; MENASHI, S. The role of matrix metalloproteinases (MMPs) in human. Journal of Dental Research, v. 85, n. 1, p. 22-32, 2006.
CHENG, X. W.; KUZUYA, M.; KANDA, S.; MAEDA, K.; SASAKI, T.; WANG, Q. L.; TAMAYA-MORI, N.; SHIBATA, T.; IGUCHI, A. Epigallocatechin-3-gallate binding to MMP-2 inhibits gelatinolytic activity without influencing the attachment to extracellular matrix proteins but enhances MMP-2 binding to TIMP-2. Archives Biochemistry and Biophysics, v. 415, n. 1, p. 126-132, 2003.
DELL'AICA, I.; CANIATO, R.; BIGGIN, S.; GARBISA, S. Matrix proteases, green tea, and St. John's wort: Biomedical research catches up with folk medicine. Clinical Chimica Acta, v. 381, n. 1, p. 69-77, 2007.
DEMEULE, M.; BROSSARD, M.; PAGE, M.; GINGRAS, D.; BE¨LIVEAU, R. Matrix metalloproteinase inhibition by green tea catechins. Biochimica et Biophysica Acta, v. 1478, n. 1, p. 51-60, 2000.
DE MUNCK, J.; VAN DEN STEEN, P. E.; MINE, A.; VAN LANDUYT, K. L.; POITEVIN, A.; OPDENAKKER, G.; VAN MEERBEEK, B. Inhibition of Enzymatic Degradation of Adhesive-Dentin Interfaces. Journal of Dental Research, v. 88, n. 12, p. 1101-1106, 2009.
DE MUNCK, J.; VAN LANDUYT, K.; PEUMANS, M.; POITEVIN, A.; LAMBRECHTS, P.; BRAEM, M.; VAN MEERBEEK, B. A critical review of the durability of adhesion to tooth tissue: methods and results. Journal of Dental Research, v. 84, n. 2, p. 118-132, 2005.
DE MUNCK, J.; VAN MEERBEEK, B.; YOSHIDA, Y.; INOUE, S.; VARGAS, M.; SUZUKI, K.; LAMBRECHTS, P.; VANHERLE, G. Four-year water degradation of total-etch adhesives bonded to dentin. Journal of Dental Research, v. 82, n. 2, p. 136-140, 2003.
GARBISA, S.; BIGGIN, S.; CAVALLARIN, N.; SARTOR, L.; BENELLI, R.; ALBINI, A. Tumor invasion: molecular shears blunted by green tea. Nature Medicine, v. 5, n. 11, p. 1216, 1999.
GARBISA, S,; SARTOR, L.; BIGGI, S.; SALVATO, B.; BENELLI, R.; ALBINI, A. Tumor gelatinases and invasion inhibited by the green tea flavanol epigallocatechin-3-gallate. Cancer, v. 91, n. 4, p. 822-832, 2001.
GENDRON, R.; GREINER, D.; SORSA, T.; MAYRAND, D. Inhibition of the activities of matrix metalloproteinases 2, 8, and 9 by chlorhexidine. Clinical and Diagnostic Laboratory Immunology, v. 6, n. 3, p. 437-439, 1999.
HANNAS, A. R.; PEREIRA, J. C.; GRANJEIRO, J. M.; TJADERHANE, L. The role of matrix metalloproteinases in the oral environment. Acta Odontologica Scandinavica, v. 55, n. 1, p. 1-13, 2007.
HASHIMOTO, M.; OHNO, H.; SANO, H.; TAY, F. R.; KAGA, M.; KUDO, Y.; OGUCHI, H.; ARAKI, Y.; KUBOTA, M. Micromorphological changes in resin-dentin bonds after 1 year of water storage. Journal of Biomedical Materials Research, v. 63, n. 3, p. 306-311, 2002.
HIRASAWA, M.; TAKADA, K. Multiple effects of green tea catechin on the antifungal activity of antimycotics against Candida albicans. Journal of Antimicrobial Chemotherapy, v. 53, n. 2, p. 225-229, 2003.
INOUE, S.; VARGAS, M. A.; ABE, Y.; YOSHIDA, Y.; LAMBRECHTS, P.; VANHERLE, G.; SANO, H.; VAN MEERBEEK, B. Microtensile bond strength of eleven modern adhesives to dentin. The Journal of Adhesive Dentistry, v. 3, n. 3, p. 237-246, 2001.
ISBRUCKER, R. A.; BAUSCH, J.; EDWARDS, J. A.; WOLZ, E. Safety studies on epigallocatechin gallate (EGCG) preparations. Part 1: genotoxicity. Food Chemical Toxicology, v. 44, n. 5, p. 626-635, 2006.
KANEKO, T.; BABA, N.; MATSUO, M. Structure-activity relationship of antioxidants for inhibitors of linoleic acid hydroperoxide-induced toxicity in cultured human umbilical vein endothelial cells. Cytotechnology, v. 35, n. 1, 43-55, 2001.
KOSHIRO, K.; INOUE, S.; SANO, H., DE MUNCK, J.; VAN MEERBEEK, B. In vivo degradation of resin–dentin bonds produced by a self-etch and an etch-and-rinse adhesive. European Journal of Oral Sciences, v. 113, n. 4, p. 341-348, 2005.
LEHMANN, N.; DEBRET, R.; ROMÉAS, A.; MAGLOIRE, H.; DEGRANGE, M.; BLEICHER, F.; SOMMER, P.; SEUX, D. Self-etching increases matrix metalloproteinase expression in the dentin-pulp complex. Journal of Dental Research, v. 88, n. 1, p. 77-82, 2009.
LOGUERCIO, A. D.; STANISLAWCZUK, R.; POLLI, L. G.; COSTA, J. A.; MICHEL, M. D.; REIS, A. Influence of chlorhexidine digluconate concentration and application time on resin– dentin bond strength durability. European Journal of Oral Sciences, v. 117, n. 5, p. 587-596, 2009.
MAEDA-YAMAMOTO, M.; KAWAHARA, H.; TAHARA, N.; TSUJI, K.; HARA, Y.; ISEMURA, M. Effects of tea polyphenols on the invasion and matrix metalloproteinases activities of human fibrosarcoma HT1080 cells. Journal of Agricultural and Food Chemistry, v. 47, n. 6, p. 2350-2354, 1999.
MANHART, J.; CHEN, H.; HAMM, G.; HICKEL, R. Buonocore memorial lecture. Review of the clinical survival of direct and indirect restorations in posterior teeth of the permanent dentition. Operative Dentistry, v. 29, n. 5, p. 481-508, 2004.
MAZZONI, A.; MANNELLO, F.; TAY, F. R.; TONTI, G.; PAPA, S.; MAZZOTTI, G.; DI LENARDA, R.; PASHLEY, D. H.; BRESCHI, L. Zymographic analysis and characterization of MMP-2 and -9 isoforms in human sound dentin. Journal of Dental Research, v. 86, n. 5, p. 436-440, 2007.
MORGUNOVA, E.; TUUTTILA, A.; BERGMANN, U.; ISUPOV, M.; LINDQVIST, Y.; SCHNEIDER, G.; TRYGGVASON, K. Structure of human pro-matrix metalloproteinase- 2: activation mechanism revealed. Science, v. 284, n. 5420, p. 1667-1670, 1999.
NAKABAYASHI, N.; NAKAMURA, M.; YASUDA, N. Hybrid layer as a dentin-bonding
mechanism. Journal of Esthetic Dentistry, v. 3, n. 4, p. 133-138, 1991.
NISHITANI, Y.; YOSHIYAMA, M.; WADGAONKAR, B.; BRESCHI, L.; MANNELLO, F.; MAZZONI, A.; CARVALHO, R. M.; TJADERHANE, L.; TAY, F. R.; PASHLEY, D. H. Activation of gelatinolytic/ collagenolytic activity in dentin by self-etching adhesives. European Journal of Oral Sciences, v. 114, n. 2, p. 160-166, 2006.
OSTERBURG, A.; GARDNER, J.; HYON, S. H.; NEELY, A.; BABCOCK, G. Highly antibiotic-resistant Acinetobacter baumannii clinical isolates are killed by the green tea polyphenol (–)-epigallocatechin-3-gallate (EGCG). Clinical Microbiology and Infection, v. 13, n. 4, p. 341-346, 2009.
PASHLEY, D. H.; CARVALHO, R. M. Dentine permeability and dentine adhesive. Journal of Dentistry, v. 25, n. 5, p. 355-372, 1997.
PASHLEY, D. H.; TAY, F. R.; YIU, C.; HASHIMOTO, M.; BRESCHI, L.; CARVALHO, R. M.; ITO, S. Collagen degradation by host-derived enzymes during aging. Journal of Dental Research, v. 83, n. 3, p. 216-221, 2004.
PERDIGÃO, J. New developments in dental adhesion. Dental Clinics of North America, v. 51,
n. 2, p. 333-357, 2007.
RASHEED, Z.; ANBAZHAGAN, A. N.; AKHTAR, N.; RAMAMURTHY, N.; VOSS, F. R.; HAQQI, T. M. Green tea polyphenol epigallocatechin-3-gallate inhibits advanced glycation end products-induced expression of tumor necrosis factor-alpha and matrixmetalloproteinase-13 in human chondrocytes. Arthritis Research & Therapy, v. 11, n. 3, p. 1-13, 2009.
SANO, H.; YOSHIKAWA, T.; PEREIRA, P. N. R.; KANEMURA, N.; MORIGAMI, M.; TAGAMI, J.; PASHLEY, D. H. Long-term durability of dentin bonds made with a self-etching primer, in vivo. Journal of Dental Research, v. 78, n. 4, p. 906-911, 1999.
SEN, T.; MOULIK, S.; DUTTA, A.; CHOUDHURY, P. R.; BANERJI, A.; DAS, S.; ROY, M.; CHATTERJEE, A. Multifunctional effect of epigallocatechin-3-gallate (EGCG) in downregulation of gelatinase-A (MMP-2) in human breast cancer cell line MCF-7. Life Sciences, v. 84, n. 7, p. 194-204, 2009.
STREK, M.; GORLACH, S.; PODSEDEK, A.; SOSNOWSKA, D.; KOZIOLKIEWICZ, M.; HRABEC, Z.; HRABEC, E. Procyanidin Oligomers from Japanese Quince (Chaenomeles
japonica) Fruit Inhibit Activity of MMP-2 and MMP-9 Metalloproteinases. Journal of
Agricultural and Food Chemistry, v. 55, n. 16, p. 6447-6452, 2007.
TAY, F. R.; PASHLEY, D. H.; SUH, B. I.; CARVALHO, R. M.; ITTHAGARUN, A. Single-step adhesives are permeable membranes. Journal of Dentistry, v. 30, n. 7, p. 371-82, 2002.
TAY, F. R.; PASHLEY, D. H.; SUH, B. I.; HIRAISHI, N.; YIU, C. K. Buonocore memorial lecture. Water treeing in simplified dentin adhesives—deja vu? Operative Dentistry, v. 30, n. 5, p. 561-579, 2005.
TJADERHANE, L.; LARJAVA, H.; SORSA, T.; UITTO, V. J.; LARMAS, M.; SALO, T. The activation and function of host matrix metalloproteinase in dentin matrix during breakdown in carious lesions. Journal of Dental Research, v. 77, n. 8, p. 1622-1629, 1998.
VAIDYANATHAN, T. K.; VAIDYANATHAN, J. Recent advances in the theory and mechanism of adhesive resin bonding to dentin: A critical review. Journal of Biomedical Materials Research Part B: Applied Biomaterials, v. 88, n. 2, p. 558-578, 2009.
VAN DIJKEN, J. W. Clinical evaluation of three adhesive systems in class V non-carious lesions. Dental Materials, v. 16, n. 4, p. 285-291, 2000.
VAN MEERBEEK, B.; DE MUNCK, J.; YOSHIDA, Y.; INOUE, S.; VARGAS, M.; VIJAU, P.; VAN LANDUYT, K.; LAMBRECHTS, P.; VANHERLE, G. Adhesion to enamel and dentin: current satatus and future challenges. Operative Dentistry, v. 28, n. 3, p. 215-235, 2003.
VAN MEERBEEK, B.; PERDIGÃO, J.; LAMBRECHTS P, VANHERLE G. The clinical performance of adhesives. Journal of Dentistry, v. 26, n. 1, p. 1-20, 1998.
VAN STRIJP, A. J.; JANSEN, D. C.; DEGROOT, J.; TEN CATE, J. M.; EVERTS, V. Host-derived proteinases and degradation of dentine collagen in situ. Caries Research, v. 37, n. 1, p. 58-65, 2003.
VISSE, R.; NAGASE, H. Matrix metalloproteinases and tissue inhibitors of metalloproteinases. Structure, function, and biochemistry. Circulation Research, v. 92, n. 8, p. 827-839, 2003.
YUN, J. H.; PANG, E. K.; KIM, C. S.; YOO, Y. J.; CHO, K. S.; CHAI, J. K.; KIM, C. K.; CHOI, S. H. Inhibitory effects of green tea polyphenol (–)-epigallocatechin gallate on the expression of matrix metalloproteinase-9 and on the formation of osteoclasts. Journal of Periodontal Research, v. 39, n. 5, p. 300-307, 2004.
APÊNDICE A
TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO
Por esse instrumento particular declaro, para os devidos fins éticos e legais, que eu, ________________________________________________________________ brasileiro(a),
nascido(a) em ___/___/___, portador do RG nº_____________ __________residente à ____________________________________________________, na
cidade de ____________________, concordo com a minha participação voluntária, na pesquisa intitulada “Efeito do flavonóide epigalocatequina-3-galato na resistência de união de sistema adesivo de condicionamento total à dentina”, doando meu dente(s) (3º molar) e declaro que fui informado e entendi, sem dúvida alguma, sobre a minha participação no estudo, de acordo com os termos abaixo relacionados:
• Fui esclarecido que a realização da pesquisa não implica em risco algum para os participantes, pois será realizada nos dentes extraídos.
• Estou ciente que os dados e resultados obtidos na pesquisa serão utilizados para fins didáticos e de divulgação em revistas científicas brasileiras ou estrangeiras; porém será garantido o sigilo de identidade, assegurando a privacidade.
• Estou ciente que a participação na pesquisa não acarretará em nenhum gasto, uma vez que todo material utilizado será fornecido pelo pesquisador.
• Estou ciente que não receberei nenhum valor em dinheiro para ingressar na pesquisa; • Este termo será preenchido em 02 (duas) vias, sendo uma para o pesquisador e a outra
para o voluntário da pesquisa.
Desta forma, uma vez tendo lido e entendido tais esclarecimentos, dato e assino esse termo de consentimento, por estar de pleno acordo com o teor do mesmo.
Fortaleza, ____ de ___________________ de _____________
________________________________________________ Assinatura do Participante
________________________________________________ Assinatura da Testemunha (se o voluntário não souber ler)
Nome da testemunha:
___________________________________ Assinatura do Pesquisador
APÊNDICE B
TERMO DE DOAÇÃO DE DENTES
Declaro que doei __________________________ (número e tipo de dentes) ao pesquisador Jiovanne Rabelo Neri, a fim de colaborar com a realização da pesquisa intitulada "Efeito do flavonóide epigalocatequina-3-galato na resistência de união de sistema adesivo de condicionamento total à dentina". Declaro, também, que estes dentes foram extraídos antes do meu conhecimento sobre a pesquisa citada acima, sendo armazenados em frasco único, o que impossibilita a identificação dos doadores.
Dat a: ___/ ___ /__ _