Avaliação da Integridade da Membrana Plasmática do
Espermatozóide em Sémen Congelado de Cavalos da Raça
Lusitana
Dissertação de Mestrado em Medicina Veterinária
Mariana Graça Correia
Orientadora: Prof. Doutora Rita Payan Carreira
Co-orientador: Dr. Miguel Bliebernicht
Agradecimentos
À Universidade de Trás-os-Montes e Alto Douro pelos conhecimentos transmitidos.
À Professora Doutora Rita Payan Carreira por ter sido incansável na orientação desta dissertação e pela rapidez, disponibilidade e atenção com que auxiliou toda a realização deste trabalho.
Ao Dr. Miguel Bliebernicht pelo incentivo para a realização deste estudo e pela disponibilidade, apoio, exigência e transmissão de conhecimentos essenciais para a realização da componente prática desta dissertação.
À Embriovet pelo financiamento deste trabalho, sem o qual não seria possível a sua realização, e pela disponibilização das instalações para a sua execução. A toda a sua equipa pela ajuda na realização deste trabalho, pelos conhecimentos transmitidos, pela simpatia e pela oportunidade de realização de estágio curricular que me proporcionou. Ao Professor Doutor Jorge Colaço pela disponibilidade, simpatia e atenção no esclarecimento de todas as minhas dúvidas na análise estatística dos resultados.
À Tânia pela disponibilidade e auxílio no tratamento estatístico desta dissertação.
Ao Dr. Henrique Cruz, à Dra. Rita Costa Cabral, ao Dr. Rui Mendes, à Clinique Vétérinaire du Grand Renaud e à Bell Equine Veterinary Clinic pelas oportunidades de realização de estágio curricular, pela simpatia e transmissão de conhecimentos práticos no âmbito da clínica e cirurgia de equinos.
Ao Hospital Veterinário do Restelo pela oportunidade de realização de estágio em pequenos animais.
Aos meus pais, pelo apoio incondicional e por terem tornado possível a realização deste curso.
Ao João pela paciência, compreensão e por todo o apoio.
Às “txucas” por tudo o que passámos e pela amizade e incentivo que sempre me deram. Às grandes amigas que fiz em Vila Real, pelo “tamo junto” quando as coisas complicavam, por todos os bons momentos que já deixam saudades, pela certeza de que daqui a muitos anos o “xuxu denguinho” ainda vai arrepiar.
Índice
Índice de Abreviaturas ... v
Índice de Figuras ... ix
Índice de Tabelas ... xi
Abstract ... xiii
Resumo ... xv
Capítulo I - Revisão Bibliográfica ... 1
1. Introdução ... 1
1.1. Morfologia do Espermatozóide Equino ... 1
1.2. Bioquímica Estrutural do Espermatozóide ... 5
1.2.1. A Membrana Plasmática do Espermatozóide ... 5
1.3. Topologia da Membrana Plasmática do Espermatozóide ... 10
1.4. Envolvimento da Membrana Plasmática do Espermatozóide no Processo de Fecundação ... 13
2. A Criopreservação e a Integridade da Membrana Plasmática do Espermatozóide ... 14
2.1. Espécies Reativas de Oxigénio ... 15
2.2. Efeitos da Temperatura ... 16
2.3. Formação e Dissolução de Cristais de Gelo ... 17
3. Contrastação Seminal ... 18
3.1. Avaliação da Integridade da MPE ... 19
3.1.1. Coloração vital com Eosina/Eosina-Nigrosina ... 21
3.1.2. Teste de Coloração com Sondas Fluorescentes ... 22
3.1.3. Teste Hipo-osmótico ... 23
Capítulo II - Componente Experimental ... 27
1. Objetivos ... 27
2. Material e Métodos ... 27
2.1. Avaliação do sémen ... 29
2.1.1. Avaliação da Motilidade Espermática ... 29
2.1.2. Teste Hipo-osmótico ... 30
2.1.3 Coloração com Eosina-Nigrosina ... 32
2.1.4. Metodologia da análise conjugada da coloração com E-N e do HOST (EN_HOST) .... 32
2.1.5. Técnica de Fluorescência ... 34
2.1.6. Análise Estatística ... 35
3. Resultados ... 37
3.1. Motilidade ... 37
3.2. HOST1 vs HOST2 ... 37
3.3. Coloração com E-N ... 41
3.4. EN_HOST1 vs EN_HOST2 ... 44
3.5. HOST1 vs E-N1 ... 50
3.6. Fluorescência vs HOST1, E-N1 e EN_HOST1 ... 50
3.7. Motilidade Total vs Testes de Viabilidade ... 52
4. Discussão ... 53
Capítulo III - Conclusão ... 57
Capítulo IV - Referências Bibliográficas ... 59
Índice de Abreviaturas
ACE: Angiotensin-converting Enzime.
ADAMs: Membros da Família Desintegrina-A e Metaloprotease-A. ADN: Ácido Desoxirribonucleico.
AMPc: Adenosina Monofosfato cíclica. ATP: Adenosina Trifosfato.
BSE: Breeding Soundness Examination. CAM: Ester de Acetoximetilcalceína.
CASA: Computer-Assisted Sperm Analysis. CFDA: Diacetato de Carboxifluoresceína. CO: Comprimento de Onda.
CV: Coeficiente de Variação de Pearson. DHA: Ácido Docosaexanóico.
DP: Desvio Padrão
DPA: Ácido Docosapentaenóico. E-N: Eosina-Nigrosina.
E-N1: E-N após submissão ao HOST1. E-N2: E-N após submissão ao HOST2. EB: Brometo de Etídio.
EGF: Epidermal Growth Factor. EH: Etídio Homodimérico-1. EM: Esfingomielina.
EN_HOST1: HOST1 em conjunto com coloração com E-N.
EN_HOST2: HOST2 em conjunto com E-N com coloração com E-N. EPM: Erro Padrão da Média.
FC: Fosfocolinoglicerídeos. FE: Fosfoetanolaminoglicerídeos. GL: Glicolípidos.
GP: Glicoproteínas.
HOST: Hypoosmotic Swelling Test. HOST1: HOST com a solução 1. HOST2: HOST com a solução 2. IA: Inseminação Artificial.
kDa: kiloDaltons.
LRO: Lisosome-Related Organelle. mL: Mililitro
mOsm: Miliosmol.
MP: Motilidade Progressiva.
MPE: Membrana Plasmática do Espermatozóide.
NSF: Soluble N-ethylmaleimide-sensitive Fusion Protein.
p: Significância.
PCSK4: Proproteína Convertase Subtilisina/Kexina tipo 4. PI: Propídium Iodide (Iodeto de Propídio).
PKA: Protein Kinase A
PMCA:
Plasma Membrane Ca2+-ATPase. PP: Proporção
r: Correlação de Spearman.
RA: Reação Acrossómica. ROS: Reactive Oxygen Species.
SCSA: Sperm Chromatin Structure Assay. SDTS: Spontaneously Developed Tail Swelling.
SNARE: Soluble NSF Attachment Protein Receptors. SP47: Sperm Surface Protein 47.
Spz: Espermatozóide
ToPro-3: Monómero de Iodeto de Benzotiazólio-4-quinolínio.
W: Valor concordância de Kendall.
WHO: World Health Organization. ZP: Zona Pelúcida.
Índice de Figuras
Figura 1 - Representação esquemática de um espermatozóide ... 2 Figura 2 - Representação esquemática da disposição dos microtúbulos no flagelo do espermatozóide de mamífero. ... 4 Figura 3 - Diagrama da estrutura da peça intermédia (A) e da peça principal (B) no espermatozóide de mamífero ... 4 Figura 4 - Representação esquemática dos 4 domínios específicos da membrana plasmática que cobre a cabeça do espermatozóide de mamífero ... 6 Figura 5 - Representação esquemática do processo de fertilização em mamíferos ... 14 Figura 6 - Diagrama representativo da ordem cronológica pela qual os procedimentos experimentais foram realizados ... 28 Figura 7 - Representação esquemática das alterações típicas da tumefação observada em sémen congelado de equino exposto a uma solução hipo-osmótica ... 31 Figura 8 - Imagem do resultado do teste de HOST e posterior coloração com eosina-nigrosina ... 33 Figura 9 - Microfotografia de espermatozóides corados com o kit Fluovit® ... 35 Figura 10 - Gráfico representativo da média das medidas de motilidade total e de motilidade progressiva com respetivo erro padrão ... 37 Figura 11 - Representação gráfica dos valores médios da percentagem de “positivos” e “negativos” encontrada no HOST1 e no HOST2, com o respetivo erro padrão ... 38 Figura 12 - Representação gráfica dos resultados e do teste de Bland-Altman para a concordância dos resultados para a população de Spz com membrana funcional das soluções HOST1 e HOST2 ... 40 Figura 13 - Representação gráfica do teste de Bland-Altman para a concordância dos resultados negativos das soluções HOST1 e HOST2 ... 41 Figura 14 - Gráfico representativo dos valores médios da percentagem de “vivos” e “mortos” encontrada no E-N1 e no E-N2, com o respetivo erro padrão. ... 42
Figura 15 - Representação gráfica da análise de concordância de Bland-Altman para o número de Spz “vivos” detetados segundo a coloração vital pela eosina-nigrosina realizada sobre duas soluções HOST distintas ... 44 Figura 16 - Representação gráfica da análise de concordância de Bland-Altman para o número de Spz “mortos” detetados segundo a coloração vital pela eosina-nigrosina realizada sobre duas soluções HOST distintas. ... 44 Figura 17 - Gráfico representativo dos valores médios da percentagem de resultados do HOST1 e E-N realizados em simultâneo, com o respetivo erro padrão ... 45 Figura 18 - Gráfico representativo dos valores médios da percentagem de resultados do HOST2 e E-N realizados em simultâneo, com o respetivo erro padrão ... 46 Figura 19 - Representação gráfica da análise de concordância de Bland-Altman para o número de Spz “vivos (+)” detetados pelos testes EN_HOST1 e EN_HOST2.. ... 48 Figura 20 - Representação gráfica da análise de concordância de Bland-Altman para o número de Spz “vivos (-)” detetados pelos testes EN_HOST1 e EN_HOST2 ... 48 Figura 21 - Representação gráfica da análise de concordância de Bland-Altman para o número de Spz “mortos (+)” detetados pelos testes EN_HOST1 e EN_HOST2 ... 49 Figura 22 - Representação gráfica da análise de concordância de Bland-Altman para o número de Spz “mortos (-)” detetados pelos testes EN_HOST1 e EN_HOST2 ... 49 Figura 23 - Gráfico representativo dos valores médios da percentagem de “vivos” e “mortos” encontrada na fluorescência, com o respectivo erro padrão ... 51
Índice de Tabelas
Tabela 1 - Constituição fosfolipídica da membrana plasmática do espermatozóide de equino ... 7 Tabela 2 - Topologia da distribuição de proteínas da membrana plasmática ... 12 Tabela 3 - Valores de referência para a correlação de Spearman e concordância de Kendall ... 36 Tabela 4 - Quadro resumo dos resultados obtidos para a análise da motilidade total e progressiva nas amostras utilizadas no estudo ... 37 Tabela 5 - Resultados do teste hipo-osmótico nas amostras em estudo, para as 4 populações identificadas ... 38 Tabela 6 - Resultados do teste de concordância de Kendall e Correlação de Spearman aplicados entre o HOST1 e o HOST2 para as duas populações celulares identificadas ... 39 Tabela 7 - Resultados do teste t da diferença entre os resultados das duas soluções HOST1 e HOST2 para a análise de Bland-Altman ... 39 Tabela 8 - Resultados do teste de coloração com E-N nas amostras em estudo, para as 4 populações identificadas ... 42 Tabela 9 - Resultados do teste de concordância de Kendall e da correlação de Spearman aplicados entre o E-N1 e o E-N2 para as duas populações celulares identificadas ... 43 Tabela 10 - Quadro-resumo da análise de Bland-Altman para a coloração vital com eosina-nigrosina realizada sobre duas soluções HOST distintas ... 43 Tabela 11 - Resultados (%) do teste HOST1 e HOST2 em conjunto com a coloração com E-N nas amostras em estudo ... 45 Tabela 12 - Resultados do teste de concordância de Kendall e Correlação de Spearman aplicados entre as 4 populações identificadas no EN_HOST1 e no EN_HOST2 ... 46 Tabela 13 - Quadro resumo da análise de Bland-Altman para a avaliação conjunta da coloração vital com o HOST ... 47 Tabela 14 - Resultados do teste de concordância de Kendall e correlação de Spearman aplicados entre Fluorescência e HOST1, E-N1 e EN_HOST1 ... 52
Tabela 15 - Resultados do teste de correlação de Spearman aplicados entre a motilidade e os testes de viabilidade ... 52
Abstract
Sperm plasma membrane plays important roles both in the cell survival and in its functions, including the establishment of ionic gradients, facilitating the entrance of larger molecules and regulating several events of cellular signaling. Thus, the integrity of the spermatozoa plasmatic membrane (MPE) is essential to ensure the oocyte fertilization. Being aware of the susceptibility of the sperm plasma membrane to damage when submitted to thermal treatments, alike freezing, it would be desirable to analyse the physical and biochemical integrity of sperm membranes to estimate, in confidence, the fertility potential of a semen sample. It would be of a great interest to ensure a good cost-efficiency relation using a repeatable and reliable method. Once the method is identified, the cryopreservation techniques can be modified in order to minimize the damage inflicted by the freezing and thawing processes.
The main goal of this study was the comparison of different available methods to assessing the sperm membrane integrity, for what it was used 30 semen frozen samples from stallions of the Lusitano breed. The semen vitality was assessed by two distinct stain protocols: the eosin-nigrosin and the fluorescent probes (Propidium Iodide and Hoechst 33342). Membrane integrity was also assessed through the hypoosmotic swelling test (HOST), which was performed using two different solutions (one with fructose and sodium citrate (HOST1) and the other with NaCl (HOST2). The eosin-nigrosin staining was performed in semen previously exposed to one of the hypoosmotic solutions and the results were analyzed together. This study revealed that, in frozen stallion semen, the HOST must be envisaged as distinct from the vital stains, as also the total motility analysis. From the two solutions used to perform HOST, the solution 1 was the one that offered more reliable results. The vital stains revealed a moderated correlation with the total motility (E-N: r=0,479; Fluorescence: r=0,484) and both were highly correlated between each other (r=0,781); still fluorescent probes constitute the most suitable stain to perform the vital staining. It was also demonstrated that the inclusion of this test in the routine semen analysis would be an advantage to predict the stallion fertilizing potential. Furthermore, there is a possibility for this analysis to be replaced by the test HOST1 combined with E-N, which cost-efficiency relation is more favorable than that of the fluorescent probes.
It would be of interest to develop further studies on fresh semen to confirm some of the results obtained on the present study and to correlate these with the stallion’s fertility rate.
Resumo
A membrana plasmática do espermatozóide (Spz) exerce um importante papel na sobrevivência e nas funções da célula, incluindo o estabelecimento de gradientes iónicos, facilitando a entrada de moléculas de maior dimensão e regulando vários eventos de sinalização celular. Por este motivo, a integridade da membrana plasmática do espermatozóide (MPE) é indispensável para que ocorra a fecundação do oócito. Sabendo-se que a membrana plasmática é susceptível a danos quando submetida a tratamentos térmicos, como a congelação, seria desejável proceder à avaliação da sua integridade física e bioquímica como forma de estimar, com alguma confiança, o potencial fecundante de uma amostra seminal. Para tal, seria de grande interesse assegurar uma boa relação custo-eficiência utilizando um método repetível e credível. Uma vez identificado o método, as técnicas de criopreservação podem ser modificadas por forma a reduzir o dano infligido na MPE nos processos de congelação e descongelação.
O principal objectivo deste trabalho foi a comparação de diferentes métodos de avaliação da integridade da MPE, para o que se utilizaram 30 amostras de sémen congelado de cavalos da raça Lusitana. A viabilidade seminal foi avaliada através de dois protocolos de coloração: eosina-nigrosina e sondas fluorescentes (Iodeto de Propídio e Hoechst 33342). A integridade de membrana foi ainda avaliada com recurso ao teste hipo-osmótico, o que foi testado com duas soluções diferentes, uma com frutose e citrato de sódio (solução 1 – HOST1) e outra com NaCl (solução 2 – HOST2). A coloração com eosina-nigrosina foi realizada em sémen previamente exposto a uma das soluções hipo-osmóticas e a análise de resultados dos dois testes foi feita em simultâneo. Este trabalho mostrou que, em sémen congelado de equino, o HOST deve ser considerado como um teste distinto dos que utilizam colorações vitais, tal como da análise de motilidade total. Entre as duas soluções utilizadas para a realização do HOST, a Solução 1 foi a que ofereceu resultados mais fiáveis. As colorações vitais apresentaram uma correlação moderada com a motilidade total (E-N: r=0,479; Fluorescência: r=0,484) e encontram-se altamente correlacionadas entre si (r=0,781), sendo que a de eleição será a utilização de sondas fluorescentes. Foi também demonstrado que a inclusão deste teste na análise seminal de rotina trará vantagens na predição do potencial fecundante do garanhão e ainda a possibilidade de esta coloração ser substituída pela análise do HOST1 em simultâneo com a coloração com E-N, cuja relação custo-eficiência é favorável quando comparado com as sondas fluorescentes.
Capítulo I - Revisão Bibliográfica
1. Introdução
1.1. Morfologia do Espermatozóide Equino
Yanagimachi (1994) distingue três regiões altamente especializadas no espermatozóide: (1) A cabeça, que contém o ADN e é vital para a interação entre gâmetas; (2) A peça intermédia que, contendo a matriz mitocondrial, está envolvida na produção de energia; (3) O flagelo, implicado na motilidade do gâmeta. Uma classificação anterior, ainda frequentemente utilizada, considera apenas a existência de cabeça e flagelo, sendo neste último reconhecida a existência de 4 regiões morfo-funcionais: (1) a peça de ligação ou colo; (2) a peça intermédia; (3) a peça principal; e (4) a peça terminal (Amann & Pickett, 1987).
Cabeça:
A cabeça do espermatozóide (Spz) equino é descrita como tendo uma forma espatulada, elíptica e achatada dorsoventralmente, sendo mais espessa na sua porção posterior do que na sua porção apical (Varner and Johnson, 2011).
O núcleo da célula (Figura 1) ocupa a maior parte do espaço interior da cabeça do Spz; contém o material genético paterno, sendo composto por cromatina altamente condensada em que as histonas de ligação foram substituídas por protaminas, o que lhe permite uma maior condensação do que noutra célula do organismo, favorecendo a sua compactação e hidrodinamismo (Brewer et al., 2002). O núcleo encontra-se rodeado pelo envelope nuclear, uma dupla membrana semelhante à encontrada nas células somáticas, sendo cada um dos folhetos constituído por uma dupla camada lipídica; os dois folhetos estão intimamente apostos. No Spz, o envelope nuclear é também perfurado mas os complexos porosos nucleares apenas se encontram em posição caudal à da cromatina, dobrando-se e estendendo-se posteriormente pela região do pescoço. A porção caudal do envelope nuclear forma uma concavidade, designada por fossa de implantação, que corresponde à zona de ligação do flagelo, que assenta numa lâmina espessa denominada de lâmina basal (revisto por Varner & Johnson 2011). À zona de ancoragem da membrana plasmática do espermatozóide (MPE) ao envelope nuclear dá-se o nome de anel posterior, e pensa-se que constitua uma barreira física entre os dois compartimentos principais do Spz, permitindo a separação entre o conteúdo citosólico da cabeça e do flagelo (Johnson et al.,
1978).
O acrossoma é uma organela exocítica de pH ácido, constituída por receptores de proteínas e numerosas enzimas hidrolíticas que são importantes para a adesão e penetração da zona pelúcida do oócito, e nas interações entre os gâmetas (Yanagimachi, 2011). O material do acrosoma encontra-se contido entre duas membranas; a membrana acrossómica interna é contínua com a membrana acrossómica externa e ambas, pela sua união, encerram uma matriz proteica designada por matriz acrossomal. Esta matriz comporta várias enzimas, entre as quais se encontram glico-hidrolases ácidas (Abou-Haila and Tulsiani, 2001), proteases, esterases, fosfatase ácida e arilsulfatases (Allison and Hartree, 1970). O acrossoma difere do lisossoma de célula somática por conter acrosina, acroguanina e a proteína espermática AM67 (Abou-Haila and Tulsiani, 2000).
Esta organela, que se sabe ser imprescindível para que ocorra a fecundação (Dam et al., 2007), recobre os dois terços anteriores do núcleo, ao qual se justapõe como uma touca ou capuchão (Figura 1).
Figura 1 - Representação esquemática de um espermatozóide. A: vista
seccionada do espermatozóide. B: subdivisões da membrana plasmática. C: reação do acrossoma. (1) membrana plasmática; (2) membrana acrossomal externa; (3) fluido do acrossoma; (4) membrana acrossomal interna; (5) envelope nuclear; (6) núcleo; (7) anel nuclear; (8) mitocôndria; (9) peça intermédia; (10) anel anular; (11) peças principal e terminal; (12) bainha fibrosa; (13) subdomínio apical; (14) subdomínio pré-equatorial; (15) subdomínio pré-equatorial; (16) subdomínio pós-pré-equatorial; (17) vesículas formadas durante a reação do acrossoma através da fusão da MPE com a membrana acrossomal externa (adaptado de Gadella et al. 2001)
A membrana acrossómica interna encontra-se em estreita aposição com o envelope nuclear, enquanto que a membrana acrossómica externa se localiza sob a MPE. Estas duas membranas convergem ao nível do segmento equatorial (Sutovsky & Manandhar 2006). A zona da superfície espermática capaz de se ligar à membrana plasmática do oócito – ou zona equatorial - é uma estrutura em formato de gancho resultante da inflexão da membrana acrossómica interna, que fica exposta aquando da reação do acrosoma que precede a ligação dos dois gâmetas (Bleil and Wassarman, 1983; Szász et al., 2000). A constituição desta zona de ligação ainda não é completamente conhecida e crê-se que possa diferir entre espécies (Chiu et al., 2014).
Flagelo:
A peça de ligação do flagelo à cabeça do espermatozóide – colo ou pescoço – é constituída primariamente pelo capitulum, por um conjunto de colunas de fibras segmentares e pelos centríolos proximal e distal. O centríolo proximal localiza-se junto da fossa de implantação do colo, e o centríolo distal origina o axonema (Varner and Johnson, 2011). O capitulum, composto por proteínas ricas em ligações dissulfito, articula com a cabeça do Spz ao nível da fossa de implantação fixando-se à placa basal através de finos filamentos. Nos equinos, a fossa de implantação nem sempre se encontra bem centrada, originando as chamadas “caudas com ligação abaxial”, geralmente associadas a motilidade circular que pode ser confundida com um desvio à normal motilidade progressiva. As colunas segmentadas (2 internas mais espessas e 5 menores periféricas) fundem-se com a origem das nove fibras densas do flagelo, que se estendem até ao final da peça principal conferindo-lhe rigidez e elasticidade (Samper, 2009; Varner et al., 2014).
A peça intermédia é caracterizada pela presença do axonema, uma disposição cilíndrica de nove pares de microtúbulos que se encontra no interior da extensão das nove fibras densas e rodeia dois microtúbulos centrais (disposição “9+2”). Os nove pares de microtúbulos externos são divididos nas sub-unidades A e B, constituídas por protofilamentos, que suportam a dineína, participando estes na atividade da ATPase necessária ao movimento flagelar (Figura 2). A bainha mitocondrial envolve as fibras densas da peça intermédia, numa disposição helicoidal, cumprindo 40-50 voltas na espécie equina; participa na produção e armazenamento de energia na forma de adenosina trifosfato (ATP), usada pelo axonema (Samper 2009; Varner et al. 2014). A peça intermédia e a cauda encontram-se divididas pelo anel anular (annulus) (Gadella et al. 2008).
Figura 2 - Representação esquemática da disposição dos microtúbulos no flagelo do espermatozóide de mamífero (Asashima et al., 2010).
Figura 3 - Diagrama da estrutura da peça intermédia (A) e da peça principal (B) no espermatozóide de mamífero (adaptado de Fawcett 1975, citado por Fawcett, 1981).
Na peça principal as fibras densas dispõem-se em torno dos microtúbulos, substituindo a bainha mitocondrial; encontram-se recobertas pela bainha fibrosa (Figura 3), que substitui a bainha mitocondrial da peça intermédia. Na peça terminal a disposição típica dos microtúbulos, em “9+2”, continua por cerca de metade do comprimento do flagelo, sendo gradualmente perdida; na peça terminal, os microtúbulos encontram-se apenas revestidos pela membrana plasmática do espermatozóide (Samper 2009).
1.2. Bioquímica Estrutural do Espermatozóide
1.2.1. A Membrana Plasmática do EspermatozóideToda a superfície do espermatozóide é revestida pela membrana plasmática (Varner & Johnson 2011) que, à semelhança do que ocorre nas células somáticas, é composta por proteínas e lípidos organizados numa estrutura clássica em dupla-camada (Jones, 2002). Na superfície externa da membrana, hidratos de carbono ligam-se às proteínas e lípidos membranares, formando glicoproteínas (GP) e glicolípidos (GL) (Alberts et al., 2002a). Sabe-se que a composição e a organização lateral da membrana plasmática do espermatozóide (MPE) regula a afinidade para fatores de adesão, a permeabilidade membranar a solutos hidrofílicos, a sinalização celular e ainda mecanismos de fusão celular (Flesch and Gadella, 2000). Crê-se ainda que a MPE contribua para a formação de barreiras entre a porção anterior e posterior do flagelo à livre difusão de substâncias ao longo da cauda do Spz, quer pela sua articulação com o annulus quer pela colocação de partículas filamentosas dispostas em linhas regularmente espaçadas evidenciadas em imagens de microscopia electrónica por fractura (revisto por Myles 1984).
A MPE está carregada negativamente, sobretudo ao nível da área flagelar (López et al., 1987).
Na membrana plasmática da cabeça reconhecem-se quatro domínios específicos ou regiões: apical, pré-equatorial, equatorial, pós-equatorial (Figura 4). A marcada heterogeneidade da membrana plasmática entre estas diferentes regiões do espermatozóide está relacionada com a sua especialização fisiológica. A composição e organização lateral da MPE tem um papel fundamental na sua afinidade por factores de adesão, na sua permeabilidade a solutos hidrofílicos e também em características associadas à sinalização intercelular e fusão celular (Gadella et al., 2001).
Figura 4 - Representação esquemática dos 4 domínios específicos da membrana plasmática que cobre a cabeça do espermatozóide de mamífero
(Brewis and Gadella, 2010).
A composição e organização lipídica definitiva da MPE apenas ocorre depois da maturação epididimária (Scott et al., 1967) e é bastante invulgar, o que se deve em grande parte à ausência, na célula, das principais organelas envolvidas na síntese e fragmentação lipídicas, bem como ao facto de a membrana plasmática não estar em contacto com outras membranas intracelulares (Gadella et al., 2001).
Composição lipídica
Todas as moléculas lipídicas que participam na constituição da membrana celular são anfipáticas, i.e. possuem uma extremidade polar ou hidrofílica e uma extremidade apolar ou hidrofóbica. Os fosfolípidos membranares são constituídos por um grupo polar na cabeça e duas caudas de hidrocarboneto apolares. Estas caudas são compostas por ácidos gordos que podem diferir no seu comprimento. O comprimento e a saturação das caudas de ácidos gordos definem a capacidade dos fosfolípidos se ligarem entre eles, afectando a fluidez da membrana (Alberts et al., 2002b).
A fluidez da MPE é um pré-requisito para a normal função do Spz e posterior vesiculação acrossómica (Cooper and Yeung, 2006). A fluidez e a flexibilidade da membrana plasmática estão muito dependentes da sua composição lipídica (Lenzi et al., 1996). Embora a composição lipídica global da MPE não varie muito em várias espécies de mamíferos a distribuição dos lípidos na membrana é bastante diferente entre espécies (Ladha S., 1998). A composição lipídica relativa da MPE no espermatozóide equino é cerca de 57% de fosfolípidos, 37% de colesterol e 6% de glicolípidos (Gadella et al., 2001). Ou
seja, possui um teor em colesterol superior ao de outras espécies (Vos et al., 1994). Os fosfolípidos existentes na MPE podem ser divididos em fosfoglicerolípidos e esfingomielina (EM), à semelhança do que se observa nas células somáticas (Gadella et al., 2001). A constituição fosfolipídica da membrana plasmática do espermatozóide de equino pode ser consultada na Tabela 1.
Tabela 1 - Constituição fosfolipídica da membrana plasmática do espermatozóide de equino (Gadella
et al. 2001).
Fosfolípidos de Membrana % Fosfocolinoglicerídeos 48 Fosfoetanolaminoglicerídeos 16 Esfingomielina 13 Fosfatidilserina/cardiolipina 15 Fosfatidilglicerol 5 Fosfatidilinositol 3
A composição da membrana em ácidos gordos determina a atividade de várias enzimas que participam na capacidade de resistência da membrana ao stress físico ou químico (Lenzi et al., 1996).
Para além das frações de fosfoetanolaminoglicerídeos (FE) e de fosfocolinoglicerídeos (FC), típicas das membranas celulares do Spz de mamíferos, a MPE equino possui ainda uma particularidade que a distingue das outras espécies: um elevado conteúdo em ácidos gordos 22:5 (DPA – Ácido Docosapentaenóico) e um conteúdo relativamente baixo em ácidos gordos 22:6 (DHA – Ácido Docosaexanóico) (Gadella et al, 2001). Noutros mamíferos verifica-se precisamente o inverso, existindo um conteúdo bastante elevado em DHA e reduzido em DPA (Brouwers et al. 1998; Parks & Lynch 1992). A composição lipídica da MPE varia de forma significativa tanto entre diferentes espécies de mamíferos como também entre diferentes machos de uma mesma espécie e até entre diferentes ejaculados do mesmo animal. A principal diferença, no caso de Spz de equino, diz respeito ao teor em colesterol da membrana, que é bastante superior à de outras espécies. O conteúdo em colesterol está relacionado com a capacitação (Yanagimachi, 1994), possivelmente porque este processo é controlado pelo efluxo desta molécula (Hoshi et al., 1990) o qual aumenta a fluidez da membrana (Wolf et al., 1986) facilitando a sua
fusão com a membrana acrossómica externa subjacente (Ehrenwald et al., 1988).
O colesterol auxilia na manutenção da integridade da MPE e participa ainda no processo de sinalização celular. Este composto lipídico possui uma porção hidrofílica e uma porção hidrofóbica; o grupo hidroxilo (OH) alinha-se com as cabeças dos fosfolípidos (compostas por um grupo fosfato hidrofílico) e a parte restante liga-se à porção de ácidos gordos da membrana. Devido à sua forma, parte do anel esteroide que o constitui é atraído para uma parte da cadeia de ácidos gordos dos fosfolípidos mais próximos. Assim, o colesterol participa na imobilização da face externa da MPE tornando-a menos permeável a pequenas moléculas hidrossolúveis, dificultando a sua passagem através da membrana. O colesterol mantém também a integridade da membrana e auxilia ainda na manutenção da sua fluidez, não permitindo que esta se torne demasiado fluída ou demasiado rígida (Sheriff and Ali, 2010).
Outra classe de lípidos também encontrados na MPE de equino são os glicolípidos, quase exclusivamente na forma de seminolípido (sulfogalactosilalquil-acilglicerol, um lípido de estrutura única encontrado apenas no Spz de mamífero e em células de Schwann) (Vos et al., 1994). Acredita-se que estes lípidos estejam envolvidos na ligação à zona pelúcida (ZP) e na prevenção da reação acrossómica pela estabilização da dupla camada lipídica. (Flesch and Gadella, 2000).
Composição proteica
Um importante passo da fecundação é o reconhecimento e ligação primária do Spz à zona pelúcida, que envolve o oócito. Para que este processo seja possível é necessária a intervenção de um vasto número de proteínas que se encontram localizadas na MPE. A ligação secundária sucede à primária com a participação de proteínas do acrossoma (Yanagimachi, 1994).
Foi localizada uma proteína de membrana, em Spz de várias espécies domésticas (rato, hamster, coelho, toiro e humano) incluindo no de equino (Klinefelter et al. 2002; Miller et al. 2003), denominada SP22 (Sperm Membrane Protein 22), que apresenta uma correlação positiva com a fertilidade em espermatozóides da cauda do epidídimo; pensa-se que possa estar também relacionada com a fertilidade no garanhão (Klinefelter et al., 2002; Wrench et al., 2006).
A enzima de conversão da angiotensina (ACE) que participa no sistema renina-angiotensina que participa na regulação da pressão sanguínea, desempenha também
funções importantes na regulação da função reprodutiva tanto masculina como feminina (Hagaman et al., 1998; Speth et al., 1999). Em ratos, foi demostrado que a ACE é importante para a fecundação “in vivo” e que no casos de carência nesta enzima o Spz apresenta defeitos de progressão no oviduto e de ligação com o a zona pelúcida do oócito (Hagaman et al., 1998). Um estudo mostra evidências da sua presença na MPE de equino e da sua provável participação no processo de capacitação (Ball et al., 2003).
Num estudo realizado por Gamboa e Ramalho-Santos (2005) foram detectadas proteínas SNARE (Soluble NSF (Soluble N-ethylmaleimide-sensitive Fusion Protein) Attachment Protein Receptors) e caveolina-1 na MPE de equino, que pareceram estar relacionadas com a fertilidade do garanhão.
Também a hialuronidase, uma das enzimas encontradas no acrossoma, foi encontrada na MPE de equino, sofrendo uma redistribuição durante o processo de capacitação espermática, o que sugere que poderá ter um papel importante na fertilidade desta espécie (Meyers and Rosenberger, 1999).
O espermatozóide possui canais permeáveis ao cálcio mas apenas um destes foi relacionado com a fertilidade do macho: os canais CatSper. Estes canais localizam-se na membrana plasmática ao nível da peça principal do flagelo (Ren et al., 2001). As proteínas CatSper 1, CatSper 2, CatSper 3 e CatSper 4 são específicas do espermatozóide e uma vez que regulam a chamada de cálcio ao Spz estão diretamente associadas à reação de capacitação, sendo por isso também essenciais no controlo da hiperativação da motilidade (Quill et al. 2001; Ren et al. 2001; Jin et al. 2007). Os canais CatSper estão presentes no espermatozóide equino e, à semelhança do que acontece em outras espécies, abrem de forma a permitir o influxo de Ca2+ em resposta ao aumento de pH (Loux et al., 2013).
Existem outras proteínas que, apesar de ainda não terem sido evidenciadas no Spz de equino, exercem importantes funções noutras espécies, admitindo-se que possam estar presentes na MPE em todas as espécies de mamíferos.
A SP47 (Sperm Surface Protein 47) ou SED1 (Secreted Protein Containing EGF Repeats and Discoidin/F5/8 Complement Domains) é uma proteína de origem epididimária que cobre a região apical da cabeça do espermatozóide. Encontra-se presente no Spz de mamífero e existem evidências de que seja indispensável à ligação espermatozóide-oócito em ratos (Shur, 2008; Shur et al., 2004).
A β-1,4-galactosyltransferase 1 (GalT) é uma proteína integral da membrana plasmática e participa na transdução de sinal. A GalT1 e a SP47 colaboram na fase inicial
do acoplamento do Spz com a zona pelúcida (Nixon et al., 2007; Shur, 2008).
A lectina hepática 2/3, localizada na cabeça e no flagelo do Spz de humano e rato, participa também na ligação deste com a zona pelúcida (Shur, 2008). Numa revisão recente sobre os modelos moleculares da adesão da superfície espermática à zona pelúcida do oócito em ratos, propõe-se que as interações com proteínas de tipo lectina, presentes na MPE, possuam o papel mais importante neste processo (Clark, 2010).
A proproteína convertase subtilisina/kexina tipo 4 (PCSK4), também conhecida como proproteína convertase 4, pertence a uma família de endoproteinases envolvidas na conversão proteolítica de precursores de proteínas na sua forma ativa. É expressa predominantemente em células germinativas masculinas e localizada na MPE. A carência nesta molécula leva a falhas na fecundação devido à sua importante participação na ligação espermatozóide-oócito (Gyamera-Acheampong and Mbikay, 2009).
A Izumo é uma proteína integrante da membrana que pertence à linha germinativa masculina da superfamília das imunoglobulinas e é necessária à fusão do Spz com o oócito. Está localizada na membrana acrosómica interna e na região equatorial da MPE (Inoue et al., 2005; Nixon et al., 2007). A Izumo consegue interagir com outras moléculas de adesão como a CD9 e CD81, presentes no oócito que participam na penetração do oolema pelo espermatozóide (Sutovsky, 2009).
Membros da família da Desintegrina-A e Metaloprotease-A (ADAMs) como a desintegrina, o domínio rico em cisteína e o fator de crescimento epidermal (EGF) são encontrados na MPE de humano e rato. Estas proteínas foram associadas à migração do Spz no oviduto e à penetração do oócito pelo Spz (Marcello and Evans, 2010).
As Ca2+-ATPases (PMCA) são bombas de extrusão de cálcio envolvidas na regulação dos níveis de cálcio intracelulares (Garcia and Strehler, 1999). A ausência destas enzimas mostrou ter um grande impacto na fertilidade, possivelmente pela incapacidade de sofrer hiperativação por excesso de cálcio (Wennemuth et al., 2003; Schuh et al., 2004). Estas enzimas encontram-se localizadas na membrana plasmática da peça intermédia do Spz bovino (Post et al., 2010).
1.3. Topologia da Membrana Plasmática do Espermatozóide
Existe uma heterogeneidade lateral da MPE, o que deriva do facto de as proteínas da membrana se encontrarem distribuídas de forma desigual pela membrana (Aguas, 1983;
Friend and Fawcett, 1974). Por ser heterogénea na sua composição, torna-se necessário conhecer a topologia lateral da MPE, de acordo com a topologia membranar (Tabela 2).
Os diferentes fosfolípidos encontram-se distribuídos de forma assimétrica entre os folhetos interno e externo da MPE. Esta assimetria está bem estabelecida e obedece a padrões espécie-específicos (Ladha S., 1998). Os fosfolípidos colina, a esfingomielina (EM) e, em menor extensão, os fosfocolinoglicerídeos (FC) estão sobretudo posicionados no folheto lipídico externo, enquanto que os aminofosfolípidos fosfoetanolaminoglicerídeos (FE), e em particular a fosfatidilserina, estão localizados no folheto lipídico interno (Gadella et al., 2001). A existência de aminofosfolípidos no folheto interno favorece a formação de estruturas lipídicas em arranjo de fase hexagonal II, particularmente quando interagem com o cálcio (Allen et al., 1990; Chernomordik, 1996), o que pode resultar na coexistência de estruturas em uni- e bicamada por toda a membrana, o que favorece a sua desestabilização e facilita a ocorrência da reação acrossómica (Ladha S., 1998).
A assimetria transmembranar dos aminofosfolípidos é estabelecida e mantida com o auxílio de uma proteína ATP-dependente (Mueller et al., 1994; Nolan et al., 1995) - a aminofosfolípido translocase - que também contribui para a existência de barreiras físicas formadas pela MPE entre segmentos contíguos do Spz.
A distribuição de colesterol na MPE não é uniforme. No Spz equino o colesterol foi encontrado com maior densidade na região acrossomal (subdomínios apical e pré-equatorial) , enquanto que a região pós-acrossomal (subdomínio pós-pré-equatorial) é quase desprovida desta molécula. Embora também tenha sido detectado colesterol na membrana plasmática do flagelo, o seu teor é reduzido e encontra-se distribuído de forma aleatória (López et al., 1987).
Os seminolípidos encontram-se localizados exclusivamente no folheto externo da MPE, concentrados no seu subdomínio apical (Gadella et al., 1994).
Tabela 2 - Topologia da distribuição de proteínas da membrana plasmática
Proteína Localização na MPE Espécie Referência
SNARE Segmento Equatorial e
Região Acrossómica
Equino (Gamboa &
Ramalho-Santos 2005)
NSF Regiões ricas em
colesterol e Segmento Equatorial
Equino (Gamboa &
Ramalho-Santos 2005)
SP22 Variável Equino (Miller et al. 2003)
Hialuronidase Região Pós-equatorial Equino (Meyers &
Rosenberger 1999) Enzima de Conversão da Angiotensina (ACE) Face interna da Região Acrossómica
Equino (Ball et al. 2003)
β-1,4-galactosyltransferase 1 (GalT)
Subdomínio Apical Rato, Murino (Nixon et al. 2007)
Lactaderina (SP47/SED1) Subdomínio Apical Mamíferos (Shur et al. 2004;
Shur 2008) Lectina Hepática R2/3
(rHL-2)
Cabeça e Flagelo Rato, Humano (Shur 2008)
Proproteína convertase 4 (PCSK4)
Região Acrossómica Rato, Primata,
Humano
(Gyamera-Acheampong & Mbikay 2009)
Espermadesina (AQN-3) Região Acrossómica Suíno (van Gestel et al.
2007)
N-acetilglucosaminidase Região Acrossómica Humano (Perez Martinez et
al. 2008)
Izumo Região Equatorial Rato, Humano (Nixon et al. 2007)
CatSper 1,2,3 e 4 Peça principal do
Flagelo
Rato (Ren et al. 2001)
Ca2+-ATPase (PMCA) Peça intermédia do
Flagelo
1.4. Envolvimento da Membrana Plasmática do Espermatozóide no Processo
de Fecundação
A sequência de acontecimentos que envolve a interação entre a célula espermática e o oócito no ambiente tubárico encontra-se fortemente regulada, tendo a MPE um papel bastante ativo neste processo (Gadella et al., 2001). Após a ejaculação, o espermatozóide deve passar por uma série de alterações físicas e metabólicas que lhe conferem, no final de uma cadeia de processos, a capacidade de se ligar à zona pelúcida (ZP) e de fecundar o oócito. Ao conjunto destas alterações dá-se o nome de capacitação e normalmente esta decorre ao longo do trato genital feminino. Este processo torna-se importante para que seja possível o reconhecimento da ZP e o desenvolvimento da reação acrossómica (RA) por parte do Spz, a qual deverá ocorrer nas imediações da ZP do oócito (Neild et al. 2005). Estas alterações incluem a chamada de cálcio ao interior da célula espermática (Okamura et al. 1993; Parrish et al. 1999), e consequentemente o aumento do cálcio intracelular e ativação do AMPc (Adenosina Monofosfato cíclica) (Florman et al., 1989; Gadella and Harrison, 2002; Visconti and Kopf, 1998; Visconti et al., 1995), um aumento da fluidez da membrana decorrente de alterações na sua composição lipídica e na sua arquitetura (Gadella et al., 2001; Harrison et al., 1996), e as alterações na atividade metabólica que culminam com a aquisição de hipermotilidade (Ferramosca and Zara, 2014; Nassar, 1999).
Aquando da capacitação os seminolípidos migram para a região equatorial (Gadella et al., 1994), e a Hialuronidase migra para a região anterior da cabeça do Spz antes de ocorrer a exocitose acrossomal (Meyers and Rosenberger, 1999).
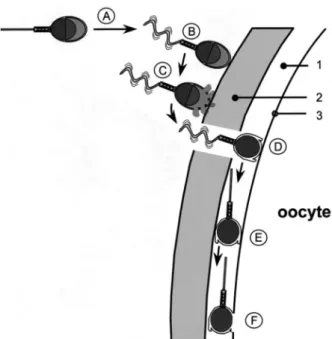
Apenas células espermáticas capacitadas se ligam à ZP (ligação primária), com condicionantes espécie-específicas, o que consequentemente ativa a sinalização celular que provoca o início da reação acrossómica pelo influxo de cálcio. Este influxo induz a fusão da membrana plasmática com a membrana acrossomal externa. Este fenómeno permite o contato das enzimas constituintes do acrossoma com a ZP, que iniciam a sua digestão. Durante a reação do acrossoma a membrana acrosómica interna torna-se contínua com a membrana plasmática. Esta estrutura liga-se à ZP (ligação secundária), permitindo que um espermatozóide com hipermotilidade ativada penetre a ZP e entre no espaço péri-vitelino. Após este evento dá-se a ligação lateral, exercida pela região equatorial da membrana plasmática. Por fim, dá-se a fusão da célula espermática com a membrana plasmática do oócito e consequentemente o Spz é incorporado no oócito (Figura 5; Flesch & Gadella 2000).
Figura 5 - Representação esquemática do processo de fertilização em mamíferos
(Flesch and Gadella, 2000).
2. A Criopreservação e a Integridade da Membrana Plasmática do
Espermatozóide
A congelação de sémen oferece grandes vantagens por tornar possível a inseminação de um maior número de éguas por ano, por diminuir a transmissão venérea de doenças, por exigir menos do garanhão e por facilitar a reprodução pela facilidade de transporte do sémen ao invés do animal, o que permite ainda um melhor e mais rentável aproveitamento de garanhões geneticamente superiores (Oliveira et al., 2013). No entanto, o sémen congelado apresenta uma fertilidade bastante inferior à que se regista com sémen fresco pertencente ao mesmo garanhão (Watson, 2000).
O protocolo de criopreservação comporta riscos potenciais de lesão dos espermatozóides associados às variações de temperatura, ao stresse osmótico e tóxico representado pela exposição a concentrações molares de crioprotetores e a formação e dissolução de gelo no meio extracelular (Watson, 2000). As lesões nos Spz de mamífero que têm sido associados à criopreservação incluem: perda de motilidade progressiva (MP), alterações morfológicas e da cromatina, permeabilização da membrana, desestabilização da membrana por reorganização lateral lipídica e formação de ROS (Reactive Oxygen Species) (revisto por Neild et al. 2003). Num estudo realizado por Blottner et al. (2001), verificou-se que a criopreservação reduz substancialmente a viabilidade do sémen de equino. As alterações induzidas na MPE não são totalmente reversíveis, podendo interferir com a
capacidade de o Spz interagir com o oócito, o que pode condicionar bastante a fertilidade (Watson, 2000).
2.1. Espécies Reativas de Oxigénio
Como todas a células que vivem em condições aeróbias, os espermatozóides produzem espécies reativas de oxigénio, os ROS, que provêm maioritariamente da normal atividade metabólica (de Lamirande et al., 1997). Os ROS, quando encontrados em baixa concentração, atuam como mediadores das funções espermáticas, enquanto que quando produzidos em excesso são altamente tóxicos para os espermatozóides (de Lamirande and Gagnon, 1995). Os ROS têm sido implicados no dano espermático pela peroxidação lipídica na MPE. Isto deve-se ao conteúdo relativamente alto em ácidos gordos polinsaturados da MPE, fazendo com que a mesma seja especialmente sensível ao stress oxidativo e peroxidação. Um nível moderado de peroxidação lipídica pode oferecer benefícios no sentido de promover a capacitação através da ativação da PKA (Protein Kinase A) específica do Spz, enquanto que os aniões superóxido induzem hipermotilidade e aumentam a sua afinidade pela ZP (revisto por Gadella et al. 2001). No entanto, quando a concentração de ROS excede a capacidade protetora exercida pelos antioxidantes naturais estão criadas condições para o aparecimento de lesões oxidativas sobre a membrana, nomeadamente através da peroxidação lipídica (Jones and Mann, 1976, 1973; Jones et al., 1979). De entre os anti-oxidantes naturais destacam-se as enzimas como a Superóxido dismutase e algumas moléculas como a albumina, a taurina ou o ácido ascórbico, que participam na eliminação dos ROS evitando o seu potencial dano oxidativo sobre o Spz (de Lamirande et al., 1997).
Os protocolos de refrigeração ou congelação do sémen obrigam à diluição do ejaculado, o que diminui a concentração de antioxidantes naturais nele presentes. Este fenómeno favorece indiretamente a acumulação de ROS acima dos limites fisiológicos (Hussain et al., 2011). A subsequente peroxidação lipídica afecta a fluidez da MPE (Agarwal et al., 2003) e pode provocar a sua ruptura, resultando em morte celular (de Lamirande and Gagnon, 1995). Neild et al. (2005) mostraram que o sémen de equino é vulnerável a radicais livres extracelulares, especialmente quando se trata de sémen congelado, apresentando este uma maior sensibilidade quando comparado com sémen fresco.
2.2. Efeitos da Temperatura
A criopreservação resulta em alterações de fase na membrana plasmática dependentes da temperatura (termotrópicas) e em alterações induzidas pela desidratação (liotrópicas) (Oldenhof et al., 2010).
O sémen de equino é mais susceptível ao choque térmico quando submetido a temperaturas entre os 19 e os 8ºC (Moran et al., 1992). Quando os espermatozóides de equino são submetidos a um arrefecimento a uma temperatura inferior aos 18ºC, os elementos da membrana sofrem alterações estruturais e de organização lateral, em que os fosfolípidos sofrem uma transição de fase de um estado líquido para um estado de gel. (Quinn 1985; Amann & Pickett 1987 citado por Moore et al. 2005). Durante esta transição, as proteínas que integram a MPE formam aglomerados (clusters) pela separação da fase lipídica, o que irá interferir com a sua função, como no caso dos canais iónicos proteicos, podendo alterar a sua permeabilidade a solutos. Uma redução da eficiência da bomba de ATP ocorre também com a redução da temperatura, acompanhando-se de um aumento do cálcio intracelular com consequente ativação de fosfolipases, que por sua vez hidrolisam os fosfolípidos de membrana. Estas ocorrências levam assim a um aumento da permeabilidade, ruptura da MPE e morte celular (De Leeuw et al., 1990; Drobnis et al., 1993; Rodriguez and Bustos Obregon, 1996; Watson, 2000). Por outro lado, o aumento do cálcio intracelular favorece um arranque precoce da reação do acrossoma. A exposição ao ionóforo de cálcio em presença de Ca2+ induz a fusão da membrana plasmática com a membrana acrosómica externa em espermatozóides capacitados, mas não em espermatozóides “não capacitados”, devido à permeabilidade superior dos primeiros (Gadella et al., 2001).
Verifica-se ainda que quanto mais a temperatura se afasta negativamente dos 0ºC mais desidratada fica a membrana, o que favorece o seu ingresso numa transição liotrópica para a fase de gel. Por isto, coloca-se a hipótese de existir um nível crítico de hidratação da membrana abaixo do qual a lesão da membrana resulta em morte celular após o descongelação (Oldenhof et al., 2010).
Como referido anteriormente, o colesterol possui um importante papel na manutenção da fluidez da membrana; por isso, em espécies que apresentam um maior teor deste composto na MPE (humano e coelho) esta alteração é pouco significativa. O elevado teor em colesterol da MPE de equino favorece a resistência do Spz às alterações de temperatura. Foi ainda provado que a adição de colesterol ao meio antes do processo de congelação favorece a sobrevivência das células espermáticas, principalmente em garanhões que oferecem maior dificuldade na manutenção de uma qualidade seminal
aceitável após submissão ao processo de criopreservação (Moore et al., 2005).
No protocolo de criopreservação são adicionados agentes crioprotetores que protegem o espermatozóide do choque térmico mas em contrapartida induzem algum stress osmótico. O Spz de equino possui uma tolerância osmótica limitada, pelo que os crioprotetores podem exercer algum efeito sobre a membrana plasmática (Ball and Vo, 2001).
2.3. Formação e Dissolução de Cristais de Gelo
O stresse induzido pela formação cristais de gelo tem maior impacto na fração de sémen que congela por último, devido às alterações na pressão osmótica a que esta é submetida por via da concentração de solutos que se instala nesta zona (Watson and Duncan, 1988). Uma vez que o espermatozóide de equino tem uma tolerância osmótica limitada, este efeito encontra-se agravado nesta espécie. A partir do momento em que a solução é arrefecida a uma temperatura inferior ao ponto de congelação, os cristais de gelo tornam-se nucleados e a água pura cristaliza como gelo.
A proporção entre a fracção congelada e a não congelada depende da temperatura – quanto mais baixa a temperatura, menor é a fração não congelada e, portanto, maior a resistência osmótica da solução. É também reconhecido que a exposição dos espermatozóides a estes fenómenos deve ser reduzida, pelo que o arrefecimento deve ser rápido, embora lento o suficiente para permitir que a água saia das células por osmose, prevenindo a formação letal de gelo intracelular. As células espermáticas são congeladas a uma velocidade de 15-60ºC/min, que se tem verificado oferecer as melhores taxas de sobrevivência (Watson, 2000). Foi sugerido que a taxa ideal em equinos é de por volta de 29ºC/min na ausência de agentes crioprotetores e de por volta de 60ºC/min na presença dos mesmos (Devireddy et al., 2002). O período mais crítico para a formação de cristais de gelo é quando a temperatura se encontra entre os 0 e os -10ºC (Check et al., 1994), pelo que, a uma taxa de refrigeração ótima, o volume celular decresce para um conteúdo em água de 5 a 15%, situação em que se acredita contrariar a formação de gelo intracelular (Mazur, 1984).
Também durante o processo de descongelação de uma amostra existe o risco de ocorrer o fenómeno de recristalização que consiste na dissolução de cristais de menor dimensão com maior superfície energética e o crescimento de cristais de maior dimensão. Esta é a principal causa de lesão da MPE, pois os cristais de gelo intracelulares podem-se revelar inócuos se o processo de descongelação for suficientemente rápido (Mazur and
Schmidt, 1968). Em amostras descongeladas mais lentamente há morte celular por alterações nas propriedades intra- e extra-celulares derivadas da formação de gelo (concentração de solutos), para além da morte celular pela pré-existência de cristais de gelo intracelulares e consequente recristalização (Mazur et al., 1972). Isto sugere que o dano da MPE causado pela pressão do gradiente osmótico pode ser revertido se a recristalização de cristais de gelo que atravessa a membrana for evitada (Muldrew and McGann, 1990).
3. Contrastação Seminal
Quando se escolhe um garanhão para ser posto à reprodução, é imperativo que se avalie o seu potencial fecundante. A avaliação andrológica, também conhecida pela designação em língua inglesa de “Breeding Soundness Examination” (BSE) determina se o garanhão cumpre os requisitos necessários a uma fertilidade “adequada” no momento em que se realiza o exame. O BSE abrange aspectos que auxiliam na estimação do potencial fecundante do macho, incluindo a avaliação da libido, da capacidade de cópula, do tamanho testicular, da capacidade de produção espermática e da qualidade do sémen, o despiste de doenças infecto-contagiosas e, quando disponível, a anterior performance reprodutiva do animal (Hurtgen, 1992). Nesta avaliação, o exame clínico encontra-se aliado à análise de uma amostra seminal, que se inclui no denominado espermograma ou contrastação seminal. Rotineiramente, o espermograma consiste no acesso imediato ao volume, aspecto, concentração e motilidade, tal como uma avaliação morfológica e da presença ou não de células estranhas. No caso do sémen congelado, a avaliação de rotina integra apenas a avaliação da motilidade espermática (Rodríguez-Martínez, 2003).
Infelizmente, nem o espermograma simples nem a avaliação de rotina de sémen congelado serão suficientes para estimar o potencial fecundante do sémen analisado, particularmente depois da IA (Inseminação Artificial) (Rodríguez-Martínez, 2003). Isto deve-se ao fato de estas análideve-ses avaliarem apenas variáveis básicas de aparência/morfologia, motilidade e concentração espermática, mas não permitirem evidenciar detalhes estruturais, bioquímicos ou metabólicos. Também não analisam a capacidade do espermatozóide interagir com o meio ambiente, em termos de reatividade de membrana, nem analisam se a integridade do material genómico levado até ao gâmeta feminino durante a fecundação é suficiente para garantir o desenvolvimento de um embrião. Outro aspecto limitante é o fato de serem utilizadas pequenas subamostras em diferentes análises de um vasto e heterogéneo número de espermatozóides pertencentes a um ejaculado (Rodríguez-Martínez,
2007).
Por isso, têm vindo a ser introduzidos alguns testes analíticos adicionais para avaliação do sémen de equino, como sejam: a avaliação da responsividade do acrossoma (ARA – Acrosomal Responsiveness Assay) (Meyers et al., 1995); a avaliação da integridade da cromatina espermática (SCSA – Sperm Chromatin Structure Assay); a avaliação do potencial de membrana mitocondrial e da integridade da membrana plasmática (Love and Kenney, 1998; Love et al., 2003).
3.1. Avaliação da Integridade da MPE
A MPE desempenha funções cruciais na regulação da interação entre os gâmetas masculino e o feminino (Gadella et al., 2001). O dano da MPE resulta na perda irreversível de motilidade e/ou capacidade fecundante. Mesmo durante a ejaculação ou quando depositado no trato genital feminino, o espermatozóide está exposto a factores que afectam negativamente a membrana plasmática ou induzem a morte celular (Aurich, 2005). Assim, um método credível, repetível e com uma boa relação custo-eficiência na avaliação da integridade da MPE pode ser um bom auxiliar para uma estimativa mais real do potencial fecundante de uma amostra.
Uma variedade de testes tem sido utilizada para avaliar a integridade da MPE. Entre estes, os métodos que têm sido mais frequentemente aplicados em sémen de equino são: a coloração com eosina ou com uma solução de eosina e nigrosina (E-N), que apenas permite a distinção entre Spz vivos e mortos; a exposição a uma solução hipo-osmótica (HOST – Hypoosmotic Swelling Test); a coloração com produtos fluorescentes e sua avaliação sob microscopia de fluorescência ou por citometria de fluxo (Varner, 2008).
Para o sémen fresco de equino, a coloração com eosina-nigrosina apresentou uma boa correlação com a fluorescência medida por citometria de fluxo. No entanto, em sémen com níveis de integridade da MPE mais baixos (<80%) verifica-se que esta coloração tende a sobrestimar o número de “vivos” (Foster et al. 2011; Love 2012). Também o HOST apresentou uma correlação positiva com a avaliação da integridade de membrana através de sondas fluorescentes quantificada por citometria de fluxo (Adams and Love, 2009). De modo equivalente, a fertilidade em sémen congelado de garanhão está correlacionada com os resultados da técnica de fluorescência medida por citometria de fluxo (Wilhelm et al. ,1996) .
correlação e concordância entre as colorações vitais com E-N e sondas fluorescentes, provando que estes testes fornecem informação acerca do mesmo parâmetro espermático. Contudo, nesta espécie, os resultados do HOST mostraram uma correlação moderada mas uma fraca concordância com as colorações vitais (Brito et al., 2003). Sabe-se também que as lesões provocadas pela criopreservação na membrana plasmática da cabeça e da cauda do espermatozóide podem ocorrer de forma independente, ou seja a existência de uma membrana plasmática integra ao nível da cabeça não indica obrigatoriamente a existência de integridade da membrana plasmática da cauda (Zhu and Liu, 2000).
Testes de Viabilidade
A viabilidade espermática, estimada pela avaliação da integridade da MPE, pode ser determinada rotineiramente em todas as amostras, mas é particularmente importante em amostras que apresentem motilidade progressiva inferior a 40% (WHO, 2010). Segundo o manual da WHO (World Health Organization) este teste pode ainda confirmar a credibilidade dos resultados da avaliação da motilidade, uma vez que a percentagem de células com membrana “não-íntegra” não deve exceder a percentagem de espermatozóides imóveis; e a percentagem de células com membrana íntegra, regra geral, excede a da motilidade total (WHO, 2010). Isto pressupõe que um Spz móvel possui sempre a membrana íntegra, o que tem sido refutado em vários trabalhos. Kuisma et al. (2006), trabalhando em sémen congelado de equino, verificaram a ausência de correlação entre a motilidade e a integridade da MPE. Samper (1992, citado por Kuisma et al. 2006) detetou uma correlação extremamente baixa entre a motilidade e a integridade da MPE, particularmente em sémen preservado. Em contraste, num estudo feito em sémen fresco de equino foi encontrada uma correlação positiva entre a integridade da MPE e a motilidade total (Love et al., 2003). E o mesmo se verificou noutro estudo feito em sémen congelado de bovino, apesar de a correlação ter sido mais baixa (Estefânia et al., 2009).
Foi também demonstrado que é possível espermatozóides sem membrana plasmática apresentarem motilidade normal quando inseridos em meio adequado (Lindemann, 1978). Num estudo realizado por McLaughlin et al. (1992) em sémen de humanos, não foi encontrada uma correlação significativa entre a motilidade progressiva e a integridade da MPE, ficando claro que a lesão membranar não será o único processo envolvido na perda de motilidade. Isto foi posteriormente confirmado por Love et al. (2003), que demonstraram a existência de uma relação funcional do potencial de membrana mitocondrial com a motilidade. Porém, a energia necessária ao movimento flagelar provém
maioritária e imprescindivelmente da glicólise, contando com uma menor participação, não essencial, proveniente da fosforilação oxidativa dependente da mitocôndria (Mukai and Okuno, 2004). Kuisma et al. (2006) não observaram correlação entre a motilidade e a integridade da MPE em sémen de equino. Mais recentemente foi evidenciado que a motilidade total e a integridade de membrana deverão analisadas de forma independente (Foster et al. 2011). Assim, o termo “vitalidade” poderá não estar totalmente correto quando se fala de integridade da MPE.
Os testes de viabilidade espermática oferecem a vantagem de serem menos susceptíveis aos efeitos imediatos do choque térmico e de avaliarem espermatozóides isolados, ao invés de o fazerem numa população como um todo como é o caso da motilidade progressiva (Neild et al., 1999).
3.1.1. Coloração vital com Eosina/Eosina-Nigrosina
Com o teste de coloração com eosina ou com uma solução de eosina- -nigrosina é possível obter informações acerca da integridade estrutural da MPE (Bassiri et al., 2013), de uma forma simples e económica (Foster et al., 2011a). Esta técnica tem sido amplamente utilizada em sémen de várias espécies de mamíferos (Jeyendran et al. 1984; Bjorndahl 2003; Buckett 2003; So et al. 2004; Estefânia et al. 2009; WHO 2010).
Este teste baseia-se na utilização de um corante, como a eosina, que marca células mortas ou com lesão membranar que pode ser utilizado em associação com um corante de fundo (nigrosina), para aumentar o contraste entre as células não coradas ou fracamente coradas num campo claro. Deste modo, os espermatozóides com membrana plasmática intacta não coram pela eosina, pois a membrana não permite a entrada do corante, contrastando com os espermatozóides que apresentam a membrana plasmática da região pós-acrossomal lesada e que permitem a entrada do corante, que se liga e cora o ADN da célula, dando à célula uma cor rosada. Este método não avalia a integridade da membrana plasmática nas porções que recobrem o acrossoma ou a peça principal do flagelo (So et al. 2004; Mocé & Graham 2008).
Foram propostos vários protocolos para a utilização da solução de eosina-nigrosina para avaliar a viabilidade, sendo que uma das variantes consiste na utilização de uma técnica de um ou dois passos. A técnica de um passo pressupõe a utilização de uma solução pré-elaborada dos dois corantes, enquanto que na técnica de dois passos as soluções de eosina e de nigrosina são elaboradas em separado; neste último caso, a
solução que primeiro entra em contacto com sémen é a solução de eosina (revisto por So et al. 2004). A WHO recomenda a utilização da técnica de um passo para a análise de sémen de humano (WHO, 2010).
3.1.2. Teste de Coloração com Sondas Fluorescentes
A técnica de fluorescência obedece a um princípio semelhante ao da técnica anterior, em que são usados corantes impermeáveis à membrana por forma a avaliar a integridade estrutural da célula. Células capazes de excluir estes corantes são consideradas como células com membrana plasmática íntegra. Uma série de sondas com afinidade para o ADN e com diferentes comprimentos de onda de excitação e emissão têm sido utilizadas com este propósito (Silva and Gadella, 2006). Estas sondas são: Hoechst 33258; YoPro-1; PI (Iodeto de Propídio); EH (Etídio Homodimérico-1), EB (Brometo de Etídio), ToPro-3 (Monómero de Iodeto de Benzotiazólio-4-quinolínio) e TOTO (dímero de cianina) (Farah et al. 2013).
Como alternativa às anteriores, ou aplicadas em simultâneo, podem ser também utilizadas sondas aciladas. Estes corantes são anfipáticos, o que lhes confere a capacidade de ultrapassar a MPE intacta. Depois de entrar para o interior da célula espermática, a sonda é desacilada por esterases intracelulares tornando-se impermeável à membrana. Assim, espermatozóides que possuam a membrana plasmática intacta ficam carregados de corante, que ficou aprisionado no seu interior. No caso de espermatozóides com a membrana plasmática lesada, o corante escapa facilmente para o exterior da célula (Silva and Gadella, 2006). Entre estes encontram-se: Hoechst 33342 (Tardif et al., 1998); CFDA (Diacetato de Carboxifluoresceina); CAM (Ester de Acetoximetilcalceína); SYTO-1 e SYBR-14 (Farah et al., 2013);
A peroxidação lipídica liberta da membrana ácidos gordos polinsaturados que são utilizados como substrato para a produção de ROS e de radicais hidroxilo. A deteção da peroxidação lipídica através da utilização de sondas fluorescentes pode assim refletir o estado funcional da membrana. Esta avaliação pode ser realizada usando uma molécula específica (C11-BODIPY), que altera cor da fluorescência que emite, de vermelho para verde, quando entra em contacto com agentes oxidantes (Brouwers et al., 2005; Drummen et al., 2004).
Os espermatozóides corados com sondas fluorescentes são avaliados sob microscopia de fluorescência, método que requer um microscópio especializado, ou por