UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
ESTUDO DE CASOS SUSPEITOS DE INTOXICAÇÃO POR RODENTICIDAS ANTICOAGULANTES EM CÃES
DISSERTAÇÃO DE MESTRADO INTEGRADO EM MEDICINA VETERINÁRIA
LAURA ALMEIDA FELÍCIO
ORIENTADOR: Professor Doutor José Manuel Almeida Universidade de Trás-os-Montes e Alto Douro
COORIENTADOR: Professora Doutora Justina Prada Oliveira Universidade de Trás-os-Montes e Alto Douro
iii
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
ESTUDO DE CASOS SUSPEITOS DE INTOXICAÇÃO POR RODENTICIDAS ANTICOAGULANTES EM CÃES
DISSERTAÇÃO DE MESTRADO INTEGRADO EM MEDICINA VETERINÁRIA
LAURA ALMEIDA FELÍCIO
COMPOSIÇÃO DO JÚRI: PRESIDENTE:
Doutor Carlos Alberto e Silva Venâncio, Professor Auxiliar do Departamento de Zootecnia da Universidade de Trás-os-Montes e Alto Douro.
VOGAIS:
Doutora Ana Cristina Silvestre Ferreira, Professora Auxiliar do Departamento de Ciências Veterinárias da Universidade de Trás-os-Montes e Alto Douro;
Doutor José Manuel de Melo Henriques de Almeida, Professor Auxiliar do Departamento de Ciências Veterinárias da Universidade de Trás-os-Montes e Alto Douro.
v DECLARAÇÃO
Nome: Laura Almeida Felício C.C.: 14396614
Telemóvel: (+351) 964786048
Correio eletrónico: laura.afelicio@gmail.com
Designação do mestrado: Mestrado Integrado em Medicina Veterinária
Título da dissertação de Mestrado em Medicina Veterinária: Estudo de casos suspeitos de intoxicação por rodenticidas anticoagulantes em cães
Orientador: Professor Doutor José Manuel de Melo Henriques de Almeida Co-Orientador: Professor Doutora Justina Prada Oliveira
Ano de conclusão: 2018
Declaro que esta dissertação de mestrado é resultado da minha pesquisa e trabalho pessoal sob orientação do meu supervisor. O seu conteúdo é original e todas as fontes consultadas estão devidamente mencionadas no texto e na bibliografia final. Declaro ainda que este trabalho não foi apresentado em nenhuma outra instituição para obtenção de qualquer grau académico.
Vila Real, junho de 2018, Laura Almeida Felício
vii
“If you can't be a pine on the top of the hill, Be a scrub in the valley — but be The best little scrub by the side of the rill; Be a bush if you can't be a tree. If you can't be a bush be a bit of the grass, And some highway happier make; If you can't be a muskie then just be a bass — But the liveliest bass in the lake! We can't all be captains, we've got to be crew, There's something for all of us here, There's big work to do, and there's lesser to do, And the task you must do is the near. If you can't be a highway then just be a trail, If you can't be the sun be a star; It isn't by size that you win or you fail — Be the best of whatever you are!”
ix AGRADECIMENTOS
Um agradecimento à Mui Nobre Academia de Trás-os-Montes e Alto Douro, pela possibilidade de ter usufruído de um ensino de qualidade ao longo destes maravilhosos anos.
Ao meu orientador, Professor Doutor José Manuel Almeida, muito obrigada por ter aceite fazer parte deste projeto de forma inesperada. Obrigada, também, por todo o apoio, motivação e crítica construtiva com que me habituou nos últimos tempos. Por último, obrigada por nunca me deixar desamparada.
À minha co-orientadora, a Professora Doutora Justina Prada, obrigada por todas as gargalhadas, por todo o apoio e por me ter deixado sempre voar à minha maneira, até encontrar o meu caminho.
Um obrigada enorme a toda a equipa do Hospital Veterinário do Baixo Vouga, que me acolheu de braços abertos e me ensinou tudo o que podia, e que me deixaram cheia de saudades desde o primeiro minuto em que terminou o estágio. Um sentido agradecimento, também, à maravilhosa equipa de estagiários que me acompanhou nesta etapa.
À Associação de Estudantes de Medicina Veterinária da Universidade de Trás-os-Montes e Alto Douro, que me deu muito mais do que aquilo que eu retribuí. A todos os membros que por lá passaram e com quem tive o prazer de privar, de trabalhar e de me rir com muita vontade, obrigada do tamanho do mundo e um desejo de que tenham guardado tão boas recordações como eu guardei.
Aos meus amigos de Caminha, que me acompanharam antes desta etapa e ainda continuam a acompanhar. Um obrigada especial à Raquel, pela paciência que teve comigo enquanto escrevia este trabalho!
Aos amigos-família que Vila Real me deu… Aqueles que são tanto o meu maior apoio como o meu maior orgulho!
Um obrigada especial ao Rui e à Inês, os padrinhos da Universidade. Vocês são o meu exemplo do melhor que se pode ser como pessoa e como médico veterinário.
Também quero agradecer a todos os animais da minha vida, àqueles a quem posso chamar a minha família de quatro patas (e a de penas, como o Nico e o Chester!), que tornam o “fardo” menos difícil de suportar! E, embora ele (ainda) não saiba ler, obrigada especialmente ao Sir Félix, a minha dose diária de amor felino.
Por último, mas não menos importante… Um grande agradecimento à minha família. Obrigada do tamanho do mundo aos meus irmãos, pais, tios, primos e, claro, à minha maravilhosa avó! Aos que, do Minho ao Algarve, me apoiaram sempre incondicionalmente e me deram a liberdade para eu crescer e me tornar a pessoa que sou hoje.
xi RESUMO
O recurso a rodenticidas tem sido frequente, desde a antiguidade, como forma de controlar pragas de roedores por todo o mundo. As opções que surgiram nas últimas décadas, como é o caso dos rodenticidas anticoagulantes, preocupam a comunidade veterinária, uma vez que a sua utilização no contexto urbano poderá promover intoxicações em animais como cães e gatos. Quando ocorre uma intoxicação, verifica-se um bloqueio do ciclo da vitamina K, associado à não ativação dos fatores de coagulação inativos dela dependentes e consequente depleção dos fatores funcionais ainda em circulação. Desta forma, o quadro típico apresentado pelos animais é de carácter hemorrágico e os sinais clínicos que surgirão serão, por norma, desta natureza. Uma desvantagem de uma intoxicação desta magnitude prende-se com a impossibilidade de a diagnosticar, com certeza irredutível, em meio clínico-hospitalar, sendo só possível fazê-lo recorrendo a laboratórios especializados. Quando em meio hospitalar, as provas de coagulação são a ferramenta mais credível para um diagnóstico presuntivo. O tratamento instituído engloba a estabilização do animal, a administração de vitamina K1 e de produtos sanguíneos que contenham os fatores de coagulação dependentes da vitamina K, apesar de haver outras possibilidades de tratamento mais recentes que têm vindo a surgir em medicina veterinária. Quando diagnosticada precocemente, uma intoxicação por rodenticidas anticoagulantes tem um prognóstico muito favorável. No entanto, este prognóstico poderá não ser tão positivo quando associado a limitações económicas ou quando o quadro hemorrágico já comprometeu a estabilidade circulatória do animal, o tratamento poderá não ser eficaz e o animal acabar por não sobreviver.
Palavras-chave: Rodenticidas anticoagulantes, Ciclo da vitamina K, Vitamina K epóxido redutase, Cascata de coagulação, Intoxicação, Transfusão sanguínea
xiii ABSTRACT
The use of rodenticides has been a common practice since ancient times to control rodent plagues all around the world. The most recent options, such as the anticoagulant rodenticides, represent a concern for the veterinary community since they may lead to the intoxication of animals such as dogs and cats. When an intoxication occurs, there is a blockage of the vitamin K’s cycle due to the non-activation of the inactive vitamin K dependent coagulation factors and consequently a depletion of the functional factors still in circulation occurs. Thus, the typical symptoms shown by the animals usually have an haemorrhagic character. One main issue of an intoxication of this magnitude is the impossibility of diagnosing it, with high level of certainty, in an every-day environment, with that only being possible to do so in specialized labs. When in an hospital environment, the coagulation tests are the most reliable tool for a presumptive diagnosis. Regarding the treatment, usually it includes the animal’s stabilization, administration of vitamin K1 and blood products which contain the vitamin K dependent coagulation factors, although new possibilities are appearing in veterinary medicine. When precociously diagnosed, an anticoagulant rodenticide intoxication has a very favourable prognosis. However, it may not be as positive when associated with economic limitations or when the coagulopathy has already compromised de circulatory stability of the animal threatening the efficiency of the treatment and thereby jeopardizing the animal’s survival.
Key words: Anticoagulant rodenticides, vitamin K cycle, vitamin K epoxide reductase, coagulation cascade, intoxication, blood transfusion
xv ÍNDICE
I - INTRODUÇÃO ... 1
II - REVISÃO BIBLIOGRÁFICA ... 3
PRIMEIRA PARTE - RODENTICIDAS NÃO ANTICOAGULANTES ... 3
SEGUNDA PARTE - RODENTICIDAS ANTICOAGULANTES ... 7
1) RODENTICIDAS ANTICOAGULANTES DE PRIMEIRA GERAÇÃO ...10
2) RESISTÊNCIAS DE ROEDORES A RODENTICIDAS DE PRIMEIRA GERAÇÃO ...11
3) RODENTICIDAS ANTICOAGULANTES DE SEGUNDA GERAÇÃO ...12
4) INANDIONAS ...14
5) APRESENTAÇÃO DE RODENTICIDAS ANTICOAGULANTES EM PORTUGAL ...15
6) CONSEQUÊNCIAS PARA AS ESPÉCIES NÃO ALVO – MEIO RURAL E URBANO ...16
7) FORMAS DE INTOXICAÇÃO ...18
8) MECANISMO DE AÇÃO, TOXICOCINÉTICA E TOXICIDADE ...19
9) SINAIS CLÍNICOS ...25 10) DIAGNÓSTICOS DIFERENCIAIS ...27 11) DIAGNÓSTICO ...28 11.1) ALTERAÇÕES LABORATORIAIS ...28 A) HEMATOLOGIA ...28 B) BIOQUÍMICA SÉRICA ...29 C) ANÁLISE DE URINA ...29 D) PERFIL DE COAGULAÇÃO ...29 E) TOXICOLOGIA ANALÍTICA ...31
11.2) MEIOS AUXILIARES DE DIAGNÓSTICO ...36
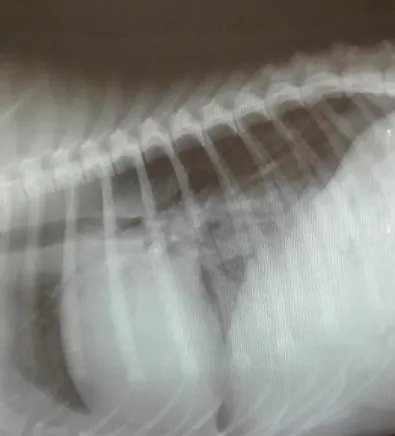
A) RADIOGRAFIA TORÁCICA E ABDOMINAL ...36
B) ECOGRAFIA DE URGÊNCIA – UTILIZAÇÃO DE AFAST E TFAST ...36
11.3) DIAGNÓSTICO PÓS-MORTE ...39
12) TRATAMENTO E ESQUEMAS TERAPÊUTICOS ...41
12.1) ANIMAIS ASSINTOMÁTICOS ...41
xvi
A) TRATAMENTO GERAL COMUM ...44
B) TRATAMENTO ESPECÍFICO ...45
B.1) TRANSFUSÃO SANGUÍNEA ...45
B.2) VITAMINA K1...50
C) NOVAS ABORDAGENS EXPERIMENTAIS ...52
C.1) EMULSÕES LIPÍDICAS INTRAVENOSAS: ...52
C.2) HEMODIÁLISE INTERMITENTE E TERAPIA DE SUBSTITUIÇÃO RENAL CONTÍNUA (DO INGLÊS CONTINUOUS RENAL REPLACEMENT THERAPY (CRRT)) ...55
13) PROGNÓSTICO ...58
14) PREVENÇÃO E NOVAS POSSIBILIDADES DE RODENTICIDAS ...59
III - MATERIAIS E MÉTODOS ...63
IV - RESULTADOS ...67
V - DISCUSSÃO...83
VI - CONCLUSÃO ...97
BIBLIOGRAFIA ...99
ANEXO 1 – ATIVIDADES REALIZADAS DURANTE O PERÍODO DE ESTÁGIO CURRICULAR ... 113
ANEXO 2 – DEFINIÇÕES E NOÇÕES DE TOXICOLOGIA ... 114
ANEXO 3 – AS MOLÉCULAS ANTICOAGULANTES E AS SUAS DOSES LETAIS ... 115
ANEXO 4 – MOLÉCULAS RODENTICIDAS, O SEU MECANISMO DE AÇÃO E A SUA VALIDADE HISTOLÓGICA ... 116
xvii ÍNDICE DE FIGURAS
Figura 1 – Estrutura química das moléculas warfarina, difacinona e da vitamina K1, da esquerda para a direita (Pelfrène, 1991). ... 9 Figura 2 - Cascata de coagulação - nomenclatura não atual. Estão sublinhados os fatores de coagulação dependentes da vitamina K e está presente o fator III como fator iniciador da cascata de coagulação (Gibson, 2013) ...19 Figura 3 - Estrutura química dos diferentes tipos de vitamina K (Ferland, 2012) ...21 Figura 4 - Ciclo da vitamina K (adaptado de Ishizuka 2008; Ferland 2012; Brown, 2015). ...22 Figura 5 - Possíveis sinais clínicos apresentados pelo animal numa intoxicação por RA (adaptado de DeClementi, 2012; Waddell, 2013; Bates, 2016) ...25 Figura 6 – Possíveis alterações nos parâmetros bioquímicos do animal intoxicado, sendo que a coluna da esquerda engloba os parâmetros que poderão estar aumentados e a coluna da direita aqueles que poderão estar diminuídos relativamente aos seus valores de referência (Valchev et al., 2008) ...29 Figura 7 - Diferenças dos tempos de protrombina e tromboplastina parcial ativado consoante o método de armazenamento da amostra, segundo aqueles descritos pelos laboratórios IDEXX (Valchev, 2006; Jolivet, 2017; Gibson, 2013; Kirby, 2015) ...30 Figura 9 - Esquema cronológico para a realização de provas de coagulação de animais suspeitos de terem ingerido RA. ...31 Figura 10 - Efusão pleural num dos animais do estudo. Imagem cedida por HVBV. ...36 Figura 11- Imagens dos quatro pontos de ecografia de urgência AFAST (Lisciandro, 2009) 37 Figura 12 – Vómito de um dos cães deste trabalho, cuja emese foi induzida com recurso a peróxido de hidrogénio. ...42 Figura 13 - Diagrama que relaciona a possibilidade de ocorrência destas três variáveis em simultâneo ou singularmente (Davis, 2013) ...44 Figura 14 - Exemplo de um teste de tipificação comercializado em Portugal. ...47 Figura 15 - Equação que nos indica qual o volume que deverá ser infundido num animal quando utilizando sangue inteiro (Manual de Hemoterapia, Banco de Sangue Animal) ...47 Figura 16 - Equação que nos indica qual o volume que deverá ser infundido num animal quando utilizando plasma (Manual de Hemoterapia, Banco de Sangue Animal) ...48 Figura 17 - Uma das apresentações de vitamina K em comprimidos comercializada em Portugal. ...50 Figura 18 - Linhas de orientação para a utilização de emulsões lipídicas intravenosas em animais com sinais de neurotoxicidade, adaptadas de protocolos de medicina humana (Robben, 2017). ...54 Figura 19 – Legenda da análise de um gráfico do programa JMP. ...64
xix ÍNDICE DE TABELAS
Tabela 1 - Tempo de semi-vida no plasma dos fatores de coagulação dependentes da vitamina K1 (adaptado de Wittkowsky, 2003; Murphy and Talcott, 2015) ...23 Tabela 2 - Diferenças de parâmetros laboratoriais em várias coagulopatia (Bates, 2016) ....27 Tabela 3 - Elementos sanguíneos utilizados mais frequentes e a sua constituição (adaptado de Banco de Sangue Animal, 2015 e Yagi, 2016) ...50 Tabela 4 – Tempo de semi-vida no plasma de vários rodenticidas (adaptado de Vandenbroucke et al., 2008 Pelfrène, 2010; Ware et al., 2015) ...51 Tabela 5 - Coeficiente de partição de vários RA (adaptado de Ruiz-Suárez, 2014) ...53 Tabela 6 - Moléculas que poderão ser eliminadas do organismo utilizando emulsões lipídicas intravenosas pela sua lipossolubilidade (adaptado de Fernandez, 2011) ...53 Tabela 7 – Peso molecular de vários rodenticidas (adaptado de Pelfrène, 1991) ...57 Tabela 8 - Classificação e doses letais 50 das várias moléculas anticoagulantes (adaptado de Valchev et al., 2008; Merola, 2002; Bates, 2016). ... 115 Tabela 9 - Indicações para suspeitas de intoxicações por rodenticidas, com as respetivas indicações de testes a realizar (adaptado de Gwaltney-Brant, 2016) ... 116
xxi ÍNDICE DE GRÁFICOS
Gráfico 1 – Distribuição da amostra em função do género (n=40). ...67 Gráfico 2 – Caracterização da amostra consoante as raças presentes na população (n=40). ...68 Gráfico 3 – Caracterização da amostra em função da idade (n=40). ...68 Gráfico 4- Caracterização da amostra em função do peso (n=28). ...69 Gráfico 5 - Distribuição dos sinais clínicos apresentados pela população em estudo e as suas relações (n=23). ...70 Gráfico 6 - Distribuição da população relativamente ao princípio ativo envolvido (n=40). ...71 Gráfico 7 – Distribuição da população relativamente à estação do ano em que as suspeitas de intoxicação ocorreram (n=40). ...71 Gráfico 8 – Distribuição da amostra relativamente à frequência e local onde foi realizada a indução de emese (n=40). ...72 Gráfico 9 - Distribuição, por intervalos, dos valores dos primeiros testes de protrombina realizados pelos animais pertencentes à população (n=38). ...73 Gráfico 10 – Resultados dos tempos de protrombina realizados ao grupo de animais com sinais clínicos (n=20). ...73 Gráfico 11 - Resultados dos tempos de protrombina realizados ao grupo de animais sem sinais clínicos (n=18). ...74 Gráfico 12 - Distribuição, por intervalos, dos valores dos primeiros tempos de tromboplastina parcial ativados realizados pelos animais pertencentes à população (n=24). ...74 Gráfico 13 - Resultados dos tempos de tromboplastina parcial ativada realizados ao grupo de animais com sinais clínicos (n=15). ...75 Gráfico 14 - Resultados dos tempos de tromboplastina parcial ativada realizados ao grupo de animais sem sinais clínicos (n=10). ...75 Gráfico 15 – Exames complementares realizados aos animais deste estudo e as relações entre estes. ...76 Gráfico 16 – Relação entre animais em que foi realizada drenagem pleural por toracocentese (n=7). ...77 Gráfico 17 – Distribuição da população quanto à necessidade de internamento (n=40). ...77 Gráfico 18 - Distribuição da amostra relativamente à realização de transfusão sanguínea (n=40)...78 Gráfico 19 - Distribuição da amostra consoante a escolha da via de administração da vitamina K (n=33) ...79 Gráfico 20 – Distribuição por classes de cinco dias relativas à duração da terapia de vitamina K1 oral consoante os grupos de animais. A linha azul é referente aos animais que não
xxii
apresentavam sinais clínicos; a linha cor-de-laranja são os animais que apresentavam sinais clínicos e a linha verde é o total dos animais que realizaram esta terapia. ...80
xxiii LISTA DE ABREVIATURAS
AFAST – Abdominal focused assessment with sonography for trauma AFS – Abdominal fluid scoring
ATP – Adenosina trifosfato
CCF – Cromatografia de Camada Fina CG – Cromatografia Gasosa
CID – Coagulação Intravascular Disseminada
CLEP – Cromatografia Líquida de Elevada Performance CP – Coeficiente de Partição
CRRT – Continuous Renal Replacement Therapy dl – Decilitro
DL50 – Dose Letal 50
E.U.A. – Estados Unidos da América IV – Intravenoso
Kg – Quilograma mg – Miligrama ºC – Graus Celsius
PDF’s – Produtos da degradação do fibrinogénio RA – Rodenticidas Anticoagulantes
SNC – Sistema Nervoso Central
TFAST – Thoracic focused assessment with sonography for trauma TP – Tempo de Protrombina
TTPA – Tempo de Tromboplastina Parcial Ativado UV – Ultravioleta
VIS – Visível
VKOR – Enzima Vitamina K Epóxido Redutase
1 I - INTRODUÇÃO
A temática abordada neste trabalho foi alvo do interesse da autora ao longo do estágio curricular desenvolvido no Hospital Veterinário do Baixo Vouga, em Águeda, entre os meses de setembro de 2016 e janeiro de 2017, apesar de terem sido adquiridas outras competências na área dos animais de companhia, como pode ser verificado no anexo 1, na forma de tabela de casuística. Face a um número elevado de suspeitas de intoxicações por rodenticidas anticoagulantes (RA), e tendo em conta a literatura disponível, o objetivo do trabalho é verificar quais as abordagens diagnósticas e as terapêuticas instituídas aos animais em que existia a suspeita de intoxicação por RA e compará-las com a informação descrita na literatura, bem como abordar alternativas e novas visões neste campo. Este documento foi elaborado com recurso à Norma Portuguesa 405 para gestão de elementos bibliográficos contidos na referência bibliográfica.
O uso de rodenticidas remonta há, pelo menos cinco séculos, desde a utilização das sementes da árvore Strychnos nux-vomica, ricas em estricnina (Gupta 2007). Tal facto não será de estranhar uma vez que, atualmente, os roedores são responsáveis pela destruição de cereais que poderiam alimentar cerca de seiscentos milhões de pessoas por ano, por alterações em ecossistemas, sendo também vetores de doenças e responsáveis pela destruição de estruturas elétricas e eletrónicas, causando grandes danos materiais e económicos. Por estas razões, é necessário o controlo ou erradicação das suas populações, sendo que a utilização de iscos com rodenticidas é das formas de controlo de populações de roedores mais comum (Buckle e Fenn, 1992; Meerburg, Singleton e Kijlstra, 2009; Banks e Hughes, 2012; Bertolino e Lurz, 2013; Capizzi, Bertolino e Mortelliti, 2014; Bordes, Blasdell e Morand, 2015; Goulois et al., 2016; Krücken et al., 2017). As espécies mais comuns de roedores são: o Rattus rattus, o Rattus norvegicus e o Mus musculus, que se pensa serem originárias do continente asiático e subsequentemente terão sido dispersas para o resto do globo pelo transporte humano, essencialmente por via marítima (Buckle e Fenn, 1992; Capizzi, Bertolino e Mortelliti, 2014; Suzuki et al., 2013, 2015).
Desta forma, não é de estranhar que o controlo de roedores seja essencial, sendo os três métodos mais comuns de controlo, por ordem de importância, os envenenamentos, as armadilhas e o maneio ambiental. No caso dos venenos utilizados, os rodenticidas anticoagulantes e não anticoagulantes são os mais comuns. No entanto, e é importante ressalvar este facto, vários autores informam que, apesar de muito comuns, os RA ainda não são utilizados por muitos agricultores de países em desenvolvimento porque estes não têm acesso aos mesmos, o que condiciona o seu uso nestes locais (Capizzi, Bertolino e Mortelliti,
2
2014). Relativamente à sua permanência no organismo ou à sua semi-vida (consultar anexo 2 para definições e noções de toxicologia), Crowell et al. (2013) agruparam as moléculas utilizadas como pesticidas naquelas que são rapidamente eliminadas (horas a dias), moderada a lentamente eliminadas (dias a meses) e muito lentamente eliminadas (vários meses). Ao primeiro grupo pertencem, entre outros compostos, o fosfato de zinco, o nitrito de sódio e o fluoroacetato de sódio. No segundo grupo, por sua vez, estão presentes a pindona, a difacinona, o coumatetralilo e o colecalciferol. Por último, estão no grupo da eliminação muito lenta no organismo o brodifacum e a bromadiolona.
A contrabalançar a utilidade destes compostos existe o problema associado aos seus efeitos tóxicos, uma vez que há estudos que, por exemplo, nos E.U.A., os pesticidas estão na origem de 13% das causas de intoxicações e que, dentro dos pesticidas, os rodenticidas são os terceiros mais frequentes (Mahdi e Van der Merwe, 2013). As características de um rodenticida também são enunciadas por Witmer et al. (2014), sendo que um composto desta natureza deverá cumprir os seguintes requisitos:
- ter elevada toxicidade ; - ser espécie-específico; - ser palatável;
- ter diminuído risco para humanos; - não criar resistências;
- ser de ação rápida; - não causar dor;
- não ser bio-cumulativo; - ser estável na forma de isca; - existir um antídoto;
- ser registável; - ser económico.
3 II - REVISÃO BIBLIOGRÁFICA
PRIMEIRA PARTE - RODENTICIDAS NÃO ANTICOAGULANTES
Ao longo dos anos, várias moléculas foram utilizadas com o objetivo de controlarem as populações de roedores. O exemplo mais primordial é o da drímia marítima, vulgarmente conhecida como cebola marítima e cujo nome científico é Urginea maritima, uma planta proveniente da zona do mar Mediterrâneo (Verbiscar, Banagan e Gentry, 1986). Embora existam registos da sua utilização como medicamento desde os tempos medievais, por egípcios e por gregos, a sua utilização como rodenticida só está documentada a partir dos séculos XVII e XVIII (Gratz, 1973; Tuncok et al., 1995). Outra molécula com lugar na história dos rodenticidas é a estricnina que, como já foi referido, tem origem nas sementes de plantas do género Strychnos nux-vomica. O seu uso como veneno para mamíferos e aves remonta o século XVIII, mas a sua diminuída palatibilidade comprometeu o seu uso, uma vez que os roedores preferem evitar ingeri-la (Gratz, 1973). Outro exemplo com caráter histórico é a crimidina, que foi criada e utilizada como rodenticida durante a II Guerra Mundial, mas não se verificou ser superior aos rodenticidas existentes no mercado; no entanto, o interesse nela prendeu-se com o facto de ser o antídoto do pentobarbital sódico, até mesmo em animais que consumiram até dez vezes a dose letal 50 (DL50) (Gratz, 1973).
O fluoroacetato de sódio foi criado pela entidade americana Fish and Wildlife of the Department of the Interior, com o número de série laboratorial “1080”, tendo sido comercializado em 1946 como um rodenticida (Kalmbach, 1945; Proudfoot, Bradberry e Vale, 2006). Tem sido um composto utilizado desde o meio do século vinte como controlo de espécies invasoras na Nova Zelândia (nomeadamente de Trichosurus vulpecula), realizado por aspersão aérea; na Austrália, é mais utilizado para controlo de lagomorfos e nos EUA é usado para controlo de coiotes (Green, 2014; Proudfoot, Bradberry e Vale, 2006). Na atualidade, a importância desta molécula é reconhecida, não como um rodenticida, mas sim como um possível marcador de alterações do metabolismo cerebral (Muir, Berl e Clarke, 1986; Ouyang et al., 2014). O composto é absorvido no trato gastrointestinal e distribuído rapidamente pelos tecidos, e o seu mecanismo de ação vai atuar no ciclo de Krebs dos animais intoxicados (Proudfoot, Bradberry e Vale, 2006).
A norbomida é outra molécula que tem sido utilizada como rodenticida. Segundo alguns autores, não tem efeitos em humanos, cães ou outros mamíferos em doses inferiores a 1000 mg/kg, tendo uma DL50 muito baixa para a espécie Rattus norvegicus, de cerca de 12 mg/kg, sendo superior para outras espécies de roedores. No entanto, como é tão específico para esta espécie, não é um composto a considerar quando se fala de erradicação de
4
populações de roedores heterogéneas, que sejam constituídas por várias espécies (Gratz, 1973). Embora este composto seja eficaz e mortal quatro horas após a ingestão de uma dose letal, alguns estudos de campo suportam a teoria de que os roedores conseguem identificar e, consequentemente, evitar a ingestão do composto (Gratz, 1973).
O fosfato de zinco inorgânico era considerado, na década de 1980, um bom rodenticida, por ser de baixo valor económico e bastante seguro, tanto para o manipulador, como para as espécies não-alvo, embora seja menos eficaz do que outros compostos como o tálio (Gratz, 1973; Marsh, 1987). O seu mecanismo de ação não é inteiramente conhecido, havendo várias hipóteses em aberto, mas sabe-se que ocorre a interação entre o fosfeto e o ar presente nos grãos de veneno, libertando-se fosfina (PH3), que é o pesticida ativo. Esta libertação ocorre de forma ainda mais vigorosa quando em contacto com meio ácido, como é o caso do estômago. O gás libertado é absorvido pela mucosa gástrica e distribuído pelos tecidos, sendo excretado na urina. Os sinais clínicos principiam quinze minutos a quatro horas após a ingestão, mas poderão demorar mais tempo e serão, por norma, gastrointestinais. Os órgãos de metabolização rápida são aqueles que são afetados primariamente, como é o caso do fígado, do coração e do cérebro. Em doses letais ocorre hemólise, icterícia hemolítica, edema pulmonar e obstrução renal por metabolitos resultantes da hemólise, bem como letargia, coma e morte súbita. O próprio zinco, por ser um metal, poderá causar efeito corrosivo, podendo haver vómito, hematoquésia ou anorexia. Intoxicações com fosfato de zinco ou de alumínio têm duas formas distintas: direta por ingestão de sais e indireta por inalação da fosfina na sua forma gasosa (Peoples, 1970; Proudfoot, 2009; Gray et al., 2011).
O tálio é um rodenticida com elevada eficácia, descoberto em 1961, com efeitos cumulativos e bastante potente, até para espécies não alvo. Normalmente utilizado sob a forma de sais, é inodoro e não absorvido por via cutânea, pelo que a sua letalidade é pouco percetível, tendo já sido banido de vários países (Gratz, 1973; Marmo et al., 1983). Em intoxicações agudas, poderão ocorrer arritmias por hipotensão e hipertensão, uma vez que ocorre deterioração do sistema nervoso autónomo. Também poderão ocorrer alterações gastrointestinal, dificuldade motoras e falência respiratória. Em doses subletais, desenvolvem-se zonas de alopécia acompanhadas por locais de hiperémia (Peoples, 1970; Marmo et al., 1983).
Já a terminar a apresentação das moléculas mais importantes no campo dos rodenticidas não anticoagulantes, é de referir a importância de duas moléculas que poderão emergir no futuro, a brometalina e o calciferol. Uma vez que os RA de segunda geração foram proibidos em países como os E.U.A., é expectável que intoxicações com estes compostos aumentem substancialmente. Esta tendência já foi observada em estudos da ultima década, como é o estudo de McLean et al. (2012), em que se notou um aumento de intoxicações por
5
calciferol, possivelmente associado à popularidade crescente da vitamina D em humanos e consequente existência do mesmo em ambiente doméstico (DeClementi e Sobczak, 2012; McLean e Hansen, 2012).
A brometalina foi desenvolvida com o objetivo de atuar em roedores resistentes a RA (Dreikorn e O’Doherty, 1984). É um composto lipossolúvel, rapidamente absorvido após ingestão, que realiza o ciclo entero-hepático e atravessa a barreira hemato-encefálica, sendo metabolizada pelas enzimas citocromo P450 para a sua forma ativa, o metabolito desmetilbrometalina. Este impede a realização da fosforilação oxidativa por parte da mitocôndria, levando a uma diminuição da adenosina trifosfato (ATP) disponível. Consequentemente, a bomba de sódio e de potássio falha, uma vez que esta é ATP-dependente, resultando em aumentos significativos da concentração de sódio a nível intracelular. Estes aumentos traduzem-se em edemas celulares, uma vez que ocorre transporte passivo de água para o interior da célula por ação da membrana plasmática. Um aumento de volume desta magnitude poderá ser suportado pelos outros grandes sistemas, mas a apresentação anatómica do sistema nervoso não permite a sua expansão, resultando em edema intra-mielínico e num aumento da pressão intracraniana, culminando em sintomatologia neurológica e morte. A causa mais comum de morte é a paralisia respiratória, por diminuída transmissão nervosa do SNC para os centros respiratórios (Lier, van e Cherry, 1988; Peterson e Talcott, 2013; Bates et al., 2015). A sua semi-vida, em situações laboratoriais, é de, aproximadamente, seis dias, sendo expectável que, em animais que tenham ingerido uma dose superior à sua DL50, os sinais clínicos surjam num período de vinte e quatro horas. (Lier, van e Cherry, 1988; Dorman, 1990).
Embora não haja um tratamento ideal para intoxicações por esta molécula, o mais adequado é realizar tratamento de suporte e diminuir a absorção gastrointestinal do composto. Isto engloba o uso de carvão ativado, podendo seguir as recomendações da Sociedade Americana para a Prevenção da Crueldade Animal, divisão de Controlo de Envenamento Animal (Animal Poison Control - American Society for the Prevention of Cruelty to Animals), uma vez que o composto é lipossolúvel e faz ciclo entero-hepático. As convulsões, caso existam, poderão ser controladas com diazepam intravenoso (IV; 1-2 mg/kg) ou fenobarbital (IV; 5-15 mg/kg) (Peterson, 2013; Ramsey, 2014; Bates et al., 2015).
Por último, far-se-á referência ao composto calciferol como um rodenticida. É curioso referir que esta molécula parece ter uma diminuída ação secundária em cães, pelo que o seu uso se revela seguro em locais onde os canídeos possam ter contacto com carcaças envenenadas (C. Eason et al. 2010). Assim, a sua DL50 em cães é 0,62-35,9 mg/kg e gatos é 4,1-5,3 mg/kg (Dorman, 1990). O calciferol atua através da indução de um aumento de metabolitos da vitamina D3 em circulação, dos quais o calcitriol é o de maior importância, o
6
que se traduz por hipercalcemia (valores de cálcio superiores a 12 mg/dl) e calcificação distrófica (Dorman, 1990). Os sinais clínicos surgem entre doze a trinta e seis horas após a ingestão e poderão incluir vómito, depressão, anorexia, poliúria, polidipsia e diarreia. O quadro de animais intoxicados poderá terminar em insuficiência renal, uma vez que ocorre a acumulação de metabolitos no rim (Dorman, 1990). A titulo de curiosidade, vários estudos estimam que a sua persistência no organismo de roedores é de sessenta e três dias (Brouwer et al., 1998). A divisão de envenenamentos da American Society for the Prevention of Cruelty to Animals, American Poison Control recomenda que o vómito seja induzido sempre que a ingestão por animais de companhia for maior do que 0,1 mg/kg (DeClementi e Sobczak, 2012). As informações relativas ao mecanismo de ação de algumas destas moléculas e quais as indicações para um melhor diagnóstico ante e post-mortem poderão ser encontradas no anexo 4, na tabela 9.
Em jeito de término deste capítulo, e de forma a ressalvar a importância e utilidade dos RA, é curioso referir o fenómeno que condiciona tanto o controlo de roedores por todo o mundo chamado, no inglês, “bait shyness”. Este fenómeno é descrito como uma atitude cautelosa perante o isco (isco esse que engloba o veneno), após uma experiência com consequências nefastas. De forma mais prática, ocorre quando um animal ingere veneno e associa os efeitos tóxicos de uma dose subletal ao consumo do mesmo, memorizando o seu aspeto e reconhecendo-o em encontros futuros. Isto ocorre não só em roedores como noutras espécies de mamíferos, como é o caso da espécie Trichosurus vulpecula ou Cusu comum, considerada uma praga na Nova Zelândia. Também está descrita a informação de que a fobia a venenos poderá ser inata, podendo justificar-se de duas formas: ou pelo facto de que os animais - como, por exemplo, os roedores, os T. vulpecula e os coelhos - rejeitam venenos com odores semelhantes a plantas venenosas, ou considerada uma neofobia, cuja definição é “receio de coisas novas” (Rzóska, 1953; Morgan et al., 2001; Tobin e Fall, 2004).
É possível contrariar este fenómeno no controlo de pragas, desde que as doses máximas de venenos sejam utilizadas e haja alteração dos compostos em operações que requeiram repetição. Podem, ainda, disfarçar-se os compostos com farinha perfumada, mas Morgan et al. (2001) fazem referência a um estudo em que, após terem experimentado cianeto em doses não letais, animais da espécie T. vulpecula rejeitavam, posteriormente, não só o cianeto, como qualquer nova comida.
7
SEGUNDA PARTE - RODENTICIDAS ANTICOAGULANTES
Como já foi referido, o método de controlo de roedores mais comumente utilizado é o uso de rodenticidas e dentro destes, os RA são os mais populares (Ishizuka et al., 2008; Shilova, 2011; Capizzi, Bertolino e Mortelliti, 2014). A importância deste trabalho prende-se com a informação de que são muito frequentes as intoxicações com RA, havendo vários estudos que dão conta do grande número de intoxicações em cães, número este que é superior a metade do total de envenenamentos reportados por diversas instituições, o que nos leva a ponderar a necessidade de os compreender e diferenciar (Berny et al., 2010).
A génese dos RA remonta a 1922, altura em que o médico veterinário Franklin Schofield publicou um artigo na revista Canadian Veterinary Record, fazendo referência a uma nova doença com um quadro hemorrágico ou uma anemia. O artigo sugeria haver uma relação entre o quadro hemorrágico apresentado por animais e uma alimentação com silagem à base de plantas do género Melilotus spp deteriorada e associada à presença de fungos, não chegando, no entanto, à conclusão do que em concreto estaria a causar o processo (Schofield, 1922). Esta silagem teria sido, normalmente, descartada pelos agricultores, mas as condições sócio-económicas da Grande Depressão dos E.U.A. da década de 1920 impediam-nos de suportar os custos associados a um alimento de melhor qualidade (Wardrop e Keeling, 2008).
De acordo com o descrito em estudos realizados no final dos anos 20, Roderick analisou o sangue de animais alimentados com extratos de silagens idênticas àquelas referidas por Schofield e chegou à conclusão de que o processo hemorrágico estava associado exclusivamente a um aumento do tempo de protrombina (TP), não havendo qualquer alteração a nível do fibrinogénio, do cálcio ou das plaquetas. Chamou-lhe, na altura, o “defeito da protrombina do plasma”, e foi descrita a possibilidade, testada na altura, de reverter os efeitos hemorrágicos deste feno deteriorado se os animais fossem alimentados com outros alimentos íntegros ou fossem alvo de uma transfusão de sangue proveniente de um animal sem sintomatologia (Roderick, 1931; Wardrop e Keeling, 2008).
Mais tarde, um agricultor chamado Ed Carlson, inconformado com as mortes dos seus animais de produção, viajou até à estação experimental agrícola local, onde se encontrava Karl Link com o seu pupilo Frank Schofield, com o cadáver de um bovino que tinha morrido com um quadro hemorrágico. Este facto intrigou ambos os cientistas, mas o seu interesse agudizou-se no dia seguinte, quando verificaram que o sangue do animal não tinha coagulado durante toda uma noite. Após 6 anos de trabalho intenso, Link e os seus colaboradores (Harold Campbell, Ralph Overman, Charles Hebner e Mark Stahmann) conseguiram, finalmente, cristalizar o composto, cuja fórmula química foi descrita como:
3,3’-metilenebis(4-8
hidroxicumarina). Em 1941, Campbell H.A. e Link K.P. descreveram a fórmula química do composto anticoagulante como sendo C19H12O6. Isto confirmou que o composto não era a cumarina, que tinha sido associada à causa, uma vez que esta não possuía a capacidade de induzir o quadro hemorrágico. Este composto não era, nada mais nada menos, do que a forma oxidada da cumarina, presente no feno deteriorado, que se passou a chamar dicumarina. Link apercebeu-se, após a descoberta da vitamina K se ter tornado pública, que esta apresentava semelhanças estruturais à dicumarina. Assim, no mesmo trabalho, descreveu que conseguiu reproduzir o problema administrando a animais este composto obtido de forma sintética, o que confirma a identificação inequívoca da substância causadora do quadro hemorrágico. Também se apercebeu, administrando o composto a um touro e este apresentando hemorragias, que a administração de vitamina K1 o fazia recuperar depressa. Link e os seus colegas sintetizaram, laboratorialmente, mais de cem análogos da dicumarina, mas havia um que sobressaía dos restantes quanto à sua potência, quando usado em testes laboratoriais com animais. Era o composto número quarenta e dois, e o seu isolamento em larga escala ocorreu mais tarde por Mark Stahmann, que o patenteou com a ajuda da Wisconsin Alumni Research Foundation. Esta organização continuou a financiar estes projetos até que Karl Link, novamente envolvido neste projeto, teve a ideia de usar o análogo mais potente da dicumarina como um rodenticida, nascendo assim a warfarina, cujo nome tem origem nas iniciais da fundação, WARF. Foi, assim, registada em 1948 como um rodenticida (Campbell e Link, 1941; Kresge, Simoni e Hill, 2005; Wardrop e Keeling, 2008; Porter, 2010; DeClementi e Sobczak, 2012; Tsoucalas et al., 2016; Setacci et al., 2017).
A utilização de anticoagulantes em humanos principiou na década de 1940, o que horrorizou a população pela ideia do consumo humano de veneno de rato (Handin, 2016). A aceitação da utilização da warfarina como anticoagulante para fins médicos ocorreu mais tardiamente, quando esta foi utilizada com sucesso no tratamento do presidente americano Dwight Einsenhower após o seu ataque cardíaco, sendo que, hoje em dia, é um facto que mais de 1% da população do Reino Unido tome warfarina regularmente, aumentando esta percentagem para 8% se considerada a faixa etária superior aos oitenta anos de idade (Kresge, Simoni e Hill, 2005; Wardrop e Keeling, 2008).
Assim, este grupo de moléculas veio oferecer uma alternativa no controlo de pragas face aos venenos de ação imediata disponíveis até então, sendo divididos em dois grupos distintos, as hidroxicumarinas e as inandionas (Hadler e Buckle, 1992). As hidroxicumarinas são moléculas que contêm um anel 4-hidroxicumarina e são moléculas que diferem na sua posição três; as inandionas possuem uma estrutura 1,3-inandiona e são distintas quando há alterações na sua posição 3 (Murphy e Lugo, 2015). A fórmula química destas moléculas poderá ser observada na figura 1.
9
Figura 1 – Estrutura química das moléculas warfarina, difacinona e da vitamina K1, da esquerda para a direita (Pelfrène, 1991).
O uso de algumas foi, ao longo dos anos, regulamentado ou proibido, havendo algumas moléculas que poderão ser utilizadas somente se manipuladas por profissionais (Fagerstone, Bullard e Ramey, 1990; Tobin e Fall, 2004).
As moléculas disponíveis no mercado são efetivas no controlo de população de roedores, uma vez que têm uma ação retardada no tempo e são eficazes contra espécies neofóbicas (Silverman, 1980; Tobin e Fall, 2004; Damin-Pernik et al., 2017). A sua comercialização é feita em diversas apresentações, tais como: pastilhas, blocos com cera como adjuvante, em formulações de pulverizar e em pó. A utilização de várias cores também é uma prática comum, o que leva a que moléculas distintas tenham apresentações semelhantes, tornando impossível a distinção do princípio ativo pela morfologia física (Merola, 2002). É comum o uso de benzoato de denatónio como agente amargante, uma vez que diminui a ingestão acidental, sobretudo em crianças (Berny et al., 2010; Bates, 2016). As apresentações de RA mais comuns são nas concentrações 0,1-0,001% (Gómez-Ramírez et al., 2014). A tabela número 8, que poderá ser consultada no anexo 3, organiza as moléculas anticoagulantes cujos efeitos em cães e gatos são conhecidos na totalidade ou em parte, dividindo-os em rodenticidas de primeira ou segunda geração.
10
1) RODENTICIDAS ANTICOAGULANTES DE PRIMEIRA GERAÇÃO
Os rodenticidas de primeira geração têm como grande limitação a necessidade de ingestões sucessivas do composto para que este seja letal para o animal que o ingeriu. A sua semi-vida plasmática varia entre as dezoito e as cinquenta e cinco horas (Dutto, Di Domenico e Rubbiani, 2018).
No grupo das hidroxicumarinas de primeira geração, deverá fazer-se menção de que estas moléculas poderão ser administradas em várias doses, com concentrações inferiores às dos rodenticidas não anticoagulantes (Tobin e Fall, 2004). O exemplo mais premente desta classe é a warfarina que, como já descrito, foi utilizada à escala mundial como um rodenticida. Este composto é considerado mais tóxico em múltiplas ingestões comparativamente com a mesma dose ingerida numa toma única, e a sua semi-vida é, de acordo com um estudo realizado por Fisher, de cerca de vinte e seis dias no fígado de Rattus norvegicus (Dorman, 1990; Fisher et al., 2003). Já o cumatetralilo, que também é um dos exemplos de um anticoagulante de primeira geração, foi criado com a finalidade de atuar em populações de roedores resistentes à warfarina, uma vez que, nestas espécies, é rapidamente absorvido do trato gastrointestinal para a corrente sanguínea e permanece no organismo dos mesmos entre 50 a 85 dias (Greaves e Ayres, 1969; Crowell et al., 2013). No entanto, em estudos subsequentes à sua criação, observou-se que animais resistentes à warfarina sê-lo-iam, também, a esta molécula, daí a necessidade de se sintetizarem novas moléculas, o que será referido no próximo capítulo (Greaves e Ayres, 1969).
11
2) RESISTÊNCIAS DE ROEDORES A RODENTICIDAS DE PRIMEIRA GERAÇÃO Há várias definições de resistência, que poderão passar pelo conceito de que se for aplicada uma técnica que permita verificar a suscetibilidade de duas estirpes para essa mesma técnica, a espécie menos suscetível será a mais resistente (Buckle, Prescott e Ward, 1994). A resistência dos roedores à warfarina foi detetada em 1960 e pensa-se que na sua base estarão mutações genéticas. Esta hipótese é suportada por estudos realizados posteriormente, como é exemplo o estudo realizado por Goulois et al. (2016) que concluiu haver uma relação entre a resistência a RA e uma alteração do seu genótipo na espécie Rattus rattus, na zona de Saragoça, Espanha.
A produção e ativação dos fatores de coagulação II, VII, IX e X depende da presença de vitamina K. Neste processo, cada molécula de vitamina K hidroquinona é oxidada em vitamina K 2,3 epóxido e, para que possa ser novamente re-utilizada, é necessário que ocorra um passo seguinte, em que é reduzida pela enzima vitamina K 2,3 epóxido redutase (VKOR). Os anticoagulantes orais inibem a VKOR e dessa forma, cada molécula de vitamina K só pode ser utilizada uma única vez, o que acaba por induzir um estado de hipocoagulação por carência de fatores de coagulação (Tran e King, 2015).
Os roedores que são resistentes à warfarina possuem um gene autossómico dominante, o gene VKOR. Esta alteração genética é herdada em várias espécies de roedores e o que ocorre é uma série de polimorfismos neste mesmo gene, que diminuem a sensibilidade do roedor à warfarina. O facto de já estarem descritos estes polimorfismos, relativamente a rodenticidas de segunda geração, em algumas espécies de roedores, poderá preocupar-nos quanto a resistências aos compostos utilizados na atualidade e à necessidade de sintetizar novos compostos (Ishizuka et al., 2008; Haniza et al., 2015; Feinstein et al., 2016; Goulois et al., 2016; O’Neil et al., 2017).
12
3) RODENTICIDAS ANTICOAGULANTES DE SEGUNDA GERAÇÃO
Estas moléculas, também chamadas superwarfarinas, foram descobertas na década de 1970, sendo consideradas mais tóxicas e podendo dar origem a sinais clínicos compatíveis com toxicidade em ratos quando ingeridas numa toma única, não havendo necessidade de várias tomas (Tobin e Fall, 2004; Vandenbroucke et al., 2008; Damin-Pernik et al., 2017).
Surgiram pela necessidade de controlar populações, uma vez que vários estudos da época documentaram a resistência de roedores a compostos de primeira geração, como já foi referido anteriormente neste trabalho (Rowe e Redfern, 1968). Desta forma, e por serem moléculas criadas como alternativa, diferem dos compostos de primeira geração em quatro características muito próprias: estão ativos após uma única ingestão, possuem tempos de permanência no organismo aumentados, as hemorragias induzidas têm uma duração mais longa e são eliminados em natureza, isto é, como compostos praticamente inalterados (Bidny et al., 2015).
Estruturalmente, estas superwarfarinas são formas da warfarina quimicamente modificadas, a que se juntaram anéis de fenil modificados na porção da 4-hidroxicumarina. A perceção de porque é que estes compostos de segunda geração são tão mais tóxicos do que os compostos mais antigos não é clara, embora haja uma ideia de que a adição de anéis de fenil às moléculas aumenta substancialmente a sua lipofilia, o que se traduz por um aumento da acumulação e retenção nos tecidos (falando em valores medidos no plasma). São bem absorvidas a nível gastrointestinal, com uma biodisponibilidade de 90%, atingindo a concentração máxima no plasma ao fim de doze horas. A metabolização hepática apresenta duas fases: uma fase inicial de metabolização mais célere, com uma semi-vida de três dias, e uma fase mais lenta, com uma semi-vida de cerca de cento e vinte a cento e trinta dias, em oposição à warfarina, que tem uma semi-vida de quinze a cinquenta e oito horas (Murphy e Lugo, 2015; Feinstein et al., 2016).
O brodifacum é um dos exemplos de um rodenticida de segunda geração. Este composto tem sido de grande utilidade, não só para erradicar roedores, mas também para erradicar outras espécies - temos, como exemplo, os lagomorfos da espécie Oryctolagus cuniculus em ilhas e Trichosurus vulpecula na Nova Zelândia (Robertson, Colbourne e Nieuwland, 1993; Taylor e Thomas, 1993; Towns et al., 1993; Buckle, Prescott e Ward, 1994; Eason et al., 1999). Uma das suas formulações comerciais mais comuns é o Talon 20P®, sendo um isco de cerca de 0,8g (Towns et al., 1993). É absorvido no trato gastrointestinal e terá a sua ação no fígado, embora não existam estudos que tenham avaliado a duração desta molécula no organismo de diferentes mamíferos, estima-se que permaneça mais de um ano no organismo dos mesmos (Crowell et al., 2013). Esta ideia é suportada pelos estudos levados a cabo na área, que nos mostram que o brodifacum tem uma semi-vida em ratos de cerca de
13
trezentos e sete dias, o que suporta a teoria de que estes rodenticidas se mantêm durante um intervalo de tempo superior em circulação. Em oposição à warfarina, e de acordo com o que já foi descrito acerca desta classe de anticoagulantes, o brodifacum é bastante hidrofóbico, contendo uma porção de brometo orgânico na sua constituição, o que poderá justificar a sua toxicidade (Vandenbroucke et al., 2008; Ware et al., 2015).
A bromadiolona, outro composto muito usado, tem uma semi-vida de cerca de trinta e três dias nos roedores da espécie Mus musculus – outro dado importante que suporta a necessidade de conhecer a molécula implicada numa intoxicação, de forma a instituir a terapia de vitamina K1 adequada (Crowell et al., 2013).
Já o flocoumafeno é uma molécula menos tóxica para os mamíferos em geral, com a exceção dos cães, em que a sua DL50 é muito reduzida (Lund, 1988). Após a criação da molécula, a mesma foi testada em roedores resistentes à warfarina e verificou-se ter potencial para estas estirpes, tendo uma toxicidade intermédia entre a bromadiolona e o brodifacum (Lund 1988). No entanto, apesar de menos tóxica, alguns estudos realizados em roedores, na década de 1980, permitiram concluir que a biodisponibilidade desta molécula aumenta quando o seu efeito cumulativo aumenta, embora haja diferenças de tolerância para a molécula em animais da mesma espécie. No trabalho de Huckle, Hutson e Warburton (1988), está descrita uma redução, após seis semanas, dos níveis de plaquetas e de cálcio, elementos fundamentais para a coagulação, sendo referido que isto poderá ser um indício de uma atuação através de diferentes mecanismos de ação (Huckle, Hutson e Warburton, 1988).
14 4) INANDIONAS
As inandionas são um grupo de rodenticidas sobre o qual os autores não têm uma opinião consensual acerca da sua caracterização, podendo incluí-las nos rodenticidas de primeira geração ou juntamente com os de segunda geração (Pelfrène, 1991; Tran e King, 2015). As moléculas mais comuns deste grupo são a difacinona e a clorofacinona, pelo que serão os dois compostos referidos a seguir (Murphy e Lugo, 2015).
A difacinona é utilizada com frequência em países como a Turquia e a Rússia e, por norma, só é utilizada por profissionais. Tem como finalidade não só o controlo de roedores, bem como o controlo de outros mamíferos. Apesar de ter uma toxicidade superior à warfarina, a sua palatibilidade é inferior e, portanto, será menos eficaz a promover um efeito letal. Em cães, a semi-vida no organismo está descrita como sendo de trinta dias, o que poderá dever-se a uma ligação forte às proteínas do fígado, a uma taxa de excreção diminuída ou a ambos os fatores (Pelfrène, 1991; Crowell et al., 2013; Murphy e Lugo, 2015).
Já a clorofacinona é uma molécula que apresenta a vantagem de não induzir o fenómeno “bait shyness”, já referido anteriormente. O seu uso é compatível com cereais, frutas, raízes e outras substâncias que possam ser utilizadas como isco (Murphy e Lugo, 2015). É um rodenticida anticoagulante frequentemente usado, mas tem um carácter tóxico para outros mamíferos e é extremamente tóxico para organismos aquáticos (Gómez-Ramírez et al., 2014). Atua no fígado não só pela impossibilidade de síntese dos fatores de coagulação, mas também pelo dano concorrente da permeabilidade capilar. Difere das hidroxicumarinas porque poderá induzir lesão neurológica e cardiopulmonar, já descrita em roedores, o que poderá ser a causa da morte ainda antes do quadro hemorrágico surgir. O tratamento com recurso a vitamina K1 deverá ter uma duração prolongada, havendo relatos de intoxicações em humanos cuja vitamina K1 foi necessária por um período de sete semanas (Pelfrène, 1991).
15
5) APRESENTAÇÃO DE RODENTICIDAS ANTICOAGULANTES EM PORTUGAL Em Portugal, os rodenticidas enquadram-se na categoria 14 segundo a Direção Geral de Alimentação e Veterinária e os produtos que poderão ser comercializados para uso profissional e não profissional incluem o difenacume, a bromadiolona, o brodifacum e a difetialona (DGS, 2015; DGAV, 2017).
16
6) CONSEQUÊNCIAS PARA AS ESPÉCIES NÃO ALVO – MEIO RURAL E URBANO A intoxicação acidental com RA está reportada em espécies como cães, cavalos, gatos e animais selvagens de diversas espécies, bem como em humanos (Valchev et al., 2008; Dutto, Di Domenico e Rubbiani, 2018).
A ingestão destes compostos poderá ocorrer de forma primária ou secundária. A forma primária está relacionada com o consumo direto do isco; a forma secundária requer que uma espécie não-alvo ingira as presas contaminadas com o veneno, o que, no caso dos rodenticidas, é mais frequente serem roedores, que poderão estar vivos ou mortos. Os riscos de intoxicação secundária poderão ser, ainda, o consumo do isco por pássaros que se alimentem do chão ou por insectívoros que ingiram insetos que carreguem o isco (Buckle e Fenn, 1992; Towns et al., 1993). No entanto, há autores que sugerem que o risco para aves predadoras e mamíferos é sobre-estimado, com a proporção de mortalidade a ser diminuída quando comparada com a frequência de utilização (Towns et al., 1993; Rattner et al., 2014). No entanto, num trabalho realizado em Itália por Muscarella et al. (2016), o grupo dos rodenticidas anticoagulantes foi responsável pelo maior número de intoxicações em cães e em gatos, sendo também detetado em várias espécies de aves, incluindo aves aquáticas, em coelhos e raposas.
Com a crescente utilização do brodifacum, a contaminação secundária de aves e mustelídeos em meios rurais tem sido motivo de preocupação (Eason et al. 1999). No entanto, em outros estudos realizados observou-se que os iscos com brodifacum têm elevada palatibilidade para roedores e diminuído interesse para aves, embora estas, quando intoxicadas com brodifacum, tenham sinais clínicos idênticos às outras espécies, tais como prostração, anemia e hematomas subcutâneos (Buckle e Fenn, 1992; Hydock, DeClementi e Fish, 2017). O composto poderá ser encontrado em órgãos como os rins, pâncreas e fígado por um período mínimo de seis meses. Em análises realizadas em suínos intoxicados, os níveis hepáticos de brodifacum alarmaram os investigadores, não só pelo risco de intoxicação secundária do suíno ou outros vertebrados, como os cães, que ingiram roedores, mas também pelo risco de uma intoxicação terciária cumulativa para o Homem enquanto consumidor de carne (Eason et al., 1999; Hydock, DeClementi e Fish, 2017). A proibição de uso de rodenticidas de segunda geração em alguns países poderá fazer surgir a necessidade de utilização de outros compostos (DeClementi e Sobczak, 2012). Assim, poderá ser real o aumento do uso de inandionas, como é o caso da difacinona, estudada num trabalho de Rattner et al. (2011), em que as aves de rapina com ingestão de doses letais não possuíam evidências de hemorragias, apresentando alterações neurológicas como ataxia e alterações de comportamento.
17
À ideia das intoxicações em espécies não alvo é, ainda, necessário juntar informações como aquelas referidas no trabalho realizado por Gómez-Canela et al. (2016), que indicam a presença de RA em lamas adjacentes a estações de tratamento de águas residuais, o que nos poderá indicar uma permanência dos compostos não só em seres vivos, como em natureza, reforçando a ideia das intoxicações secundárias.
Em humanos, os RA já foram utilizados por grupos radicais, dada a sua disponibilidade em várias apresentações, tanto sólidas como líquidas. Estas apresentações poderão pressupor a sua utilização em comidas e águas ingeridas por grandes grupos e consequente surgimento de sinais clínicos. No caso específico do brodifacum, há vários registos de ocorrências, desde duzentos homens que manifestaram sinais de coagulopatia durante a Guerra Fria no sul de África ou o consumo de carne com RA por prisioneiros de uma cadeia em Nova Iorque, tendo havido várias mortes reportadas. Dado estes cenários, as autoridades e as equipas médicas deverão ter em atenção grandes grupos de pessoas que tenham participado nos mesmos eventos e que manifestem sinais compatíveis com estas intoxicações, tendo em atenção o surgimento tardio dos sinais clínicos (Murphy e Lugo, 2015; Feinstein et al., 2016).
18 7) FORMAS DE INTOXICAÇÃO
É normal pensar que o meio onde os animais habitam será aquele que terá maior risco de contaminação para os mesmos (Mahdi e Van der Merwe, 2013). Assim, os animais domésticos que tenham acesso ao exterior de forma não supervisionada, e que habitem em áreas em que seja frequente o controlo de roedores têm um risco superior de sofrer intoxicações (Merola, 2002; Kohn, Weingart e Giger, 2003). Juntamente com a procura por comida, típica de vários animais mas essencialmente de canídeos, a ingestão acidental de rodenticidas ocorre em todas as regiões geográficas, repetidamente no tempo (McLean e Hansen, 2012; O’Neil et al., 2017). Um outro estudo realizado nos Estados Unidos da América e que analisou, durante três anos, as chamadas telefónicas efetuadas para a seção de toxicologia de um laboratório universitário, classificou a ingestão oral como a via de envenenamento mais frequente (cerca de 90% das chamadas), da inalação e, por último, da via intra-venosa (Mahdi e Van der Merwe, 2013). Poderá haver, ainda que menos frequente, ingestão de água em que os RA estejam presentes, uma vez que os compostos hidroxicumarínicos são solúveis em água (Valchev et al., 2008). Por último, referir que estas moléculas atravessam a barreira placentária, podendo atuar no feto ou embrião, com a possibilidade de causar um quadro hemorrágico e, consequentemente, deslocamentos de placenta e abortos, contribuindo para a mortalidade neonatal (Peterson e Talcott, 2013; Tilley e Smith, 2016).
19
8) MECANISMO DE AÇÃO, TOXICOCINÉTICA E TOXICIDADE
A hemóstase é um processo fundamental para o mecanismo de defesa de animais vertebrados. Vem do termo grego, em que “hemo” nos remete para sangue e “estase” nos remete para “paragem”. Esta ocorre em duas alturas que não se dissociam: num primeiro momento, a hemóstase primária, as plaquetas aderem ao endotélio vascular que foi lesionado, formando um tampão plaquetário; num segundo momento, verifica-se a hemóstase secundária, onde, através de um processo enzimático, ocorre a ativação dos fatores de coagulação e a formação de um tampão de fibrina. O termo coagulação também deve ser referido nesta altura, uma vez que é o processo que conta com a participação das proteínas pró-coagulantes do plasma, que são denominadas, por convenção, fatores de coagulação. Estes fatores de coagulação são designados por letras romanas, como será observado nesta secção (Gentry, 2004; Palta, Saroa e Palta, 2014). Há vários fatores de coagulação, que se dividem na família do fibrinogénio (fibrinogénio ou fator I; fator V; fator VIII e fator XIIII), nos fatores dependentes da vitamina K (fatores II, VII, IX e X) e na família de contacto (fatores XI, XII, entre outros) (Palta, Saroa e Palta, 2014).
No processo da coagulação, é importante ter em atenção que as proteínas ou fatores envolvidos na coagulação sanguínea só alteram o seu estado inativo para o estado ativo quando há perturbação da vasculatura e comprometimento da hemóstase. A trombina é a enzima mais importante do processo hemostático e tem origem no seu percursor, a protrombina, que está normalmente em circulação e reage a qualquer estímulo ativador. A cascata de coagulação é controlada por várias proteínas anticoagulantes ou inibitórias, que irão garantir que a formação de trombina esteja confinada à área onde ocorreu o traumatismo vascular e que não seja produzida em excesso. Antigamente considerava-se a via intrínseca
Figura 2 - Cascata de coagulação - nomenclatura não atual. Estão sublinhados os fatores de coagulação dependentes da vitamina K e está presente o fator III como fator iniciador da cascata de
20
e a via extrínseca da coagulação, em que a via intrínseca era a via responsável pela formação da trombina após traumatismo vascular e a via extrínseca era uma via complementar para que a trombina pudesse ser formada. No entanto, embora os termos utilizados neste trabalho sejam referentes à antiga nomenclatura e o esquema a considerar seja aquele representado na figura 2, é importante referir que atualmente apenas se considera uma única via, a via do fator tissular (do original “tissue factor pathway”), antigamente conhecida como a via extrínseca, que é aquela envolvida na iniciação da formação de trombina. A via intrínseca é, atualmente, enquadrada nas vias de amplificação e de propagação (Gentry, 2004; Byers, 2017). Assim, pelas informações atuais, a cascata de coagulação inicia-se na fase de iniciação, onde, após a agressão da vasculatura, o fator tissular ou fator III, que é um cofator da proteína VIIa, se vai ligar a este último de forma a formarem um complexo capaz de ativar os fatores IX e X. Após este passo, o fator Xa irá ligar-se ao fator II, a protrombina, de forma a gerar trombina. Nesta fase do processo, o processo que gera trombina não é definitivo e poderá ser revertido se o fator tissular for inibido. Após a fase da inibição, ocorre a fase da amplificação. Nesta fase, a trombina que foi gerada anteriormente não é suficiente para promover a hemóstase, pelo que se geram vários feedbacks positivos que a irão ligar às plaquetas. Esta trombina ativará, também, o fator V e o fator VIII, que serve de cofator no complexo protrombinase e aceleram a ativação do fator II pelo fator Xa e do fator Xa pelo fator IXa, respetivamente. A fase de propagação sucede-se e os complexos enzimáticos acumulados na superfície das plaquetas irão suportar grandes quantidades de trombina a ser gerada e ocorrerá, também, ativação plaquetária. Isto promove a formação sucessiva de trombina e, subsequentemente, de fibrina para que se forme um tampão plaquetário de dimensões suficientes. Por fim, dá-se a fase de estabilização, em que a trombina gerada leva à ativação do fator XIII, que é o fator estabilizador da fibrina. Este fator irá ligar-se aos polímeros de fibrina e providenciar que a fibrina presente no tampão plaquetário seja suficientemente forte e estável. Adicionalmente, a trombina ativa o inibidor da fibrinólise ativado pela trombina, que irá impedir que o tampão plaquetário sofra fibrinólise (Palta, Saroa e Palta, 2014).
Como tem sido frisado ao longo do trabalho, a absorção de RA pelo trato gastrointestinal ocorre de forma rápida, sendo que estes são metabolizados no fígado. Em animais, atingem a sua concentração plasmática máxima doze horas após a ingestão oral, sendo depois excretados maioritariamente na urina e uma pequena percentagem nas fezes (Valchev et al., 2008; Merola, 2002; Bates, 2016). Uma vez que estes compostos têm ação no ciclo da vitamina K, o funcionamento normal do mesmo e as consequências das suas alterações serão aqui referidas. A vitamina K enquanto personagem central de vários processos fisiológicos tem sido descrita na literatura desde há vários anos, tanto em humanos
21
como em animais (O’Neil et al., 2017). Esta vitamina foi descoberta em 1929, segundo a pesquisa histórica elaborada por Ferland (2012). Nesta altura, o bioquímico da Universidade de Copenhaga, Henrik Dam, apercebeu-se de que uma dieta sem gordura e colesterol, em galinhas, culminava no surgimento de hemorragias musculares e subcutâneas, bem como em aumentos do tempo de coagulação. Intrigado, Dam descobriu que o composto necessário para colmatar estas deficiências era lipossolúvel, mas distinto das outras vitaminas já conhecidas (vitaminas A, D e E), uma vez que a adição dos nutrientes essenciais já conhecidos não prevenia esta condição. Desta forma, e tendo em conta que a ausência do composto provocava alterações na coagulação, decidiu nomeá-lo vitamina K, com a inicial da palavra “Koagulation”, a variante da palavra coagulação nas línguas escandinavas. Link, após a descoberta da estrutura da vitamina K, apercebeu-se que esta e o dicumarol possuíam estruturas idênticas (Kresge, Simoni e Hill, 2005; Ferland, 2012; O’Neil et al., 2017).
Após vários estudos, concluiu que haveriam vários tipos de vitamina K, consoante a sua estrutura química, tal como está descrito na figura 3: todos possuíam um anel 2-metil-2,4-naftoquinona, mas diferiam na estrutura na sua ligação 3. Assim, individualizou três tipos de vitamina K. A primeira, e a mais importante para este trabalho, é a vitamina K1, filoquinona ou fitomenadiona, que é sintetizada em plantas verdes de folha escura. A segunda é a vitamina K2 ou menaquiona, cuja síntese ocorre no cólon por bactérias anaeróbias, mas tem uma absorção limitada; está presente em queijos, carnes e produtos fermentados. Por fim, a vitamina K3 ou menadiona: esta última não existe em natureza, mas é um fator de crescimento bacteriano, processo no qual é sintetizada em menaquionas nos tecidos dos mamíferos e aves, tendo como limitação o facto de não conseguir participar na gama-carboxilação de proteínas vitamina K-dependentes, processo explicado mais à frente (Ferland, 2012; O’Neil et al., 2017).
Figura 3 - Estrutura química dos diferentes tipos de vitamina K (Ferland, 2012)
Portanto, a vitamina K1 é um cofator na ativação dos fatores de coagulação (ou proteínas de coagulação) II (protrombina), VII, IX e X. Estes exercem um efeito pro-coagulante, contrário às proteínas C e S, que são as proteínas inibidoras da coagulação. Quando esta vitamina não está disponível, estes fatores de coagulação não são ativados, sendo chamados percursores não funcionais – do termo inglês PIVKA (proteins induced by