CENTRO DE CIÊNCIAS DEPARTAMENTO DE FÍSICA
PROGRAMA DE PÓS-GRADUAÇÃO EM FÍSICA
JOSÉ GADELHA DA SILVA FILHO
PROPRIEDADES VIBRACIONAIS DO DIPEPTÍDEO L,L-DIFENILALANINA SOB CONDIÇÕES EXTREMAS DE TEMPERATURA E PRESSÃO
JOSÉ GADELHA DA SILVA FILHO
PROPRIEDADES VIBRACIONAIS DO DIPEPTÍDEO L,L-DIFENILALANINA SOB CONDIÇÕES EXTREMAS DE TEMPERATURA E PRESSÃO
Tese de Doutorado apresentada ao Programa de Pós-Graduação em Física da Universidade Fe-deral do Ceará, como requisito parcial para a obtenção do Título de Doutor em Física. Área de Concentração: Física da Matéria Conden-sada.
Orientador: Prof. Dr. Paulo de Tarso Caval-cante Freire.
Biblioteca Universitária
Gerada automaticamente pelo módulo Catalog, mediante os dados fornecidos pelo(a) autor(a)
S58p Silva Filho, José Gadelha da.
Propriedades vibracionais do dipeptídeo L,L-Difenilalanina sob condições extremas de temperatura e pressão / José Gadelha da Silva Filho. – 2017.
141 f. : il. color.
Tese (doutorado) – Universidade Federal do Ceará, Centro de Ciências, Programa de Pós-Graduação em Física , Fortaleza, 2017.
Orientação: Prof. Dr. Paulo de Tarso Cavalcante Freire.
JOSÉ GADELHA DA SILVA FILHO
PROPRIEDADES VIBRACIONAIS DO DIPEPTÍDEO L,L-DIFENILALANINA SOB CONDIÇÕES EXTREMAS DE TEMPERATURA E PRESSÃO
Tese de Doutorado apresentada ao Programa de Pós-Graduação em Física do Departamento de Física da Universidade Federal do Ceará, como requisito parcial para obtenção do título de Doutor em Física. Área de concentração: Física da Matéria Condensada.
Aprovada em: 04/09/2017.
BANCA EXAMINADORA
_________________________________________________ Prof. Dr. Paulo de Tarso Cavalcante Freire (Orientador)
Universidade Federal do Ceará (UFC)
_________________________________________ Prof. Dr. Francisco Erivan de Abreu Melo
Universidade Federal do Ceará (UFC)
_________________________________________ Prof. Dr. José Marcos Sasaki
Universidade Federal do Ceará (UFC)
_________________________________________ Prof. Dr. Sanclayton Geraldo Carneiro Moreira
Universidade Federal do Pará (UFPA)
_________________________________________ Prof. Dr. Bartolomeu Cruz Viana Neto
AGRADECIMENTOS
Ao meu orientador, professor Paulo de Tarso Cavalcante Freire, pela simplicidade, paciência e dedicação, características que influenciaram diretamente no meu amadurecimento profissional e na conclusão dessa tese. Espero poder continuar aprendendo e colaborando com o que for possível no desenvolvimento de outros trabalhos.
Ao professor Josué Mendes Filho, pelos conselhos, ensinamentos e principalmente pela demonstração de força e empenho com a ciência e com os estudantes.
Ao professor José Alves de Lima Júnior por toda a disponibilidade, ajuda e colabo-ração nos diversos experimentos realizados ao longo deste doutorado.
Ao professor Carlos William Paschoal e ao professor Alejandro Pedro Ayala por serem extremamente solícitos e dispostos a esclarecer dúvidas ou indicar meios de solucionar problemas nos laboratórios.
Ao professor José Marcos Sasaki, pelas valiosas discussões envolvendo os experi-mentos de difração de raios-X.
A minha mãe Maria Aracélia Carneiro e ao meu pai José Gadelha da Silva, por sempre terem priorizado a formação dos filhos, pelo cuidado constante e por compreenderem as minhas ausências nestes últimos anos de doutorado.
A minha namorada Aldilene Saraiva Souza, por todos os momentos de cumplicida-de, angústias e alegrias que dividimos um com o outro. Muito obrigado por estar ao meu lado nessa caminhada.
Aos velhos amigos José Enedilton Medeiros e Samuel Martins, por todas as conver-sas inúteis, piadas repetitivas e momentos constrangedores que formam nossa amizade desde o período da graduação na UECE.
Aos meus amigos e colegas de laboratório Cícero Moézio (grande parceiro de ex-perimentos), Edilan, Diego, Felipe, João Victor, Fellipe, Thiago, Cristiano, Daniel, Joel, João Rufino (Rufas Lenhador), Jorge Capuan e Francisco Mocineis pelos diversos momentos de des-contração dentro e fora do laboratório. Gostaria de fazer um agradecimento em especial ao Bruno Sousa, por ter sido muito solícito no esclarecimento dos diversos procedimentos de uso e manutenção de equipamentos no laboratório.
Aos funcionários do programa de pós-graduação em física que realizam o trabalho burocrático de suporte do programa, em especial as senhoras Rejane Coelho e Ana Cleide Fer-reira.
simpatia ao longo do dia de trabalho.
Aos membros do CENAPAD-UFC, pelo suporte computacional.
Ao programa de Pós-Graduação em Física da Universidade Federal do Ceará (UFC).
RESUMO
Neste trabalho investigamos a estabilidade do dipeptídeo aromáticoL,L-difenilalanina sob con-dições extremas de temperatura e pressão. Inicialmente, confirmamos por meio do método Rietveld de refinamento a fase cristalina do dipeptídeo. Os parâmetros instrumentais e estrutu-rais foram refinados durante o processo e encontramos uma boa concordância entre o padrão de difração calculado e experimental. Em seguida, estudamos os efeitos de altas e baixas tempera-tura na estabilidade da fase hexagonal desse dipeptídeo, utilizando técnicas não destrutivas de espectroscopia Raman e infravermelho. Os movimentos vibracionais associados as bandas ob-servadas experimentalmente foram atribuídos de acordo com cálculos de primeiros princípios. Os espectros infravermelho foram medidos para a amostraL,L-difenilalanina resfriada até 160 K, enquanto os espectros Raman foram coletados para temperaturas ainda menores, em torno de 20 K. Os dados vibracionais apontam a estabilidade daL,L-difenilalanina neste intervalo de temperatura. Por outro lado, espectros Raman obtidos em duas configurações de espalhamento Y(XX)Y e Y(ZZ)Y indicam uma transição de fase daL,L-difenilalanina em altas temperaturas (≈390 K). Entre as modificações vibracionais, destacam-se as mudanças na região espectral abaixo de 200 cm−1, acompanhadas do deslocamento da banda amida I e do alargamento de
bandas associadas aos movimentos vibracionais dos radicais que compõem o dipeptídeo. A transição de fase apontada pelos experimentos de espectroscopia Raman em altas temperaturas foi confirmada por métodos termoanalíticos e através de experimentos de difração de raios-X. Os difratogramas foram obtidos para amostra resfriada até 83 K (≈ -190 ◦C) e aquecida até 473 K (≈200◦C). A fase hexagonal daL,L-difenilalanina permanece estável até o limite entre 393 e 403 K. A partir desse valor de temperatura, uma mudança perceptível na fase cristalina é observada. Por fim, foi realizado por meio de espectroscopia Raman um estudo do com-portamento vibracional do dipeptídeo submetido a pressões hidrostáticas de até 7,4 GPa. Os resultados apresentaram grandes modificações nas bandas de baixas energias, acompanhadas de mudanças nas vibrações dos modos internos entre 3,9 e 4,6 GPa, indicando a ocorrência de uma transição de fase estrutural. Uma vez que o acoplamento entre as moléculas de água e os nanocanais do cristal L,L-difenilalanina é extremamente sensível à disposição tubular, as mudanças vibracionais observadas na região espectral dos modos internos, podem ser interpre-tadas como modificações conformacionais no esqueleto do dipeptídeo. Após a descompressão do material, a partir de 7,4 GPa, verificamos que a transição de fase é reversível uma vez que o espectro ambiente é recuperado quando a pressão é completamente liberada.
In this thesis, we investigated the stability of the aromatic dipeptideL,L-diphenylalanine under extreme conditions of temperature and pressure. Firstly, the crystalline phase of the dipeptide was confirmed by Rietveld analysis. During this refinement, the instrumental and structural parameters were refined and a good fit was found between observed and calculated peak posi-tions. Next, we have studied the hexagonal phase of this dipeptide under both low- and high-temperature conditions, using nondestructive Raman spectroscopy and infrared techniques. The experimental bands have been assigned on the basis of first principles calculations. Infrared spectra were taken of the sample as the sample was cooled up to 160 K, whereas the Raman spectra were collected at even lower temperatures, around 20 K. Our vibrational data indicate a structural stability in this temperature range. On the other hand, Raman spectra recorded in the Y(XX)Y and Y(ZZ)Y polarization scheme forL,L -diphenylalanine provides evidence of a phase transition at high temperatures (≈ 390 K). The major changes occurring in the Ra-man spectrum of L,L-diphenylalanine involve the bands in the low-wavenumber region (≤200 cm−1), accompanied by the softening of the amide I peak and the broadening of bands associ-ated with the vibrational motions of the aromatic radicals. This phase transition was confirmed by thermoanalytical methods and X-ray diffraction experiments. The XRD patterns were col-lected as the sample was cooled up to 83 K (≈-190◦C) and heated to 473 K (≈200◦C). The hexagonal phase of theL,L-diphenylalanine is stable until the limit of 393-403 K is reached. Increasing the temperature from 403 to 413 K induces significant changes in the observed crys-talline phase. Finally, we report a high-pressure study (0.0-7.4 GPa) of L,L-diphenylalanine crystals using Raman spectroscopy. The application of high-pressure leads to considerable mo-difications in the vibrational bands, mainly between 3.9 GPa and 4.6 GPa. This includes the disappearance of Raman bands in the spectral region associated with the lattice mode vibrati-ons and changes in the relative intensities of some internal-mode lines. During decompression, from 7.4 GPa, the reversion to the hexagonal phase indicates that there is little or no hysteresis between 2.7 and 0.7 GPa.
LISTA DE TABELAS
Tabela 1 – Parâmetros de rede (em Å) e volume da célula unitária (em Å3) da amostra
L,L-difenilalanina, iniciais e calculados após o refinamento. . . 35 Tabela 2 – Tabela de caracteres do grupo pontualC6(6). [35] . . . 39 Tabela 3 – Comprimentos de ligação (Å), ângulos de ligação (◦) e ângulos diedros (◦)
paraL,L-difenilalanina calculados com B3LYP/6-31++G(d,p) e determinados por experimentos de difração de raios-X [32]. . . 41 Tabela 4 – Números de onda medidos por espectroscopia no infravermelho (ωIR,exp),
Ra-man (ωR,exp), calculados (ωcalc) e as atribuições de modos normais (análise PED), na escala de 0 - 1200 cm−1para a molécula deL,L-difenilalanina. . . . 45
Tabela 5 – Números de onda medidos por espectroscopia no infravermelho (ωIR,exp), Ra-man (ωR,exp), calculados (ωcalc) e as atribuições de modos normais (análise PED), na escala de 1200 - 1800 cm−1para a molécula deL,L-difenilalanina. . 48 Tabela 6 – Números de onda medidos por espectroscopia no infravermelho (ωIR,exp),
Ra-man (ωR,exp), calculados (ωcalc) e as atribuições de modos normais (análise PED), na escala de 2800 - 3700 cm−1para a molécula deL,L-difenilalanina. . 50 Tabela 7 – Atribuição das bandas infravermelho observadas em 300 K (ωexp),
frequên-çias vibracionais calculadas (ωcalc) e coeficientes de temperatura obtidos a
partir de um ajuste linear ω = ω0 + α·T. Todos os números de onda ω são dados em cm−1, enquanto os valores de temperatura (T) estão em K. . . . 51 Tabela 8 – Atribuição das bandas Raman observadas em 300 K (ωexp), frequênçias
vi-bracionais calculadas (ωcalc) e coeficientes de temperatura obtidos a partir de
um ajuste linearω =ω0 +α·T. Todos os números de ondaω são dados em cm−1, enquanto os valores de temperatura (T) estão em K. . . . 62 Tabela 9 – Atribuição das bandas Raman do cristalL,L-difenilalanina observadas para as
geometrias de espalhamento Y(XX)Y e Y(ZZ)Y à temperatura ambiente. . . 76 Tabela 10 –Parâmetros de rede (em Å) e volume da célula unitária (em Å3) da amostra
L,L-difenilalanina à 473 K, calculados a partir dos dados cristalográficos da fase ortorrômbica daL,L-difenilalanina-cíclica. . . 94 Tabela 11 –Atribuição das bandas Raman observadas em 0,0 GPa (ωexp), frequênçias
vi-bracionais calculadas (ωcalc) e coeficientes de pressão obtidos a partir de um
L,L-difenilalanina pelo método de Rietveld. . . 117 Tabela 13 –Atribuição das bandas Raman na configuração Y(XX)Y observadas em 300
K (ωexp), frequênçias vibracionais calculadas (ωcalc) e coeficientes de tempe-ratura obtidos a partir de um ajuste linearω =ω0+α·T. Todos os números de ondaω são dados em cm−1, enquanto os valores de temperatura (T) estão em
K. . . 118 Tabela 14 –Atribuição das bandas Raman na configuração Y(ZZ)Y observadas em 300 K
(ωexp), frequênçias vibracionais calculadas (ωcalc) e coeficientes de tempera-tura obtidos a partir de um ajuste linearω =ω0+α·T. Todos os números de ondaω são dados em cm−1, enquanto os valores de temperatura (T) estão em
K. . . 122 Tabela 15 –Parâmetros obtidos no refinamento dos dados cristalográficos da amostraL,L
LISTA DE FIGURAS
Figura 1 – (a) Esquema estrutural básico de um aminoácido proteico. (b) As formas qui-rais do aminoácido α−fenilalanina: a esquerda o levógiro e a direita o des-trógiro. (c) Os 20 aminoácidos encontrados nos eucarióticos agrupados pelos diferentes tipos de cadeias laterais, carregadas de acordo com o pH fisiológico. 23 Figura 2 – A ligação peptídica (a) conecta dois monômeros de aminoácidos consecutivos
em cadeias polipeptídicas (b) ou proteicas (c). . . 24 Figura 3 – Estrutura molecular básica de um dipeptídeo constituído por aminoácidos
pro-teicos. Os diedros θ, ψ eφ descrevem o arranjo molecular característico da
cadeia peptídica. . . 25 Figura 4 – Representação esquemática das estruturas cristalinas dos dipeptídeos (a)L,L
-glicilglicina e (b)L,L-alanilalanina. As pontes de hidrogênio são representa-das pelas linhas verdes tracejarepresenta-das. . . 26 Figura 5 – (a) Estrutura molecular do dipeptídeoL,L-difenilalanina (b) Cadeia
polipeptí-dica da proteínaβ-amilóide. (c) As diferentes morfologias de nanoestruturas formadas a partir do dipeptídeoL,L-difenilalanina [27]. . . 27 Figura 6 – (a) Estrutura tubular isolada encontrada no monocristal deL,L-difenilalanina,
evidenciando o canal hidrofílico. (c) Perfil tubular estabilizado por interações (π-π) entre as cadeias laterais. . . 28 Figura 7 – Configuraçãoθ−2θ para medidas em pó. A amostra é fixa e o tubo de raios-X
rotaciona a uma taxa de -θ◦/mine o detector rotaciona a uma taxa deθ◦/min. 29 Figura 8 – Analisador térmico simultâneo − Netzsch STA 449 F3 utilizado na análise
das propriedades térmicas. . . 30 Figura 9 – (a) Espectrômetro T64000 triplo monocromador da Jobin Yvon. (b) Criostato
da APD Cryogenics modelo THMS 600. (c) Sistema de aquecimento para medidas em altas temperaturas (forno caseiro). (d) Célula a extremos de di-amantes com membranas para realização de experimentos de altas pressões hidrostáticas (esquerda). A amostra é inserida em um compartimento preen-chido com líquido compressor e um pequeno pedaço de rubi (direita). . . 31 Figura 10 –Diagrama esquemático das configurações de espalhamento empregadas nos
experimentos de espectroscopia Raman envolvendo altas temperaturas. . . 32 Figura 11 –(a) Espectrômetro Vertex 70V da Bruker. (b) Acessório de reflexão única
método de Rietveld. A linha preta e os círculos vermelhos representam as intensidades teóricas e observadas, respectivamente. A linha verde indica a diferença entre os perfis observados e simulados. (b) Célula unitária hexago-nal daL,L-difenilalanina. . . 37 Figura 13 –Estrutura molecular em duas dimensões da molécula L,L-difenilalanina,
es-quematizada pela numeração atômica e separada em regiões. . . 40 Figura 14 –Representação estrutural do movimentos atômicos vibracionais com suas
des-crições correspondentes. . . 42 Figura 15 – (a) Espectro infravermelho e (b) Raman experimental (Exp) e calculado (Calc)
da moléculaL,L-difenilalanina na região espectral entre 0 e 1200 cm−1. . . . 44 Figura 16 – (a) Espectro infravermelho e (b) Raman experimental (Exp) e calculado (Calc)
da moléculaL,L-difenilalanina na região espectral entre 1200 e 1800 cm−1. . 47
Figura 17 – (a) Espectro infravermelho e (b) Raman experimental (Exp) e calculado (Calc) da molécula L,L-difenilalanina na região espectral entre 1200 e 2800 e 3500 cm−1. . . . 49 Figura 18 –Espectros infravermelho daL,L-difenilalanina observados no intervalo de
tem-peratura entre 160 e 300 K, para a faixa de frequência de (a) 350 a 600 cm−1 e (c) 600 a 800 cm−1. (b) e (d) Evolução dos números de onda do espectro infravermelho em função da temperatura. Os círculos meio abertos correspon-dem aos dados coletados durante o resfriamento. As linhas sólidas vermelhas representam o ajuste linear pelo método de mínimos quadrados. . . 55 Figura 19 –Espectros infravermelho daL,L-difenilalanina observados no intervalo de
tem-peratura entre 160 e 300 K, para a faixa de frequência de (a) 800 a 1000 cm−1 e (c) 1000 a 1200 cm−1. (b) e (d) Evolução dos números de onda do espectro
infravermelho em função da temperatura. Os círculos meio abertos correspon-dem aos dados coletados durante o resfriamento. As linhas sólidas vermelhas representam o ajuste linear pelo método de mínimos quadrados. . . 57 Figura 20 –Espectros infravermelho daL,L-difenilalanina observados no intervalo de
Figura 21 –Espectros infravermelho daL,L-difenilalanina observados no intervalo de tem-peratura entre 160 e 300 K, para a faixa de frequência de (a) 2840 a 3120 cm−1 e (c) 3120 a 3360 cm−1. (b) e (d) Evolução dos números de onda do espectro infravermelho em função da temperatura. Os círculos meio abertos correspondem aos dados coletados durante o resfriamento. As linhas sólidas vermelhas representam o ajuste linear pelo método de mínimos quadrados. . . 61 Figura 22 –Espectros Raman daL,L-difenilalanina observados no intervalo de
tempera-tura entre 20 e 300 K, para a faixa de frequência de (a) 350 a 600 cm−1e (c) 600 a 800 cm−1. (b) e (d) Evolução dos números de onda do espectro Raman
em função da temperatura. Os círculos meio abertos correspondem aos dados coletados durante o resfriamento. As linhas sólidas vermelhas representam o ajuste linear pelo método de mínimos quadrados. . . 65 Figura 23 –Espectros Raman daL,L-difenilalanina observados no intervalo de
tempera-tura entre 20 e 300 K, para a faixa de frequência de (a) 450 a 600 cm−1e (c) 600 a 800 cm−1. (b) e (d) Evolução dos números de onda do espectro Raman em função da temperatura. Os círculos meio abertos correspondem aos dados coletados durante o resfriamento. As linhas sólidas vermelhas representam o ajuste linear pelo método de mínimos quadrados. . . 67 Figura 24 –Espectros Raman daL,L-difenilalanina observados no intervalo de
tempera-tura entre 20 e 300 K, para a faixa de frequência de (a) 800 a 935 cm−1e (c) 935 a 1200 cm−1. (b) e (d) Evolução dos números de onda do espectro Raman
em função da temperatura. Os círculos meio abertos correspondem aos dados coletados durante o resfriamento. As linhas sólidas vermelhas representam o ajuste linear pelo método de mínimos quadrados. . . 69 Figura 25 –Espectros Raman daL,L-difenilalanina observados no intervalo de
tempera-tura entre 20 e 300 K, para a faixa de frequência de (a) 1140 a 1415 cm−1e (c) 1415 a 1750 cm−1. (b) e (d) Evolução dos números de onda do espectro infravermelho em função da temperatura. Os círculos meio abertos correspon-dem aos dados coletados durante o resfriamento. As linhas sólidas vermelhas representam o ajuste linear pelo método de mínimos quadrados. . . 71 Figura 26 –Espectros Raman daL,L-difenilalanina observados no intervalo de
ente para diferentes configurações de espalhamento (Y(XX)Y e Y(ZZ)Y) e espectro simulado daL,L-difenilalanina em fase gás nas regiões espectrais (a) 200-600 cm−1, (b) 600-1800 cm−1e (c) 2800-3300 cm−1. . . . 75 Figura 28 –(a) e (c) Espectros Raman da L,L-difenilalanina coletados para altas
tempe-raturas na região espectral de 35 a 250 cm−1, plotados nas configurações de espalhamento Y(XX)Y e Y(ZZ)Y, respectivamente. (b) e (d) Evolução dos números de onda do espectro Raman em função da temperatura. Os círculos meio abertos correspondem aos dados coletados durante o resfriamento. As linhas sólidas vermelhas representam o ajuste linear pelo método de mínimos quadrados. . . 79 Figura 29 –(a) e (c) Espectros Raman daL,L-difenilalanina coletados para altas
tempera-turas na região espectral de 250 a 700 cm−1, plotados nas configurações de
espalhamento Y(XX)Y e Y(ZZ)Y, respectivamente. (b) e (d) Evolução dos números de onda do espectro Raman em função da temperatura. Os círculos meio abertos correspondem aos dados coletados durante o resfriamento. As linhas sólidas vermelhas representam o ajuste linear pelo método de mínimos quadrados. . . 81 Figura 30 –(a) e (c) Espectros Raman daL,L-difenilalanina coletados para altas
tempera-turas na região espectral de 700 a 1100 cm−1, plotados nas configurações de espalhamento Y(XX)Y e Y(ZZ)Y, respectivamente. (b) e (d) Evolução dos números de onda do espectro Raman em função da temperatura. Os círculos meio abertos correspondem aos dados coletados durante o resfriamento. As linhas sólidas vermelhas representam o ajuste linear pelo método de mínimos quadrados. . . 83 Figura 31 –(a) e (c) Espectros Raman daL,L-difenilalanina coletados para altas
Figura 32 –(a) e (c) Espectros Raman daL,L-difenilalanina coletados para altas tempera-turas na região espectral de 2700 a 3100 cm−1, plotados nas configurações de espalhamento Y(XX)Y e Y(ZZ)Y, respectivamente. (b) e (d) Evolução dos números de onda do espectro Raman em função da temperatura. Os círculos meio abertos correspondem aos dados coletados durante o resfriamento. As linhas sólidas vermelhas representam o ajuste linear pelo método de mínimos quadrados. . . 87 Figura 33 –Termogramas de DSC e TG da amostraL,L-difenilalanina. . . 90 Figura 34 –Difratogramas de raios-X da L,L-difenilalanina submetida a baixas
tempe-raturas (linhas azuis). Os difratogramas foram deslocados verticalmente de acordo com a temperatura na qual foram coletados. . . 91 Figura 35 –Difratogramas de raios-X daL,L-difenilalanina submetida a altas
temperatu-ras (linhas vermelhas). Os difratogramas foram deslocados verticalmente de acordo com a temperatura na qual foram coletados. . . 92 Figura 36 –Difratogramas de raios-X daL,L-difenilalanina (após a transição de fase)
re-tornando à temperatura ambiente. As linhas vermelhas, indicam as temperatu-ras elevadas na qual a amostra foi medida. Os difratogramas foram deslocados verticalmente de acordo com a temperatura na qual foram coletados. . . 93 Figura 37 –(a) Padrão de difração de raios-X do cristal ciclo-difenilalanina refinado com
método de Rietveld. A linha preta e os círculos vermelhos representam as intensidades teóricas e observadas, respectivamente. A linha verde indica a diferença entre os perfis observados e simulados. (b) Célula unitária ortor-rômbica daL,L-difenilalanina-cíclica. . . 95 Figura 38 –Espectros Raman experimental (medido no monocristal) e simulado (na
mo-lécula isolada) daL,L-difenilalanina nas regiões espectrais (a) 200-600 cm−1,
(b) 600-1200 cm−1e (c) 1370-1800 cm−1. . . . 96 Figura 39 –(a) Espectros Raman do cristalL,L-difenilalanina observados no intervalo de
dos em pressões de 0,0 GPa e 4,6 GPa. Os círculos abertos correspondem aos dados experimentais, as linhas sólidas pretas são as funções Lorentzia-nas e as linhas sólidas vermelhas correspondem a soma de todos das funções Lorentzianas. . . 98 Figura 41 –Espectros Raman do cristalL,L-difenilalanina observados no intervalo de
pres-são entre 0,0 e 7,4 GPa, para a faixa de frequência de (a) 400-550 cm−1 e (b) 550-950 −1. Evolução dos números de onda Raman do cristal L,L -difenilalanina em função da pressão, para a faixa de frequência de (c) 400-550 cm−1 e (d) 550-950 −1. Os círculos meio abertos correspondem aos dados coletados durante a compressão. As linhas sólidas vermelhas representam o ajuste linear pelo método de mínimos quadrados. A região sombreada indica a faixa de pressão onde ocorre a transição de fase. . . 100 Figura 42 –Espectros Raman do cristalL,L-difenilalanina observados no intervalo de
pres-são entre 0,0 e 7,4 GPa, para a faixa de frequência de (a) 970-1070 cm−1 e (b) 1500-1800 −1. Evolução dos números de onda Raman do cristal L,L -difenilalanina em função da pressão, para a faixa de frequência de (c) 970-1070 cm−1e (d) 1500-1800−1. Os círculos meio abertos correspondem aos dados coletados durante a compressão. As linhas sólidas vermelhas represen-tam o ajuste linear pelo método de mínimos quadrados. A região sombreada indica a faixa de pressão onde ocorre a transição de fase. . . 102 Figura 43 –Espectros Raman daL,L-difenilalanina para regiões de baixa frequência,
me-didos ao longo da (a) descompressão e (b) compressão da amostra. . . 107 Figura 44 – Efeito da absorção do fóton na energia potencial e amplitude interatômica de
vibração. . . 129 Figura 45 – Diagrama de espalhamento de luz, a radiação emitida pela oscilação do
di-polo molecular. . . 131 Figura 46 – Diagrama do tubo de raios-X. . . 133 Figura 47 – Espectro de raios-X do molibdênio em função da voltagem aplicada.
Adap-tada de [73]. . . 134 Figura 48 – Transições eletrônicas em um átomo (esquema). . . 135 Figura 49 – Diagrama esquemático do Síncrotron. . . 136 Figura 50 – Esquema do espalhamento da radiação. A onda incidente com vetor de onda
LISTA DE SÍMBOLOS
ν Estiramento
δ Deformação angular
wag Deformação angular simétrica fora do plano ρ Deformação angular simétrica no plano
τ Deformação angular antissimétrica fora do plano
νs Estiramento simétrico
D Dextrógiro
L Levógiro
TGA Thermogravimetric Analysis
DSC Differential Scanning Calorimetry
CCD Charge-Coupled Device
MDAC Membrane Diamond Anvil Cell
IR Infrared
DLaTGS Deuterated Triglycine Sulfate Doped with L-Alanine KBr Brometo de Potássio
DFT Density Functional Theory
PCM Polarizable Continuum Model
PED Potential Energy Distribution
VEDA Vibrational Energy Distribution Analysis Rwp R-weighted-pattern
Rp R-pattern
SUMÁRIO
1 INTRODUÇÃO . . . 22
2 ASPECTOS TEÓRICOS . . . 23
2.1 L,L-Difenilalanina . . . 27
3 MATERIAIS E MÉTODOS . . . 29
3.1 A amostra do dipeptídeoL,L-difenilalanina . . . 29
3.2 Experimentos de difração de raios-X . . . 29
3.3 Experimentos de análise termigravimétrica e de calorimetria exploratória diferencial . . . 30
3.4 Experimentos de espectroscopia Raman . . . 30
3.5 Experimentos de espectroscopia no infravermelho . . . 33
3.6 Metodologia Computacional . . . 33
4 RESULTADOS . . . 35
4.1 Análise do cristal de L,L-difenilalanina à temperatura ambiente . . . 35
4.1.1 Refinamento dos dados cristalográficos à temperatura ambiente . . . 35
4.1.2 Análise vibracional do grupo espacial . . . 38
4.1.3 Análise estrutural da moléculaL,L-difenilalanina simulada em fase gás . . . 39
4.1.4 Atribuição dos modos normais de vibração . . . 42
4.1.5 Espectroscopia Raman e infravermelho daL,L-difenilalanina à temperatura ambiente . . . 43
4.1.5.1 Região espectral entre 0 e 1200 cm−1 . . . . 43
4.1.5.2 Região espectral entre 1200 e 1800 cm−1 . . . . 47
4.1.5.3 Região espectral entre 2800 e 3500 cm−1 . . . . 49
4.2 Medidas com temperatura . . . 51
4.2.1 Espectroscopia no infravermelho em baixas temperaturas . . . 51
4.2.1.1 Região espectral entre 350 e 800 cm−1 . . . . 54
4.2.1.2 Região espectral entre 800 e 1200 cm−1 . . . . 56
4.2.1.3 Região espectral entre 1200 e 1800 cm−1 . . . . 58
4.2.1.4 Região espectral entre 2840 e 3360 cm−1 . . . . 60
4.2.2 Espectroscopia Raman em baixas temperaturas . . . 62
4.2.2.1 Região espectral entre 60 e 300 cm−1 . . . . 65
4.2.2.2 Região espectral entre 450 e 800 cm−1 . . . . 66
4.2.2.5 Região espectral entre 2900 e 3100 cm−1 . . . . 72
4.2.3 Discussão dos resultados da medidas com baixas temperaturas . . . 74
4.2.4 Espectroscopia Raman em altas temperaturas . . . 75
4.2.4.1 Região espectral entre 35 e 250 cm−1 . . . . 78
4.2.4.2 Região espectral entre 250 e 700 cm−1 . . . . 80
4.2.4.3 Região espectral entre 700 e 1100 cm−1 . . . . 82
4.2.4.4 Região espectral entre 1100 e 1800 cm−1 . . . . 84
4.2.4.5 Região espectral entre 2700 e 3100 cm−1 . . . . 86
4.2.5 Discussão dos resultados da medidas com altas temperaturas . . . 88
4.2.6 Análise térmica . . . 90
4.2.7 Difração de raios-X em função da temperatura . . . 91
4.2.8 Refinamento dos dados cristalográficos da amostra após a transição de fase . 94 4.3 Medidas com pressão . . . 96
4.3.1 Espectroscopia Raman . . . 96
4.3.1.1 Regiao espectral entre 40 e 300 cm−1 . . . . 97
4.3.1.2 Regiao espectral entre 400 e 950 cm−1 . . . . 99
4.3.1.3 Regiao espectral entre 970 e 1800 cm−1 . . . 101
4.3.2 Descompressão da amostra . . . 107
4.3.3 Discussão dos resultados da medidas com pressão . . . 107
5 CONCLUSÕES E PERSPECTIVAS . . . 109
REFERÊNCIAS . . . 111
APÊNDICE A -- PARÂMETROS REFINADOS DO PADRÃO DE DIFRA-ÇÃO DA LL-DIFENILALANINA. . . 117
APÊNDICE B -- AJUSTE LINEAR DOS MODOS RAMAN DA LL- DI-FENILALANINA EM ALTAS TEMPERATURAS . . . 118
APÊNDICE C -- PARÂMETROS REFINADOS DO PADRÃO DE DIFRA-ÇÃO DAL,L-DIFENILALANINA APÓS A TRANSIÇÃO DE FASE. . . . 126
ANEXO A -- TÉCNICAS DE ESPECTROSCOPIA VIBRACIONAL . . . 127
A.1 Infravermelho . . . 127
A.1.1 O modelo clássico para a molécula diatômica . . . 128
A.2 Fundamentos teóricos do efeito Raman . . . 129
A.2.1 A descrição clássica do efeito Raman . . . 130
A.3 Regras de Seleção . . . 132
ANEXO B -- DIFRAÇÃO DE RAIOS-X . . . 133
B.1.1 Tubo de raios-X . . . 133
B.1.2 Síncrotron . . . 135 B.2 Equações de Laue . . . 137
1 INTRODUÇÃO
Aminoácidos são estruturas capazes de regular diversos processos fisiológicos, fun-cionando como sinalizadores em processos endócrinos, pancreáticos e até mesmo viabilizando a propagação da informação sináptica no sistema nervoso [1]. Além disso, essas estruturas fun-cionam como blocos moleculares das cadeias proteicas, que desempenham papel metabólico fundamental nos seres vivos. Essas diferentes atividades biológicas se devem a alta variabili-dade estrutural das cadeias laterais presentes nas estruturas à base de aminoácidos [2].
Uma das propriedades mais importantes dos aminoácidos é a capacidade de formar ligações covalentes entre si, especialmente chamadas de ligações peptídicas. Em particular, os dipeptídeos são estruturas orgânicas formadas a partir de uma única ligação peptídica entre dois aminoácidos. A variabilidade conformacional dessas estruturas e suas diferentes possibilida-des de empacotamento molecular são consideradas as granpossibilida-des responsáveis pelo fenômeno de polimorfismo observado em grande parte dos cristais moleculares à base de peptídeos [3]. Os estudos envolvendo cristais de aminoácidos e pequenos peptídeos buscam investigar as con-dições externas que influenciam na estabilidade e/ou modificação das suas fases estruturais. Controlar o aparecimento de estruturas polimórficas, bem como suas propriedades físicas par-ticulares, é fundamental para utilização prática dessas estruturas e fornece parâmetros físicos importantes para o desenvolvimento de novos materiais.
23
2 ASPECTOS TEÓRICOS
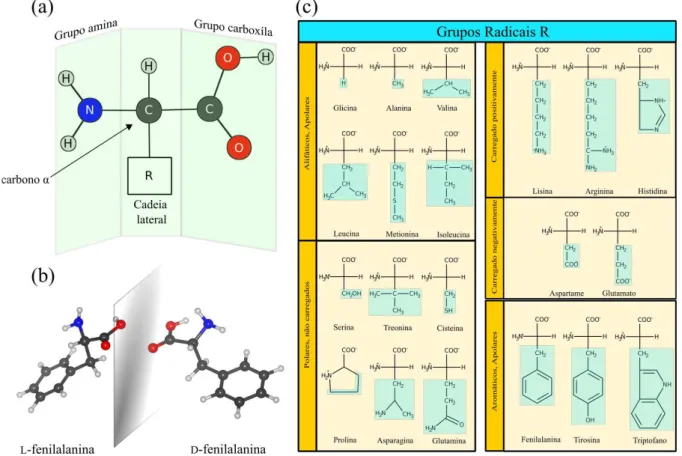
Individualmente, todo aminoácido proteico é constituído por um grupo amina, um grupo carboxílico e uma cadeia lateral, ligados a um carbono central, como esquematizado na Fig. 1(a). Com exceção da glicina, os demais aminoácidos apresentam pelo menos um carbono quiral, exibindo atividade ótica por meio de enantiômeros dextrógiros (D) ou levógiros (L). Por exemplo, o aminoácido fenilalanina possui um grupo lateral benzilo e apresenta isômeros
L- e D- relacionados enantiomericamente, como esquematizado na Fig. 1(b). Entre os mais de trezentos aminoácidos naturais, apenas vinte deles funcionam como blocos de construção proteica em seres eucarióticos e são conhecidos como aminoácidos primários [4].
Figura 1: (a) Esquema estrutural básico de um aminoácido proteico. (b) As formas quirais do aminoácidoα−fenilalanina: a esquerda o levógiro e a direita o destrógiro. (c) Os 20 aminoáci-dos encontraaminoáci-dos nos eucarióticos agrupaaminoáci-dos pelos diferentes tipos de cadeias laterais, carregadas de acordo com o pH fisiológico.
Fig. 1(c) e suas propriedades são listadas a esquerda de cada grupamento. No total existem cinco classes de aminoácidos primários, cujos grupos R são: alifáticos apolares, aromáticos (geralmente apolares), polares não carregados, carregados negativamente e carregados positiva-mente [5]. Uma das propriedades mais importantes dos aminoácidos é a capacidade de formar ligações covalentes entre si, especialmente chamadas de ligações peptídicas. Essa ligação re-sulta de uma reação entre a porção ácida de um dos aminoácidos com o grupamento amina de outro resíduo. Como produto, uma molécula de água é liberada e os aminoácidos são ligados por meio de um grupo amida (−CO−NH−) [6]. As ligações entre diversos aminoácidos cons-tituem cadeias que, dependendo do tamanho, são classificadas como peptídeos, polipeptídeos e proteínas (ver Fig. 2).
Figura 2: A ligação peptídica (a) conecta dois monômeros de aminoácidos consecutivos em cadeias polipeptídicas (b) ou proteicas (c).
Os dipeptídeos, em particular, são estruturas orgânicas formadas a partir de uma única ligação peptídica entre dois aminoácidos. Assim como qualquer cadeia peptídica, essas moléculas são identificadas partir da extremidade N-terminal, ou seja, a partir do nome do re-síduo que contém o grupo amina livre seguido do aminoácido C-terminal [1]. Uma descrição simplificada da estrutura molecular de um dipeptídeo pode ser obtida através dos ângulos die-drais, como esquematizado na Fig. 4. O ânguloθ determina as posições relativas das cadeias
laterais, enquanto os ângulosψeφ descrevem o arranjo conformacional do esqueleto da cadeia
25
mais elevadas, em torno de 120◦C [8, 9]. Enquanto a tirosina (tyr) é praticamente insolúvel em
água (0,4 g/L) a 20◦C, o dipeptídeo ala-tyr pode ser dissolvido nas mesmas condições em até
14 g/L. Em alguns casos, essa diferença na solubilidade pode ser ainda maior. As solubilida-des da alanina (ala) e da glutamina (gln) são 89 g/L e 36 g/L, respectivamente, enquanto que a solubilidade da ala-gln é de 586 g/L [10].
Figura 3: Estrutura molecular básica de um dipeptídeo constituído por aminoácidos proteicos. Os diedrosθ,ψ eφ descrevem o arranjo molecular característico da cadeia peptídica.
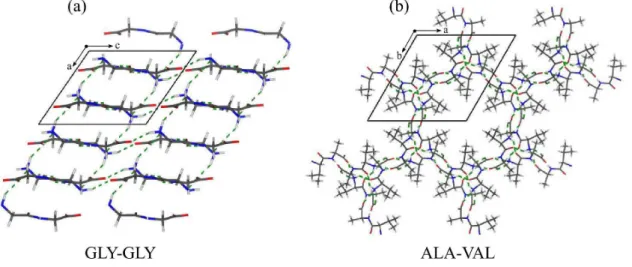
Os cristais moleculares de aminoácidos e pequenos peptídios foram inicialmente usados no refinamento das primeiras estruturas cristalinas de proteínas [11]. Entretanto, com o avanço das técnicas de resolução estrutural, as características físicas desses materiais passa-ram a ser exploradas em outras áreas de estudo, como no desenvolvimento de modelos teóricos que descrevem a distribuição da densidade eletrônica e padrões de empacotamento de biopo-límeros [12]. Por outro lado, trabalhos experimentais tem reportado a presença de diversas propriedades físicas importantes em cristais à base de peptídeos, incluindo alta rigidez, piezoe-letricidade e efeitos óticos não-lineares [13–15]. Identificados como entidades supramolecula-res, esses cristais são formados por uma auto-organização estabilizada por múltiplas interações inter- e intra- moleculares, como pontes de hidrogênio, interações de van der Walls e empilha-mentosπ-π [16]. Uma característica quase universal na estrutura cristalina desses materiais é a
por um eixo de simetria parafuso [7]. Assim, as estruturas cristalinas tridimensionais são cons-truídas de várias formas, desde um empacotamento de moléculas empilhadas em camadas, até mesmo a formação de nano-poros tridimensionais com cavidades hidrofílicas ou hidrofóbicas de tamanhos variáveis.
Figura 4: Representação esquemática das estruturas cristalinas dos dipeptídeos (a) L,L -glicilglicina e (b) L,L-alanilalanina. As pontes de hidrogênio são representadas pelas linhas verdes tracejadas.
27
Controlar o aparecimento de estruturas polimórficas, bem como suas propriedades físicas par-ticulares, é fundamental para utilização prática dessas estruturas e fornece parâmetros físicos importantes para o desenvolvimento de novos materiais.
2.1 L,L-Difenilalanina
AL,L-difenilalanina é um pequeno peptídeo alifático formado por apenas dois re-síduos deL-fenilalanina, como mostrado na Fig. 5(a). Esse dipepitídeo foi inicialmente inves-tigado pelo seu papel fundamental na formação das fibrilas amilóides, estruturas polipeptídi-cas responsáveis por diversas doenças degenerativas, como doença de Alzheimer, doença de Creutzfeldt-Jakob e diabetes tipo 2 [24–26]. Na Fig. 5(b), podemos observar a presença da
L,L-difenilalanina na estrutura secundária da proteínaβ−amilóide (-F19-F20-), um precursor das fibrilas amiloides. Os estudos envolvendo esse dipeptídeo tem sido crescente nos últimos anos, principalmente pela capacidade dessa molécula de se auto-organizar em diferentes am-bientes (aquosos ou orgânicos), formando nanoestruturas estáveis com diferentes morfologias (ver Fig. 5(c)) e capacidades funcionais, incluindo nanofibras, nanovesículas, nanotubos, entre outros [27].
Figura 5: (a) Estrutura molecular do dipeptídeo L,L-difenilalanina (b) Cadeia polipeptídica da proteínaβ-amilóide. (c) As diferentes morfologias de nanoestruturas formadas a partir do
dipeptídeoL,L-difenilalanina [27].
como visto nas Fig. 6 (a) e (b). Os tubos apresentam ainda canais abertos com diâmetros em torno 12 Å, preenchidos por moléculas de água que contribuem para a estabilidade física do cristal. Além disso, esses canais hidrofílicos apresentam dimensões suficientes para o trans-porte de ions e encapsulamento de pequenas moléculas, característica explorada em aplicações biomédicas e biotecnológicas. [29, 30]. Trabalhos com microscopia de força atômica e mi-croscopia ótica não linear reportaram também fenômenos de piezoeletricidade e de geração de segundo harmónico (GSH) nas estruturas tubulares deL,L-difenilalanina, caracterizando esse material como um potencial componente de dispositivos eletrônicos e óticos [22].
A fase hexagonal do dipeptídeoL,L-difenilalanina tem sido bastante explorada nos últimos anos afim de modificar as propriedades físicas desse material, incluindo a sua alta ri-gidez e seus fenômenos óticos não lineares. Entre esses trabalhos, investigações teóricas e experimentais apontam uma transição de fase irreversível deste material por volta de 390 e 410 K [31]. Nesta tese, realizamos uma investigação da estabilidade cristalina desse dipeptídeo em baixas temperaturas. Além disso, reportamos os espectros Raman coletados em duas configu-rações de espalhamento para o cristalL,L-difenilalanina submetido em altas temperaturas a fim de caracterizar as evidências locais da transição de fase a partir do ponto de vista vibracional. Por fim, estudos envolvendo aL,L-difenilalanina sob altas pressões hidrostáticas também foram realizados com intuito de identificar possíveis transições de fase.
Figura 6: (a) Estrutura tubular isolada encontrada no monocristal deL,L-difenilalanina, eviden-ciando o canal hidrofílico. (c) Perfil tubular estabilizado por interações (π-π) entre as cadeias
29
3 MATERIAIS E MÉTODOS
3.1 A amostra do dipeptídeoL,L-difenilalanina
O dipeptídeo L,L-difenilalanina na forma de pó (98% de pureza), com fórmula molécular C18H20N2O3·xH2O, foi adquirido a partir da empresa química Sigma−Aldrich Co. (EUA) e utilizado sem purificação adicional. As medidas presentes nesta tese foram realizadas no pó e em monocristais daL,L-difenilalanina, obtidos pela evaporação rápida (em torno de uma à duas horas à 80oC) de uma solução aquosa saturada do dipeptídeo com concentração de 2 mg/ml. Enquanto a amostra em pó apresenta uma cor branca, os cristais são incolores e em formato de agulhas, similares as amostras obtidas em etanol ou metanol [32].
3.2 Experimentos de difração de raios-X
A medida de difração de raios-X à temperatura ambiente foi realizada em monocris-tais pulverizados deL,L-difenilalanina, enquanto as medidas envolvendo variações de tempe-ratura foram realizadas diretamente na amostra em pó (policristalina). Os difratogramas foram obtidos pelo difratômetro de raios-X Bruker D8Advanceequipado com uma câmara de alta e baixa temperatura, operando com uma linha de radiação Kα do cobre (λ =1,540 Å) e geome-tria de aquisição de dados Bragg-Brentano. Nas medidas envolvendo variações de temperatura, a amostra foi submetida a vácuo. Nesta geometria, o feixe de radiação monocromática rotaci-ona um ânguloθ e os dados são coletados por um detector que se move em 2θ, como visto
no esquema da Fig. 7. A amostra em pó foi inicialmente resfriada de 303 K até 83 K, em um intervalo de 10 K. Em seguida, retornou à temperatura ambiente e foi aquecida até 473 K, em intervalos de 10 K.
Figura 7: Configuração θ−2θ para medidas em pó. A amostra é fixa e o tubo de raios-X
rotaciona a uma taxa de -θ◦/mine o detector rotaciona a uma taxa deθ◦/min.
durante os experimentos foram de 40kV e 40 mA, respectivamente. Todas as medidas foram obtidas no intervalo angular 5◦≤ 2θ ≤40◦ e com passo angular de 0,01◦ por segundo. A
análise de Rietveld do difratograma em temperatura ambiente foi realizada utilizando o pacote Fullprof [33, 34] com os parâmetros estruturais reportados por Mason et al [32].
3.3 Experimentos de análise termigravimétrica e de calorimetria exploratória diferen-cial
As propriedades térmicas foram determinadas através do analisador térmico simul-tâneo STA 449 F3 da Netzsch, ilustrado na Fig. 8, operando no modo de termogravimétrica (do inglês: Thermogravimetric Analysis - TGA) e de calorimetria exploratória diferencial (do inglês:Differential Scanning Calorimetry- DSC). As análises foram realizadas em uma atmos-fera controlada de nitrogênio (N2). A amostra L,L-difenilalanina na forma de pó (cerca de 4 mg) foi colocada em um pequenocontainerdo equipamento (cadinho) e submetida a variações de temperatura em um intervalo de 303 a 630 K, com uma taxa de aquecimento de 5K/min.
Figura 8: Analisador térmico simultâneo−Netzsch STA 449 F3 utilizado na análise das pro-priedades térmicas.
3.4 Experimentos de espectroscopia Raman
31
Charge-Coupled Device- CCD) resfriado com nitrogênio liquido. A fonte de luz utilizada nas medidas envolvendo variações de temperatura origina-se de um laser de argônio (Ar+)
emi-tindo em um comprimento de onda de 514,5 nm e potência de saída de 70 mW. Os espectros coletados tanto no experimento à temperatura ambiente quanto nas medidas em baixas tempe-raturas referem-se à amostraL,L-difenilalanina na forma de pó. Essas medidas foram realizadas com duas varreduras e um tempo de acumulação de 100 segundos, coletando a luz espelhada a frequência de 60 a 3800cm−1. Um criostato da APDCryogenicsmodelo THMS 600, visto na Fig. 9(b), acoplado a um compressor de gás hélio e um controlador de temperatura Lake Shore modelo 330 foram usados para resfriar a amostra em pó, submetida à vácuo, em um intervalo de 30/20 K até uma temperatura próxima de 20 K.
Figura 9: (a) Espectrômetro T64000 triplo monocromador da Jobin Yvon. (b) Criostato da APD Cryogenics modelo THMS 600. (c) Sistema de aquecimento para medidas em altas tempera-turas (forno caseiro). (d) Célula a extremos de diamantes com membranas para realização de experimentos de altas pressões hidrostáticas (esquerda). A amostra é inserida em um comparti-mento preenchido com líquido compressor e um pequeno pedaço de rubi (direita).
medidas, o monocristal foi colocado em um forno (ver Fig. 9(c)) desenvolvido no programa de pós-graduação em Física da UFC [36], onde a temperatura é monitorada por um controlador de temperatura (Coel Hw4200) e um termopar tipo K (constituído por um fio de Cromel como elemento positivo, e Alumel como negativo), localizado próximo ao porta amostra. A amostra foi aquecida a partir da temperatura ambiente até 413 K, em intervalos de 10 K.
Figura 10: Diagrama esquemático das configurações de espalhamento empregadas nos experi-mentos de espectroscopia Raman envolvendo altas temperaturas.
Nas medidas envolvendo altas pressões hidrostáticas foi utilizado um laser Verdi (Coherent) operando em um comprimento de onda de 532 nm e potência de saída 70 mW. Essas medidas foram realizadas em uma célula a extremos de diamantes com membrana (do inglês: Membrane Diamond Anvil Cell - MDAC). A força sobre os diamantes, esquematizada na Fig. 9(d), é gerada enchendo-se a membrana da célula com gás argônio, conduzido através de um tubo capilar. Esta célula, em princípio, permite controlar a força aplicada e usar diver-sos meios compressores como óleo mineral (Nujol), metanol, etanol e diverdiver-sos outros álcoois. O monocristal L,L-difenilalanina foi carregado em uma MDAC juntamente com um pequeno pedaço de rubi e uma gaxeta pré-indentada, com espessura de 45µm e orifício de 120µm de
33
3.5 Experimentos de espectroscopia no infravermelho
Os espectros de infravermelho (do inglês:Infrared- IR) foram coletados para amos-tra na forma de pó, utilizando um espectrômetro de absorção no infravermelho por amos-transformada de Fourier FT-IR VERTEX 70V da Bruker, como mostrado na Fig. 11(a), equipado com um de-tetor de Alanina Dopada com Sulfato de Triglicina Deuterada (DLaTGS) e um divisor de feixe de silício, permitindo medidas no infravermelho médio e distante. Uma lâmpada de vapor de mercúrio foi utilizada como fonte de luz na na região do infravermelho distante (10 - 400 cm−1),
enquanto uma lâmpada globar (carbeto de silício) foi usada para as medidas na região do in-fravermelho médio (400 - 4000 cm−1). Todas as medidas foram realizadas sob vácuo, com 128 varreduras e resolução de 2 cm−1. A medida à temperatura ambiente foi realizada com o acessório de reflectância total atenuada (PLATINUM ATR), identificado na Fig. 11(b), no in-tervalo de 130 até 3500 cm−1. As medidas com baixas temperaturas foram realizadas em uma pastilha compactada deL,L-difenilalanina com brometo de potássio (KBr). Essa pastilha foi obtida a partir do seguinte procedimento: aproximadamente 5 mg da amostra em pó de L,L -difenilalanina foi dissolvida em 100 mg de KBr, em seguida esse composto foi colocado sobre um pastilhador de 13 mm de diâmetro (comercializado pela PIKE) e prensado a 7 toneladas por uma prensa hidráulica. Nestes experimentos foram utilizados ainda um criostato VPF-100 da JANIS (ver Fig. 11(c)) e um controlador de temperatura Lake Shore modelo 330. O intervalo de frequência medido em todas as temperaturas foi de 350 até 3360 cm−1. A amostra foi resfriada da temperatura ambiente (≈300 K) até 160 K, em intervalos de 20 K.
3.6 Metodologia Computacional
Dis-Figura 11: (a) Espectrômetro Vertex 70V da Bruker. (b) Acessório de reflexão única (Platinum – ATR com cristal de diamante). (c) Criostato VPF-100 da JANIS.
35
4 RESULTADOS
4.1 Análise do cristal de L,L-difenilalanina à temperatura ambiente
4.1.1 Refinamento dos dados cristalográficos à temperatura ambiente
O programa Fullprof foi utilizado para confirmação da fase estrutral do monocristal deL,L-difenilalanina através do método Rietveld de refinamento [33, 34, 43]. O difratograma teórico foi inicialmente calculado a partir dos dados cristalográficos coletados do banco de dados da Cambridge Crystallographic Data Centre(CCDC) com número 994054 [32]. Uma função perfil pseudo-Voigt foi usada para modelar o formato dos picos de difração. Inicialmente apenas os parâmetros de deslocamento na posição da amostra, fator de escala e o coeficienteW
(relacionado a largura à meia altura dos picos de difração) foram otimizados. Em seguida, os coeficientes polinomiais (que determinam a radiação de fundo) e os parâmetros de rede (a,be
c). Os dados cristalográficos do difratograma calculado estão associados a uma célula unitária hexagonal, com grupo espacial P61, sem nenhum sítio especial de Wyckoff. Isto permite, em princípio, a otimização das coordenadas espaciais de qualquer átomo da estrutura cristalina. Entretanto, apenas as posições atômicas dos carbonos foram refinadas. Por último, os parâ-metros térmicos isotrópicos e os coeficientesU eV foram refinados. Os parâmetros de rede refinados (a, b, c eV) apresentaram uma pequena variação numérica com relação aos dados experimentais [32], com variações∆a, ∆b, ∆c e∆V iguais a -0,019 Å, -0,019 Å, -0.003 Å e -5,4 Å3, respectivamente. Os parâmetros de rede calculados são mostrados na Tabela 1.
Tabela 1: Parâmetros de rede (em Å) e volume da célula unitária (em Å3) da amostraL,L-difenilalanina, iniciais e calculados após o refinamento.
Parâmetros a(Å) b(Å) c(Å) V (Å3)
Iniciais1 24,160 24,160 5,459 2759,5 Refinados 24,141 24,141 5,456 2754.1
1Retirados da Ref. [32].
Confirmada a fase cristalina pertencente à amostraL,L-difenilalanina, a análise vi-bracional do grupo espacial será apresentada na próxima subseção, quantificando os modos vibracionais previstos nos experimentos de espectroscopia Raman e infravermelho. Em segui-da, os espectros Raman e infravermelho para amostraL,L-difenilalanina à temperatura ambiente são apresentados, juntamente com a classificação dos modos normais de vibração.
4.1.2 Análise vibracional do grupo espacial
Nesta subseção é apresentada uma análise vibracional do grupo espacial do cristal daL,L-difenilalanina utilizando o método do sítio nuclear [35]. De acordo com a analise Ri-etveld, a estrutura cristalina do dipeptídeo é formada pelo empilhamentoπ-π de grupos fenil ao longo de um arranjo helicoidal repleto de moléculas de água. Porém, trabalhos experi-mentais reportam quantidades diferentes de moléculas de água preenchendo as estruturas tubu-lares [28, 32]. Um vez que esses estudos concordam que o cristal deL,L-difenilalanina possui uma unidade hexagonal, decidimos usar os dados cristalográficos mais atualizados tanto no refi-namento de Rietveld quanto na nossa análise vibracional, conforme mostrado na Fig. 6 (a) [32]. Assim, a estrutura cristalina possui um grupo espacialP61(C62) com seis unidades assimétricas por célula unitária (Z=6), cada unidade é composta por uma molécula deL,L-difenilalanina (43 átomos) e duas moléculas de água (6 átomos). Todos os átomos encontram-se em posi-ções não especiais de Wyckoff, sítioacom simetriaC1 [44]. Segundo a Tabela 21(B e C) da Ref. [35], os modos mecânicos, provenientes do sítio a ocupado, devem possuir as seguintes representações irredutíveis:
M=3A+3B+32E2+31E1+31E2+32E1. (4.1)
No total existem 882 modos vibracionais associados com representações irredutíveis do tipo:
Γcristal=147A+147B+1472E2+1471E1+1471E2+1472E1, (4.2)
entre eles, há três modos acústicos caracterizados por representações irredutíveis ΓAcústico =
A+1E1+2E1(ver Tabela 21E da Ref. [35]). Os modos restantes são óticos com representações irredutíveis descritas por:
Γóticos=146A+147B+1472E2+1461E1+1471E2+1462E1. (4.3)
Entre esses 879 modos óticos, 846 são modos internos das moléculas presentes no cristal (Z(3N−6)) e 33 modos são de vibrações da rede, sendo 18 librações (3Z) e 15 vibrações translacionais (3Z−3). Os modos cujas representações irredutíveis são do tipo: A,2E
39
mostrado na Tabela 2 de caracteres do grupo pontualC6[35].
Tabela 2: Tabela de caracteres do grupo pontualC6(6)1. [35]
C6(6) E C6 C3 C2 (C3)2 (C6)5 Fun.Linear Fun.Quadr.
A 1 1 1 1 1 1 z;Rz x2+y2+z2
B 1 -1 1 -1 1 -1
E1
1 ε -ε* -1 -ε ε* x+iy;Rx+iRy
(xz,yz) 1 ε* -ε -1 -ε* ε x−iy;Rx−iRy
E2
1 -ε* -ε 1 -ε* -ε
(x2−y2,xy) 1 -ε -ε* 1 -ε -ε*
1 ε=exp(2πi/6)
4.1.3 Análise estrutural da moléculaL,L-difenilalanina simulada em fase gás
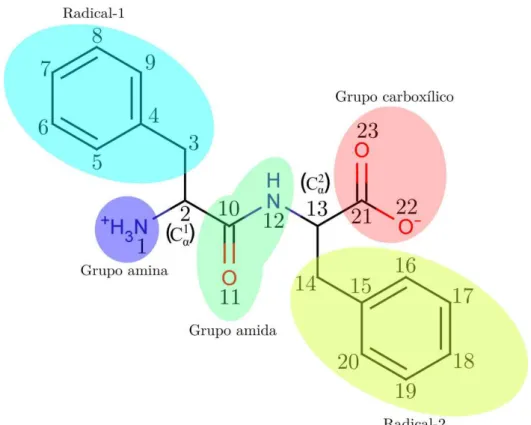
A estrutura molecular da L,L-difenilalanina (grupo pontual C1) foi modelada de maneira isolada (fase gás), levando em conta apenas efeitos implícitos de moléculas de água por meio de um modelo de polarização continua (PCM). Assim, a atribuição dos modos normais se limita a regiões de frequência acima de 200 cm−1, onde os movimentos vibracionais são primariamente associados aos modos internos da molécula. A análise estrutural e vibracional se encontra em conformidade com a nomenclatura de átomos e regiões apresentadas no esquema da Fig. 13.
A Tabela 3 apresenta os comprimentos de ligação, ângulos de ligação e ângulos di-edros calculados com B3LYP/6-31++G(d,p) e obtidos experimentalmente por difração de raios X [32]. Após a otimização, os comprimentos de ligação otimizados apresentaram-se levemente superiores aos medidos experimentalmente. Como a simulação foi realizada para a molécula em fase gás esse resultado é esperado, dado que as contribuições das interações intermoleculares no cristal não foram consideradas. É importante lembrar que no estado sólido as moléculas de
L,L-difenilalanina estão dispostas de forma helicoidal, interagindo através de múltiplas ligações de hidrogênio locais, incluindo interações entre os grupos amina e grupos carboxílicos (N1H+
3 +· · · −O23O22C21) e entre os grupos carboxílicos e grupos amida (C21O22O23− · · · N12-H). Portanto, além das ligações, os diedros e os ângulos de ligação também foram ligeiramente mo-dificados após a otimização da molécula isolada. Por exemplo, os ângulos de ligação formados a partir dos átomos (N1-C2-C10) e (N12-C13-C21) são 106◦ e 116◦ no ambiente cristalino,
enquanto os valores obtidos na simulação são 104◦e 116.9◦. Os diedros que determinam a
Figura 13: Estrutura molecular em duas dimensões da moléculaL,L-difenilalanina, esquemati-zada pela numeração atômica e separada em regiões.
foram modificados, os valores calculados são 157,1◦e 53,8◦, enquanto os medidos
experimen-talmente são 156,9◦ e 54,7◦, respectivamente. Os parâmetros estruturais que mais se afastam
do resultado experimental se referem aos diedros formados pelos átomos (C16-C15-C14-C13) = 164,0◦ e (C5-C4-C3-C2) = 93,2◦. Na molécula isolada, esses valores diminuem para
(C16-C15-C14-C13) = 115,6◦ e (C5-C4-C3-C2) = -101,4◦. Esses diedros determinam as posições
relativas das cadeias laterais aromáticas em relação ao esqueleto do dipeptídeo. A disposição das cadeias laterais daL,L-difenilalanina no cristal é mantida por interações de empilhamento
41 Tabela 3: Comprimentos de ligação (Å), ângulos de ligação (◦) e ângulos diedros (◦) paraL,L-difenilalanina calculados com B3LYP/6-31++G(d,p) e
determi-nados por experimentos de difração de raios-X [32].
Comprimento de ligação (Å) B3LYP/6-31++G(d,p) Raios-X Ângulo de ligação (◦) B3LYP/6-31++G(d,p) Raios-X Ângulo diedro (◦) B3LYP/6-31++G(d,p) Raios-X
N1-C2 1.508 1.487 C3-C2-N1 111.1 112.7 N12-C10-C2-N1 157.1 156.9
C2-C3 1.556 1.536 C4-C3-C2 115.7 114.4 C21-C13-N12-C10 53.8 54.7
C3-C4 1.517 1.518 C5-C4-C3 119.8 120.8 C4-C3-C2-N1 40.5 66.9
C4-C5 1.405 1.383 C6-C5-C4 120.9 120.4 C5-C4-C3-C2 -101.4 -93.2
C5-C6 1.399 1.384 C7-C6-C5 120.0 120.4 C6-C5-C4-C3 179.2 179.5
C6-C7 1.397 1.376 C8-C7-C6 119.6 119.9 C7-C6-C5-C4 0.3 1.3
C7-C8 1.400 1.373 C9-C8-C7 120.2 119.6 C8-C7-C6-C5 0.2 -0.2
C8-C9 1.397 1.380 C10-C2-N1 104.3 106.3 C9-C8-C7-C6 -0.4 -0.2
C2-C10 1.548 1.528 O11-C10-C2 118.9 120.2 C10-C2-N1-C3 124.1 124.1
C10-O11 1.240 1.221 N12-C10-C2 115.7 116.0 O11-C10-C2-N1 -23.2 -25.9
C10-N12 1.337 1.334 C13-N12-C10 124.2 120.7 C13-N12-C10-C2 -172.9 -179.4
N12-C13 1.471 1.465 C14-C13-N12 112.6 113.0 C14-C13-N12-C10 -77.2 -73.1
C13-C14 1.542 1.522 C15-C14-C13 114.2 117.6 C15-C14-C13-N12 -65.8 -68.3
C14-C15 1.517 1.510 C16-C15-C14 121.3 118.6 C16-C15-C14-C13 115.6 164.0
C15-C16 1.402 1.383 C17-C16-C15 121.3 121.3 C17-C16-C15-C14 179.4 173.5
C16-C17 1.400 1.377 C18-C17-C16 120.1 120.5 C18-C17-C16-C15 -0.1 0.6
C17-C18 1.397 1.370 C19-C18-C17 119.4 119.7 C19-C18-C17-C16 -0.3 1.4
C18-C19 1.400 1.352 C20-C15-C14 120.2 123.8 C20-C15-C14-C13 0.2 -19.7
C15-C20 1.397 1.387 C21-C13-C12 111.7 111.0 O22-C21-C13-N12 -150.8 -138.8
C13-C21 1.576 1.533 O22-C21-C13 116.4 119.1 O23-C21-C13-N12 33.2 44.5
C21-O22 1.260 1.253 O23-C21-C13 116.0 116.9
4.1.4 Atribuição dos modos normais de vibração
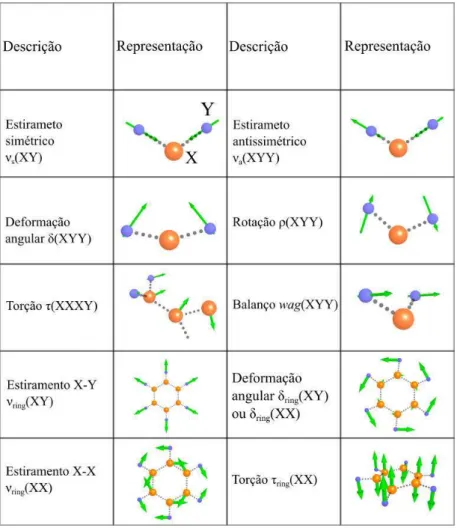
A atribuição dos modos normais de vibração se baseou na análise da distribuição de energia potencial (PED) realizada com o programa VEDA 4 [42]. Os resultados teóricos obtidos nesta tese demonstraram uma boa concordancia com outros trabalhos da literatura [45,46]. Uma vez que os modos normais de vibração são compostos por diversos movimentos moleculares, a análise apresentada nas tabelas de atribuição (Tabela 4, Tabela 5 e Tabela 6) levam em conside-ração apenas movimentos cuja percentagem PED é maior que 10%. As vibrações moleculares foram representadas de seis formas, incluindo estiramento (ν) simétrico (s) e antissimétrico (a),
deformação angular (δ), deformação angular simétrica fora do plano (balanço ouwag), defor-mação angular antissimétrica no plano (rotação ouρ) e deformação angular antissimétrica fora
do plano (torção ouτ). Esses movimentos vibracionais são ilustrados na Fig. 14.
43
4.1.5 Espectroscopia Raman e infravermelho daL,L-difenilalanina à temperatura ambiente
Nesta subseção são apresentados os espectros Raman e infravermelo para a amostra em pó daL,L-difenilalanina à temperatura ambiente. As bandas experimentais foram analisa-das com base nos correspondentes espectros Raman e infravermelho simulados em diferentes regiões espectrais.
4.1.5.1 Região espectral entre 0 e 1200 cm−1
A Fig. 15 apresenta os espectros Raman e infravermelho experimentais e calculados daL,L-difenilalanina na região espectral entre 0 e 1200 cm−1. As bandas observadas nessa re-gião espectral foram atribuídas de acordo com a Tabela 4. Essa faixa de frequência corresponde a modos normais caracterizados por várias torções e deformações em toda a estrutura mole-cular. É importante notar que as atribuições dos modos normais de vibração foram realizadas apenas nos picos com frequências acima de 200 cm−1. Na região com número de onda abaixo de 200 cm−1 foram encontrados cinco bandas no espectro Raman, associadas a vibrações na
rede (modos externos) que não são adequadamente descritas pela análise teórica vibracional da molécula isolada. Em geral, as vibrações existentes nessa região correspondem a movimen-tos coletivos das diversas moléculas presentes no ambiente cristalino, incluindo movimenmovimen-tos ao longo de ligações intermoleculares fracas, formadas, por exemplo, por ligações de hidro-gênio ou van-der-Waals [47]. No caso particular daL,L-difenilalanina, esses modos de baixa frequência estão diretamente relacionados ao sensível acoplamento presente entre o esqueleto do dipeptídeo e as moléculas de água que preenchem a estrutura tubular formada no ambiente cristalino.
A região espectral entre 200 e 600 cm−1apresenta principalmente modos de vibra-ção relacionados a torções nos diedros do grupo amida e nos anéis aromáticos que compõem as cadeias laterais. Ao contrário das bandas de infravermelho, as bandas Raman observadas nessa região apresentam baixa intensidade. Mesmo assim foi possível correlacionar o espectro experimental e simulado nessa região, como pode ser visto noinset da Fig. 15(b). As bandas Raman em torno de 222 e 237 cm−1 foram atribuídas a deformações antissimétricas do grupo amina (N1H+
3) e dobramentos das cadeias laterais. No espectro de infravermelho, os picos em torno 350-400 cm−1foram atribuídos principalmente a diversas deformações e torções nos dois
anéis fenil das cadeias laterais.
Na região entre 400 a 510 cm−1, tanto o espectro Raman quanto o infravermelho revelam a presença de bandas associadas a torções vibracionais do grupo amida. Por volta de 485 cm−1, um pequeno pico foi relacionado a uma deformação angular do grupo carboxilato
re-Figura 15: (a) Espectro infravermelho e (b) Raman experimental (Exp) e calculado (Calc) da moléculaL,L-difenilalanina na região espectral entre 0 e 1200 cm−1.
45
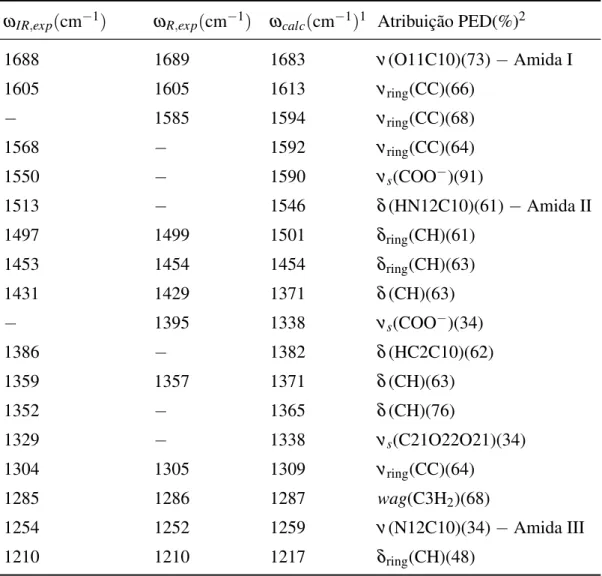
Tabela 4: Números de onda medidos por espectroscopia no infravermelho (ωIR,exp), Raman (ωR,exp), calculados (ωcalc) e as atribuições de modos normais (análise PED), na escala de 0 - 1200 cm−1para a molécula deL,L-difenilalanina.
ωIR,exp(cm−1) ωR,exp(cm−1) ωcalc(cm−1)1 Atribuição PED(%)2
1198 1192 1196 ν(C14C15)(54)
− 1184 1183 νring(CC)(71)
1159 1160 1160 δring(CH)(89)
1144 − 1156 δring(CH)(82)
1122 1122 1121 wag(N1H+
3)(52)
1080 1086 1086 δring(CH)(55)
1048 − 1072 ν(N12C13)(40)
1039 1039 1030 δring(CH)(60)
1031 1033 1028 δring(CH)(64)
1002 1003 992 δring(CC)(62)
− 991 990 wagring(CH)(67)
982 − 981 wagring(CH)(92)
956 955 969 wagring(CH)(89)
926 − 962 wagring(CH)(91)
917 919 957 wagring(CH)(82)
882 − 929 τ(C2C3C4C9)(36)
− 877 917 wagring(CH)(16)
867 867 913 wagring(CH)(61)
854 − 894 δ(C10N12C13)(32)
834 824 855 ν(C2C3)(23) +ν(C3C4)(10)
819 814 844 τ(HC9C4C3)(90)
784 786 801 δ(C2C3C4)(16)
764 764 752 δring(CC)(35)
748 745 738 wagring(CH)(64)
730 732 727 wagring(CH)(47)
702 701 697 wagring(CH)(73)
657 658 655 δ(C10C2N1)(33)
621 623 619 δring(CC)(82)
590 595 602 wagring(CH)(27)
Tabela 4: (continua)
ωIR,exp(cm−1) ωR,exp(cm−1) ωcalc(cm−1)1 Atribuição PED(%)2
534 542 531 δring(CC)(44)
503 503 506 τ(HN12C10C2)(72)
485 485 476 δ(COO−)(35)
463 465 448 τ(N12C13C21O22)(32)
437 − 431 τ(N1C2C3C4)(15)
412 − 407 τring(CC)(89)
393 − 366 δring(CC)(47)
381 − 353 δring(CC)(56)
353 350 334 δring(CC)(55)
323 − 318 δ(COO−)((47)
302 303 294 δ(C2C10N12)(53)
274 − 290 δ(C2C3C4)(57)
237 246 ρ(N1H+3) (77) +δ(C2C3C4)(17)
− 222 226 δ(C15C14H)(27) +ρ(N1H+3)(13)
191 − Modos de rede
172 172 − Modos de rede
161 − − Modos de rede
− 136 − Modos de rede
− 114 − Modos de rede
− 81 − Modos de rede
Símbolos: ν=estiramento,νs=estiramento simétrico ,νa=estiramento
antissimé-trico ,δ =dobramento angular,ρ =rotação,wag= balanço,τ =torção.
1Os fatores de escala 0,955 e 0,977 foram aplicados sobre os números de onda
calcu-lados acima e abaixo de 1800 cm−1, respectivamente.
47
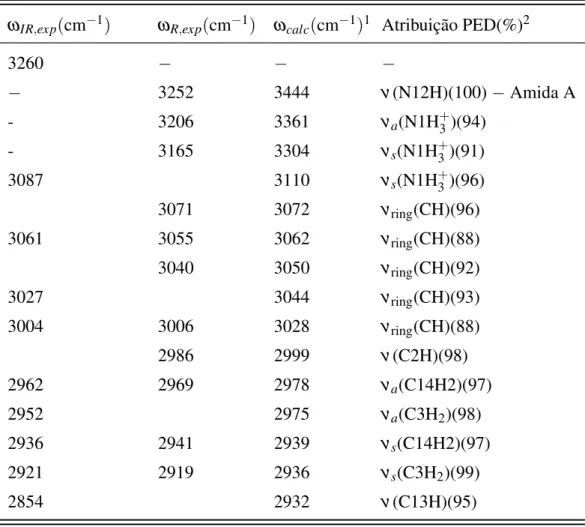
4.1.5.2 Região espectral entre 1200 e 1800 cm−1
Na Fig. 16 são apresentadas as bandas Raman e de infravermelho, simuladas e observadas experimentalmente, na faixa de frequênçia entre 1200 e 1800 cm−1. A Tabela 5 apresenta as atribuições correspondentes as bandas observadas nessa região de frequência. Os espectros Raman e infravermelho revelam a presença de uma banda em torno de 1210 cm−1, associada a deformações nos anéis fenil do dipeptídeo. O pico localizado em 1252 cm−1 no espectro Raman (1254 cm−1 no IR) corresponde ao estiramento (N12-C10) do grupo amida, característico de estruturas peptídicas e conhecido como modo amida III. A frequência desse modo depende tanto da configuração conformacional do esqueleto peptídico quanto das ligação de hidrogênio locais entre o N-H e o grupo carboxilato (COO−) [28].
Figura 16: (a) Espectro infravermelho e (b) Raman experimental (Exp) e calculado (Calc) da moléculaL,L-difenilalanina na região espectral entre 1200 e 1800 cm−1.
O pico localizado em torno de 1286 cm−1no espectro Raman (1285 cm−1no IR) foi associado principalmente a uma deformação simétrica fora do plano em um dos carbonosα do
bandas Raman em torno de 1585 e 1605 cm−1. A banda de absorção no infravermelho em torno
de 1513 cm−1 foi atribuída ao modo Amida II, ou seja, uma deformação angular dos átomos (HN12C10). As bandas localizados acima de 1500 cm−1 no espectro infravermelho são largas e relativamente intensas. O pico mais visível por volta de 1550 cm−1 corresponde ao estira-mento (ν) simétrico do grupo carboxílico (COO−). A largura dessa banda se confunde com a
localização do modo vibracional em torno de 1585 cm−1, identificado no espectro Raman. O pico Raman localizado em torno de 1689 cm−1(1688 cm−1 no IR) foi atribuído a outro modo característico de estruturas peptídicas, amida I. Esse modo consiste basicamente do estiramento C=O do grupo amida.
Tabela 5: Números de onda medidos por espectroscopia no infravermelho (ωIR,exp), Raman (ωR,exp), calculados (ωcalc) e as atribuições de modos normais (análise PED), na escala de 1200 - 1800 cm−1para a molécula deL,L-difenilalanina.
ωIR,exp(cm−1) ω
R,exp(cm−1) ωcalc(cm−1)1 Atribuição PED(%)2
1688 1689 1683 ν(O11C10)(73)−Amida I
1605 1605 1613 νring(CC)(66)
− 1585 1594 νring(CC)(68)
1568 − 1592 νring(CC)(64)
1550 − 1590 νs(COO−)(91)
1513 − 1546 δ(HN12C10)(61)−Amida II
1497 1499 1501 δring(CH)(61)
1453 1454 1454 δring(CH)(63)
1431 1429 1371 δ(CH)(63)
− 1395 1338 νs(COO−)(34)
1386 − 1382 δ(HC2C10)(62)
1359 1357 1371 δ(CH)(63)
1352 − 1365 δ(CH)(76)
1329 − 1338 νs(C21O22O21)(34)
1304 1305 1309 νring(CC)(64)
1285 1286 1287 wag(C3H2)(68)
1254 1252 1259 ν(N12C10)(34)−Amida III
1210 1210 1217 δring(CH)(48)
Símbolos: ν =estiramento,νs=estiramento simétrico ,νa=estiramento antis-simétrico ,δ =dobramento angular,ρ=rotação,wag= balanço,τ=torção.
1Os fatores de escala 0,955 e 0,977 foram aplicados sobre os números de onda
calculados acima e abaixo de 1800 cm−1, respectivamente.
49
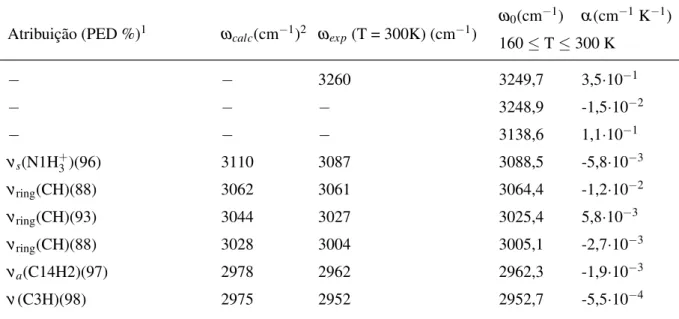
4.1.5.3 Região espectral entre 2800 e 3500 cm−1
Os espectros simulados e experimentais Raman e infravermelho daL,L-difenilalanina na região espectral entre 2800 e 3700 cm−1são apresentadas na Fig. 17. A Tabela 6 contém as atribuições de modos normais para as bandas dessa região de frequência. As bandas observadas nesta faixa de frequencia possuem um complexo comportamento em cristais de peptídeos, pois certos movimentos moleculares participam ativamente de ligações de hidrogênio, por exemplo, os estiramentos das unidades CH, CH2, NH e NH+3. No caso particular daL,L-difenilalanina, que apresenta um ambiente cristalino hidratado, essa região deve apresentar ainda estiramentos das moléculas de H2O. As bandas observadas entre 2900-3000 cm−1foram atribuídas a diver-sos estiramentos simétricos e antissimétricos dos carbonosβ (C3 e C14) daL,L-difenilalanina. Entre 3000 e 3100 cm−1, cerca de cinco bandas surgem devido aos diversos estiramentos dos
Figura 17: (a) Espectro infravermelho e (b) Raman experimental (Exp) e calculado (Calc) da moléculaL,L-difenilalanina na região espectral entre 1200 e 2800 e 3500 cm−1.
hidrogênios dos anéis aromáticos do dipeptídeo. Estiramentos simétricos e antissimétricos do grupo amina são claramente observados no espectro Raman nas bandas entre 3150 e 3200 cm−1. Além disso, uma banda larga e quase sem intensidade foi atribuída ao modo Amida A, ou se-ja, um estiramento N12-H do grupo amida. Essas mesmas bandas no espectro infravermelho são encobertas por uma banda larga em torno de 3260 cm−1. Essa banda, em princípio, se