Universidade de Trás-os-Montes e Alto Douro
Estudo electrocardiográfico em cães de raça
Galgo Inglês
Dissertação de Mestrado em
Mestrado Integrado em Medicina Veterinária
Inês Rodrigues Santos
Orientador: Professora Doutora Maria João Miranda Pires
Universidade de Trás-os-Montes e Alto Douro
Estudo electrocardiográfico em cães de raça
Galgo Inglês
Dissertação de Mestrado em
Mestrado Integrado em Medicina Veterinária
Inês Rodrigues Santos
Orientador: Professora Doutora Maria João Miranda Pires
Composição do Júri:
_____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________
DECLARAÇÃO
NOME: Inês Rodrigues Santos
C.C.: 14007823
TELEMÓVEL: 919338476
CORREIO ELECTRÓNICO: ines.r.santos00@gmail.com
DESIGNAÇÃO DO MESTRADO: Mestrado Integrado em Medicina Veterinária
TÍTULO DA DISSERTAÇÃO DE MESTRADO EM MEDICINA VETERINÁRIA: Estudo eletrocardiográfico em cães de raça Galgo Inglês
ORIENTADOR: Professora Doutora Maria João Miranda Pires
ANO DE CONCLUSÃO: 2017
Declaro que esta dissertação de mestrado é resultado da minha pesquisa e trabalho pessoal e das orientações dos meus supervisores. O seu conteúdo é original e todas as fontes consultadas estão devidamente mencionadas no texto e na bibliografia final. Declaro ainda que este trabalho não foi apresentado em nenhuma outra instituição para obtenção de qualquer grau académico.
Vila real, 19 de Junho de 2017 Inês Rodrigues Santos
Agradecimentos
À Universidade de Trás-os-Montes e Alto Douro, a todos os professores, técnicos, auxiliares e funcionários, muito obrigado.
À Professora Doutora Maria João Miranda Pires por ter aceite ser minha orientadora e por toda a ajuda e apoio que sempre me prestou.
Ao banco de sangue animal (BSA), principalmente ao Dr. Rui Ferreira e à auxiliar Liliana, um grande obrigada por me terem possibilitado fazer este trabalho e por toda a ajuda que me deram.
A todo o corpo clínico do HV Trofa, Dr. Diogo Frias (director clínico), Dr. André Cálix, Dr. Diana Alves, Dr. Dora Pinheiro, Dr. Rita Pereira, Enf. Nádia Reis, Enf. Diana Gomes e Auxiliar Pamela Matos, um sincero obrigado por fazerem do meu estágio inesquecível e a melhor das experiencias que poderia ter tido.
Um especial agradecimento aos meus pais que me permitiram estudar e que me acompanharam e apoiaram em todos as alegrias e dificuldades que fui vivendo durante o meu período académico. À minha irmã, que esteve sempre ao meu lado e que festejou comigo todas as minhas conquistas e chorou comigo todas as minhas derrotas. Agradeço também à minha restante família, principalmente aos meu avós que foram sempre uns grandes pilares na minha vida.
Às minhas bichas, Milu, Mia, Lira e Cuba, que me alegraram todos os dias e me fizeram companhia em todos os serões de estudo.
Agradeço também ao Mário e à Filipa que me acompanharam sempre de perto e que fizeram do meu percurso académico único e inesquecível. Nos bons e nos maus momentos foram os melhores que tive e espero continuar a ter sempre a meu lado. Obrigada!
Às minhas meninas, Ana Silva, Bárbara Coimbra, Cláudia Gonçalves, Maria Torres, Mariana Gama, Silvana Pontes, Sílvia Braga e Taís Segantini, o maior obrigado do mundo por serem tão importantes e por terem marcado a minha vida académica como mais ninguém marcou.
Obrigada também aos restantes “verdadeiros da bila”, que fizeram deste percurso único. Foram e são parte fundamental na minha vida e vou levar-vos sempre no coração.
Por fim, mas não menos importante, um obrigada ao meu avó Albano, que esteja onde estiver terá o maior orgulho de me ver acabar mais esta grande etapa da
minha vida. Obrigada pela maravilhosa pessoa que eras e pelo quanto animaste os meus dias sempre que estavas presente.
Resumo
O eletrocardiograma (ECG) é um importante meio de diagnóstico na prática Médico-Veterinária, especialmente no diagnóstico e monitorização de arritmias. A abordagem tradicional na interpretação do ECG é a comparação dos resultados obtidos para um animal, com os intervalos de referência existentes para a espécie em questão. No entanto, os intervalos de referência são afetados por muitos fatores nomeadamente a idade, o género e a raça. Por isso, é importante o estabelecimento de intervalos de referência para cada raça, tendo em conta o género e a faixa etária de cada indivíduo. Deste modo, o objetivo principal deste trabalho foi estabelecer valores de referência específicos para a raça Galgo Inglês, comparar os valores obtidos com os valores de referência já existentes para os cães em geral e por fim, estudar a influência do género, peso e idade sobre os parâmetros de ECG estudados.
Neste trabalho foram utilizados 27 cães de raça Galgo Inglês pertencentes ao banco de sangue animal, 14 fêmeas e 13 machos. Todos os animais incluídos no estudo foram considerados saudáveis com base nos dados obtidos na anamnese, no exame físico, hemograma, bioquímica sérica (creatinina, proteínas totais, alanina aminotransferase e fosfatase alcalina) e o PCR de Leishmania spp., Ehrlichia spp.,
Anaplasma spp., Babesia spp. e Dirofilaria immitis. Para a realização do ECG, os
animais foram separados dos restantes de forma a que lhe fosse proporcionado um ambiente tranquilo.
Quando comparados os valores obtidos com os valores da literatura, a maioria dos parâmetros apresenta parte dos valores fora do intervalo de referência, sendo que a duração da onda P, a duração do complexo QRS e a amplitude da onda R, apresentam mais de 50% dos valores fora da referência. Esta diferença dos valores obtidos com os valores encontrados na literatura pode ser explicada na maioria dos parâmetros pela síndrome do coração atlético. Segundo os valores obtidos, o género, peso ou idade, não parecem influenciar de forma estatisticamente significativa os resultados, exceto o intervalo P-R que parece ser influenciado pelo peso.
Mesmo com todas as limitações que este trabalho apresentou, os resultados obtidos salientam a necessidade de os valores de referência utilizados para a interpretação do ECG serem adaptados à raça em questão, uma vez que se verificaram diferenças entre os valores obtidos e os valores de referência utilizados para a generalidade dos cães.
Palavras chave: Galgo Inglês; Electrocardiografia; Parâmetros electrocardiográficos; Valores de referencia pra ECG.
Abstract
The electrocardiogram (ECG) is an important diagnostic tool used in veterinary medicine practice, especially in to diagnose and monitoring arrhythmias. The traditional approach in ECG interpretation is to compare the results obtained from an animal with references for its species. However, reference ranges are affected by many factors including age, gender and breed. It is therefore important to establish reference ranges for each breed, taking into account the gender and age of each individual. Thus, the main objective of this work was to establish specific reference values for the English Greyhound breed, compare the values obtained with the reference values already available for dogs in general, and finally, to study the influence of gender, weight and age on the ECG parameters studied.
In this work 27 dogs of Greyhound breed belonging to the animal blood bank were used, 14 females and 13 males. All animals included in the study were considered healthy based on the data obtained in the anamnesis, physical examination, hemogram, serum biochemistry (creatinine, total proteins, ALT, ALP) and PCR assays for diagnosis of Leishmania spp., Ehrlichia spp., Anaplasma spp., Babesia spp. and Dirofilaria immitis. To perform the ECG, the animals were separated from the rest of the group in order to provide a quiet environment.
When comparing the values obtained with the literature, most of the parameters present part of the values outside the reference range, with the duration of the P wave, the duration of the QRS complex and the amplitude of the R wave, presenting more than 50% values outside the reference. Athletic heart syndrome can explain differences of the values obtained with the values found in the literature. According to the values obtained, gender, weight or age did not seem to influence the results, except for the P-R interval that seems to be influenced by weight.
Even with all this work limitations, the results obtained highlight the need for the reference values of ECG to be adapted to each breed, since there were differences between the values obtained and the reference values used for most dogs.
Keywords: English Greyhound; Electrocardiography; Electrocardiographic parameters; ECG reference values.
Índice geral
Agradecimentos...v Resumo...vii Abstract...ix Índice de figuras...xiii Índice de tabelas...xv Índice de gráficos...xvii Lista de siglas...xviii I. Revisão bibliográfica...1 1. Eletrofisiologia cardíaca...1 2. Ciclo cardíaco...23. Eletricidade nas células cardíacas...5
a. Potencial de ação transmembranar...5
b. Células marcapasso e sistema especializado de condução elétrica...8
c. Formação do complexo P-QRS-T...10 4. Inervação cardíaca...11 5. Electrocardiograma...12 a. Indicações...13 b. Limitações...15 c. Como fazer...15 d. Valores de referência...16
6. Galgo Inglês: Especificidades da raça...18
II. Componente prática...21
1. Objetivos...21
2. Materiais e Métodos...22
3. Resultados...24
a. Caracterização da amostra...24
b. Valores eletrocardiográficos obtidos para o Galgo Inglês ...24
c. Valores eletrocardiográficos obtidos para o Galgo Inglês- comparação com os intervalos de referência segundo Martin (2002b)...28
d. Valores eletrocardiográficos obtidos para o Galgo Inglês-influência do género...39
e. Valores eletrocardiográficos obtidos para o Galgo Inglês-influência do
peso...30
f. Valores eletrocardiográficos obtidos para o Galgo Inglês-influência da idade...32
4. Discussão de resultados...34
a. Valores eletrocardiográficos obtidos para o Galgo Inglês- comparação com os intervalos de referência segundo Martin (2002b)...34
b. Valores eletrocardiográficos obtidos para o Galgo Inglês-influência do género...40
c. Valores eletrocardiográficos obtidos para o Galgo Inglês-influência do peso...41
d. Valores eletrocardiográficos obtidos para o Galgo Inglês-influência da idade...41
III. Conclusões e perspectivas futuras...43
IV. Referências bibliográficas...45
Índice de figuras
• Figura 1- Esquema representativo do ciclo cardíaco. Adaptado de Cochran, 2011...3 • Figura 2- Potenciais de ação nos miócitos (à esquerda) e nas células do nodo SA (à direita). Adaptado de Ferez, 2012………...……….7 • Figura 3- Sistema de condução elétrica do coração. Adaptado de Spielmann, 2004………...9 • Figura 4 – Esquema representativo da diástole e sístole associadas com o
ECG. Adaptado de Fox et al., 1999...10 • Figura 5- Esquema da colocação normal dos elétrodos. Adaptado de Afonso et
al., 2004...14
• Figura 6- Imagem de um Galgo Inglês. Adaptado de http://es.123rf.com/clipart-vectorizado/galgo.html...19 • Figura 7 – Local de colocação dos eletrodos (fotografia gentalmente cedida
pelo banco de sangue animal)...23 • Figura 8 – À esquerda uma representação gráfica da percentagem de animais
com arritmia sinusal respiratória vs ritmo sinusal regular. À direta uma imagem ilustrativa de um traçado sinusal normal (a.) e um traçado arrítmico sinusal respiratório (b.)...24
Índice de tabelas
• Tabela 1- Valores de referência para diferentes raças de cães. Retirado de (Onyango et al., 1992; Su et al., 2002; Hanton e Rabemampianina, 2006; Bavegems et al., 2009; Atmaca e Emre, 2010; Cardoso et al., 2013; Filipa et
al., 2013; Gugjoo et al., 2014; Mukherjee et al., 2015; Kumar et al.,
2016)...17 • Tabela 2 – Estatística descritivas das variáveis idade e peso corporal consoante o sexo...24 • Tabela 3 – Valores obtidos para os diferentes parâmetros avaliados no ECG de cada animal...26 • Tabela 4 – Estatística descritiva, intervalos de referência e intervalo de confiança a 90% para os parâmetros estudados. DP: desvio padrão; LI: limite inferior; IC: intervalo de confiança; LS: limite superior...28 • Tabela 5 – Tabela representativa das médias observadas no estudo, valores de referência segundo Martin, (2002) e % de valores fora dos mesmos...28 • Tabela 5 – Média e desvio padrão dos elementos interpretados do ECG para
cada género, macho e fêmeas...29 • Tabela 6 – Média, desvio padrão e valor de p dos parâmetros estudados no ECG para dois grupos diferentes de peso...31 • Tabela 7 - Média e desvio padrão dos elementos interpretados do ECG para dois grupos de idades...33
Índice de gráficos
• Gráfico 1 – Representação gráfica dos valores de p encontrados para os grupos do género...30 • Gráfico 2 - Representação gráfica dos valores de p encontrados para os grupos do peso...32 • Gráfico 3 - Representação gráfica dos valores de p encontrados para os grupos
Lista de siglas
ECG – electrocardiograma SA - sinoatrial AV - atrioventricular VD – ventrículo direito VE – ventrículo esquerdo AD – átrio direito AE – átrio esquerdoBSA – banco de sangue animal bpm – batimentos por minuto s - segundos
mV – milivoltes
MAD – membro anterior direito MAE – membro anterior esquerdo MPD – membro posterior direito MPE – membro posterior esquerdo
I.
Revisão Bibliográfica
1. Electrofisiologia cardíaca
O coração tem a capacidade intrínseca de contrair, assim não depende de impulsos nervosos para que se inicie uma contração. Este vai continuar a bater ritmicamente mesmo que o sistema nervoso esteja gravemente afetado (Cochran, 2011). Contudo, a frequência cardíaca é condicionada por impulsos do sistema nervoso parassimpático e do sistema nervoso simpático (Fox et al., 1999).
As células do músculo cardíaco, ao contrário das do músculo esquelético e liso, estão eletricamente ligadas umas às outras através de correntes iónicas chamadas “jump the gap”. Assim sendo, o potencial de ação propaga-se de célula em célula fazendo com que todas contraiam em sincronia, como uma unidade, e depois relaxem. O músculo cardíaco é então um sincício funcional (Cunningham e Klein, 2007).
Para que as células musculares contraiam é necessário que um potencial de ação seja produzido e chegue à membrana celular das mesmas através da abertura dos canais iónicos. No coração são observados dois potenciais de ação, um de ação rápida e um de ação lenta que vão estar associados com as mudanças na permeabilidade da membrana celular, principalmente aos iões de sódio, potássio e cálcio (Oyama et al., 2014). Todas as células do miocárdio e do sistema de condução especializado são excitáveis, se um estímulo de força e duração apropriado for aplicado a uma célula forma-se um potencial de ação (Tilley, 1979). Devido ao facto do músculo cardíaco formar um sincício funcional, qualquer célula do mesmo pode iniciar um batimento cardíaco. Por outras palavras, quando uma célula despolariza e forma um potencial de ação, este vai propagar-se de célula em célula por todo o coração, fazendo com que contraia. Só algumas células especializadas (células marcapasso) têm capacidade de despolarizar espontaneamente e formar potenciais de ação, a esta capacidade chamamos de automatismo cardíaco. Estas células estão presentes no nodo sinoatrial (SA), no nodo atriventricular (AV), no feixe de His e respetivos ramos e nas fibras de purkinje (Cunningham e Klein, 2007). Depois de formado o potencial de ação, este propaga-se pelo sistema de condução especializado até que atinja todas as células musculares cardíacas (Oyama et al., 2014). O potencial de ação vai despolarizar primeiro os dois átrios e depois, com um tempo de intervalo, os dois ventrículos. Depois disto o coração é repolarizado a tempo da formação do seguinte potencial de ação (Martin, 2007).
De todas as células marcapasso que encontramos no coração, são as células do nodo SA as que têm capacidade de produzir mais rapidamente um impulso elétrico, por isso são consideradas o marcapasso do coração (Martin, 2007). Então, cada batimento cardíaco normal inicia-se por um potencial de ação formado no nodo SA que se propaga através dos átrios, primeiro o direito e depois o esquerdo, até que chega ao nodo AV através dos feixes internodais. Ao chegar ao nodo AV a condução abranda marcadamente, devido às características de despolarização lenta presente nas células deste nodo (Oyama et al., 2014). Sendo que os átrios e os ventrículos estão separados por um tecido de conexão que não pode formar nem conduzir um potencial de ação, o impulso tem obrigatoriamente que passar pelo nodo AV. Isto faz com que haja um atraso entre a contração atrial e a contração ventricular (Cunningham e Klein, 2007). Do nodo AV o impulso passa pelo feixe de His e continua-se pelos seus ramos, esquerdo e direito, que o vão conduzir até ao ventrículo esquerdo e direito respectivamente. Na fase final dos ramos do feixe de His saem numerosas fibras denominadas fibras de purkinje, estas estão ligadas ao miocárdio ventricular (Cochran, 2011). Assim, o impulso elétrico percorre todo o músculo cardíaco e dá-se a contração atrioventricular.
É esta atividade elétrica que é detetada pelo eletrocardiógrafo e que é traduzida no traçado do electrocardiograma (Martin, 2002a).
2. Ciclo cardíaco
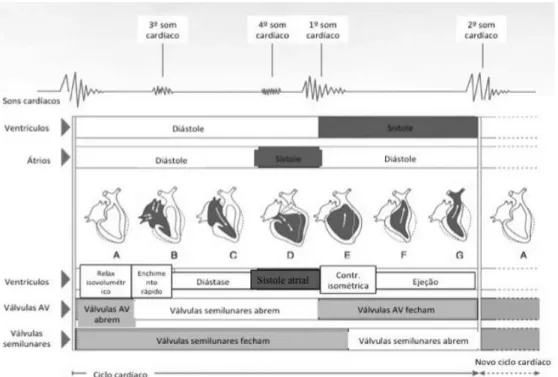
O ciclo cardíaco corresponde à sequência de eventos que ocorre durante a contração e o relaxamento do coração (Fox et al., 1999). É importante conhecer-se o ciclo cardíaco de um animal saudável e poder relaciona-lo com as ondas elétricas que são detetadas no ECG.
No ciclo cardíaco, como demonstrado na figura 1, observam-se duas fases, a contração e o relaxamento. A contração ou sístole, é a fase ativa, quando a energia é gasta, e é nesta fase que se observa o processo de esvaziamento das câmaras cardíacas. No relaxamento ou diástole, ocorre o enchimento das câmaras cardíacas e é considerada a fase de descanso (Reece, 2005; Cochran, 2011). A sístole e a diástole estão ainda divididas em diferentes fases de atividade cardíaca (Kittleson e Kienle, 1998). A sístole pode ser dividida em duas fases: contração isovolumétrica e ejeção ventricular e a diástole em quatro fases: relaxamento isovolumétrico, enchimento rápido ventricular, diástase e sistole atrial (Fukuta e Little, 2008; Keene et al., 2015).
Ambos os átrios contraem praticamente ao mesmo tempo, assim como os dois ventrículos (Cochran, 2011). O ciclo cardíaco começa com os átrios relaxados, recebendo o sangue vindo da veia cava e veia pulmonar. Quando a pressão nos átrios supera a pressão dos ventrículos as valvas atrioventriculares (AV) abrem deixando o sangue fluir para os ventrículos, começando aqui o período de enchimento rápido ventricular. A este período segue-se a diástase que corresponde ao enchimento lento e passivo dos ventrículos e dá-se quando existe um equilíbrio entre as pressões nos átrios e nos ventrículos (Kittleson e Kienle, 1998; Keene et al., 2015). Durante esta fase de relaxamento dos átrios, aproximadamente 70% do volume ventricular fica preenchido. Depois disto os átrios contraem, ou seja dá-se a sístole atrial, forçando os restantes 30% de sangue a ir para os ventrículos de forma a que estes se encham completamente. Nesta fase os ventrículos estão relaxados, correspondendo por isso ao final da diástole ventricular. O volume de sangue presente nos ventrículos é chamado de volume diastólico final (Cochran, 2011; Akers e Denbow, 2013). No ECG o ciclo cardíaco é iniciado pela onde P, que representa a onda elétrica que vai estimular os átrios a contrair (sístole atrial) (Fox et al., 1999).
Seguidamente, os ventrículos começam a contrair, ou seja começa a sístole
Figura 1- Esquema representativo do ciclo cardíaco. Adaptado de Cochran, 2011.
pressão nos átrios e as valvas AV fecham, produzindo um som audível que é o primeiro som cardíaco. Quando a pressão ventricular é inferior à pressão na artéria aorta e no tronco pulmonar, por fração de segundo, o coração tem todas as valvas fechadas e o volume ventricular mantêm-se constante, acontecendo o que se denomina de contração isovolumétrica. Esta fase é caracterizada por um aumento brusco da pressão ventricular (Kittleson e Kienle, 1998). No ECG, o sinal elétrico que causa a contração dos ventrículos corresponde ao complexo QRS. Ao continuar a contrair o ventrículo vence a pressão das artérias e as valvas semilunares (pulmonar e aórtica) abrem, começando a fase de ejeção ventricular que está dividida em duas fases, uma fase inicial e breve de ejeção rápida e outra fase posterior e mais longa de ejeção lenta (Keene et al., 2015). O sangue move-se para dentro das artérias, do ventrículo direito para o tronco pulmonar e do ventrículo esquerdo para a artéria aorta, que devido à sua elasticidade, dilatam e permitem que a pressão dentro desses vasos se torne suficiente para ultrapassar a pressão nos ventrículos e as valvas semilunares fechem. As valvas ao fecharem produzem um som audível que é considerado o segundo som cardíaco (Cochran, 2011). Nesta fase o ventrículo fica com um volume pequeno, chamado de volume sistólico final; o volume diastólico final menos o volume sistólico final é igual ao volume de sangue que é ejetado para as artérias a quando da sístole ventricular. O encerramento das valvas semilunares é considerado o final da sístole e início da diástole (Kittleson e Kienle, 1998).
No início da diástole, a pressão nos ventrículos vai diminuindo, os músculos ventriculares ficam relaxados e o volume ventricular não se altera, o que faz com que se observe uma fase de relaxamento isovolumétrico, estando todas as valvas cardíacas fechadas. Quando os ventrículos atingem pressões inferiores às dos átrios as valvas tricúspide e mitral abrem e começa a fase de enchimento rápido ventricular, que dá origem ao terceiro som cardíaco. O quarto som cardíaco corresponde à sístole atrial (Keene et al., 2015). Tanto o terceiro como o quarto sons cardíacos, em cães saudáveis, são ouvidos somente através de um estetoscópio esofágico. Se estes sons poderem ser auscultados com um estetoscópio normal, é sinal de alerta para um possível problema cardíaco (Cochran, 2011). A frequência a que se repete o ciclo difere de animal para animal.
Se a frequência cardíaca for em média 75 batimentos por minutos (bpm), o ciclo cardíaco dura cerca de 0,8 segundos. A sístole atrial por volta de 0,1 segundos e
a sístole ventricular cerca de 0,3 segundos. O resto do ciclo dura aproximadamente 0,4s (Akers e Denbow, 2013).
3. Atividade elétrica do coração
a. Potencial de ação transmembranar
O coração é um órgão eletricamente carregado. O que quer dizer, que mesmo em descanso, a maioria das células mantêm um gradiente de ação na sua membrana celular. Quando uma célula é despolarizada esta altera o seu gradiente de ação e, como as células cardíacas são eletricamente ligadas, vai estimular as células vizinhas a despolarizarem também. Esta atividade elétrica é responsável pela contração coordenada do coração (Kittleson e Kienle, 1998).
O potencial de ação formado no músculo cardíaco tem uma duração 100 vezes maior que a do potencial de ação do músculo esquelético. Este aumento de duração está relacionado com diferenças na permeabilidade da membrana das células musculares aos iões de sódio, potássio e cálcio. Os canais de sódio e potássio são idênticos em ambos os músculos, sendo diferente o seu timing de abertura e encerramento. Mas a grande diferença está nos canais de cálcio, que estão presentes na membrana das células musculares cardíacas, fazendo com que haja entrada de cálcio extracelular para o interior da célula durante o período de potencial de ação, causando o prolongamento do mesmo (Cunningham e Klein, 2007).
Nas células cardíacas o potencial de membrana em descanso é grande, variando entre -40 milivolts (mV) e -90 mV, estando o interior das células negativo em comparação com o fluido extracelular (Kittleson e Kienle, 1998). A concentração intracelular de potássio é aproximadamente 30 vezes maior que a sua concentração no fluído extracelular. Já para os iões de sódio e cálcio observa-se o oposto, a sua concentração é mais elevada no fluído extracelular que no interior da célula (Tilley, 1979). O potencial de ação para o ião de sódio é de +67 mV, para o ião de cálcio de +123 mV, enquanto que para o ião de potássio é de aproximadamente -92 mV (Cunningham e Klein, 2007). O potencial transmembranar é gerado por uma distribuição desigual dos iões entre os compartimentos intra e extracelular. A bomba sódio-potássio ATPase e os canais de potássio são o mais importante para estabelecer o potencial de membrana em repouso (Fischbach, 2006). Os iões de potássio mantém-se no interior da célula devido a proteínas e polipeptídos de carga negativa fixa, que
potássio impedindo que a maioria deles possam voltar para o fluído extracelular através do seus canais (Kittleson e Kienle, 1998).
A membrana é altamente resistente ao fluxo de carga elétrica, fazendo com que os iões não se possam mover livremente, e por isso requer canais especializados que permitem o movimento seletivo dos iões para dentro e para fora da célula. Os canais de iões têm 3 propriedades gerais: 1. Um poro central cheio de água por onde os iões passam; 2. Um filtro seletivo; 3. Um mecanismo de portas que abrem e fecham os canais. Os canais podem ser abertos como resposta a mudanças de voltagem, forças mecânicas e mudanças no estado metabólico da célula (Fischbach, 2006).
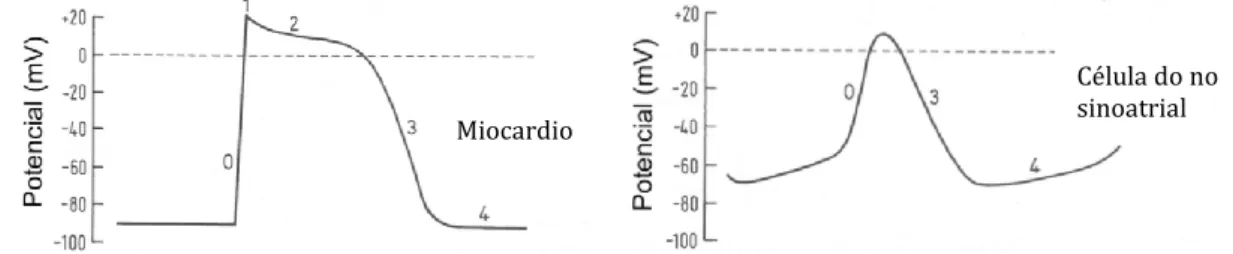
Segundo Fischbach (2006) os miócitos podem ser divididos em dois tipos distintos de células, as células de resposta rápida (atriais, ventriculares e células de Purkinje) e células de resposta lenta (nodo SA e nodo AV). Esta caracterização deve-se às diferenças da despolarização (fadeve-se 0) de cada uma, deve-sendo que na primeira a despolarização é mais rápida que na segunda, porque nas células de resposta rápida há maior quantidade de canais de sódio e com características de influxo rápido (Fox et
al., 1999).
Inicialmente forma-se um potencial de ação no nodo SA que viaja pelo sistema de condução especializado até que despolarize todas as células cardíacas. Quando uma célula cardíaca que está em repouso é atingida por um potencial de ação, o seu potencial de membrana vai reduzir a níveis críticos, o que é chamado de potencial limite (Tilley, 1979).
Nas células de resposta rápida, como se observa na figura 2, inicialmente há a abertura dos canais rápidos e dependentes de voltagem de sódio, permitindo que o sódio extracelular entre na célula. Este influxo inicia um ciclo de feedback positivo que causa a fase ascendente do potencial de ação, aumentando o potencial de membrana de -90 mV a 30 mV. Esta fase (fase 0) é muito breve e é chamada de despolarização, porque os canais de sódio fecham rapidamente e o influxo de sódio para (Marieb e Hoehn, 2012). A fase 1 também chama de overshoot é determinada por um excesso de iões de sódio dentro das células. Nesta fase os canais de sódio fecham e o influxo de sódio para, o que faz com que o potencial de membrana caia até próximo dos 0 mV (Fox et al., 1999). A fase 2 ou fase de plateau representa um balanço entre a entrada de cálcio, porque há abertura dos canais lentos de cálcio, e a saída de potássio, devido à abertura de alguns dos canais dependentes de voltagem de
potássio. Ambos os canais são ativos pela despolarização da célula e ambos são desativados com o passar de um determinado período, cerca de 0,25s. (Fischbach, 2006; Marieb e Hoehn, 2012). Depois disto o potencial de ação cai rapidamente. Esta repolarização (fase 3) resulta da inativação dos canais de cálcio e da abertura dos restantes canais dependentes de voltagem de potássio. A rápida perda de potássio da célula através dos canais de potássio restabelece o potencial de membrana em repouso (Marieb e Hoehn, 2012). Na fase de potencial de membrana em repouso, ou fase 4, os miócitos mantêm-se num potencial de membrana constante (-90 mV), até que sofram novo estímulo (Fischbach, 2006).
As células cardíacas marcapasso são células de resposta lenta ao potencial de ação. Estas têm um potencial de membrana em repouso estável que despolariza continuamente chegando lentamente ao limite de potencial de ação (Marieb e Hoehn, 2012). O potencial de ação das células de resposta lenta é morfologicamente diferente do das células de resposta rápida (figura 2) (Fischbach, 2006). Em descanso (fase 4), os canais de sódio estão abertos o que faz com que haja um influxo constante de sódio e o potencial de ação vá subindo de -65 mV a -40 mV. A despolarização (fase 0) é iniciada quando o potencial de ação atinge o potencial limite (-40 mV). Nesta fase os canais de cálcio abrem, permitindo a entrada do mesmo para o interior da célula, havendo um influxo maior de cálcio do que de sódio. Atingindo o potencial de ação o
valor de cerca de +10 mV. Em seguida, os canais de cálcio fecham e os canais de potássio abrem, havendo saída de potássio da célula, causando a repolarização da célula (fase3) até ao potencial de descanso. Ao chegar aos -65mV, os canais de potássio fecham, mantendo-se abertos os canais de sódio (Marieb e Hoehn, 2012). Então, as diferenças deste potencial de ação em relação ao das células de resposta rápida são que neste caso existe uma ativação lenta durante a fase 0, a duração do potencial de ação é mais curto, não tem a fase de overshoot nem de plataeu e durante
Figura 2- Potenciais de ação nos miócitos (à esquerda) e nas células do nodo SA (à direita). Adaptado de Ferez, 2012.
Célula do no sinoatrial Miocardio
a fase 4 a despolarização é espontânea até que seja atingido o potencial limite (Fox et
al., 1999).
O músculo cardíaco, como qualquer outro músculo, necessita de ATP para poder funcionar corretamente. Este é dependente de energia devido em parte aos canais de iões, às bombas de iões, aos trocadores de iões e às grandes proteínas aniónicas intracelulares imóveis (Fischbach, 2006). Devido à baixa capacidade de respiração celular anaeróbia, o músculo cardíaco depende quase inteiramente da respiração aeróbia. Contudo, o músculo cardíaco precisa continuadamente de O2, que é fornecido pela circulação coronária ou pelo O2 libertado pela mioglobina no interior das fibras musculares. O músculo cardíaco pode produzir ATP pela oxidação de ácidos gordos, glucose, ácido láctico, aminoácidos e corpos cetónicos. O músculo cardíaco também contem fosfato de creatina, que pode ser usado para produzir ATP, através da enzima creatina quinase (Akers e Denbow, 2013).
O potencial de ação é reposto na célula em repouso através das bombas (bomba sódio-potássio, bomba de cálcio e bomba sódio-cálcio) presentes na membrana das mesmas, de forma a que restabeleça a quantidade dos diferentes iões no interior da célula. A bomba de sódio-potássio e a bomba de cálcio necessitam de ATP para que possam funcionar, já que funcionam por transporte ativo (contra o gradiente de concentração). Já a bomba de sódio-cálcio funciona a favor do gradiente de concentração, o que faz com que não utilize ATP (Tilley, 1979).
b. Células marcapasso e sistema de condução elétrica
O sistema especializado cardíaco é responsável pela iniciação e condução do impulso cardíaco. Fazem parte deste sistema as seguintes estruturas: o nodo SA, o nodo AV, o feixe de His e os seus ramos e na parte final as fibras de purkinje (Waller
et al., 1993).
O nodo SA está situado na junção da circunferência anterior da veia cava cranial e a aurícula direita, no sulco terminal (Eliska, 2006). O nodo SA é também chamado de célula marcapasso do coração fornecendo o estímulo para que se inicie a contração cardíaca (Cochran, 2011). Este é amplamente inervado por fibras simpáticas e parassimpáticas (Martin, 2007).
O nodo AV é parte do eixo de condução AV, que conduz o impulso elétrico dos átrios para os ventrículos (Dobrzynski et al., 2013). Está localizado entre o sino coronário e o folheto septal da valva tricúspide (Eliska, 2006). Este conecta-se com o
feixe de His. Normalmente é considerado a região de condução mais lenta, mas foi comprovado por Kittleson e Kienle, (1998) que a condução na parte proximal do feixe AV é bastante mais lenta que no nodo AV, contribuindo ambos para o atraso que se verifica na propagação do impulso elétrico.
O restante sistema especializado de condução é formado essencialmente por uma estrutura, o feixe de His, que conecta os átrios a todas as partes dos ventrículos. O feixe de His penetra o anel fibroso AV e é a única ligação elétrica entre os átrios e os ventrículos. O feixe de His corre ao longo da superfície do septo membranoso até à zona da válvula aórtica onde se divide em dois ramos, o direito e o esquerdo. O ramo direito dirige-se para o ventrículo direito e no final é dividido numa rede complexa de fibras que que se estende por todo o miocárdio ventricular direito e são chamadas de fibras de Purkinje. O ramo esquerdo vai para o ventrículo esquerdo e divide-se em duas vias, um fascículo posterior e um anterior que depois se dividem também numa rede de fibras de Purkinje que se vão distribuir por todo o miocárdio ventricular esquerdo (Tilley, 1979).
O impulso elétrico é propagado pelo sistema de condução da seguinte forma (figura 3): é iniciado no nodo SA, ou seja, a despolarização do mesmo resulta num potencial de ação que se transmite através dos átrios. O potencial de ação alcança o nodo AV. No nodo AV dá-se um atraso de aproximadamente 0,1s, isto acontece porque as fibras são mais pequenas e existem menos junções de comunicação que no restante sistema de condução. Este atraso permite que haja tempo suficiente para que os átrios completem a sua contração antes dos ventrículos a iniciarem. Depois do nodo AV, o potencial de ação propaga-se para o feixe de His (Akers e Denbow, 2013). Os átrios e ventrículos estão isolados eletricamente uns dos outros, devido à existência do esqueleto fibroso, o que faz com que obrigatoriamente o impulso tenha de passar pelo nodo AV para chegar aos ventrículos (Fischbach, 2006). O potencial de ação continua para os ramos esquerdo e direito do feixe de His. E por fim, chega às fibras de purkinje, que transmitem o impulso elétrico pelos ventrículos (Akers e Denbow,
Figura 3- Sistema de condução elétrica do coração. Adaptado de Spielmann, 2004
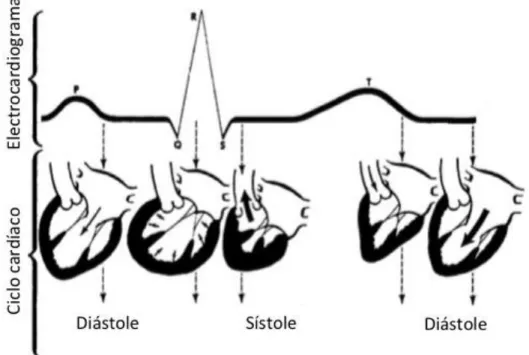
c. Formação do complexo P-QRS-T
É importante perceber-se como é um complexo sinusal normal (figura 4), saber as diferentes características que apresenta e a que eventos fisiológicos correspondem. O complexo sinusal é composto por uma onda P, um complexo QRS e umas onda T (Pace, 2011). Só desta forma é possível interpretar corretamente um ECG.
O impulso elétrico inicia-se no nodo SA e vai despolarizar os dois átrios, do direito para o esquerdo e de cranial para caudal (Oyama et al., 2014). Se os elétrodos estiverem colocados segundo as normas internacionais, então a onda de despolarização desloca-se em direção ao elétrodo positivo, o que vai criar uma deflexão positiva no traçado do ECG (Martin, 2007). Apesar de depois da despolarização dos átrios se seguir a repolarização dos mesmos, esta não aparece no traçado do ECG. Alguns autores referem que este evento está escondido pelo complexo QRS. No entanto para isto ser verdade, quando os complexos estivessem ausentes ou atrasados, este evento devia estar presente, o que não se verifica. Na realidade a repolarização dos átrios tem uma amplitude elétrica muito pequena para ser gravada pelo eletrocardiógrafo (Becker, 2006).
Quando o impulso se conduz lentamente através do nodo AV, no feixe de His, ramos do feixe de His e nas fibras de Purkinje, o ECG apresenta uma linha isoelétrica.
Figura 4 – Esquema representativo da diástole e sístole associadas com o ECG. Adaptado de Fox et al., 1999.
Isto verifica-se porque estes tecidos de condução são isolados eletricamente, o que faz com que o impulso não atinja o músculo e não produza um sinal mensurável no ECG (Oyama et al., 2014).
Um vez que o impulso atinge o miocárdio ventricular, este propaga-se pelo septo interventricular e depois atravessa ambos os ventrículos, produzindo o complexo QRS no ECG (Oyama et al., 2014). A despolarização do septo interventricular corresponde à onda Q, que é negativa porque o impulso se afasta do elétrodo positivo (Martin, 2007). A onda R representa a despolarização da massa muscular ventricular, e apresenta-se no traçado como uma deflexão grande e positiva, devido à grande massa muscular presente nos ventrículos (Martin, 2007; Pace, 2011). No final dá-se a despolarização das porções basilares dos ventrículos que corresponde à onda S, uma pequena e negativa onda (Pace, 2011). Seguido da despolarização temos a repolarização ventricular, este evento já tem amplitude suficiente para aparecer no ECG como a onda T (Becker, 2006). A morfologia da onda T pode variar de animal para animal e por isso tem pouco valor de diagnóstico (Pace, 2011).
4. Inervação cardíaca
Os ciclos cardíacos de contração e relaxamento nos mamíferos têm origem miogénica. Ou seja, é gerado automaticamente nas células cardíacas independentemente da inervação das mesmas. O coração é inervado por todo sistema autónomo, pelo sistema simpático e pelo sistema parassimpático (San Mauro et al., 2009). O sistema nervoso autónomo regula a frequência de formação do impulso elétrico intrínseco, afeta a condução do impulso e influência a contração de ambos os átrios e ventrículos (Tilley, 1979).
Os átrios são extensivamente inervados pelas fibras simpáticas e parassimpáticas, assim como por fibras aferentes, especialmente na sua face posterior. Os nodos SA e AV são ricamente inervados, sendo o nodo SA inervado primariamente por fibras provenientes do lado direito do corpo e o nodo AV de ambos os lados. Já a inervação ventricular, com a exceção do feixe de His, é muito menos profusa que a atrial (Fox et al., 1999).
O centro cardiovascular na medula oblonga influencia a frequência cardíaca. Este centro recebe informação a partir dos receptores sensoriais, do sistema límbico e do córtex cerebral. E envia as informações para o sistema autónomo simpático e parassimpático. O centro cardiovascular é influenciado por sinais com origem em
várias áreas. Os propriorrecetores controlam a posição dos membros e articulações. Os quimiorrecetores monitorizam as alterações químicas do sangue. Por fim, os barorrecetores estão localizados no arco aórtico e nas artérias carótidas e qualquer mudança de pressão brusca nestas zonas altera a frequência cardíaca (Akers e Denbow, 2013).
As fibras simpáticas originam-se na medula espinhal torácica (Reece et al., 2015). Quando o centro simpático é estimulado, é libertada norepinefrina que vai atuar no nodo SA, miocárdio atrial, região do nodo AV, feixe de His e os miocárdio ventricular (Tilley, 1979). A estimulação deste sistema vai aumentar a taxa de descarga do nodo SA (efeito conotrópico positivo), aumentar a velocidade de condução AV e aumentar a contractilidade (efeito inotrópico positivo) devido ao aumento da entrada de cálcio nas células cardíacas (Tilley, 1979; Akers e Denbow, 2013; Reece et al., 2015). O aumento da frequência cardíaca e da contractilidade resulta num mais eficiente bombeamento de sangue durante a sístole (Akers e Denbow, 2013).
Os nervos parassimpáticos originam-se na medula oblonga (Tilley, 1979). A ativação do sistema nervoso parassimpático envia sinais para o coração através do nervo vago. O nervo vago termina no nodo SA, no nodo AV e no miocárdio atrial (Akers e Denbow, 2013). Quando o centro vagal na medula oblonga é estimulado, a acetilcolina vai diminuir a descarga do nodo SA, diminuir a velocidade de condução AV e produzir bloqueios AV e vai também diminuir a contração atrial e ligeiramente a ventricular. Então a ativação parassimpática vai diminuir a frequência cardíaca (Fox
et al., 1999; Reece et al., 2015).
5. Electrocardiograma
Um eletrocardiógrafo é um voltímetro que amplifica e grava os pequenos sinais elétricos, que correspondem a alterações elétricas do coração devido ao percurso do potencial de ação, e transforma-os num gráfico voltagem por tempo. Ao processo de gravação destas alterações elétricas chama-se electrocardiografia (Martin, 2002a; Green, 2010). Esta atividade elétrica irradia na pele e por isso são colocado elétrodos nos membros ou tórax que detetam e transmitem o sinal para o eletrocardiógrafo (Wilkins, 2005; Oyama et al., 2014).
As forças elétricas são vectores quantitativos cuja magnitude é representada pelo comprimento da seta e a direção e polaridade pela direção da seta. Os vectores
cardíacos são todas as forças elétricas do ciclo cardíaco. A maioria dos potenciais são cancelados por forças opostas. Então são os vectores médios para a despolarização atrial e ventricular e a repolarização ventricular que são registados (Tilley, 1979).
De modo a registar cada onda no ECG, é gravada a diferença elétrica entre dois elétrodos, colocados em diferentes pontos do corpo. Um dos elétrodos é positivo e o outro é negativo. A diferença registada entre um par de elétrodos é chamada de derivação (Oyama et al., 2014). O eletrocardiograma pode ser usado para estudar a atividade elétrica do coração de diferentes ângulos para conseguir uma imagem completa do mesmo. É possível realizar as seguintes derivações: derivações bipolares: derivação I- Membro anterior direito (MAD) (-) comparado com o membro anterior esquerdo (MAE) (+); derivação II- MAD (-) comparada com membro posterior esquerdo (MPE) (+); e derivação III- MAE (-) comparada com MPE (+); derivações unipolares aumentadas: derivação aVR- MAD (+) comparado com MAE e MPE (-); derivação aVL- MAE (+) comparado com o MAD e MPE (-); e derivação aVF- MPE (+) comparado com MAD e MAE (-); derivações unipolares precordiais: derivação CV5RL (rV2)- quinto espaço intercostal direito perto do esterno; derivação CF6LL (V2)- sexto espaço intercostal esquerdo perto do esterno; derivação CV6LU (V4)- sexto espaço intercostal na junção costocondral; e derivação V10- sobre o processo espinhoso dorsal da sétima vértebra torácica. As derivações bipolares e unipolares aumentadas são as que normalmente se fazem nos estudos electrocardiográfico, as derivações precordiais são usadas para condições especiais e é necessária uma maior precisão (Tilley, 1979).
Na prática clínica, o ECG deve ser avaliado em conjunto com uma completa anamnese, um correto e exaustivo exame físico e os exames complementares necessários (Tilley, 1979).
a. Registo eletrocardiográfico
Os aparelhos padrão de ECG gravam um sinal analógico e usam uma agulha aquecida que regista no papel. As máquinas antigas gravam uma derivação de cada vez, já as mais recentes, são digitais e permitem registar 6 ou 12 derivações simultaneamente (Oyama et al., 2014).
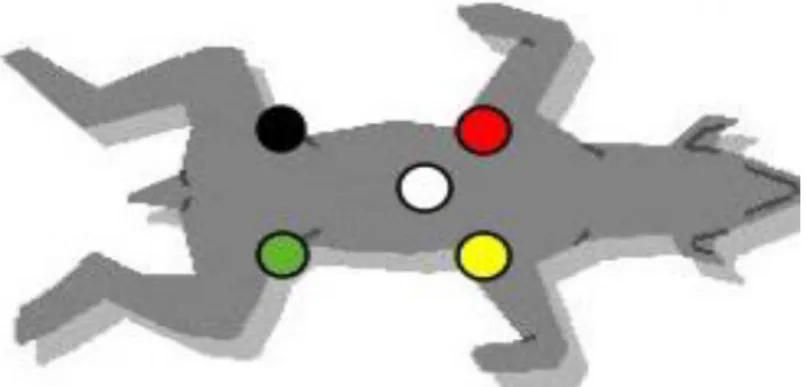
Estes equipamentos, em geral, dispõe de 5 cabos de cores diferentes: amarelo, vermelho, verde, preto e branco. As primeiras quatro cores servem para obter as 6 derivações habituais, 3 bipolares e 3 unipolares: I, II, III, aVR, aVL e aVF. O elétrodo branco é usado para obter as derivações precordiais. Estas derivações fornecem muita pouca informação nos cães e gatos, por isso geralmente não são efetuadas. Os elétrodos devem ser colocados seguindo um código internacional, o amarelo no membro anterior esquerdo, o vermelho no membro anterior direito, o verde no membro posterior esquerdo e o preto no membro posterior direito (figura 5). O eléctrodo branco geralmente não é preciso ser colocado a não ser que se queira obter as derivações precordiais, ou que o aparelho o exija (Ynaraja Ramírez e Montoya Alonso, 2012).
É importante que o animal esteja calmo e relaxado e que seja deitado numa superfície electricamente isolada (Byrne e Murray, 2010). O animal deve ser colocado em decúbito lateral direito com os membros perpendiculares ao corpo. Devem ser colocados os eléctrodos e a pele humedecida com álcool ou gel (com uma concentração iónica alta), atuando como um transdutor na interface pele-eléctrodo (Oyama et al., 2014). Em animais dispneicos ou não cooperativos, o exame pode ser realizado com o animal em decúbito esternal, posição de cão sentado ou em estação. Nestes casos a morfologia das ondas é mais variável (Byrne e Murray, 2010).
Os fármacos anestésicos e os sedativos podem afectar a frequência e o ritmo cardíaco devido ao seu efeito no tónus autonómico e alguns são potencialmente proarritmicos. Por isto, idealmente o electrocardiograma deve ser realizado antes da administração de algum destes fármacos (Luis Fuentes et al., 2010).
Figura 5- Esquema da colocação normal dos elétrodos. Adaptado de Afonso et al., 2004.
b. Indicações
O ECG é muito útil principalmente no diagnóstico de arritmias cardíacas, na determinação da origem da arritmia assim como avaliar com que frequência ocorrem. Com recurso ao ECG pode ainda avaliar-se, em algumas situações, o estado do miocárdio (Tilley, 1979).
As lesões cardíacas não causam sempre alterações no electrocardiograma. O electrocardiograma pode ser normal mesmo numa doença cardíaca avançada ou mesmo em insuficiência cardíaca. Alterações como o derrame pleural, o derrame pericárdico ou a obesidade podem alterar o traçado do electrocardiograma. Além disso, um coração morfologicamente normal pode desenvolver uma arritmia grave devida a algumas doenças sistémicas (Fox et al., 1999).
As principais indicações para a realização de um eletrocardiograma são as seguintes: arritmias ou sopros cardíacos à auscultação, história de síncopes ou episódios de fraqueza, monitorização cardíaca durante e após a anestesia, monitorização cardíaca em doentes críticos, avaliar alterações de ritmo ou frequência causadas por fármacos, cardiomegalias detetadas em radiografias torácicas, avaliação pré-anestésica em animais velhos, animais com alterações eletrolíticas (especialmente do potássio) e/ou doença sistémica (piómetra, sépsis, pancreatite, dilatação/torção gástrica) (Tilley, 2008; Oyama et al., 2014).
c. Limitações
Esta técnica é muitas vezes difícil de aplicar devido às diferentes limitações que apresenta (Zendejas e Cambreros, 1981). Por este motivo não devem ser tiradas informações a mais do traçado (Tilley, 1979). Das várias limitações há duas que são as mais importantes, a primeira é a falta de sensibilidade para detetar alterações mecânicas no coração (Fox et al., 1999). A segunda deve-se ao facto dos resultados desta técnica serem facilmente influenciados pelas diferenças na condição ou conformação corporal dos indivíduos, o género, a raça e a idade (Tilley, 1979; Zendejas e Cambreros, 1981). Uma outra limitação, que não sendo diretamente uma limitação da técnica em si, é muito importante e condiciona bastante a interpretação de um estudo electrocardiográfico, é o facto de os valores de referência utilizados não serem adaptados à raça em questão. Por todas estas limitações, o electrocardiograma deve ser analisado de forma conjunta com uma série de outros exames
d. Valores de referência
Para uma correta interpretação de alterações num ECG, é necessário conhecer o traçado de um ECG normal (Hanton e Rabemampianina, 2006). Para conseguirmos um diagnóstico electrocardiográfico é necessário comparar os valores dos animais doentes com os valores de referência estabelecidos para cães saudáveis (Randhawa et
al., 2014). A análise de electrocardiogramas de muitas raças de cães mostra que estas
podem ser diferentes entre elas (Rezakhani et al., 1990). Isto pode dever-se a variações na cavidade torácica ou diferenças genéticas (Avizeh et al., 2010).
Na interpretação de um electrocardiograma, geralmente, são usados valores de referência que foram determinados por estudos realizados num número relativamente pequeno de animais de diferentes raças, pesos e idades, ou em estudos com um grande número de animais, mas realizados em apenas uma raça, quase sempre a raça beagle. Isto faz com que os valores não sejam os adequados para animais de determinada raça ou indivíduo (Hanton e Rabemampianina, 2006; Randhawa et al., 2014).
Ao longo dos anos têm sido publicados vários artigos sobre estudos electrocardiográficos em diferentes raças de cães, de forma a melhorar e adequar a interpretação dos mesmos consoante a raça de cão em questão (Onyango et al., 1992; Hanton e Rabemampianina, 2006; Bavegems et al., 2009; Atmaca e Emre, 2010; Calejo, 2013; Cardoso et al., 2013; Gugjoo et al., 2014; Mukherjee et al., 2015; Kumar et al., 2016). Na tabela 1 estão indicados os vários valores de referência
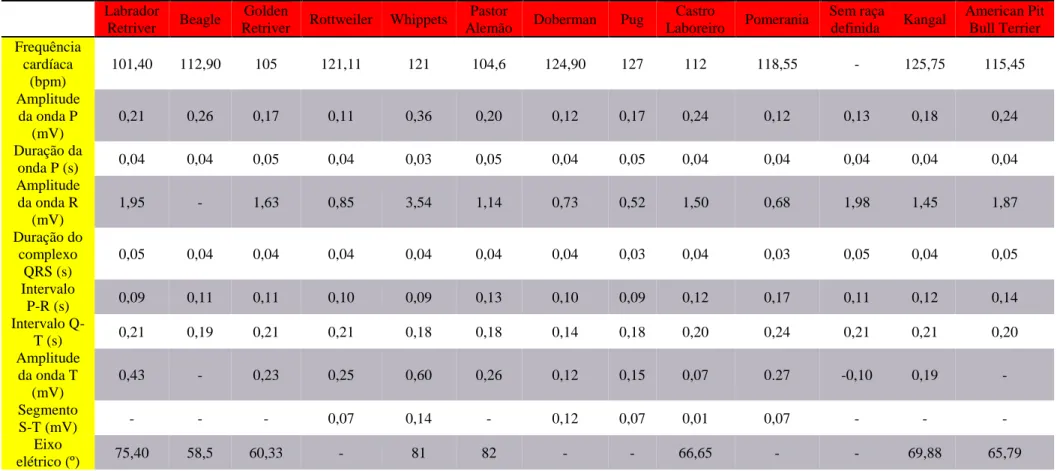
Tabela 1- Valores de referência para diferentes raças de cães. Adaptado de Onyango et al., 1992; Hanton e Rabemampianina, 2006; Bavegems et al., 2009; Atmaca e Emre, 2010; Calejo, 2013; Cardoso et al., 2013; Gugjoo et al., 2014; Mukherjee et al., 2015; Kumar et al., 2016.
Labrador
Retriver Beagle
Golden
Retriver Rottweiler Whippets
Pastor
Alemão Doberman Pug
Castro Laboreiro Pomerania Sem raça definida Kangal American Pit Bull Terrier Frequência cardíaca (bpm) 101,40 112,90 105 121,11 121 104,6 124,90 127 112 118,55 - 125,75 115,45 Amplitude da onda P (mV) 0,21 0,26 0,17 0,11 0,36 0,20 0,12 0,17 0,24 0,12 0,13 0,18 0,24 Duração da onda P (s) 0,04 0,04 0,05 0,04 0,03 0,05 0,04 0,05 0,04 0,04 0,04 0,04 0,04 Amplitude da onda R (mV) 1,95 - 1,63 0,85 3,54 1,14 0,73 0,52 1,50 0,68 1,98 1,45 1,87 Duração do complexo QRS (s) 0,05 0,04 0,04 0,04 0,04 0,04 0,04 0,03 0,04 0,03 0,05 0,04 0,05 Intervalo P-R (s) 0,09 0,11 0,11 0,10 0,09 0,13 0,10 0,09 0,12 0,17 0,11 0,12 0,14 Intervalo Q-T (s) 0,21 0,19 0,21 0,21 0,18 0,18 0,14 0,18 0,20 0,24 0,21 0,21 0,20 Amplitude da onda T (mV) 0,43 - 0,23 0,25 0,60 0,26 0,12 0,15 0,07 0.27 -0,10 0,19 - Segmento S-T (mV) - - - 0,07 0,14 - 0,12 0,07 0,01 0,07 - - - Eixo elétrico (º) 75,40 58,5 60,33 - 81 82 - - 66,65 - - 69,88 65,79
6. Galgo Inglês: Especificidades da raça
O Galgo Inglês é originário do Reino Unido (Dennis-Bryan, 2013), tendo alterado pouco as suas características desde há sete mil anos quando foi conhecido pela sua velocidade e usado pelo Homem para caçar gazelas e lebres (Weighton, 1922). Pinturas rupestres em França mostram que os cães têm feito parte da vida dos seres humanos ao longo dos últimos quinze mil anos, tendo sido os mais antigos ossos de cães datados para doze mil a.c. (Livingood, 2000). Pensa-se que os mais ancestrais galgos foram retratados em túmulos egípcios que datam para cerca de quatro mil a.c. (Dennis-Bryan, 2013).
Os Galgos de corrida como agora são conhecidos desenvolveram-se no início dos anos 1900 (Livingood, 2000) e são capazes de atingir os 72 km/h num espaço curto de tempo (Dennis-Bryan, 2013). Nem todos os Galgos são cães de corrida, alguns são usados em exposições ou apenas como animais de companhia (Livingood, 2000). Os Galgos de corrida quando deixam de servir para esse fim, por lesão, velhice, entre outros, são chamados de Galgos de corrida aposentados. Os Galgos de corrida aposentados têm-se tornado um popular cão de companhia. Eles são gentis, inteligentes e fáceis de manter, requerem apenas exercício moderado, mas possuem um corpo esguio, uma pele fina e uma camada fina de pelo por isso precisam de proteção contra o frio nos meses com temperaturas mais baixas (Dennis-Bryan, 2013). Comparados com outras raças, os Galgos em geral não têm grandes problemas de saúde e vivem em média 12 a 14 anos (Livingood, 2000).
Estes animais (figura 6) têm a cabeça comprida e estreita, ligeiramente mais larga no crânio com olhos negros e orelhas pequenas, finas e semi-eretas. Apresentam um pescoço longo e musculado. O corpo destes animais é bastante musculado, eles têm membros anteriores retos e compridos, o peito é profundo e as costelas bem arqueadas, os membros posteriores apresentam coxas muito musculadas, mostrando um bom poder de propulsão, joelhos bem angulados e cauda longa e fina (Weighton, 1922). Os machos geralmente pesam entre 24 a 38 kg e medem de 66 a 76 cm. Já as fêmeas normalmente pesam entre 22 a 34 kg e medem de 58 a 66 cm (The Greyhound Adoption Handbook) e podem ter diferentes cores de pelagem (Dennis-Bryan, 2013).
Figura 6- Imagem de um Galgo Inglês. Adaptado de http://es.123rf.com/clipart-vectorizado/galgo.html.
II.
Componente Prática
1. Objectivos
O eletrocardiograma é um exame complementar de rotina utilizado para diagnosticar e monitorizar arritmias, hipertrofia do miocárdio, alterações eletrolíticas, derrames pericárdicos e pleurais, e a frequência cardíaca. No cão, foi demonstrado que os intervalos de referência para os diferentes parâmetros eletrocardiográficos variam com a idade, o género e a raça. Assim, os principais objetivos deste trabalho foram:
• Estabelecer o intervalo de referência para alguns parâmetros eletrocardiográficos nos cães de raça Galgo Inglês;
• Comparar os valores obtidos com os intervalos de referência gerais, segundo Martin (2002b);
• Estudar a influência do género, peso e a idade nas diferentes variáveis estudadas.
2. Materiais e Métodos
O estudo foi realizado num canil que pertence ao banco de sangue animal (BSA) no período compreendido entre março e abril de 2016. A amostra era composta por 30 cães, 15 machos e 15 fêmeas, dos quais 28 cães da raça Galgo Inglês, 1 da raça Galgo Espanhol e 1 cruzado de Galgo Inglês. Todos os animais se encontravam alojados aos pares em boxes duplas nas instalações do BSA localizado em Vila do Conde. Os animais eram alimentados um vez por dia e após a alimentação eram soltos (durante no mínimo 30 minutos) em grupos de forma a poderem fazer exercício e interagirem. A maioria dos animais pertenciam a linhagens de atletas usados em corridas, e por estarem reformados ou não terem as características desejadas pelos proprietários, foram colocados no canil do BSA de forma a poderem ser dadores de sangue e evitar que fossem abatidos. Os animais estavam aí alojados no máximo há um ano. As recolhas de sangue eram feitas normalmente de três em três meses, a não ser que fosse necessário em alguma urgência. Do total da amostra inicial dois animais foram excluídos por não pertencerem à raça Galgo Inglês e um outro por apresentar alterações aos exames realizados.
Inicialmente foi feita uma detalhada anamnese à pessoa responsável pelos animais em estudo de forma a perceber melhor a sua história clinica e se apresentavam alguma alteração que nos pudesse indicar que não estivessem saudáveis (anexo 1). Depois, todos os animais foram sujeitos a um exame físico completo que incluía a medição da temperatura corporal, prega de pele, observação da cor e humidade das mucosas, tempo de repleção capilar, auscultação cardíaca e pulmonar, avaliação do pulso femoral e palpação dos linfonodos (anexo 2). Foram também realizadas análises sanguíneas das quais hemograma e bioquímica sérica (creatinina, proteínas totais, alanina aminotransferase e fosfatase alcalina) e o despiste de
Leishmania spp., Ehrlichia spp., Anaplasma spp., Babesia spp. e Dirofilaria immitis
através de análise PCR. Nenhum dos animais incluídos neste estudo apresentava alterações nos exames referidos anteriormente.
Os exames físicos e electrocardiográficos eram realizados numa sala isolada das restantes instalações após a alimentação de todos os animais de forma a evitar estados de ansiedade que pudessem falsear os resultados.
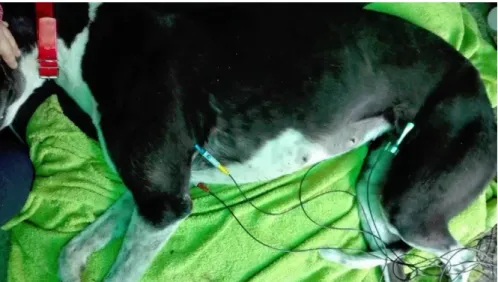
Os eletrocardiogramas foram gravados com os animais em decúbito lateral direito, usando o eletrocardiografo Cardiette Vet 600. Os elétrodos foram colocados
segundo as regras internacionais, elétrodo vermelho na axila direita, elétrodo preto na virilha direita, elétrodo amarelo na axila esquerda e por fim o elétrodo verde na virilha esquerda (figura 7). A pele em contacto com os elétrodos foi humedecida com álcool de forma a aumentar a condutividade do sinal elétrico. Todos os estudos electrocardiográficos foram gravados a amplitude de 10mm/mV e velocidade de 25 e 50 mm/s. Foram gravadas as derivações I, II, III, aVR, aVL, aVF e V. Os parâmetros avaliados em cada ECG foram a frequência e ritmo cardíaco, a amplitude e duração da onda P, a amplitude da onda R, a duração do complexo QRS, os intervalos P-R e Q-T, a morfologia e amplitude da onda T e o segmento S-T, todos avaliados apenas na derivação II. Foi ainda determinado o eixo elétrico através da medição do complexo QRS nas derivações I e III (anexo 3).
Para calcular a frequência cardíaca, foram medidos, na velocidade de 25mm/s os batimentos em 15 centímetros (corresponde a 6 segundos) e depois multiplicados por 10.
Para calcular a estatística descritiva básica, os limites dos intervalos de referência e respetivos intervalos de confiança (CI) a 90% foi utilizado o programa MedCalc para Windows versão 14.8. Os intervalos de referência (IR) foram estimados seguindo as normas do Instituto para padrões Clínicos e laboratoriais (CLSI Guidelines), nomeadamente aquelas recomendadas para amostras com dimensões (x) compreendidas no intervalo 20 ≤ x < 40.
Figura 7 – Local de colocação dos elétrodos (fotografia gentilmente cedida pelo banco de sangue animal).
3. Resultados
a. Caracterização da amostra
Neste trabalho foram incluídos 27 Galgos Ingleses, 13 machos e 14 fêmeas, de idades compreendidas entre os 4 e 7 anos e com peso que varia dos género de todos os animais em estudo (tabela 2).
A idade média da amostra total (n=27) em estudo era de 4,37 anos (2-7) sendo que em alguns animais a idade foi aferida com base na dentição e aspecto físico geral. O peso dos animais variava entre os 21 e os 42kg (média=31,07kg).
Tabela 2 – Estatística descritivas das variáveis idade e peso corporal consoante o género. DP: desvio padrão; Xmin: valor mínimo observado; Xmax: valor máximo observado;
Estatística descritiva
Variáveis Sexo N Média ± DP Xmin Xmax
Idade (anos) Machos 13 4,92 ± 0,92 4 7
Idade (anos) Fêmeas 14 3,86 ± 1,30 2 6
Peso corporal (kg) Machos 13 35,38 ± 4,31 28 42
Peso corporal (kg) Fêmeas 14 27,07 ± 4,33 19 35
b. Valores eletrocardiográficos obtidos para o Galgo Inglês
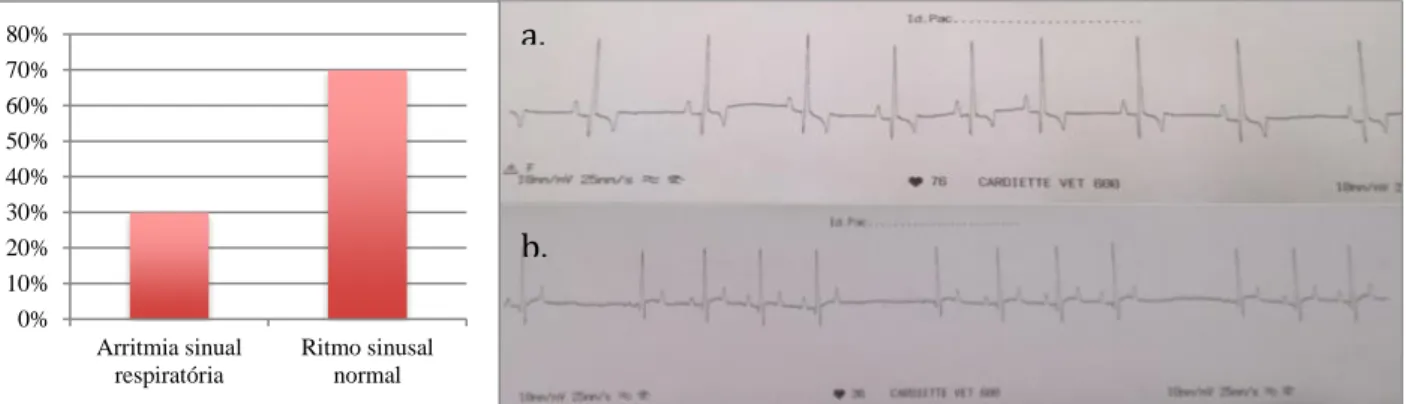
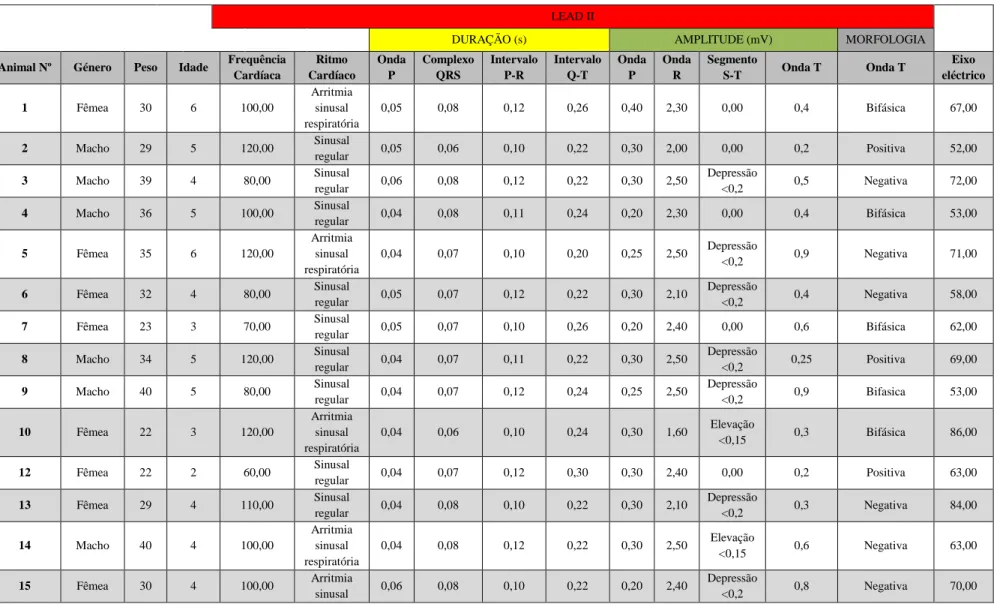
Os resultados obtidos em cada um dos parâmetros para cada um dos animais em estudo são apresentados na tabela 3. Para a frequência cardíaca obteve-se uma média de 103,33 bpm. Relativamente ao ritmo cardíaco, 29,63% (8 em 27) dos animais apresentaram arritmia sinusal respiratória e os restantes 70,37% (19 em 27) ritmo sinusal normal, como mostra a figura 8. Em relação à onda P as médias são de
0,05s para a duração, e de 0,28mV para a amplitude. O complexo QRS apresentou
0% 10% 20% 30% 40% 50% 60% 70% 80% Arritmia sinual respiratória Ritmo sinusal normal a. b.
Figura 8 – À esquerda uma representação gráfica da percentagem de animais com arritmia sinusal respiratória vs ritmo sinusal regular. À direta uma imagem ilustrativa de um traçado sinusal regular (a.) e um traçado arrítmico
duração média de 0,07s e a onda R amplitude de 2,29mV. As durações do intervalo P-R e Q-T encontradas foram de 0,11s e 0,24s, respectivamente. Em relação ao segmento S-T, 51,85% (14 em 27) dos animais apresentaram depressão, 11,11% (3 em 27) elevação e os restantes 37,04% (10 em 27) apresentavam-se isoeléctricos em relação à linha base.
Os valores da amplitude média da onda T foram de 0,50s sendo que 48,15% (13 em 27) dos animais tinham ondas negativas, 22,22% (6 em 27) ondas positivas e 29,63% (8 em 27) ondas bifásicas. A média do eixo elétrico foi de 67,70º.
LEAD II
DURAÇÃO (s) AMPLITUDE (mV) MORFOLOGIA
Animal Nº Género Peso Idade Frequência Cardíaca Ritmo Cardíaco Onda P Complexo QRS Intervalo P-R Intervalo Q-T Onda P Onda R Segmento S-T Onda T Onda T Eixo eléctrico 1 Fêmea 30 6 100,00 Arritmia sinusal respiratória 0,05 0,08 0,12 0,26 0,40 2,30 0,00 0,4 Bifásica 67,00 2 Macho 29 5 120,00 Sinusal regular 0,05 0,06 0,10 0,22 0,30 2,00 0,00 0,2 Positiva 52,00 3 Macho 39 4 80,00 Sinusal regular 0,06 0,08 0,12 0,22 0,30 2,50 Depressão <0,2 0,5 Negativa 72,00 4 Macho 36 5 100,00 Sinusal regular 0,04 0,08 0,11 0,24 0,20 2,30 0,00 0,4 Bifásica 53,00 5 Fêmea 35 6 120,00 Arritmia sinusal respiratória 0,04 0,07 0,10 0,20 0,25 2,50 Depressão <0,2 0,9 Negativa 71,00 6 Fêmea 32 4 80,00 Sinusal regular 0,05 0,07 0,12 0,22 0,30 2,10 Depressão <0,2 0,4 Negativa 58,00 7 Fêmea 23 3 70,00 Sinusal regular 0,05 0,07 0,10 0,26 0,20 2,40 0,00 0,6 Bifásica 62,00 8 Macho 34 5 120,00 Sinusal regular 0,04 0,07 0,11 0,22 0,30 2,50 Depressão <0,2 0,25 Positiva 69,00 9 Macho 40 5 80,00 Sinusal regular 0,04 0,07 0,12 0,24 0,25 2,50 Depressão <0,2 0,9 Bifasica 53,00 10 Fêmea 22 3 120,00 Arritmia sinusal respiratória 0,04 0,06 0,10 0,24 0,30 1,60 Elevação <0,15 0,3 Bifásica 86,00 12 Fêmea 22 2 60,00 Sinusal regular 0,04 0,07 0,12 0,30 0,30 2,40 0,00 0,2 Positiva 63,00 13 Fêmea 29 4 110,00 Sinusal regular 0,04 0,08 0,10 0,22 0,30 2,10 Depressão <0,2 0,3 Negativa 84,00 14 Macho 40 4 100,00 Arritmia sinusal respiratória 0,04 0,08 0,12 0,22 0,30 2,50 Elevação <0,15 0,6 Negativa 63,00 15 Fêmea 30 4 100,00 Arritmia sinusal 0,06 0,08 0,10 0,22 0,20 2,40 Depressão <0,2 0,8 Negativa 70,00
respiratória 17 Fêmea 29 5 140,00 Sinusal regular 0,05 0,08 0,09 0,20 0,40 2,40 Depressão <0,2 0,8 Negativa 97,00 18 Fêmea 31 5 100,00 Sinusal regular 0,05 0,07 0,12 0,22 0,30 2,10 Depressão <0,2 0,9 Negativa 51,00 19 Macho 42 4 100,00 Sinusal Normal 0,05 0,07 0,14 0,24 0,30 2,50 Depressão <0,2 0,5 Bifasica 82,00 20 Fêmea 28 4 100,00 Arritmia sinusal respiratória 0,04 0,07 0,12 0,20 0,30 2,40 Depressão <0,2 0,7 Negativa 49,00 21 Macho 39 7 80,00 Arritmia sinusal respiratória 0,05 0,07 0,12 0,24 0,20 2,80 0,00 0,3 Bifásica 63,00 22 Fêmea 22 4 120,00 Sinusal regular 0,06 0,07 0,10 0,22 0,30 1,50 0,00 0,2 Positiva 77,00 24 Fêmea 25 2 120,00 Sinusal regular 0,06 0,08 0,10 0,24 0,30 2,90 0,00 0,3 Positiva 69,00 25 Macho 32 5 100,00 Sinusal regular 0,05 0,08 0,12 0,58 0,45 2,50 0,00 0,7 Negativa 55,00 26 Macho 35 4 110,00 Arritmia sinusal respiratória 0,04 0,07 0,12 0,22 0,20 2,20 Depressão <0,2 0,4 Negativa 90,00 27 Macho 35 6 100,00 Sinusal regular 0,05 0,07 0,10 0,22 0,20 2,40 Depressão <0,2 0,6 Bifásica 60,00 28 Macho 28 6 120,00 Sinusal regular 0,04 0,07 0,09 0,22 0,20 1,20 0,00 0,25 Negativa 90,00 29 Macho 31 4 120,00 Sinusal regular 0,04 0,06 0,10 0,22 0,30 1,90 Elevação <0,15 0,4 Positiva 67,00 30 Fêmea 21 2 120,00 Sinusal regular 0,04 0,07 0,08 0,22 0,20 2,90 Depressão <0,2 0,7 Negativa 55,00
Na tabela 4 estão representados os intervalos de referência e os intervalos de confiança a 90%.
Tabela 4 – Intervalos de referência e de confiança a 90% para os parâmetros estudados.
Variáveis
Intervalo de Referência e Intervalos de Confiança a 90% Intervalo de
referência Limite inferior Limite superior
Nº de animais Frequência Cardíaca (bpm) 66,50-140,00 56,0- 76,9 129,80-150,60 27 Amplitude da onda P (mV) 0,15-0,41 0,11-0,19 0,37-0,45 27 Duração da onda P (s) 0,03-0,06 0,03-0,04 0,06-0,07 27 Amplitude da onda R (mV) 1,28- 2,95 0,00-1,74 2,75-3,02 27 Duração do complexo QRS (s) 0,06-0,06 0,06 -0,09 0,08-0,09 27 Intervalo P-R (s) 0,08-0,14 0,08-0,09 0,13-0,14 27 Intervalo Q-T (s) 0,19-0,26 0,19-0,20 0,25-0,27 25 Amplitude da onda T (mV) 0,04-0,96 0,01-0,17 0,83-1,09 27 Eixo elétrico (º) 41,45-93,96 34,01-48,89 86,52-101,40 27
c. Valores eletrocardiográficos obtidos para o Galgo Inglês- comparação com os intervalos de referência segundo Martin (2002b)
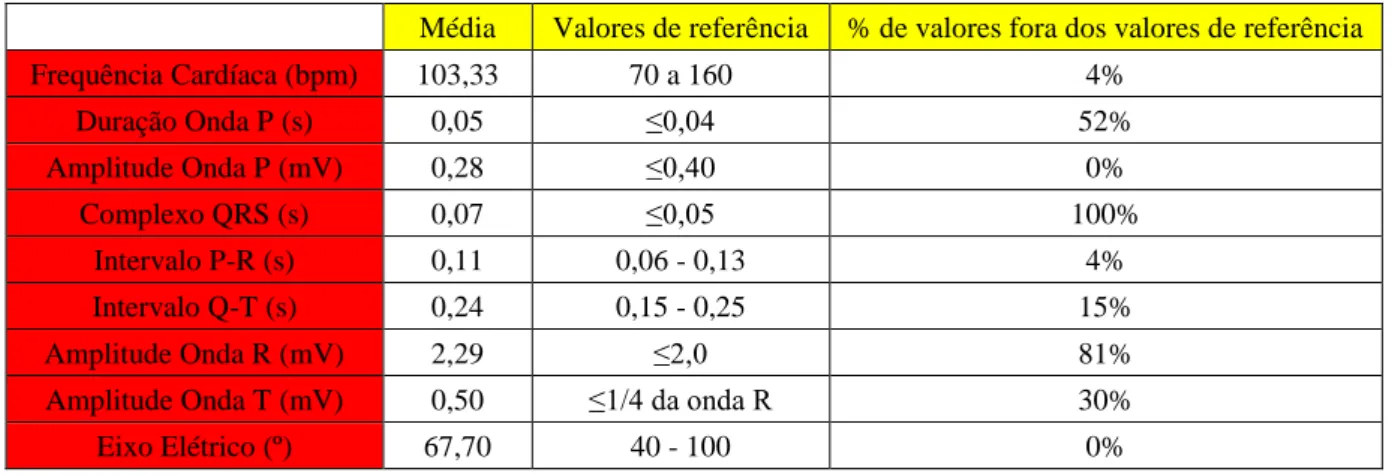
Foram analisados 12 parâmetros no ECG de cada um dos 27 cães da raça Galgo Inglês em estudo. Na tabela 5, estão representadas as médias observadas no presente estudo, assim como os valores de referência admitidos pela comunidade científica e na última coluna a percentagem de valores da amostra que se encontravam fora dos valores de referência. Com isto, verifica-se que uma grande parte dos valores encontrados apresenta resultados fora dos valores de referência.
Tabela 5 – Tabela representativa das médias observadas no estudo, valores de referência segundo Martin, (2002) e % de valores fora dos mesmos.
Média Valores de referência % de valores fora dos valores de referência
Frequência Cardíaca (bpm) 103,33 70 a 160 4% Duração Onda P (s) 0,05 ≤0,04 52% Amplitude Onda P (mV) 0,28 ≤0,40 0% Complexo QRS (s) 0,07 ≤0,05 100% Intervalo P-R (s) 0,11 0,06 - 0,13 4% Intervalo Q-T (s) 0,24 0,15 - 0,25 15% Amplitude Onda R (mV) 2,29 ≤2,0 81%
Amplitude Onda T (mV) 0,50 ≤1/4 da onda R 30%