Aspe
Re
Orientado Professora de Madrid Co-orient Professoraectos pa
elação co
or Científic a Titular da d tador Cient a Auxiliar dUniv
Vila R
tológico
om carac
e se
co: Professo a Faculdade tífico: Profe da Universidersidade
Real, 200
os do m
cterística
eu valor
ora Doutora de Medicin essora Dout dade de Tráde Trás-o
08
mastocito
as epidem
prognós
a Laura Luis na Veteriná tora Anabel s os Montesos-Montes
oma cu
miológica
stico
sa Peña Fern ária da Univ la Gouveia A s e Alto Dous e Alto D
utâneo c
as e clíni
nandez versidade Co Antunes Alv uroDouro,
canino
icas
omplutense ves eTítulo: Aspectos patológicos do mastocitoma cutâneo canino : Relação com características epidemiológicas e clínicas e seu valor prognóstico
Autor: Oliveira, Justina Maria Prada Data de impressão: Março de 2008 ISBN: 978-989-20-1106-6
Dissertação de candidatura ao grau de Doutor em Ciências Veterinárias, apresentada à Universidade de Trás-os-Montes e Alto Douro, de acordo com o disposto no nº1 do artigo 17º do Decreto-Lei nº216/92 de 13 de Outubro.
Aos meus pais, ao António, a toda a minha família.
muitas as pessoas e entidades que prestaram o seu contributo. A todos queremos expressar os nossos mais sinceros agradecimentos:
À Universidade de Trás-os-Montes e Alto Douro (UTAD), na pessoa do seu magnífico Reitor, Professor Doutor Armando Mascarenhas Ferreira, manifestamos o nosso maior reconhecimento por todo o apoio concedido, que possibilitou a realização desta tese de doutoramento.
À Sra. Professora Doutora Laura Peña Fernandez, da Universidade Complutense de Madrid, pela aceitação da orientação científica conducente ao presente trabalho. Com o mérito dos grandes investigadores, soube sempre encaminhar-nos na linha que nos propusemos investigar e a sua larga experiência científica e pedagógica foi determinante para ultrapassar alguns dos obstáculos que se nos depararam.
À Sra. Professora Doutora Anabela Alves, nossa co-orientadora e principal impulsionadora deste trabalho, não podemos deixar de agradecer a presença constante e a grande ajuda e sentido crítico na orientação da presente tese.
Ao Dr. Pedro Roquete, expressamos o nosso profundo reconhecimento pelos anos de aprendizagem que nos proporcionou. A sua amizade e exemplo contribuíram para que nos tornássemos melhores patologistas, melhores profissionais e sobretudo melhores pessoas. Somos-lhes gratas por tudo aquilo que não se consegue agradecer e consideramo-lo, verdadeiramente, o nosso mestre.
À Sr.ª Professora Doutora Paula Rodrigues, agradecemos a inestimável ajuda na metodologia da microscopia electrónica de transmissão e na revisão do texto desta dissertação. O seu profissionalismo, espírito crítico e uma disponibilidade única foram de extrema importância para a realização deste trabalho.
À Sr.ª Professora Doutora Isabel Pires, colega de disciplina, agradecemos o apoio na actividade docente, a revisão do texto e, acima de tudo, a sua amizade inestimável.
esta dissertação.
Ao Instituto de Histologia e Embriologia da Universidade de Coimbra, na pessoa do Sr. Professor Doutor Vasco Bairos, agradecemos a disponibilidade dos meios para a realização de algumas das técnicas de Microscopia Electrónica de Transmissão.
À Unidade de Microscopia Electrónica da UTAD, na pessoa do Sr. Professor Doutor Pedro Bandeira Tavares, agradecemos ter-nos facilitado os meios para a realização das técnicas de Microscopia Electrónica de Transmissão e a sua constante disponibilidade para nos ensinar.
À Sr.ª Professora Doutora Conceição Martins, actual coordenadora do Departamento de Patologia e Clínicas Veterinárias, agradecemos as facilidades concedidas na fase de finalização deste trabalho.
Ao Professor Doutor Jorge Rodrigues, coordenador do Departamento de Ciências Veterinárias durante o tempo de realização desta tese, agradecemos todo o interesse que sempre demonstrou pelo nosso trabalho, disponibilizando com brevidade os meios necessários à realização desta dissertação.
À Sr.ª Professora Doutora Maria dos Anjos Pires, gostaríamos de agradecer a forma cordata com que acompanhou o nosso trabalho. Às colegas de laboratório, Dr.ª Maria de Lurdes Pinto, Dr.ª Adelina Gama e Professora Doutora Fernanda Seixas, agradecemos o incentivo dado ao longo destes anos de convívio.
À Sr.ª D. Lígia Lourenço, técnica do Laboratório de Anatomia Patológica da UTAD, gostaríamos de expressar a nossa gratidão por todo o apoio técnico prestado, com extremo profissionalismo, boa vontade e simpatia. À Sr.ª D. Glória Milagre e Sr.ª D. Ana Plácido, funcionárias do mesmo laboratório, não podemos deixar de agradecer toda a colaboração que nos prestaram.
Ao Sr. Dr. Pedro Cuesta, Estatístico do Centro de Cálculo da UCM, um especial agradecimento pelo tratamento estatístico dos dados.
À Reprografia da UTAD, na pessoa do Sr. Emílio, agradecemos o excelente trabalho e profissionalismo demonstrado na impressão desta tese.
Não podemos deixar de agradecer aos colegas clínicos, que forneceram a matéria-prima para este trabalho e que permitiram a recolha dos dados de seguimento. Um agradecimento especial ao Dr. João Machado e aos funcionários do Hospital Veterinário da UTAD, D. Salete, D. Cristina e D. Mónica, pela ajuda e apreço que sempre nos demonstraram.
A todos os amigos e família, não podemos deixar de agradecer o apoio incondicional e a paciência e o carinho nos momentos de desânimo. Um agradecimento especial para o Mário Cotovio, a Margarida Costa e o João Forte, amigos de sempre e sempre presentes.
Resumo
O mastocitoma canino é uma das neoplasias cutâneas mais frequentes no cão, tendo um comportamento biológico muito variável. A gradação histológica por si só, não prediz o comportamento destes tumores, pelo que a elaboração de novos estudos de prognóstico se reveste de extrema importância.
O objectivo fundamental desta tese foi a aquisição de conhecimento actualizado acerca de factores de prognóstico clássicos assim como de novos factores biológicos, que possam fornecer indicações mais precisas acerca do comportamento destes tumores. Foram analisados 90 tumores (31 de grau I, 30 de grau II e 29 de grau III), nos quais foi realizada a caracterização de alguns parâmetros epidemiológicos e clínicos como a raça, o sexo e a idade dos animais, bem como a localização e o tamanho das lesões. Foram utilizados métodos de imunohistoquímica para avaliação da proliferação (Ki-67), da presença de proteínas de membrana (c-Kit), caracterização de componentes da matriz (fibronectina, MMP-1, MMP-2, MMP-9), marcadores de angiogénese (VEGF, CD31), marcadores inflamatórios (Mac 387, CD3, CD79) e presença de quimiocinas eosinofilotácticas (Eotaxina, IL-5 e RANTES). Realizou-se ainda microscopia electrónica de transmissão e imunohistoquímica ultrastrutural (eotaxina).
Na análise da ocorrência de recidiva/metástase, por análise univariada, as características epidemiológicas, clínicas e histopatológicas que revelaram associação estatisticamente significativa foram a raça (p=0,049), o tamanho (p=0,021), as mitoses (p=0,005), a ulceração (p=0,003), a infiltração profunda (p=0,002), a quantidade de estroma (p=0,004), as aberrações celulares (p<0,0001), a morfologia do citoplasma (p=0,003) e do núcleo (p=0,002), o grau histológico (p<0,0001) e a metacromasia com azul de toluidina (p<0,0001). Dos marcadores imunohistoquímicos estudados encontramos associação com o Ki-67 (p<0,0001), o Mac 387 (p=0,003), a fibronectina do estroma (p=0,009), a MMP-9 (p=0,016) e o c-Kit (p<0,0001).
A análise multivariada revelou o grau histológico como a melhor variável independente para predizer a ocorrência de recidiva/metástase para um primeiro nível de análise. Num segundo nível de análise, o c-Kit foi decisivo para predizer a evolução dos tumores de grau III e a IL-5 para os tumores de grau I e de grau II.
Na análise da morte devida ao tumor, as características epidemiológicas, clínicas e histopatológicas que mostraram associação significativa foram a raça (p=0,005), o tamanho (p<0,0001), as mitoses (p=0,016), a ulceração (p<0,0001), a actividade juncional (p=0,035), a infiltração profunda (p<0,0001), a quantidade de estroma (p<0,0001), a degradação do colagénio (p=0,001), as aberrações (p<0,0001), a morfologia do citoplasma (p<0,0001) e do núcleo (p=0,001), o grau histológico (p<0,0001) e a metacromasia com azul de toluidina (p<0,0001). Dos marcadores imunohistoquímicos estudados encontramos associação com o Ki-67 (p<0,0001), o Mac 387 (p<0,0001), a fibronectina do estroma (p=0,022), a MMP-9 (p<0,0001) e o c-Kit (p<0,0001).
A análise multivariada revelou o grau histológico e o Ki-67 como as melhores variáveis independente para predizer a ocorrência de morte devida ao tumor, para um primeiro nível de análise. Num segundo nível de análise, o c-Kit e a ulceração surgiram como os melhores factores para predizer a evolução dos tumores de grau III. Nos tumores de grau I e de grau II, a MMP-9 mostrou-se preditiva da evolução, tendo particular importância nos tumores de grau I.
O presente estudo demonstra a importância da gradação histológica, da marcação do c-Kit e do índice proliferativo no prognóstico dos mastocitomas. Dentro das características histopatológicas, a ulceração surge também como um factor de prognóstico independente. O estudo da imunorreactividade para as MMPs revelou que a MMP-9 está implicada no processo metastático. A expressão desta MMP está aumentada no grupo de mastocitomas de elevada agressividade, surgindo assim como um bom indicador de prognóstico.
Abstract
Mast cell tumors are among the most common cutaneous neoplasms in dogs, having a highly variable biological behavior. Histological gradation does not totally predict the behavior of these tumors, for which new prognostic studies are important.
The aim of this research was the acquisition of up-to-date knowledge about some classic prognostic factors as well as new biological factors, which will be able to bring more accurate data about the behavior of these tumors.
The characterization of some epidemiological and clinical parameters was carried out in a series of 90 tumors (31 grade I, 30 grade II, 29 grade III). Race, sex and age of the animals, as well as location and size of the lesions were recorded. Immunohistochemistry methods were used to evaluate proliferation (Ki-67), presence of membrane proteins (c-Kit), characterization of matrix components (fibronectin, MMP-1, MMP-2, MMP-9), angiogenic markers (VEGF, CD31), inflammatory markers (Mac 387, CD3, CD79), and eosinophylotactic chemokines (Eotaxin, IL-5 and RANTES). Transmission electron microscopy was carried out, as well as immunoelectron for eotaxin.
Univariate analysis for local recurrence/metastasis revealed significant statistical association with race (p=0,049), size (p=0,021), mitosis (p=0,005), ulceration (p=0,003), deep infiltration (p=0,002), amount of stroma (p=0,004), cellular aberrations (p<0,0001), cytoplasm morphology (p=0,003), nuclear morphology (p=0,002), histological degree (p<0,0001), toluidine blue metachromasia (p<0,0001), Ki-67 (p<0,0001), Mac 387 (p=0,003), stromal fibronectin (p=0,009), MMP-9 (p=0,016), and c-kit (p<0,0001).
The multivariate analysis revealed histological degree as the best independent variable to predict recurrence/metastasis in a first level of analysis. A second level of analysis revealed c-Kit as the best prognostic marker for grade III tumors and IL-5 for grade I and grade II tumors. Regarding tumor related death, the parameters that showed significant statistical association were race (p=0,005), size (p<0,0001), mitosis (p=0,016), ulceration (p<0,0001), junctional activity (p=0,035), deep infiltration (p<0,0001), amount of stroma (p<0,0001), collagen degradation (p=0,001), cellular aberrations (p<0,0001), cytoplasm morphology (p<0,0001), nuclear morphology
(p=0,001), toluidine blue metachromasia (p<0,0001), Ki-67 (p<0,0001), Mac 387 (p<0,0001), stromal fibronectin (p=0,022), MMP-9 (p<0,0001), and c-Kit (p<0,0001).
Multivariate analysis revealed histological degree and Ki-67 as the best independent prognostic variables to predict tumor related death in a first level of analysis. A second level of analysis revealed c-Kit and ulceration as the best prognostic markers for grade III tumors and MMP-9 for grade I and grade II tumors.
The present study demonstrates the importance of histological grading, c-Kit immunostaining, and proliferation rate as prognostic markers in mast cell tumor, as well as ulceration. MMP immunoreactivity was demonstrated in neoplastic mast cells and the results suggests that MMP-9 is the major gelatinase in the invasive process of canine mastocytoma.
Índice
Dedicatória ... v
Agradecimentos ... vii
Resumo ... xi
Abstract ... xiii
Índice de figuras e quadros ... xxi
Abreviaturas, acrónimos e siglas ... xxvii
1. Introdução ... 1 1.1. Objectivos ... 4 2. Revisão Bibliográfica ... 7 2.1. O Mastócito ... 7 2.1.1. Morfologia ... 7 2.1.2. Diferenciação ... 8 2.1.3. Heterogeneidade ... 9 2.1.4. Marcadores membranares ... 10 2.1.5. Funções biológicas ... 13 2.2. Mastocitose e mastocitomas ... 14
2.3. Mastocitoma cutâneo canino ... 16
2.3.1. Aspectos epidemiológicos ... 16
2.3.1.1. Sexo ... 16
2.3.1.2. Idade ... 17
2.3.1.3. Raça ... 17
2.3.2. Etiopatogenia ... 18
2.3.3. Aspectos clínicos e características macroscópicas ... 19
2.3.3.1. Localização ... 21
2.3.3.2. Sinais sistémicos ... 21
2.3.4. Tratamento ... 22
2.3.5 Diagnóstico e características histopatológicas ... 24
2.3.5.1. Colorações específicas e imunohistoquímica ... 26
2.3.5.2. Infiltrado inflamatório associado ao tumor ... 27
2.3.5.2.1. Eosinofilia associada ao tumor ... 30
2.3.7. Factores de prognóstico ... 33
2.3.7.1. Factores de prognóstico epidemiológicos e clínicos ... 33
2.3.7.1.1. Sexo ... 33
2.3.7.1.2. Idade ... 34
2.3.7.1.3. Raça ... 34
2.3.7.1.4. Localização e número de tumores ... 34
2.3.7.1.5. Ritmo de crescimento, tamanho tumoral e aderência a tecidos profundos ... 35
2.3.7.2. Factores de prognóstico histopatológicos ... 36
2.3.7.2.1. Grau histológico ... 36
2.3.7.2.2. Mitoses ... 37
2.3.7.2.3. Outros factores ... 38
2.3.7.3. Marcadores imunohistoquímicos e outras técnicas usadas como prognóstico de mastocitoma ... 39
2.3.7.3.1. Proliferação tumoral ... 40
2.3.7.3.1.1. Regiões organizadoras nucleolares: AgNORs ... 40
2.3.7.3.1.2. Antigénio proliferativo celular nuclear: PCNA ... 41
2.3.7.3.1.3. Ki-67 ... 41
2.3.7.3.1.4. Incorporação de Bromodeoxiuridina ... 42
2.3.7.3.2. Ploidia, oncogenes e genes supressores ... 43
2.3.7.3.2.1. Ploidia do ADN ... 43 2.3.7.3.2.2. Expressão da proteína p53 ... 43 2.3.7.3.2.3. Expressão da proteína Mdm2... 44 2.3.7.3.2.4. Expressão da p21 e da p27 ... 45 2.3.7.3.2.5. c-Kit ... 45 2.3.7.3.3. Outras proteínas ... 47
2.3.8. Outros componentes tumorais avaliados neste estudo ... 48
2.3.8.1 Matriz Extracelular ... 48 2.3.8.1.1. Fibronectina ... 48 2.3.8.1.2. Metaloproteinases de matriz ... 49 2.3.8.1.2.1. Colagenase intersticial (MMP-1) ... 52 2.3.8.1.2.2. Gelatinases (MMP-2 e MMP-9) ... 53 2.3.8.2. Marcadores de angiogénese ... 55 2.3.8.2.1. CD31 ... 56
2.3.8.2.2. Factor de Crescimento Vascular Endotelial A (VEGF-A) ... 57
2.3.8.3.1. CD3 ... 59
2.3.8.3.2. CD79 ... 59
2.3.8.3.3. Mac 387 ... 60
2.3.8.4. Factores quimiotácticos para eosinófilos ... 60
3. Material e métodos ... 65
3.1. Animais, avaliação clínica e seguimento ... 65
3.2. Avaliação histológica ... 65
3.3. Imunohistoquímica ... 67
3.3.1. Metodologia geral ... 68
3.4. Métodos de quantificação da imunorreactividade ... 71
3.4.1. Proliferação: Proteína Ki-67 ... 71
3.4.2. Proteínas de membrana: c-Kit ... 71
3.4.3. Matriz extracelular ... 72
3.4.3.1. Fibronectina ... 72
3.4.3.1.1.Marcação dos mastócitos... 72
3.4.3.1.2. Marcação do estroma ... 73
3.4.3.2. Metaloproteinases de Matriz -1 e -2 (MMP-1 e MMP-2) ... 73
3.4.3.3. Metaloproteinase de Matriz -9 (MMP-9) ... 74
3.4.4. Angiogénese ... 74
3.4.4.1. Factor de crescimento endotelial vascular A (VEGF A) ... 74
3.4.4.2. CD31 ... 74
3.4.5. Infiltrado inflamatório associado ao tumor ... 75
3.4.5.1. Proteína mielomonocítica L1 (MAC 387) ... 75
3.4.5.2. Marcadores de linfócitos: CD3 (Linfócitos T) e CD79 (Linfócitos B) ... 75
3.4.6. Citocinas ... 76
3.4.6.1. Eotaxina e Interleucina 5 ... 76
3.4.6.2. Regulated on Activation Normal T Cell Expressed and Secreted – RANTES ... 76
3.5. Estudo ultra-estrutural ... 76
3.5.1. Detecção imunohistoquímica de Eotaxina por microscopia electrónica de transmissão ... 78
4. Resultados ... 85
4.1. Avaliação de dados epidemiológicos e clínicos ... 86
4.1.1. Sexo ... 86 4.1.2. Idade ... 86 4.1.3. Raça ... 87 4.1.4. Localização ... 87 4.1.5. Tamanho ... 88 4.2. Avaliação histopatológica ... 88
4.2.1. Metacromasia demonstrada com azul de toluidina ... 92
4.3. Avaliação imunohistoquímica ... 99
4.3.1. Proliferação: Ki-67 ... 99
4.3.2. Proteínas de membrana: c-Kit ... 99
4.3.3. Matriz extracelular ... 100 4.3.3.1. Fibronectina ... 100 4.3.3.2. Metaloproteinase de Matriz -1 (MMP-1) ... 101 4.3.3.3. Metaloproteinase de Matriz-2 (MMP-2) ... 101 4.3.3.4. Metaloproteinase de Matriz-9 (MMP-9) ... 102 4.3.4. Angiogénese ... 102
4.3.4.1. Factor de Crescimento Endotelial Vascular A (VEGFA) ... 102
4.3.4.2. CD31 ... 102
4.3.5. Infiltrado associado ao tumor ... 103
4.3.5.1. Proteína mielomonocítica L1 (Mac 387) ... 103
4.3.5.2. Linfócitos T- CD3 ... 103
4.3.5.3. Linfócitos B - CD79 ... 104
4.3.6. Quimiocinas eosinofilotácticas ... 104
4.3.6.1. Eotaxina ... 104
4.3.6.2. Interleucina-5 (IL-5) ... 105
4.3.6.3. Regulated on Activation Normal T Cell Expressed and Secreted – RANTES ... 105
4.4. Associações estatísticas ... 118
4.4.1. Análise univariada ... 118
4.4.1.1. Associações entre as variáveis epidemiológicas e clínicas ... 118
4.4.1.2. Associações entre as variáveis epidemiológicas e clínicas e as variáveis histopatológicas ... 119
4.4.1.4. Análise estatística dos resultados dos marcadores gerais de
imunohistoquímica ... 128
4.4.1.4.1. Proliferação: Ki-67 ... 129
4.4.1.4.1.1. Associações do Ki-67 com variáveis epidemiológicas e clínicas ... 129
4.4.1.4.1.2. Associação do Ki-67 com variáveis histopatológicas ... 129
4.4.1.4.1.3. Associação do Ki-67 com outros marcadores ... 130
4.4.1.4.2. Proteínas de membrana:c-Kit ... 131
4.4.1.4.2.1. Associações do c-Kit com variáveis epidemiológicas e clínicas . .131 4.4.1.4.2.2. Associações do c-Kit com as variáveis histopatológicas ... 132
4.4.1.4.2.3. Associações do c-Kit com outros marcadores ... 133
4.4.1.4.3. Matriz extracelular ... 134
4.4.1.4.3.1. Fibronectina ... 134
4.4.1.4.3.1.1. Associações da fibronectina do estroma com as variáveis epidemiológicas e clínicas ... 134
4.4.1.4.3.1.2. Associações da marcação da fibronectina no estroma e intracelular e as variáveis histopatológicas ... 135
4.4.1.4.3.1.3. Associação da marcação pelo anticorpo anti-fibronectina com outros marcadores ... 137
4.4.1.4.3.2. MMP-1, MMP-2 e MMP-9 ... 138
4.4.1.4.3.2.1. Associações da marcação das metaloproteinases de matriz com as variáveis epidemiológicas e clínicas ... 138
4.4.1.4.3.2.2. Associações das metaloproteinases de matriz com as variáveis histopatológicas ... 139
4.4.1.4.3.2.3. Associações das metaloproteinases de matriz com outros marcadores ... 141
4.4.1.4.4. Angiogénese: CD31 e VEGF ... 142
4.4.1.4.4.1. Associações dos marcadores de angiogénese com as variáveis epidemiológicas e clínicas ... 142
4.4.1.4.4.2. Associações dos marcadores de angiogénese com as variáveis histopatológicas ... 143
4.4.1.4.4.3. Associação dos marcadores de angiogénese com outros marcadores ... 145
4.4.1.4.5. Infiltrado inflamatório avaliado pelo CD3, CD79 e Mac 387 ... 145
4.4.1.4.5.1. Associações do infiltrado inflamatório com as variáveis epidemiológicas e clínicas ... 145
4.4.1.4.5.2. Associações do infiltrado inflamatório com as variáveis
histopatológicas ... 146
4.4.1.4.5.3. Associações do infiltrado inflamatório com outros marcadores .. .148
4.4.1.4.6. Quimiocinas eosinofilotácticas: Eotaxina, Interleucina-5 e RANTES ... 150
4.4.1.4.6.1. Associações das quimiocinas eosinofilotácticas com todos os parâmetros avaliados ... 150
4.4.1.5. Estudo de microscopia electrónica de transmissão (MET) ... 151
4.4.1.5.1. Avaliação da imunorreactividade à Eotaxina por MET ... 152
4.4.1.6. Estudo de factores de prognóstico ... 156
4.4.1.6.1. Análise estatística univariada ... 156
4.4.1.6.1.1. Relação da recidiva/metástase e morte devida ao tumor com os aspectos epidemiológicos e clínicos ... 156
4.4.1.6.1.2. Recidiva/Metástase e morte devida ao tumor: relação com os aspectos histopatológicos ... 157
4.4.1.6.1.3. Recidiva/metástase e morte devida ao tumor: relação com os marcadores imunohistoquímicos ... 159
4.4.1.6.2. Análise estatística multivariada ... 160
4.4.1.6.2.1. Análise estatística multivariada para a recidiva/metástase: árvores de decisão ... 161
4.4.1.6.2.2. Análise estatística multivariada para a morte devida ao tumor: árvores de decisão ... 164
5. Discussão ... 169
6. Conclusões ... 201
Índice de figuras
Fig. 2.1. Representação esquemática do c-Kit. Adaptado de Lennartssom et al. 2005 ... 11
Fig. 4.1. Aspecto macroscópico de mastocitoma cutâneo de grau II, no membro esquerdo de um Boxer ... 85
Fig. 4.2. Distribuição dos mastocitomas por sexo ... 86
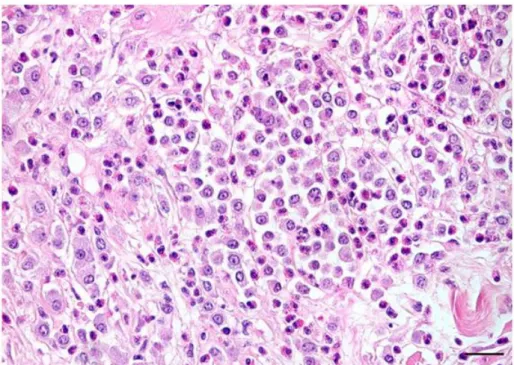
Fig. 4.3. Mastocitoma cutâneo canino de grau I. As células tumorais ocupam a derme superficial. Estalão = 50 μm ... 94
Fig. 4.4. Mastocitoma cutâneo canino de grau I. Os limites do tumor são bem definidos, observando-se a degradação do estroma Estalão= 400 μm ... 94
Fig. 4.5. Mastocitoma cutâneo canino de grau I. As células tumorais são monomórficas, bem diferenciadas. O estroma é escasso, bem como os eosinófilos. Estalão = 25 μm ... 95
Fig. 4.6. Mastocitoma de grau II. Ulceração superficial, edema intercelular e atipia moderada. Estalão = 50 μm ... 95
Fig. 4.7. Mastocitoma de grau II. Observam-se imagens de degradação do colagénio e eosinofilia moderada. Estalão = 25 μm ... 96
Fig. 4.8. Mastocitoma de grau II. Infiltração abundante de eosinófilos. Estalão= 20 μm ... 96
Fig. 4.9. Mastocitoma de grau III. Células aberrantes, de citoplasma pálido e sem granulação visivel. Hialinização do estroma. Estalão = 20 μm ... 97
Fig. 4.10. Mastocitoma de grau III. Atipia celular marcada, escassos eosinófilos e figuras mitóticas. Estalão = 20 μm ... 97
Fig. 4.11. Mastocitoma de grau II. Granulação variável e atipia nuclear moderada (semi-fino, Azul de Toluidina). Estalão= 20 μm ... 98
Fig. 4.12. Mastocitoma de grau II. Degradação da parede vascular e diapedese dos eosinófilos (semi-fino, Azul de toluidina). Estalão= 20 μm ... 98
Fig. 4.13. Mastocitoma canino de grau I. Imunorreactividade para o Ki-67. Estalão = 25μm... 106
Fig. 4.14. Mastocitoma canino de grau III. Imunorreactividade para o Ki-67. Estalão = 25μm ... 106
Fig. 4.15. Mastocitoma canino de grau I. Imunorreactividade para o c-Kit, padrão membranar. Estalão = 25μm ... 107
Fig. 4.16. Mastocitoma canino de grau II. Imunorreactividade para o c-Kit, padrão citoplasmático focal. Estalão = 20μm ... 107
Fig. 4.17. Mastocitoma canino de grau III. Imunorreactividade para o c-Kit, padrão citoplasmático difuso. Estalão = 20μm ... 108
Fig. 4.18. Imunorreactividade para a fibronectina. Marcação citoplasmática. Estalão = 20μm ... 108
Fig. 4.19. Imunorreactividade para a fibronectina. Marcação do estroma. Estalão = 25μm ... 109
Fig. 4.20. Imunoreractividade escassa para a MMP-1. Estalão = 25μm ... 109
Fig. 4.21. Imunoreractividade abundante para a MMP-1. Estalão = 20μm ... 110
Fig. 4.22. Imunorreactividade para a MMP-2. Marcação nos eosinófilos que rodeiam colagénio degradado. Estalão = 50μm ... 110
Fig. 4.23. Imunoreractividade para a MMP-2. A marcação é citoplasmática granular, em posição perinuclear. Estalão = 25μm ... 111 Fig. 4.24. Imunorreactividade escassa para a MMP-9. Estalão = 20μm ... 111 Fig. 4.25. Imunorreactividade abundante para a MMP-9. Marcação citoplasmática difusa. Estalão =
25μm ... 112 Fig. 4.26. Imunorreactividade para o VEGFA. Estalão = 20 μm ... 112 Fig. 4.27. Marcação de microvasos pelo CD31. Estalão = 50 μm ... 113 Fig. 4.28. Marcação de microvasos pelo CD31. Estalão = 20 μm ... 113 Fig. 4.29. Imunorreactividade para o Mac387. Estalão = 50μm ... 114 Fig. 4.30. Mastocitoma cutâneo de grau III. Imunorreactividade para o CD3. Infiltrado abundante.
Estalão=50 μm ... 114
Fig. 4.31. Marcação de linfócitos B CD79+, com formação de folículos linfóides. Estalão=25 μm ... 115 Fig. 4.32. Imunorreactividade para a eotaxina nos mastócitos neoplásicos, em posição perinuclear.
Estalão = 25 μm ... 115
Fig. 4.33. Imunorreactividade para a eotaxina nos mastócitos neoplásicos, em posição perinuclear. Estalão = 20 μm ... 116
Fig. 4.34. Imunorreactividade abundante para a IL-5. Estalão = 25 μm ... 116 Fig. 4.35. Imunorreactividade para o RANTES. Observa-se marcação nos eosinófilos, mas não nas
células neoplásicas. Estalão = 20 μm ... 117 Fig. 4.36. Mastocitoma bem diferenciado. À esquerda, o mastócito com abundantes grânulos
maduros. Junto ao canto inferior direito pode observar-se um eosinófilo. Estalão=1 μm .... 153 Fig. 4.37. Mastocitoma de grau III. De notar o volume e aspecto do núcleo, e o nucléolo muito
evidente, e a quase ausência de grânulos citoplasmáticos. Observa-se fragmento de colagénio degenerado. Estalão = 1 μm ... 153 Fig. 4.38. Imunorreactividade para a eotaxina no citoplasma das células neoplásicas, na área de
Golgi. Observam-se em algumas células tumorais grânulos não marcados, e grânulos com forte marcação, e outros ainda, com marcação intermédia. Estalão = 1 μm ... 154 Fig. 4.39. Imunorreactividade para a eotaxina no citoplasma de uma célula neoplásica, mais
indiferenciada, com localização perinuclear. De notar a ausência de grânulos com marcação intensa. Estalão = 1 μm ... 154 Fig. 4. 40. Pormenor da marcação de uma célula indiferenciada. Marcação da eotaxina associada a
perfis membranares de retículo e vesículas. Estalão = 1 μm ... 155 Fig. 5.1. Indicações de prognóstico na avaliação dos mastocitomas cutâneos caninos ... 200
Índice de quadros
Quadro 2.1. Opções de tratamento para o mastocitoma cutâneo ... 23 Quadro 2.2. Estadiamento clínico dos mastocitomas pela OMS (Owen, 1980) ... 40 Quadro 3.1. Critérios de classificação histopatológica dos mastocitomas cutâneos ... 66 Quadro 3.2. Anticorpos usados, concentrações, tempo, temperatura de incubação e tratamentos
efectuados para recuperação antigénica. ... 70 Quadro 3.3. Avaliação semi-quantitativa da marcação de fibronectina nos mastócitos ... 72 Quadro 3.4. Avaliação semi-quantitativa da marcação de fibronectina no estroma ... 73 Quadro 3.5. Avaliação semi-quantitativa da marcação de MMP-9 ... 74 Quadro 3.6. Avaliação semi-quantitativa da marcação das quimiocinas IL-5 e eotaxina ... 76 Quadro 3.7. Variáveis epidemiológicas e clínicas usadas na análise estatística ... 80 Quadro 3.8. Variáveis histológicas usadas na análise estatística ... 81 Quadro 3.9. Variáveis imunohistoquímicas usadas na análise estatística ... 82 Quadro 4.1. Análise descritiva da idade ... 86 Quadro 4.2. Distribuição dos mastocitomas por raça ... 87 Quadro 4.3. Frequências absolutas e relativas das variáveis epidemiológicas e clínicas ... 88 Quadro 4.4. Distribuição dos diferentes parâmetros histológicos por graus e pela totalidade da
amostra... 92 Quadro 4.5. Avaliação da metacromasia com azul de toluidina, dos diferentes graus e na totalidade
da amostra ... 93 Quadro 4.6. Avaliação da imunorreactividade à proteína Ki-67 ... 99 Quadro 4.7. Avaliação da imuno-expressão do c-Kit ... 100 Quadro 4.8. Avaliação da imunomarcação da fibronectina nos mastócitos tumorais ... 100 Quadro 4.9. Avaliação da imunomarcação da matriz pela fibronectina ... 100 Quadro 4.10. Avaliação da expressão da MMP-1 ... 101 Quadro 4.11. Avaliação da imunoexpressão da MMP-2 ... 101 Quadro 4.12. Avaliação da imunomarcação para a MMP-9 ... 102 Quadro 4.13. Avaliação da densidade de microvasos ... 103 Quadro 4.14. Avaliação da imunorreactividade para o Mac 387 ... 103 Quadro 4.15. Avaliação da imunorreactividade para o CD3 ... 104 Quadro 4.16. Avaliação da imunorreactividade para o CD79 ... 104 Quadro 4.17. Avaliação da imunorreactividade para a eotaxina ... 105 Quadro 4.18. Avaliação da imunorreactividade para a IL-5 ... 105 Quadro 4.19. Associações estatisticamente significativas entre as variáveis epidemiológicas e
clínicas ... 119 Quadro 4.20. Associações estatisticamente significativas entre o sexo e a disposição celular ... 120 Quadro 4.21. Associações estatisticamente significativas entre as variáveis epidemiológicas e
Quadro 4.22. Associações estatisticamente significativas entre as variáveis epidemiológicas e clínicas e as variáveis histopatológicas (continuação) ... 122 Quadro 4.23. Associações estatisticamente significativas entre as variáveis epidemiológicas e
clínicas e as variáveis histopatológicas (continuação ... 123 Quadro 4.24. Associação das variáveis histopatológicas entre si ... 125 Quadro 4.25. Associação das variáveis histopatológicas entre si (continuação) ... 126
Quadro 4.26. Associações entre as variáveis histopatológicas entre si (continuação) ... 127 Quadro 4.27. Associações entre as variáveis histopatológicas entre si (continuação) ... 128 Quadro 4.28. Associações estatisticamente significativas entre o Ki-67 e as variáveis
epidemiológicas e clínicas ... 129 Quadro 4.29. Associações estatisticamente significativas entre o Ki-67 e as variáveis
histopatológicas ... 130 Quadro 4.30. Associações estatisticamente significativas entre o Ki-67 e as variáveis
histopatológicas (continuação) ... 130 Quadro 4.31. Associações estatisticamente significativas entre o Ki-67 e as variáveis
histopatológicas (continuação) ... 130 Quadro 4.32. Associações estatisticamente significativas entre o Ki-67 e os restantes marcadores
imunohistoquímicos ... 131 Quadro 4.33. Associações estatisticamente significativas entre o Ki-67 e os restantes marcadores
imunohistoquímicos (continuação) ... 131 Quadro 4.34. Associações estatisticamente significativas entre o c-Kit e as variáveis
epidemiológicas e clínicas ... 132 Quadro 4.35. Associações estatisticamente significativas entre o c-Kit e as variáveis
histopatológicas ... 132 Quadro 4.36. Associações estatisticamente significativas entre o c-Kit e as variáveis
histopatológicas (continuação) ... 133 Quadro 4.37. Associações estatisticamente significativas entre o c-Kit e as variáveis
histopatológicas (continuação) ... 133 Quadro 4.38. Associações estatisticamente significativas entre o c-Kit e as variáveis
imunohistoquímicas ... 134 Quadro 4.39. Associações estatisticamente significativas entre a marcação do estroma pelo
anticorpo anti-fibronectina e as variáveis epidemiológicas e clínicas ... 134 Quadro 4.40. Associações estatisticamente significativas entre a marcação pelo anticorpo
anti-fibronectina e as variáveis histopatológicas ... 136 Quadro 4.41. Associações estatisticamente significativas entre a marcação pelo anticorpo
anti-fibronectina e as variáveis histopatológicas (continuação) ... 137 Quadro 4.42. Associações estatisticamente significativas entre a marcação pelo anticorpo
Quadro 4.43. Associações estatisticamente significativas entre a MMP-2 e as variáveis epidemiológicas e clínicas ... 138 Quadro 4.44. Associações estatisticamente significativas entre a MMP-1 e multiplicidade de
tumores ... 138 Quadro 4.45. Associações estatisticamente significativas entre a MMP-9, o tamanho e a idade ... 139 Quadro 4.46. Associações estatisticamente significativas entre a MMP-1, MMP-2 e MMP-9 e as
variáveis histopatológicas ... 140 Quadro 4.47. Associações estatisticamente significativas entre a MMP-1 e restantes marcadores ... 141 Quadro 4.48. Associações estatisticamente significativas entre a MMP-2 e restantes marcadores ... 141 Quadro 4.49. Associações estatisticamente significativas entre a MMP-9 e restantes marcadores ... 142 Quadro 4.50. Associações entre os marcadores de angiogénese e as variáveis clínicas e
epidemiológicas... 142 Quadro 4.51. Associações estatisticamente significativas entre os marcadores de angiogénese e as
variáveis histopatológicas ... 144 Quadro 4.52. Associações estatisticamente significativas entre os marcadores de angiogénese e os
restantes marcadores ... 145 Quadro 4.53. Associações estatisticamente significativas entre os marcadores do infiltrado
inflamatório e as variáveis epidemiológicas e clínicas ... 146 Quadro 4.54. Associações estatisticamente significativas entre o CD3, CD79 e Mac 387 e os
parâmetros histológicos ... 147 Quadro 4.55. Associações estatisticamente significativas entre o CD3, CD79 e Mac 387 e os
parâmetros histológicos ... 148 Quadro 4.56. Associações estatisticamente significativas entre o Mac 387 e os restantes marcadores.149 Quadro 4.57. Associações estatisticamente significativas entre o CD3, CD79 e os restantes
marcadores ... 149 Quadro 4.58. Associações estatisticamente significativas entre as quimiocinas e os restantes
parâmetros avaliados ... 150 Quadro 4.59. Associações estatisticamente significativas entre as quimiocinas e os restantes
parâmetros avaliados ... 151 Quadro 4.60. Associações significativas entre a recidiva/metástase e a morte devida ao tumor e as
variáveis clínicas ... 156 Quadro 4.61. Associações significativas entre a recidiva/metástase, a morte devida ao tumor e as
variáveis histopatológicas ... 158 Quadro 4.62. Associações significativas entre a recidiva/metástase, a morte devida ao tumor e os
Abreviaturas, Acrónimos e Siglas
ADN - Ácido desoxirribonucleico
AgNORs - Regiões organizadoras nucleolares ANOVA - Análise de variância
BrdU - Bromodeoxiuridina CCR - Chemokine receptor CD - Cluster of differentiation CDK - Cyclin-dependent kinase
DAB - Tetra-hidrocloreto de 3,3’-diaminobenzidina DMV - Densidade de microvasos
EAT - Eosinofilia associada ao tumor EGF - Epidermal growth factor FGF - Fibroblast growth factor Fig - Figura
GM-CSF - Granulocyte Macrophage Colony Stimulating Factor (factor estimulador da
formação de colónias de granulócitos e macrófagos
HE - Hematoxilina e Eosina Ig - Imunoglobulina IL - Interleucina IM - Índice Mitótico INF - Interferão IR - Índice de imunorreactividade M - Mastócito
M±DP - Média ± Desvio Padrão
MATs - Macrófagos associado ao tumor MCC - Mastocitoma cutâneo canino
MCP - Monocyte Chemoattractant Protein (proteína quimioatractiva dos monócitos) MDT - Morte devida ao tumor
MEC - Matriz extracelular
MET - Microscopia electrónica de transmissão MIF - Macrophage migratory inhibitory factor
MIP - Macrophage inflammmatory protein (proteína inflamatória dos macrófagos) MMP - Metaloproteinase de Matriz
n- Número de observações NK - Natural killer
OMS - Organização Mundial de Saúde p - Probabilidade
PBS - Phosphate Buffer Saline (tampão fosfato salino) PCNA - Antigénio proliferativo celular nuclear
PECAM - Platelet/endothelial cell adhesion molecule (molécula de adesão das células
endoteliais às plaquetas)
PgP - Glicoproteína P Q - Quimase
RANTES - Regulated on Activation Normal T Cell Expressed and Secreted Rec/met - Recidiva/metástase
RT-PCR - Real Time – Polimerase chain reaction SCF - Stem Cell Factor
SLD - Sobrevida livre de doença SRD - Sem raça definida
ST - Sobrevida total T - Triptase
TGF - Transforming Growth Factor Th - T helper
TIMP - Inibidor tissular da Metaloproteinase de Matriz TNF - Tumor Necrosis Factor (factor de necrose tumoral) UCM - Universidade Complutense de Madrid
UTAD - Universidade de Trás os Montes e Alto Douro
VEGF - Vascular Endothelial Growth Factor (factor de crescimento vascular endotelial) VEGFR - Receptor para o factor de crescimento vascular endotelial
1. Introdução
Os mastocitomas são uma das neoplasias mais comuns no cão. Representam cerca de 10 a 15% de todos os tumores cutâneos (Gross et al., 2005) e 11 a 27% de todos os tumores malignos desta espécie (Thamm e Vail, 2001, 2007), o que está em contraste directo com os humanos, em que as neoplasias dos mastócitos são muito raras (Tharp, 1998).
Os mastocitomas apresentam um comportamento biológico muito variável. Vários autores têm incidido a sua pesquisa na busca de parâmetros clínicos ou patológicos que possam ter utilidade diagnóstica e/ou prognóstica. Apesar de alguns avanços nesta área, o conhecimento da biopatologia destas neoplasias é insuficiente.
A predisposição racial, particularmente em Boxer, surge descrita nos primeiros estudos acerca do mastocitoma (Bostock e Dye, 1973; Bostock, 1986). A multiplicidade de tumores, também foi objecto de vários estudos (McCaw et al., 1997; Thamm et al., 1999; Séguin et al., 2001; Kiupel et al., 2005; McNeil et al., 2006; Mullins et al., 2006; Murphy et al., 2006; Scase et al., 2006; Preziosi et al., 2007), assim como a localização tumoral e o tamanho (Turrel et al., 1988; O'Keefe, 1990; Cahalane et al., 2004; Sfiligoi
et al., 2005), factores que podem influenciar o comportamento destes tumores.
De entre as variáveis histopatológicas, o grau histológico tem-se revelado o critério mais consistentemente associado com o prognóstico (Hottendorf e Nielsen, 1968; Bostock e Dye, 1973; Patnaik et al., 1984; Simoes et al., 1994; Thamm et al., 2006). Existem dois sistemas de gradação histológica publicados (Bostock e Dye, 1973; Patnaik et al., 1984), ambos desenvolvidos numa amostra retrospectiva relativamente pequena. O sistema correntemente usado é o de Patnaik, havendo numerosos problemas na compreensão dos critérios descritos nesta classificação, como exemplificado em estudos recentes, em que vários patologistas classificavam o mesmo tumor em diferentes graus (Northrup et al., 2005a; Northrup et al., 2005b). O sistema de gradação corrente tem sido criticado por incluir no grau histológico II mais de 40% dos mastocitomas (Patnaik et al., 1984), criando, deste modo, um grupo grande e heterogéneo, que inclui mastocitomas de comportamento biológico muito distinto (Gross et al., 2005). Por essa razão, os mastocitomas de grau II têm sido objecto de vários estudos (Weisse et al., 2002; Fulcher et al., 2006; Séguin et al., 2006; Ozaki et
al., 2007), a fim de se identificarem marcadores que permitam clarificar o seu
comportamento biológico.
Nos últimos anos, tem-se assistido a um avanço crescente na procura de novos elementos que apoiem os critérios morfológicos clássicos e que possam ser utilizados no diagnóstico e prognóstico das neoplasias.
Os marcadores de proliferação celular (Ki-67; índice mitótico) têm sido estudados nos mastocitomas caninos, como potenciais ferramentas para predizer a resposta à terapia e o prognóstico (Bostock e Dye, 1973; Ayl et al., 1992; Simoes et al., 1994; Kravis et al., 1996; Abadie et al., 1999; Preziosi et al., 2004b; Dobson e Scase, 2007; Romansik et al., 2007). A marcação da fracção de crescimento tumoral através do Ki-67 tem sido bastante utilizada em medicina veterinária (Peña et al., 1998; Zuccari et
al., 2004). No mastocitoma canino, o Ki-67 surgiu associado com o prognóstico e, mais
importante, mostrou ser um factor de prognóstico independente do grau histológico (Abadie et al., 1999; Scase et al., 2006; Webster et al., 2007). Assim, o Ki-67 parece ser um marcador de prognóstico promissor para predizer o comportamento dos mastocitomas (Dobson e Scase, 2007). A avaliação do índice mitótico, como uma medida indirecta da proliferação celular, também foi avaliada como um possível factor de prognóstico nos mastocitomas, sendo fortemente indicadora da evolução tumoral (Preziosi et al., 2004b; Romansik et al., 2007).
As alterações moleculares no proto-oncogene c-kit têm vindo a ser investigadas nos últimos anos. O produto proteico deste gene, o receptor tirosina cinase c-Kit, é expresso nos mastócitos e é crítico para a sua diferenciação, proliferação, sobrevivência e activação (London et al., 1996). As mutações activadoras no c-kit têm sido descritas nos mastocitomas (Ma et al., 1999), estando a expressão citoplasmática aberrante do c-Kit associada com mutações neste gene (Webster et al., 2006b). A marcação citoplasmática do c-Kit tem sido associada com um pior prognóstico em diferentes estudos (Zemke et al., 2002; Abadie et al., 2005; Webster et al., 2007), continuando a ser, no entanto, importante pesquisar a relação da sua expressão com outros marcadores celulares, de forma a elucidar a sua importância conjunta na transformação neoplásica.
Além da pesquisa de factores de prognóstico, outros estudos têm sido conduzidos no mastocitoma canino a fim de clarificar a biopatologia destas neoplasias.
Em medicina humana, a acção das metaloproteinases nos mecanismos de invasão e metástase tem sido objecto de inúmeros estudos (Stetler-Stevenson et al., 1996; Stetler-Stevenson e Yu, 2001). Em medicina veterinária, a acção das mesmas, particularmente das metaloproteinases -1, -2 e -9, foi estudada em processos inflamatórios de canídeos, como a artrite reumatóide (Comer et al., 1996; Coughlan et
al., 1998a), a cardiomiopatia dilatada (Gilbert et al., 1997) e processos eosinofílicos do
pulmão (Rajamäki et al., 2002a, b; Rajamäki et al., 2005). A sua função nas neoplasias, nomeadamente nos mastocitomas, foi escassamente investigada (Leibman et al., 2000), pelo que novos estudos que contribuam para clarificar a função das MMPs nas neoplasias são fundamentais, com vista a elucidar a sua real participação no processo invasivo.
A angiogénese (formação de novos vasos sanguíneos a partir da rede vascular pré-existente), é um processo de importância vital para o crescimento, progressão e metastização das neoplasias (Robinson e Stringer, 2001). Nos mastocitomas, o papel da angiogénese na progressão tumoral tem sido investigado através do estudo da densidade de microvasos e da detecção do factor de crescimento vascular endotelial, sugerindo que estes factores podem estar implicados na transformação maligna (Ranieri et al., 2003; Preziosi et al., 2004b; Rebuzzi et al., 2007). No entanto, são necessários estudos que analisem o valor prognóstico deste parâmetro, através de análise estatística multivariada, contribuindo assim para um conhecimento mais alargado acerca do impacto da angiogénese no comportamento biológico do mastocitoma.
As células tumorais interagem com o estroma de uma maneira complexa, intercambiando uma grande variedade de moléculas de sinalização, que incluem factores de crescimento, citocinas, hormonas e mediadores inflamatórios (Kusewitt e Rush, 2007). Estas trocas modulam o crescimento tumoral, o estadio de diferenciação e o comportamento das células neoplásicas (Tlsty e Hein, 2001). Esta grande variedade de moléculas vai regular, entre outros mecanismos, a presença de infiltrado inflamatório associado ao tumor. A presença do infiltrado eosinofílico é uma constante em quase todos os mastocitomas caninos (Simoes et al., 1994; Newman et al., 2007), sendo as razões da sua presença ainda desconhecidas. A libertação de factores quimiotácticos para os eosinófilos pelos mastócitos neoplásicos está fracamente investigada em
medicina veterinária, pelo que nos propusemos investigar as razões desta acumulação, bem como averiguar a presença de outras células inflamatórias.
Todos os mastocitomas caninos são potencialmente malignos. No entanto, estas neoplasias apresentam uma grande variabilidade de comportamentos biológicos, o que levanta sérios problemas aos patologistas e clínicos veterinários. Se, por um lado, o patologista necessita de novas ferramentas que auxiliem o diagnóstico e permitam diferenciar com segurança neoplasias de baixo e alto grau de malignidade, por outro, os clínicos necessitam de novos factores de prognóstico que auxiliem a identificação dos animais em alto risco de sofrer recidiva ou morte. Assim, neste trabalho, foram objecto de estudo diversas características epidemiológicas, clínicas e histopatológicas, assim como diferentes marcadores imunohistoquímicos, com o propósito de averiguar a sua utilidade diagnóstica e implicações prognósticas.
1.1. Objectivos
Os objectivos gerais deste trabalho foram, por um lado, a descrição de factores histológicos e imunohistoquímicos nos mastocitomas, muitos deles desconhecidos nestas neoplasias e, por outro, a avaliação da sua relação com aspectos epidemiológicos e clínicos e com a evolução biológica do tumor.
Para isso, propusemo-nos atingir uma série de objectivos específicos, utilizando para tal uma amostra de mastocitomas caninos fixados em formol tamponado e arquivados em parafina, usando técnicas histológicas convencionais e técnicas imunohistoquímicas específicas. Assim, foi nosso objectivo:
1. Estudar diversos parâmetros histológicos usando critérios de avaliação específicos. 2. Determinar a proliferação tumoral (índice de Ki-67) e a imunoexpressão da proteína
c-Kit, sendo estes dois factores de importância crescente no estudo do mastocitoma. 3. Conhecer a imunoexpressão de componentes da matriz extracelular como a
fibronectina e as metaloproteinases de matriz -1, -2 e -9.
4. Analisar a presença de VEGF-A e a densidade de microvasos, detectados com o CD31.
5. Detectar populações celulares do infiltrado inflamatório associado ao tumor (macrófagos, eosinófilos, linfócitos T e linfócitos B) para conhecer o seu valor na patogenia e evolução tumoral.
6. Determinar a produção de citocinas eosinofilotácticas como a eotaxina, a IL-5 e o RANTES
7. Conhecer as possíveis associações entre as diferentes variáveis incluídas no estudo, com o fim de elucidar aspectos da etiopatogenia tumoral e posterior evolução, determinando o valor prognóstico das mesmas com recurso a análise estatística univariada e multivariada.
2. Revisão Bibliográfica
2.1. O MastócitoOs mastócitos, desde há muito tempo que fascinam a comunidade médica. Este interesse deveu-se, em grande parte, às características tintoriais dos grânulos citoplasmáticos, ricos em proteoglicanos e proteases, que levaram ao reconhecimento dos mastócitos por Paul Ehrlich em 1877 (Ehrlich, 1877), ainda que anteriormente tenham sido identificados elementos estruturais no mesentério da rã, que presumivelmente seriam mastócitos (Von Recklinghausen, 1863).
Os mastócitos são uma população heterogénea de células com aparentes diferenças no seu desenvolvimento, conteúdo em mediadores inflamatórios, ultra-estrutura e na sua habilidade em interagir com o ambiente local (Bradding e Holgate, 1999). Estão amplamente distribuídos pelo organismo, tanto no tecido conjuntivo como nas mucosas, e foi estimado que se todos os mastócitos fossem agrupados formariam um órgão do tamanho do baço (Bradding e Holgate, 1999).
A pele normal do cão contém 4 a 12 mastócitos por campo de maior ampliação, (Beningo et al., 2000), sendo mais numerosos no pavilhão auricular e no focinho, (Auxilia e Hill, 2000), estando principalmente localizados na derme e na junção dermo-epidérmica (Noviana et al., 2004). Os mastócitos cutâneos estão preferencialmente localizados no tecido perivascular sanguíneo e linfático, junto aos anexos cutâneos e nervos, o que lhes permite interagir com as células residentes da derme, bem como responder a proteínas estranhas circulantes e agentes infecciosos (Tharp, 1998). A sua ampla distribuição torna os seus produtos acessíveis aos fibroblastos e a outras células do tecido conjuntivo (Galli, 1993).
2.1.1. Morfologia
O mastócito é uma célula mononucleada de 8 a 20 μm de diâmetro, de forma variável (redonda, oval, poligonal ou fusiforme), com um núcleo redondo central ou ligeiramente descentrado (Arok, 2004). O seu citoplasma tem a normal composição em organelas, mas a sua característica mais evidente são os grânulos citoplasmáticos que variam entre 0,2 e 0,5 μm de diâmetro. Estes grânulos contêm numerosos mediadores
inflamatórios que são libertados aquando da sua estimulação (Tharp, 1998). Cada mastócito contém, em média, 1000 grânulos, e cada grânulo encerra numerosas substâncias biologicamente activas como a histamina, a heparina, a dopamina, as prostaglandinas e diferentes interleucinas. Contêm ainda enzimas como a quimase, a triptase, várias hidrolases, os proteoglicanos e as carboxipeptidases (Bensignor et al., 1996a). Os proteoglicanos dentro dos grânulos dos mastócitos permitem a ligação a uma variedade de corantes catiónicos, como o azul de toluidina ou o Giemsa, que coram metacromaticamente (Kramer e Windrum, 1955). Esta metacromasia é causada pela presença de hexassacarídeos, a unidade fundamental da heparina (Jaques et al., 1977).
2.1.2. Diferenciação
No homem, a diferenciação dos mastócitos efectua-se a partir de progenitores hematopoiéticos CD34+ ou CD13+ (uma subpopulação de células CD34+ consideradas como particularmente imaturas), presentes na medula óssea, no sangue do cordão umbilical, no sangue periférico e no fígado fetal (Kirshenbaum et al., 1999; Arok, 2004), que circulam no sangue periférico como células agranulares, semelhantes a monócitos (Kirshenbaum et al., 1991). Este precursor pluripotencial, além de CD34 e CD13, expressa também c-Kit, sendo precursor dos mastócitos, monócitos e mastócitos/monócitos (precursor bipotencial) (Kirshenbaum et al., 1999). Depois de migrarem para os tecidos, estas células precursoras dos mastócitos assumem a sua típica aparência granular e completam a sua maturação com a concomitante diversidade fenotípica (Zucker-Franklin et al., 1981; Kirshenbaum et al., 1991; Gurish e Austen, 2001).
A diferenciação e proliferação dos mastócitos são reguladas por dois mecanismos. O primeiro, é dependente de um factor de crescimento derivado dos fibroblastos (Stem Cell Factor - SCF), e o segundo, é dependente de interleucinas (IL) produzidas por células T (IL-3, -4, -9 e -10) (Hill e Martin, 1998). A IL-3 é importante para a proliferação precoce dos mastócitos, enquanto que o SCF actua para manter a viabilidade e promover a maturação dos mesmos (Metcalfe et al., 1997).
A diferenciação caracteriza-se pelo aparecimento sequencial de três categorias de marcadores: antigénios precoces presentes nos precursores mastocitários que se
encontram na circulação (estes receptores são positivos para o CD34, o CD13 e o c-Kit) (Kirshenbaum et al., 1999), marcadores de diferenciação mastocitária precoce (FcεRI ou receptor de alta afinidade das IgE, histamina e triptase) (Welle, 1997; Carter e Metcalfe, 2002), e marcadores de diferenciação mastocitária tardia (heparina, quimase) (Welle, 1997). Estes dois últimos tipos de marcadores encontram-se unicamente nos mastócitos que atingiram os tecidos. Somente as enzimas triptase e quimase são específicas dos mastócitos, sendo a triptase a de escolha na identificação dos mesmos, (Schwartz, 1985).
2.1.3. Heterogeneidade
A heterogeneidade dos mastócitos foi primeiro descrita no ratinho, onde se demonstrou que as células da pele eram distinguíveis das da mucosa pelas suas características histoquímicas e bioquímicas. Isto levou ao termo mastócitos das mucosas e mastócitos do tecido conjuntivo (Hill e Martin, 1998). Os mastócitos das mucosas contêm apenas triptase, enquanto que os do tecido conjuntivo contêm triptase, quimase e catepsina G (Noli e Miolo, 2001). No homem, inicialmente foram identificados dois tipos de mastócitos, baseado em determinações bioquímicas e morfológicas (Tharp, 1998). Os mastócitos (M) da pele contêm grânulos associados à triptase e à quimase, além de carboxipeptidase, denominando-se MTQ (Irani et al., 1991; Caughey, 1996;
Tharp, 1998). Mais de 90% dos mastócitos cutâneos contêm triptase e quimase (Buckley et al., 1999). Por outro lado, a maioria dos mastócitos do pulmão e da mucosa intestinal produz apenas triptase e foi denominado MT (Beil e Pammer, 2001). Um
considerável número de mastócitos que exprime apenas quimase denominado MQ, pode
estar presente numa medula normal ou reactiva e foi encontrado nos gânglios axilares e pulmão, bem como na mucosa e submucosa intestinal (Weidner e Austen, 1993; Horny
et al., 2003). O fenótipo dos mastócitos humanos também é heterogéneo no seu
conteúdo em citocinas. Por exemplo, a IL-4 existe preferencialmente em MTQ enquanto
que a IL-5 e IL-6 estão quase exclusivamente restritas ao subtipo MT (Puxeddu et al.,
2003).
A heterogeneidade dos mastócitos também se provou na pele canina. Os mastócitos do cão, tal como os mastócitos humanos são heterogéneos em relação ao seu
conteúdo em proteases (Caughey et al., 1988) e foram clonadas e caracterizadas ambas as proteínas quimase e triptase (Caughey et al., 1990). Identificaram-se três tipos de mastócitos, baseados no seu conteúdo em triptase e quimase e na sensibilidade ao formol. Os mastócitos que contêm as duas enzimas são os mais comuns na pele canina, após fixação com formol, constituindo cerca de 70% dos mastócitos cutâneos (Kube et
al., 1998; Welle et al., 1999; Noli e Miolo, 2001). Os diferentes subtipos de mastócitos
também foram identificados em outras espécies animais, como os bovinos (Jolly et al., 1999; Jolly et al., 2000) e os ovinos (Sture et al., 1995).
A heterogeneidade dos mastócitos é regulada por muitos factores, incluindo citocinas que influenciam a maturação, diferenciação e proliferação celular. Experiências em ratinhos indicam que as características fenotípicas da população de mastócitos podem mudar, por vezes de forma reversível, em resposta a alterações do ambiente (Kitamura, 1989). A capacidade de gerar populações individuais que exibem diferenças nas propriedades bioquímicas e funcionais (dependendo da localização anatómica e dos processos biológicos em que participam), permite maior flexibilidade e diversidade da resposta dos mastócitos aos requerimentos fisiológicos, imunológicos, inflamatórios e outras respostas biológicas em que estejam envolvidos (Longley et al., 1995; Galli et al., 2005).
2.1.4. Marcadores membranares
O c-Kit, também designado CD117 ou Kit, é o produto proteico do proto-oncogene c-Kit (Yarden et al., 1987), o homólogo celular do proto-oncogene vírico v-Kit, identificado no genoma do vírus do sarcoma felino de Hardy-Zucherman 4 (Besmer et
al., 1986). O gene do c-Kit está localizado no cromossoma 4 nos humanos e no
cromossoma 5 nos ratinhos (D'Auriol et al., 1988).
O receptor tirosina cinase – c-Kit (fig. 2.1) é uma proteína transmembranar de cerca de 14,5 kDa, constituído por um domínio extracelular, contendo 5 pontes semelhantes a imunoglobulinas (que se liga ao SCF), um domínio transmembranar que ancora o c-Kit à membrana celular, um domínio justamembranar negativo regulador e um domínio citoplasmático cinase, dividido por uma sequência de inserção em regiões ligadoras de ATP e fosfotransferases (Huizinga et al., 1995; Lennartsson et al., 2005;
Roskoski este recep crescimen 1995). O (Longley e pela acção encontra conjuntivo mastócitos Fig A dimerizaçã citoplasmá sinalização 1998). As a prolifera desgranula apoptose Jr, 2005b, ptor é desi nto dos mast
SCF é uma et al., 1997 o de enzim necessariam o (Kitayama s (de Paulis g. 2.1. Represe activação d ão e activ áticas e fos o que leva sim, este fa ação à dife ação, a reg e a adesão a; Pardanan ignado por tócitos ou p a citocina q ). Uma dest mas proteolí mente ligad a et al., 19 s et al., 1999 entação esque do c-Kit pe vação do sforilação d a várias res actor de cres erenciação gulação da o aos fibrob ni et al., 20 Stem Cell por Steel Fa que pode se tas isoform íticas, torna da à memb 95). O SCF 9). mática do c-K lo SCF des c-Kit, ass e outras pro spostas celu scimento or (Nilsson e libertação blastos, à f 006; Webst l Factor ta actor (Willi r produzida as apresenta ar-se solúve brana citop F está local Kit. Adaptado sencadeia u sociação d oteínas do c ulares (Kita rquestra o ci Metcalfe, diferencial fibronectina ter et al., 2 ambém con ams et al., a como dua a um local d el, enquanto plasmática izado e é c de Lennartsso uma série de do c-Kit c citosol, inic ayama et al. iclo comple 1996). O S de mediad a e matriz 006a). O li nhecido por 1990; Kitay as isoformas de clivagem o a outra i de células clivado e lib om et al. 2005 e eventos, com certas ciando uma ., 1995; Hil eto do mastó SCF também dores, a su extracelula igando para r factor de yama et al., s diferentes m, podendo, isoforma se do tecido bertado nos 5 incluindo a s proteínas a cascata de ll e Martin, ócito, desde m regula a upressão da ar, além de a e , s , e o s a s e , e a a e
desencadear efeitos quimiotácticos para outros mastócitos (Tsai et al., 1991; Meininger
et al., 1992; Dastych e Metcalfe, 1994; Metcalfe et al., 1995; Broudy, 1997; Gagari et al., 1997; Webster et al., 2004).
O SCF é produzido, para além dos mastócitos, por outras células como os fibroblastos, as células endoteliais e as células do estroma da medula óssea, células das vias aéreas e células musculares lisas da parede brônquica, bexiga, cérvix e útero, células mioepiteliais das glândulas sudoríparas, células ductais das glândulas salivares e células da tiróide. No sistema nervoso central, a expressão do SCF demonstrou-se nas células de Pürkinje no cerebelo e em algumas células de Golgi (Lammie et al., 1994; de Paulis et al., 1999; Oliveira et al., 2002). Além das funções relativas aos mastócitos, o SCF tem ainda um papel crucial na proliferação, diferenciação, migração e sobrevivência das células mãe hematopoiéticas, nos melanócitos e nas células germinativas (Kitayama et al., 1995). O SCF tem também um papel importante na activação dos eosinófilos, na indução da desgranulação e na produção de citocinas e leucotrienos. Activa a adesão dos eosinófilos à fibronectina e à molécula de adesão vascular 1, sugerindo que pode ser responsável pela imobilização dos mesmos no compartimento tissular (Yuan et al., 1997; Oliveira et al., 2002).
O c-Kit é expresso nas células pluripotenciais hematopoiéticas e nas células progenitoras (Orlic et al., 1995; Doi et al., 1997). Está envolvido na auto-renovação, bem como na diferenciação de ambas as linhas linfóides e mielóides. À medida que as células progenitoras se diferenciam nas respectivas células maduras, o c-Kit perde a expressão membranar (Akin et al., 2000; Akin e Metcalfe, 2004). Uma excepção a este fenómeno são os mastócitos, que retêm níveis altos de c-Kit na membrana e o expressam durante todos os estádios do seu desenvolvimento (Carson et al., 1994; Nilsson et al., 1994; Akin e Metcalfe, 2004). As únicas células da medula óssea, além dos mastócitos, que expressam quantidades significativas de c-Kit, são pequenos linfócitos ocasionais, presumivelmente um subtipo de células Natural Killer (NK) (Li, 2001). Os eosinófilos são também fortemente positivos para a proteína de superfície c-Kit, quando analisados por citometria de fluxo (Oliveira et al., 2002).
No homem, a proteína c-Kit foi identificada imunohistoquímicamente em tecidos normais, nos mastócitos tissulares em marcação membranar, nos melanócitos, nas células epiteliais glandulares da mama, da parótida, das glândulas sudoríparas e das
glândulas esofágicas, nas células intersticiais do testículo e nas células do estroma do ovário e também no cerebelo, no hipocampo e no corno dorsal da medula espinhal (Lammie et al., 1994).
O c-Kit é expresso, para além dos mastócitos, no cão e na idade adulta, nas células de Purkinje do cerebelo (marcação citoplasmática paranuclear), nas células intersticiais de Cajal do tubo digestivo (marcação citoplasmática), nas células endometriais uterinas e nas células epiteliais luminais da glândula mamária (Morini et
al., 2004). A sequência de aminoácidos do c-Kit canino normal apresenta uma
homologia de 93%, 88%, 81% e 64% comparado com a proteína do gato, homem, ratinho e pinto, respectivamente (Ma et al., 1999).
2.1.5. Funções biológicas
Os mastócitos intervêm nos mecanismos de defesa do organismo, em particular na reacção inflamatória. O mastócito integra-se num conjunto de mecanismos imunológicos, humorais e celulares (Bensignor et al., 1996a), participando activamente num amplo espectro de respostas imunológicas inatas e adquiridas, incluindo reacções de hipersensibilidade retardada (Dvorak et al., 1976; Askenase et al., 1980; Takizawa et
al., 1989), fibrose (Claman, 1993), doenças auto-imunes (Mochizuki et al., 1984;
Dietsch e Hinrichs, 1989), neoplasias (Hartveit et al., 1984; Aiba et al., 1985), artrite reumatóide (Gruber et al., 1986; Gruber et al., 1988) e doença inflamatória intestinal (Marsh e Hinde, 1985; Sarin et al., 1987).
O mastócito é uma fonte de numerosas citocinas que possuem efeitos pró-inflamatórios e com actividade a nível do sistema imune, hematopoiese, reconstrução tissular e outros processos biológicos. Entre as citocinas sintetizadas pelos mastócitos estão as IL-1, IL-3, IL-4, IL-5, IL-6, IL-8, IL-10, IL-13, IL-16, TNFα, TGF-β e várias moléculas da família das quimiocinas C-C, como a MIP-1α e a MCP-1, assim como factores de crescimento como o SCF e o factor de crescimento vascular endotelial (VEGF) (Galli, 1993; Galli et al., 2005). A IL-4 actua sobre a migração transendotelial dos eosinófilos e a IL-5 sobre o seu crescimento, adesão, migração transendotelial, quimiotaxia, activação e prolongamento da sobrevivência. A IL-8 induz a quimiotaxia após activação com a IL-3, IL-5 ou GM-CSF. A IL-13 activa e aumenta a sobrevivência
dos eosinófilos. O TNFα aumenta a citotoxicidade e a produção de oxidantes (Bradding e Holgate, 1999). A IL-6 é um potente quimiotáctico para os linfócitos T, a IL-8 é quimiotáctica para os monócitos, enquanto que o MCP-1 é quimioatractivo para os monócitos e células T (Bradding e Holgate, 1999).
Os mastócitos normais estão implicados na geração da resposta angiogénica em várias doenças, estando demonstrado que expressam vários factores angiogénicos potentes, incluindo o VEGF, a histamina e a heparina, o TNF-alfa e a IL-8 (Grützkau et
al., 1998; Norrby, 2002). Existe uma associação directa entre os mastócitos e a
formação do tubo vascular, sendo a triptase um factor crítico na mediação da angiogénese (Blair et al., 1997).
Os mastócitos interagem com as restantes células inflamatórias. A interdigitação das membranas dos linfócitos e mastócitos foi observada em processos inflamatórios (Friedman e Kaliner, 1985) e os mastócitos activados formam agregados heterotípicos com os linfócitos T (Thompson et al., 1992). Estas observações sugerem uma relação funcional entre mastócitos e linfócitos.
2.2. Mastocitose e mastocitomas
Os mastócitos são as únicas células de origem hematopoiética que passam a maior parte da sua vida nos tecidos, e o aumento do seu número é acompanhado por uma disfunção multi-sistémica importante (Metcalfe et al., 1995). O número de mastócitos tissulares, em circunstâncias normais, é relativamente constante (Garriga et
al., 1988) e é regulado por um equilíbrio entre o número de mastócitos provenientes dos
precursores hematopoiéticos e a taxa de morte celular, regulada em grande parte pelo SCF (Metcalfe et al., 1995; Okayama e Kawakami, 2006).
A mastocitose é uma doença rara, caracterizada por um excesso de mastócitos nos tecidos, sendo a pele o órgão mais frequentemente afectado. A Organização Mundial de Saúde (OMS) apresentou critérios específicos para a classificação da mastocitose sistémica humana em 6 subtipos: mastocitose cutânea, mastocitose sistémica indolente, mastocitose sistémica com alteração hematológica clonal não-mastocitária, mastocitose sistémica agressiva, leucemia mastocitária e sarcoma mastocitário (Pardanani et al., 2006). Em algumas condições, este processo parece ser a
expressão clínica da desregulação da produção e função dos mastócitos causada por distintas activações somáticas do c-Kit (Tharp, 1998; Longley et al., 1999; Carter e Metcalfe, 2002). Estas mutações resultam numa activação ligando-independente do receptor tirosina cinase nos mastócitos e a sua consequente proliferação (Longley et al., 1999) e parecem ter um papel na patogenia da mastocitose esporádica dos adultos (Longley et al., 1993; Longley et al., 1995; Nagata et al., 1995; Hartmann et al., 2003), mas são raras na forma cutânea infantil, sugerindo que outros factores possam estar presentes na patogenia da doença (Longley et al., 1993; Hartmann et al., 2003).
Nos doentes humanos adultos com mastocitose esporádica, a mutação mais frequente é a mutação somática do codão 816, com a substituição da valina pelo aspartato (Longley et al., 1999). Esta mutação c-Kit Asp816Val ocorre numa célula progenitora indiferenciada e adicionalmente aos mastócitos afecta outras células mielomonocíticas, células T e B. No entanto, contrariamente aos mastócitos, as restantes células não expressam o c-Kit na superfície, tornando-se menos susceptíveis aos efeitos desta mutação (Akin et al., 2000). Ainda que as mutações que activam constitutivamente o c-Kit estejam claramente associadas com a mastocitose humana, estas não ocorrem universalmente e a questão de se as mutações individuais são necessárias e suficientes para causar a transformação celular continua por responder (Pardanani et al., 2006).
Nos canídeos, a classificação dos tumores de origem hematopoiética não contempla a existência da mastocitose, como definida nos humanos (Valli et al., 2002). A mastocitose sistémica ou disseminada, representando a forma visceral do mastocitoma cutâneo, ocorre com muito menor frequência que a lesão cutânea (Thamm e Vail, 2007). A mastocitose disseminada é quase sempre precedida por um tumor cutâneo indiferenciado, enquanto que os tumores viscerais primários são raros (Takahashi et al., 2000). Existem algumas descrições de mastocitomas com origem primária na cavidade torácica (Davies et al., 1981) ou na cavidade abdominal (Patnaik
et al., 1980), sem lesões cutâneas associadas. De uma forma geral, estes animais
apresentam linfadenopatia, esplenomegalia e hepatomegalia, e é comum o envolvimento da medula óssea com mastocitemia associada (Endicott et al., 2007). Podem também surgir outras anomalias no hemograma como neutrofilia, eosinofilia, basofilia e linfopenia (Hikasa et al., 2000). Os tumores viscerais são, por norma, mais