UNIVERSIDADE FEDERAL DO CEARÁ
FACULDADE DE MEDICINA
DEPARTAMENTO DE FISIOLOGIA E FARMACOLOGIA PROGRAMA DE PÓS-GRADUAÇÃO EM FARMACOLOGIA
BIANCA MOREIRA KURITA
ATIVIDADES ANTI-INFLAMATÓRIA E ANTIRREABSORTIVA ÓSSEAS DO ÁCIDO ZOLEDRÔNICO DURANTE A MOVIMENTAÇÃO
DENTÁRIA INDUZIDA EM RATOS
BIANCA MOREIRA KURITA
ATIVIDADES ANTI-INFLAMATÓRIA E ANTIRREABSORTIVA ÓSSEAS DO ÁCIDO ZOLEDRÔNICO DURANTE A MOVIMENTAÇÃO
DENTÁRIA INDUZIDA EM RATOS
Dissertação apresentada ao Programa de Pós-graduação em Farmacologia da Universidade Federal do Ceará como requisito parcial para obtenção do título de Mestre em Farmacologia. Área de concentração: Farmacologia.
Orientadora: Prof.ª Dr.ª Vilma de Lima.
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca Universitária
Gerada automaticamente pelo módulo Catalog, mediante os dados fornecidos pelo(a) autor(a)
K1a Kurita, Bianca Moreira.
Atividades anti-inflamatória e antirreabsortiva ósseas do Ácido Zoledrônico durante a movimentação dentária induzida em ratos / Bianca Moreira Kurita. – 2017.
109 f. : il. color.
Dissertação (mestrado) – Universidade Federal do Ceará, Faculdade de Medicina, Programa de Pós-Graduação em Farmacologia, Fortaleza, 2017.
Orientação: Profa. Dra. Vilma de Lima.
1. Movimentação Dentária. 2. Ácido Zoledrônico. 3. Remodelação Óssea. 4. Osteoclastos. 5. Osteoblastos.. I. Título.
BIANCA MOREIRA KURITA
ATIVIDADES ANTI-INFLAMATÓRIA E ANTIRREABSORTIVA ÓSSEAS DO ÁCIDO ZOLEDRÔNICO DURANTE A MOVIMENTAÇÃO
DENTÁRIA INDUZIDA EM RATOS
Dissertação apresentada ao Programa de Pós-graduação em Farmacologia da Universidade Federal do Ceará como requisito parcial para obtenção do título de Mestre em Farmacologia. Área de concentração: Farmacologia.
Orientadora: Prof.ª Dr.ª Vilma de Lima.
Aprovado em ___/___/_____
COMISSÃO EXAMINADORA
_______________________________________________
Profª. Drª. Vilma Lima (Orientadora) Universidade Federal do Ceará – UFC
________________________________________________ Prof. Drª. Cristiane Sá Roriz Fonteles
Universidade Federal do Ceará – UFC
_____________________________________________ Prof. Drª. Ana Maria Sampaio Assreuy
AGRADECIMENTOS
À minha orientadora, Drª. Vilma Lima, por todos os ensinamentos e incentivos os quais se fizeram imprescindíveis em minha vida acadêmica e
profissional.
Às professoras doutoras Cristiane Sá Roriz Fonteles e Ana Maria Sampaio Assreuy participantes da banca avaliadora desta dissertação, pelas considerações fundamentais para o aprimoramento deste trabalho.
Aos professores doutores Thyciana Ribeiro Rodrigues, Nylane Maria Nunes de Alencar e Roberto César Pereira Lima Júnior, pelas correções pertinentes por ocasião do exame de qualificação de mestrado.
Ao professor Ronaldo de Albuquerque Ribeiro (in memorian), que deixou
em nós a saudade, mas merece agradecimentos sinceros pelos ensinamentos repassados, os quais nunca serão esquecidos. Será sempre lembrado pela pessoa íntegra e ética que sempre foi.
Ao coordenador do programa de pós-graduação em Farmacologia, professor doutor Pedro Jorge Caldas Magalhães pelo trabalho sólido que vem desenvolvendo à frente deste cargo.
Aos professores do programa de pós-graduação em Farmacologia do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina (UFC), pelos conhecimentos compartilhados durante as disciplinas cursadas.
À professora doutora Deysi Viviana Tenazoa Wong, pela disponibilidade e auxílio durante as dosagens de citocinas. Agradeço também pela amizade e palavras de otimismo.
À doutoranda Iracema Matos de Melo, pelo companheirismo durante
todos os passos deste trabalho.
Aos pós-graduandos e colegas de laboratório Rafael Reis Ribeiro e José Carlos Ribeiro, pela cordialidade e apoio durante os experimentos.
Às alunas de iniciação científica Marina Fiúza Sarte, Tereza Cristina Marques Forte e Lorena Araújo Silva, por toda a dedicação e ajuda.
À minha turma de pós-graduação, por terem me proporcionado momentos de alegria e me concedido a oportunidade de construir amizades novas e sinceras.
Carvalho, Alana Carvalho Bezerra Viana, Naiara Felipe Alves, Adaulto Rodrigues de Sousa e Gabriela Mariângela Faria de Oliveira pelo suporte concedido durante esses dois anos.
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pelo apoio científico e suporte financeiro.
AGRADECIMENTOS ESPECIAIS
À Deus, que em sua infinita bondade, nunca me desamparou, mesmo nos momentos em que duvidei, sua força e amor me levantaram e me encorajaram a estar aonde estou. Sei que continuará a andar ao meu lado pelo restante de minha trajetória.
Aos meu pais, Evandro e Cecy Moreira, que com muito amor me criaram e por nenhum minuto descuidaram do meu futuro. Tudo que fiz e farei não será o
suficiente para agradecer por todo o suporte que me deram. Para vocês, meu maior amor e gratidão.
Ao meu marido, Lucio Kurita, que me incentivou a perseguir meus objetivos. Seu amor, companheirismo diário e palavras de ânimo me ajudaram a
prosseguir e ultrapassar todos os obstáculos.
Aos meus irmãos, Arianne e Nacip, que mesmo de longe, sei que torcem por mim assim como torço por eles.
Aos meus amigos Ana Larissa Lima, Marco Antônio Ribeiro, Elysderble Nogueira, Juliana Oliveira, Edyr Freitas, Flávia Jucá, Thales Dantas e Felipe Ramirez, pela amizade dedicada a mim e por estarem sempre presentes nos momentos de tristeza e alegria.
À orientadora e amiga, professora Vilma, com quem construí uma relação que vai além do laboratório. Uma amiga sincera, que sempre me incentivou e reconheceu meus esforços.
RESUMO
A movimentação dentária induzida (MDI) combina respostas de reabsorção e neoformação ósseas, que dependem da atividade de mediadores químicos da inflamação, culminando em remodelação óssea. Tal observação tem incentivado a avaliação do efeito do ácido zoledrônico (ZOL), um bisfosfonato que inibe a atividade osteoclástica, sendo amplamente utilizado para tratamento de desordens metabólicas ósseas, como a osteoporose e metástases ósseas. Contudo a literatura não tem abordado a participação de citocinas pró-inflamatórias e a modulação do eixo RANKL-OPG durante a MDI e tratamento com ZOL. Diante, disso, avaliou-se o
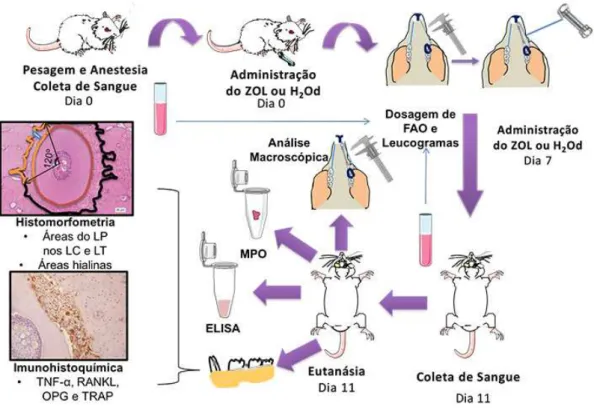
efeito do ZOL na remodelação óssea da MDI. A MDI foi realizada em 72 ratos Wistar
anestesiados pela instalação e ativação de uma mola fechada de níquel-titânio com 50 gf, fixada ao 1° molar superior esquerdo e aos incisivos superiores. Os mesmos receberam H2O destilada, sendo considerados animais não tratados (NT - 1
ml/kg-i.v.) ou ZOL (50, 100 e 200 µg/kg-i.v.), 5 min antes da inserção do dispositivo, e no
7º dia. No dia zero, foram coletadas amostras sanguíneas para avaliação do leucograma (mm3 de sangue) e dosagem de fosfatase alcalina óssea (FAO: U/I) e mensurados os espaços entre os dentes. No 11º dia, as coletas e as mensurações foram repetidas e as gengivas e hemiarcadas removidas para as avaliações da
atividade da mieloperoxidase (MPO: x 103 mg de gengiva) e dos níveis de TNF-α e
IL-1β (pg/mg de gengiva), análise histomorfométrica das áreas de compressão,
tração e hialinas do ligamento periodontal (LP), análise histológica por escores (0 a 3) das reabsorções radicular (RR) e óssea (RO) e análise imunohistoquímica para
RANKL, OPG, TRAP e TNF-α. Os animais foram pesados diariamente durante todo
o período experimental, sendo os valores encontrados, relacionados à massa do dia zero; Comissão de Ética no Uso de Animais-UFC nº 28/15. O grupo NT apresentou aumento do deslocamento dentário, escores altos para as RR e RO, aumento da atividade de MPO e dos níveis gengivais de TNF-α e IL-1β, maior imunomarcação
para RANKL, TRAP e TNF-α no lado de compressão do LP e para RANKL e OPG
no lado de tração, resultando em aumento da razão RANKL/OPG no lado de compressão (p<0,05). Não apresentaram alterações nos níveis séricos de FAO, leucograma e na análise histomorfométrica (p>0,05), mas perderam peso inicialmente, alcançado os valores basais ao 7º dia. O tratamento com ZOL nas três doses reduziu o movimento dentário de forma dose-dependente, bem como reduziuos escores de RR e RO e a atividade de MPO (p<0,05). No entanto, a maior dose de ZOL (200 µg/kg) não alterou os níveis gengivais de TNF-α e IL-1β (p>0,05). Nessa mesma dose, o ZOL reduziu a imunomarcação para TRAP no lado de
compressão, OPG no lado de tração e RANKL e TNF-α em ambos os lados,
resultando em decréscimo na razão RANKL/OPG nas duas regiões avaliadas (p<0,05). Ademais, o tratamento com o ZOL não induziu alterações do leucograma e não promoveu perda de peso significante em relação aos animais não tratados (p>0,05). Em suma, o ZOL reduziu a MDI por meio da inibição de biomarcadores ósseos essenciais à diferenciação e atividade osteoclástica e redução do anabolismo ósseo.
ABSTRACT
BONE ANTI-INFLAMMATORY AND ANTIRREABSORTIVE ACTIVITIES OF ZOLEDRONIC ACID DURING INDUCED TOOTH MOOVEMENT IN RATS
The induced tooth movement (ITM) combines bone resorption and neoformation that depends on chemical mediators of inflammation, thus culminating in bone remodeling. This observation has encouraged the evaluation of the effect of zoledronic acid (ZOL), a bisphosphonate that inhibits osteoclastic activity, being widely used for treating bone metabolic disorders, such as osteoporosis and bone metastasis. However, literature has not addresses the participations of proinflammatory cytokines on RANKL-OPG axis modulation during MDI and ZOL treatment. On this, we evaluated the effect of ZOL on bone remodeling of ITM. ITM was performed in 72 anesthetized Wistar rats by the installation and activation of a nickel-titanium coil-spring, with 50 gf, fixed on upper left 1st molar and upper incisors. The same received distilled water, being considered as non-treated group (NT - 1 ml/kg-i.v.) or ZOL (50, 100 e 200 µg/kg-iv), 5 minutes before the dispositive insertion, and on 7th day. On day zero, blood samples were collected for leukogram assay (mm3) and bone alkaline phosphatase dosage (BALP: U/I), and the space between
the teeth were measured. On the 11th day, the collects and measures were repeated
and the gingivas and hemimaxillas were removed for myeloperoxidase activity
dosage (MPO: 103 mg of tissue) and TNF-α e IL-1β gingival levels analysis (pg/mg of
tissue), histomorphometric analysis of periodontal ligament areas of compression, traction and hyalines, histological evaluation by scores (0 to 3) of root and bone
resorptions and immunohistochemical staining for RANKL, OPG, TRAP, TNF-α e
IL-1β. The animals were weighted daily during the all-experimental period, and then, were related to basal values; Ethics Committee on the Use of Animals-UFC nº 28/15. The NT group, had an increase of tooth movement, high scores of root and bone resorption, increased activity of MPO and high gingival levels of TNF-α e IL-1β,
intense immunostaining for RANKL, TRAP e TNF-α on the compression side and for
RANKL and OPG on the traction side of periodontal ligament, resulting on increased RANKL/OPG ratio on compression side (p<0.05). Still, they do not presented changes in serum levels of BALP, in total and differential leukogram assay and histomorphometric analysis (p>0.05), but they lost weight initially, being the initial
weight, recovered from the 7th day. ZOL treatment in three doses used reduced tooth
movement in a dose-dependent manner, as well as resulted in low scores of root and bone resorption and reduction of MPO activity. However, ZOL in the high dose (200
µg/kg) did not change TNF-α e IL-1β gingival levels (p>0.05). Still, this dose reduced the immunostaining of TRAP on compression side, OPG on traction side and RANKL and TNF-α on both sides, resulting on a decrease of RANKL/OPG ratio on both regions analyzed (p<0.05). In addition, ZOL treatment did not induce changes on leukogram values and body mass variation in comparison to the animals that
received dH2O (p>0.05). In short, ZOL reduced the ITM by decreasing bone
biomarkers essential for osteoclastic differentiation and activity and reducing bone anabolism.
LISTA DE FIGURAS
Figura 1 Vias de indução da transcrição gênica de fatores que estimulam a
osteoclastogênese 19
Figura 2 Ligação do osteoclasto maduro à matriz óssea 20 Figura 3 Vias de indução da transcrição gênica de fatores que estimulam a
osteoblastogênese 21
Figura 4 Resposta inflamatória após aplicação de uma força 25 Figura 5 Desenhos esquemáticos dos processos de reabsorção óssea alveolar no lado de
compressão e neoformação óssea alveolar no lado de tração 28 Figura 6 Estrutura química de um bisfosfonato, destacando-se a ligação P-C-P. Os ligantes
R1 e R2 podem variar de acordo com cada tipo de fármaco 33 Figura 7 Fórmulas moleculares de um bisfosfonato não-nitrogenado, como exemplo, o
Clodronato, e de bisfosfonatos nitrogenados, como o Alendronato de Sódio e
Ácido Zoledrônico. 34
Figura 8 Mecanismo de ação dos N-BFs 36
Figura 9 Estrutura química do Ácido Zoledrônico 38
Figura 10 Representação esquemática do modelo de MDI por mola fechada Ni-Ti e
administração de ZOL 46
Figura 11 Fotografia ilustrativa do modelo de movimentação dentária induzida 47 Figura 12 Fotomicrografia das raízes do primeiro molar superior esquerdo do rato 50 Figura 13 Fotomicrografias ilustrando os delineamentos para quantificação das áreas de
compressão e tração do ligamento periodontal 52
Figura 14 Fotomicrografia com delineamento para a quantificação das áreas hialinas do
ligamento periodontal 53
Figura 15 Fotomicrografia com delineamento para as análises histológicas de reabsorções
radiculares e ósseas 54
Figura 16 Movimentação dentária induzida (MDI) durante 11 dias por mola fechada de Ni-Ti
com 50 gf 58
Figura 17 Dosagem sérica de fosfatase alcalina óssea em animais submetidos à MDI por
mola fechada de Ni-Ti com 50 gf 59
Figura 18 Análise histomorfométrica dos sítios de compressão (A) e de tração (B) e áreas hialinas do ligamento periodontal pós 11 dias de MDI por mola fechada de Ni-Ti
com 50 gf 61
Figura 19 Fotomicrografias dos cortes transversais das raízes distovestibulares 62 Figura 20 Atividade da mieloperoxidase no tecido gengival de hemiarcadas controles e
submetidas à MDI por mola fechada de Ni-Ti com 50 gf 63 Figura 21 Níveis de TNF-α e IL-1β no tecido gengival de hemiarcadas controles e
submetidas à MDI por mola fechada de Ni-Ti com 50 gf 64 Figura 22 Contagens das imunomarcações para TNF-α, RANKL, OPG e TRAP 66 Figura 23 Imunomarcações para TNF-α, RANKL, OPG e TRAP no lado de compressão de
hemiarcadas controles e submetidas à MDI por mola fechada de Ni-Ti com 50 gf 67 Figura 24 Imunomarcações para TNF-α, RANKL, OPG e TRAP no lado de tração de
hemiarcadas controles e submetidas à MDI por mola fechada de Ni-Ti com 50 gf 68 Figura 25 Leucograma de animais submetidos à MDI por mola fechada de Ni-Ti com 50 gf 69 Figura 26 Efeito do Ácido Zoledrônico (ZOL) na variação da massa por 11 dias em animais
LISTA DE QUADROS E TABELAS
Quadro 1 Escores referentes à extensão de reabsorções radiculares (RR) e ósseas
(RO) nos lados de compressão 53
Tabela 1 Efeito do ácido zoledrônico nas reabsorções radiculares e ósseas após 11
LISTA DE ABREVIATURAS E SIGLAS
ABC Complexo avidina-biotina-peroxidase
ADP Adenosida disfosfato
AMPc Adenosida monofosfato cíclica
ANOVA Análise de Variância
ATP Adenosina trifosfato
AP Proteína Ativadora
AppCCl2p Adenosina-5’-beta-gamma-diclorometileno-trifosfato
Apppi Éster do ácido trifosfórico 1-adenosina-5-3-[3-metilbut-3-enil]
BSA Albumina sérica bovina
BFs Bisfosfonatos
BMP Proteína morfogenética óssea
c Cemento
C Controle
CCL Quimiocina motivo (C-C) ligante
CMO Conteúdo mineral ósseo
CMOs Células da medula óssea
CXCL Quimiocina motivo (C-X-C) ligante
C-fms Receptor para o fator estimulador de colônias
C-Jun Proteína codificada pelo gene Jun
d Dentina
DKK Dickkopf
DL Raiz distolingual
DV Raiz distovestibular
EDTA Ácido etilenodiamino tetra-acético
ELISA Ensaio de imunoabsorção enzimática
EphB Receptor de efrina B
FAO Fosfatase alcalina óssea
FCG Fluido crevicular gengival
FGF Fator de crescimento fibroblástico
FPP Farnesil pirofosfato
FPPS Farnesil pirofosfato sintetase
Gf Gramas força
Gp Glicoproteína
GGPP Geranil-geranil pirofosfato
GGPPS Geranil-geranil pirofosfato sintetase
G-MCSF Fator estimulador de colônias de granulócitos e macrófagos
H2Od Água destilada
ICAM Proteína de adesão intercelular
IFN Interferon
IGF Fator de crescimento insulínico
IL Interleucina
INT Raiz intermediária
IPP Isopentenil pirofosfato
IV Intravenosa
JAK Janus quinase
K7M3 Células de osteosarcoma murinho
lp Ligamento periodontal
LPR Receptor de lipoproteína
LPS Lipopolissacarídeo
M Raiz mesial
MAPK Proteíno-quinases ativadas por mitógenos
MDI Movimentação dentária induzida
ML Raiz mesio-lingual
MPO Mieloperoxidase
mRNA RNA mensageiro
NaCl Cloreto de sódio
NAFTc Fator nuclear de células T ativadas
NaPO4 Fosfato de sódio
NF-κB Fator nuclear κ-B
Ni-Ti Níquel-Titânio
NO Óxido nítrico
NT Não tratado
NT-x Telopeptídio N-terminal
N-BFs Bisfosfonatos nitrogenados
oa Osso alveolar
OCN Osteocalcina
ONMB Osteonecrose dos maxilares induzida por bisfosfonatos
OPD O-fenilenodiamina
OPG Osteoprotegerina
OSF Fator estimulante de osteoblastos
OSM Oncostatina M
OSX Osterix
p Polpa
PBS Tampão fosfato-salino
PG Prostaglandina
pH Potencial hidrogêniônico
qPCR Reação em cadeira de polimerase em tempo real
RANK Receptor ativador do fator nuclear-κB
RANKL Ligante do receptor ativador do fator nuclear-κB
RAW 264.7 Células de linhagem macrofágica murina
RFA Reação de fase aguda
ROS Espécies Reativas de Oxigênio
RO Reabsorção óssea
RR Reabsorção radicular
RT-PCR Transcriptase reversa- reação em cadeia de polimerase
RUNX Fator de transcrição relacionado a RUNT
SMAD Proteína SMAD
SP Substância P
STAT Transdutor de sinal e ativador da transcrição
TGF Fator transformador do crescimento
TLR Receptor Toll-like
TNF Fator de necrose tumoral
TRAF Receptor associado ao TNF
TRAP Fosfatase ácida tartarato-resistente
UFC Universidade Federal do Ceará
V-CAM Proteína vascular de adesão celular
VEGF Fator de crescimento do endotélio vascular
VO Volume ósseo
VT Volume de tecido
SUMÁRIO
1. INTRODUÇÃO 16
2. REVISÃO DE LITERATURA 18
2.1 Remodelação óssea 18
2.2 Movimentação dentária e inflamação 23
2.3 Estudos da movimentação dentária induzida (MDI) 29
2.4 Bisfosfonatos 32
2.5 Ácido Zoledrônico 38
3. JUSTIFICATIVA 42
4. OBJETIVOS 43
4.1 Geral 43
4.2 Específicos 43
5. METODOLOGIA 44
5.1 Seleção de animais 44
5.2 Fármacos, reagentes e anticorpos 44
5.3 Protocolo experimental 45
5.2.1 Modelo de Movimentação Dentária Induzida (MDI) 45
5.3.2 Grupos experimentais 47
A. Grupos não-tratados 47
B. Grupos ácido zoledrônico (ZOL) 47
C. Grupos controles 48
5.4 Quantificação dos espaços interdentais 48
5.5 Dosagem sérica de fosfatase alcalina óssea 49
5.6 Histomorfometria das áreas do ligamento periodontal 49 5.7 Histologia de reabsorções radiculares e ósseas
alveolares 53
5.8 Dosagem da atividade da mieloperoxidase (MPO)
gengival 54
5.9 Dosagens dos níveis gngivais de TNF-α e IL-1β 55
5.10 Análise imunohistoquímica para detecção de TNF-α,
RANKL, OPG e TRAP 56
5.11 Análise do leucograma 57
5.13 Aspectos éticos 57
5.14 Análise estatística 57
6.RESULTADOS 58
6.1 Quantificação dos espaços interdentais 58
6.2 Dosagem sérica de fosfatase alcalina óssea 58
6.3 Histomorfometria das áreas do ligamento periodontal 59 6.4 Histologia das reabsorções radiculares e ósseas 60 6.5 Atividade da mieloperoxidase gengival (MPO) 63
6.6 Análise dos níveis gengivais de TNF-α e IL-1β 63
6.7 Análises imunohistoquímicas 64
6.8 Leucograma 69
6.9 Variação de massa corpórea 70
7. DISCUSSÃO 71
8. CONCLUSÃO 82
Referências 83
Apêndices 105
Apêndice A - Controles negativos para TNF-α, RANKL,
OPG e TRAP 105
Apêndice B - Aparelhos e instrumentos laboratoriais 106
Apêndice C- Soluções e materiais de consumo 108
Anexo 109
Anexo A - Aprovação da comissão de ética no uso de
1 INTRODUÇÃO
As repercussões de fármacos que afetam o metabolismo ósseo, como os antirreabsortivos, a exemplo dos bisfosfonatos, têm sido investigadas especialmente em
modelos animais (KAIPATUR et al., 2013; FERNANDEZ-GONZÁLEZ et al., 2016). Os
bisfosfonatos nitrogenados são utilizados no tratamento de desordens metabólicas
ósseas, como osteoporose e metástases ósseas (JUNG et al., 1973; BROOM et al.,
2014). Dentre eles, destaca-se o ácido zoledrônico, um potente inibidor de osteoclastos, utilizado como adjuvante quimioterápico (BARNADAS et al., 2014) e para o tratamento
de fraturas na osteoporose pós-menopausa (CHÁVEZ-VALENCIA et al., 2014). O uso de
bisfosfonatos nitrogenados, principalmente o ácido zoledrônico, por períodos prolongados, impossibilita o manejo odontológico dos pacientes, uma vez que o risco de osteonecrose dos maxilares aumenta (GHONEIMA; ALLAN; WINDSOR, 2010). Esta condição se caracteriza por exposição do tecido ósseo decorrente da incapacidade de
cicatrização do epitélio (KOHSLA et al., 2007). Diante disso, o tratamento ortodôntico e
outras intervenções cirurgicas orais são contraindicados durante a terapia com bisfosfonatos nitrogenados (KRISHNAN; PANDIAN; KUMAR, 2015).
O osso é um tecido especializado rico em Ca2+ que se encontra em
remodelação óssea contínua. Esse processo depende da atividade de osteoclastos, que reabsorvem o osso em desuso da matriz óssea, osteoblastos que recompõem a matriz,
formando um novo osso, e osteócitos que regulam a atividade dessas células (DATTA et
al., 2008; RUCCI, 2008). A remodelação óssea é o processo que renova o tecido ósseo,
mantendo a força e a homeostasia óssea, que se inicia logo após o nascimento e perdura até a morte. Em mulheres na menopausa tende a diminuí-la, mas não a torna
inexistente (CLARKE et al., 2008). A mesma, depende da atividade orquestrada de
osteoclastos e osteoblastos, os quais se intercomunicam pela expressão de proteínas e receptores que regulam a diferenciação, proliferação e atividade dessas células (ZHAO
et al., 2006; PEDERSON et al., 2008; MARTIN; SIMS, 2005; TANG et al., 2009). O osso
também sofre influência expressiva do sistema imune, uma vez que clastos e blastos expressam receptores para leucócitos, citocinas e quimiocinas, os quais regulam o
processo de maturação dessas células, modulando o metabolismo ósseo (DATTA et al.,
2008; RUCCI, 2008; JIANG et al., 2015).
estresse mecânico leva a deformação do ligamento periodontal, originando áreas de compressão e tração (WISE; KING, 2008). No lado de compressão, o colabamento dos vasos induz hipóxia e consequente morte celular (GAEGLER; MERTE, 1983). A partir disso, a matriz extracelular passa a ser composta por fibras colágenas densas, com ausência de células, denominadas áreas hialinas da matriz extracelular (FRACALOSSI
et al., 2009). Essas áreas liberam fatores quimiotáticos para células gigantes
multinucleadas, que se diferenciam em osteoclastos e tornam a reabsorver o osso adjacente (VON BÖHL; KUIJPERS-JAGTMAN, 2009). Os eventos inflamatórios são gerados ao redor das áreas hialinas, uma vez que, os macrófagos, ao fagocitarem essas áreas, liberam quimiocinas e citocinas que atraem células mesenquimais. Por isso, a movimentação dentária agrega uma resposta inflamatória asséptica, sem infecção (KRISHNAN; DAVIDOVITCH, 2006). Quando a força é aplicada corretamente, o mínimo de áreas hialinas é gerado, permitindo a reabsorção óssea frontal. Forças de grande
intensidade, induzem áreas hialinas extensas, o que leva ao atraso do movimento
dentário (FRACALOSSI et al., 2009). No lado de tração, o estiramento do ligamento
periodontal permite a aposição óssea, mediada pelo aumento da angiogênese e de células osteogênicas como osteoblastos, as quais são induzidas por fatores de
crescimento (FRANCESCHI; XIAO, 2003; BODINE et al., 2007).
2 REVISÃO DE LITERATURA
2.1 Remodelação óssea
O osso é um tecido conjuntivo resistente e especializado, constituído por íons
Ca2+ na forma de hidroxiapatita, que se encontra em constante remodelação óssea
(DATTA et al., 2008). O processo de renovação é dependente da atividade de células como osteoclastos, que reabsorvem a matriz óssea, osteoblastos, que exercem funções osteogênicas, e osteócitos, células provenientes de osteoblastos, que constituem a matriz óssea e exercem funções mecanossensoriais (RUCCI, 2008). Essas células atuam de forma sincronizada para que a reabsorção seja seguida de neoformação óssea, preservando a matriz tecidual (RAGGAT; PARTRIDGE, 2010).
Os osteoclastos são derivados de células estaminais hematopoiéticas e seu desenvolvimento envolve a interação do fator estimulador de colônias de macrófagos (M-CSF) e do seu receptor C-fms, o qual é encontrado na superfície de tais células
progenitoras (REDLICH; SMOLLEN, 2012). Na osteoclastogênese o recrutamento de células originadas da linhagem de macrógafos se fundem para formar células
multinucleadas com bordas em escova, os osteoclastos (UDAGAWA et al., 1990;
WALKER, 1975), os quais expressam fosfatase ácida tartarato-resistente (TRAP) em
sua superfície (TEITELBAUM; ROSS, 2003). Nesse processo de diferenciação, diversos
mediadores inflamatórios, tais como as prostaglandinas E (PGE2) (BEZERRA et al.,
2000), citocinas como o fator de necrose tumoral alfa (TNF-α), a interleucina (IL)-1β
(LIMA et al., 2004) e a IL-17, metaloproteinases de matriz óssea, e óxido nítrico (LEITAO
et al., 2005) exercem um papel crucial na destruição óssea osteoclástica (GUIMARÃES
et al., 2016). Tais mediadores estimulam o aumento de citocinas como o ligante do
receptor ativador do fator nuclear-κB (RANKL), expresso em células estromais como
linfócitos T e B, fibroblastos e osteoblastos, e do M-CSF (WIKTOR-JEDRZEJCZAK et
al., 1990; YASUDA et al., 1998; HOWARD; ZWILLING, 1998; QUINN et al., 2000;
MANABE et al., 2001). O M-CSF atua na proliferação de pré-osteoclastos, ao passo que
o RANKL ativa o receptor ativador do fator nuclear κB (RANK), induzindo a diferenciação
e a ativação de osteoclastos (YASUDA et al., 1998). Após a ligação entre RANK e
RANKL, o fator nuclear-κB (NF-κB) e a proteína ativadora-1 (AP-1), encontrados no
citoplasma sob condições normais, migram para o núcleo e regulam a transcrição gênica
(BOYLE, SIMONET, LACEY; 2003). O NF-κB e a AP-1 ativam o fator nuclear de células
nesse processo por intermédio de vias como a do receptor associado ao TNF-6 (TRAF-6), c-Jun e proteína MAPK p38 (IKEDA et al., 2004; GOHDA et al., 2005; ZHAO et al.,
2007), promovendo oscilação intracelular dos níveis de Ca2+, e induzindo a
osteoclastogênese (YANG, LI; 2007) (Figura 1).
Figura 1 – Vias de indução da transcrição gênica de fatores que estimulam a osteoclastogênese. A interação RANK-RANKL na presença de M-CSF na membrana de pré-osteoclastos promove a ativação de NF-κB e AP-1, com consequente migração para o núcleo. Ambos regulam a ativação de NAFTc-1, que estimula a osteoclastogênese via TRAF6, C-Jun e MAPK p38. Baseado em DATTA et al., 2008; RUCCI et al., 2008; RAGGAT; PARTRIDGE, 2012.
Para interagir com o osso, os osteoclastos maduros expressam αVβ3
integrina, um receptor que interage com proteínas da matriz óssea como a osteopontina
e a sialoproteína óssea (DAVIES et al., 1989). A ocupação do sítio da αVβ3 integrina,
além de promover a oscilação dos níveis de Ca2+, promove a fosforilação de tirosina e a
produção de espécies reativas de oxigênio (ROS), ativando o osteoclasto para promover
reabsorção óssea (SHANKAR et al., 1993; DATTA et al., 1995; NAKAMURA et al.,
1998). As mudanças que ocorrem no citoesqueleto para formar a borda em escova são
Figura 2 – Ligação do osteoclasto maduro à matriz óssea. A ligação do osteoclasto ao osso ocorre pela expressão de αVβ3 integrina, que induz oscilação dos níveis de cálcio e produção de espécies reativas de oxigênio (ROS). Assim, a célula passa a reabsorver o tecido pela presença da borda em escova formada pelas GTPases. Baseado em DATTA et al., 2008.
De maneira coordenada, os osteoblastos são as células importantes durante a neoformação óssea, cuja diferenciação também é estimulada por diversos fatores, em
diferentes estágios. Os osteoblastos se desenvolvem a partir de células progenitoras mesodérmicas que, quando completamente diferenciadas, produzem a matriz óssea. O fator estimulador de osteoblastos (OSF-1) atua na quimiotaxia de pré-osteoblastos e na
maturação de osteoblastos imaturos (YANG et al., 2001). Todavia, o anabolismo ósseo
depende, principalmente, da expressão do fator de transcrição relacionado a RUNT-2, o RUNX2, cuja ativação resulta em diferenciação de pré-osteoblastos em osteoblastos
maduros, bem como a sobrevivência dessas células (GAUR et al., 2005).
O RUNX2 pode ser induzido pela via Wnt/β-Catenina, pelo fator transformador
do crescimento-β (TGF-β) e pelas proteínas morfogenéticas ósseas (BMPs) (DATTA et
al., 2008). O hormônio da paratireoide (PTH), os fatores de crescimento fibroblástico (FGF) e insulínico (IGF), e as BMPs também levam à expressão de RUNX2, via indução
de SMADs e MAPKs (FRANCESCHI; XIAO, 2003; BODINE et al., 2007).
A via Wnt/β-Catenina exerce um papel importante na ativação osteoblástica
(BODINE; KOMM, 2006). As proteínas Wnt são glicoproteínas secretadas por células da
medula óssea e hematopoiéticas (YAMANE et al., 2001). Elas se ligam a um complexo
de receptores composto pelos receptores de lipoproteínas de baixa densidade 5 e 6 e
um receptor Frizzled (VAN AMERONGEN; NUSSE, 2009). A interação entre as
proteínas Wnt e o complexo de receptores inibe a fosforilação de β-catenina, levando a
um acúmulo da forma não-fosforilada no citoplasma, a qual se transloca para o núcleo, e
Esta via também leva à superexpressão de Osteoprotegerina (OPG), uma citocina antiosteoclastogênica produzida por osteoblastos que se liga ao RANKL e
impede sua ligação ao RANK (KAWASAKI et al., 2006). Desta forma, inibe a
osteoclastogênese e induz apoptose de osteoclastos maduros (LACEY et al., 1998).
Esta via pode ser infra-regulada por proteínas como a Dickkopf -1 (DKK1), a qual é
secretada fisiologicamente pela pele e baço (KWACK et al., 2008).
A oncostatina M (OSM) também induz a atividade osteoblástica ao se ligar a um receptor de citocinas chamado glicoproteína 130 (Gp130), presente na membrana de osteoblastos, induzindo a ativação da via de sinalização JAK-STAT, o que resulta na
modulação da transcrição gênica (WALKER et al, 2010). Ainda, a expressão
osteoblástica de osteopontina, osteonectina e osteocalcina é importante na produção de componentes da matriz, a exemplo da hidroxiapatita, contribuindo para a manutenção da
mineralização óssea (MURSHED et al., 2005) (Figura 3).
Em relação aos osteócitos, estas células também estão incluídas na “Unidade Básica Multicelular” do esqueleto, juntamente aos osteoblastos e osteoclastos, demonstrando participar ativamente na remodelação do tecido ósseo (BONEWALD, JOHNSON, 2008; O’BRIEN; NAKASHIMA; TAKAYANAGI, 2013), apesar de terem sido considerados inertes durante anos. Osteócitos são osteoblastos terminalmente diferenciados contidos dentro da matriz óssea mineralizada e são envolvidos na mecanosensação e transdução deste tecido (BONEWALD, JOHNSON, 2008). A literatura tem destacado a função de osteócitos no controle da formação e reabsorção óssea. A identificação da esclerostina, uma proteína restrita a osteócitos e considerada
antagonista da via Wnt/β-Catenina (TEN DIJKE et al., 2008), forneceu a primeira
evidência de que os osteócitos exercem controle direto sobre a formação óssea. Ainda, estudos genéticos revelaram que os osteócitos são fontes celulares de RANKL e que
reconhecidamente controlam a osteoclastogênese (NAKASHIMA et al., 2011; XIONG;
O’BRIEN, 2012).
Sabe-se que os osteoblastos são os principais reguladores da diferenciação
de osteoclastos, uma vez que as principais citocinas requeridas para esse processo são
expressas por essas células (DATTA et al., 2008), a exemplo de RANKL e M-CSF, que
são marcadores característicos da linhagem osteoblástica, assim como PTH, fosfatase
alcalina e osteocalcina (SIMS; GOOI, 2008; RUCCI, 2008; GOOI et al., 2010). Foi
observado, ainda, em um estudo in vitro, que a osteoclastogênese ocorria somente na
presença de osteoblastos e células estromais (TAKAHASHI et al., 1988).
Durante o processo de reabsorção óssea, os osteoclastos e os osteócitos
liberam TGF-β e IGF-1 que induzem o recrutamento de células mesenquimais
pré-osteoblásticas aos sítios de destruição óssea (MARTIN; SIMS, 2005; TANG et al., 2009).
Osteoclastos também expressam a 1-fosfato de esfingosina, uma proteína de sinalização osteoblástica, que atua como agente quimiotático para osteoblastos
(PEDERSON et al., 2008). Ainda, essas células também produzem efrina-B2, que ao se
ligar aos receptores EphB4, presentes em osteoblastos, induz o aumento da diferenciação osteogênica, bem como a inibição da osteoclastogênese pela
infrarregulação de NAFTc-1 (ZHAO et al., 2006). De fato, há uma estreita comunicação
entre osteoblastos e osteoclastos, que interagem para promover remodelação e manutenção do tecido ósseo (RAGGAT; PARTRIDGE, 2010).
defesa e quimiocinas (DATTA et al., 2008). Quando há algum fator de ativação desse
sistema, a exemplo de doenças como a artrite reumatoide (JI et al., 2002) e periodontite
(YOSHIHARA et al., 2004), e indução de estresses mecânicos como a instalação de
aparelhos ortodônticos (GARLET et al., 2007; 2008), há a produção de mediadores da inflamação que interagem com clastos e blastos modulando o metabolismo ósseo
(RUCCI, 2008; JIANG et al., 2015). Dessa forma, modelos de movimentação dentária
induzida têm sido utilizados afim de elucidar os mecanismos inerentes à remodelação óssea.
2.2 Movimentação dentária e inflamação
A movimentação dentária é, por definição, o deslocamento de um dente decorrente de uma força mecânica aplicada ao mesmo, envolvendo diretamente o ligamento periodontal e o osso alveolar, de tal forma a gerar uma área de compressão
do ligamento contra o osso alveolar e, no lado oposto, uma de tração dos ligamentos periodontais. As forças mecânicas não induzem apenas a movimentação dentária, mas também, estimulações biológicas capazes de promover reações teciduais que
determinarão uma nova posição estável e duradoura do dente (FRACALOSSI et al.,
2009), cujo fenômeno é denominado mecanotransdução. Tais estímulos biológicos envolvem eventos celulares, a partir dos quais ocorrem as proliferação, diferenciação e apoptose de células do ligamento periodontal nos sítios de compressão e tração, estimulados pela liberação de mediadores da inflamação como prostaglandinas,
citocinas, quimiocinas, fatores de crescimento, dentre outros (KRISHNAN;
DAVIDOVITCH, 2009; CHIBEBE; SATAROBINAS; PALLOS 2011).
Burstone (1962) dividiu a movimentação dentária em seres humanos em três
fases. A primeira, chamada de fase inicial que perdura até o 5º dia e se caracteriza pelo
movimento do dente no espaço periodontal. A segunda, corresponde à fase de latência em que há o retardo do movimento dentário, devido à formação de áreas hialinas por
volta do 6º ao 12º dia. Por fim, a fase de pós-latência, que ocorre a partir do 13º dia, na
qual há um aumento das taxas de movimentação dentária por conta da reabsorção das áreas hialinas por osteoclastos (KRISHNAN; DAVIDOVITCH, 2006).
Consequentemente, surgem zonas de necrose focal, que apresentam trombose capilar e redução do número de células, chamadas de áreas hialinas da matriz extracelular, por
se assemelharem à cartilagem hialina em cortes histológicos (MEIKLE et al., 2006). Os
macrófagos são recrutados e diferenciados em osteoclastos para remoção dessas áreas e, por conseguinte, acabam por reabsorver o osso circunjacente e favorecer o deslocamento do dente (VON BÖHL; KUIJPERS-JAGTMAN, 2009).
A hipóxia instalada no sítio de compressão leva ao desenvolvimento de um processo inflamatório agudo, no qual há a liberação de fatores como a histamina, a bradicinina, a substância P e o fator de crescimento do endotélio vascular (VEGF), os quais facilitam o extravasamento de plasma dos capilares (WISE; KING, 2008). Com a perda de líquido, os leucócitos se concentram no lúmen do vaso, e dada a evolução do processo, se aderem ao longo do endotélio e transmigram para o meio extracelular, sendo recrutados para o lado de compressão por meio de estímulos de citocinas e
quimiocinas (ANDRADE; TADDEI; SOUSA, 2012) (Figura 4). Em conjunto com as alterações vasculares e celulares, a compressão do ligamento periodontal também induz a produção de mediadores da inflamação. Esses mediadores atuam no processo inflamatório agudo induzindo quimiotaxia de leucócitos como neutrófilos, linfócitos e
monócitos para o local da inflamação por meio da expressão de moléculas de adesão
como VCAM-1 e ICAM-1 (KINDLE et al., 2006), bem como desempenhando um papel
relevante na remodelação óssea induzida pela movimentação ortodôntica, agindo de forma direta e indireta na atividade das células ósseas (KRISHNAN, DAVIDOVITCH,
2006; 2009; MEIKLE, 2006; JIANG et al., 2015). Dentre eles, destacam-se a PGE2 e as
citocinas pró-inflamatórias, o TNF-α e as IL-1β, -6 e -8 e -17, bem como o fator
estimulador de colônias de granulócitos e macrófagos (GM-CSF). Esses mediadores
químicos ativam os osteoclastos a promover reabsorção óssea (KUWABARA et al.,
Figura 4 – Resposta inflamatória após aplicação de uma força. A hipóxia estimula a liberação mediadores da inflamação que facilitam a saída de leucócitos dos vasos e a quimiotaxia para o local da inflamação. PG: prostaglandina; SP: substância P; VEGF: fator de crescimento de endotélio vascular; TNF: fator de necrose tumoral; IL: interleucina. Adaptado de Andrade; Taddei; Sousa, 2012.
Em contrapartida, as citocinas anti-inflamatórias como IL-4, -10, -18, e os
fatores TGF-β, FGF e IGF exercerem efeitos estimulatórios sobre osteoblastos,
favorecendo a neoformação óssea (HORWOOD et al., 1998; TEIXEIRA et al., 2010;
CHENG et al., 2011).
As prostaglandinas (PGs) atuam principalmente nos eventos vasculares da inflamação, mas sabe-se que também são potentes reguladores da osteoclastogênese
(SHIMIZU et al., 1992). Estudos revelam uma correlação positiva entre a dor após
instalação de elásticos separadores e os níveis de PGE2 no fluido crevicular gengival
(FCG) de pacientes, uma vez que o pico de deste mediador no FCG se deu por volta de 1 hora após o estímulo, sendo concomitante ao aumento dos escores da Escala Visual
Analógica (GIANNOPOULOU; DUDIC; KILIARIDIS, 2006). Também foi observado um
aumento na produção PGE2, bem como a consequente ativação de osteoclastos nos
sítios de reabsorção óssea alveolar na presença de periodontite (RASMUSSEN; HANSTROM; LERNER; 2000). Além disso, a incubação de monócitos de sangue
periférico com 10-7 M de PGE2 aumentou a expressão de RANKL após 48 horas
(KANZAKI et al., 2002).
TNF-α, IL-1β e IL-6 são citocinas envolvidas na resposta inflamatória inicial.
remodelação óssea, uma vez que atuam ativamente na maturação osteoclástica (REDLICH; SMOLEN, 2012).
Particularmente, o TNF-α promove a osteoclastogênese mediante a sua
ligação ao receptor p55 presente na membrana de pré-osteoclastos, induzindo a diferenciação dessas células em osteoclastos maduros. Também promove a
suprarregulação de RANKL, M-CSF e quimiocinas em osteoblastos (LAM et al., 2000;
TEITELBAUM; ROSS, 2003; YANO et al., 2005). Além de induzir a osteoclastogênese, o
TNF-α exerce uma ação inibitória na neoformação óssea, pois estimula a apoptose de
osteócitos, células que promovem a manutenção da matriz óssea por regularem a
atividade de osteoblastos (AHUJA et al., 2003; RUCCI, 2008).
Da mesma forma, a IL-1β também é um mediador chave envolvido na
osteoclastogênese, que é expresso em níveis elevados no lado de compressão durante
o movimento dentário (GARLET et al., 2007; NAKAO et al., 2007; REN et al., 2007). A
diferenciação de osteoclastos mediada por IL-1β ocorre tanto pela indução de fusão,
ativação e sobrevivência de células reabsortivas (BASARAN et al., 2006), como pelo
aumento da produção de RANKL por osteoblastos e células estromais durante as fases iniciais da movimentação ortodôntica (LE GALL, SASTRE, 2010). Outros estudos
também constataram que a IL-1β induz a suprarregulação de PGE2, M-CSF e
quimiocinas e a infrarregulação da expressão de osteoprotegerina (OPG), em
osteoblastos (TANABE et al., 2005; BLETSA; BERGGREEN; BRUDVIK, 2006).
A IL-6, induzida por TNF-α e IL-1β, estimula a reabsorção óssea por um
mecanismo distinto, que consiste em intensificar o acoplamento entre osteoclastos e
osteoblastos (STEEVE et al., 2004). Foi observado que esta citocina estimula a
osteoclastogênese na presença de osteoblastos, mas não em culturas de osteoclastos,
apenas (HATTERSLEY et al., 1988). Receptores para a IL-6, como o Gp130, presentes
em osteoblastos, são necessários para que haja osteoclastogênese (UDAGAWA et al.,
1995). Seu efeito se dá pela estimulação da expressão de RANKL nessas células,
intensificando a interação RANK-RANKL (PALMQVIST et al., 2002). Além disso, a IL-6
regula a ativação do eixo hipotálamo-hipófise-adrenal por TNF-α e IL-1, induzindo o
aumento da liberação de cortisol que também promove reabsorção óssea (VAN GOOL
et al., 1990; CHROUSOS, 1995).
Por outro lado, a IL-4, a IL-10 e o TGF-β desempenham papel inibitório
Estes são expressos no ligamento periodontal durante a movimentação dentária e inibem a osteoclastogênese por estimular a expressão de OPG em osteoblastos
(HORWOOD et al., 1998; TEIXEIRA et al., 2010). Além disso, a IL-4 diminui a expressão
de RANKL via inibição de STAT 6. A IL-10 inibe a produção de TNF-α, IL-1β e IL-6,
tendo sua expressão superior no lado de tração em comparação ao de compressão
(PALMQVIST et al., 2006; GARLET et al., 2007). Um estudo in vitro constatou que
TGF-β induz a suprarregulação de osteoblastos e de OPG durante a tração de células do
ligamento periodontal e, semelhante à IL-10, esta citocina inibe a expressão de IL-6 (KANZAKI et al., 2006).
Mesmo sendo considerada uma citocina importante na ativação de
macrófagos, IFN-γ possui uma ação inibitória da osteoclastogênese em conjunto com os
receptores tipo-Toll (toll-like receptors ou TLRs), inibindo a expressão de RANKL e do gene que codifica o receptor do fator estimulador de colônias (c-Fms) (JI et al., 2009). Também foi encontrada em níveis aumentados no lado de tração após indução do
movimento dentário em humanos (GRANT et al., 2013).
O sistema de quimiocinas também exerce função importante na remodelação óssea. Quimiocinas, como CCL2, 3 e 5, CXCL8 (IL-8) e CXCL12, promovem a
diferenciação de pré-osteoclastos pela indução de RANKL (YU et al., 2004) e induzem a
quimiotaxia e sobrevivência de osteoclastos maduros (OKAMATSU et al., 2004;
WATANABE et al., 2004). RANKL induz a produção de CCL2, 3 e 5 por osteoclastos,
sugerindo uma sinalização autócrina e parácrina da osteoclastogênese e um aumento
da reabsorção óssea (YU et al., 2004; BINDER et al., 2009).
CCL5 e CXCL12 também exercem influência na atividade de osteoblastos (ANDRADE; TADDEI; SOUSA, 2012). Estudos observaram que a ligação dessas quimiocinas aos osteoblastos induz o recrutamento e inibição da apoptose dessas células, como também induzem a expressão de colágeno tipo-I em suas superfícies
(YANO et al., 2005; ANDRADE et al., 2009).
A comunicação entre osteoclastos e osteoblastos por intermédio do sistema RANK/RANKL/OPG pode ser mediada pela ação das quimiocinas (BOYCE, XING,
2008), as quais são induzidas por IL-1β e TNF-α, contribuindo para a osteoclastogênese
e exacerbando a reabsorção óssea (YU et al., 2004; YANO et al., 2005; SCHALL,
Figura 5 – Desenhos esquemáticos dos processos de reabsorção óssea alveolar no lado de compressão (A) e neoformação óssea alveolar no lado de tração (B). No lado de compressão, a reabsorção óssea é regulada pela via RANK/RANKL/OPG, podendo, também, ser estimulada por mediadores pró-inflamatórios como TNF-α, IL-1β, IL-6, IL-8 e PGE2 e quimiocinas. No lado de tração
2.3 Estudos da movimentação dentária induzida (MDI)
Os modelos de movimentação dentária induzida (MDI) em animais constituem boas estratégias para o estudo da remodelação óssea, uma vez que mimetizam as principais características clínicas, como o movimento propriamente do dente em direção à força aplicada e a produção de biomarcadores inflamatórios e ósseos (REN et al., 2004).
Um modelo que vem sendo bastante utilizado consiste na instalação e ativação de dispositivos ortodônticos, no qual o movimento dentário induz a liberação de mediadores químicos da inflamação em poucos dias após a aplicação de força (XIE;
KUIJPERS-JAGTMAN; MALTHA et al., 2011; BOAS NOGUEIRA et al., 2013; YAN et al.,
2015).
À semelhança do que se observa em humanos, em que um conjunto de eventos biológicos estão bem estabelecidos, em modelos animais, a hipóxia gerada pela
compressão do ligamento periodontal da raiz sob movimentação resulta em trombose capilar e apoptose celular, formando as chamadas áreas hialinas da matriz extracelular, que apresentam poucas células. Os eventos vasculares iniciais conduzem, rapidamente, à mobilidade celular para a área afetada, sendo os neutrófilos importantes componentes
que atuam pela liberação de enzimas lisossomais, sinalizando e atraindo novas células para o local. Tais eventos favorecem a ação de diversos mediadores químicos
plasmáticos e celulares (KRISHNAN; DAVIDOVITCH, 2006; FRACALOSSI et al., 2009;
ANDRADE et al., 2012; YUCEL-LINDBERG; BAGE et al., 2013).
Um estudo observou o aumento de prostaglandina E2 em apenas 24 h após a
indução do movimento dentário em gatos (SAITO et al., 1991), o que sugere a
participação desse mediador nos eventos iniciais da inflamação consequente do estresse mecânico, favorecendo a formação de osteoclastos, uma vez que estimula a enzima adenilato-ciclase e a adenosina monofosfato cílica (AMPc) intracelular em
osteoblastos (SUZAWA et al., 1999).
Xie, Kuijpers-Jagtman e Maltha (2011) constataram um aumento da marcação para macrófagos, nos 3º e 5º dias da ativação, de uma mola de níquel-titânio em ratos. Outro estudo, também em ratos, revelou o aumento de IL-8, importante agente
quimiotáxico para neutrófilos em 5 dias de MDI (YANG et al., 2013).
Vandevska-Radunovic et al. (1997) constataram o aumento da marcação de neutrófilos na 24ª hora
e aos 3 dias do início da MDI em ratos, o que foi confirmado na imunohistoquímica para
ortodôntico em animais induz um aumento dos níveis de citocinas pró-inflamatórias advindas da ação de macrófagos e neutrófilos ativados.
Estudos observaram, ainda, o aumento da produção de citocinas como TNF-α
e IL-1β em até 7 dias de MDI em roedores, coincidente com maiores taxas do
deslocamento dentário (SAITO et al., 1991; HAZAN-MOLINA et al., 2013; ALIKHANI et
al., 2015; YAN et al., 2015). Quando do tratamento com o Basiliximab, bloqueador de
linfócitos T, ou com o Etanercepte, anticorpo para TNF-α, houve um decréscimo na
movimentação dentária em camundongos, evidenciando que TNF-α participa ativamente
da remodelação óssea da MDI nesses animais. Além disso, também foi verificado um aumento de IL-6 no 5º dia da instalação da mola, o que possibilita a sugestão da
correlação entre TNF-α, IL-1β e IL-6, citocinas que agem em conjunto na ativação da
reabsorção óssea (YANG et al., 2013; YAN et al., 2015).
Sabe-se que TNF-α, IL-1β e IL-6 induzem diferenciação de osteoclastos pelo
aumento da expressão de mediadores como RANKL e M-CSF (PALMQVIST et al., 2002;
TANABE et al., 2005; YANO et al., 2005). Deveras, a literatura relata a presença de RANKL, de c-fms e de M-CSF em 3 e 10 dias do início da movimentação em roedores, evidenciando que o aumento da expressão desses mediadores é consequência dos níveis aumentados de citocinas pró-inflamatórias, contribuindo, assim para a
osteoclastogênese (KAKU et al., 2008; XIE; KUIJPERS-JAGTMAN; MALTHA et al.,
2008; FRANZEN et al., 2014; ALIKHANI et al., 2015). Estudos mostram, ainda, a
presença de osteoclastos, pelo aumento da marcação para TRAP e Catepsina K em até
10 dias de MDI em roedores (XIE; KUIJPERS-JAGTMAN; MALTHA et al., 2011;
HAZAN-MOLINA et al., 2013; FRANZEN et al., 2014; ALIKHANI et al., 2015; YAN et al., 2015).
Além disso, constatou-se que a interação RANK-RANKL pode ocorrer logo após a
aplicação de força, uma vez que foi relatado o aumento da subunidade p65 do NF-κB,
em 3 e 24 horas de MDI em ratos (ZUO et al., 2007).
Um aumento da expressão do fator de crescimento do endotélio vascular (VEGF) no lado de tração foi relatado em dois estudos em camundongos aos 10 dias de MDI, o que confirma os achados histológicos que relataram um aumento da microcirculação do ligamento periodontal nessa região (SANDSTEDT, 1904;
OPPENHEIN, 1911; SHWARZ,1932; KOHNO et al., 2003; KAKU et al., 2008). Além
disso, mediadores anti-inflamatórios também modulam a reabsorção óssea da MDI,
a neoformação óssea também foi observada durante a MDI em animais (WANG; ZHU;
LIANG, 2000; LOW et al., 2005; BROOKS et al., 2009; KOHARA et al., 2012; HAKAMI et
al., 2015).
O tratamento local diário com 1,5 µg/kg de IL-4 em camundongos submetidos
à MDI por 12 dias reduziu a taxa de movimentação, o que sugere um desequilíbrio na remodelação óssea devido o estímulo da neoformação óssea. Ademais, houve diminuição da marcação para TRAP, mostrando que a IL-4 também interfere na
atividade de osteoclastos (HAKAMI et al., 2015). Da mesma forma, camundongos
tratados localmente com 1,5 µg/20µl de IFN-γ também demonstraram taxas de
movimentação e marcação para TRAP reduzidas no mesmo período (KOHARA et al.,
2012). Ainda, a presença de TGF-β também foi verificada após por Wang, Zhu, Liang
(2000) em ambos os lados, sendo superior no lado de tração em 5 e 10 dias de MDI em ratos. Outros achados também revelam o aumento da marcação para RUNX2 e OPG
aos 1º e 14º dias de MDI em ratos, respectivamente (LOW et al., 2005; BROOKS et al.,
2009).
Quanto às fases da movimentação dentária em humanos, a MDI em animais também segue essa mesma divisão. Observou-se que a fase inicial da MDI em ratos
ocorre a partir da 6ª hora até o 4ª dia. A fase de latência perdura até o 7⁰ dia. A fase de
pós-latência se dá a partir do 8⁰ dia, em que há um aumento gradual das taxas de MDI,
as quais atingem o pico de movimentação no 11⁰ dia (ARAÚJO, 2015). Além de todas
essas semelhanças, a cavidade oral de humanos e murinos também é similar, uma vez que ambas são constituídas por epitélio gengival, sulcular e juncional, fibras colágenas,
cementos celular e acelular e osso alveolar. A principal diferença é que o epitélio gengival do roedor é queratinizado, diferentemente da do humano que não apresenta queratina (LISTGARTEN, 1975).
Acerca da indução da movimentação dentária, a literatura relata a inserção de elásticos entre molares (WALDO; ROTHBLATT, 1954), fixação de molas helicoidais de
fabricação manual (ALTAN et al., 2012), e instalação de molas fechadas de níquel-titânio
A utilização de ratos é vantajosa para o estudo do movimento dentário, pois estes apresentam baixo custo de manutenção, favorecem um número maior da amostra em estudo, além da possibilidade de conservação do dispositivo ortodôntico por período mais prolongado. Adicionalmente, o preparo para análises histológicas é relativamente fácil, e a maioria de anticorpos necessários para as técnicas de biologias molecular e celular estão disponíveis para estes animais (REN; MALTHA; KUJIPERS-JAGTMAN, 2004). Além de ratos, a movimentação dentária também foi induzida em cachorros
(TENG; LIOU, 2014) e gatos (SAITO et al., 1991).
Diante de todas essas observações, considera-se que a movimentação dentária induzida por aparato ortodôntico em ratos agrega uma série de eventos biológicos que levam à remodelação óssea e ao aumento da taxa de movimentação dentária, também observadas clinicamente.
Observa-se, de fato que a movimentação dentária induzida agrega
fenômenos biológicos que culminam em remodelação óssea (WISE; KING, 2008). Nesse contexto, a utilização de fármacos anti-inflamatórios ou antirreabsortivos, como os
bisfosfonatos, podem repercutir negativamente neste processo (KRASNY et al., 2013;
KRISHNAN; PANDIAN; KUMAR, 2015)
2.4 Bisfosfonatos
Os bisfosfonatos (BFs) são análogos não-biodegradáveis do pirofosfato com intensa afinidade por cristais de hidroxiapatita e constituem a principal classe de fármacos utilizados no tratamento de desordens metabólicas ósseas, dentre elas a osteoporose, uma condição caracterizada pelo aumento da taxa de reabsorção óssea (JUNG et al., 1973).
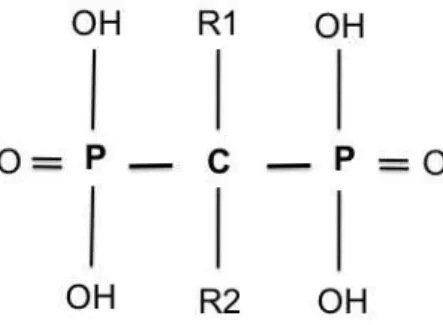
A estabilidade desses fármacos se deve à ligação de um átomo de carbono com dois átomos de fosfato (P−C−P), o que confere ao composto, resistência à
metabolização e hidrólise enzimática por pirofosfatases (ROGERS et al., 1994; FLEISH
et al., 2002). As ligações adicionais do carbono central podem interagir com diversos
grupamentos, dentre eles, destacam-se os átomos de carbono, oxigênio e nitrogênio. Essas cadeias laterais ligadas ao carbono podem ser definidas como ligantes R1 e R2
Figura 6 – Estrutura química dos bisfosfonatos, destacando-se a ligação P-C-P. Os ligantes R1 e R2 podem variar de acordo com cada tipo de fármaco. Baseado em RUSSEL et al., 2008.
Quando uma dessas cadeias laterais é um grupamento hidroxila (-OH) ou
uma amina primária (NH2) ocorre a formação de um complexo tridentado que se liga de
forma mais eficaz ao cálcio, aumentando a afinidade a este mineral (JUNG et al., 1973).
Primariamente, os BFs são pouco absorvidos quando ingeridos por via oral o que se atribui à baixa lipossolubilidade desses fármacos, o que interfere no seu transporte transcelular por entre as barreiras epiteliais. O transporte de BFs ocorre, principalmente, pela circulação sanguínea, após atravessarem as junções entre células do epitélio (BOULENC et al., 1993; LIN et al., 1996). A elevada afinidade pela matriz mineral óssea favorece a rápida depuração plasmática dos BFs (LIN et al., 1996). Os mesmos são metabolicamente estáveis, portanto, são excretados pela urina na sua forma inalterada (LIN et al., 1996).
Esses fármacos são adsorvidos em sítios de intensa remodelação óssea (CHEONG, 2014) onde exercem seu efeito farmacológico (GREEN, 2004), dependente da internalização em osteoclastos. Tal internalização causa inibição da reabsorção óssea por induzir a apoptose dos osteoclastos (FLANAGAM; CHAMBERS, 1990). Além de influenciar a funcionalidade de osteoclastos, os BFs promovem efeitos diretos na
matriz óssea decorrentes da sua interação com os cristais de hidroxiapatita, inibindo a precipitação do fosfato de cálcio plasmático, a agregação e a dissolução desses cristais (FLEISH et al., 1969).
Devido à avidez para se ligar ao osso, os BFs são úteis como agentes
marcadores de metástases ósseas e locais de fraturas (RUSSEL et al., 2008). A partir da
década de 1970, estes fármacos começaram a ser amplamente empregados no tratamento na terapia oncológica, permanecendo até os dias atuais como ferramenta na
prevenção de complicações esqueléticas decorrentes de mieloma múltiplo (JI et al.,
2014) e de metástases ósseas do câncer de mama (SUMI et al., 2014). Também são
metabolismo ósseo e o risco de fraturas óssea e aumentando a densidade mineral
óssea (LIBERMAN et al., 1995; REGINSTER et al., 2000).
Por conta da adsorção dos BFs em superfícies minerais ósseas, o contato com as células osteoclásticas é facilitado. Além disso, a queda do pH característica de áreas de reabsorção óssea facilita a dissociação entre esses fármacos e a hidroxiapatita e, consequentemente, os BFs são fagocitados pelos osteoclastos (SATO et al., 1991). No meio intracelular localizam-se em vesículas endocíticas, as quais devem ser
acidificadas para permitir a saída dos BFs para o citoplasma (THOMPSON et al., 2006) e
exercer seus efeitos que culminam em apoptose dos osteoclastos.
Os BFs se dividem em duas classes farmacológicas. Na primeira, estão aqueles que não contém nitrogênio em sua fórmula molecular, sendo então chamados de bisfosfonatos não-nitrogenados. A segunda classe, agrega os bisfosfonatos mais atuais, os quais apresentam o átomo de nitrogênio em sua composição, sendo
classificados como bisfosfonatos nitrogenados (N-BFs) (GREEN 2004, RUSSEL et al.,
2008) (Figura 7).
Figura 7 – Fórmulas moleculares de um bisfosfonato não-nitrogenado, como exemplo, o Clodronato, e de bisfosfonatos nitrogenados, como o Alendronato de Sódio e Ácido Zoledrônico. Arquivo da autora.
Os BFs não-nitrogenados, como o clodronato, o etidronato e o tiludronato, exercem seu mecanismo de ação mediante a produção de análogos não-hidrolizáveis do ATP (ROGERS et al., 1994). Lehenkari et al. (2002), em um estudo in vitro utilizando mitocôndrias de ratos Sprague-Dawley, observaram que o metabólito
adenosina-5'-beta-gamma-diclorometileno-trifosfato (AppCCl2p), originado pelo clodronato, administrado na
concentração de 5x10-4 M, diminuiu do consumo de oxigênio nessas organelas, por inibir
ensaio in vitro com osteoclastos humanos onde foi constatado que o AppCCl2p provocou
a apoptose de 80% dessas células por induzir a perda do potencial de membrana mitocondrial, caracterizado pela ineficiência em transcolar um átomo de fósforo ao ADP para formar ATP.
Os N-BFs, como o alendronato, o pamidronato, o ibandronato, o risedronato e o ácido zoledrônico interferem na atividade e na sobrevivência de osteoclastos, porém por um mecanismo de ação distinto ao dos BFs não nitrogenados. Seu local de ação corresponde à via do mevalonato, conhecida pela importância da biossíntese de colesterol e outros esteróis (RUSSEL et al., 2008). Os N-BFs interferem na cascata
desta via, bloqueando a atividade da farnesil difosfato sintetase (FPPS) (FISHER et al.,
1999)
Esse bloqueio leva à inibição da formação de isopentenil pirofosfato (IPP) em farnesil pirofosfato (FPP), substrato necessário para a formação de geranil-geranil
pirofosfato (GGPP), via geranil-geranil pirofosfato sintetase (GGPS). Tanto o FPP quanto o GGPP são necessários para a prenilação das GTPases, como Ras, Rab, Rho e Rac,
as quais são fundamentais para a função e sobrevivência de osteoclastos (LUCKMAN et
al., 1998; ROGERS, 2003). Devido ao acúmulo de GTPases não preniladas em
consequência da interferência na sinalização dessas proteínas, o citoesqueleto perde a sua conformação, e o transporte vesicular fica comprometido, resultando na desorganização e achatamento dos prolongamentos celulares. Desta forma, a célula
perde a capacidade reabsortiva óssea, sendo induzida à apoptose (ROELOFS et al.,
2006). Também foi demonstrado que o acúmulo de IPP induzido por N-BFs resulta na sua ligação ao AMPc para formar um análogo ao ATP intracelular, o Apppi (éster do ácido trifosfórico 1-adenosina-5-3-[3-metilbut-3-enil]). Esta molécula induz de forma
direta a apoptose de osteoclastos, semelhante ao AppCC12p (MONKKONEN et al.,
Figura 8 – Mecanismo de ação dos N-BFs. Esses fármacos interferem na via do mevalonato levando à desorganização do citoesqueleto e indução direta e indireta da apoptose de osteoclastos. Baseado em Rogers, 2003; Roelofs et al., 2006; Russel et al., 2008.
Clinicamente, o tratamento com N-BFs é bem tolerado desde que a dosagem correta seja respeitada (OROZCO; MAALOUF, 2012). Contudo, a elevada afinidade pelo osso mineral promove incorporação duradoura à matriz óssea, mesmo após anos do uso cessado (WATTS; DIAB, 2010). O tratamento e a ligação à matriz óssea prolongados
culminam em decréscimo da qualidade óssea, quando comparada a um tecido ósseo fisiológico (ALLEN; BURR, 2008). Por fim, a baixa qualidade óssea é responsável pelo aumento da incidência de fraturas atípicas de fêmur em pacientes sob tratamento da
osteoporose pós-menopausa (DONNELLY et al., 2012) e de metástases ósseas
resultantes do câncer de mama (WON et al., 2014).
O uso de N-BFs por um período prolongado também apresenta repercussões importantes na cavidade oral, em que se destaca a osteonecrose dos maxilares, uma condição restrita ao osso alveolar, caracterizada pela exposição de tecido ósseo decorrente da incapacidade de cicatrização do epitélio após intervenções orais (AMLER;
JOHSON; STAM, 1960; KOHSLA et al., 2007).
A patogênese da osteonecrose dos maxilares induzida por bisfosfonatos (ONMB) possui caráter multifatorial, envolvendo os efeitos ósseos dos BFs como supressão da remodelação óssea, depleção de osteoclastos e redução da angiogênese associadas à invasão tecidual por micro-organismos periodontopatógenos e traumas orais (EID; ATLAS, 2014). Pode-se estabelecer, também, uma relação entre a ocorrência de ONMB e a utilização de N-BFs por via intravenosa, uma vez que esses fármacos têm sua ação potencializada pela maior afinidade à hidroxiapatita (OROZCO; MAALOUF, 2012).
A ocorrência aumentada de osteonecrose nos maxilares se deve à alta taxa de remodelação óssea sofrida pelos ossos da face em comparação aos demais do corpo, o que propicia a rápida adsorção dos N-BFs nessas regiões. Por isso, os efeitos
negativos desse tratamento são vistos, primeiramente, nos maxilares (WALTER et al.,
2014).
A combinação entre a supressão da remodelação óssea e seus efeitos antiangiogênicos com intervenções cirúrgicas dentoalveolares interfere na reconstituição
óssea, promovendo a exposição deste tecido (ESTILO et al.; 2008; ALLEN et al., 2009).
Os sintomas mais comuns incluem dor, edema, parestesia local, supuração e úlceras na
mucosa inserida (OROZCO; MAALOUF, 2012), que se seguem à necrose propriamente dita.
A ONMB pode ser evitada ou pelo menos minimizada com o correto aconselhamento do paciente a solicitar uma avaliação dentária antes do início do
tratamento, realizando as intervenções necessárias (RIZZOLI et al., 2008). O tratamento
inclui o uso de enxaguatórios bucais como o digluconato de clorexidina a 0,12%, terapia