Universidade de Trás-os-Montes e Alto Douro
Estudo da degradação de efluentes agroindustriais através de
reatores do tipo perfeitamente agitado, utilizando UV-LEDs/TiO
2Dissertação de Mestrado em
Biotecnologia e Qualidade Alimentar
Leonor Caldeira Ferreira
Orientadores: Professor Doutor Pedro Bandeira Tavares
Doutor Jorge Rodríguez Chueca
Vila Real, 2016
Discriminação de Vinhos M onovarietais de
acordo com a sua composição fenólica, por
FTI R-ATR e HPLC
!!
Relatório Final de Estágio
Licenciatura em Bioquímica
! ! !
Juliana Milheiro Ferreira! Nº 35302
Universidade de Trás-os-M ontes e Alto Douro
Vila Real, 2012
I
Universidade de Trás-os-Montes e Alto Douro
Estudo da degradação de efluentes agroindustriais através de
reatores do tipo perfeitamente agitado, utilizando UV-LEDs/TiO
2Dissertação de Mestrado em
Biotecnologia e Qualidade Alimentar
Leonor Caldeira Ferreira
Orientadores:
Professor Doutor Pedro Bandeira Tavares
Doutor Jorge Rodríguez Chueca
Composição do Júri:
II
Este trabalho foi expressamente elaborado como
dissertação original para o efeito de obtenção de grau
de Mestre em Biotecnologia e Qualidade Alimentar
III
“As doutrinas apresentadas no presente trabalho são da
exclusiva responsabilidade do autor”
IV
Agradecimentos
Ao Professor Doutor Pedro Tavares e ao Doutor Jorge Chueca, pela oportunidade concedida para a realização deste trabalho, pelos ensinamentos e orientação científica.
Ao Professor Doutor Ramiro Fernandes, pela montagem dos sistemas de iluminação UV-LEDs e por se ter mostrado sempre disponível para ajudar.
Ao Professor Doutor José Peres, ao Professor Doutor Fernando Nunes e ao Doutor Marco Lucas por toda a disponibilidade.
À empresa que tão amavelmente me forneceu o efluente e ainda permitiu a minha ida às instalações e para que pudesse perceber o funcionamento da mesma.
Aos meus pais, por me terem encaminhado e tornado possível a concretização de mais uma etapa, e ainda, pela confiança que depositam em mim.
Ao meu irmão, por todas as alegrias, pelo carinho e pela força que me transmite. Aos meus avós, por todo o carinho e pelo fato de terem estado sempre presentes.
À minha grande amiga Juliana, um enorme obrigada! Tanta paciência, incentivos mas acima de tudo uma amizade indiscutível, tornaram toda uma jornada bem mais fácil e memorável.
À Sandrine, à Sandra e à Mélanie por terem estado sempre presentes e contribuído para que tudo fosse mais fácil.
À Lis por toda a ajuda e carinho!
Agradeço ainda a todos os meus amigos e familiares, que direta ou indiretamente, contribuíram para a realização deste trabalho.
V
Resumo
A indústria agroalimentar produz compostos recalcitrantes ao tratamento biológico, pelo que os tratamentos convencionais, como lamas ativadas, são ineficazes devido à baixa razão
CBO5/CQO.
Os processos de oxidação avançados, nomeadamente a fotocatálise heterogénea assistida
por materiais semicondutores, é uma alternativa ao tratamento deste tipo de efluentes. O TiO2
é o catalisador mais utilizado, visto ser resistente à foto-corrosão, estável, de baixo custo e ter elevada atividade fotocatalítica. Contudo, há dificuldade na sua separação do meio reacional e
só é ativado por luz UV de <380 nm.
No presente trabalho foram construídos dois sistemas de LEDs a emitir a 370 nm e a
365 nm, com potências até 30 W/m2 e 85 W/m2, respetivamente. Estes dispositivos foram
testados num reator construído à escala laboratorial, em ensaios de fotocatálise com TiO2 P25
da Evonik (ex-Degussa), em ensaios descontínuos e em contínuo do tipo reator perfeitamente agitado (RPA).
Numa primeira fase, investigou-se a degradação do corante azo Reactive Black 5 (RB5) e
de um composto fenólico modelo, o ácido p-hidroxibenzóico, C7H6O3. Numa segunda fase,
investigou-se a mineralização de um efluente simulado com base na lavagem da baga de sabugueiro (Sambucus nigra), muito rico em antocianinas, e de um efluente de uma indústria agroalimentar de processamento de baga de sabugueiro. As degradações e mineralizações foram monitorizadas por espetrofotometria UV/Vis, HPLC, CQO e TOC.
Foi testado o efeito de diferentes condições experimentais como a concentração dos
compostos, o pH do meio e a quantidade relativa do TiO2 P25 em solução, mantendo
constantes a potência dos LEDs e a temperatura.
Efetuando ensaios comparativos ([TiO2] = 500 mg/L; [RB5] = 25 mg/L; T= 21º C), em
descontínuo, a remoção total da cor do corante RB5 é três vezes mais rápido utilizando o segundo sistema de LEDs, com cinéticas semelhantes às obtidas sob irradiação solar (AM 1,5).
Relativamente à fotodegradação do C7H6O3, verificou-se que mantendo as condições
[TiO2] = 500 mg/L, P= 85 W/m2, T= 21º C e variando a concentração do ácido, se obtêm
cinéticas de pseudo-primeira ordem, que ajustadas ao modelo de Langmuir-Hinshelwood
VI
de TiO2 verificou-se a presença de dois regimes, com as constantes cinéticas a variar
proporcionalmente à [TiO2] até 100 mgTiO2/L e a depender linearmente para concentrações
superiores.
Para o efluente simulado os ensaios de fotocatálise apenas funcionaram para teores de TOC inicial abaixo de 60 mg C/L. Acima deste valor há a necessidade de recorrer a sistemas
combinados de foto-Fenton ou foto-Fenton/TiO2 para se obterem mineralizações.
Utilizando um sistema combinado foto-Fenton/TiO2, o efluente simulado, com um TOC
inicial de 1860 mg C/L, obteve uma mineralização de 37,1% ao fim de 6 horas. O efluente agroindustrial, com um TOC inicial de 435 mg C/L, obteve uma mineralização de 32,4% ao fim de 6 horas.
Este novo desenho de reatores fotocatalíticos, baseados em UV-LEDs, permite uma flexibilidade nas condições operacionais, sendo uma alternativa à utilização convencional de lâmpadas UV de vapor de mercúrio. O reator pode operar em processo descontínuo ou em contínuo, com acoplamento em série, paralelo ou sistemas série-paralelo de múltiplos reatores.
VII
Abstract
The agri-food industry originates low biodegradability compounds and conventional
treatments, such as activated sludge, are not effective due to the low BOD5/CQO ratio.
The Advanced Oxidation Processes, in particular the heterogeneous photocatalysis assisted
by semiconductor materials, is an alternative. The TiO2 is the most used catalyst due to its
photo-corrosion resistance, high stability, low cost and high catalytic activity. However there is a problem in the separation from the reaction medium and it is only activated by UV light
with <380 nm.
In the current work two LED systems were built emitting at 370 nm and 365 nm with
30 W/m2 and 85 W/m2, respectively. These devices were tested in batch or continuous
(CSTR) photocatalytic experiments, with TiO2 P25 from Evonik, in a reactor built at
laboratorial scale.
In a first stage, it was investigated the decomposition of an azo dye, the Reactive Black 5
(RB5) and a phenolic compound, the p-hidroxybenzoic acid, C7H6O3. In a second stage, it
was investigated the mineralization of a simulated effluent from the wash of elderberry (Sambucus nigra), with high anthocyanins content and an effluent from an elderberry agri-food industry. The decomposition and mineralization were monitorized by UV/Vis spectrophotometry, HPLC, COD and TOC.
The effect of different experimental conditions such as the concentration of compounds,
the pH and the concentration of TiO2 P25, was tested keeping constant the power of the LEDs
and temperature.
Performing comparative studies in batch ([TiO2] = 500 mg/L; [RB5] = 25 mg/L;
T= 21º C), the decolourization of RB5 was three times faster with the second LED system, with kinetics equivalent of solar irradiation (AM 1.5).
In the photodegradation of C7H6O3, keeping constant the conditions [TiO2] = 500 mg/L,
P = 85 W/m2, T= 21º C and changing the acid concentration, pseudo-first order kinetics were
obtained. The results were adjusted to the Langmuir-Hinshelwood model resulting in
kc= 0.885 mg/Lmin and KLH= 0.217 L/mg.
Changing the TiO2 concentration, two kinetic regimes were detected, the first with a
VIII
In the simulated effluent the photocatalytic experiments were only successful with TOC content below 60 mg C/L. Above that value there is a need to use combined systems such as
photo-Fenton or photo-Fenton/TiO2 to obtain mineralization.
Using the combined photo-Fenton/TiO2 system, the simulated effluent, with an initial TOC
of 1860 mg C/L, presented a mineralization of 37.1% in 6 hours. The agri-food industry effluent, with an initial TOC of 435 g C/L, presented a mineralization of 32.4% in 6 hours.
This new design of photocatalytic reactors, based on UV-LEDs, allows flexibility in the operation conditions, being an alternative to the conventional utilization of mercury vapour lamps. The reactor can operate in batch or in continuous mode, with serial, parallel or serial-parallel scheme.
IX
Índice
Agradecimentos IV
Resumo V
Abstract VII
Índice de Figuras XII
Índice de Tabelas XVI
Índice de Abreviaturas XVII
1. Introdução 1
1.1. Setor agroalimentar 1
1.1.1. Diretrizes no setor agroalimentar 1
1.1.2. Água na indústria agroalimentar 3
1.1.3. Compostos fenólicos 7
1.1.4. Empresa agroindustrial 11
1.2. Processos de tratamento de águas residuais 14
1.3. Processos de Oxidação Avançados 15
1.3.1. Fotocatálise heterogénea 17
1.3.1.1. Materiais semicondutores para fotocatálise 20
1.3.1.2. Dióxido de Titânio 23
1.3.2. Fenton e foto-Fenton 25
1.4. Fontes de radiação ultravioleta 27
1.5. Objetivos 29 2. Material e Métodos 30 2.1. Reagentes utilizados 30 2.2. Amostras 30 2.2.1. Reactive Black 5 31 2.2.2. Ácido p-hidroxibenzóico 32 2.2.3. Efluente simulado 32 2.2.4. Efluente agroindustrial 33 2.3. Reator construído 34
X
2.4. Sistema de radiação UV-A LEDs 35
2.4.1. Primeiro sistema de iluminação UV-LEDs 36
2.4.2. Segundo sistema de iluminação UV-LEDs 37
2.5. Procedimento experimental 38
2.6. Metodologias analíticas 40
2.6.1. Difração de Raio-X 40
2.6.2. Microscopia Eletrónica de Transmissão 40
2.6.3. Espetrofotometria de UV-Vis 40
2.6.4. Cromatografia Líquida de Alta Eficiência 40
2.6.5. Carbono Orgânico Total 42
2.6.6. Carência Bioquímica de Oxigénio 42
2.6.7. Carência Química de Oxigénio 43
2.6.8. Polifenóis Totais 44
2.6.9. Sólidos Suspensos Totais 44
2.6.10. Condutividade 44
2.6.11. Turbidez 44
2.6.12. Potencial redox e pH 45
2.6.13. Análise de iões 45
3. Resultados e Discussão 46
3.1. Caraterização dos materiais 46
3.1.1. Análise do dióxido de titânio P25 46
3.1.2. Análise do efluente simulado 47
3.1.3. Análise do efluente agroindustrial 49
3.2. Comparação dos sistemas UV-A LEDs 50
3.3. Ensaios de fotocatálise com o ácido p-hidroxibenzóico 53
3.3.1. Efeito da concentração do ácido p-hidroxibenzóico 53
3.3.2. Efeito do pH das soluções do ácido p-hidroxibenzóico 59
3.3.3. Efeito da quantidade relativa do TiO2 P25 na solução 60
3.3.4. Ensaios em contínuo 62
XI
3.4.1. Combinações com H2O2, Fenton e foto-Fenton 66
3.5. Ensaios com o efluente agroindustrial 69
4. Conclusão 71
5. Referências Bibliográficas 76
XII
Índice de Figuras
Figura 1.1 – Ácido p-hidroxibenzóico (34). 9
Figura 1.2 – Estrutura base das antocianinas. R1, R3 e R7= H ou OH; R2 e R5=
H, OH ou OMe; R4 e R6= OH ou OMe (47).
9
Figura 1.3 – Estruturas de antocianinas em função do pH do meio (47). 10
Figura 1.4 – Sabugueiro, espécie Sambucus nigra: a) Em flor; b) Com fruto. 11
Figura 1.5 – Esquema simplificado do processo de tratamento de águas
residuais da empresa. RSS – Removedor de Sólidos Suspensos; TH – Tanque de Homogeneização; SBR – Sequenching Batch Reactor; POA – Processo de Oxidação Avançado.
13
Figura 1.6 – Representação do mecanismo de fotocatálise (62). 18
Figura 1.7 – Posicionamento do hiato de bandas de alguns semicondutores
quando em contato com um eletrólito aquoso a pH=1 (62).
22
Figura 1.8 – Estrutura cristalina: a) Anatase; b) Rutilo; c) Broquite (88). 24
Figura 1.9 – Esquema da degradação de poluentes orgânicos por fotocatálise
heterogénea assistida por TiO2 (64).
25
Figura 1.10 – Reator CPC da Plataforma Solar de Almería (103). 27
Figura 1.11 – Espetro de emissão de uma lâmpada de vapor de mercúrio de
baixa pressão (Heraeus Noblelight).
28
Figura 2.1 – Espetro de absorção do RB5 para uma concentração de 50 mg/L. 31
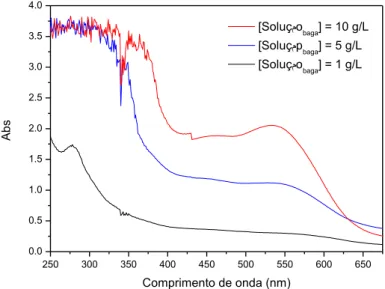
Figura 2.2 – Solução extraída da baga, 10 g/L. 32
Figura 2.3 – Espetros de absorção da solução de baga em diferentes
concentrações.
33
Figura 2.4 – Efluente agroindustrial. 33
Figura 2.5 – Reator à escala laboratorial construído. 35
Figura 2.6 – LEDs: a) Eficiência do LED em função do comprimento de onda;
b) Preço por mW de cada LED em função do comprimento (Roithner: lista de preços de 12/11/2014).
35
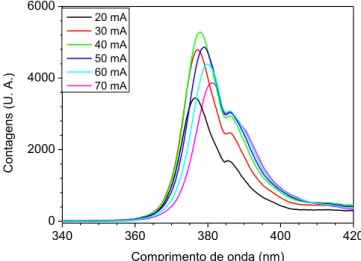
Figura 2.7 – Espetro de emissão de um UV-LED em função da corrente, com
um máximo a 370 nm.
36
XIII
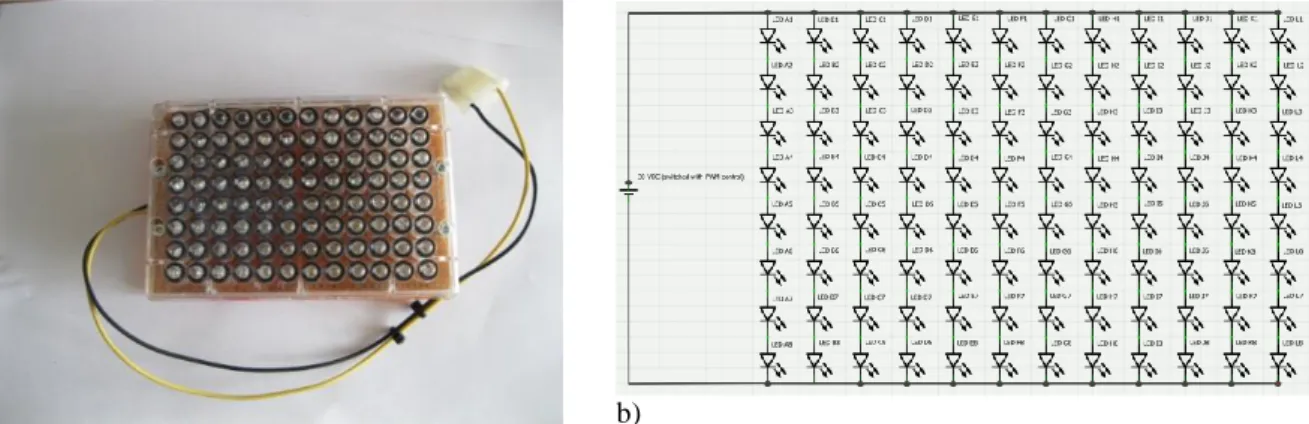
foto da montagem efetuada; b) diagrama esquemático das ligações.
Figura 2.9 – Foto da montagem efetuada do segundo sistema de UV-LEDs. 37
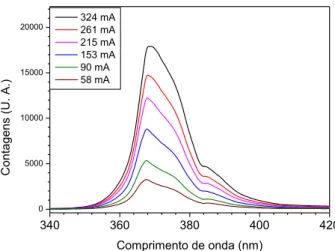
Figura 2.10 – Espetro de emissão de um UV-LED em função da corrente, com
um máximo a 365 nm.
38
Figura 2.11 – Reator contínuo perfeitamente agitado (RPA) construído com o
primeiro sistema de UV-LEDs.
39
Figura 2.12 – Reator construído com o segundo sistema de UV-LEDs, em
descontínuo.
39
Figura 2.13 – Cromatograma do ácido p-hidroxibenzóico numa concentração
de 50 mg/L.
41
Figura 3.1 - Análise por Refinamento de Rietveld do TiO2 P25. 46
Figura 3.2 – Análise do semicondutor TiO2 P25 por TEM. A) Imagem de
TEM; b) Distribuição de tamanho das partículas.
47
Figura 3.3 – Cromatograma por HPLC de Sambucus nigra: a) efluente
simulado pela solução de lavagem da baga utilizada para os ensaios; b) solução obtida pela extração das antocianinas.
48
Figura 3.4 – Espetro de absorção do TiO2 P25 e de emissão dos UV-LEDs. 50
Figura 3.5 – Calibração da quantidade de radiação produzida pelos dois
sistemas UV-LEDs, em comparação com a radiação UV solar em condições AM1,5.
51
Figura 3.6 – Comparação dos dois sistemas de UV-LEDs e com radiação solar
na descoloração do RB5 com TiO2 P25 (análise a 595 nm): a) ensaio em
descontínuo; b) ensaio em contínuo.
52
Figura 3.7 – Efeito de diferentes concentrações do ácido p-hidroxibenzóico,
mediante condições de reação semelhantes, análise por HPLC: a) resultados experimentais; b) ajuste a um modelo cinético de pseudo-primeira ordem; c) tempos de meia vida em função da concentração do ácido p-hidroxibenzóico; d) ajuste ao modelo de Langmuir-Hinshelwood.
54
Figura 3.8 – Medição da CQO em soluções de ácido p-hidroxibenzóico: a)
Valores da CQO iniciais; b) evolução da CQO ao longo do ensaio de fotocatálise, com diferentes concentrações do ácido p-hidroxibenzóico iniciais, nas mesmas condições de reação.
55
XIV
mediante condições de reação semelhantes, análise por TOC.
Figura 3.10 – Comparação do sistema UV-LEDs com o solar, em condições
semelhantes, análise por HPLC.
57
Figura 3.11 – Sobreposição de cromatogramas HPLC ao longo da degradação
do ácido p-hidroxibenzóico: a) cromatogramas completos; b) ampliação para verificação dos subprodutos da degradação.
58
Figura 3.12 – Cromatograma HPLC de uma solução do ácido
2,4-dihidroxibenzóico (β-resorcílico) numa concentração de 50 mg/L.
58
Figura 3.13 – Efeito de diferentes valores de pH da solução na degradação do
ácido p-hidroxibenzóico: a) Co= 50 mg/L; b) Co= 75 mg/L.
59
Figura 3.14 – Efeito de diferentes concentrações do TiO2 P25, mediante
condições de reação semelhantes: a) resultados experimentais; b) ajuste a um modelo cinético de pseudo-primeira ordem; c) constantes de velocidade em
função da quantidade relativa de TiO2 na solução.
61
Figura 3.15 – Efeito de diferentes caudais na degradação do ácido
p-hidroxibenzóico em condições constantes: a) [C7H6O3]o= 50 mg/L; b)
[C7H6O3]o= 75 mg/L.
62
Figura 3.16 – Constantes cinéticas observadas para os ensaios com diferentes
caudais: a) tabela de valores; b) constantes cinéticas observadas em função dos caudais.
63
Figura 3.17 – Medidas de TOC ao efluente simulado: a) Teor de TOC em
função da diluição do efluente; b) evolução do TOC em ensaios de fotocatálise do efluente simulado, com diferentes diluições.
64
Figura 3.18 – Efeito de diferentes concentrações de TiO2 P25, na
mineralização da solução de lavagem da baga.
65
Figura 3.19 – Efeito de diferentes valores de pH na mineralização do efluente
simulado 0,3125 mg/L.
65
Figura 3.20 – Análise do comportamento da mineralização quando exposta a
uma quantidade de 0,011% de H2O2.
66
Figura 3.21 – Evolução do TOC nas reações do líquido de lavagem (10g/L)
com H2O2, FeSO4·7H2O, Fenton, foto-Fenton e foto-Fenton com TiO2 P25: a)
resultados obtidos; b) determinação das constantes cinéticas de pseudo-primeira
XV
ordem.
Figura 3.22 – Evolução da solução de lavagem (10 g/L) ao longo do tempo de
reação com reagente de Fenton.
68
Figura 3.23 – Efeito de reacções com H2O2, FeSO4·7H2O, Fenton, Foto-Fenton
e foto-Fenton com TiO2 P25, no efluente agroindustrial, avaliação por TOC.
XVI
Índice de Tabelas
Tabela 2.1 – Volume de amostra dependendo do CBO5 com o respetivo fator
de conversão (fabricante).
43
Tabela 2.2 – Metodologias utilizadas para as análises dos iões (110). 45
Tabela 3.1 – Parâmetros de rede obtidos e da literatura. 46
Tabela 3.2 – Parâmetros medidos no efluente agroindustrial e valores máximos
permitidos por lei para a sua descarga nas águas ou solos e para coletores municipais (nd: não definido).
XVII
Índice de Abreviaturas
HACCP: Análise de Perigos e Pontos Críticos de Controlo CQO: Carência Química de Oxigénio
CBO5: Carência Bioquímica de Oxigénio
HPLC: Cromatografia Líquida de Alta Eficiência TOC: Carbono Orgânico Total
XRD: Difração de Raio-X BET: Brunauer-Emmett-Teller
TEM: Microscópio Eletrónico de Transmissão PT: Polifenóis Totais
SST: Sólidos Suspensos Totais
POA: Processo de Oxidação Avançado BV: Banda de Valência BC: Banda de Condução SC: Semicondutor e-: eletrão h+: lacuna UV: Ultravioleta Vis: Visível
CPC: Coletores solares parabólicos concentradores RB5: Reactive Black 5
LED: Light-Emitting Diode
CSTR: Continuous Stirring Tank Reactor RPA: Reator Perfeitamente Agitado
1
1. Introdução
1.1. Setor Agroalimentar
As indústrias na área alimentar representam cerca de 16% do total de toda a indústria portuguesa (1). Somente após a criação de um mercado único em 1993, é que houve a necessidade de se uniformizar todas as regras de manuseamento e fabrico, nas quais foram também englobadas as regras relativamente à higiene, aditivos e rotulagem.
Segundo as estatísticas estruturais das empresas, as agroindústrias são a segunda maior indústria, posicionando-se logo depois da indústria metalúrgica (2).
Em Portugal, as agroindústrias são o maior setor a nível industrial, com taxas de empregabilidade das mais elevadas, sendo também indispensável para o setor primário, pelo que é um forte impulsionador para a economia nacional (3).
As agroindústrias envolvem todo o processamento e empacotamento do produto (2). Caraterizam-se por cadeias de produção longas, com início na produção das matérias-primas, seguido de diversas transformações do produto e acondicionamento industrial, tendo como última etapa a venda ao consumidor final.
1.1.1. Diretrizes legais no setor agroalimentar
Os consumidores são cada vez mais exigentes para com o produto que lhes é apresentado e é de extrema importância que sejam mantidos padrões elevados de qualidade e segurança alimentar (4). De forma a manter ou mesmo a melhorar os requisitos, não somente relativos à produção mas também à conservação, têm sido criadas diretrizes cada vez mais rigorosas (5).
O Codex Alimentarius, tal como o nome indica, é o Código dos Alimentos e consiste num conjunto de normas alimentares internacionais aprovadas e apresentadas de forma uniforme. Este abrange práticas e diretrizes com vista a atingir os objetivos, garantindo assim que “ (…) proteger a saúde dos consumidores e assegurar práticas justas relativamente ao comércio de alimentos” seja o mais importante, desde a produção primária até ao consumidor final (6).
Ainda segundo o Codex Alimentarius, “Todas as pessoas têm o direito de esperar que todos os alimentos que consomem sejam inócuos e aptos para consumo”, prevenindo assim qualquer transmissão de doenças, que na pior das hipóteses pode mesmo chegar a tornar-se
2
fatal. Pelos Princípios Gerais deste Código segue-se uma linha diretora para assegurar a higiene dos alimentos, sendo recomendado sempre que possível a base desta higienização num sistema de Análise de Perigos e Pontos Críticos de Controlo (HACCP) (6).
No entanto, anteriormente à aplicação do sistema de HACCP é necessário que os pré-requisitos estejam bem estabelecidos. Nestes pré-requisitos englobam-se: as Boas Práticas de Higiene; a formação total de todos os funcionários; as instalações e equipamentos estarem de acordo com os princípios do desenho sanitário; o controlo dos fornecedores, assegurando o programa de Boas Práticas de Fabrico e de segurança alimentar; as especificações devem estar descritas em todos os ingredientes, produtos e embalagens; o controlo de pestes e controlo químico; a receção, o armazenamento e a expedição estarem sempre sob condições sanitárias; e a rastreabilidade e a retirada, pelo que todos os produtos devem ser facilmente identificados por lotes (7).
O sistema de HACCP baseia-se em fundamentos científicos e permite identificar, avaliar e controlar os perigos significativos para a segurança dos alimentos. Portanto, é um sistema de caráter preventivo e para que este funcione eficazmente é necessário que haja envolvimento de todos os intervenientes nas empresas.
O HACCP é composto por 7 princípios de maneira a que a sua aplicação seja objetiva. Primeiramente é necessário realizar uma recolha e análise de informação acerca dos perigos e das condições em que são originados e em seguida, como já se tem noção do que pode acontecer, têm de se determinar os pontos críticos de controlo, ou seja, têm de se aplicar controlos em determinadas etapas para que se previna, elimine ou se reduza o perigo para níveis aceitáveis. No terceiro princípio estabelecem-se os limites críticos, que vão determinar a aceitabilidade ou não de um processo numa determinada fase e em seguida, define-se um sistema planificado de medições de parâmetros de controlo para avaliar se cada ponto crítico de controlo está efetivamente sob controlo. Caso o ponto 4 não se verifique, é necessário tomar as medidas corretivas, pelo que estas já devem estar definidas para cada um dos pontos. Como passo seguinte, aplicam-se métodos para confirmar que todo o sistema HACCP funciona com eficácia. Por fim, documentam-se todos os procedimentos e registos apropriados (6). Assim, seguindo todas as etapas conscienciosamente, o consumidor terá um produto seguro para consumo.
A ISO 22000:2005 define os requisitos para um sistema de gestão de segurança alimentar, pelo que engloba os requisitos necessários para qualquer organização que opere na cadeia alimentar: “Destina-se particularmente à aplicação por parte das organizações que procuram
3
um sistema de gestão da segurança alimentar mais focado, coerente e integrado do que geralmente é requerido pela legislação” (8). Os elementos chave que asseguram esta segurança são: a comunicação interativa tanto da cadeia alimentar como do cliente/fornecedor e ainda da comunicação interna; a gestão do sistema segundo a ISO 9001:2000; os programas pré-requisitos e os princípios do HACCP, ambos descritos no Codex Alimentarius (6, 9). É portanto um referencial certificável especificamente para a qualidade. A ISO 9001:2000 define os requisitos para os sistemas de gestão de qualidade com o objetivo de ir ao encontro dos requisitos do cliente, pelo que a ISO 22000 foi alinhada por esta (9).
Neste seguimento, temos ainda a família das ISO 14000, que estão direcionadas para as organizações preocupadas com os efeitos que vão ter no ambiente e que querem contribuir de forma positiva para o ambiente. Assim, o comité (ISO/TC 207) que desenvolve estas ISO baseia-se na ideia de que se as práticas de gestão forem melhoradas, haverá uma melhoria contínua no desempenho ambiental das organizações.
A ISO 14004:2004 refere os sistemas de gestão ambiental, definindo linhas de orientação gerais sobre princípios, sistemas e técnicas de apoio. Esta norma orienta a minimização dos impactos ambientais das atividades, produtos e serviços, dando diretrizes relativamente aos estabelecimentos, implementação, manutenção e melhoria de um sistema de gestão ambiental e ainda a sua coordenação com os outros sistemas de gestão. Segundo esta norma, “Um sistema de gestão ambiental eficaz contribui para que uma organização evite, reduza ou controle os impactes ambientais negativos das suas atividades, produtos e serviços, obtenha a conformidade com as exigências legais aplicáveis e com os requisitos que a organização subscreva, e auxilia na melhoria contínua do desempenho ambiental” (10).
De entre muitas legislações que contribuem para a melhoria e uniformidade de todos os setores, estas encontram-se sempre aplicadas ao setor agroalimentar e a sua boa implementação é um passo fulcral para este setor funcionar em pleno.
1.1.2. A água na indústria agroalimentar
O contínuo aumento da população tem um efeito não só local mas também global no meio ambiente. No relatório de 1987 “O Nosso Futuro Comum”, uma comissão das Nações Unidas, a World Commission on Environment and Development, define desenvolvimento sustentável como: “(…) desenvolvimento que satisfaz as necessidades do presente, sem comprometer a capacidade das gerações vindouras satisfazerem as suas próprias necessidades”. Assim, para
4
um desenvolvimento sustentável há necessidade de se pensar não só a nível ambiental mas também a nível económico e social (11).
Uma das grandes preocupações globais na qual tem sido depositada muita atenção é a poluição ambiental, pelo que a falta de fontes de energia naturais e limpas compromete a sua resolução (12). O Decreto-Lei nº 173/2008, de 26 de Agosto, relativo à prevenção e controlo integrados da poluição define poluição como “a introdução direta ou indireta, em resultado de ação humana, de substâncias, vibrações, calor ou ruído no ar, na água ou no solo, suscetíveis de: i) prejudicar a saúde humana ou a qualidade do ambiente; ii) causar deteriorações dos bens materiais; ou iii) causar entraves, comprometer ou prejudicar o uso e fruição e outros usos legítimos do ambiente” (13). Desta forma, e como os problemas ambientais não conhecem fronteiras nacionais, há necessidade de se pensar no planeta Terra como um todo e tentar solucionar as problemáticas de maneira a assegurar a preservação de todos os recursos naturais.
Em Portugal de forma a visar as necessidades ecológicas e a consciencialização das mesmas, foi publicada a 7 de Abril, a Lei nº 11/87, Lei das Bases do Ambiente. Esta foi atualizada a 14 de Abril de 2014, pela Lei nº 19/2014, que define as bases de política do ambiente. No artigo 2º, alínea 1 é expresso que “A política de ambiente visa a efetivação dos direitos ambientais através da promoção do desenvolvimento sustentável, suportada na gestão adequada do ambiente, em particular dos ecossistemas e dos recursos naturais, contribuindo para o desenvolvimento de uma sociedade de baixo carbono e uma «economia verde», racional e eficiente na utilização dos recursos naturais, que assegure o bem-estar e a melhoria progressiva da qualidade de vida dos cidadãos” (14).
Uma das questões ambientais mais pertinentes e com um número bastante elevado de legislativas já implementadas, contínua a ser a água. Tanto a nível ambiental, como a nível social e económico, este recurso natural é considerado uma das soluções para inúmeros problemas, tais como, pobreza, saúde pública e segurança alimentar (15).
A água é um constituinte presente em todos os seres vivos e é portanto, um bem indispensável à nossa subsistência, por isso, é extremamente vital que continue a permanecer na sua forma mais pura de maneira a que a sua qualidade não seja comprometida (16-17). O próprio ser humano é constituído por dois terços de água, pelo que a falta desta impossibilita a nossa subsistência (18). A superfície da Terra é constituída por cerca de 70% de água, mas desta apenas 2,5% é potencialmente utilizável como “água fresca”. Porém, menos de metade dessa quantidade é que pode ser efetivamente utilizada (19).
5
A água é cada vez mais frequente nas atividades humanas e a sua utilização está dividida em vários grupos, com 14% destinado ao uso urbano, 30% à agricultura, 10% à indústria, 32% para sistemas de refrigeração na geração de energia e 14% de usos indefinidos (20).
O grande pico de consumo de água teve origem com a industrialização, o que levou a um aumento da população e consequentemente a um incremento drástico no consumo. Este consumo desmedido fez com que a reposição de água necessária às populações viesse a verificar-se insuficiente em certas regiões (21). Com uma quantidade de água insuficiente e indústrias a necessitar de milhares de litros de água e a produzirem, por vezes, efluentes contaminados, a água não deveria ser devolvida ao meio sem um tratamento adequado. Na sociedade atual, a partir das nossas casas, com a utilização de detergentes ou mesmo com o uso de pesticidas ou fertilizantes para os nossos jardins, geramos efluentes com compostos químicos muito nocivos para o ambiente. Este tipo de compostos não podem ser novamente lançados nos cursos de água, pelo que a eliminação dos mesmos se foi tornando um assunto cada vez mais preocupante (22).
As indústrias têm vários aspetos de poupança em vista, no que se refere às diversas matérias-primas, à mão-de-obra e mesmo no processo de fabrico. Porém, no que concerne à utilização e descarga da água, este assunto nem sempre é uma preocupação, o que se vai refletir num uso desnecessário deste recurso (23). Como a água ainda tem um custo reduzido e pode ser obtida facilmente na maior parte dos países industrializados, a possibilidade de haver eventuais limitações ao seu uso ainda é uma hipótese remota para a maior parte das indústrias (24).
Em países com menores recursos aquíferos e numa tentativa de melhorar o planeta, minimizando os custos globais, o sector industrial do Japão, por exemplo, recicla cerca de 80% da água utilizada (17).
As indústrias usam água nos mais diversos processos, desde a limpeza e desinfeção dos equipamentos e dos funcionários que intervêm no processamento, como matéria-prima e meio de transporte, em sistemas de refrigeração ou em esgotos sanitários (21). Desta forma, e tendo ainda em consideração que dependendo das aplicações que cada tipo de indústria tem, são gerados efluentes mais ou menos contaminados, é impreterível que se efetue o tratamento adequado antes de se devolver estes efluentes ao meio ambiente. As águas provenientes destas indústrias têm também caraterísticas biológicas, estando, por vezes, contaminadas com organismos patogénicos. Caso se verifiquem, os agentes patogénicos vão comprometer a decomposição da matéria orgânica e posteriormente afetar a natureza. Portanto, o seu controlo
6
é essencial, tanto no controlo de doenças para os seres humanos, como para o mundo animal e vegetal (25). Deste modo, os resíduos gerados por este setor estão a comprometer a qualidade e a preservação deste recurso hídrico (26).
Reforçando mais uma vez a ideia de que é extremamente necessário manter o nosso planeta mais limpo, a procura de tecnologias “amigas do ambiente”, passa maioritariamente por dois grandes grupos: i) a degradação e eventual mineralização de poluentes e ii) pela produção ou utilização de energia de uma forma sustentável (27).
As indústrias agroalimentares dependem de um elevado consumo de água de grande qualidade. Nestas indústrias a água tem dois grandes destinos, o seu uso como componente do produto final (exemplo de cervejas ou sumos) ou então na forma de efluentes industriais (exemplo de águas de lavagem). Nas indústrias agroalimentares são muito comuns as que funcionam sazonalmente, apenas no tempo de campanha (exemplo a indústria vitivinícola), verificando-se a produção de poucos efluentes no resto do ano. A quantidade de água utilizada por setor e em cada operação efetuada não tem qualquer tipo de limitação, pois acima da preservação de água está a qualidade do produto e a sua higiene durante todo o processo. Esta deverá estar sempre de acordo com as normas da qualidade da água para o consumo humano, descritas no Decreto-Lei nº 306/2007, de 27 de Agosto, tentando minimizar-se ao máximo as possíveis contaminações dos géneros alimentícios (28-30).
Os resíduos alimentares são essencialmente resíduos orgânicos derivados do processamento dos produtos em bruto, produzindo assim resíduos sólidos e líquidos (31). A formação de efluentes pode advir de limpezas, contendo assim desinfetantes e agentes de limpeza tanto orgânicos como inorgânicos, que podem ainda ser originários do meio de transporte e mesmo dos aparelhos utilizados (30-31). Estas águas residuais são uma grande preocupação devido ao fato de terem valores elevados de matéria orgânica, traduzidos numa carência química de oxigénio (CQO) e carência bioquímica de oxigénio (CBO) com quantidades elevadas, parâmetros que quando comparados com os efluentes domésticos podem atingir valores 10 a 100 vezes superiores (29-30). A CQO é a quantidade de oxigénio (em mg/L) necessária para oxidar tanto a matéria orgânica como os compostos inorgânicos
oxidáveis. A CBO5 define-se pela quantidade de oxigénio que é consumido pelos processos
biológicos ao quebrarem a matéria orgânica em cinco dias, isto é, a taxa a partir da qual os microrganismos utilizam o oxigénio do efluente ao mesmo tempo que estabilizam a matéria orgânica decomposta, sob condições de aerobiose (32). Em certas áreas há ainda a presença de sólidos suspensos e gorduras, o que torna ainda mais difícil o seu tratamento. Setores de
7
produção de óleos ou de processamento de peixe produzem efluentes com elevados teores de gorduras, óleos e ceras (30). Estes efluentes com elevada carga vão posteriormente para as estações de tratamento de águas residuais municipais, na qual se procede a novo tratamento, pelo que será uma mais-valia a sua remoção prévia (29).
Na realidade, a grande maioria das pequenas empresas agroindustriais apenas trata os efluentes para que eles cumpram os valores exigidos pela legislação que define os valores para lançamento em sistemas municipais de tratamento, beneficiando do efeito de diluição que ocorre. Muito mais difícil seria efetuar o tratamento dos efluentes agroindustriais, de forma a cumprir a legislação de lançamento no ambiente, nomeadamente em ribeiras e rios.
1.1.3. Compostos fenólicos
Os efluentes provenientes da indústria ou mesmo das atividades domésticas são bastante ricos em compostos fenólicos. As indústrias agroalimentares são das que produzem maiores quantidades de compostos fenólicos, visto necessitarem de processar os produtos. Compostos
como ácido p-hidroxibenzóico (C6H4(OH)COOH), ácido gálico (C6H2(OH)3COOH), ácido
tânico (C76H52O46) e tirosol (C6H4(OH)(CH2)2OH) são bastante comuns (33-35).
Um composto fenólico pertence a uma classe de compostos que englobam estruturas em que se verifica no mínimo a presença de um anel aromático, no qual há pelo menos uma substituição de um hidrogénio por um grupo hidroxilo. Outros grupos funcionais, como por exemplo ésteres ou glicosídeos, podem ainda substituir os carbonos do anel aromático, sendo classificados em concordância com a sua estrutura principal e com a cadeia do substituinte: C6, correspondente ao anel de benzeno; Cx, com x dependente das substituições que ocorreram (36).
É possível encontrá-los na natureza em plantas, geralmente sob a forma de metabolitos secundários, produtos derivados do metabolismo das mesmas (por exemplo os esteróis). Na sua natureza química são bastante heterogéneos, sendo que podem possuir estruturas simples ou conjugadas. Os açúcares naturais e as proteínas costumam ser parte integrante das estruturas destes compostos. Os compostos fenólicos são constituídos por uma variedade de estruturas orgânicas, pelo que houve necessidade de classificá-los, sendo divididos em 12 grupos (36-37).
De todos os polifenóis conhecidos destacam-se os ácidos fenólicos, os flavonóides, os taninos, as cumarinas, os tocoferóis, as ligninas e os fenóis simples. No entanto, quando nos
8
referimos aos antioxidantes mais comummente encontrados na natureza, temos os flavonóides, os ácidos fenólicos, os taninos e os tocoferóis (38).
Como os compostos fenólicos apresentam estruturas químicas estáveis, quando são encontrados em altas concentrações, nos efluentes, não é possível degradá-los pelos métodos de tratamento biológicos convencionais, sendo necessário recorrer a processos de tratamento alternativos (35).
Os ácidos fenólicos são constituídos por um anel de benzeno, um grupo carboxílico e pelo menos um grupo hidroxilo e/ou metoxilo. Esta estrutura faz com que as moléculas sejam detentoras de propriedades antioxidantes no organismo e também nos alimentos (37). Estes subdividem-se em dois grupos, os polifenóis derivados do ácido hidroxibenzóico, tendo a estrutura C6-C1, como por exemplo o ácido gálico, o ácido p-hidroxibenzóico e o ácido vanílico, e os derivados do ácido hidroxicinâmico, com estrutura C6-C3, como são exemplos o ácido cafeico e o ácido ferúlico. Estes são capazes de aumentar a vida útil de diversos produtos entre 15 a 200% (37-38).
O ácido p-hidroxibenzóico (figura 1.1) apresenta estrutura em C6-C1, tem a fórmula
molecular C6H4(OH)COOH e o peso molecular de 138,1 g/mol, podendo também ser
designado de ácido 4-hidroxibenzóico. É um composto conhecido desde 1924, devido às investigações de Sabalitschka, no seu uso como agente antifúngico e antimicrobiano (39). A indústria alimentar utiliza este composto como forma de evitar a oxidação lipídica, funcionando portanto como uma ratoeira de radicais livres. No entanto a utilização deste e de outros compostos têm sido questionadas devido aos efeitos tóxicos que estavam a provocar. Desta forma, investiga-se para se tentar diminuir as concentrações utilizadas na indústria alimentar (33-34, 37). É frequentemente encontrado nos efluentes de largares de azeite, funcionando como um intermediário para outros compostos fenólicos. O ácido
p-hidroxibenzóico, tal como os outros compostos fenólicos, é bastante tóxico e refratário ao
tratamento biológico (40-41). Este composto está presente nas frutas frescas, nomeadamente nas framboesas, em percentagens superiores a outros compostos fenólicos. No entanto, está também presente em uvas ou em sumos de maças (36).
9 OH
OH O
Figura 1.1 – Ácido p-hidroxibenzóico (34).
Os flavonoides são compostos provenientes de metabolitos secundários a partir do reino vegetal. são constituídos por dois anéis aromáticos (A e B), unidos por um anel heterocíclico (C) formado por 3 carbonos e têm uma estrutura em C6-C3-C6. O anel A é originário do ciclo do acetato/malonato e o anel B é proveniente da fenilalanina, sendo que as substituições que ocorrem no anel C é que vão determinar o grupo de flavonóides. As substituições nos anéis A e B vão diferenciar compostos dentro do mesmo grupo, podendo ocorrer substituições de oxigenação, glicosilação ou acilação (38). Os flavonóides podem subdividir-se portanto em antocianidinas, flavanonas, flavanóis, flavonas, flavonóis e isoflavonas (36-38, 42).
As antocianinas (figura 1.2) pertencem ao grupo dos flavonóides, mais concretamente das antocianidinas, mas são as únicas que formam o catião flavílio e são também o grupo mais importante de pigmentos solúveis em água da planta (43). A natureza tem cerca de dezassete antocianidinas, mas apenas seis desempenham importantes papéis na dieta humana, a cianidina, a delfinidina, a peonidina, a petunidina, a pelagornina e a malvidina (44). Estes são compostos bioativos e são frequentemente ingeridos como alimentos, visto serem também alternativas aos corantes sintéticos (45-46).
O
+R
4R
3R
2R
1R
5R
6R
7 A B CFigura 1.2 – Estrutura base das antocianinas. R1, R3 e R7= H ou OH; R2 e R5= H, OH ou OMe; R4 e R6= OH
10
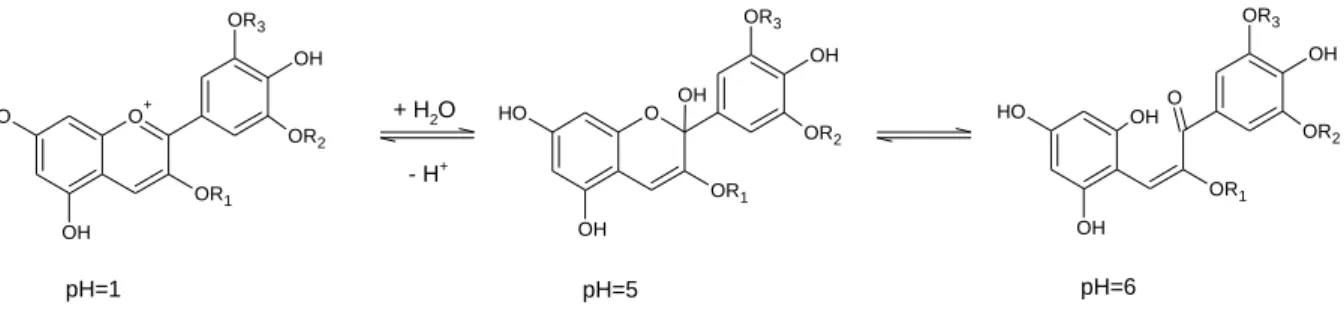
Estes compostos conferem pigmentação laranja, vermelha, azul e roxa às plantas, frutos e vegetais e considera-se que protegem estas espécies de radiação UV, do stresse provocado pelo frio e aumentam a capacidade de resistência. Dependendo do pH em que estão inseridas, exibem diferentes cores, desde o vermelho a pH ácido, até amarelo a pH alcalino, podendo passar por tonalidades azuladas a pH neutro. A coloração e a sua intensidade são dependentes do número de grupos hidroxilo e metoxilo existentes na antocianina. Com um maior número de grupos hidroxilo, a antocianina é mais azulada e com mais grupos metoxilo, a antocianina apresentará coloração mais avermelhada (42). Desta forma, são uma alternativa aos corantes sintéticos, embora de uso controlado, pois a cor não é estável perante diferenças de temperatura, radiação e pH (45). Na figura 1.3, a antocianina a pH=1 apresenta uma coloração vermelha, a pH=5 apresenta coloração rosa e a pH=6 coloração lilás.
O+ OR3 OH O H OH OR1 OR2 O OR3 OH O H OH OR1 OR2 OH OR3 OH O H OH OR1 OR2 OH O pH=1 pH=5 pH=6 + H2O - H+
Figura 1.3 – Estruturas de antocianinas em função do pH do meio (47).
Os frutos de pequenas dimensões, tais como amoras, sabugueiro, mirtilos e framboesas são ricos tanto em antocianinas como em outros compostos fenólicos. Quando incluídos na dieta humana conferem proteção antioxidante e benefícios terapêuticos, tais como diminuição do risco de acidentes vasculares cerebrais, diminuem a atividade carcinogénica e melhoram a visão e o comportamento cognitivo. As antocianinas são encontradas maioritariamente nas flores e nos frutos mas podem também encontrar-se nas folhas, no pé e nos órgãos de armazenamento (42, 48).
O sabugueiro apresenta cerca de vinte espécies pertencentes ao gene Sambucus da família das Caprifoliaceae. É uma árvore pequena na qual nasce um fruto que tem sido usado para conferir cor a geleias, compotas e vinhos em toda a Europa, utilizando das espécies Sambucus
nigra e Sambucus canadensis, devido ao seu elevado conteúdo em antocianinas (45, 49-50).
Tem também sido utilizado na medicina e como suplemento dietético. É um fruto sazonal que amadurece no fim do verão. As bagas (figura 1.4 b) têm cerca de 6 mm de diâmetro e coloração roxo escuro. No início do verão, antes de haver formação de baga, verifica-se o
11
crescimento de flores (figura 1.4 a) brancas hermafroditas no arbusto (51). As flores são também de tamanho reduzido, verificando-se existência de flores entre os 3 e os 6 mm (52). Na Europa é habitual a plantação da espécie Sambucus nigra, sendo pouco frequente o seu consumo direto. O seu processamento, para obtenção de concentrados e frutos, envolve a presença de metabolitos primários, como açúcares e ácidos orgânicos, e metabolitos secundários envolvendo várias antocianinas (51). Estima-se que o sabugueiro tenha uma quantidade de antocianinas entre 2 a 15,6 g/Kg (42). As antocianinas presentes em maior concentração são a cianidina-3-glucosido e a cianidina-3-sambubiosido e em menor concentração são a cianidina-3-sambubiosido-5-glucosido, a cianidina-3,5-diglucosido, a cianidina-3-rutinosido, a pelargonidina-3-glucosido e a pelargonina-3-sambubiosido (53-54).
Figura 1.4 - Sabugueiro, espécie Sambucus nigra: a) Em flor; b) Com fruto.
1.1.4. Empresa Agroindustrial
A empresa agroindustrial que nos forneceu o efluente industrial dedica-se à transformação de sabugueiro e maçãs. A empresa tem implementada a ISO 22000:2005 (8), baseando-se no “Planeamento e Realização de Produtos Seguros” cumprindo o programa de pré-requisitos e princípios do HACCP, respeitando os parâmetros da Comissão do Codex Alimentarius (6).
Durante a campanha do sabugueiro, a empresa processa a baga para obtenção do corante alimentar ou, em alternativa, para posterior congelação. Durante este processo a baga é lavada
com água, gerando-se entre 5 e 40 m3/dia de efluente corado. Para tratamento deste efluente a
empresa possui um sistema de tratamento de águas residuais que recorre a um processo biológico, seguido de um Processo de Oxidação Avançado (POA), implementado pela Adventch (Advanced Environmental Technologies).
12
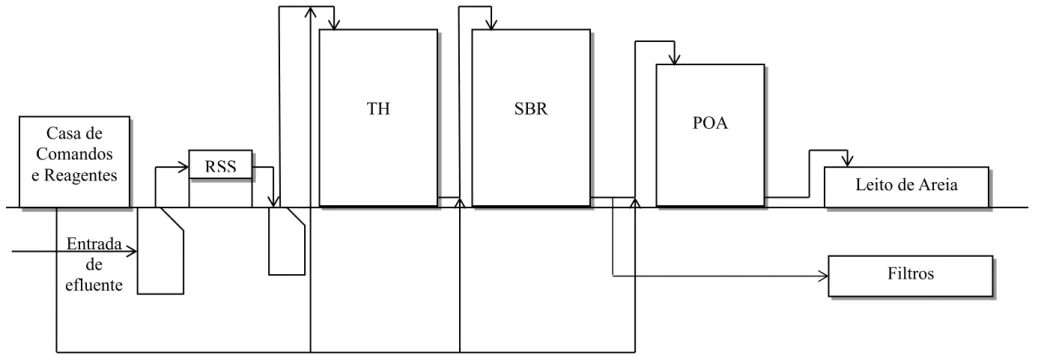
Este sistema de tratamento de águas residuais é constituído por várias fases (Figura 1.5). A casa de comando é o local onde estão armazenados todos os reagentes que são introduzidos nos diferentes tanques e em que se programa todos os passos deste procedimento.
O processo começa pela entrada do efluente num separador de sólidos suspensos que funciona por gravidade. Seguidamente o efluente passa para um tanque de homogeneização (TH), que funciona maioritariamente como um reservatório. Neste, o efluente está sob constante agitação até que possa passar para o tanque seguinte.
A próxima etapa consiste num reator SBR (Sequencing Batch Reactor). Este reator funciona por etapas: i) numa primeira etapa procede-se ao enchimento do reator, sob constante agitação e borbulhamento de ar; ii) na segunda etapa procede-se ao acerto do pH, por adição de hidróxido de sódio, ácido fosfórico e ureia, como fontes de nutrientes para os microorganismos, dando-se início ao processo de lamas ativadas, mantendo-se a forte agitação e borbulhamento de ar; iii) na terceira etapa procede-se à sedimentação das lamas, processo coadjuvado pela adição de cloreto de polidialilmetilamónio e à decantação para o próximo tanque; as lamas são filtradas, sendo que uma parte delas é reciclada ao tanque SBR.
No último tanque ocorre o POA, do tipo Fenton. Primeiramente efetua-se a correção do pH para 4 por adição de ácido sulfúrico e seguidamente adiciona-se peróxido de hidrogénio, ferro II e ferro III. Quando terminado este tratamento, o efluente é passado por um leito de areia que irá reter todos os resíduos sólidos que possam ainda existir.
Desta forma, e tendo em atenção que nenhum passo deste processo pode ser contornado, considera-se que estas águas residuais se encontram tratadas e podem ser lançadas no sistema de efluentes municipais.
13 Casa de Comandos e Reagentes TH SBR POA Leito de Areia RSS Entrada de efluente Filtros
Figura 1.5 – Esquema simplificado do processo de tratamento de águas residuais da empresa. RSS – Removedor de Sólidos Suspensos;
14
1.2. Processos de tratamento de águas residuais
Os processos de tratamento de águas residuais têm em vista a remoção da carga poluente para que as águas possam ser lançadas novamente no meio aquático ou então reutilizadas. A série de etapas que constituem o tratamento integra técnicas físicas, biológicas e químicas (16,31, 55).
O pré-tratamento consiste na aplicação de um conjunto de técnicas físicas de separação, envolvendo a remoção de pedras, gorduras, ceras e todos os materiais flutuantes que possam interferir e danificar os equipamentos ou que possam também comprometer o processo de tratamento. Assim utilizam-se técnicas como triagem, redução de sólidos (fragmentação e maceração), sedimentação, desnatação e flotação (25, 31, 56). No final desta etapa procede-se a uma equalização do fluxo utilizando um tanque de elevado tempo de retenção (1 a 5 dias).
A etapa seguinte designa-se por tratamento primário e continua a empregar técnicas físicas, como a remoção dos sólidos suspensos e coloidais do efluente por floculação, sedimentação e decantação. Esta etapa pode ser seguida por sistemas de filtração, a fim de se aumentar a sua eficácia.
Segue-se o tratamento secundário, essencialmente biológico, que tem por objetivo a remoção da matéria orgânica biodegradável em solução. Utilizam-se processos do tipo lamas ativadas, leitos percoladores de leito fixo ou de leito móvel, ou reatores anaeróbicos. Nesta etapa podem ser geradas grandes quantidades de lamas que são separadas em sedimentadores (55). Num sistema de lamas ativadas, uma parte destas lamas é reciclada ao reator. As lamas necessitam igualmente de tratamento, tanto para reduzir o seu volume, como também para estabilizar biologicamente o produto final. Este processo pode ser feito por filtragem, desidratação, secagem ou digestão (31).
As etapas posteriores podem ser muito diversas, sendo designadas por tratamentos terciários. Tipicamente podem ocorrer desinfeções, por processos com cloro ou ozono, ou ainda com radiação UV, processos do tipo químico. No caso de haver compostos recalcitrantes ao tratamento biológico, recorre-se a processos de adsorção em carvão ativado, ou mais recentemente os POA (57-58). Este tratamento terciário é sobretudo aplicado aos tratamentos de águas residuais caso estas se destinem para o consumo humano ou para a regeneração da própria água (25, 31).
O tipo de compostos orgânicos presentes nos efluentes industriais, agrícolas, municipais e sobretudo hospitalares, tem mudado nas últimas décadas, com o aumento da carga tóxica e
15
comportamento refratário ao tratamento biológico. São exemplo destes compostos os efluentes da indústria têxtil e alimentar, os pesticidas, os produtos de higiene e limpeza e os produtos farmacêuticos dos quais se destacam os antibióticos (59-60). Apesar de se verificar que alguns tratamentos biológicos conseguem modificar os compostos, a mineralização total só é alcançada pelos processos de oxidação avançada (26).
Desta forma, tornou-se indispensável pensar em novas técnicas que conseguissem mineralizar ou transformar moléculas refratárias noutras, mais facilmente biodegradáveis (58, 61). Estas técnicas deverão ser capazes de degradar poluentes específicos, reduzir conteúdos orgânicos, tratar lamas e reduzir a cor e o odor (62). Tendo em vista estes objetivos, os POA
surgiram como uma alternativa bastante promissora (58, 60,63).
1.3. Processos de Oxidação Avançados
Os POA destacam-se por serem considerados processos “amigos do ambiente”, visto não produzirem grandes quantidades de lamas potencialmente perigosas e por não necessitarem de uma segunda fase de tratamento para que a carga poluente seja eliminada (64). Destacam-se também por terem obtido bons resultados em efluentes que continham compostos orgânicos recalcitrantes, potencialmente tóxicos, como pesticidas e surfactantes, com coloração e compostos provenientes da indústria farmacêutica. De destacar também a sua eficácia na desinfeção de microrganismos patogénicos (61, 65-67).
Os POA conseguem decompor praticamente todo o tipo de compostos orgânicos contaminantes dissolvidos em água, baseando-se na formação de radicais livres altamente
reativos. Um dos radicais muito gerados são os radicais hidroxilo (HO•), que têm um
potencial redox de 2,8 V pelo que detêm baixa seletividade e elevado poder oxidante (59, 64, 68). O facto de este radical ser pouco seletivo, faz com que seja uma mais-valia no tratamento de efluentes, pois oxida e mineraliza moléculas orgânicas, por meio de uma sequência de reações de oxidação, convertendo-as em água, dióxido de carbono e moléculas inorgânicas (25, 69). O ataque do radical hidroxilo a moléculas orgânicas é geralmente realizado à pressão
e temperatura ambientes, com cinéticas muito rápidas, entre 106 e 109 M-1 s-1 (64).
Inicialmente o radical hidroxilo reage por abstração de hidrogénio (eq. 1.1), seguido por
adição eletrofílica do HO• (eq. 1.2) e finalmente por transferência de eletrão (eq. 1.3), tal
16
RH + HO• → R• + H2O (1.1)
RX + HO• → RXOH (1.2)
RX + HO• → R•+ + OH− (1.3)
Os POA englobam fotocatálise, peróxido de hidrogénio, fotólise (UV), ozono ou uma combinação de todos estes. Estes processos subdividem-se ainda em homogéneos (apenas com fase líquida) e heterogéneos (fases líquida e gasosa ou fases líquida e sólida). A fotocatálise inclui processos de catálise heterogénea, associada a semicondutores, ou de catálise homogénea do tipo foto-Fenton; os processos que contêm peróxido de hidrogénio são
H2O2/UV, o processo de Fenton e foto-Fenton; a fotólise necessita apenas de fotões para
quebrar os compostos, portanto somente a radiação UV de maior energia é eficaz; o processo
de ozono inclui ozonação (O3 gasoso), O3/UV, O3/catalisador heterogéneo, O3/H2O2 e
O3/Fenton. Podemos ainda distinguir os processos com e sem radiação, como os sistemas, O3
+ H2O2, O3 + OH−, Fenton (H2O2 + Fe2+/Fe3+) e eletro-Fenton sem radiação e os semicondutor
+ O2 + UV, semicondutor + H2O2 + UV, O3 + UV, H2O2 + UV, H2O2 + Fe2+/Fe3+ + UV
(foto-Fenton) com radiação (70).
Desta forma, e apontando o facto de os POA originarem resultados muito mais satisfatórios, com elevadas taxas de remoção de poluentes, quando comparados com tratamentos convencionais biológicos, a única problemática associada a estes processos reflete-se nos elevados custos das fontes de energia e dos reagentes, tal como o do ozono e do peróxido de hidrogénio (59). Contudo, quando se fala em radiação UV engloba-se também a
radiação solar. A potência ótica da radiação solar encontra-se entre os 20 e 30 W/m2, gerando
0,2 a 0,3 moles de fotões/m2/h dentro de comprimentos de onda entre 300 e 400 nm. A
utilização de radiação solar faz com que os custos inerentes ao processo diminuam e reforça o facto de estes serem processos ecológicos, tornando-os também sustentáveis (69).
De entre todos os POA existentes e estudados, a fotocatálise heterogénea assistida por
materiais semicondutores, nomeadamente o TiO2, os processos incluindo peróxido de
hidrogénio e radiação UV e ainda processos de Fenton, são os que têm obtido melhores resultados na remoção de compostos recalcitrantes dos efluentes (61, 68). Destes, a fotocatálise heterogénea assistida por materiais semicondutores parece ser a menos nociva ambientalmente (58).
17
1.3.1. Fotocatálise heterogénea
A fotocatálise foi descoberta no início dos anos setenta com a investigação das células fotoeletroquímicas e teve um impulso em 1972 pela demonstração da separação da água em
H2 e O2 com o uso de um fotocatalisador, nomeadamente TiO2, por Fujishima e Honda (71).
Esta experiência foi realizada numa célula eletrolítica constituída por TiO2 como ânodo e
platina como cátodo. Após incidência de radiação com o comprimento de onda de 415 nm,
ocorrem no cátodo e no ânodo as reações de libertação de hidrogénio e de oxigénio,
respetivamente (62, 72).
Após décadas de investigação ainda é complicado ser assertivo quanto à definição de fotocatálise. Segundo as recomendações da IUPAC, no Glossário de termos usados em Fotoquímica, fotocatálise é definida como uma mudança na velocidade da reação química que está a ocorrer devido à presença do fotocatalisador, sob a ação de radiação infravermelha, visível ou ultravioleta (73). O fotocatalisador absorve a luz e encontra-se inteiramente ligado às transformações químicas subsequentes, regenerando-se no fim de cada ciclo de interações. Esta definição de fotocatálise encontra-se ainda concordante com a proposta por Andrew Mills e Stephen Le Hunte, em 1997, que a define mais sucintamente como sendo a aceleração da fotoreação na presença de um fotocatalisador (74).
A fotocatálise heterogénea é considerada uma técnica bastante promissora pelo facto de se conseguir degradar os compostos à pressão e temperatura ambiente, de se atingir praticamente a mineralização completa dos poluentes, pela possibilidade de se poder adquirir semicondutores a baixo custo, de não haver necessidade do uso de outros químicos e ainda pelo facto de se usar radiação UV ou radiação solar (62, 75).
Neste processo a luz interveniente no processo é um reagente e o material semicondutor utilizado, do tipo óxido metálico, é o catalisador, sendo que este utiliza a luz juntamente com o oxigénio para degradar o poluente. O catalisador é geralmente um sólido, pelo deve formar uma suspensão coloidal estável durante a irradiação (76).
Para que haja fotocatálise é ainda necessário que a energia dos fotões que estão a incidir no fotocatalisador seja igual ou superior ao seu hiato de bandas (band gap). Este hiato de energia separa a banda de valência (BV), de menor energia, da banda de condução (BC). Assim, após irradiação, os eletrões são excitados da BV para a BC (figura 1.6) deixando lacunas na BV
(70, 77). O par eletrão/lacuna (e–/h+) assim formado deverá migrar para a superfície do
18
radicais hidroxilo altamente reativos, que promovem uma série de reações de oxidação e de redução à superfície do fotocatalisador, conduzindo assim à degradação dos poluentes (62, 74).
Figura 1.6 – Representação do mecanismo de fotocatálise (62).
Enquanto se processa o passo anterior, ocorrem recombinações entre os eletrões da BC com as lacunas da BV, devido às forças eletrostáticas de interação. Os eletrões da BC possuem elevada capacidade de redução, reduzindo assim as espécies recetoras de eletrões (potencial químico entre +0,5 e -1,5 V) e as lacunas da BV detêm bom poder oxidante, e oxidam as espécies dadoras de eletrões adsorvidas na superfície do fotocatalisador (potencial químico entre +1,0 e +3,5) (62).
Segundo Pawar (62), as reações químicas inerentes à fotocatálise heterogénea assistida por materiais semicondutores, podem ser descritas da seguinte forma:
semicondutor + hν → h+ + e– (1.4) h+ + H2O → HO• + H+ (1.5) h+ + OH– → HO• (1.6) h+ + poluente → (poluente)+ (1.7) e– + O2→ O2•– (1.8) O2 •– + H+ → HOO• (1.9) 2 HOO• → O2 + H2O2 (1.10) H2O2 + O2•–→HO• + OH– + O2 (1.11)
19
H2O2 +hν → 2 HO• (1.12)
Atendendo tanto ao descrito anteriormente como às equações químicas que lhes correspondem, é possível ver que este processo desenvolve-se numa série de etapas com a participação dos radicais hidroxilo e superóxido. Desta forma, e atendendo às caraterísticas destes radicais, consegue-se degradar diversos poluentes orgânicos e mesmo transformá-los em produtos inofensivos (62).
O modelo cinético mais utilizado na descrição da fotocatálise heterogénea é o de Langmuir-Hinshelwood que se baseia nos seguintes pressupostos: i) o número de lugares para a adsorção à superfície do catalisador é limitado; ii) a superfície do catalisador é coberta por apenas uma camada, ou seja, cada lugar pode adsorver apenas uma molécula; iii) as reações de adsorção são reversíveis; iv) a superfície do catalisador é homogénea; v) não há interação entre as moléculas adsorvidas.
As cinéticas destas reações podem ser obtidas pela equação de Langmuir-Hinshelwood, que se expressa através da concentração inicial do composto orgânico e da taxa de degradação inicial. A equação 1.13 traduz a esta expressão, que é a cinética mais frequentemente utilizada na determinação das cinéticas de fotocatálise heterogénea.
𝑟
𝑜=
𝑘𝑐𝐾𝐿𝐻𝐶𝑜1+𝐾𝐶𝑜 (1.13)
Esta equação é habitualmente reescrita, tendo em consideração cinéticas de pseudo-primeira ordem:
𝑟
𝑜= 𝑘
𝑜𝑏𝑠𝐶
𝑜 (1.14)Pelo que substituindo na equação (1.13) e linearizando resulta em:
1 𝑘𝑜𝑏𝑠
=
1 𝑘𝑐𝐾𝐿𝐻+
1 𝑘𝑐𝐶
𝑜 (1.15)Nestas equações C0 é a concentração inicial de poluente (mg/L), KLH é a constante de
equilíbrio de adsorção de Langmuir-Hinshelwood (L/mg) e kc é constante de velocidade de
20
Este modelo só é adequado em processos fotocatalíticos nos quais apenas há intervenção de um composto orgânico. A medição da adsorção na ausência de radiação deverá ser
cineticamente semelhante ao KLH. A medição da quantidade de composto orgânico adsorvido
é realizada através da equação 1.16.
𝑄
𝑎𝑑𝑠=
∆𝐶[𝑆𝐶]
(1.16)
E a relação entre as duas quantidades é:
𝐾𝐿𝐻= 𝑄 1
𝑎𝑑𝑠[𝑆𝐶] (1.17)
Em que Qads é a quantidade de composto orgânico adsorvido (mg/g), C é a variação da
concentração do composto orgânico antes e depois da adsorção (mg/L) e [SC] é a concentração de catalisador (g/L) (78).
1.3.1.1. Materiais semicondutores para fotocatálise
Os primeiros materiais semicondutores foram descobertos por Michael Faraday, em 1833,
quando verificou que a resistência elétrica do Ag2S diminuía com a temperatura, mas apenas
despertaram interesse quando foi criada a primeira junção metal-semicondutor, em 1874, por Karl Ferdinand Braun (79).
Muitos semicondutores têm estruturas cúbicas do tipo diamante ou blenda de zinco, como o silício, o GaAs ou o InP. No entanto, outros semicondutores cristalizam em estruturas do tipo wurtzite, com simetria hexagonal, como por exemplo o ZnO (80). Os semicondutores podem ser elementares, Si ou Ge, compostos binários dos grupos III-V (13-15 atualmente), como o GaAs ou o InP, dos grupos II-VI (12-16) como o CdS ou o CdTe, ou ainda compostos orgânicos tal como o poliacetileno. Estes podem ainda exibir propriedades magnéticas, como
o Cd1-xMnxTe, ou ferroelétricas, como SbSi ou então serem supercondutores, quando são
dopados, tal como é o caso do GeTe ou do SrTiO3 (81).
Um semicondutor ideal para o processo de fotocatálise deverá ser química e biologicamente inerte, de simples utilização e produção e ainda facilmente ativado por
21
CdS, GaP, WO3 e NiO. Verificou-se que em diversas situações o ZnO, CdS e GaP formavam
facilmente subprodutos tóxicos, o que não é de todo o desejado para o ambiente, motivo porque não são utilizados (64, 82).
Uns dos requisitos mais importantes num semicondutor é o seu hiato de bandas, sendo que o menor valor está limitado pelo potencial necessário para quebrar as ligações da água, 1,23 eV. A este valor será necessário adicionar o sobrepotencial da água, num mínimo de 0,5 eV, valor que varia de acordo com o material do elétrodo. O desejado seria um semicondutor que tenha o seu hiato de bandas na região do visível do espetro solar. Tendo em consideração que a radiação visível ocorre entre 390 e 700 nm, a aplicação da equação 1.19 resulta em valores de energia entre 1,77 eV e 3,18 eV.
𝐸 = ℎ𝜈 =
ℎ𝑐𝜆 (1.18)
𝐸(𝑒𝑉) =
1240𝜆 (𝑛𝑚) (1.19)
Na equação 1.18, representa a frequência, c a velocidade da luz no vazio e λ o
comprimento de onda. Na equação 1.19 tem-se a representação simplificada de como converter o comprimento de onda (de nm), para energia (em eV).
Outro requisito reside na posição das bandas. A BC tem de ter um potencial mais elevado do que o potencial de redução do hidrogénio, enquanto a BV tem de ter um potencial inferior ao potencial de redução do oxigénio.
A figura 1.7 ilustra o hiato de bandas de alguns semicondutores que têm sido utilizados
para fotocatálise (62). Nesta figura verifica-se que o SnO2, por exemplo, tem uma banda de
condução com um potencial inferior ao da redução do hidrogénio, motivo porque não pode ser usado para fotocatálise em soluções aquosas.