Caracterização de cultivares de grão-de-bico (Cicer
arietinum L.) e seleção de microrganismos benéficos
associados à cultura
- Versão Provisória -DISSERTAÇÃO DE MESTRADO EM ENGENHARIA AGRONÓMICA
Bernardo Rocha Leal
Orientador: Professora Doutora Guilhermina Marques
ii
Caracterização de cultivares de grão-de-bico (Cicer
arietinum L.) e seleção de microrganismos benéficos
associados à cultura
- Versão Provisória -DISSERTAÇÃO DE MESTRADO EM ENGENHARIA AGRONÓMICA
Bernardo Rocha Leal
Orientador: Professora Doutora Guilhermina Marques
Composição do Júri:
_________________________________________________ _________________________________________________ _________________________________________________
iii As doutrinas apresentadas neste trabalho são da exclusiva responsabilidade do autor.
iv AGRADECIMENTOS
Em primeiro lugar, gostaria de agradecer todo o contributo e apoio fornecido pela minha orientadora, Professora Doutora Guilhermina Marques.
Gostaria ainda de agradecer toda a ajuda, paciência, material e muitas horas despendidas pela Sara Laranjeira, Sara Reis, Sandra Pereira e Dr. Lav Sharma, essenciais para a conclusão deste trabalho.
De referir ainda, o apoio e paciência extra necessários nos últimos meses, da parte de toda a minha família, companheira e amigos.
Financiamento:
This work was financed by Portuguese national funds through Programa Operacional Competitividade e Internacionalização (POCI), Project 3599 – Promover a Produção Científica e Desenvolvimento Tecnológico e a Constituição de Redes Temáticas (3599-PPCDT) and Fundo Europeu de Desenvolvimento Regional (FEDER) under Project POCI-01-0145-FEDER-016801 and by Fundação para a Ciência e a Tecnologia (FCT) under Project PTDC/AGR-TEC/1140/2014.
v
consumo humano de baixo custo. Devido ao grão-de-bico ser cultivado principalmente em ambientes de sequeiro, a seleção de genótipos de grão-de-bico e microrganismos benéficos associados a este hospedeiro é necessária para aumentar a sua produtividade e resiliência às alterações climáticas. No presente estudo, o ensaio de campo foi realizado no campus da Universidade de Trás-os-Montes e Alto Douro (latitude 41º28’N; longitude 7º74; altitude 430 m) situado no concelho de Vila Real, e decorreu entre outubro de 2016 e julho de 2017.
O dispositivo experimental foi um ensaio com duas épocas de sementeira (outono e primavera) e 12 linhas de grão-de-bico, entre as quais, oito do grupo Kabuli e quatro do grupo Desi, em blocos casualizados completos e quatro repetições de cada.
Foram efetuadas análises de produção e fitoquímicas. A produtividade foi determinada a partir da pesagem e registo do peso seco dos diferentes componentes morfológicos da planta, entre os quais a parte aérea total, número de vagens e peso de cem sementes, enquanto os parâmetros produtivos foram definidos pela simples contagem, manual e/ou mecânica, das vagens, grãos e ramificações basais. Quanto à parte fitoquímica foram realizadas análises ao teor de proteína, fenóis totais, orto-difenóis, flavonóides, ABTS e DPPH.
Procedeu-se ainda ao isolamento de rizóbios e outros microrganismos benéficos associados à cultura realizando de seguida a identificação molecular por análise filogenética e caracterização para uma seleção das estirpes mais eficientes na solubilização do fósforo e na valorização do crescimento da cultura.
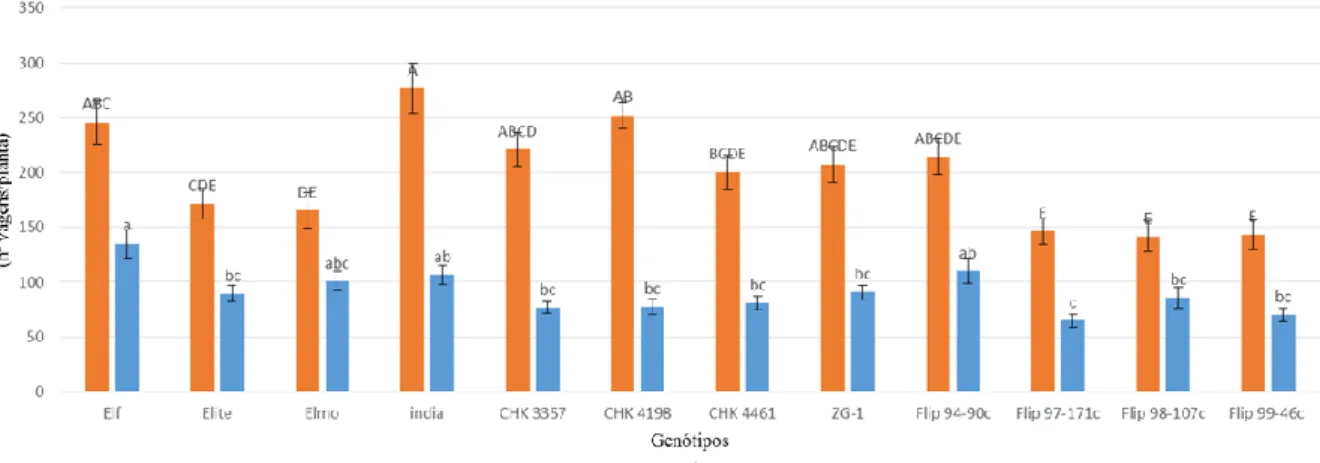
Os genótipos em estudo que obtiveram os melhores valores nos parâmetros produtivos foram o India e o CHK 3357 na primavera e outono, respetivamente. No que diz respeito ao teor de proteína, o genótipo Flip 97-171c, evidenciou-se nas duas datas de sementeira com os maiores valores.
Relativamente à parte fitoquímica, nas análises de orto-difenóis, ABTS e flavonóides, foram os genótipos Flip a destacar-se, com os valores superiores do Flip 94-90c no primeiro teste e o Flip 99-46c nos dois seguintes. Já no que concerne à atividade antioxidante determinada pelo método DPPH e aos fenóis totais, foram dois genótipos do grupo Desi, Elite e Elf, que obtiveram os dados mais elevados.
vi
O aumento de rendimento da cultura pode ser obtido através da aplicação combinada de uma sementeira precoce e variedades adaptadas à sementeira de Outono, tornando o grão de bico uma cultura promissora e alternativa para os sistemas agrícolas praticados em Portugal.
Palavras-chave: Leguminosas; rizóbio; fixação biológica de azoto; solubilização de fósforo; filogenia, fitoquímicos.
vii
important grain legumes. It is a low-cost source of vegetable protein for human consumption. Once chickpea is mostly grown in rainfed environments, the selection of chickpea lines and beneficial microorganisms associated to this host is required to enhance productivity and resilience to climatic changes.
The field trial was carried out on the campus of the University of Trás-os-Montes and Alto Douro (latitude 41º28'N; longitude 7º74; altitude 430 m) located in the municipality of Vila Real, between October 2016 and July 2017.
The experimental device was a trial with two sowing dates (autumn and spring) and 12 chickpea genotypes, including eight Kabuli and four Desi type, in completely randomized blocks and four replicates of each.
Chemical, productive and phytochemical analysis were carried out. Productivity was determined by weighing and recording the dry weight of the different morphological components of the plant, including total aerial area, number of pods and weight of one hundred seeds, while productivity parameters was defined by simple manual and/or mechanical counting of pods, grains and basal branches. As for the chemical and phytochemical part, analyzes were carried out on protein content, total phenols, ortho diphenols, flavonoids, ABTS and DPPH.
Isolation of rhizobia and other beneficial microorganisms associated with the culture were also carried out, followed by a molecular identification by phylogenetic analysis and characterization for a selection of the most efficient strains in phosphorus solubilization and growth enhancement.
The genotypes in the study that obtained the best values in the productive parameters were India and CHK 3357, in the spring and autumn, respectively. In relation to the protein content, the line Flip 97-171c, presented the higher values in the two dates of sowing.
Regarding the phytochemical analysis, the Flip genotypes presented the higher values for ortho diphenols, ABTS and flavonoids, with the upper values of Flip 94-90c in the first test and Flip 99-46c in the following two. Concerning the antioxidant activity by DPPH method and total phenols contents, two Desi genotypes obtained the highest values, Elite and Elf.
viii
Increased crop yields can be achieved through the combined application of early sowing and varieties adapted to autumn sowing, making chickpeas a promising and alternative crop for agricultural systems practiced in Portugal.
Keywords: Legumes; Rhizobia; biological fixation of nitrogen; P solubilization; phylogeny, phytochemicals.
ix
RESUMO ... v
ÍNDICE DE FIGURAS ... xi
ÍNDICE DE QUADROS ... xii
SÍMBOLOS E ABREVIATURAS ... 1
CAPÍTULO I – INTRODUÇÃO ... 1
CAPÍTULO II – REVISÃO BIBLIOGRÁFICA ... 2
2.1. Leguminosas ... 2
2.2. Grão-de-bico ... 3
2.2.1. Taxonomia ... 3
2.2.2. Origem e história ... 3
2.2.3. Situação nacional e mundial ... 4
2.2.4. Composição nutricional e fitoquímica ... 5
2.2.5. Bactérias promotoras de crescimento de plantas ... 7
2.2.5.1. Microrganismos benéficos para as culturas ... 7
2.2.5.2. Fixação biológica do azoto ... 10
2.2.5.3. Bactérias solubilizadoras de fósforo ... 14
2.2.5.4. Desenvolvimento e utilização de inóculos de microrganismos benéficos ... 16
CAPÍTULO III – MATERIAL E MÉTODOS ... 18
3.1. Isolamento de bactérias ... 18
3.1.1. Culturas armadilha ... 18
3.1.2. Nódulos de plantas leguminosas ... 19
3.1.3. Avaliação da capacidade infetiva ... 20
3.1.4. Solubilização de fósforo ... 21
3.1.5. Identificação molecular das bactérias ... 22
3.1.5.1. Extração de DNA ... 22
3.1.5.2. Amplificação da região 16S rDNA por PCR ... 23
3.1.5.3. Electroforese em gel de agarose do produto PCR ... 23
3.1.5.4. Análise de sequências ... 24
3.2. Ensaio de campo ... 24
3.2.1. Localização do ensaio e caracterização edafoclimática ... 24
3.2.2. Análise do solo ... 26
x
3.2.5.2. Determinação de extratos hidro-metanólicos de (poli)fenóis ... 28
3.2.5.3. Determinação dos fenóis totais ... 29
3.2.5.4. Determinação dos orto-difenóis ... 30
3.2.5.5. Avaliação da atividade antioxidante (ABTS) ... 31
3.2.5.6. Avaliação da atividade antioxidante (DPPH) ... 33
3.2.5.7. Avaliação do conteúdo em flavonóides ... 34
3.3. Análise estatística ... 35
CAPÍTULO IV – RESULTADOS ... 36
4.1. Análise de parâmetros produtividade/culturais ... 36
4.2. Teor de proteína bruta ... 39
4.3. Análise fitoquímica ... 40
4.4. Avaliação da capacidade infectiva em ensaios in vitro ... 43
4.5. Análise filogenética ... 47
CAPÍTULO V – DISCUSSÃO ... 49
CAPÍTULO VI – CONCLUSÕES ... 53
BIBLIOGRAFIA ... 54
xi
leguminosas nos últimos 50 anos (adaptado de FAO 2016). ... 3
Figura 2: Produção e área plantada mundial de grão-de-bico nos últimos 20 anos (adaptado de FAOSTAT, 2018). ... 4
Figura 3: Produção e área plantada nacional de grão-de-bico nos últimos 20 anos (adaptado de FAOSTAT, 2018). ... 5
Figura 4: Culturas armadilha realizadas na UTAD. ... 18
Figura 5: Planta de grão-de-bico retirada de cultura armadilha e respetivas raízes noduladas. ... 19
Figura 6: Cultura no meio YMA+BTB. ... 20
Figura 7: Planta de grão-de-bico inoculada in vitro e raiz nodulada. ... 21
Figura 8: Teste de solubilização de fósforo (TCP) e respetivos halos. ... 22
Figura 9: Bandas obtidas através da eletroforese em gel de agarose. ... 24
Figura 10: Ensaio de campo UTAD. ... 25
Figura 11: Linhas utilizadas no estudo. ... 28
Figura 12: Número de vagens por planta em ambas as datas de sementeira. ... 36
Figura 13: Valores do peso de vagens por planta no outono e primavera. ... 37
Figura 14: Número de sementes por planta nas duas datas de ensaio. ... 37
Figura 15: Peso de sementes por planta em ambas as datas de sementeira. ... 38
Figura 16: Peso de 100 sementes no outono e primavera. ... 38
Figura 17: Índice de colheita das diferentes linhas nas duas datas de sementeira. ... 39
Figura 18: Rendimento real (kg/ha) nas duas datas de sementeira. ... 39
Figura 19: Teor de proteína bruta dos genótipos estudados nas duas datas de sementeira. ... 40
Figura 20: Valores de orto-difenóis dos genótipos em estudo. ... 41
Figura 21: Valores de fenóis totais dos genótipos em estudo. ... 41
Figura 22: Valor ABTS das linhas do estudo. ... 42
Figura 23: Valor DPPH das linhas do estudo. ... 42
Figura 24: Avaliação do valor em flavonóides dos genótipos em estudo. ... 43
Figura 25: Árvore filogenética de bactérias associadas ao grão-de-bico com base na região 16S do rDNA. ... 48
xii
Quadro 2 - Padrões de ácido gálico. ... 30
Quadro 3 - Preparação dos padrões de Trolox ... 32
Quadro 4 - Preparação dos padrões de Catequina ... 34
Quadro 5 - Caracterização dos microrganismos isolados (a). ... 44
Quadro 6 - Caracterização dos microrganismos isolados e capacidade solubilizadora de P (b). ... 45
1 SÍMBOLOS E ABREVIATURAS % ... Percentagem ºC ... Graus Celsius µL ... Microlitro Abs ... Absorvância aC ... antes de Cristo
BTB ... Bromothimol blue/corante azul de bromotimol cm ... Centímetro
CR ... Congo red/corante vermelho do Congo
CTAB ... Cetyl trimethylammonium bromide/brometo de cetiltrimetilamónia DNA ... Ácido desoxirribonucleico
FBA …….……Fixação Biológica do Azoto FMA ... Fungos micorrízicos arbusculares g ... Grama ha ... Hectare kg ... Quilograma m ... Metro M ... Mole mg... Miligrama mL ... Mililitro mm ... Milímetro mM ... Milimole N ... Azoto ng ... Nanograma nm ... Nanómetro P ... Fósforo
PCR ... Polimerase Chain Reaction/ Reação em Cadeia da Polimerase
PGPR ... Plant growth promoting rhizobacteria/bactérias promotoras do crescimento das plantas PSB... Plant solubilizing bacteria / bactérias solubilizadoras de fósforo
1 CAPÍTULO I – INTRODUÇÃO
Devido à grande capacidade que as leguminosas têm de estabelecer simbioses com microrganismos e da sua importância nutritiva, augura-se um aumento da sua produção, pretendendo dar resposta aos problemas ambientais e demográficos que o nosso planeta enfrenta.
As restrições económicas e ambientais associadas à aplicação de fertilizantes sintéticos impulsionaram a aplicação de microrganismos benéficos como biofertilizantes devido aos seus mecanismos biológicos, que melhoram a absorção de nutrientes e o desempenho das plantas.
O grão-de-bico é a segunda leguminosa mais consumida a nível mundial, devido às suas características nutritivas (proteína, hidratos de carbono, minerais e vitaminas), à sua adaptabilidade cultural em termos de solos e climas e ainda devido ao seu reduzido preço, sendo muito importante nos países do terceiro mundo em que alimentos de origem animal escasseiam.
O presente estudo enquadra-se no projeto LegSeedCoat, em que um dos objetivos é o revestimento de sementes de leguminosas com inóculos eficientes, incluindo rizóbios, adaptados a condições desfavoráveis, como solos pobres, ácidos e sujeitos a défice hídrico. Deste modo, pretende-se contribuir para a melhoria da qualidade dos inóculos comerciais existentes e para a redução do uso de fertilizantes químicos de modo a minimizar os seus efeitos no ambiente.
Com este trabalho pretende-se avaliar o efeito da data de sementeira nas características produtivas, fitoquímicas e nutritivas de 12 genótipos de grão-de-bico. Adicionalmente, pretende-se selecionar e identificar bactérias promotoras do crescimento das plantas (PGPR, do inglês plant growth promoting rhizobacteria) associadas à cultura do grão-de-bico, com potencial para aumentar a produtividade e o valor nutricional da cultura sob condições de stress hídrico causado pelas alterações climáticas. As estirpes de bactérias foram testadas quanto às características de promoção de crescimento de plantas nomeadamente: capacidade de nodulação, fixação de azoto atmosférico e solubilização de fósforo.
2 CAPÍTULO II – REVISÃO BIBLIOGRÁFICA
2.1. Leguminosas
A família Fabaceae, também conhecida por Leguminosae (leguminosas), é a terceira maior família de angiospérmicas e é composta por 751 géneros e 19 500 espécies. As leguminosas são cultivadas para fins comerciais em cerca de 180M ha, o que corresponde sensivelmente a 13 a 15% da área arável mundial e contribui para 25% da produção de proteína mundial (Graham e Vance, 2003). Esta é uma família de plantas na qual se depositam grandes esperanças para o futuro insustentável que se avizinha, devido ao estabelecimento de simbioses com microrganismos diversos e aos benefícios que pode fornecer para outras culturas e para as propriedades físico/químicas dos solos (Courty et al., 2015).
No entanto, a maior valência das leguminosas resulta da sua capacidade de fixação de azoto atmosférico, que consequentemente leva a uma redução dos custos de fertilização e uma maior sustentabilidade e biodiversidade dos solos (Kumar et al., 2015).
Do ponto de vista nutricional, estudos prévios demonstraram, através de ensaios de digestibilidade in vitro, a elevada biodisponibilidade para os nossos organismos das proteínas provenientes de leguminosas (Monsoor e Yusuf, 2002), e ainda a grande riqueza em hidratos de carbono que possuem, a baixa percentagem de gordura e o seu contributo para a redução de alguns tipos de colesterol levando portanto a um incremento do interesse nestas culturas devido aos benefícios para a saúde pública (Duane, 1997; Arnoldi et al., 2014).
A grande quantidade de minerais e vitaminas como o ácido fólico e a vitamina B contida nos grãos de algumas leguminosas, bem como o alto valor nutritivo das suas sementes (Petterson 1998; El-Adawy et al., 2001; Badiane et al., 2014) leva ainda a que as leguminosas desempenhem cada vez mais um papel na melhoria das rações para produção de carne e leite de primeira qualidade (Boelt et al., 2015). As leguminosas, mais especificamente as leguminosas de grão, representam apenas 25% do que são plantadas relativamente aos cereais, apesar do seu crescimento mundial gradual desde os anos 70 até ao presente (Figura 1).
Na Europa, curiosamente, verifica-se o oposto, visto que desde 1961 a área cultivada decresceu de 5.8 milhões ha para 2.0 milhões ha em 2014 (FAOstat, 2016; Foyer et al., 2016).
3
Figura 1: Relações entre as mudanças na produção mundial e área plantada mundial dos cereais e leguminosas nos últimos 50 anos (adaptado de FAO 2016).
2.2. Grão-de-bico 2.2.1. Taxonomia
O grão-de-bico, Cicer arietinum L., pertence ao gênero Cicer, tribo Cicerae, família
Fabacae e subfamília Papilionoideae, e trata-se de uma planta anual herbácea que possui
características da classe das dicotiledóneas (Singh e Diwakar, 1995).
2.2.2. Origem e história
Apesar de alguma controvérsia na literatura, alguns autores começaram por admitir que o grão-de-bico teria dois centros de origem: um perto da Etiópia e outro no Mediterrâneo (De Candolle, 1883), no entanto esses dois centros de origem principais foram alterados, passando a ser um no Mediterrâneo e outro no sudoeste asiático, havendo um ponto de origem secundário acrescentado na Etiópia (Vavilov, 1926). A partir dos anos 70 foi dado um maior destaque a este assunto e vários investigadores afirmaram que a Turquia, mais concretamente a fronteira com a Síria, seria a sua origem (Van der Maesen, 1972), uma vez que foram encontrados vestígios de grão-de-bico datados de 5400 a.C. na Turquia (Helbaek, 1970; Zohary e Hopf, 1973), assumiu-se que esta cultura seria uma das primeiras leguminosas de grão a ser domesticada (Tanno e Willcox, 2006). O facto de também terem sido encontradas mais três espécies selvagens de Cicer muito semelhantes ao grão-de-bico nesta região, ajudou a corroborar esta ideia (Van der Maesen, 1987).
4
Com base no tamanho, forma e cor da semente, identificam-se dois grupos distintos de grão-de-bico, macrocarpa e microcarpa, que correspondem aos termos Kabuli e Desi, respetivamente (Cubero, 1975). O grupo Kabuli apresenta, geralmente, sementes maiores do que o grupo Desi, com formas redondas e cor creme. Já o grupo Desi apresenta sementes de menor tamanho, de forma angular e cor variada, sendo que as mais comuns são o preto, castanho e verde (Huntrods, 2013). Já no que concerne ao clima, o grupo Kabuli desenvolve-se mais em regiões temperadas enquanto o Desi prefere os trópicos desenvolve-semi-áridos (Malhotra et
al., 1987; Muehlbauer e Singh, 1987).
Trata-se de um alimento que faz parte da dieta tradicional asiática, mediterrânea, árabe, sul-americana e ainda africana (Phillips,1993; Geil e Anderson, 1994), especialmente nos países em desenvolvimento devido ao seu custo reduzido e alto valor proteico.
2.2.3. Situação nacional e mundial
No panorama mundial, desde o ano 2000 até 2014 houve um incremento praticamente constante da área plantada e produção total. Contudo de 2014 a 2016 houve um decréscimo em ambas como a seguir se apresenta (Figura 2). Somente a Ásia contribui aproximadamente com 87% da produção mundial.
No caso especifico de Portugal, desde 2014, a área de cultivo de grão-de-bico aumentou para o dobro (de 920 para 1782 ha em 2017), e quase que triplicou relativamente à produção (de 531 para 1325 toneladas), sendo que a região que mais contribui para a produção é o Alentejo (Figura 3) (INE, 2016).
Figura 2: Produção e área plantada mundial de grão-de-bico nos últimos 20 anos (adaptado de FAOSTAT, 2018).
5
Figura 3: Produção e área plantada nacional de grão-de-bico nos últimos 20 anos (adaptado de FAOSTAT, 2018).
2.2.4. Composição nutricional e fitoquímica
O grão-de-bico é um alimento cada vez mais valorizada a nível nutritivo devido a um bom equilíbrio de aminoácidos, uma alta biodisponibilidade proteica, valores altos em potássio, ferro, zinco, cálcio, magnésio, cobre e selénio, entre outros, sendo por isto considerado como uma fonte de minerais suficiente para satisfazer as necessidades humanas em minerais (Recommended Dietary Allowance) (Thavarajah, 2012).
Cerca de 87% da matéria seca do grão-de-bico é composta por hidratos de carbono (onde a grande maioria é amido), proteínas e o conteúdo lipídico, 6,04%, é comparativamente alto em relação às outras culturas de grão (Sanjeewa et al., 2010; Mittal et al., 2012).
Sendo um alimento de baixo índice glicémico, o potencial medicinal vai desde a redução do risco de diabetes, doenças cardiovasculares e alguns tipos de cancro, entre outros. No entanto, há que ter em conta os fatores antinutricionais, que são divididos em dois tipos: 1) fatores antinutricionais não proteicos que incluem alcalóides, taninos, ácido fítico, saponinas e fenóis, e 2) fatores antinutricionais proteicos que incluem inibidores da tripsina e da quimotripsina, lectinas e peptídeos antifúngicos (Roy et al., 2010; FAOSTAT, 2011).
O ácido fítico pode ligar-se a vários catiões divalentes importantes como o Fe, Zn, Ca e Mg, formando complexos insolúveis e tornando-os indisponíveis para a absorção e utilização no intestino delgado (Cheryan e Rackis, 1980; Van der Poel, 1990).
No caso dos taninos, estes inibem enzimas, reduzindo a digestibilidade e tornando o grão-de-bico adstringente. Por fim, as saponinas dão um sabor amargo, tornando-o menos apreciável para consumo humano e animal (Birk e Peri, 1980).
6
No caso específico do grão-de-bico, os fatores antinutricionais proteicos são de dois tipos: polipéptidos de cadeia única do tipo Kunitz, que inibem a actividade enzimática da tripsina mas não da quimotripsina (Muzquiz e Wood, 2007), e inibidores Bowman-Birk que também são polipeptídos de cadeia única que inibem a atividade enzimática tanto da tripsina como da quimotripsina (Smirnoff et al., 1976; Srinivasan et al., 2005; Guillamon et al., 2008).
Os inibidores de proteína interferem na digestão por via de uma ligação irreversível com a tripsina e a quimotripsina no trato digestivo humano, visto serem resistentes à enzima digestiva pepsina e ao pH ácido do estômago (García-Carreño, 1996), afetando assim negativamente as modificações enzimáticas necessárias para o processamento de alimentos, tais como a capacidade de retenção, formação de gel e capacidade de formação de espuma (Sandberg, 2002).
Para além dos elementos nutritivos presentes nas leguminosas, promotores da saúde humana, as propriedades fitoquímicas das mesmas prestam um grande contributo neste campo.
Os fitoquímicos são geralmente divididos em polifenóis, flavonóides, isoflavonas, antocianinas, fitoestrógenos, carotenóides, fitoesteróis, glucosinolatos, terpenóides, fito-hemaglutininas e limonóides entre outros, apresentando uma panóplia de propriedades biológicas extremamente úteis.
Nos fenóis, por exemplo, o grupo mais abundante de fitoquímicos nas leguminosas, são bem conhecidas as suas capacidades anti-inflamatórias, antioxidantes e antimicrobianas (Shahidi e Ambigaipalan, 2015).
No caso específico do grão-de-bico, existe uma grande variação da composição fitoquímica relativamente ao tipo de variedade e genótipo em questão se bem que existem componentes como o B-sitosterol (38.52 mg/100 g), que actua inibindo a assimilação intestinal do colesterol, as saponinas, isoflavonas (biochanina A e formonetina; (Dziedzic e Dick, 1982; Sharma, 1979), ácidos p-hidroxibenzóicos e gentísicos que estão presentes em maior número neste grão que na maior parte das restantes leguminosas.
Relativamente à variedade e tipo do grão, estudos anteriores já comprovaram que a composição dos flavonóides difere entre o grupo Desi e Kabuli, sendo que no primeiro, os flavonóides são compostos por glicósidos de luteolina, miricetina e quercetina e no segundo pinocembrina, quercetina, kaempferol e biochanina (Aguilera et al., 2011).
7
Quanto ao teor de compostos fenólicos totais é dependente dos genótipos, sendo que a maior quantidade de compostos fenólicos são encontrados nas linhas escuras como a Elmo (Segev et al., 2010, 2011), derivando isto não só da cor escura do tegumento como também a maior proporção de casca em sementes menores (Marathe et al., 2011).
No entanto, segundo a bibliografia, existem estudos contraditórios neste campo, como podemos ver no caso exposto por Kalogeropoulos et al. (2010) onde foram encontrados teores iguais de ácidos fenólicos e frações de flavonóides nas sementes de grão-de-bico enquanto Magalhães et al. (2017) verificou que os ácidos fenólicos predominaram largamente sobre os flavonóides em todos os casos.
2.2.5. Bactérias promotoras de crescimento de plantas 2.2.5.1. Microrganismos benéficos para as culturas
A Revolução Verde liderada por Norman Borlaug, considerado o pai da agricultura moderna, teve um impacto significativo na agricultura mundial. Através dela foi possível salvar milhares de vidas da fome, no entanto, os métodos utilizados para atingir esse objectivo não foram os mais correctos e deles surgiram problemas significativos para a agricultura e o ambiente, atuais e futuros (Shiva, 2016).
As imensas monoculturas de variedades de alto rendimento plantadas nessa época levaram a um aumento da incidência de pragas e doenças, que sendo tratadas com pesticidas em elevadas quantidades, reduziram também o número de organismos naturais capazes de as controlar. Por outro lado, o uso contínuo destes pesticidas, levou a um aumento da resistência dos organismos fitopatogénicos aos tratamentos, sendo, portanto, cada vez mais nocivos e poluentes para o planeta.
O uso de fertilizantes químicos levou a um aumento da salinidade do solo que consequentemente diminuiu a fertilidade do mesmo, e aumentou a poluição dos lençóis freáticos e respetiva eutrofização (Kumar et al., 2015; Ahmad et al., 2016; Parewa et al., 2014).
Para além disso, a utilização da irrigação industrial e da mecanização levou à erosão, diminuição do teor de nutrientes e compactação do solo (Prakash e Verma, 2016; Jaiswal et
al., 2016; Jha e Subramanian, 2016).
Sendo a saúde do solo essencial para produtividades elevadas em sistemas de produção sustentáveis (Meena et al., 2016), substituir/suplementar o uso de fertilizantes químicos e pesticidas por/com biofertilizantes e biopesticidas é uma das medidas mais
8
promissoras para manter/reestruturar a fertilidade do solo e aliviar vários stresses abióticos e bióticos de uma forma natural (Shakilabanu et al., 2012).
Os biofertilizantes são compostos principalmente por microrganismos denominados de rizobacterias/bactérias promotoras de crescimento das plantas (PGPR), sendo estes de origem fúngica ou bacteriana e actuando numa grande diversidade de funções químicas, biológicas e culturais (Fuentes-Ramirez e Caballero-Mellado, 2005).
Os microrganismos promotores do crescimento de plantas são bactérias do solo que colonizam a rizosfera e aumentam o crescimento das plantas quando inoculadas artificialmente no solo ou nas sementes. Os PGPR podem, directa ou indirectamente, influenciar o crescimento das plantas através de vários mecanismos que incluem a fixação do azoto atmosférico, solubilização de minerais, síntese de várias enzimas e fito-hormonas e inibição de fitopatógeneos, entre outros (Gopalakrishnan et al., 2015b).
Diferentes grupos funcionais e taxonómicos de microrganismos têm características para serem promotores de crescimento. Estes incluem bactérias livres, tais como
Pseudomonas, Erwinia, Caulobacter, Serratia, Arthrobacter, Micrococcus, Flavobacterium, Chromobacterium, Hyphomicrobium e ainda bactérias fixadoras de N2 simbióticas, tais como Rhizobium, Burkholderia, Bradyrhizobium, Sinorhizobium, Azorhizobium, Mesorhizobium e Allorhizobium (Vessey, 2003).
Bactérias do género Mesorhizobium, caracterizam-se por uma elevada diversidade de espécies com diversas formas de organização dos seus genomas. Associado à grande variedade de possíveis hospedeiros e à sua elevada distribuição mundial, permite eleger este género como um excelente modelo no estudo da evolução das capacidades simbióticas dos rizóbios (Laranjo et al., 2014). Através do estudo dos seus genes de simbiose, como os genes de nodulação (nod) e os genes responsáveis pela fixação do azoto (nif e fix), existe a possibilidade de aumentar os conhecimentos nesta área e a capacidade de obtenção de inóculos comerciais otimizados.
A maioria das PGPR testadas são rizobactérias, no entanto as bactérias endofíticas são um grupo que também possui potencial na promoção do crescimento. As bactérias endofíticas caracterizam-se por colonizar o tecido interno da planta, não apresentando sinais externos de infeção ou efeitos negativos no seu hospedeiro. As bactérias endofíticas exercem vários efeitos benéficos sobre as plantas hospedeiras, como a estimulação da promoção do crescimento e a proteção contra doenças, entre outros (Saini et al., 2015).
9
Um grande número de bactérias endofíticas não-rizobiais e rizobiais foi isolado de diferentes leguminosas recentemente, particularmente de tecidos de raízes e nódulos e inclui:
Agrobacterium, Bacillus, Curtobacterium, Enterobacter, Herbaspirillum, Mycobacterium, Paenibacillus, Phyllobacterium, Ochrobactrum, Sphingomonas, Ensifer, Burkholderia, Phyllobacterium e Devosia (Dudeja et al., 2012).
Apesar de o grão-de-bico ter sido anteriormente considerado como um hospedeiro restritivo para a nodulação (Raju, 1936), rizóbios capazes de nodular esta espécie foram descritos, pela primeira vez, por Cadahía et al. (1986), sendo que posteriormente Jarvis et al. (1997) incluíram-nos no género Mesorhizobium. Duas espécies foram identificadas pela primeira vez como simbiontes específicos do grão-de-bico: Mesorhizobium ciceri e
Mesorhizobium mediterraneum por Nour et al. (1994a, 1994b, 1995).
Mais recentemente, variados estudos mostraram que diversas espécies de
Mesorhizobium podem efetivamente nodular o grão-de-bico (Laranjo et al., 2004; Rivas et al.,
2007). Atualmente existem várias espécies conhecidas de Mesorhizobium capazes de estabelecer associação com o grão-de-bico: M. amorphae (Rivas et al., 2007), M. huakuii (Alexandre et al., 2009), M. loti (Laranjo et al., 2008), M. muleiense (Zhang et al., 2012), M.
opportunistum (Laranjo et al., 2012) e M. tianshanense (Rivas et al., 2007). Brígido et al.
(2017) verificaram ainda, que a maioria dos isolados de Mesorhizobium do grão-de-bico possuem duas ou mais características promotoras do crescimento das plantas, sendo a produção de ácido indolacético e de sideróforos os mecanismos mais comuns.
Em Portugal, três Mesorrizóbios do grão-de-bico, foram isolados e posteriormente caracterizados, V-15b-Viseu, PMI-6-Portimão e ST-2-Setúbal, com vantagens produtivas associadas (Da Silva et al., 2019).
Para além das espécies do género Mesorhizobium, várias espécies de Rhizobium,
Agrobacterium e Bradyrhizobium demonstraram ter a capacidade para fixar azoto através da
nodulação com grão-de-bico (Maatallah et al.,2002 e Bhattacharjee et al.,2008).
Joseph et al. (2007) concluíram ainda que a população de Pseudomonas sp. (1.1-2.1 X 106
cfu/g de solo) está bastante presente na rizosfera do grão-de-bico. Gopalakrishnan et al. (2015) verificaram que 5 estirpes de Streptomyces sp. promoveram aumentos no número de nódulos, peso dos nódulos, peso da raiz e peso da parte aérea, 30 dias após a sementeira (DAS), e no número de vagens, peso da vagem, área foliar, peso foliar e peso do caule aos 60 DAS.
10
É de referir ainda que, Siddiqui e Mahmood (2001) demonstraram que a aplicação combinada de uma rizobacteria P. fluorescens com o fungo micorrízico arbuscular Glomus
mosseae levou a melhorias no rendimento cultural e no combate ao nemátodo patogénico Meliodogyne javanica.
Manjunatha et al. (2011) e Deepa et al. (2018) demonstraram também, que o fungo
Trichoderma harzianum e a bactéria Pseudomonas fluorescens foram eficazes no controlo da
podridão da raiz no grão-de-bico.
Uma bactéria, isolada de nódulos de grão-de-bico, designada IC-76, foi avaliada relativamente ao seu potencial na promoção de crescimento da planta, em estufa, individualmente e em combinação com cinco estirpes de Streptomyces sp. (CAI-24, CAI-121, CAI-127, KAI32 e KAI-90) demonstradas anteriormente como agentes de biocontrolo contra
Fusarium no grão-de-bico. As características, que incluíam, número e peso dos nódulos, peso
da raiz, número e peso das vagens, número e peso das sementes e fósforo disponível, foram significativamente maiores em relação ao controlo não inoculado em ambos os casos (Gopalakrishnan et al., 2018).
A prática melhorada de inoculação de sementes de grão-de-bico com rizóbios por si só, foi eficaz, traduzindo-se num aumento de 12,9% no rendimento do grão-de-bico (Singh e Asthana, 1999), e as inoculações combinadas de rizóbios fixadores de N2, solubilizadores de
fosfato e fungos micorrízicos arbusculares (FMA), isto é, Rhizobium sp. Pseudomonas striata e Glomus fasciculatum, no trabalho supracitado, melhoraram a nodulação, absorção de nutrientes e rendimento cultural do grão-de-bico sendo estatisticamente superiores ao controle, a inoculação simples, dupla ou tripla com Pseudomonas striata.
2.2.5.2. Fixação biológica do azoto
O azoto (N) foi descoberto pelo cientista Daniel Ratherford em 1772, e trata-se de um elemento essencial para todos os organismos, devido a ser parte componente de aminoácidos, ácidos nucleicos e da clorofila, entre outros, estando, portanto, altamente ligado à taxa fotossintética e consequentemente ao crescimento e desenvolvimento das plantas (Ohyama, 2010). A sua função mais importante está relacionada com a sua participação na constituição das proteínas, mas também na formação de compostos indispensáveis às plantas, como purinas, pirimidinas, pafininas e coenzimas (Verísssimo, 2008).
Dentro de todos os nutrientes fornecidos pelo solo, o azoto é o que as plantas necessitam em maior quantidade, variando a sua concentração nas plantas de 1.0 a 5.0%
11
(Quelha dos Santos, 1996) sendo esta concentração nos solos também relativamente pequena. Isto leva a que se trate de um elemento limitante para o desenvolvimento natural das plantas ou para o aproveitamento agrícola ótimo de diversas culturas. No entanto, elevados conteúdos de azoto nas folhas alteram a composição das plantas e atraem ainda uma grande variedade de insetos (Engels e Marschner, 1995).
O azoto, tal como todos os outros elementos biologicamente importantes está sujeito a transformações cíclicas, de modo que pode ser utilizado e restituído, constituindo-se assim, o ciclo do azoto, através do qual um átomo de azoto passa do estado orgânico ao inorgânico e vice-versa, numa sequência de processos que implicam a participação de organismos vivos e conversões químicas. Segundo Militão, (2004), o ciclo do azoto compreende um conjunto de transformações que se processam em várias etapas, de entre as quais se destacam: a) formação de azoto inorgânico, como amoníaco, nitrito e nitrato, a partir de azoto orgânico resultante da decomposição de organismos e das suas excreções, através da mineralização; b) o azoto inorgânico pode ser absorvido por plantas e microrganismos e voltar a entrar na composição da matéria viva podendo assim circular, de novo na cadeia alimentar; c) o azoto inorgânico pode ser transformado em azoto molecular e óxidos de azoto que se libertam para a atmosfera, através da desnitrificação; d) o azoto molecular atmosférico (N2) pode passar para a forma
combinada através da fixação.
A mineralização inclui dois processos: a amonificação e a nitrificação (Militão, 2004), A amonificação consiste na formação de compostos amoniacais e é realizada por microrganismos heterotróficos entre os quais se destacam muitas bactérias e fungos. A nitrificação é a oxidação da amónio (NH4+) a nitrato (NO3-) em duas fases realizadas por dois
géneros de bactérias obtendo assim, a energia necessária para o seu crescimento.
A nitrificação nos solos dá-se com relativa rapidez, no entanto, o nitrato constitui a principal fonte de azoto para a maioria das plantas. É importante salientar que enquanto a amónio é facilmente retida no solo, o mesmo não acontece com o nitrato, que é facilmente lixiviado para zonas inacessíveis ao sistema radicular das plantas, em condições de forte pluviosidade e de solo permeável. Estas perdas de azoto para as plantas podem atingir, em climas mediterrânicos, no período das chuvas de inverno cerca de 50% (Varennes, 2003).
Segundo Havlin et al. (2014), o azoto é obtido pela planta através de duas fontes principais: o solo, cuja origem pode derivar de fertilizantes comerciais, adubos verdes, e da mineralização da matéria orgânica; ou então da atmosfera, via fixação biológica de N2.
12
A forma predominante do azoto, sendo o sétimo elemento mais abundante na terra, é a gasosa (que constitui sensivelmente 78% da atmosfera terrestre). Esta forma de N é relativamente inerte, garantindo portanto, a sua conversão para formas disponíveis para diferentes organismos e plantas (Carroll e Salt, 2004; Sergei, 2012).
Visto isto, a necessidade de fixar o azoto no solo de forma a estar disponível para as plantas é crucial, sendo as bactérias fixadoras de azoto, descobertas em 1901 por Beijerinck, o mecanismo mais viável para a fixação biológica do azoto (FBA), realizada por grupos específicos de procariontes e responsáveis por cerca de 65 % da fixação anual de azoto, segundo Hungria et al. (2001). De acordo com Mayz-Figueroa (2004), entre os microrganismos envolvidos na FBA encontram-se bactérias, cianobactérias e actinobactérias. Podem fixar azoto vivendo de forma livre, formando associações ou vivendo em simbiose com plantas hospedeiras. Todos estes microrganismos têm como característica comum a capacidade de converter N2, mas diferem na fisiologia, metabolismo e características
genéticas.
Estes organismos utilizam o complexo enzimático nitrogenase para catalisar a conversão de azoto atmosférico em amoníaco (NH3), ficando este, assimilável para as plantas
(Wagner, 2011). Estes microrganismos são largamente utilizados para a preparação de biofertilizantes, sendo assim um fertilizante “vivo” composto por inóculos microbianos (Gupta, 2004). Para o estabelecimento da relação simbiótica é necessário que ocorram diversas etapas: i) multiplicação das bactérias na rizosfera; ii) colonização da rizosfera; iii) entrada das bactérias na raiz; iv) enrolamento dos pêlos radiculares (ocorre nas raízes quando a infeção acontece via pelos radiculares, em alguns casos a infeção ocorre através das raízes laterais ou raiz principal); v) formação dos canais ou de zonas intercelulares de infeção; vi) crescimento do canal de infeção até às células corticais ou invasão direta das mesmas; e vii) diferenciação celular em bacteróides e desenvolvimento do nódulo segundo Mayz-Figueroa (2004). De acordo com o mesmo autor, o tipo e estrutura nodular é dependente da planta hospedeira.
A simbiose Leguminosas-Rizóbios inicia-se com um diálogo molecular entre os parceiros da associação. Em primeiro lugar a leguminosa segrega um conjunto de compostos fenólicos, predominantemente flavonóides e isoflavonóides na rizosfera, que de seguida são captados pelo rizóbio, ligando-se ao regulador transcricional NodD e ativando um conjunto de genes de nodulação bacteriana (Long, 1996). Estes genes são os responsáveis pela produção de oligossacarídeos lipoquitínicos chamados fatores Nod. Estes fatores são sinais simbióticos
13
chave, indispensáveis na interação específica entre hospedeiro-rizóbio e em etapas posteriores do processo de infeção e organogénese do nódulo como referido por Oldroyd e Downie, (2008).
No entanto, o grau de especificidade entre leguminosas e rizóbios varia. Por exemplo, embora os fatores de Nod produzidos por Rhizobium etli e Rhizobium loti sejam idênticos, as duas espécies possuem intervalos de hospedeiros distintos (Cárdenas et al., 1995).
Existem grandes diferenças na morfologia e fisiologia de todos organismos fixadores de azoto, mas o processo que se leva a cabo nestes organismos executado pelo complexo enzimático nitrogenase é similar para todos (Fernández-Pascual et al., 2002). Segundo Pope
et al. (1985) e Lowery et al. (1986), o complexo enzimático nitrogenase é responsável pela
redução da molécula de N2 a NH3, sendo também capaz de reduzir o acetileno a etileno
(Ludden, 2001). Segundo Lowery et al. (1986) e Ludden, (2001), o complexo nitrogenase é composto por duas proteínas: a dinitrogenase redutase (Fe-proteina) que é constituída por ferro e enxofre, e a dinitrogenase (FeMo-proteina) que contém 24 átomos de ferro e 2 átomos de molibdeno. Segundo Lowery et al. (1986), a reação em que se forma o amoníaco consome no mínimo 16 moléculas de ATP por cada molécula de N2 reduzido, no entanto Ludden
(2001), estima que 20 a 30 moléculas de ATP são hidrolisadas por cada molécula de N2
reduzido. Soto-Urzúa e Baca (2001), afirmam que a atividade da nitrogenase é gravemente inibida pelo O2, sendo que concentrações elevadas deste elemento poderão causar danos
irreversíveis à enzima. De modo a colmatar esta adversidade, os microrganismos fixadores de azoto desenvolveram um conjunto de estratégias como: i) saída de O2 e crescimento em
ambientes anaeróbios, ii) criação de barreiras físicas de proteção, iii) eliminação do O2 pelo
metabolismo reduzindo a sua concentração para níveis aceitáveis no complexo enzimático, iv) alteração da nitrogenase, de modo a resistir à inativação, e v) síntese contínua da nitrogenase alterando o equilíbrio entre a inativação e a síntese (Soto-Urzúa e Baca, 2001).
Os rizóbios formam nódulos nas raízes das leguminosas, onde se processa a fixação de azoto atmosférico. Espindola et al. (2005) referem que o azoto fixado é transferido para as leguminosas na forma de aminoácidos, enquanto hidratos de carbono produzidos pelas plantas são fornecidos às bactérias, servindo de fonte energética. A quantidade de azoto fixado por leguminosas varia em função das espécies e das condições edafoclimáticas em questão, sendo que, em alguns casos as quantidades fixadas podem ser superiores a 100 kg de N/ha (Espindola et al., 1997). A fixação biológica do azoto oferece benefícios económicos, sociais e ambientais como a redução de emissão de gases promotores do efeito de estufa; menor uso
14
de combustíveis fósseis utilizados para a produção de fertilizantes azotados; menor perda de nutrientes e menor contaminação de rios e lençóis freáticos; diminuição dos problemas associados à lixiviação, escoamento e erosão; melhoria das condições do solo com o aumento da massa verde assegurando a manutenção da biodiversidade e ainda a diminuição dos custos de produção pela redução do uso de fertilizantes azotados (Embrapa, 2016).
2.2.5.3. Bactérias solubilizadoras de fósforo
A palavra fósforo (P) tem origem grega, significando “phos” luz e “phorus” o verbo trazer, e foi descoberto por Brandt em 1669. Desde então, a sua importância tem aumentado, sendo o nutriente mais aplicado após o azoto, e considerado crucial para o crescimento e desenvolvimento das plantas e para diversos processos bioquímicos, estando estes aspetos intrinsecamente ligados.
Trata-se de um elemento que na natureza constitui cerca de 0,12% da crosta terrestre (Van Wazer 1958) e existe sob a forma de rochas que são insolúveis para as plantas, cerca de 95 a 99% do P perde-se devido à fixação do mesmo que ou é precipitado pelos minerais do solo ou adsorvido pelos hidróxidos de Al3+ e Fe3+ (Sharma et al., 2013), ficando o solo com uma percentagem mínima disponível para as plantas, que se estima que corresponda a sensivelmente 0,013 – 0,155% do P existente. Mitran e Mani (2017), consideram que as fontes nativas do P no solo, minerais primários de P (apatite) e minerais secundários de argila como o cálcio (Ca), ferro (Fe) e Al-fosfatos, desempenham um papel significativo na acumulação do P disponível no solo por processos de dissolução e dessorção.
Outro fator preocupante é, caso o P seja aplicado no solo através de fertilizantes ou de adubo orgânico, sofre várias reações bioquímicas que removem iões de fosfato da solução do solo (Kruse et al., 2015), sendo que apenas 15-30% do fertilizante aplicado é absorvido pelas culturas no ano da sua aplicação (Swarup, 2002; Syers et al., 2008). Porém, é um elemento que é facilmente translocado na planta passando de tecidos mais velhos para mais novos (Williamson et al., 2001).
No solo, formas orgânicas de fosfatos como biomassa viva do solo, matéria orgânica do solo (MOS) e P orgânico solúvel (SOP) podem ser disponibilizados às plantas por bactérias que decompõem a matéria orgânica (MO) para formas inorgânicas de P (Pi); processo este denominado por mineralização (Meena et al., 2018).
O mecanismo de captação pelo qual as plantas adquirem diretamente Pi do ambiente do solo, é realizado pela epiderme da raiz e respetivos pelos radiculares, sendo definida como
15
a via de absorção direta (DPU), e o mecanismo onde Pi é obtido da solução do solo por associações micorrízicas arbusculares é definida como a via de absorção micorrízica de Pi (MPU) (Bucher, 2007; Smith e Smith, 2011).
Como já referido anteriormente, a solução presente no solo (H2PO4− e HPO42-) pode
ser imobilizada em P orgânico ou adsorvida na superfície das partículas do solo e associada a partículas amorfas como óxidos de Al e Fe, tornando-se indisponíveis para as plantas (Ohel et
al., 2004). No entanto, existem vários mecanismos pelos quais as leguminosas podem
adaptar-se à baixa disponibilidade de P, seja ativando o ião de alta afinidade de ortofosfato ou libertando ácidos orgânicos que solubilizam a ligação de P ao Ca pela libertação de enzimas fosfatadas para hidrolisar compostos orgânicos de P (George et al., 2011; Richardson et al., 2011).
A libertação destes ácidos orgânicos é realizada através de exsudados radiculares e depende das concentrações de pH e P do solo, isto é, será maior quanto menor a concentração de P no solo e depende da espécie de leguminosa cultivada (Egle et al., 2003).
A deficiência de fósforo (P) no solo tem ainda um impacto adverso na relação simbiótica entre as leguminosas e as bactérias, visto uma certa quantidade de P ser necessária para realizar a fixação biológica de azoto (Rotaru e Sinclair, 2009; Udvardi e Poole, 2013; Yadav et al., 2017). Ainda, restrições ao nível da concentração de P diminuem diretamente a fotossíntese através dos efeitos negativos no crescimento vegetativo das culturas, desenvolvimento da área foliar e capacidade fotossintética por unidade de área foliar (Vance
et al., 2003; Sulieman et al., 2013), como ainda a absorção e distribuição de nutrientes entre
os rebentos da planta e o sistema radicular (Zhang et al., 2014). Além disso, desempenha um papel importante no alongamento e no desenvolvimento da raiz e a sua deficiência afeta a arquitetura da raiz e o desenvolvimento de sementes (Williamson et al., 2001).
O P é componente vital da adenosina difosfato (ADP) e da adenosina trifosfato (ATP) (Cabeza et al., 2014a, b; Nesme et al., 2014), envolvidos em processos das leguminosas como a respiração, fotossíntese, síntese de ácidos nucleicos e proteínas, e também na formação celular através do transporte de nutrientes (Nesme et al., 2014; Meena et al., 2014). O ATP formado durante a fotossíntese possui P na sua composição desde o início do crescimento das plântulas até a formação dos grãos e respetiva maturação (Nesme et al., 2014).
Estes fatores demonstram a importância que este nutriente possui ao nível do rendimento cultural, entre outros, e a necessidade existente em encontrar soluções alternativas viáveis, sendo que neste campo, hoje em dia, é fundamental identificar as bactérias
16
solubilizadoras de fósforo (PSB, do inglês phosphorous solubilizing bacteria) como a aposta com maior potencial, visto serem mais eficientes do que os fungos para este efeito (Alam et
al., 2002).
Portanto, o uso de PSB na produção das culturas não só diminuiria o alto custo do fabrico e uso de fertilizantes fosfatados, mas também solubilizaria fertilizantes químicos insolúveis que são aplicados no solo (Chang e Yang, 2009; Banerjee et al., 2010).
As leguminosas são colonizadas por bactérias solubilizadoras de fósforo capazes de aceder ao P disponível dentro da zona rizosférica (Morel e Plenchette, 1994; Meena et al., 2018) e que tem como função solubilizar fósforo inorgânico através da síntese de ácidos orgânicos de baixo peso molecular presentes no solo, como o ácido glicólico e cítrico, pela mineralização do P orgânico através da síntese de uma variedade de diferentes fosfatases, catalizando a hidrólise de ésteres fosfóricos, sendo que, mais importante ainda, tanto a solubilização quanto a mineralização de fosforo podem coexistir na mesma espécie bacteriana (Yasin et al., 2016; Saha et al., 2016). As PSB são consideradas como promissores biofertilizantes, pois podem fornecer às plantas P de fontes de outra forma não disponíveis por variados mecanismos (Zaidi et al., 2009). Exemplos de géneros de bactérias boas solubilizadoras de P são Azotobacter, Bacillus, Beijerinckia, Burkholderia, Enterobacter,
Erwinia, Flavobacterium, Microbacterium, Pseudomonas, Rhizobium e Serratia (Bhattacharyya e Jha, 2012).
2.2.5.4. Desenvolvimento e utilização de inóculos de microrganismos benéficos
O grande interesse da utilização de microrganismos como biofertilizantes existe especialmente em zonas com disponibilidade de nutrientes abaixo dos limites necessários para as culturas, onde estes se encontrem sob formas indisponíveis, ou então como método de reduzir as aplicações de fertilizantes minerais, aumentando a eficiência de uso dos nutrientes já presentes no solo ou aplicados sob formas orgânicas ou inorgânicas insolúveis (Tripura et
al., 2005).
A inoculação é um recurso à colmatação destas necessidades. Neste processo ocorre uma incorporação de organismos benéficos ao solo e às culturas, que irá desencadear competição com a população microbiana já existente, levando a que a taxa de sucesso da inoculação possa ser reduzida. Atualmente o tipo de inóculo comercializado em maior quantidade são rizóbios para leguminosas, de modo a aumentarem a quantidade de azoto fixado a partir da atmosfera (Plaster, 2008).
17
São três as características fundamentais e essenciais para todos os inóculos: apoiar o crescimento dos microrganismos, suportar o número necessário de células microbianas viáveis em boas condições fisiológicas por um período de tempo aceitável (Stephens e Rask, 2000), e fornecer microrganismos suficientes no momento da inoculação para alcançar o número limite de bactérias que é necessário para obter uma resposta da planta, ou seja, o inóculo deve conter bactérias viáveis suficientes mesmo após o processo de formulação (Bashan et al., 2013).
Os fatores que podem influenciar a eficácia dos inóculos são os relacionados com a maior probabilidade de sobrevivência dos microrganismos na semente como: fase de crescimento (logarítmica ou estacionária) no momento da mistura de culturas bacterianas num substrato de suporte, porque estas influenciam a incorporação no inoculo de células muito ativas, esporos, cistos, ou células floculadas de várias espécies de PGPR (Bashan, 1998), taxa de secagem e re-hidratação, características apropriadas do material de suporte e da tecnologia de inoculação empregue (Date, 2001).
Os principais fatores bióticos que afectam a sobrevivência dos microrganismos inoculados inclui a sua sobrevivência ao meio, competição entre estes e os do solo, predação e desenvolvimento das raízes e da taxa de libertação de exudados, que são a fonte alimentar destes seres. Os fatores abióticos incluem a textura, pH, temperatura, humidade e disponibilidade de alimento no solo (Gyaneshwar et al., 2002).
Quanto aos substratos de suporte para inóculos estes podem ser divididos em cinco categorias básicas: solo: 1) turfa, carvão, argilas e solos inorgânicos; 2) resíduos de plantas de diversas origens industriais e agrícolas; 3) materiais inertes: polímeros, fragmentos de rocha tratados, como vermiculite e perlite; 4) culturas microbianas liofilizadas; e 5) inóculos líquidos, onde alguma substância química foi adicionada para o meio líquido contendo os microrganismos para melhorar a aderência, estabilização, função e dispersão (Bashan, 1998)
18 CAPÍTULO III – MATERIAL E MÉTODOS
3.1. Isolamento de bactérias 3.1.1. Culturas armadilha
Com o objetivo de isolar microrganismos benéficos que promovam o crescimento de plantas em solos com diferentes condições edafoclimáticas e com precedentes culturais de leguminosas, utilizou-se o método de cultura armadilha. Este método consiste na colocação de sementes, da cultura em estudo, em vasos que contêm os solos escolhidos, para verificar a ocorrência ou não ocorrência da formação de nódulos (Figura 4).
Os solos escolhidos foram recolhidos em Vila Real (41°18'29.8"N 7°44'33.2"W), Barbacena (38°57'40.6"N 7°17'48.0"W), Arronches (39°08'00.3"N 7°16'42.2"W), Elvas (38°52'54.2"N 7°09'38.2"W), Mirandela (41°29'19.5"N 7°10'50.2"W), Alijó (41°16'57.7"N 7°28'36.3"W) e Cabanões (40°07'49.8"N 8°10'55.6"W). As sementes de grão-de-bico foram previamente esterilizadas através de uma imersão das mesmas numa solução de 1,5% de hipoclorito de sódio durante 10 minutos, seguida de uma lavagem em 70% de etanol e sucessivas lavagens por água destilada esterilizada.
19 3.1.2. Nódulos de plantas leguminosas
Após o desenvolvimento do grão-de-bico em culturas armadilha, procedeu-se à extração e isolamento dos nódulos recolhidos das mesmas. Para tal é necessário começar pela recolha das plantas das culturas armadilhas, para observar nas raízes a presença ou ausência de nódulos como podemos verificar na figura 5. Na presença de nódulos é efetuada a respetiva recolha. Previamente foi preparado o meio de cultura YMA (Yeast Mannitol Agar), cuja composição é de 1g de extrato de levedura, 15 g de agar, 0,2g de MgSO4.7H2O, 0,5g de
K2HPO4, 10 g de Manitol, 0,1g de NaCl para um litro de água destilada. O meio foi
autoclavado a 121ºC, durante 15 minutos.
Seguidamente, o meio foi suplementado com 10 mL vermelho do congo (CR) ou 5 mL de corante azul bromotimol (BTB) através de uma filtração. Estes meios são denominados de diferenciais, visto possibilitarem a distinção de baterias, através da absorção/não absorção do corante do meio (YMA+CR) ou através da alcalinização/acidificação (YMA+BTB).
Figura 5: Planta de grão-de-bico retirada de cultura armadilha e respetivas raízes noduladas.
Para finalizar a preparação dos meios foi apenas necessário distribuí-los em placas de Petri estéreis, deixar arrefecer e solidificar, e acondicioná-las no frigorífico. Após a preparação dos meios foi efetuada a remoção dos nódulos das raízes e posterior desinfeção, remoção esta que foi realizada com 0,5 cm de raiz para cada lado para evitar possíveis perfurações e consequentes contaminações dos nódulos.
20
A desinfeção foi realizada numa câmara de fluxo laminar na seguinte ordem: 60 segundos numa solução de etanol a 70%, 90 segundos numa solução de hipoclorito de sódio 3-5% (v/v) e 5 lavagens sucessivas em água destilada e esterilizada.
De seguida efetuou-se o esmagamento dos nódulos no meio YMA+CR recorrendo a varetas de vidro previamente esterilizadas. Os isolamentos ficaram aproximadamente 4 dias numa estufa de crescimento a 28ºC (Panasonic MIR-262) e foram sucessivamente repicados para o meio YMA+BTB (Figura 6), até obtenção de culturas puras.
3.1.3. Avaliação da capacidade infetiva
Para confirmar a presença de rizóbios nas culturas puras obtidas anteriormente recorreu-se aos critérios formulados por Robert Koch na década de 1880 – postulados de Koch. Segundo estes postulados, o microrganismo presente nas lesões das plantas pode ser isolado e cultivado em cultura pura e reproduzir os sintomas quando inoculado em planta sadia. Por último, deve ser re-isolado da planta inoculada artificialmente e corresponder, em todas as suas características, com o isolado inicial.
Para o caso concreto dos rizóbios, procedeu-se à preparação de tubos com vermiculite e perlite (1:1, v/v) e 30 mL de solução de nutrientes sem azoto (1g de CaHPO4, 0,2g de
K2HPO4, 0,2g de MgSO4.7H20, 0,1g de FeCL3.6H2O, 0,2g de NaCl, 1,0 mL de uma solução
de micronutrientes e 9,0 g de agar),seguindo o protocolo de Somasegaran e Hoben, 2012, que posteriormente foram autoclavados a 121°C durante 15 minutos. Seguidamente as sementes previamente selecionadas, esterilizadas superficialmente e germinadas foram transferidas para os tubos em questão. Deve-se enrolar folha de alumínio na parte exterior e inferior dos tubos para proteger as raízes da luz e calor como verificamos na figura 7. Seis dias após a
21
germinação foi dispersado na área ao redor da raiz o inóculo juntamente com 1 mL de NaCl (evita o rebentamento das células da bactéria por diferença osmótica).
A eficácia do inóculo foi verificada 4 a 5 semanas depois, a partir da presença de nódulos, que abertos, apresentaram uma coloração vermelha/rosa (Figura 7).
Figura 7: Planta de grão-de-bico inoculada in vitro e raiz nodulada.
3.1.4. Solubilização de fósforo
A solubilização do fósforo foi aferida através de um ensaio de placas usando o meio de crescimento de fósforo do Instituto nacional de investigação botânica (NBRIP) (Nautiyal, 1999) suplementado com 0,025g/L de azul de bromotimol (Metha e Nautiyal 2001). Este meio contém 5g/L de fosfatos insolúveis minerais - Ca3(PO4)2 (também denominado de TCP)
ou AlPO4-, tricálcio fosfato e fosfato de alumínio respetivamente, como única fonte de P, e foi
ajustado para pH=7.0 antes da autoclavagem.
As bactérias em estudo foram repicadas para as extremidades da placa e incubadas a 28ºC durante 3 dias. A atividade da bactéria solubilizadora de fósforo foi detetada aquando da formação de um halo distinguível em torno das colónias, como se pode observar na figura 8.
22
Figura 8: Teste de solubilização de fósforo (TCP) e respetivos halos. 3.1.5. Identificação molecular das bactérias
3.1.5.1. Extração de DNA
A extração do DNA foi adaptada para as bactérias em estudo, com base no método de Sikora et al (2002). Sucintamente, uma porção de bactérias retiradas de uma colónia foi colocada num eppendorf com 250 µl de tampão de lise - CTAB (brometo de cetiltrimetilamónio) e esferas esterilizadas de 1mm. A amostra foi incubada a 65 °C durante cerca de uma hora. Seguidamente, o eppendorf foi agitado no FastPrep, a uma velocidade de 6,5 durante 40 segundos, sendo esta ação repetida três vezes. Posteriormente, foram adicionados 600 µl de clorofórmio e álcool isoamílico. Depois o eppendorf foi gentilmente invertido até formação de emulsão e brevemente agitado no Vortex. A amostra foi mantida a 4 °C durante 30 minutos. Após estas etapas, a amostra foi centrifugada a 13000 rpm durante 10 minutos.
Recolheu-se o sobrenadante para um novo eppendorf de 2 mL e foram adicionados 250 µl de NH4Ac 5M. A amostra foi mantida a -20 °C, durante 30 minutos. Posteriormente
foi adicionado 600 µl de isopropanol frio à amostra, que foi submetida novamente a uma temperatura de -20 °C, pelo menos durante 1 hora.
A amostra foi centrifugada a 13000 rpm durante 20 minutos, a uma temperatura de 4 °C, sendo posteriormente removido o sobrenadante. O pellet foi ressuspenso em 200 µl de etanol frio a 70%. Uma nova centrifugação foi efetuada a 7000 rpm durante 5 minutos, a uma temperatura de 4 °C. Depois desta fase, o sobrenadante foi descartado e o restante etanol evaporado mantendo-se a amostra aberta no interior da câmara de fluxo laminar durante algumas horas. Posteriormente, foram adicionados 20 µl de água ultra pura esterilizada. A
23
concentração de DNA extraído foi estimada por espectrofotometria, através da leitura e registo da respetiva absorvância a 260 e 280 nm. De acordo com as concentrações obtidas foram efetuadas as respetivas diluições.
3.1.5.2. Amplificação da região 16S rDNA por PCR
Após a extração do DNA, os primers universais fD1 (5' AGAGTTTGATCCTGG CTCAG 3') e rD1 (5' AAG GAG GTG ATC CAG CC 3') foram utilizados para amplificar a região do gene 16S rDNA (1 500 pb) (Weisburg et al., 1991). A amplificação ocorreu num volume de reação total de 20 µl contendo: 8 µl da diluição DNA da bactéria, 1 µl de cada primer forward e reverse e 10 µl de Master Mix.
As condições da reação PCR foram as seguintes: 3 minutos a 96 °C, seguido de 30 ciclos a 94 °C durante 45 segundos (desnaturação), 56 °C durante 45 segundos (hibridação dos primers), 72 °C durante 45 segundos (extensão) e por fim 7 minutos a 72 °C (extensão final).
As reações foram realizadas num termociclador (BIO-RAD T100) e os produtos de PCR foram separados em gel de agarose a 1% utilizando o corante RedSafe para a visualização dos fragmentos do DNA. Este corante intercala-se com o DNA e emite fluorescência quando exposto à luz ultravioleta (UV).
3.1.5.3. Electroforese em gel de agarose do produto PCR
Procedeu-se à preparação de um novo gel de agarose, desta vez para a confirmação do sucesso da amplificação. O gel foi preparado dissolvendo 1 g de agarose em 100 mL de tampão TBE, que foi ao microondas durante 2 minutos. Posteriormente deixou-se arrefecer um pouco e adicionou-se 1 µL do corante RedSafe, Utilizando o suporte, verteu-se o gel, colocou-se o pente para marcação dos poços e ficou a solidificar. Assim que o gel solidificou, o pente foi retirado e o gel transferido para a tina de electroforese (POWER PAC 300, da BIO RAD), onde cada poço foi carregado com 3µL do produto PCR previamente misturado com 3 µL de corante Loading Buffer. A corrida eletroforética (Figura9) foi realizada a 90V durante cerca de 40 minutos. Os resultados foram analisados no equipamento de aquisição de imagem Gel DOc EZ Imager, da BIO RAD, para observação da presença de uma banda em cada amostra. As amostras nas quais foi possível observar uma banda, foram enviadas para sequenciação.
24
Figura 9: Bandas obtidas através da eletroforese em gel de agarose.
3.1.5.4. Análise de sequências
As amostras foram sequenciadas pela empresa STABVIDA e as sequências obtidas foram editadas com recurso a ferramentas bioinformáticas, nomeadamente o MEGA 6.0 e BioEdit. As identidades das amostras foram efetuadas com pesquisas BLAST, no servidor NCBI (National Center for Biotecnology Information). Com base nas sequências obtidas e nas sequências depositadas no GenBank foram efectuadas análises filogenéticas e moleculares evolutivas.
3.2. Ensaio de campo
3.2.1. Localização do ensaio e caracterização edafoclimática
O ensaio de campo foi realizado no campus da Universidade de Trás-os-Montes e Alto Douro (41°17'09.2"N 7°44'28.2"W) situado no concelho de Vila Real, entre outubro de 2016 ejulho de 2017.
A parcela onde foi efetuado o estudo (Figura 10), apresenta um declive de 5%, estando as linhas de sementeira da cultura conduzida de acordo com o maior declive, com orientação Este-Oeste.
Vila Real apresenta uma classificação do clima do local de ensaio, segundo Köppen e Geiger (1936), Csb (Clima temperado húmido com verão seco e temperado), caracterizada por possuir temperaturas médias do mês mais frio compreendidas entre os 0 e 18ºC, possuir um período marcadamente seco no verão, que é temperado, ou seja possui quatro meses ou mais
25
com uma temperatura média superior a 10ºC e o mês mais quente tem uma média inferior ou igual a 22ºC.
26 3.2.2. Análise do solo
A 30 de setembro de 2016 foram recolhidas aleatoriamente da parcela, amostras
compósitas de terra, de 0 a 20 cm, as quais foram utilizadas para caracterização do solo. Os resultados obtidos estão apresentados no Quadro 2.
Quadro 1 - Análise de solo do terreno onde o ensaio de campo foi realizado.
Parâmetros Valor Médio (n=2)
Textura Média
pH água 5,4
pH KCl 4,65
Reacção do solo Moderadamente ácido
Teor matéria orgânica (%) 1,82
Fósforo assimilável (mg P2O5 kg-1) 174 Potássio extraível (mg K2O kg-1) 236,5
Boro (mg B kg-1) 0,255
Cobre (mg Cu kg-1) 13,50 (EDTA)
Zinco (mg Zn kg-1) 3,5 (EDTA)
Ferro (mg Fe kg-1) 47,45 (EDTA)
Manganês (mg Mn kg-1) 49,8 (EDTA) Cálcio de troca (cmolc kg-1) 5,53 Magnésio de troca (cmolc kg-1) 0,645 Potássio de troca (cmolc kg-1) 0,525 Sódio de troca (cmolc kg-1) 0,135 Alumínio de troca (cmolc kg-1) 0,155 CTC Potencial (pH=7,0) (cmolc kg-1) 9,145 Grau de saturação em bases (%) 97,7 Grau de saturação em Alumínio (%) 2,3 Condutividade eléctrica (dS m-1) 0,09
Azoto total (g N kg-1) 1,04
Relação C:N 10,15
Teor areia grossa (g kg-1) 189
Teor areia fina (g kg-1) 448
Teor limo (g kg-1) 219,5
Teor argila (g kg-1) 143
Classe textura Franco
O solo é considerado moderadamente ácido, franco, com um teor de matéria orgânica 1,82 e, do ponto de vista químico é altoem fósforo 174 e muito alto em potássio 236,5.