UNIVERSIDADE FEDERAL DE OURO PRETO
NÚCLEO DE PESQUISAS EM CIÊNCIAS BIOLÓGICAS
Programa de Pós-graduação em Ciências Biológicas
Área de Concentração: Bioquímica Estrutural e Fisiológica
PREVENÇÃO DA
OXIDAÇÃO TECIDUAL E MODIFICAÇÕES NA
EXPRESSÃO GÊNICA DA mTOR E MAFbx DO MÚSCULO DE
RATOS EXERCITADOS ALIMENTADOS COM AS PROTEÍNAS
DO SORO DO LEITE
Fabiano Kenji Haraguchi
Catalogação
H254p Haraguchi, Fabiano Kenji.
Prevenção da oxidação tecidual e modificações na expressão gênica da mTOR e MAFbx do músculo de ratos exercitados alimentados com as proteínas do soro do leite [manuscrito] / Fabiano Kenji Haraguchi – 2011.
114f.: il., color; grafs.; tabs.
Orientadora: Profa. Dra. Maria Lúcia Pedrosa. Co-orientador: Prof. Dr. Marcelo Eutáquio Silva.
Tese (Doutorado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas em Ciências Biológicas. Área de concentração: Bioquímica Estrutural e Fisiológica.
1. Soro do leite - Teses. 2. Exercícios físicos - Teses. 3. Antioxidantes - Teses. 4. Anabolismo muscular - Teses. 5. Expressão gênica - Teses. I. Universidade Federal de Ouro Preto. II. Título.
Fabiano Kenji Haraguchi
PREVENÇÃO DA
OXIDAÇÃO TECIDUAL E MODIFICAÇÕES NA
EXPRESSÃO GÊNICA DA mTOR E MAFbx DO MÚSCULO DE
RATOS EXERCITADOS ALIMENTADOS COM AS PROTEÍNAS
DO SORO DO LEITE
Tese apresentada ao Programa de Pós-graduação do Núcleo de Pesquisas em
Ciências Biológicas (NUPEB) da
Universidade Federal de Ouro Preto, como requisito parcial à obtenção do título de Doutor.
Orientador: Dra Maria Lúcia Pedrosa -
Laboratório de Bioquímica Molecular.
Coorientador: Dr Marcelo Eustáquio Silva - Laboratório de Nutrição Experimental.
Ouro Preto NUPEB – UFOP
AGRADECIMENTOS
Primeiramente, a Deus, Pai Todo-Poderoso, fonte de energia, inspiração e vida.
Aos meus orientadores, Dra Maria Lúcia Pedrosa e Dr. Marcelo Eustáquio Silva,
pelos ensinamentos, paciência e compreensão. Serei eternamente grato pela oportunidade dada.
A todos os amigos, colegas, professores e funcionários do Laboratório de Nutrição Experimental (LABNEX), Laboratório de Bioquímica Metabólica (LBM), assim como de outros laboratórios da instituição, que de alguma forma contribuíram para a realização deste trabalho.
À instituição Universidade Federal de Ouro Preto, ao Núcleo de Pesquisas em Ciências Biológicas (NUPEB) - em especial à Cida Reis -, à Escola de Nutrição e às agências de fomento Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG) e Conselho Nacional de Desenvolvimento Científico e Tecnológico/ Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CNPq/CAPES), por darem suporte a todo o meu aprendizado.
RESUMO
Haraguchi, F.K. (Tese de Doutorado) - Núcleo de Pesquisas em Ciências Biológicas (NUPEB), Universidade Federal de Ouro Preto, Minas Gerais, 2011.
As proteínas do soro do leite (PSL) são aquelas que permanecem na porção aquosa do leite após a coagulação das caseínas. Apresentam alto valor nutricional, elevado teor de aminoácidos essenciais, em especial a leucina, como também peptídeos bioativos, que possuem, entre outras propriedades, atividade antioxidante. Atualmente, as PSL são extensivamente encontradas em diferentes produtos alimentares, especialmente naqueles destinados a atletas e praticantes de atividade física. Embora sejam aclamadas por favorecerem o anabolismo muscular, o conhecimento científico acerca dessa propriedade não está totalmente elucidado. Neste trabalho, avaliaram-se o efeito das PSL como fonte proteico-dietética sobre o crescimento muscular, a atividade antioxidante e a expressão gênica de proteínas do metabolismo proteico-muscular de ratos submetidos a um programa de exercício físico de resistência com pesos. Os resultados revelaram que dietas compostas de PSL preveniram a oxidação proteico-muscular induzida pelo exercício, inibiram a oxidação de proteínas hepáticas, assim como a formação de lipoperóxidos hepáticos e musculares, independentemente do exercício. Concomitantemente, observou-se que o exercício em associação à dieta composta de PSL promoveu significativo aumento na expressão gênica da mTOR - quinase integrante da via sinalizadora da síntese proteico-muscular. Além disso, animais alimentados com as PSL apresentaram acentuada redução da expressão gênica da MAFbx - enzima envolvida no processo de degradação proteico-muscular pela via ubiquitina-proteassoma, o que provavelmente resultou em animais com mais ganho de peso corporal e muscular. Dessa forma, os dados do presente trabalho sugerem que a combinação de exercício de resistência com pesos e a ingestão das PSL favorece o ganho de peso corporal e muscular e que essa indução parece ser mediada parcialmente pelas propriedades antioxidantes das PSL.
ABSTRACT
Haraguchi, F.K. (Ph.D. Thesis) – Preventing tissue oxidation and modifications on muscle mTOR and MAFbx mRNA expression in rats fed with whey proteins- Research in Biological Sciences (NUPEB), Ouro Preto University, Brazil, 2011.
Whey proteins (WP) are a mixture of milk globular proteins that remain in whey fraction after casein coagulation. They possess high nutritional value, high levels of essential amino acids such as leucine, as well as bioactive peptides with enhanced/potential antioxidant properties. Nowadays WP can be found in several market products, mainly in food recommended for athletes and physically active people. Although it is claimed that WP enhance muscle growth, not much has been reported in the literature in this regard. In this work, the efficiency of WP as a dietary protein source was evaluated in rats submitted to a resistance-exercise program. The influence of WP in muscle growth, antioxidant activity and mRNA expression of proteins of muscle growth signaling pathways was studied. The results show that WP preclude exercise-induced muscular protein oxidation and inhibit hepatic protein oxidation as well as muscular and hepatic lipoperoxil formation independently of the resistance-exercise. In combination with resistance-exercise, WP increase significantly mTOR mRNA expression - a kinase important in muscle protein synthesis signaling pathway. In addition, WP reduced significantly MAFbx mRNA expression - a protein of ubiquitin-proteasome pathway, leading to rats with increased body and muscle weight gain. Thus, this study suggests that combining resistance exercise with WP ingestion leads to enhancement of body and muscle gain, what can be partially attributed to WP’ antioxidant properties.
LISTA DE ABREVIATURAS E SIGLAS
ALA Alfa-lactoalbumina
AMPK Proteína quinase AMP ativada
BCAA Aminoácidos de cadeia ramificada
BHT Butil hidroxitolueno
BLG Beta-lactoglobulina
BSA Albumina do soro bovino
CAT Catalase
CCK Colecistoquinina
CE Controle exercitado
CS Controle sedentário
CT Colesterol total
CUP Coeficiente de utilização proteica
DBO Demanda bioquímica de oxigênio
DF Diafiltração
DMH Dimetilhidrazina
DMSO Dimetil sulfóxido
DNPH Dinitrofenilhidrazina
DNTB Dinitrotiocianobenzeno
DP Desvio-padrão
DV Digestibilidade verdadeira
EA Eficiência alimentar
ECA Enzima conversora da angiotensina
EDTA Ácido etilenodiaminotetracético
ELD Extensor longo dos dedos
ELISA Enzyme-linked immunoabsorbent assay
FoxO Forkhead box O
GAS Gastrocnêmio
GLP Glucagon like peptide-1
GMP Glicomacropeptídeos
GPX Glutationa peroxidase
GSH Glutationa reduzida
GSSH Glutationa oxidada
H2O2 Peróxido de hidrogênio
HDL Lipoproteína de alta densidade
IA Ingestão alimentar
IG Imunoglobulina
IGF Insulin like growth factor
IRS Insulin Receptor Substrate
MAFbx Muscle atrophy F-box protein
MBP Milk basic protein
MDA Malondealdeído
MF Microfiltração
MHC Cadeia pesada da miosina
MPS Síntese de proteína miofibrilar
MRF Fatores regulatórios da miogenia
mTOR Mamalian target of rapamycinn
MuRF-1 Muscle RING finger-1 protein
NNP Nitrogênio não proteico
NO Óxido nítrico
PC Proteínas carboniladas
PI3K Phosphatidylinositol 3-kinase
PKB Proteína quinase B
PSL Proteínas do soro do leite
PUFA Ácidos graxos poli-insaturados
qPCR Reação em cadeia da polimerase em tempo real
RHEB Ras homologue enriched in brain
RNS Espécies reativas do nitrogênio
RONS Espécies reativas do oxigênio e nitrogênio
ROS Espécies reativas do oxigênio
RPL Razão proteica líquida
SA Soro ácido
SDS Dodecil Sulfato de Sódio
SH Grupo Sulfidrila
SSA Ácido sulfosalicílico
TBARS Ácido tiobarbitúrico
TCA Ácido tricloroácetico
TI Troca iônica
TNB Ácido 5-tio-2-nitrobenzóico
UF Ultrafiltração
UPS Sistema ubiquitina-proteassoma
WE PSL - exercitado
WPC Whey protein concentrate
WPH Whey protein hydrolysate
WPI Whey proteinisolate
LISTA DE ILUSTRAÇÕES
Figuras
FIGURA 1 – Fluxograma da produção de WPC, WPI e lactoalbumina... 23 FIGURA 2 – Principais reações ocorridas durante o processo de
peroxidação lipídica... 38
FIGURA 3 – Formação de proteínas carboniladas por oxidação direta do
resíduo de prolina (A) ou por glicação e glicoxidação (B); a partir da reação do 4-hidroxi-2-nonenal com resíduo de lisina (C); reação de grupos amino com o MDA (D)... 40 FIGURA 4 – Sinalização celular da síntese e degradação proteico-muscular
controlada pela via IGF-1-Akt/PKB... 44 FIGURA 5 – Hipóteses para a ativação da mTOR por aminoácidos (AA)... 45
FIGURA 6– Múltiplos fatores e vias que afetam a sinalização
IGF-1-Akt/PKB, destacados em vermelho... 48
Gráficos
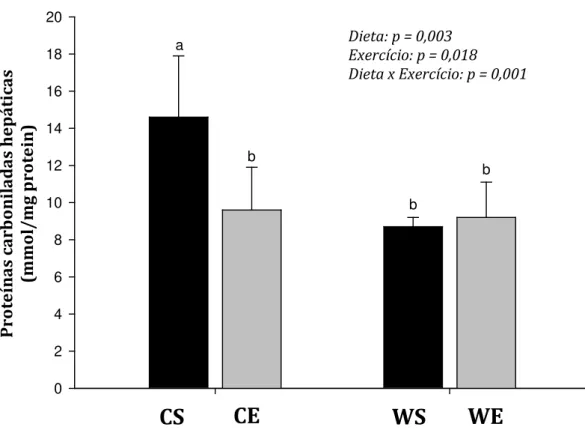
GRÁFICO 1 – Concentração muscular de proteínas carboniladas de ratos sedentários (barras pretas) ou exercitados (barras cinzas) alimentados com dieta controle (CS e CS) ou PSL (WS e WE)... 65 GRÁFICO 2 – Concentração hepática de proteínas carboniladas de ratos
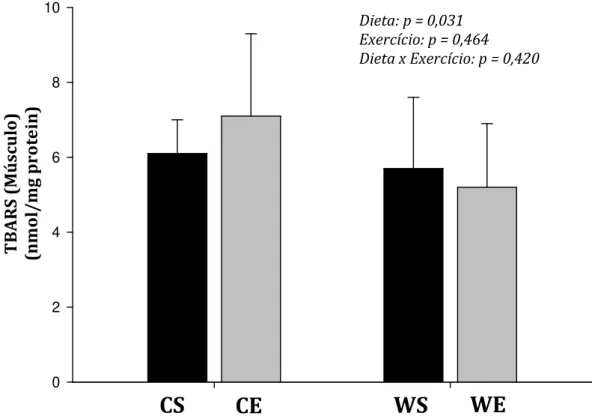
sedentários (barras pretas) ou exercitados (barras cinzas) alimentados com dieta controle (CS e CS) ou PSL (WS e WE). ... 66 GRÁFICO 3 – Concentração muscular de TBARS de ratos sedentários
(barras pretas) ou exercitados (barras cinzas) alimentados com dieta controle (CS e CS) ou PSL (WS e WE)... 67 GRÁFICO 4 – Concentração hepática de TBARS de ratos sedentários
(barras pretas) ou exercitados (barras cinzas) alimentados com dieta controle (CS e CS) ou PSL (WS e WE)... 68 GRÁFICO 5 – Conteúdo hepático de glutationa total de ratos sedentários
GRÁFICO 6 – Atividade hepática da catalase de ratos sedentários (barras pretas) ou exercitados (barras cinzas) alimentados com dieta controle (CS e CS) ou PSL (WS e WE). ... 70 GRÁFICO 7 – Expressão gênica da mTOR de ratos sedentários (barras
pretas) ou exercitados (barras cinzas) alimentados com dieta controle (CS e CS) ou PSL (WS e WE)... 71
GRÁFICO 8 – Expressão gênica da MuRF-1 de ratos sedentários (barras
pretas) ou exercitados (barras cinzas) alimentados com dieta controle (CS e CS) ou PSL (WS e WE)... 72
GRÁFICO 9 – Expressão gênica da MAFbx de ratos sedentários (barras
pretas) ou exercitados (barras cinzas) alimentados com dieta controle (CS e CS) ou PSL (WS e WE)... 73
Quadros
QUADRO 1 – Valor energético e composição química do WPC 34%, WPC 80%, WPI e de alguns produtos comerciais compostos de PSL... 18 QUADRO 2 – Composição aminoacídica percentual da beta-lactoglobulina
(BLG), alfa-lactoalbumina (ALA), glicomacropeptídeos (GMP), WPI e a média de 207 proteínas... 20
QUADRO 3 – Composição percentual dos peptídeos do WPC e WPI,
segundo o processo de obtenção... 24 QUADRO 4 – Composição de aminoácidos da caseína e PSL utilizadas nas
LISTA DE TABELAS
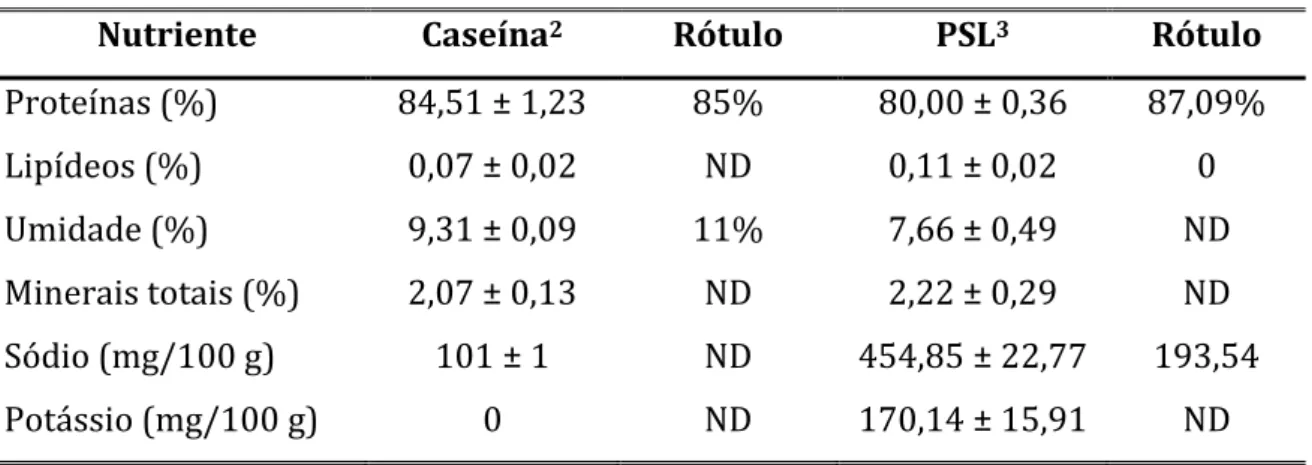
TABELA 1 – Composição (g/1.000 g) das dietas dos grupos controle
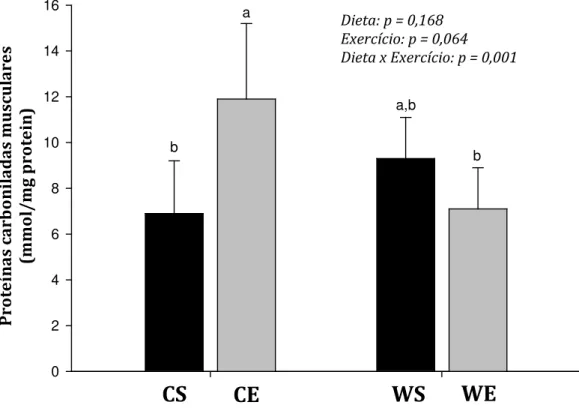
sedentário (CS), controle exercitado (CE), PSL sedentário (WS) e PSL exercitado (WE)... 52 TABELA 2 – Análise bromatológica das fontes proteicas utilizadas -
caseína e PSL... 61 TABELA 3 – Ingestão alimentar, eficiência alimentar, ganho de peso
corporal, peso dos músculos gastrocinêmicos e extensor longo dos
SUMÁRIO
11 INTRODUÇÃO ... 15
2 REVISÃO DA LITERATURA ... 17
2.1 As proteínas do soro de leite (PSL) ... 17
2.2 A obtenção das PSL...22
2.3 Propriedades funcionais das PSL ... 25
2.4 As PSL e o exercício físico. ... 32
2.5 As proteínas do soro do leite, o estresse oxidativo e o exercício...36
2.6 Mecanismos moleculares do crescimento muscular ... 43
3 OBJETIVOS... 50
3.1 Objetivo geral ... 50
3.2 Objetivos específicos ... 50
4 MATERIAL E MÉTODOS ... 51
4.1 Material ... 51
4.2 Dietas e protocolo de exercício ... 51
4.3 Eutanásia, coleta do sangue e tecidos...54
4.4 Avaliação bromatológica ... 55
4.4.1 Umidade ... 55
4.4.2 Cinzas ... 55
4.4.3 Proteínas ... 56
4.4.4 Lipídeos ... 57
4.5 Dosagens bioquímicas ... 57
4.5.1 Concentração de glutationa total em tecidos ... 57
4.5.2 Catalase ... 57
4.5.3 Proteína carbonilada ... 58
4.5.4 Substâncias reativas ao ácido tiobarbitúrico (TBARS) ... 58
4.5.5 Proteínas totais em tecidos ... 58
1 Este trabalho foi revisado de acordo com as novas regras ortográficas aprovadas pelo Acordo
4.5.6 Glicogênio muscular ... 58
4.5.7 Análise da reação em cadeia da polimerase em tempo real (qPCR) ... 58
4.5.7.1 RNA total e cDNA ... 58
4.5.7.2 qPCR ... 59
4.6 Análise estatística ... 59
5 RESULTADOS ... 61
5.1 Avaliação bromatológica ... 61
5.2 Ingestão alimentar, ganho de peso corporal, peso muscular, glicogênio muscular, gordura abdominal e eficiência alimentar... 61
5.3 Proteínas carboniladas e TBARS ... 64
5.4 Concentração total de glutationa e atividade da catalase no fígado ... 68
5.5 PCR em tempo real ... 70
6 DISCUSSÃO ... 74
7 CONCLUSÃO ... 85
REFERÊNCIAS ... 86
1 INTRODUÇÃO
Há muito tempo se sabe que atletas e praticantes de atividades físicas ingerem suplementos alimentares proteicos com os mais diversos objetivos, seja com o intuito de aumentar a força, a massa muscular esquelética e mesmo o desempenho físico. Desde a Antiguidade, na Grécia Antiga, há relatos de que atletas faziam refeições ricas em alimentos de origem animal, pois se acreditava que o consumo excessivo de carne estava associado a melhor desempenho esportivo (GRANDJEAN, 1997).
Na Era Moderna, os primeiros suplementos alimentares comerciais datam da década de 40, quando bebidas formuladas à base de chás e ervas tinham como intuito aumentar os níveis de energia dos atletas (SALZANO JR., 1996). Os primeiros suplementos proteicos nutricionais a serem comercializados eram compostos de soja, conhecida pelo alto teor de proteína (cerca de 90%), relativa solubilidade e baixo custo. Com a explosão do consumo de suplementos, a indústria de alimentos, principalmente a norte-americana, passou a explorar esse grande mercado. Assim, surgiram produtos formulados com diferentes fontes proteicas, com o intuito de se conseguir um produto mais “completo”, de alto valor biológico, como os suplementos à base de proteína do ovo desidratada, como também os primeiros produtos contendo o leite em pó na sua formulação. O soro do leite, gerado durante o processo de fabricação do queijo, não tinha até o início da década de 70 grande importância econômica. Entretanto, com o advento da utilização de membranas para a separação de proteínas e dos primeiros estudos envolvendo a avaliação de sua qualidade nutricional, as proteínas do soro do leite (PSL) passaram, então, a ter mais importância comercial, sendo atualmente as principais matérias-primas utilizadas em suplementos nutricionais proteicos para atletas.
Entre as principais razões que levam atletas e praticantes de atividades físicas a ingerirem suplementos nutricionais à base das PSL, estão seus possíveis efeitos sobre a composição corporal, em especial o aumento da massa muscular esquelética. Desde o fim da década de 90 diversos autores têm proposto diferentes hipóteses para
explicar os possíveis benefícios das PSL para o exercício (BOIRIE et al., 1997;
ESMARCK et al., 2001; HA; ZEMEL, 2003; LANDS; GREY; SMOUTAS, 1999; MARSHAL,
cientificamente comprovadas. Sabe-se, por exemplo, que as PSL são capazes de aumentar, em resposta ao exercício, a fosforilação/ativação de proteínas celulares
envolvidas no processo de síntese proteica, como a mamalian target of rapamycinn
(mTOR) (HULMI et al., 2009; MOORE et al., 2011), mesmo não se conhecendo se as
PSL alteram a expressão gênica dessas proteínas nas condições do exercício.
Recentemente, tem sido hipotetizado que os radicais livres podem estar
associados à etiologia de inúmeros estados patogênicos (LIU et al., 2011; OLIVEIRA;
NOGUEIRA-MACHADO; CHAVES, 2010; STANTON, 2011). O exercício físico é sabidamente conhecido por aumentar a geração de espécies reativas em resposta ao
aumento na utilização do oxigênio (DAVIES et al., 1982; REID, 2008). E segundo
alguns autores, excessiva produção dessas espécies reativas, gerando estado de estresse oxidativo, pode afetar a contração muscular e a produção de força motora (JACKSON, 2009; POWERS; JI; LEEUWENBURG, 1999). Apesar disso, não está ainda suficientemente esclarecido se o estresse oxidativo gerado pelo exercício pode alterar a síntese proteico-muscular.
Neste contexto, as PSL merecem atenção especial, uma vez que são conhecidas
por apresentarem propriedades antioxidantes (BOUNOUS et al., 1988; FARREL et al.,
2004; PAPENBURG et al., 1990). O objetivo do presente trabalho foi avaliar o impacto
2 REVISÃO DA LITERATURA
2.1 As proteínas do soro de leite (PSL)
O leite humano é o alimento de escolha para o desenvolvimento dos recém-nascidos, satisfazendo suas necessidades nutricionais e metabólicas nos primeiros meses de vida. Após o desmame, o leite bovino passa a ter mais significância para a nutrição humana. Assim como na maioria dos leites de mamíferos, as proteínas do leite bovino são compostas de caseínas e PSL. As caseínas são as proteínas que
precipitam quando o leite é mantido sob pH de 4,6 a 200C, enquanto que as PSL
permanecem no soro nessas mesmas condições (SGARBIERI, 1996). A obtenção das PSL envolve sua separação das caseínas, que pode ser realizada por coagulação enzimática ou por precipitação ácida da caseína, gerando o soro “doce” ou “ácido”, respectivamente (BORGES et al., 2001).
Durante décadas, o soro do leite era dispensado pela indústria de alimentos. Desde a Idade Média, era considerado um produto de descarte, sendo no máximo destinado à alimentação de animais de abate ou, então, simplesmente descartado no meio ambiente. Entretanto, o fato de ser altamente poluente por apresentar alta
demanda bioquímica de oxigênio (DBO) para ser degradado (BORGES et al., 2001)
estimulou os pesquisadores a encontrarem melhor destino para ele. Em 1971, o Dr. Paavo Airola descreveu as PSL como parte importante no tratamento e prevenção de flatulências e prisão de ventre (SALZANO JR., 1996). Seu consumo faz parte do hábito alimentar de diversas culturas, povos e grupos populacionais específicos. Na Islândia,
as PSL, conhecidas como syra, são fermentadas e estocadas em barris. Diluída em
água, é uma bebida comumente consumida pela população daquele país (MARSHAL, 2004). Atletas, praticantes de atividades físicas, pessoas fisicamente ativas e até mesmo portadores de doenças vêm procurando benefícios nessa fonte proteica.
representam cerca de 80%. Com o decorrer da lactação esse percentual diminui para
50% (BORGES et al., 2001; SALZANO JR., 1996). Em termos de composição química,
as PSL podem exibir diferenças dependendo da metodologia utilizada para sua obtenção. O QUADRO 1 apresenta a composição química média dos concentrados
proteicos do soro do leite -whey protein concentrate - (WPC) e isolados proteicos do
soro do leite - whey proteinisolate - (WPI), assim como de alguns produtos comerciais compostos pelas PSL.
QUADRO 1 - Valor energético e composição química do WPC 34%, WPC 80%, WPI e de alguns produtos comerciais* compostos de PSL**
WPC 34%
WPC
80% WPI Whey1 Whey2 Whey3 Whey4
Valor Energético (kcal) 375 407 381 357 385 411 340
Proteína (%) 34 80 92 70 79 77 85
Carboidratos (%) 53 6 1 8 9,8 10 0
Cinzas (%) 7 3 2 ND ND ND ND
Gordura (%) 3 7 1 5 ND 7 0
Umidade (%) 3 4 4 ND 3,3 ND ND
* Dados fornecidos nos rótulos nutricionais. ** Adaptado de Huffman e Harper (1999).
Whey1: produto comercial composto por WPC 80%.
Whey2: produto comercial composto por mistura de WPC/WPI/WPH.
Whey3: produto comercial composto por mistura de WPC/WPI.
Whey4: produto comercial composto por WPI.
ND: valores não declarados.
Semelhantemente aos teores de proteínas, os WPC, WPI e WPH apresentam diferenças no perfil de aminoácidos, dependendo da metodologia empregada na sua obtenção, a qual determina que diferentes peptídeos podem se apresentar em maiores ou menores concentrações. E isso afeta sensivelmente sua composição
aminoacídica (QUADRO 2) (BORGES et al., 2001; ETZEL, 2004; FORSUM, 1973;
FORSUM; HAMBREUS, 1976).
Entre as principais proteínas presentes no soro do leite destacam-se a β
-lactoglobulina (BLG), α-lactoalbumina (ALA), albumina do soro bovino (BSA), imunoglobulinas (Ig) e glicomacropeptídeos (GMP). Proteínas e peptídeos como a lactoferrina, beta-microglobulinas, lactolina, lactofano e fatores de crescimento do
tipo Insulin like growth factor (IGF)-1 e IGF-2 também estão presentes. A BLG
g/L de leite bovino. É o peptídeo que apresenta mais altos teores de aminoácidos de cadeia ramificada (BCAA) (25%). A BLG não está presente no leite humano (DE WIT, 1998). Assim, em termos quantitativos, a ALA é o segundo peptídeo do soro do leite
bovino (15-25%) e o principal do leite humano (SHANNON et al., 2003). Contém o
mais alto teor de triptofano (6%) entre todas as fontes proteicas alimentares, sendo também rica em lisina, leucina, treonina e cisteína (KINSELLA; WHITEHEAD, 1989; MARKUS; OLIVER; DE HAAN, 2002). Apresenta atividade antimicrobiana contra bactérias patogênicas, como, por exemplo, Escherichia coli, Staphylococcus aureus e Klebsiella pneumoniae (LÖNNERDAL, 2003). A BSA corresponde a cerca de 10% das PSL. É rica em cisteína (aproximadamente 6%), sendo importante precursor da síntese de glutationa (BOUNOUS; GOLD, 1991).
Quatro das cinco classes das Igs estão presentes no leite bovino (IgG, IgA, IgM e IgE), sendo a IgG a principal, constituindo cerca de 80% do total. No leite humano, a IgA constitui a principal imunoglobulina (> 90%). Suas principais ações biológicas residem na imunidade passiva e atividade antioxidante (DE WIT, 1998; HA; ZEMEL 2003). O GMP é um peptídeo resistente ao calor, à digestão, assim como a mudanças de pH. Curiosamente, muitos autores não descrevem o GMP como um peptídeo do soro do leite, pois é derivado da digestão da caseína-kapa, pela ação da quimosina durante a coagulação do queijo. Essa fração está presente em um tipo de soro
conhecido como whey rennet (ETZEL, 2004) e, assim como as frações BLG e ALA,
QUADRO 2 - Composição aminoacídica percentual da beta-lactoglobulina (BLG), alfa-lactoalbumina (ALA), glicomacropeptídeos (GMP), WPI* e a média de 207 proteínas**
Aminoácido BLG ALA GMP WPI 207 proteínas
Alanina 5,4 1,5 6,4 4,9 5,8
Arginina 2,6 1,1 0 2,5 6,7
Asparagina 3,1 9,7 5,1 3,8 4,6
Ácido Aspártico 6,9 7,3 1,7 10,7 5,8
Cisteína 2,8 5,8 0 1,7 2,6
Glutamina 6,4 4,5 3,8 3,4 4,6
Ácido Glutâmico 11,3 7,3 15,5 15,4 7,3
Glicina 0,9 2,4 0,9 1,7 3,9
Histidina 1,5 2,9 0 1,7 2,6
Isoleucina 6,2 6,4 11,9 4,7 4,8
Leucina 13,6 10,4 1,7 11,8 7,8
Lisina 10,5 10,9 5,8 9,5 8,2
Metionina 2,9 0,9 2,0 3,1 2,0
Fenilalanina 3,2 4,2 0 3,0 4,7
Prolina 4,2 1,4 11,7 4,2 4,1
Serina 3,3 4,3 7,8 3,9 5,6
Treonina 4,4 5,0 16,7 4,6 5,5
Triptofano 2,0 5,3 0 1,3 1,9
Tirosina 3,6 4,6 0 3,4 5,2
Valina 5,4 4,2 8,9 4,7 6,2
BCAA 25,1 21,0 22,5 21,2 18,8
Essenciais 48,1 47,2 47,0 42,7 41,1
* WPI obtido por cromatografia de troca iônica.
**Calculada pela ocorrência de cada aminoácido em 207 proteínas de sequência conhecida (KLAPPER, 1977).
Fonte: Eztel (2004).
maiores que a média computada de 207 proteínas (KLAPPER, 1977) ou, ainda, 25%
maiores que a da caseína comercial (HARAGUCHI et al., 2010a).
Além de apresentarem composição aminoacídica distinta, as PSL são conhecidas por possuírem peptídeos bioativos, raramente encontrados em outras fontes alimentares. Tais peptídeos conferem às PSL diferentes propriedades biológicas e funcionais (HA; ZEMEL, 2003; SGARBIERI, 2004; ZYDNEY, 1998) que as fazem diferir significativamente de outras proteínas alimentares. De fato, o valor nutricional de uma proteína é determinado, em primeiro lugar, pela sua composição de aminoácidos essenciais. No entanto, esse potencial pode não ser real se a proteína não for digerida completamente ou se algum de seus aminoácidos não for totalmente
disponível ao organismo (GILANI; XIAO; LEE, 2008). Portanto, para se determinar a
qualidade real de uma proteína, é imprescindível a avaliação biológica nutricional. De forma geral, os métodos utilizados para avaliar a qualidade de uma proteína procuram quantificar quão boa ela é para fins de síntese proteica. A proteína sintetizada pelo organismo destina-se ao crescimento, manutenção, reparação e reprodução. As primeiras pesquisas envolvendo a avaliação biológica nutricional das PSL datam da década de 70, descritas por Forsum (1973), Forsum, Hambraeus e Siddiqi (1973) e Forsum e Hambreus (1976). Na maioria desses estudos os autores registraram altos valores de coeficiente de utilização proteica (CUP) e digestibilidade dessas proteínas, sendo, inclusive, superiores às caseínas (FORSUM 1973; FORSUM; HAMBREUS, 1976). Entretanto, a maioria dos concentrados proteicos do soro existentes na época não estava disponível comercialmente para consumo humano.
Outros estudos, como os de McDonough et al. (1974), Boza et al. (1994),
Borges et al. (2001) e Gilani e Sepehr (2003), também foram conduzidos utilizando-se
produtos não comerciais. Os primeiros suplementos proteicos à base de PSL a serem comercializados para o consumo humano datam do início da década de 90 e, desde então, o conhecimento científico acerca da qualidade biológica nutricional destes é raramente descrito. A avaliação biológica nutricional desses produtos é de extrema importância, pois eles são largamente difundidos no meio esportivo e o conhecimento do seu real potencial para fins de crescimento e síntese proteica pode corroborar o que é descrito na literatura e contribuir para o conhecimento de possíveis benefícios.
Assim, em estudo anterior (HARAGUCHI et al., 2010a), observou-se que um
escolhido, fora mais eficiente em gerar valores significativamente mais altos de CUP, razão proteica líquida (RPL) e digestibilidade verdadeira (DV) do que a caseína comercial, proteína considerada de referência para estudos de avaliação biológica de proteínas (PELLET; YOUNG, 1980). Verificou-se, também, que as PSL foram importantes para a manutenção da homeostase glicêmica dos animais após jejum noturno de 12 horas e que os animais alimentados com as PSL apresentaram altas concentrações plasmáticas de lipoproteína de alta densidade (HDL), proteínas totais e albumina, assim como mais atividade da paraoxonase, enzima de característica antioxidante. Esse trabalho forneceu importante dado a respeito das propriedades das PSL em afetar positivamente indicadores biológicos e bioquímicos do crescimento. Entretanto, não se tinha, até aquele momento, avaliado seus efeitos nas condições metabólicas do exercício.
2.2 A obtenção das PSL
Assim como na maioria do leite de mamíferos, as proteínas do leite bovino são compostas de caseínas e PSL. As caseínas são as proteínas que precipitam quando o
leite é mantido sob pH de 4,6 e 20oC, enquanto que as PSL permanecem no soro
nessas mesmas condições (SGARBIERI, 1996). A obtenção das PSL envolve sua separação da caseína, que pode ser realizada por coagulação enzimática ou por precipitação ácida da caseína, gerando o soro “doce” ou “ácido”, respectivamente
(BORGES et al., 2001). As propriedades nutricionais das PSL são descritas desde
1950. Entretanto, as metodologias existentes na época para a recuperação dessas proteínas resultavam basicamente em um subproduto descrito como lactoalbumina, um pó granulado, insolúvel, com proteínas desnaturadas pelo calor e, portanto, com
limitadas aplicações para a indústria de alimentos (McDONOUGH et al., 1974).
recuperação das PSL: a osmose reversa, a nanofiltração, a ultrafiltração (UF) e a microfiltração (MF); e por processos cromatográficos, que se baseiam nas diferenças de cargas ou, ainda, por afinidade (CHEANG; ZYDNEY, 2003; HUFFMAN; HARPER, 1999; ROSEMBERG, 1995). Um fluxograma simplificado da obtenção dos WPC, WPI e lactoalbumina é descrito na FIG. 1.
FIGURA 1 – Fluxograma da produção de WPC, WPI e lactoalbumina
Fonte: Huffman e Harper (1999).
QUADRO 3 -Composição percentual dos peptídeos do WPC e WPI, segundo o processo de obtenção*
SD = soro “doce”; SA = soro “ácido”; MF = microfiltração; TI = troca iônica. *Adaptado de Huffman e Harper (1999).
Desde 1980, a UF tem sido a metodologia mais utilizada para a produção de WPC. Nesse processo, o soro é inicialmente filtrado ou centrifugado para remoção de partículas como as de caseína e gordura. Outros processos de pré-tratamento podem ser usados para melhorar o desempenho da UF, como a desmineralização, clarificação e controle de pH, com o intuito de evitar o acúmulo de substâncias como o fosfato de cálcio, que pode se incrustar nos poros das membranas. A UF fraciona o soro em duas partes, nas quais os compostos de baixo peso molecular, tais como a lactose, vitaminas, minerais e nitrogênio não proteico (NNP), são filtrados do soro para o permeato, enquanto que as PSL são concentradas no retentato. A UF pode gerar WPC com percentuais que variam de 30 a 80% de proteína (MATTHEWS, 1984). O concentrado pode, ainda, passar por um processo de diafiltração (DF), em que o retentato é lavado com água deionizada continuamente, com o objetivo de remover mais lactose e minerais. A combinação UF-DF pode gerar concentrados com aproximadamente 85% de proteína (ZYDNEY, 1998).
com a adição de hidróxido de sódio (NaOH). A solução proteica resultante é concentrada por UF (SALZANO JR., 1996).
Ainda na década de 80, surgiram também os primeiros hidrolisados proteicos
do soro de leite (whey protein hydrolysate – WPH) obtidos por hidrólise enzimática,
uma nova alternativa, na época, para se obter um produto contendo peptídeos
menores, de rápida absorção intestinal (ABE; HOSHI; TAJIMA, 1987; GRIMBLE et al.,
1986), com baixo percentual de aminoácidos livres, responsáveis por causarem sabor
amargo característico, alto valor nutricional e baixa alergenicidade (BOZA et al.,
1994).O avanço tecnológico e os investimentos na área têm permitido a utilização da
microfiltração, da cromatografia de troca iônica ou de afinidade e de processos de eletrosseparação para o fracionamento das PSL para a obtenção isolada de BSA, ALA, IgGs e peptídeos como lactoferrina e lactoperoxidase (EL-SAYED; CHASE 2011).
2.3 Propriedades funcionais das PSL
Nos últimos anos, inúmeros trabalhos têm reportado o efeito das PSL sobre diversas condições fisiológicas e metabólicas, sendo consideradas por muitos autores
como um alimento funcional (HA; ZEMEL, 2003; HARAGUCHI; ABREU; DE PAULA,
2006; MARSHAL, 2004; SGARBIERI 2004; WARD; GERMAN 2004). Contudo, para que essas proteínas apresentem tais propriedades, as PSL devem fornecer peptídeos bioativos intactos, não desnaturados, preservando assim sua atividade biológica original.
Em uma série de pesquisas, Bounous e Gold (1991), Bounous, Batist e Gold
(1989) e Bounous et al. (1988) observaram que, na forma não desnaturada, as PSL
Pesquisas têm demonstrado que as PSL apresentam atividade anticâncer em
modelos animais e em culturas de células (BOUNOUS et al., 1988; BOURTOURAULT et
al., 1991; CASTRO et al., 2009; HAKKAK et al., 2001; KENT; HARPER; BOMSER, 2003;
McINTOSH et al., 1995). Bourtourault et al. (1991) observaram que as PSL foram
capazes de reduzir significativamente o crescimento de células cancerosas mamárias MCF-7 e prostáticas PC-3.
A glutationa é um tripeptídeo (γ-glutamil-cisteina-glicina) cuja síntese ocorre pela ação sequencial das enzimas γ-glutamilcisteina sintetase e glutathiona sintetase, sendo regulada principalmente pela primeira, em função da disponibilidade de cisteína e GSH por mecanismo de retroalimentação. A GSH é sintetizada principalmente no fígado, sendo exportada para o plasma e, então, para outros tecidos extra-hepáticos (MEISTER; ANDERSON, 1983). A maior parte da glutationa celular (90%) está presente na forma reduzida (GSH) e o restante aparece na forma de oxidada (GSSG). A GSH é um potente antioxidante que, diretamente ou pela ação das peroxidases selênio-dependentes, neutraliza diversas substâncias conhecidas como espécies reativas do oxigênio (ROS). Em condições de exacerbada produção de ROS, estas podem causar desequilíbrio no balanço oxidativo, gerando estado de estresse oxidativo que, dependendo da magnitude, pode causar danos em diversas estruturas celulares, como proteínas e lipídeos, incluindo também o ácido
desoxirribonucleico (DNA) (ABDI; ALI, 1999; OKAMURA et al., 1997).
Danos ao DNA causados por ROS e produtos derivados da lipoperoxidação são
considerados fatores que contribuem para o risco de câncer (WU et al., 2004). Da
mesma forma, a GSH participa diretamente, ou a partir de reações catalisadas pela glutationa S-transferase, na detoxificação de compostos como os xenobióticos, carcinogênicos e seus metabólitos. Além disso, a GSH mantém os grupos SH de proteínas na forma reduzida, assim como de outros compostos com atividade antioxidante, como o ácido ascórbico e a vitamina E, por exemplo (SEN; PACKER, 2000).
A capacidade das PSL em aumentar a síntese de GSH tem sido também objeto de investigação no tratamento de pacientes portadores do vírus da imunodeficiência
humana (HIV) (AGIN et al., 2001; MICKE; BEEH; BUHL, 2002). Estudando os efeitos
da suplementação de WPC em crianças portadores do vírus HIV, Moreno et al. (2006)
eritrocitária de GSH após 16 semanas de estudo. Embora a suplementação não tenha
aumentado a concentração de células linfocitárias T-CD4+, eles perceberam tendência
a aumentar a razão das células CD4+/CD8+. Segundo os autores, a GSH parece exercer
poder estimulatório sobre linfócitos, melhorando a razão de células linfocitárias T-CD4+/CD8+ e diminuindo, assim, a ocorrência de infecções agudas oportunistas.
É descrito que as PSL apresentam atividades antimicrobianas e antivirais.
Peptídeos como a lactoferrina, lactoferricina, lisozima, α -lactoalbumina e β
-lactoglobulinas demonstram forte atividade antimicrobiana em estudos com animais
e em cultura de células de Escherichia coli, Salmonela typhimurium, Shigella
dysinteriae, Lysteria monocytogenes, Bacillus stearothermophilus, Bacillus subtilis, Micrococcus luteus e Helicobacter pylori (BATISH et al., 1988; DI MARIO et al., 2003; IKEDA et al., 1998; PACHECO et al., 2006; SAITO et al., 1991,).
A característica do leite em favorecer o desenvolvimento e a prevenção de doenças ósseas está no seu conteúdo de cálcio. Entretanto, pesquisas têm revelado que, além do cálcio, peptídeos bioativos presentes no leite podem também apresentar
tais efeitos. Estudos in vitro e com animais têm mostrado que as PSL contêm um
componente conhecido como proteína básica do leite (milk basic protein - MBP), que
possui a habilidade de estimular a proliferação e a diferenciação de células osteoblásticas, assim como de suprimir a reabsorção óssea (TAKADA; ALOE;
KUMEGAWA, 1996; TOBA et al., 2000).
O MBP é preparado a partir do fracionamento das PSL, de uma resina de troca catiônica. Contém mais de 98% de proteínas e peptídeos como a lactoferrina,
lactoperoxidase, entre outros (MARSHAL, 2004). Toba et al. (2000) verificaram que a
administração de 300 mg de MBP em 30 homens adultos saudáveis aumentou a concentração de hormônios indicadores da formação óssea, osteocalcina e do
pró-peptídeo pró-colágeno I após 16 dias de estudo. Yamamura et al. (2000) conduziram
estudo duplo-cego com 30 mulheres durante um período de seis meses. Resultados indicaram que a dose diária de 40 mg de MBP aumentou significativamente a
densidade mineral óssea dessas mulheres. Aoe et al. (2001) referiram que a
suplementação com 40 mg de MBP resultou no aumento na densidade mineral óssea de 33 mulheres adultas suplementadas em comparação com o grupo placebo.
Apesar dessas evidências, trabalhos realizados com WPC e WPI existentes no mercado são raramente descritos. Neste sentido, pesquisando o efeito das PSL na dieta de ratos controles ou hipercolesterolêmicos, observou-se que um produto comercial composto da mistura de WPC, WPI e WPH promoveu maior crescimento do osso fêmur desses animais, medido com base em parâmetros morfométricos, como
peso, comprimento e diâmetro do osso fêmur (HARAGUCHI et al., 2009).
Os peptídeos da caseína (casocininas) e das PSL (lactocininas) apresentaram
também efeitos hipotensores em estudos in vitro e em estudos com modelos animais
(FITZGERLAD; MURRAY; WALSH, 2004; GROZIAK; MILLER, 2000; KAWASE et al.,
2000; PINS; KEENAN, 2006). Tais peptídeos exibem atividade inibidora da enzima conversora da angiotensina (ECA), bloqueando, desta forma, a conversão da
angiotensina I em angiotensina II, um potente vasoconstritor (PIHLANTO-LEPPALA et
al., 2006), o que pode também favorecer indiretamente o funcionamento do sistema
cardiovascular.
Neste sentido, outros trabalhos têm encontrado efeitos benéficos das PSL no tratamento e prevenção das doenças cardiovasculares (CHOI; IKEDA; SUGANO, 1989; HARAGUCHI et al., 2010a; JACOBUCCI et al., 2001; KAWASE et al., 2000; LOVATI et al.,
1990; NAGAOKA et al., 1992; SAUTIER et al., 1983; ZHANG; BEYNER, 1993).
Entretanto, embora o efeito hipolipidêmico e hipocolesterolemiante das PSL tenha sido constatado em certos modelos animais, Lovati et al. (1990) e Teixeira et al. (2011 – dados não publicados) sugerem que esses efeitos são ainda controversos em outros modelos, como em ratos e principalmente em humanos, sobre os quais os estudos são
escassos. Por exemplo, Sautier et al. (1983) ressaltaram que as PSL reduziram a
concentração plasmática de colesterol total (CT) em ratos recebendo dietas sem adição de colesterol, redução que foi consequência da diminuição na concentração plasmática de HDL. Choi, Ikeda e Sugano (1989) não detectaram esse mesmo efeito em dietas sem a adição de colesterol, mas redução no CT foi observada quando 0,5% de colesterol foi adicionado às dietas.
Recentemente, Haraguchi et al. (2009) reportaram que as PSL não foram
capazes de reduzir as concentrações plasmáticas de CT e das frações não HDL de ratos hipercolesterolêmicos, com tendência à redução. Entretanto, as dietas utilizadas
no estudo de Haraguchi et al. caracterizavam-se por serem hipercolesterolêmiantes
Além do colesterol, o percentual de proteína nas dietas parece também interferir em sua ação hipolipidêmica. Zhang e Beynen (1993) informaram que dietas com 30% de PSL foram capazes de reduzir a concentração plasmática de CT de ratos, mas não em dietas com 15%. Ainda, estudos têm revelado efeito dependente da idade
dos animais (CHOI; IKEDA; SUGANO, 1989; MINEHIRA et al., 2000). Esses autores
salientaram que as PSL reduziram o CT em ratos adultos (8-9 meses), mas não em ratos jovens (3-4 meses). Dessa forma, esses dados sugerem que o efeito das PSL sobre o perfil lipídico de ratos resulta de complexa interação entre diferentes fatores, como o colesterol dietético, a quantidade de proteína, a idade dos animais e mesmo exercícios físicos.
A maioria dos estudos com modelos animais tem demonstrado resultados
conflitantes. Mas Nagaoka et al. (1992) acreditam que a ação hipocolesterolemiante
das PSL reside na fração BLG, que pode inibir a absorção intestinal de colesterol, via alteração de sua solubilidade no intestino.
Em pesquisa conduzida com 20 adultos saudáveis, o efeito da administração de leite fermentado adicionado de WPC sobre o perfil lipídico e a pressão sanguínea
foi avaliado (KAWASE et al., 2000). O consumo diário de 200 mL do fermentado
enriquecido com WPC, duas vezes ao dia por oito semanas, resultou em significativo aumento na concentração plasmática da HDL e redução na concentração plasmática de triglicerídeos, além de redução da pressão sanguínea sistólica.
Na literatura, alguns autores notificam que as PSL podem favorecer o processo de redução da gordura corporal (HA; ZEMEL, 2003; ZEMEL, 2009) a partir de mecanismos associados ao cálcio e pela homeostase glicêmica induzida pelos BCAAs no jejum. As PSL são ricas em cálcio (cerca de 600 mg/100 g). Estudos epidemiológicos têm verificado relação inversa entre a ingestão de cálcio proveniente do leite e seus derivados e a gordura corporal (ZEMEL, 2009). Provável mecanismo de ação seria de que o aumento no cálcio dietético reduz as concentrações dos hormônios calcitrópicos, principalmente o 1,25 hidroxicolecalciferol [1,25(OH)2D], que, por sua vez, inibe por retroalimentação negativa a transferência de cálcio para os adipócitos. Nos adipócitos, baixas concentrações de cálcio levam à redução da
lipogênese (síntese de novo) e ao aumento da lipólise. Esse processo pode ajudar a
percentual de gordura (<1% em isolados proteicos) e para indivíduos intolerantes à lactose, uma vez que grande parte dos suplementos à base de proteínas do soro é praticamente isenta de lactose.
O alto teor de BCAA presente nas PSL pode, em parte, favorecer o controle e a redução da gordura corporal, por afetar os processos metabólicos da regulação
energética. Em uma série de estudos, Layman (2003), Layman et al. (2003) e Layman
e Baum (2004) mostraram que dietas com maior relação proteína-carboidratos são mais eficientes para o controle da glicemia e da insulina pós-prandial, favorecendo, desta forma, a redução da gordura corporal e a preservação da massa muscular durante a perda de peso. Os BCAAs podem contribuir para a homeostase glicêmica, pois esses aminoácidos não são degradados no fígado, mas nos tecidos periféricos, como os musculares, em proporção relativa à sua ingestão. Essa degradação aumenta as concentrações plasmáticas dos aminoácidos alanina e glutamina, que são transportadas para o fígado para a produção de glicose pela via metabólica conhecida como ciclo alanina-glicose. Estudos sugerem que o ciclo alanina-glicose contribui em até 40% com a glicose endógena produzida durante o exercício e em até 70% depois de jejum noturno, estabilizando, assim, a glicemia em períodos de jejum e reduzindo a resposta da insulina após as refeições (LAYMAN, 2003). Por elevar as concentrações
plasmáticas de BCAA (ESMARCK et al., 2001), a utilização das PSL nesses tipos de
dietas é vantajosa, por reduzir a liberação de insulina pós-prandial e maximizar a ação do fígado no controle da glicemia a partir da gliconeogênese hepática.
Para avaliar tais hipóteses, Layman et al. (2003) submeteram mulheres obesas
(>15% do peso ideal) a dois tipos de dietas isocalóricas. Um grupo (proteico) recebeu
dieta com 1,5 g.kg-1.dia-1 de proteína, com 22,3 g/dia de BCAA, sendo 9,9 g/dia de
após 16 semanas, a dieta proteica ocasionou perda significante de peso, gordura corporal e resultou menos perda de massa magra (p<0,05).
Semelhantemente, em estudo prévio anteriormente relatado (HARAGUCHI et
al., 2010a), as dietas contendo PSL como fonte proteica foram capazes de promover
valores estatisticamente mais altos de glicemia de jejum (12 horas) do que dietas-controle compostas de caseína.
Em outra investigação, também realizada com ratos, Bouthegourd et al.
(2002) encontraram que refeições pré-exercício contendo as PSL enriquecidas com a fração ALA foram mais eficientes que refeições contendo apenas glicose ou proteínas do leite para a manutenção da massa muscular na perda de peso e mantiveram alta taxa de oxidação lipídica durante o exercício, similar às taxas verificadas quando o exercício era realizado em jejum. Os autores documentaram que a captação intestinal e a composição de aminoácidos da proteína tiveram papel decisivo nos resultados. Porém, os mecanismos de ação não tinham sido esclarecidos. Possivelmente os BCAAs
tiveram efeito similar aos do estudo de Layman (2003), Layman et al. (2003) e
Haraguchi et al., (2010a).
A colecistoquinina (CCK) e o peptídeo similar ao glucagon (GLP-1) são dois hormônios produzidos pelas células intestinais e sua liberação na corrente sanguínea ocorre em presença de macronutrientes no duodeno, produzindo efeito supressor do
apetite (BALLINGER; CLARK, 1994; VERDICH et al., 2001). Comparando os efeitos das
proteínas do leite, caseína e as PSL, Hall et al. (2003) avaliaram seus efeitos sobre o apetite, percepção de fome, saciedade e hormônios gastrointestinais. Realçaram que quando os voluntários ingeriam solução contendo 48 g de PSL 90 minutos antes da refeição, apresentavam significativa redução do apetite e da ingestão calórica e aumento da saciedade em comparação com o grupo que ingeriu a mesma solução contendo caseína. Essa percepção, apesar de subjetiva, estava relacionada às mais altas concentrações sanguíneas de CCK e do GLP-1, geradas pela ingestão da solução contendo as PSL, indicando possível mecanismo pelo qual as PSL podem ajudar no controle do peso corporal.
assim, estudar suas propriedades sob as condições metabólicas do exercício pode ajudar a elucidar os possíveis benefícios, assim como seus respectivos mecanismos.
2.4 As PSL e o exercício físico
Avaliar a ação de nutrientes e de substâncias ergogênicas sobre o desempenho físico torna-se, muitas vezes, tarefa difícil, principalmente quando se quer eleger o parâmetro para considerar qual nutriente, ou substância, tem efeito direto sobre o desempenho. Entretanto, se determinada substância exerce efeito sobre, por exemplo, a composição corporal do atleta, possivelmente tal benefício afetará, igualmente, seu desempenho. Entre os principais argumentos que levam pessoas
fisicamente ativas e atletas a utilizarem os inúmeros suplementos “whey”, estão seus
possíveis efeitos sobre o anabolismo muscular. Na literatura, os primeiros trabalhos que descreveram os possíveis benefícios das PSL no exercício físico datam do final da
década de 90 e início da década seguinte (AGIN et al., 2001; BURKE et al., 2001;
LANDS; GREY; SMOUTAS, 1999; VAN HALL et al., 2000). Entretanto, por serem
estudos pioneiros e do tipo observacional, os mecanismos associados aos benefícios não foram avaliados.
Lands, Grey e Smoutas (1999) compararam o efeito de um suplemento nutricional composto de WPC (Immunocal®) e da caseína sobre o desempenho físico de adultos jovens, medido por teste isocinético em bicicletas. O grupo suplementado com WPC (20 g/dia) apresentou aumento de 35,5% na concentração de glutationa em linfócitos de células sanguíneas. Além disso, os voluntários suplementados conseguiram gerar mais potência e maior quantidade de trabalho em testes de velocidade. Os autores concluíram que o aumento na concentração de glutationa foi decisivo para os efeitos constatados.
Voluntários submetidos a programa de exercícios de resistência por seis semanas e suplementados com PSL apresentaram mais aumento de massa magra e da
força muscular do que voluntários não suplementados (BURKE et al., 2001). Embora a
Nos anos que se seguiram, diferentes autores relataram possíveis benefícios associados ao consumo de PSL por atletas, como, por exemplo, a capacidade em melhorar a resposta imunológica e antioxidante (MIDDLETON; JELEN; BELL, 2004),
reposição do glicogênio muscular (MORIFUJI et al., 2005b) e mesmo o anabolismo
muscular (BORSHEIM; AARSLAND; WOLFW, 2004; CRIBB et al., 2006; HARAGUCHI et
al., 2010b; TANG et al., 2009; TRIPTON et al., 2004; 2007).
Existem diferentes hipóteses pelas quais as PSL poderiam favorecer a hipertrofia muscular, mas nem todas têm sido cientificamente comprovadas. A quantidade e o tipo de proteína ou de aminoácidos ingeridos influenciam a síntese
proteica (BOIRIE et al., 1997; DANGIN et al., 2003; LEMON 1991; TARNOPOLSKY;
MacDOUGALL; ATKINSON, 1988; WOLFE, 2000). Até o início da década de 90 não havia consenso científico acerca das reais necessidades proteicas de atletas e pessoas fisicamente ativas, pois se acreditava que a atividade física era insuficiente para alterar significativamente as necessidades proteicas. Tal afirmativa não havia sido sistematicamente avaliada até aquele momento pela comunidade científica.
Em uma série de publicações, Lemon, Yarasheski e Dolny (1984) e Lemon (1991; 2000) preconizaram que atletas e indivíduos fisicamente ativos necessitam de acréscimo em suas necessidades proteicas. Esses autores recomendam valores entre 1,2 e 1,4 g.kg-1.dia-1 para os exercícios de resistência e 1,6 a 1,7 g.kg-1.dia-1 para os
exercícios de força, bem superiores aos 0,8-1,0 gkg-1.dia-1 estabelecidos para
indivíduos sedentários. Além da quantidade de proteína, fatores como o tipo de proteína, o momento da ingestão e sua distribuição ao longo das refeições parecem exercer forte impacto no anabolismo muscular (BØRSHEIN; AARSLAND; WOLFE,
2004; ESMARCK et al., 2001; LEMON, 2000).
Esmarck et al. (2001) avaliaram o efeito da suplementação proteica (10 g de
Outra característica que afeta diretamente o metabolismo de proteínas é a velocidade da sua digestão. As PSL caracterizam-se por não se coagularem no pH ácido do estomago. Com isso, são digeridas mais rapidamente quando comparadas às caseínas, que se coagulam nesse pH, retardando sua digestão. Desta forma, aminoácidos provenientes da digestão da caseína aparecem no sangue de forma mais lenta, gerando um “platô” de concentração de menor magnitude que a promovida pelas PSL. Essas características levaram a classificar as caseínas como proteínas de digestão lenta, “slow proteins”, e as PSL como de rápida absorção, “fast proteins”, sendo, consequentemente, associadas a padrões distintos de síntese, oxidação e degradação proteica (BOIRIE et al., 1997; DANGIN et al., 2003).
Além de aumentar as concentrações plasmáticasde aminoácidos, a ingestão de soluções contendo PSL aumenta, significativamente, a concentração de insulina plasmática (ZAWADZKI; YASPELKIS; IVY, 1992; CALBET; MACLEAN, 2002) o que favorece a captação de aminoácidos para o interior da célula muscular, otimizando a síntese e reduzindo o catabolismo protéico. Calbet e MacLean (2002) avaliaram o efeito de quatro diferentes soluções, uma contendo somente 25g/L de glicose e três contendo 25g/L de glicose e 0,25g/Kg de peso corporal de três diferentes fontes protéicas: ervilhas, PSL e leite integral sobre as concentrações de insulina e aminoácidos. Observaram que, após 20 minutos da ingestão, a solução contendo PSL provocou elevação na concentração plasmática de insulina de forma significante (p<0,05). Essa elevação foi aproximadamente duas vezes maior que a observada com a solução contendo leite integral (615±104 pmol/L e 388±51pmol/L para PSL e leite integral respectivamente) e quatro vezes maior que a solução contendo somente glicose (615±104pmol/L e 208±53pmol/L para PSL e glicose respectivamente). Após 80 minutos, a concentração de insulina em todos os grupos voltou aos valores iniciais. Observaram, também, que, após 20 minutos, a solução composta pelas PSL provocou uma maior elevação na concentração plasmática de aminoácidos essenciais
(738±75μmol/L para 1.586±178μmol/L), principalmente os BCAA, do que as outras
soluções. Resultados semelhantes tem sido descritos recentemente (MORIFUJI et al.
2010; REITELSEDER et al. 2011).
Segundo Boirie et al. (1997), por promoverem rápido e alto aumento nas
pós-prandial, o que pode ser uma vantagem se ingeridas após o exercício físico (BURKE et al., 2001; HULMI et al., 2009; TANG et al., 2009).
O aparecimento da fadiga durante o exercício está frequentemente associado à depleção do glicogênio muscular. Dessa forma, altas concentrações de glicogênio muscular antes dos exercícios são essenciais para o desempenho físico, o qual dependerá principalmente da eficiência no processo de recuperação dos seus estoques entre as sessões de treinamento. O período inicial após o treinamento é fundamental na recuperação dos estoques de glicogênio, pois é nesse período que os processos recuperativos são favorecidos em decorrência de adaptações bioquímicas e moleculares provocadas pelo exercício. É nesse período, por exemplo, que a reposição do glicogênio se encontra mais acelerada, em razão da resposta insulínica (ZIERATH, 2002), do aumento da expressão de proteínas celulares, como do transportador
GLUT-4 e de diferentes proteínas quinases como MAPK e PI3-kinase (CHIBALIN et al.,
2000; DELA et al., 1993; HJELTNES et al., 1998; ZIERATH, 2002), e do aumento na atividade da enzima glicogênio sintase (MORIFUJI et al., 2005a; NUR et al., 1995).
Nesse processo, é conhecido que os carboidratos são os principais nutrientes para a recuperação do glicogênio. Entretanto, estudos mostram que a combinação de carboidratos e proteínas é mais efetiva que apenas os carboidratos nessa reposição
(IVY et al., 2002; ZAWADZKI; YASPELKIS; IVY, 1992) e que PSL são capazes de
promover maior deposição do glicogênio muscular e hepático que as caseínas após o exercício, justamente por aumentarem a atividade da enzima glicogênio sintase
(MORIFUJI et al., 2005a). Outra hipótese é de que as PSL podem favorecer o
crescimento muscular e mesmo o desempenho físico, devido às suas propriedades antioxidantes (HARAGUCHI et al., 2010b).
2.5 As proteínas do soro do leite, o estresse oxidativo e o exercício
mal de Parkinson (TOBÓN-VELASCO et al., 2010), diabetes (STANTON, 2011), entre outros.
Os radicais livres podem ser definidos como qualquer átomo ou molécula que contém um ou mais elétrons não pareados, com existência independente (HALLIWELL, 1994). São moléculas de meia-vida curta, altamente instáveis e reativas. Basicamente, o termo espécies reativas do oxigênio (ROS) refere-se não apenas aos radicais oxigênio-centrados, mas também às substâncias reativas derivadas do oxigênio, como o peróxido de hidrogênio, por exemplo.
De forma semelhante, o termo espécies reativas do nitrogênio (RNS) refere-se tanto aos radicais contendo nitrogênio como outras moléculas reativas cujo centro reativo é o nitrogênio. Já o termo espécies reativas do oxigênio e nitrogênio (RONS) é também usado como um termo coletivo para os ROS e RNS e inclui também as outras espécies reativas. A produção de ROS é uma consequência natural do metabolismo aeróbio, sendo, inclusive, importante para a manutenção de muitas funções fisiológicas, como, por exemplo, para o controle da expressão gênica de diferentes proteínas, regulação de vias sinalizadoras celulares e até mesmo para a produção de
força muscular (DROGE, 2002; MAHADEV et al., 2001; REID, 2001).
Em condição pró-oxidativa, a concentração de ROS pode aumentar devido à maior geração intracelular ou pela deficiência dos mecanismos antioxidantes, gerando desequilíbrio entre moléculas oxidantes e antioxidantes, com a tendência ao estado oxidativo. Esse desequilíbrio tem sido denominado de estresse oxidativo (SIES, 1993).
Os primeiros RONS gerados nas células são o íon superóxido (O2•-) e o óxido
(1)
O H2O2 é um composto reativo mais estável, permeável nas membranas, que
pode, em circunstâncias específicas, gerar outros RONS, como o radical hidroxil (OH•), a partir de reações catalisadas por metais, como na reação de Fenton, por exemplo. Isso é possível mesmo sendo fraco agente oxidante e não sendo aparentemente capaz de oxidar DNA e lipídeos diretamente (HALLIWELL; GUTTERIDGE, 2007).
(2)
Por outro lado, o radical hidroxil (OH•) é extremamente reativo, com forte
potencial oxidativo, sendo considerado o mais danoso ROS presente em materiais biológicos. Já o NO, sintetizado a partir do aminoácido arginina em diferentes tipos celulares, apesar de ser um fraco agente redutor, quando reage com o íon superóxido produz o peroxinitrito, um forte agente oxidante que leva à depleção de grupos tióis, à nitração de proteínas e a danos no DNA (HALLIWELL, 1994).
(3)
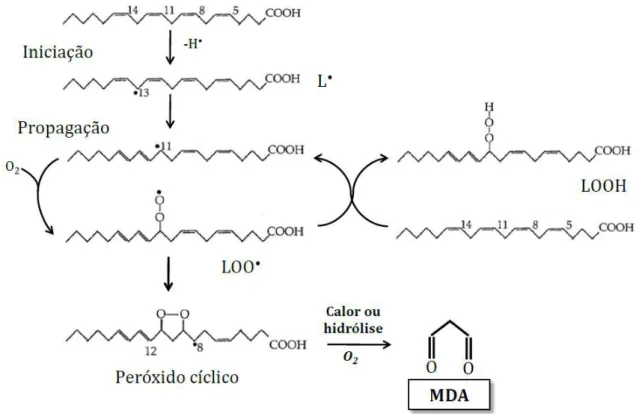
Desde que os RONS possam iniciar reações radicalares em cadeia em diferentes moléculas biológicas, outros RONS secundários podem ser gerados como parte dessas reações. Um exemplo inclui radicais intermediários formados durante a peroxidação lipídica. A bicamada lipídica é formada por grande quantidade de ácidos graxos poli-insaturados (PUFA) e sua peroxidação, que se desenvolve em vários estádios, pode levar a alterações em sua função biológica. Inicialmente, os ROS, como o hidroxil, por exemplo, iniciam a peroxidação abstraindo um átomo de hidrogênio de um metileno da cadeia lateral, formando um radical alquila e uma molécula de água
(HALLIWELL; CHIRICO, 1993). O radical alquila (L•) apresenta um elétron
radical alquila inicialmente formado combina-se com o oxigênio, formando o radical
peroxila (LOO•), o qual pode abstrair um hidrogênio alílico de outro ácido graxo,
gerando outro radical carbono-centrado, promovendo, assim, a etapa conhecida como propagação. A reação termina com a formação de hidroperóxidos lipídicos (LOOH), peróxidos cíclicos ou, ainda, um malondealdeído (MDA), conforme mostrado na FIG. 2. O MDA é um dos principais e mais estudados produtos da peroxidação dos PUFAs, principalmente do ácido araquidônico. É considerado mais do que simples marcador da liporoxidação, pois é capaz de interagir com ácidos nucleicos e outras proteínas, levando à formação de compostos de características genotóxicas (DEL RIO; STEWART; PELLEGRINI, 2005).
FIGURA 2 – Principais reações ocorridas durante o processo de peroxidação lipídica
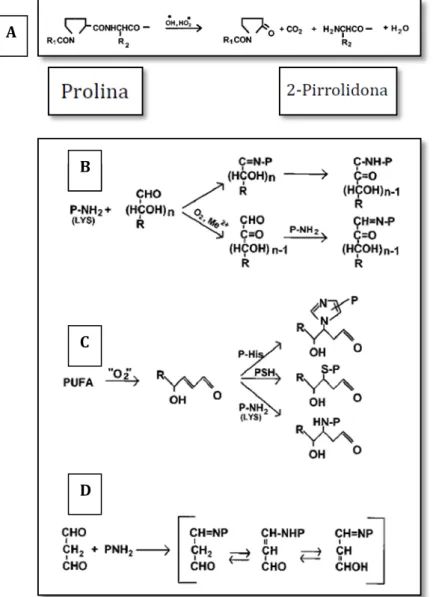
Os RONS podem, também, promover modificações oxidativas em proteínas celulares. A carbonilação de proteínas é um tipo particular de oxidação caracterizada pela adição de um grupo carbonila, como aldeído ou cetona, a partir de uma cascata de reações oxidativas irreversíveis e irreparáveis (BARREIRO; HUSSAIN, 2010). É considerada marcador primário do estresse oxidativo e origina-se de proteínas que reagem diretamente com RONS, levando à formação de derivados proteicos ou peptídeos fragmentados contendo grupos carbonilas altamente reativos.
FIGURA 3 – Formação de proteínas carboniladas por oxidação direta do resíduo de prolina (A) ou por glicação e glicoxidação (B); a partir da reação do 4-hidroxi-2-nonenal com resíduo de lisina (C); reação de grupos amino com o MDA (D)
Fonte: Berllett e Stadman (1997).
O exercício físico é conhecido por aumentar a geração de ROS devido ao
aumento na utilização do oxigênio (DAVIES et al., 1982; REID, 2008). Entretanto, tem
sido proposto que o tipo e a intensidade do exercício físico podem afetar
diferentemente o sistema antioxidante (DA SILVA et al., 2009; MALAGUTI et al.,
A
B
C
2009). A prática regular de exercícios físicos de intensidade baixa a moderada produz moderada quantidade de ROS, que, por sua vez, causa adaptação nos sistemas antioxidantes e de reparação. Concentrações moderadas de ROS induzem a expressão de enzimas antioxidantes e de outros mecanismos de defesa, tais como superóxido dismutase, peroxidases e glutationa, sendo, neste caso, o exercício considerado um
próprio antioxidante (GOMEZ-CABRERA; DOMENECH; VINA, 2008; RISTOW et al.,
2009). O princípio desse fenômeno é baseado no conceito da “hormese”, um efeito caracterizado por relação dose-resposta em que baixas doses de uma substância são estimulatórias e alta dose, inibitória (CALABRESE; BALDWIN, 2003).
Assim, o exercício de alta intensidade e exaustivo leva a exacerbado aumento na produção de ROS, causando distúrbio no balanço pró-oxidante/antioxidante, podendo resultar estado de estresse oxidativo. Essas alterações podem levar à degradação de proteínas musculares, contribuindo para o aparecimento de sinais e sintomas de possíveis lesões musculares, como, por exemplo, o cansaço e a perda de
força muscular (BLOOMER et al., 2007), afetando, assim, o desempenho físico.
A formação de ROS induzida pelo exercício aeróbio de alto volume e em diferentes intensidades tem sido reportada em promover fadiga muscular (POWERS; JI; LEEUWENBURGH, 1999; REARDON; ALLEN, 2009; REID; KHAWLI; MOODY, 1993)
e dano no DNA (OKAMURA et al., 1997). Em relação ao exercício de resistência com
pesos, também é descrito aumento variável na concentração de moléculas oxidadas
após o exercício (LIU et al., 2005; RAMEL; WAGNER; ELMADFA, 2004). O plasma é o
principal material biológico utilizado para a avaliação do impacto desse tipo de exercício sobre a produção de produtos oxidativos e marcadores antioxidantes (DEMINICE et al., 2010; HUDSON et al., 2008).
A biópsia do músculo-esquelético, embora em menor proporção, é também utilizada, enquanto que o uso de outros tecidos, como o fígado, é praticamente impraticável, devido à natureza invasiva das biópsias para serem realizadas em estudos desse tipo com humanos e também devido à dificuldade em se estabelecer um protocolo de exercícios de resistência com pesos, do tipo musculação, com
animais de laboratório. Uchiyama et al. (2006), um dos pioneiros em estabelecer um
marcadores indiretos, tais como alterações musculares na atividade das enzimas superóxido dismutase, glutationa peroxidase e catalase.
O dano oxidativo induzido pelo exercício pode produzir inflamação e, por conseguinte, disfunção tecidual, afetando, consequentemente, a contração muscular e a produção de força motora, favorecendo o desenvolvimento da fadiga muscular
(JACKSON, 2009; POWERS; JI; LEEUWENBURGH, 1999; REID; KHAWLI; MOODY,
1993). Até o presente momento, não está bem esclarecido se o estresse oxidativo pode ocasionar alteração na síntese proteico-muscular induzida pelo exercício de resistência com pesos, sendo possível que as ROS possam estar envolvidas na
diminuição/redução do efeito anabólico de nutrientes (MARZANI et al., 2008;
MOSONI et al., 2010). Marzani et al. (2008) registraram que a leucina apresenta
capacidade diminuída em estimular a síntese muscular de ratos idosos in vitro, mas
que a suplementação com vitaminas e compostos antioxidantes foi capaz de reverter o efeito reduzido da leucina nesses animais.
Os antioxidantes são geralmente conhecidos por protegerem o organismo contra o estresse oxidativo induzido pelo exercício, podendo, inclusive, melhorar o desempenho esportivo (LANDS; GREY; SMOUTAS, 1999; ROSSI; BLOSTEIN-FUJII; DiSILVESTO, 2000). Entre os inúmeros compostos atualmente conhecidos por apresentaram propriedades antioxidantes, as PSL merecem atenção especial.
Conhecidas pelo seu alto valor biológico (HARAGUCHI et al., 2010a), diferentes
estudos têm revelado seus benefícios para o desempenho esportivo, assim como para
melhorar a resposta antioxidante durante o treinamento aeróbio (ELIA et al., 2006).
Entretanto, são menos conhecidos os efeitos das PSL sobre o sistema antioxidante e sobre biomarcadores de produtos de oxidação em diferentes tecidos, induzidos pelo exercício de resistência com pesos.
Embora crescentes evidências tenham sugerido que o estresse oxidativo possa inibir a síntese proteica via diminuição da fosforilação de proteínas sinalizadoras do
metabolismo proteico (CHEN et al., 2010; ZHANG et al., 2009), como, por exemplo, a
proteína 4E-BP1 em miócitos e em células neuronais PC12 (O’LOGHLEN et al. 2006;
PHAM, SUGDEN e CLERK, 2000) e mesmo a mTOR (ZHANG et al. 2009), não está
2.6 Mecanismos moleculares do crescimento muscular
A prática regular de exercícios físicos, em particular os de resistência/força com pesos, em combinação com adequada ingestão de nutrientes, principalmente de proteínas, é uma eficiente combinação para estimular e promover o crescimento
muscular (BIOLO et al., 1995; 1997). Esse efeito é consequência do balanço proteico,
que se torna positivo em virtude de aumento na taxa de síntese proteica excedendo a taxa de degradação.
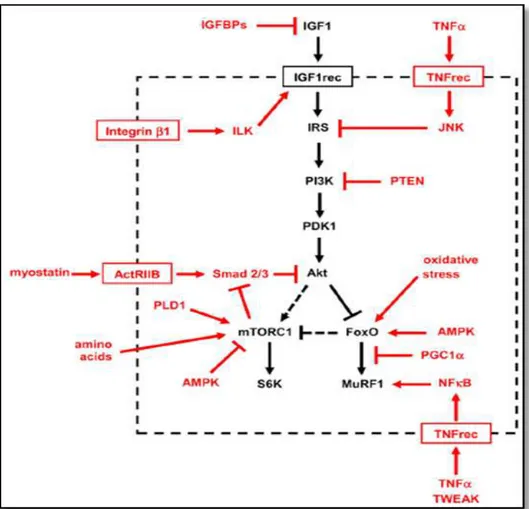
Os mecanismos moleculares de síntese e degradação proteica envolvem uma rede de vias moleculares sinalizadoras, compostas de diferentes quinases e fosfatases que, quando fosforiladas ou defosforiladas, ativam vias específicas, resultando em processos de síntese ou degradação. Entre essas vias, a que envolve o fator de crescimento semelhante à insulina-1 (IGF-1), conhecida como IGF-1-Akt/proteína quinase B (IGF-1-Akt/PKB), é considerada a principal via metabólica que regula a
síntese proteica (ROMMEL et al., 2001; SCHIAFFINO; MAMMUCARI, 2011). Tal via
envolve uma proteína celular conhecida como mTOR, uma serina/treonina quinase que integra diferentes vias sinalizadoras com o objetivo de controlar, entre outros
processos, a tradução do mRNA para a síntese de proteínas (BODINE et al., 2001;
GLASS, 2005). A via IGF-1-Akt1 compartilha grande parte de seus componentes com a via insulina-Akt2 e ambas realizam intersecções em várias etapas.
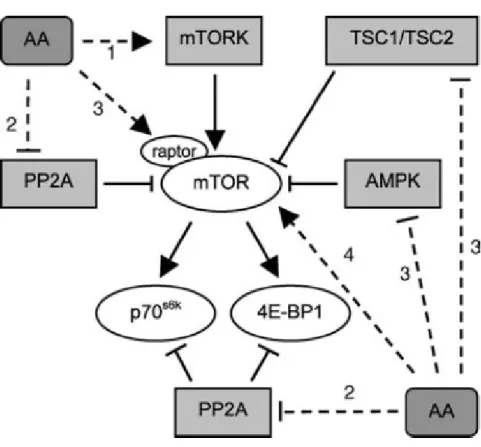
Os fatores de crescimento, como, por exemplo, o IGF-1, uma vez ligado em seu respectivo receptor na membrana celular, promove a fosforilação e ativação do substrato receptor da insulina (IRS), que, por sua vez, ativa outra molécula sinalizadora, a phosphatidylinositol 3-kinase (PI3K) (BACKER et al., 1993). Um dos alvos da PI3K é a proteína quinase B (PKB), que ativa então a mTOR direta ou indiretamente. O efeito indireto é mediado pela inibição na formação do complexo
TSC1/TSC2. A ativação direta ocorre pela ação da proteína Ras homologue enriched in
brain (RHEB). A mTOR forma dois complexos proteicos diferentes, mTORC1 e