UNIVERSIDADE FEDERAL DE SÃO CARLOS Centro de Ciências Exatas e de Tecnologia
DEPARTAMENTO DE QUIMICA Programa de Pós-graduação em Química
“
Complexos de Ru (II) com ligantes de interesse biológico:
síntese,
caracterização e citotoxicidade
”
Melina Andrea Mondelli Fleitas*
Dissertação apresentada como parte dos requisitos para obtenção do título de MESTRE EM QUÍMICA, área de
concentração: QUÍMICA
INORGÂNICA.
Orientador: Prof. Dr. Alzir Azevedo Batista * bolsista CAPES
Ficha catalográfica elaborada pelo DePT da Biblioteca Comunitária da UFSCar
M741cr
Mondelli Fleitas, Melina Andrea.
Complexos de Ru (II) com ligantes de interesse biológico : síntese, caracterização e citotoxicidade / Melina Andrea Mondelli Fleitas. -- São Carlos : UFSCar, 2011.
128 f.
Dissertação (Mestrado) -- Universidade Federal de São Carlos, 2011.
1. Química inorgânica. 2. Complexos de rutênio. 3. Síntese inorgânica. 4. Citotoxicidade. 5. Química bioinorgânica. 6. Bioligantes. I. Título.
Enquanto estiver vivo, sinta-se vivo.
Se sentir saudades do que fazia, volte a fazê-lo.
Não viva de fotografias amareladas...
Continue, quando todos esperam que desistas.
Não deixe que enferruje o ferro que existe em você.
Faça com que em vez de pena, tenham respeito por você.
Quando não conseguir correr através dos anos, trote.
Quando não conseguir trotar, caminhe.
Quando não conseguir caminhar, use uma bengala.
Mas nunca se detenha.
Agnes Gonxha Bojaxhiu
Dedico especialmente este trabalho
Aos meus queridos pais, Hugo Mondelli e Renée Fleitas pelo apoio, incentivo, seus ensinamentos e suas palavras motivadoras... os quero muito!!!
Á Prof. Dra. María H. Torre pelo apoio em todo momento, carinho, ensinamentos e as oportunidades oferecidas...muito obrigada!!!
Á minha irmã Fiorella e seu marido Santiago.
AGRADECIMENTOS
Agradeço pela oportunidade e pela infraestrutura oferecida ao Prof. Dr. Alzir Azevedo Batista.
À Prof. Dra. María H. Torre pelos ensinamentos, apoio, carinho e conselhos.
Aos meus chefes em Uruguai, Profs. Eduardo e Dr. Carlos Kremer pela autorização para vir, e a licença concedida neste tempo em que esteve fora.
Aos Prof. Dr. Javier Ellena e Dr. Victor Deflon, da USP-SC pela resolução das estruturas cristalinas.
À Dra. Denise Crispim (UNIFRAN) e à Dra. Heloisa Selistre (UFSCar) pela disponibilização dos seus laboratórios para a realização dos testes biológicos.
À Prof. Rose Maria Carlos pelo seu apoio científico.
Ás minhas queridas amigas Edjane Rocha e Marilia Barbosa, pelo recebimento, conselhos e apoio. Edjane muito obrigada por ter me mostrado o verdadeiro valor da amizade.Foi um prazer ter te conhecido!!!!!
Aos infinitos apoios recebidos de minha querida família começando por meus pais e minha querida irmã e cunhado; os meus amigos em Uruguai Adriana Servetti, Alejandra Zagarzazú, Alicia Mollo, Ana Della Santa, Ana Techera, Andrea Garcia, Carolina Buzó, Eduardo Santi, Gianella Facchin, Jacqueline Soppi-Coppola, Laura Palleiro, Lorena Gonzatto, María Casatroja, Miriam Villella, Mónica Carle,Patricia Sorondo, Rossana Engerman, assim também como aos integrantes de A.E.R.C.U (“Associazione Emigrati Regione Campania in Uruguay”), A.N.C.R.I (“Associazione Nazionale di Combattenti e Riduci Italiani) e aos meus colegas de trabalho na Faculdade de Química em Uruguai.
Às secretárias da Pos-Graduação do Departamento de Química da UFSCar, Ariane, Cristina e Luciani, pela sua infinita ajuda.
Aos técnicos do Departamento de Química da Universidade, sempre prestativos e dispostos a ajudar, Ademir, Doraí,Luciana e Paulo.
Rodrigues, Eliana Valle, Fábio do Nascimento, Giovanna Trevisan, Jõao Barolli, Jõao Possatto, José Cruz Júnior, Juliana, Leonardo Cantanhede, Lucas Pozzi, Marcio Almeida, Patrick Pires, Rodrigo de Souza.
Aos colegas do laboratório LAFIB.
Aos órgãos de fomento FAPESP e CNPq. À RED CYTED pela oportunidade de ter conhecido professores e alunos de Argentina, Espanha, México, Paraguai, Portugal e Venezuela.
viii
LISTA DE ABREVIATURAS E SIMBOLOS
2-pyS Íon 2-mercaptopiridinato 2-pySH 2-mercaptopiridina 4-Mepy 4-metilpiridina
A2780 Câncer ovariano
A375 Melanoma
A498 Câncer de rins
A549 Câncer de pulmão
A.A.A. Analgésico, antipirético e antiinflamatório
a.C. Antes de Cristo
A.D.M.E Absorção, distribuição, metabolização e excreção A.I.N.E Antiinflamatorio não esteroidal
B16F10-Nex2 Melanoma murino bipy 2,2’-bipiridina
CAS Chemical Abstracts Subject cGMP Guanilato monofosfato cíclico cNOS Óxido nítrico sintetase constitutiva CH1 Câncer de faringe e laringe
d.C. Depois de Cristo
dmpm mercaptopirimidina ou íon 4,6-dimetil-2-mercaptopirimidinato
DNA Ácido desoxirribonucleico dppb 1,4-bis(difenilfosfina)butano dppe 1,2-bis(difenilfosfina)etano dppm 1,1-bis(difenilfosfina)metano dppp 1,3-bis(difenilfosfina)propano ϵ Absortividade molar (M-1cm-1) Epa Potencial de pico anódico Epc Potencial de pico catódico
EVSA-T Câncer de mama
F.N. Formulário Nacional
FRED Fator de relaxamento endotélio dependente GTP Guanosina trifosfato
H226 Câncer de pulmão
HCT-15 Câncer de colón HCV29t Câncer de bexiga
HeLa Câncer de colo de útero
HL60 Leucemia
IARC/ OMS Agência Internacional para Pesquisa em Câncer/ Organização Mundial da Saúde
I.C. Índice de coordenação
ix
IGROV Câncer ovariano
I.U.P.A.C. International Union of Pure and Applied Chemistry
Iv Intravenoso
IV Infravermelho
Jurkat Leucemia
Λ Lambda, comprimento de onda
M19 Melanoma
MCF-7 Câncer de mama
MTD Dose Máxima Tolerada
MTT Brometo de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazol NAMI New Anti-tumor Metastasis Inhibitor
NBu4 Cátion tetrabutilamônio
NOSe Enzima óxido nítrico sintasa endotelial
pic Íon picolínato
picH Ácido picolínico
31P{1H} Fósforo-31 desacoplado de hirogênio (RMN) PPh3 Trifenilfosfina
PTBA Perclorato de tetrabutilamônio RMN Ressonância Magnética Nuclear
S.D. Desviação estandar
sGC Guanilato ciclasa
SiHa Câncer cervical
SW480 Câncer de colo
TK-10 Carcinoma renal
TMS Tetrametilsilano
UACC-62 Melanoma
V79 Fibroblastos de pulmão de hamster chinês
x
LISTA DE TABELAS
TABELA 01- Medicamentos contendo íons metálicos, usados como fármacos no mundo...4
TABELA 02- Alguns regimes para o tratamento de alguns cânceres...11
TABELA 03- Drogas à base de platina que receberam aprovação para uso humano em ao menos um pais...12
TABELA 04- Citotoxicidade de complexos de cobre (II) com indoloquinolina (1a - 4b)
ou ligantes “bases de Paullone” em três linhagens de células cancerosas...17
TABELA 05- Complexos de cobre (II) que apresentam atividade semelhante à cisplatina, em células de câncer humano...18
TABELA 06- Complexos de estanho que apresentam melhor atividade que a cisplatina, em células de câncer humano...20
TABELA 07- Atividade citotóxica de tiosemicarbazonas derivadas de 2-piridinoformamida e seus complexos de Ga(III) em células de glioblastoma...22
TABELA 08- Atividade citotóxica de alguns complexos de ouro (I)...23
TABELA 09- Avaliação de complexos de rutênio contendo fosfinas e tiossemicarbazonas como potenciais agentes antitumorais...26
TABELA 10- Atividade de complexos bifosfínicos de Au (I), Ag (I) e Cu (I) em ratos portadores de leucemia ip P388, sarcoma de células reticulares ip M5076 e melanoma ip B16 e atividade citotóxica in vitro para células melanoma B16...28
TABELA 11- Valores de IC50 de alguns complexos contra a linhagem celular derivada de tumor humano MDA-MB231 (ensaios em DMSO)...29
TABELA 12- Valores de IC50 para nitrosilo complexos de rutênio contra as linhagens Jurkat (leucemia humana), V79 (fibroblastos de pulmão de hamster Chinês) e B16F10-Nex2 (células de melanoma murino) (ZACHI, 2008)...38
TABELA 13- Valores de IC50 para nitrosilo complexos de rutênio contra a linhagem MDA-MB231. Complexos dissolvidos em DMSO; tempo de incubação: 48h...38
TABELA 14- Ligantes utilizados...43
TABELA 15- Freqüências (cm-1) correspondentes às principais bandas e atribuições dos espectros no IV do complexo [RuCl(dmpm)2(NO)]...61
TABELA 16- Principais valores de distâncias [Å] e ângulos [o] e ν NO (em cm-1)...67
xi
[RuCl(dmpm)2(NO)]...70
TABELA 18- Principais distâncias de ligação (Å), presentes no cristal do [RuCl(dmpm)2(NO)]...71
TABELA 19- Principais ângulos de ligação (º), presentes no cristal do [RuCl(dmpm)2(NO)]...71
TABELA 20- Dados dos análises elementares dos compostos sintetizados...72
TABELA 21- Resultados obtidos do espectro UV-vis para os complexos [Ru(pic)2(dppb)] e [Ru(dmpm)2(dppb)]...74
TABELA 22- Estiramentos simétricos e assimétricos de alguns complexos sintetizados em nosso laboratório e seu correspondente ∆ (cm-1)...75
TABELA 23- Frequências (cm-1) correspondentes ás principais bandas e atribuições dos espectros no IV dos complexos [Ru(dppb)(pic)2] e [Ru(dppb)(dmpm)2]...76
TABELA 24- Valores de freqüências de estiramento de interes, de alguns compostos sintetizados em nosso laboratório...77
TABELA 25- Dados de refinamento das estruturas dos complexos (a) [Ru(pic)2(dppb)] e (b) [Ru(dmpm)2(dppb)]...81
TABELA 26- Principais distâncias de ligação (Å) dos complexos (a) [Ru(pic)2(dppb)] e (b) [Ru(dmpm)2(dppb)]...82
TABELA 27- Principais ângulos de ligação (º) dos complexos (a) [Ru(pic)2(dppb)] e (b) [Ru(dmpm)2(dppb)]...82
TABELA 28- Distâncias dos heteroátomos dos ligantes dmpm e pic ao rutênio em outros compostos do rutênio...83
TABELA 29- Valores de IC50 (M) dos complexos contra a linhagem celular derivada de tumor humano MDA-MB231,U251 e V79...84
xii
LISTA DE FIGURAS
FIGURA 01.- Estrutura do salvarsan...3
FIGURA 02.-Estrutura de alguns fármacos inorgânicos...5
FIGURA 03.- Múmia Hatsheput, primeira mulher a desempenhar o posto de faraó..6
FIGURA 04-.(a)- Tipos de câncer mais incidentes estimados para 2010, exceto pele não melanoma, na população brasileira;(b) tipos de câncer mais incidentes no período 2002-2006 no Uruguai...9
FIGURA 05- Estruturas dos fármacos comercializados no mundo à base de platina...12
FIGURA 06- Drogas à base de platina que entraram em testes clínicos, mas seus desenvolvimentos não foram continuados por causas ou efeitos não previsiveis na fase I, ou por falta de atividade nas fases II/III de testes clínicos, ou por razões econômicas...13
FIGURA 07- Potenciais fármacos a base de platina em testes clínicos (WHEATE et al, 2010)...14
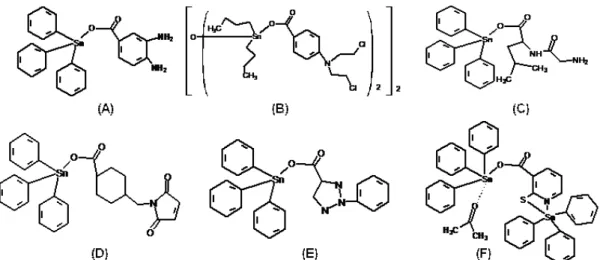
FIGURA 08- Estruturas dos complexos: (a) análogo ao ácido acetilsalicílico de cobalto, Co2C12H11O4 e (b) compostos hexacarbonilos de cobalto...16
FIGURA 09- Estrutura dos complexos de cobre (II) citados na TABELA 04...17
FIGURA 10 –Estruturas dos compostos de cobre do Tipo 1:[Cu(N-N)(acetilacetonato]NO3 e Tipo 2: [Cu(N-N)(glicinato]NO3 (BRAVO-GÓMEZ et al, 2009)...18
FIGURA 11 –Outras estruturas dos compostos de cobre com atividade antitumoral promissora (RUIZ-AZUARA & BRAVO-GÓMEZ, 2010)...19
FIGURA 12- Complexos de estanho com promissora atividade antitumoral em algumas linhagens de células cancerosas humanas...20
FIGURA 13- Estruturas de complexos de gálio...22
FIGURA 14- Compostos de ouro com atividade antitumoral promissora...23
xiii
FIGURA 16- Estruturas típicas de arenos de Ru (II) e alguns exemplos de ligantes
quelantes...25
FIGURA 17- Interações de H e estéricas que promovem ligação forte da unidade {(6-areno)Ru(en)}2+ à guanina e ligação fraca com adenina, en = etilenodiamina..26
FIGURA 18- a: Nucleobases do DNA; b:tautomerismo tiol/tiona da 4.6-dimetil-2-mercaptopirimidina; c: modos de coordenação do ligante...30
FIGURA 19- a: Formas moleculares do ác. picolínico em solução ; b: estrutura do ácido picolínico e seu modo de coordenação a metais...31
FIGURA 20- Vencedores do Prêmio Nobel em Medicina e Fisiologia em 1998 pelas descobertas com o NO como molécula sinalizadora no sistema cardiovascular...33
FIGURA 21- Modos de coordenação do NO a um centro metálico...34
FIGURA 22- Esquema da síntese de NO in vivo (IGNARRO, 2000)...34
FIGURA 23- Ativação do relaxamento da musculatura vascular pela acetilcolina com o NO atuando como molécula mensageira (BUTLER & NICHOLSON, 2003)...35
FIGURA 24- Estrutura de complexos de rutênio que atuam como capturadores de NO...37
FIGURA 25 – Reação de obtenção de monóxido de nitrogênio (NO (g))...43
FIGURA 26- Sistema de geração de monóxido de nitrogênio...44
FIGURA 27- Reação de obtenção do [RuCl2(PPh3)3]...45
FIGURA 28- Reação de obtenção do [RuCl2(dppb)(PPh3)]...46
FIGURA 29- Reação de obtenção do [RuCl(dmpm)2NO]...46
FIGURA 30- Reação de obtenção do [Ru(pic)2(dppb)]...47
FIGURA 31- Reação de obtenção do [Ru(dmpm)2(dppb)]...48
FIGURA 32- Metabolização do XTT em uma solução aquosa de sal de formazan por células viáveis.(GERLIER & THOMASSET,1986)...55
xiv
FIGURA 34- Espectro de absorção na região do IV de [RuCl(dmpm)2(NO)], em pastilla de KBr...60
FIGURA 35- Espectro de RMN 1H do complexo [RuCl(dmpm)2(NO)] em CDCl3...62
FIGURA 36- Esquema indicando a possível entrada do solvente (CH3CN) no composto [RuCl(dmpm)2(NO)]...63
FIGURA 37- Voltamograma cíclico do [RuCl(dmpm)2(NO)] em acetonitrila (eletrólito suporte: 0,1 M PTBA vs Ag/AgCl; 100 mVs-1) e voltametria de pulso diferencial...64
FIGURA 38- Voltamograma cíclico do [RuCl(dmpm)2(NO)] em acetonitrila (eletrólito suporte: 0,1 M PTBA vs Ag/AgCl; 100 mVs-1) antes e depois da eletrólise...65
FIGURA 39- espectro de absorção na região do infravermelho do [RuCl(dmpm)2(NO)] antes (em vermelho) e depois (em preto) do produto gerado durante a eletrólise, em pastilha de KBr...65
FIGURA 40- Voltametria de pulso diferencial do [RuCl(dmpm)2(NO)] em acetonitrila (eletrólito suporte: 0,1 M PTBA vs Ag/AgCl; 100 mVs-1)...66
FIGURA 41- Estrutura ORTEP do complexo [RuCl(dmpm)2(NO)]. Elipsóides térmicas com 50 % de probabilidade...67
FIGURA 42- Estrutura cristalográfica da cela unitária do cristal de [RuCl(dmpm)2(NO)]...68
FIGURA 43- Ligações de hidrogênio entre átomos de moléculas vizinhas, na estrutura cristalina do [RuCl(dmpm)2(NO)]...69
FIGURA 44- Espectros UV-vis do a: [Ru(pic)2(dppb)] e b: [Ru(dmpm)2(dppb)] em CH2Cl2; caminho óptico 1cm...73
FIGURA 45- Espectros IV a: [Ru(pic)2(dppb)] e b: [Ru(dmpm)2(dppb)] em pastilla de KBr...75
FIGURA 46- Espectros de RMN de 31P{1H} dos complexos a: [Ru(pic)2(dppb)] e b: [Ru(dmpm)2(dppb)] em CH2Cl2 (capilar de D2O)...78
Figura 47– Voltamograma cíclico de [Ru(dppb)(pic)2] em diclorometano (eletrólito suporte: 0,1 M PTBA vs Ag/AgCl; 100 mVs-1)...79
Figura 48 – Voltamograma cíclico de [Ru(dmpm)2 (dppb)] em diclorometano (eletrólito suporte: 0,1 M PTBA vs Ag/AgCl; 100 mVs-1)...79
xv
xvi
RESUMO
“COMPLEXOS DE RU (II) COM LIGANTES DE INTERESSE BIOLÓGICO: SÍNTESE, CARACTERIZAÇÃO E CITOTOXICIDADE”
Foram sintetizados e caracterizados três novos complexos de Ru(II), com formulas [RuCl(dmpm)2NO], [Ru(dmpm)2(dppb)] e [Ru(pic)2(dppb)]., onde dmpm= 4,6-dimetil-2-mercaptopirimidina, dppb= 1,4-bis(difenilfosfina)butano e pic= íon picolinato. Os dados da caracterização desses compostos são condizentes com as formulações propostas e adicionalmente, foram obtidos cristais dos três complexos e suas estruturas cristalinas foram determinadas por difração de raios X e demonstraram que se tratam de estruturas octáedricas distorcidas. Para o complexo [RuCl(dmpm)2NO] o seu espectro de RMN 1H mostrou dois singletos em 7,3 e 6,7 ppm atribuidos ao hidrigênio do anel aromático e dois singletos em 2,5 e 2,3 ppm atribuidos ao hidrogênio alifático. Essas diferenças nos singletos em campos mais altos podem ser explicadas avaliando-se as ligações de hidrogênio na estrutura cristalina do composto, que ocorre entre moléculas vizinhas, o que justifica os diferentes sinais observados no RMN de 1H. O espectro de absorção na região do IV do composto mostrou a presença do grupo NO+, com absorção em 1857 cm-1. O voltamograma cíclico deste composto mostrou os processos característicos dos nitrosilos complexos e uma eletrólise do mesmo foi feita para mostrar a liberação do NO, que foi comprovada pelo desaparecimento do pico do NO+, característico no espectro de absorção na região do IV.
Os complexos [Ru(dmpm)2(dppb)] e [Ru(pic)2(dppb)] mostraram singletos no RMN 31P{1H} em 47,5 e 46,2 ppm, respectivamente, e os voltamogramas cíclicos mostraram processos quasi-reversíveis, atribuídos a Ru III/Ru II.
xvii
ABSTRACT
“RU (II) COMPLEXES WITH LIGANDS OF BIOLOGIC INTEREST: SYNTHESES, CARACTHERIZATION AND CITOTOXICITY”
Three new Ru(II) complexes where were synthesized and characterized. The formulas were [RuCl(dmpm)2NO], [Ru(dmpm)2(dppb)] and [Ru(pic)2(dppb)], where dmpm = 4,6-dimethyl-2-mercaptopyrimidine, dppb = 1,4-bis(diphenylphosphine)butane e pic = picolinate ion. The characterization data are in agreement with the proposed formulation and also crystals were obtained and solved by X-ray diffraction. The resolution of the crystal structures confirmed the proposed structures, and demonstrated that they present distorted octahedral configuration. For [RuCl(dmpm)2NO], 1H RMN showed two singlets, at 7,3 and 6,7 ppm assigned to the hydrogen of the aromatic ring, and two singlets at 2,5 and 2,3 ppm assigned to aliphatic hydrogen. This differences could be explained by evaluating how the intermolecular hydrogen bonds are affecting the aliphatic hydrogen atoms present in the molecule and in the nearest neiborhood this differences could be explained evaluating the hydrogen bonds between neighbouring molecules. The infrared spectrum showed very intense band in 1857 cm-1 assigned to NO+ group. The cyclic voltammogram of this compound showed processes assigned to the nytrosil group, and electrolysis was performed to promote the NO release from the compound, which was confirmed by the disappearance of the NO+ band in the infrared spectrum of the complex.
The complexes [Ru(dmpm)2(dppb)] and [Ru(pic)2(dppb)] showed singlets in 31P{1H} RMN at 47,5 and 46,2 ppm, respectively, and the cyclic voltammetry showed one process attributed to Ru III/ Ru II.
xviii
SUMÁRIO
1.INTRODUÇÃO
11.1 Câncer
51.1.1 Histórico 5
1.1.1.1 Histórico: Antiguidade 5
1.1.1.2 Histórico: Idade Média, Renascimento e Moderna 6
1.1.2.- Dados estatísticos 8
1.1.3 Origens e causas 9
1.1.4 Tratamento do câncer 10
1.1.5 Quimioterapia em câncer 11
1.1.5.1 Outros metalocomplexos promissores. 14
1.1.5.1.1. Cobalto 15
1.1.5.1.2 Cobre 16
1.1.5.1.3 Estanho 19
1.1.5.1.4 Ferro 20
1.1.5.1.6 Gálio 21
1.1.5.1.7 Ouro 22
1.1.5.1.8 Rutênio 23
1.1.5.1.8 Vanádio 27
1.2 Arquitetura dos compostos
271.2.1 Rutênio (Ru) 27
1.2.2 Fosfinas: 1,4(difenilfosfina)butano (dppb) 27
1.2.3 4,6-dimetil-2-mercaptopirimidina (dmpm). 30
1.2.4 Ácido picolínico (pic) 31
1.2.5 Monóxido de nitrogênio (NO) 32
2. OBJETIVOS
393. PARTE EXPERIMENTAL
413.1 Atmosfera inerte, solventes, reagentes, ligantes e óxido nítrico 42
3.1.1 Obtenção da atmosfera de Argônio 42
3.1.2 Solventes 42
3.1.3 Reagentes e produtos químicos em geral 42
xix
3.1.5 Monóxido de nitrogênio (NO) 43
3.2 Síntese dos complexos precursores. 44
3.2.1 Tricloronitrosilrutênio(II) - [RuCl3NO•2H2O] 44 3.2.2 Síntese dos precursores fosfínicos de rutênio 45
3.2.2.1 [RuCl2(PPh3)3] 45
3.2.2.2 [RuCl2(dppb)(PPh3)] 45
3.3 Síntese dos novos complexos 46
3.3.1 [RuCl(dmpm)2NO] 46
3.3.2 [Ru(pic)2(dppb)] 47
3.3.3 [Ru(dmpm)2(dppb)] 47
3.4 Instrumentação 48
3.4.1 Análise Elementar 48
3.4.2 Medidas de Condutividade 48
3.4.3 Espectroscopia de Absorção na Região do UV-vis 49 3.4.4 Espectroscopia de absorção na região do infravermelho 49 3.4.5 Espectroscopia de Ressonância Magnética Nuclear de 1H e 31P{1H} 49 3.4.6 Medidas Eletroquímicas (Voltametria Cíclica e Voltametria de Pulso
Diferencial) 50
3.4.7 Difração de Raios X 50
3.4.8 Ensaios de citotoxicidade in vitro 50
3.4.8.1 Linhagem MDA-MB231 51
3.4.8.1.1 Linhagem de células, condições de cultura e incubação com as
metalodrogas 51
3.4.8.1.2 Ensaios de citotoxicidade in vitro (MDA-MB231) 52 3.4.8.1.3 Preparação dos compostos para os ensaios 53
3.4.8.2 Linhagens V79 e U251 53
3.4.8.2.1 Linhagem de células, condições de cultura e incubação com as
metalodrogas 54
3.4.8.2.2 Ensaios de citotoxicidade in vitro (V79 e U251) 55 3.4.8.2.3 Preparação dos compostos para os ensáios 56
4.RESULTADOS E DISCUSSÃO
574.1 Caracterização do [RuCl(dmpm)2(NO)] 58
4.1.1 Análise Elementar 58
4.1.2 Medidas de Condutividade Molar 58
4.1.3 Espectroscopia Eletrônica (UV-vis) 58
xx
4.1.5 Espectroscopia de Ressonância Magnética Nuclear (RMN) 61 4.1.6 Medidas Eletroquímicas (Voltametria Cíclica e Voltametria de Pulso
Diferencial) 62
4.1.6.1 Estudos de liberação de NO - Eletrólise 64
4.1.7 Difração de Raios X 66
4.1.8 Ensaios de citotoxicidade 72
4.2 Caracterização dos [Ru(pic)2(dppb)] e [Ru(dmpm)2(dppb)] 72
4.2.1 Análise Elementar 72
4.2.2 Medidas de Condutividade Molar 72
4.2.3 Espectroscopia Eletrônica (UV-vis) 73
4.2.4 Espectroscopia de Absorção na Região do Infravermelho (IV) 74 4.2.5 Espectroscopia de Ressonância Magnética Nuclear (RMN) 77 4.2.6 Medidas Eletroquímicas (Voltametria Cíclica e Voltametria de Pulso
Diferencial) 78
4.2.7 Difração de Raios X 80
4.2.8 Ensaios de citotoxicidade 84
5.CONSIDERAÇÕES FINAIS E PERSPECTIVAS FUTURAS
876.REFERÊNCIAS BIBLIOGRÁFICAS
912
1.INTRODUÇÃO
3
FIGURA 01.- Estrutura do salvarsan.
Em 1924 o chumbo coloidal foi empregado no tratamento do câncer (ALAMA et al, 2009); o AsI3 em 1939 foi usado no tratamento de dermatitis, e compostos de mercúrio, no tratamento da sífilis (benzoato) e como antiséptico tópico (salicilato).
Outros compostos inorgânicos foram utilizados pelas suas aplicações terapêuticas, entre os anos 1900-1960, embora seus usos não tenham sidos continuados, devido aos efeitos adversos.
O ano de 1964 marca uma data importante para a química inorgânica, a farmacologia inorgânica e a química inorgânica medicinal. Foi nessa época que o físico americano Barnett Rosenberg, estudando os efeitos do campo elétrico sobre o crescimento de Escherichia coli, utilizando eletrodos de platina descobriu que a divisão celular era interrompida, mas não o crescimento das células (HOESCHELE, 2009). O estudo foi aprofundado e descobriu-se que o composto responsável por esse efeito era a cisplatina (cis -[PtCl2(NH3)2]). O cis-[PtCl2(NH3)2] foi descrito na literatura primeiramente por Reiset, em 1844 e um ano depois por Peyroné, mas foi Alfred Werner, em 1893 que propôs a estrutura desse complexo, sendo que o primeiro era o transplatina e o segundo, a cisplatina (FONTES et al, 2005). A determinação unívoca das estruturas desses compostos e os aportes feitos no desenvolvimento da “Teoría de Coordenação” valeram a Werner o Premio
4
Foi por essa causa que complexos metálicos começaram a despertar maior interesse em possíveis aplicações na medicina e desde então tem-se desenvolvido uma grande quantidade de compostos de coordenação, cujas informações gerais e particulares estão compiladas em diversas fontes de informação.
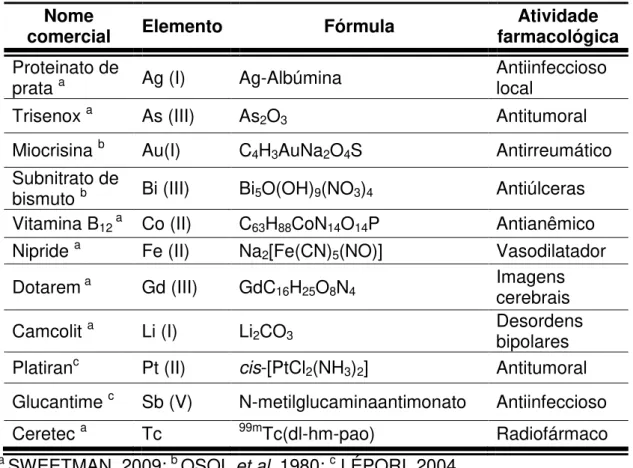
Na TABELA 01 apresentam-se alguns exemplos de medicamentos contendo íons metálicos usados na atualidade no mundo, e nos ANEXO I e no ANEXO II encontram-se as estruturas de alguns deles.
TABELA 01- Medicamentos contendo íons metálicos, usados como fármacos no mundo.
Nome
comercial Elemento Fórmula farmacológica Atividade Proteinato de
prata a Ag (I) Ag-Albúmina Antiinfeccioso local
Trisenox a As (III) As2O3 Antitumoral
Miocrisina b Au(I) C4H3AuNa2O4S Antirreumático Subnitrato de
bismuto b Bi (III) Bi5O(OH)9(NO3)4 Antiúlceras Vitamina B12 a Co (II) C63H88CoN14O14P Antianêmico Nipride a Fe (II) Na2[Fe(CN)5(NO)] Vasodilatador
Dotarem a Gd (III) GdC16H25O8N4 Imagens cerebrais
Camcolit a Li (I) Li2CO3 Desordens bipolares
Platiranc Pt (II) cis-[PtCl2(NH3)2] Antitumoral Glucantime c Sb (V) N-metilglucaminaantimonato Antiinfeccioso
Ceretec a Tc 99mTc(dl-hm-pao) Radiofármaco
a SWEETMAN, 2009; b OSOL et al, 1980; c LÉPORI, 2004
5
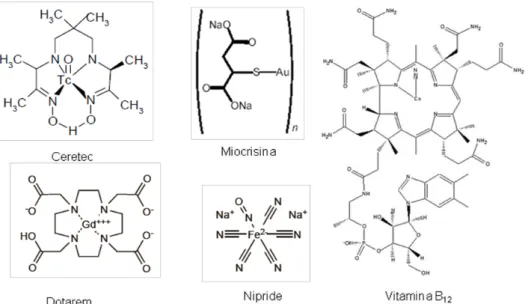
FIGURA 02.-Estrutura de alguns fármacos inorgânicos.
1.1 Câncer
O câncer deve ser uma doença tão antiga quanto o ser humano e há registros de sua existência desde a Pré-História. Tem-se encontrado evidências de câncer em múmias do antigo Egito, em tábuas achadas em Nínive (capital do Império Assírio), em monumentos funerários etruscos e em múmias peruanas. É uma doença que não tem foco geográfico, nem condição social.
1.1.1 Histórico
1.1.1.1 Histórico: Antiguidade
6
FIGURA 03.- Múmia Hatsheput, primeira mulher a desempenhar o posto de faraó.
No século V a.C. acreditava-se que quatro elementos governavam o universo: água, ar, fogo e terra, e quatro fluidos (humores) governavam a saúde: sangue, fleuma, bile amarela e bile negra. As doenças resultariam do desequilíbrio dos humores e o câncer foi atribuído a um excesso de bile negra. Hipócrates (460-370 a.C.) foi quem descreveu e classificou a doença. O tratamento na época era a cauterização e o uso de pomadas.
Aulus Cornelius Celsius (25 a.C-50 d.C.), médico romano, descreveu fases de evolução da doença e acreditava que os casos mais iniciais poderiam ser tratados com cirurgia, mas não os tardios, enquanto que Galeno (129-200) pensava que a origem da doença era o desequilíbrio da bile negra e recomendava dietas especiais, alem de exorcismos.
1.1.1.2 Histórico: Idade Média, Renascimento e Idade Moderna
7
Na Europa o tratamento consistia na cirurgia ou cauterização se o tamanho era pequeno, mas também eram empregadas pastas cáusticas contendo arsênico, sangria, dietas especiais, remédios à base de plantas, pó de caranguejo e encantamentos. Mesmo assim, continuava-se acreditando que não havia cura para o câncer.
William Harvey (1578-1657) colocou por terra a teoria humoral das doenças, e abriu-se o caminho para o conhecimento de sua fisiopatologia e seu tratamento. Foi descrito que o câncer começava como uma doença localizada em um órgão e depois se estendia através dos canais linfáticos para o resto do corpo. Os tumores eram tratados com cirurgia.
Outros pesquisadores começaram a estudar as possíveis causas do câncer e acharam alguns fatores ambientais, como uso de rapé e a fuligem. No século XIX se começaram a coletar dados sobre o câncer na França e na Itália, e inúmeras intervenções cirúrgicas foram feitas, com sucesso, para a extração de tumores gástricos e extração completa de mama, linfonodos axilares e músculos peitorais.
No início do século XX somente eram curáveis os tumores pequenos e localizados que pudessem ser removidos completamente pela cirurgia. Posteriormente, a radioterapia foi usada após a cirurgia para controlar o crescimento de pequenos tumores que não tivessem sido removidos cirurgicamente. Finalmente a quimioterapia foi acrescentada para destruir as poucas células cancerosas remanescentes.
A maior descoberta sobre o assunto câncer foi a vantagem em usar múltiplos agentes quimioterápicos em lugar de drogas isoladas. Algumas neoplasias com crescimento muito rápido (leucemias, linfomas e alguns cânceres pediátricos) respondem muito bem à quimioterapia combinada e podem ser curadas hoje em dia.
8
freqüentemente levavam ao desenvolvimento do câncer. Descobriram que a maioria dos agentes carcinogênicos causava dano genético (mutações), e estas davam origem a grupos de células anormais (chamados clones). Com o tempo os clones mutantes evoluíam para clones malignos e, com mais danos genéticos e mutações. Assim, o câncer progredia.
Os pesquisadores já identificaram e continuam identificando quais são os genes que, ao serem danificados, podem levar ao câncer, o que é a base para a prevenção, diagnóstico e tratamentos mais específicos e mais eficazes (ALVES & TUBINO, 2009).
1.1.2.- Dados estatísticos
Em dados reportados pela Agência Internacional para Pesquisa em Câncer (IARC/OMS) no ano 2008 (World Cancer Report), o impacto global do câncer mais que dobrou em 30 anos. Espera-se cerca de 12 milhões de casos para 2010, sendo a terceira causa de morte no mundo. Prediz que a metade dos casos novos e dois terços dos óbitos será em países de médio e baixo desenvolvimento.
Em países como o Brasil e o Uruguai é muito preocupante a situação, já que é a segunda causa de morte na população, depois das doenças cardiovasculares.
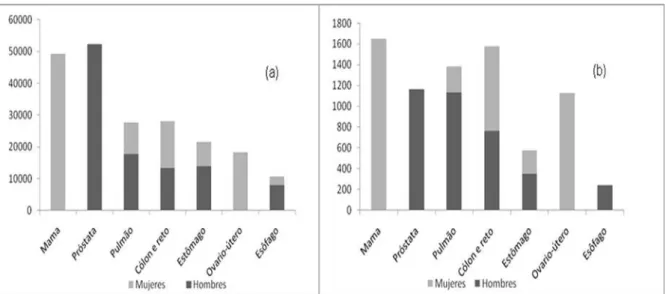
9
FIGURA 04-.(a)- Tipos de câncer mais incidentes estimados para 2010, exceto pele não melanoma, na população brasileira;(b) tipos de câncer mais incidentes no período 2002-2006 no Uruguai.
1.1.3 Origens e causas
O câncer é originado a partir de uma célula normal, onde ocorre uma mutação genética e não é controlado a tempo. A célula tem mecanismos de reparo, ou seja a célula pode detectar, a tempo, uma falha na informação genética e repará-la, mas às vezes esses mecanismos falham, permitindo que a mutação seja passada para as células das seguintes gerações, e assim por diante. Com o tempo a célula acumula outros defeitos genéticos que não são nem controlados, nem reparados a tempo, gerando células cancerosas. Essas células se diferenciam das normais por serem menos diferenciadas que as normais e possuir uma elevada taxa de replicação, tendo a capacidade de invadir tecidos adjacentes e de ser propagada a outros tecidos através da corrente sanguínea, podendo gerar metástase (ALMEIDA et al, 2005).
10
Cerca de 80% dos casos de câncer estão relacionados ao meio ambiente e os outros 20% a fatores hereditários. Entendendo por meio ambiente, o meio onde o homem se move (onde mora, onde trabalha e o que consume).
1.1.4 Tratamento do câncer
Os tipos principais de tratamento do câncer são mediante cirurgia, radioterapia, quimioterapia ou transplante de medula óssea, ou combinação de várias destas modalidades. Na maioria dos casos é empregada a combinação destas, com alto grau de sucesso, em caso de ser detectado em fases iniciais.
A cirurgia consiste em remover o tumor e pode ser eficaz em caso de não houver metástase. No geral este tratamento é empregado em conjunto com quimioterapia ou radioterapia (onde poderia diminuir o tamanho do tumor, prévio à cirurgia).
A radioterapia é o tratamento no qual se utilizam radiações para destruir um tumor, ou impedir que suas células aumentem. Estas radiações não são vistas, e durante a aplicação o paciente não sente nada. A radioterapia pode ser usada em combinação com a quimioterapia, ou outros recursos, no tratamento dos tumores.
A quimioterapia é o tratamento que utiliza medicamentos para combater o câncer, os quais são aplicados, em sua maioria, na veia, podendo também serem dados por via oral, intramuscular, subcutânea, tópica e intratecal. Os medicamentos se misturam com o sangue e são levados a todas as partes do corpo, destruindo as células doentes que estão formando o tumor e impedindo, também, que elas se espalhem pelo corpo. A desvantagem é que são atacadas tanto células cancerosas quanto normais e geram vários efeitos secundários, como falência renal, náuseas e vômitos, entre outros.
11 1.1.5 Quimioterapia em câncer
Como já foi mencionado a quimioterapia emprega medicamentos
para o tratamento da doença. No “Martindale: The Complete Drug Reference”,
nas pp 644-649 encontram-se citados 75 tipos de protocolos mais usuais no tratamento com quimioterápicos, para todos os tipos de cânceres. Os protocolos podem variar um pouco entre instituições, ou como parte de um regime já iniciado. Como exemplos, mostram-se na TABELA 02 alguns desses regimes (SWEETMAN, 2009).
TABELA 02- Alguns regimes para o tratamento de alguns cânceres.
Protocolo Fármacos, dose e vias de administração Ciclo Uso em
EC Etopósido 100 mg/m2 iv dias 1-3 e
carboplatina 450 mg/m2 iv dia 1 28 dias Câncer de pulmão pequeno EC Etopósido 100 mg/m2 iv dias 1-3 e
carboplatina 325 mg/m2 iv dia 1 21 dias Câncer de pulmão não pequeno ECF Epirubicina 50 mg/m2 iv dia 1
cisplatina 60 mg/m2 iv dia 1; e
fluorouracil 200 mg/m2 continuamente iv, dias 1-4
8 ciclos de 21 dias
Câncer de estômago
EDAP Etopósido 100-200 mg/m2 continuamente por iv, dias 1-4;
dexametasona 40 mg oral ou iv dias 1-5;
citrabina 1 g/m2 iv dia 5; e
cisplatina 20 mg/m2 continuamente por iv dias 1-4
21-28 dias
Melomas múltiplos e linfomas
EP (PE) Etopósido 80 mg/m2 iv dias 1-3 e
cisplatina 80 mg/m2 iv dia 1 21 dias Câncer de pulmão (dose padrão) iv:intravenoso.
12
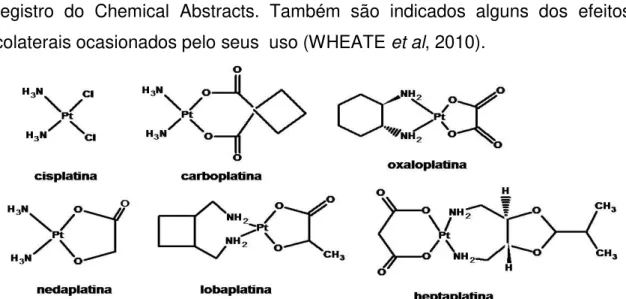
representadas na FIGURA 05. Na TABELA 03 mostram-se os fármacos com seus nomes comerciais, onde é comercializado assim como o número de registro do Chemical Abstracts. Também são indicados alguns dos efeitos colaterais ocasionados pelo seus uso (WHEATE et al, 2010).
FIGURA 05- Estruturas dos fármacos comercializados no mundo à base de platina.
TABELA 03- Drogas à base de platina que receberam aprovação para uso humano em ao menos um pais.
Droga Nomes comerciais no CAS Efeitos adversos País
Cisplatina
Platinol® Platidiam Platosin
Briplatin Platinex® Neoplatin
15663-27-1 Nefrotoxicidade Mundial
Carboplatina Paraplatina Carbosin JM 8 Ribocarbo 41575-94-4 Melosupresão Mundial
Oxaloplatina Eloxatin® Dacotin® Dacplat® Elplat® 61825-94-3 Neurotoxicidade Mundial
Nedaplatina Aqupla® 254-S
95734-82-0 Melosupresão Japão
Lobaplatina
135558-11-1 Trombocitopenia China
Heptaplatina Sunpla SKI2053R 146665-77-2 Nefrotoxicidade /sangramento
intraabdominal Corea
13
Japão), o que indica o grau de dificuldade em chegar à obtenção de fármacos aptos para seu uso como quimioterápicos no tratamento do câncer. Nestes últimos 30 anos, foram feitas muitas pesquisas e um grande número de compostos de coordenação foram testados contra o câncer, mas só foram adicionados aos regimes terapêuticos os já conhecidos, a carboplatina e a oxaloplatina. Alem dessas dificuldades, outros fatores como baixa atividade, quando comparada com a cisplatina, ou insuficiência renal imprevisível, ou severa nefrotoxicidade detectadas na fase II de testes clínicos, contribuiram para que os compostos em estudo não chegassem ao mercado consumidor. Na FIGURA 06 mostram-se alguns compostos de platina que não completaram a etapa de testes clínicos (WHEATE et al, 2010).
FIGURA 06- Drogas à base de platina que entraram em testes clínicos, mas seus desenvolvimentos não foram continuados por causas ou efeitos não previsiveis na fase I, ou por falta de atividade nas fases II/III de testes clínicos, ou por razões econômicas.
14
somando as desvantagens, a carboplatina é ativa nos mesmos tipos de tumores que a cisplatina, e é administrado intravenosamente (WONG & GIANDOMENICO, 1999). Ao mesmo tempo, são inativos frente a algumas linhagens de células cancerosas e em metástase (DYSON & SAVA, 2006).
É por isso que as pesquisas foram direcionadas para a procura de novos metalofármacos contendo platina ou outro metal que possam ser utilizados na clínica, tentando diminuir os efeitos secundários e a resistência ao tratamento.
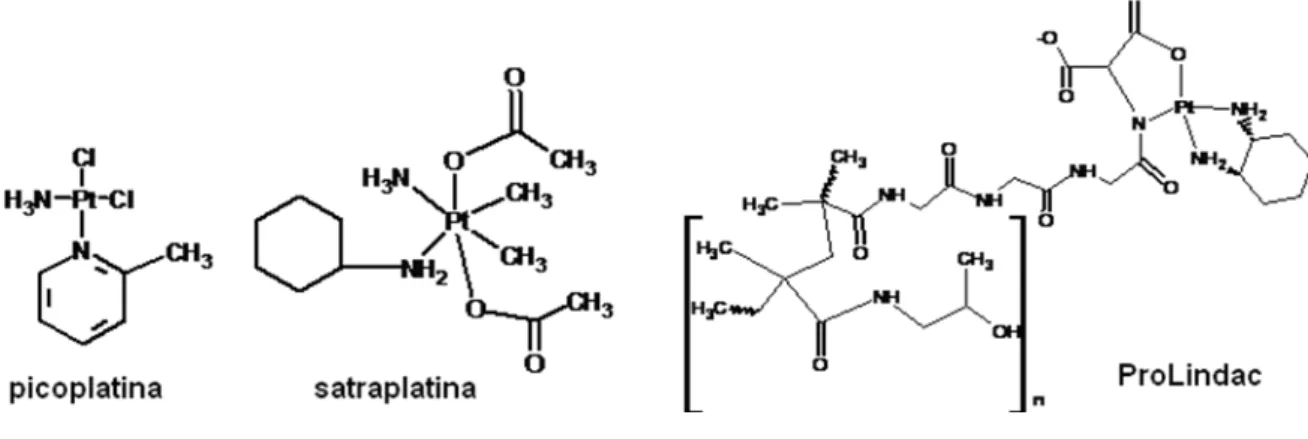
Para os complexos contendo platina, quatro fármacos se encontram em testes clínicos (satraplatina, picoplatina, ProLindacTM e lipoplatina TM), sendo que os dois primeiros já estão em fase de serem liberados ao mercado. Os dois primeiros demonstraram eficácia na fase III de testes e estes também podem ser administrados oralmente, o que é muito vantajoso no tratamento, já que o paciente pode ser tratado fora do meio hospitalar. Os dois últimos podem se converter nos primeiros fármacos liposomais/poliméricos à base de platina. Na FIGURA 07 mostram-se as estruturas dos potenciais fármacos picoplatina, ProLindac e satraplatina, sendo que a lipoplatina é uma forma de cisplatina encapsulada liposomicamente (WHEATE et al, 2010).
FIGURA 07- Potenciais fármacos a base de platina em testes clínicos (WHEATE et al, 2010).
1.1.5.1 Outros metalocomplexos promissores
15
levando em consideração os seguintes aspectos: diminuição tanto da toxicidade quanto dos efeitos colaterais; aumento do número de sítios de coordenação, a diferença da Pt (II) que só apresenta quatro sítios de coordenação, existem outros metais em diversos estados de oxidação que possuem quatro, cinco ou seis sítios de coordenação; que sejam seletivos, atacando preferencialmente ás células cancerosas e não as sadias; e/ou específicos, alcançando o órgão ou o tecido específico onde está sendo desenvolvida a doença.
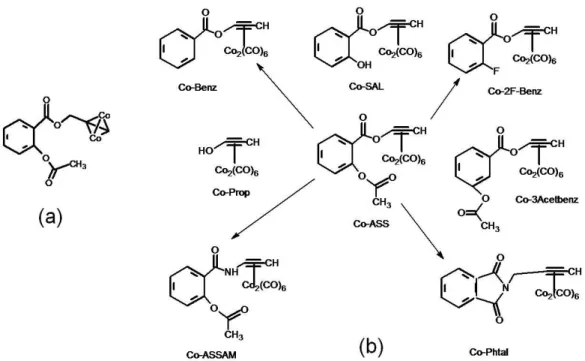
1.1.5.1.1. Cobalto
Alguns compostos hexacarbonilos de cobalto demonstraram atividade promissora contra várias linhagens de células cancerosas. Por exemplo, o composto análogo ao ácido acetilsalicílico, contendo cobalto, tem se mostrado muito ativo em células de câncer de mama (MCF-7 e MDA-MB231), mostrando um IC50 (μΜ) de 4,9 e 1,9 respectivamente, sendo que o
16
FIGURA 08- Estruturas dos complexos: (a) análogo ao ácido acetilsalicílico de cobalto, Co2C12H11O4 e (b) compostos hexacarbonilos de cobalto.
1.1.5.1.2 Cobre
A potencial atividade antitumoral de complexos de cobre tem sido avaliada recentemente mostrando resultados promissores. A vantagem do cobre com respeito a outros complexos contendo metais de transição é que naturalmente se encontra presente em organismos vivos e desenvolve funções tais como transferência de elétrons, reações de oxigenação, e transporte de oxigênio, entre outras (TISATO et al, 2010), e não seria um agente estranho no organismo. Nas TABELAS 04 e 05 são mostrados os IC50 (μM) de complexos
17
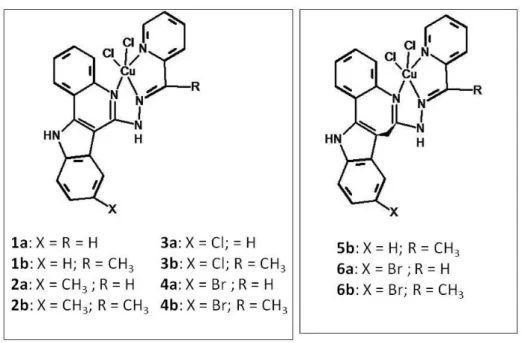
TABELA 04- Citotoxicidade de complexos de cobre (II) com indoloquinolina (1a - 4b) ou ligantes “bases de Paullone” em três linhagens de células cancerosas.
Compostoa IC50 (μM)
b
A549 SW480 CH1
1a 1,72 ± 0,03 1,3 ± 0,1 0,40 ± 0,07 1b 0,18 ± 0,04 0,024 ± 0,001 0,030 ± 0,005 2a 1,7 ± 0,1 0,75 ± 0,04 0,33 ± 0,07 2b 0,14 ± 0,01 0,024 ± 0,002 0,026 ± 0,006 3a 1,4 ± 0,3 0,64 ± 0,11 0,41 ± 0,05 3b 0,23 ± 0,01 0,049 ± 0,003 0,065 ± 0,012 4a 1,6 ± 0,1 0,47 ± 0,03 0,36 ± 0,03 4b 0,20 ± 0,03 0,032 ± 0,004 0,052 ± 0,008 5b 0,67 ± 0,15 0,21 ± 0,04 0,064 ± 0,015 6a 1,28 ± 0,03 0,40 ± 0,04 0,28 ± 0,03 6b 0,43 ± 0,03 0,18 ± 0,02 0,080 ± 0,005
cisplatina n.d 4,5 ± 1,7 n.d
carboplatina n.d 61 ± 10 n.d
oxaloplatina n.d 0,30 ± 0,08 n.d
a As estruturas dos compostos estão na FIGURA XXX. b As células foram tratadas por 96 hs. A citotoxicidade foi medida pelo método de MTT. A549: câncer de pulmão; SW480: câncer de colo; CH1: câncer de faringe e laringe . (PRIMIK et al, 2010). n.d: não detalhado.
18
TABELA 05- Complexos de cobre (II) que apresentam atividade semelhante à cisplatina, em células de câncer humano.
Compostoa IC50 (μM)
b
HeLa SiHa MCF-7 HCT-15
Tipo 1
4-Me 1,6 ± 0,1 3,4 ± 0,5 5,6 ± 0,7 6,0 ±0,9 5-Me 6,2 ± 0,7 3,2 ± 0,2 4,4± 0,5 2,6 ± 0,4 4,7-diMe 1,4 ± 0,1 0,96 ±0,09 4,9 ± 0,6 2,1 ± 0,1 5,6-diMe 3,4 ± 0,5 1,7 ± 0,2 3,9 ± 0,4 1,9 ± 0,3 3,4,7,8-tetraMe 1,9 ± 0,2 1,2 ± 0,1 2,2 ± 0,3 1,4 ± 0,2 5-fenilo 3,9 ± 0,3 3,0 ± 0,3 3,9 ± 0,4 2,5 ± 0,3 4,7-difenilo 4,2 ± 0,6 3.2 ± 0,5 2,2 ± 0,3 3,2 ± 0,4 5-Cl 4,5 ±0,5 8,8 ± 0,6 9,8 ± 0,5 12,9 ± 0,5
Tipo 2
5,6-diMe 5,3 ± 0,1 3,1 ± 0,3 4,4 ± 0,3 2,1 ± 0,1 3,4,7,8-tetraMe 1,8 ± 0,0 1,4 ± 0,2 2,6 ± 0,2 1,8 ± 0,4 4,7-difenilo 5,1 ± 0,2 6,6 ± 0,9 4,1 ± 0,4 7,6 ± 0,7 Cisplatina 5,1 ± 0,4 5,4 ± 0,5 5,6 ± 0,8 21,8 ± 2,4
a As estruturas representam os Tipos 1 e 2 mostrados na FIGURA xxx, substituídas com os grupos indicados nesta TABELA. b As células foram tratadas por 24 hs.Linhagens avaliadas: HCT-15: câncer de colo; HeLa: câncer cervical; MCF-7: câncer de mama; SiHa: câncer cervical. Os dados são a media de três experimentos feitos em triplicata (BRAVO-GÓMEZ et al, 2009).
19
FIGURA 11 –Outras estruturas dos compostos de cobre com atividade antitumoral promissora (RUIZ-AZUARA & BRAVO-GÓMEZ, 2010).
Os valores de IC50 detalhados nas TABELAS 04 e 05,encoraja aos investigadores a continuar a linha de pesquisa com complexos de cobre (I ou II) e sua potencial atividade antitumoral.
1.1.5.1.3 Estanho
20
TABELA 06- Complexos de estanho que apresentam melhor atividade que a cisplatina, em células de câncer humano.
Compostoa Linhagem IC50
(μg/ml) I.Cc No Cisplatina IC50 (μg/ml)
A HCV29T 0,004 4 4 0,7b
B A549 0,20-0,020 5 24 3,3b
C A498 0,03 4 24 2,253
C EVSA-T 0,007 4 37 0,422
D H226 0,005 5 27 3,269
C IGROV 0,006 4 28 0,169
C M19 0,016 4 17 0,558
D MCF-7 0,008 5 40 0,699
C WiDr 0,008 4 40 0,697
E HeLa 0,005 5 41 0,433
F Leiomiossarcoma 0,005 5 12 1,2-1,5
a As estruturas desses compostos estão na FIGURA 09. N0 =n0 de compostos testados nessa linhagem em particular; bIC50 em (MATYSIAK & OPOLSKI, 2006); c I.C.: índice de coordenação. Linhagens: HCV29T: câncer de bexiga; A549: câncer de pulmão; A498: câncer de rins; EVSA-T: câncer de mama; H226: câncer de pulmão; IGROV: câncer ovariano; M19: melanoma; MCF-7: câncer de mama; WiDr: câncer de colo; HeLa: câncer cervical; Leimiossarcoma: câncer de útero.
FIGURA 12- Complexos de estanho com promissora atividade antitumoral em algumas linhagens de células cancerosas humanas.
1.1.5.1.4 Ferro
21
destacar é a formação de espécies ativas quando o ferro se liga a agentes quimioterapéuticos, como a bleomicina, para produzir espécies de oxigênio responsáveis pela quebra do DNA. Além disso, a administração com agentes quelantes de ferro, como a desferroxamina em conjunto com cisplatina, etopósido, ou doxorrubicina, tem efeitos sinérgicos através da formação de complexos citotóxicos, ou pela captura de ferro na célula cancerosa (ALAMA et al, 2009).
1.1.5.1.5 Gálio
As propriedades antitumorais do gálio foram descritas pela primeira vez em 1971, por Hart e colaboradores. O gálio 67 e 68 radiativo, tem-se mostrado promissores no tratamento de câncer óstem-seo e tem-seus compostos são absorvidos pelas células cancerosas. (COLLERY et al, 2002). No momento o 8-quinolinato de gálio (KP46) e o maltolato de gálio estão em testes clínicos (FIGURA 13). Um estudo preliminar feito como o KP46 mostrou atividade em câncer de rins, exibindo estabilização na doença em alguns pacientes por mais de dez meses (ALAMA et al, 2009). A vantagem destes compostos é que são administrados por via oral, além de serem menos tóxicos, permitindo um tratamento crônico e maior biodisponibilidade nos tumores, comparado com outras vias de administração e também de importância, os compostos de gálio são sinérgicos com outros fármacos anticancerígenos (COLLERY et al, 2002). O nitrato de gálio, mostrou também uma boa ação em pacientes com linfoma, avaliada em 43 %, quando administrado em infusão por via intravenosa continua (ALAMA et al, 2009). Outros compostos de gálio foram sintetizados e testados em glioblastoma (células cancerosas do sistema nervoso), apresentando a maioria dos compostos menor IC50 (μM) com respeito ao
22
FIGURA 13- Estruturas de complexos de gálio.
TABELA 07- Atividade citotóxica de tiosemicarbazonas derivadas de 2-piridinoformamida e seus complexos de Ga(III) em células de glioblastoma.
Composto IC 50 (μM)
RT2 T98
Cisplatina 17 ± 1 5 ± 3
H2Am4DH 7,28 ± 0,09 3,6± 0,3
H2Am4Me 12,2 ± 0,7 32 ± 1
H2Am4Et 359 ± 10 143 ± 41
[Ga(H2Am4DH)2]NO3 5,31 ± 0,03 5,7 ± 0,3 [Ga(H2Am4Me)2]NO3 0,81 ± 0,03 4,7 ± 0,9 [Ga(H2Am4Et)2]NO3 9,6 ± 0,6 4,0 ± 0,6
Ga(NO3)3 >100 >1000
1.1.5.1.6 Ouro
Alguns compostos de ouro (I) tem uma ampla faixa de atividade antitumoral in vivo, especialmente em algumas linhagens de células resistentes à cisplatina. Fosfol complexos contendo ouro (I) (FIGURA 14) apresentaram atividade inibitoria muito potente, em concentrações muito baixas. Outros exemplos são compostos contendo ligantes fosfinas, sendo a auranofina o mais conhecido deles, apesar de ser usado contra a artrite reumatoidea, ele também apresenta boa atividade antitumoral. Na TABELA 08 mostram-se as citotoxicidades de alguns desses compostos, onde pode ser observado que todos os complexos apresentam menor IC50 (μM) que a cisplatina, indicando que são mais ativos.
23
reduzidos à ouro (0) no meio biológico. Apesar disso alguns complexos de ouro (III) tem incorporado ligantes para aumentar a estabilidade do centro metálico e tem exibido baixo IC50 em algumas linhagens de células cancerosas. Podemos considerar como ligantes algumas porfirinas, compostos bipiridínicos, ditiocarbamatos, e os ligantes oxo, gerando compostos dinucleares. Na FIGURA 14 mostram-se alguns compostos de ouro (ALAMA et al, 2009; VAN RIJT & SADLER, 2009).
TABELA 08- Atividade citotóxica de alguns complexos de ouro (I).
Composto IC50(μM)±S.D.
HL60 A549 MCF-7 A375 HCT-15 HeLa [AuCl(PEt3)] 0,52±0,13 0,85±0,01 0,84±0,01 0,78±0,31 0,97±0,17 0,90±0,21
[AuBr(PEt3)] 0,62±0,06 1,21±0,54 1,44±0,41 1,02±1,00 1,08±0,82 0,63±0,32
[Au(CN)(PEt3)] 0,19±0,07 0,41±0,06 0,45±0,12 0,21±0,23 0,08±0,01 0,09±0,02
[Au(SCN)(PEt3)] 0,21±0,12 0,71±0,02 0,65±0,11 0,37±0,29 0,32±0,02 0,18±0,01
[Au(dedc)(PEt3)] 0,96±1,21 1,22±0,96 1,63±0,58 1,47±0,77 0,92±0,01 0,54±0,07
[Au(xant)(PEt3)] 0,19±0,06 0,33±0,47 0,41±0,21 0,13±0,27 0,61±0,13 0,13±0,61
[Au(tu)(PEt3)] 2,84±1,29 3,01±1,01 3,28±1,12 2,23±1,03 2,75±1,43 1,84±0,25
Auranofina 0,23±0,11 0,75±0,05 0,98±0,32 0,34±0,21 0,11±0,02 0,15±0,03 Cisplatina 4,56±1,13 29,21±1,92 19,04±1,51 2,37±1,23 20,34±1,31 8,50±1,51 S.D.:desvio padrão. As células foram tratadas por 72 hs.A citotoxicidade foi medida pelo método de MTT. HL60: leucemia; A549: câncer de pulmão; MCF7: câncer de mama; A375: melanoma; HCT-15: câncer de colo; HeLa: câncer cervical (GANDIN et al, 2010)
FIGURA 14- Compostos de ouro com atividade antitumoral promissora.
1.1.5.1.7 Rutênio
-24
RuCl4(Im)2](Im = imidazol), ou ICR, que apresenta interessantes propriedades antitumorais em modelos animais e inspirou a síntese de compostos relacionados, como o [indH][trans-RuCl4(ind)2] ou KP1019, ind = indazol (KEPPLER, 1993), que já finalizou estudos em testes clínicos fase I, iniciando a fase II (BERGAMO et al, 2010). Por outro lado, o grupo do Prof. Enzo Alessio, em Trieste, Itália, tem estudado uma série de compostos de Ru (III) possuindo DMSO como ligante. O composto conhecido por NAMI (acrônimo para New Anti-tumor Metastasis Inhibitor), é ativo contra carcinoma de Lewis de pulmão, melanoma B16 e carcinoma mamário (Mca) e possui um efeito anti-metastático, não apresentado pela cisplatina (BERGAMO et al, 2002; SAVA et al, 1999; SAVA & BERGAMO, 2000). O NAMI-A é derivado do NAMI, pela substituição do Na+ por ImH+, sendo que foi o primeiro complexo de rutênio a entrar em testes clínicos. Estes complexos apresentam uma baixa toxicidade, não afetando o crescimento de tumores primários e não exibindo citotoxicidade contra células tumorais in vitro (BERGAMO et al, 2002). NAMI-A é um composto que in vitro apresenta efeitos pró-adesivos que completou a fase I (clinical trial) no Instituto de Câncer da Holanda (RADEMAKER-LAKHAIet al, 2004) e está em fase II de testes clínicos (BERGAMO et al, 2010) . É interessante observar que o NAMI-A não exibe citotoxicidade contra células tumorais in vitro, mas sim in vivo. Na FIGURA 15 mostram-se as estruturas dos complexos previamente mencionados.
FIGURA 15- Estruturas dos compostos: ICR ou [ImH]{trans-[RuCl4(Im)2]} (ICR); KP1019 ou [IndH]{trans-[RuCl4(Ind)2]}, NAMI ou Na{trans-[RuCl4(Im)(DMSO)]} e NAMI-A ou {[ImH]{trans-[RuCl4(Im)(DMSO)]}.
-25
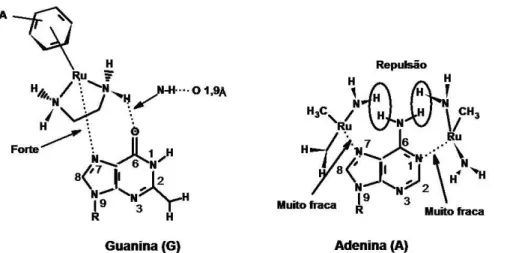
areno)Ru(X)(Y)(Z)], FIGURA 16, (KAI et al, 2005). Encontrou-se que se os ligantes Y e Z forem quelantes observa-se aumento da atividade anticâncer, isto devido á maior estabilidade dos complexos formados. Quando X, Y e Z são ligantes monodentados, observou-se que não apresentam atividade citotóxica contra a linhagem celular A2780 (carcinoma de ovário) (KAI et al, 2005). As observações experimentais indicaram uma relação estrutura-atividade na qual um ligante areno, mais hidrofóbico, e a presença de apenas um ligante para ser substituído estão associados a altas atividades citotóxicas.
FIGURA 16- Estruturas típicas de arenos de Ru (II) e alguns exemplos de ligantes quelantes.
Nesta mesma linhagem A2780, os complexos citados acima, contendo etilenodiamina, 1-2-diaminobenzeno e acetilacetonato são bastante ativos. Entretanto, quando o ligante quelante é a 2,2’-bipiridina ou o N,N,N’,N’ -tetrametiletilenodiamina os complexos apresentaram baixa citotoxicidade (KAI
26
FIGURA 17- Interações de H e estéricas que promovem ligação forte da unidade {(6-areno)Ru(en)}2+ à guanina e ligação fraca com adenina, en = etilenodiamina.
Nosso grupo de pesquisas, particularmente, tem conseguido relevantes resultados em estudos envolvendo complexos de rutênio contendo fosfinas em suas estruturas. Em estudos recentes, foi mostrado que compostos contendo fosfinas e tiossemicarbazonas em suas estruturas são bastante promissores em termos de suas atividades citotóxicas em células tumorais das linhagens UACC-62 (melanoma), TK-10(carcinoma renal) e MCF-7(câncer de mama) (GRAMINHA et al, 2008a). Como pode ser observado da TABELA 09, o composto [RuCl(dppb)(H2Bz4M)]Cl não só é mais ativo que a colchicina e o etopósido, fármacos comerciais, como também é seletivo para a linhagem UACC-62 (melanoma), o que é desejável para qualquer fármaco.
TABELA 09- Avaliação de complexos de rutênio contendo fosfinas e tiossemicarbazonas como potenciais agentes antitumorais.
Composto UACC-62 TK-10 MCF-7
[RuCl2(dppb)(PPh3)] 185 ± 12 73 ± 0 85 ± 7 [RuCl3(dppb)(H2O)] 200 ± 0 143 ± 45 129 ± 50 [RuCl(dppb)(2BzDH)]Cl 194 ± 4 149 ± 6 110 ± 29 [RuCl(dppb)(H2BzDH)]PF6 191 ± 9 143 ± 12 106 ± 26 [RuCl(dppb)(H2Bz4M)]Cl 183 ± 14 84 ± 21 65 ± 1 [RuCl(dppb)(2Bz4M)]PF6 170 ± 33 150 ± 4 108 ± 26 [RuCl(dppb)(H2Bz4Ph)]Cl 186 ± 16 120 ± 37 90 ± 9 [RuCl(dppb)(2Bz4Ph)(PPh3)]PF6 195 ± 13 101 ± 6 83 ± 3
Colchicina 141 ± 16 67 ± 1 79 ± 8
Etopósido 135 ± 12 41 ± 32 74 ± 2
27 1.1.5.1.8 Vanádio
O primeiro estudo dos possíveis efeitos antitumorais de compostos contendo sais de vanádio data do ano 1965 (KIELER et al, 1965). Após essa data foram avaliados compostos contendo vanádio como íon vanadilo (vanádio em estado de oxidação V) ou íon vanadato (vanádio em estado de oxidação IV) em diversas linhagens de células tumorais (EVANGELOU, 2002; KLEIN et al, 2008; KOSTOVA, 2005 & RAY et al, 2006) mostrando atividade promissora (BISHAYEE et al,2010). Na bibliografia consultada foram encontradas as atividades antitumorais do VOSO4 (EVANGELOU, 2002), do Na3VO4 (KLEIN et al, 2008), do NH4VO3 (RAY et al, 2006); e outros compostos tais como bis(etilmaltolato) de oxovanádio, vanado tartrato de diamônio,vanadiltartrato de amônio (BISHAYEE et al,2010).
1.2 Arquitetura dos compostos
1.2.1 Rutênio
O rutênio é um metal que pode se apresentar em vários estados de oxidação, sendo os mais estáveis II, III e IV, apresentando vantagens tais como: (a) métodos seguros de sínteses de seus compostos e obtenção de produtos estáveis; (b) habilidade em se complexar a diversos ligantes, modificando as velocidades de troca e substituição de ligantes (CLARKE, 2002).
No meio biológico o rutênio pode assumir propriedades semelhantes ao de seu congênere mais leve da Tabela Periódica, o ferro (Fe), sendo então uma das hipóteses para ele atingir o alvo é utilizar os mecanismos de transporte do ferro até a célula (CLAIRE & PAUL, 2008).
1.2.2 Fosfinas: 1,4(difenilfosfina)butano (dppb)
28
& BATISTA, 1996). A auranofina é capaz de destruir células cancerosas em diversas culturas (BERNERS-PRICE et al, 1986). A atividade antitumoral de um composto análogo, porém sem fosfina, AuSGlu(Ac)4, diminui 150 vezes, sugerindo que o agente ativo seja a fosfina. Para o composto Et3PAuSGlu(Ac)4 o IC50 é 1,5 μM, enquanto que para o sem fosfina é 150 μM. É importante
destacar que os ligantes fosfínicos quando livres são também ativos, ainda que em menor extensão (BERNERS-PRICE et al, 1987). Outros íons metálicos (Ag, Cu, Ru, Rh, Pt, Pd) contendo fosfinas como ligantes foram avaliados em varias linhagens celulares (TABELA 10, QUEIROZ & BATISTA, 1996). Entretanto, é possível que os complexos como um todo sejam, de fato, as espécies ativas e não propriamente a fosfina, embora isto também possa ser viável e que as fosfinas tenham razoável grau de citotoxidade.
TABELA 10- Atividade de complexos bifosfínicos de Au (I), Ag (I) e Cu (I) em ratos portadores de leucemia ip P388, sarcoma de células reticulares ip M5076 e melanoma ip B16 e atividade citotóxica in vitro para células melanoma B16.
Composto MTD
a
mmol/Kg/dia P388
M5076
ILSb % B16 IC50 c(μM)
[Au(dppe)2]Cl 3 83±24d 57±15 38±9c 4,5
[Au(dppe)2]NO3 3 90±17 i i 4
[Au(dppp)2]Cl 3 89±28h 116 34±6h 0,6
[Au(dppey)2]Cl 1,5 92±26f 69 35 2
[Au(eppe)2]NO3 4 54±16g 46 i 5
[Au(depe)2]NO3 4 40/30 i i 17
[Ag(dppe)2]NO3 3 89/90 48 i 4
[Ag(depe)2]NO3 1 50/40 i i 4
[Ag(dppey)2]NO3 5 60/40 i i i
[Cu(dppey)2]Cl 3 66±20 40 42 i
[Cu(dppp)2]Cl 2 89±149 i 32/47 i
[(CuCl2)(dppe)3] 2 100/115 60 54 3
Cisplatina 6 125 i i 0,9
a Dose máxima tolerada em rato; b Aumento da vida média de ratos portadores de
tumores ip; dados separados por / representam dados gerados em experimentos distintos. Uma droga é considerada ativa se porduz > 50 % ILS em leucemia P388 e > 25 % ILS nos outros dois sistemas de tumores; c IC
50 é a concentração para diminuir
um 50 % o numero de colônias formadas após exposição de 2 horas ao composto; d
baseado em 33 experimentos diferentes; e 5 experimentos; f 7 experimentos; g 4
29
Em nosso laboratório temos trabalhando na síntese e caracterização de complexos de rutênio contendo fosfinas, há duas décadas e recentemente começou-se a avaliar a potencial atividade antitumoral desses compostos, obtendo resultados promissores, estimulando nossas pesquisas. A título de exemplo, apresentam-se na TABELA 11 alguns desses complexos, destacando os resultados para o ligante o qual foi estudado neste trabalho, a 1,4-bis(difenilfosfina)butano (dppb).
TABELA 11- Valores de IC50 de alguns complexos contra a linhagem celular derivada de tumor humano MDA-MB231 (ensaios em DMSO).
Complexo IC50 (M)
[Ru(dmpm)(Me-bipy)(dppb)]PF6 0,43n
[Ru(dmpm)(bipy)(dppb)]PF6 0,46n
[RuCl2(bipy)(dppb)] 31,3n
Composto com CO
cc-[RuCl(CO)(bipy)(dppb)]PF6a 1,9o
Cisplatina 63*
Compostos com aminoácidosp
[Ru(L-Met)(bipy)(dppb)]PF6b 5,0 [Ru(L-Leu)(bipy)(dppb)]PF6c 7,1 [Ru(L-Gli)(bipy)(dppb)]PF6d 14,5 [Ru(L-Lis)(bipy)(dppb)]PF6e 16,2 [Ru(L-Try)(bipy)(dppb)]PF6f 21,3 [Ru(L-Ser)(bipy)(dppb)]PF6g 24,1 [Ru(L-Val)(bipy)(dppb)]PF6h 26,2 [Ru(L-Trp)(bipy)(dppb)]PF6i 28,2 [Ru(L-Ala)(bipy)(dppb)]PF6j 28,5 Compostos com tiossemicarbazonasq
[RuCl(2Ac4mT)(dppb)]k 5,1 ± 0,1
[RuCl(2Fo4mT)(dppb)]l 1,3 ± 0,4
[RuCl(2Bz4mT)(dppb)]m 1,3 ± 0,1
30
1.2.3 4,6-dimetil-2-mercaptopirimidina (dmpm)
Nos últimos anos as mercaptopirimidinas tem sido muito estudadas, devido as suas semelhanças com as nucleobases dos ácidos nucleicos (citosina, timina e uracilo) (FIGURA 18a). Além de possuirem dois átomos doadores, o enxofre (mole) e o nitrogênio (duro), presentes nas suas estruturas, permitindo que esses átomos possam unir-se ao mesmo tempo, tanto aos metais moles, quanto aos duros. Também apresentam duas formas tautoméricas, tiol e tiona (FIGURA 18b) que conferem a este ligante, maior riqueza química. Cabe destacar a grande variedade de seus modos de coordenação ao metal (monodentado neutro, bidentado, ligante ponte, monodentado aniônico, ou ligar ao mesmo tempo a dois centros metálicos) (FIGURA 18c) (RAPER, 1996; RAPER, 1997).
FIGURA 18- a: Nucleobases do DNA; b:tautomerismo tiol/tiona da 4.6-dimetil-2-mercaptopirimidina; c: modos de coordenação do ligante.
31
antiinflamatórias, antiparkinsonianas androgênicas e anabólicas, assim como propriedades analgésicas, antiarrítmicas e antitumorais (PARVEEN et al, 2010).
No nosso laboratório temos sintetizado e avaliado as atividades antitumorais de alguns compostos contendo este ligante, obtendo bons resultados preliminares na linhagem MDA-MB231 (câncer de mama). Na TABELA 09 os compostos [Ru(dmpm)(Me-bipy)(dppb)]PF6 e [Ru(dmpm)(bipy)(dppb)]PF6 apresentaram um IC50 de 0,43 e 0,46 μM
respectivamente, e para os compostos [Ru(dmpm)(bipy)(P-P)]PF6, onde P-P = dppe, dppp ou dppf, foram obtidos IC50 entre 0,14 e 0,20 μM (LIMA, 2010), o
que são ótimos resultados comparado com a cisplatina, que tem um IC50 de 63
μM
1.2.4 Ácido picolínico (pic)
A molécula do ácido picolínico, dependendo do pH, pode existir em três formas: como cátion picolinium (em meio fortemente ácido), como zwiterion (em meio ácido) ou como ânion picolinato (em meio neutro ou básico)(FIGURA 19a) (MIN et al, 1995). O íon picolonato (pic) se liga aos íons metálicos na forma bidentada N,O formando anéis de 5 membros (FIGURA 1.16b) (GHATAK et al, 1995).
FIGURA 19- a: Formas moleculares do ác. picolínico em solução ; b: estrutura do ácido picolínico e seu modo de coordenação a metais.
32
2007), apresentando funções moduladoras e estimuladoras da resposta dos macrófagos no sistema imunológico. Em concordância com o último tem-se demonstrado que a administração de ácido picolínico a macrófagos infestados
com Mycobacterium avium reduz seu crescimento e produz completa
mycobacteriostasis (PAIS & APPELBERG, 2000). Comercialmente, o trispicolinato de cromo (III) ([Cr(pic)3]) existe em comprimidos, sendo empregado como suplemento de cromo, e estão sendo investigadas suas propriedades no controle da glicemia em pacientes com diabetes mellitus, sendo que alguns nomes comerciais são Ripped Max na Argentina, Edul K-200 no Chile e Chroma-Pak nos Estados Unidos (SWEETMAN, 2009).
Nosso grupo de pesquisa vem empregando este ligante nas sínteses de alguns complexos de rutênio, que apresentam resultados promissores tanto em linhagens de células cancerosas de MDA-MB231 (câncer de mama), quanto contra Mycobacterium tuberculosis. Os compostos cis -[Ru(pic)(dppm)2] e cis-[Ru(pic)(dppm)2] apresentaram valores de IC50 iguais a
0,50 μM em células cancerosas e valores de MIC (Concentração Inibitória
Mínima) 0,69 e 0,22 μM em Mycobacterium tuberculosis respectivamente
(sendo que o MIC para o fármaco padrão, a isoniazida, é de 0,36 μM) (PAVAN et al, 2010).
1.2.5 Monóxido de nitrogênio (NO)
Até os anos 80 os efeitos do NO na natureza e sobre o homem não eram tidos como benéficos. O NO gerado como gás de escapamento dos carros é liberado na atmosfera e transformado em NO2, gás de cor marrom, que reagindo com a energia liberada dos raios ultravioletas emitidos pelo sol provoca um “smog fotoquímico”. A sua exposição à poluição causa irritação bronquial, branqueia as folhas das árvores e acelera a corrosão da borracha (BUTLER & NICHOLSON, 2003)
33
publicação seriada nomeada Nitric Oxide, publicada desde 1995 pela Elsevier, dedicada integramente às pesquisas que vem sendo feitas sobre esta substância. Tal foi o interesse que a revista Science, no ano 1992 escolheu o NO como a molécula do ano (CULOTTA & KOSHLAND, 1992). No ano posterior foi considerada como a estrela surpreendente da bioquímica pela revista Chemical and Engineering News (FELDMAN et al, 1993), e no ano 1998 Robert Furchgott, Louis Ignarro e Ferid Murad (ver FIGURA 20) obtiveram o Prêmio Nobel em Medicina e Fisiologia “...pelas descobertas com o NO como molécula sinalizadora no sistema cardiovascular”.
FIGURA 20- Vencedores do Prêmio Nobel em Medicina e Fisiologia em 1998 pelas descobertas com o NO como molécula sinalizadora no sistema cardiovascular.
O oxido nítrico é a menor e a mais simples molécula biologicamente ativa. É a única molécula endógena que cumpre variadas funções no organismo, como neurotransmissor, autacoide, mediador constitutivo e induzível, molécula citoprotetora e molécula citotóxica. O NO tem a ver com diversas atividades realizadas pelo sistema imunológico e em diversos órgãos como cérebro, pâncreas, pulmões, útero e pênis, assim como agente vasodilatador, diminuindo a pressão sanguínea e com processos como a memória e aprendizagem (IGNARRO, 2000).
34
nitrosilos ou ligando-se a centros metálicos mais eletropositivos, como lítio ou sódio. O NO coordenado pode adotar geometria linear ou angular com respeito ao centro metálico, refletindo as diferentes interações da ligação M-NO (FIGURA 21).
M N O M N O
2- + + - +
Linear
M N
O M N O
+
-Angular
FIGURA 21- Modos de coordenação do NO a um centro metálico.
Quando os comprimentos de ligação são curtos (entre 1,60 e 1,75 Å) e a freqüência de estiramento do NO no infravermelho (ν NO entre 1650 e 1985 cm-1) é alta, a forma linear predomina. Uma hibridização sp do átomo de nitrogênio é observada e os orbitais π* disponíveis estão propícios a receber densidade eletrônica do metal. Assim, a forma angular apresenta maiores comprimentos das ligações (entre 1,80 e 1,95 Å) e menores freqüências de
estiramento no infravermelho (ν NO entre 1525 e 1590 cm-1), sendo o centro metálico rico em elétrons (RICHTER-ADDO & LEGZDINS, 1992).
In vivo, o NO é produzido nas células de maneira continua. A isoforma da enzima óxido nítrico sintase endotelial (NOSe) produz o NO oxidando o aminoácido L-arginina para formar L-citrulina (ver FIGURA 22). O NADPH e o O2 são empregados como co-substratos, envolvendo a transferência de 5 elétrons.