UNIVERSIDADE FEDERAL DO CEARÁ
CENTRO DE CIÊNCIAS
PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
Thiago dos Santos Francisco
COMPLEXOS FOSFÍNICOS DE RUTÊNIO: SÍNTESE, CARACTERIZAÇÃO, IMOBILIZAÇÃO E ATIVIDADE CATALÍTICA
FORTALEZA
THIAGO DOS SANTOS FRANCISCO
COMPLEXOS FOSFÍNICOS DE RUTÊNIO: SÍNTESE, CARACTERIZAÇÃO, IMOBILIZAÇÃO E ATIVIDADE CATALÍTICA
Tese apresentada ao Curso de Doutorado em Química do Departamento de Química Orgânica e Inorgânica da Universidade Federal do Ceará, como parte dos requisitos para obtenção do título de Doutor em Química. Área de concentração: Química Inorgânica.
Orientadora: Profa. Izaura Cirino Nogueira Diógenes.
FORTALEZA
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca de Ciências e Tecnologia
F893c Francisco, Thiago dos Santos.
Complexos fosfínicos de rutênio: síntese, caracterização, imobilização e atividade catalítica /
Thiago dos Santos Francisco. – 2015. 146 f. : il. color.
Tese (doutorado) – Universidade Federal do Ceará, Centro de Ciências, Departamento de Química Orgânica e Inorgânica, Programa de Pós-Graduação em Química, Fortaleza, 2015.
Área de Concentração: Química.
Orientação: Profa. Dra. Izaura Cirino Nogueira Diógenes. 1. Compostos de coordenação. 2. Rutênio. 3. Catálise. I. Título.
À Deus, por me abençoar com mais essa conquista.
Aos meus pais: Severino F. Filho e Irene M. S. Francisco, que sempre me
ensinaram os verdadeiros valores da vida e são os meus maiores exemplos de
dignidade, respeito, honestidade, companheirismo, humildade e generosidade.
Pelo apoio e incentivos sempre constantes durante toda minha vida.
Ao meu irmão, Rafael, que sempre acreditou e incentivou.
Agradecimentos
A Profª Dra. Izaura Cirino N. Diógenes pela orientação sempre constante, pela oportunidade e confiança depositadas em mim e por todos os ensinamentos que com certeza contribuíram muito para minha formação pessoal e profissional.
Aos membros da banca por terem aceitado tão prontamente a participar dessa comissão avaliativa e por todas as valiosas observações.
Ao Prof. Dr. Ícaro de Sousa Moreira (in memoriam) pelo exemplo de pesquisador, de educador e administrador. Seus ensinamentos irão permanecer na memória de todos que tiveram o enorme prazer de conhecê-lo e seu legado continuará através daquilo que nos ensinou com suas ações.
Ao CENAUREM, na pessoa do Prof. Dr. Edilberto Rocha Silveira pela disponibilidade em ceder os equipamentos para a realização dos experimentos de Ressonância Magnética Nuclear que foram fundamentais na realização desse trabalho, além de permitir que fizesse parte do quadro de operadores pelo período de aproximadamente 3 anos.
Ao Prof. Alzir A. Batista pela colaboração continua e efetiva na realização de diversas análises.
Profª Marcia L. A. Temperini pela colaboração que possibilitou a determinação dos teores de carbono, hidrogênio e nitrogênio por análise elementar.
A CAPES, FUNCAP e CNPq, pelo suporte financeiro.
Aos professores Marcelo Oliveira Santiago e Ana Lúcia Rodrigues de Sousa que muito colaboraram para o meu crescimento acadêmico e profissional.
Aos demais professores (as) do Grupo de Bioinorgânica: Alda Karine, Audísio Filho, Eduardo Henrique, Idalina Maria, Jackson Rodrigues, Luiz Gonzaga e Tércio de F. Paulo.
Os alunos de iniciação científica (IC’s) que tive o prazer que co-orientar:
Dayane Oliveira, Yana Luck, Natanna Azevedo de Aguiar (“As Mariazinhas”), Priscila Luz e Ramon Linhares. Espero que vocês tenham aprendido comigo, tanto quanto, eu aprendi ao co-orienta-lós.
Aos amigos que fazem parte de Laboratório de Bioinorgânica, em especial, Adilson Sales, Arquimedes, Dieric Abreu, Elis Cristina, Fernado Barroso, Jefferson Saraiva, Natanna Aguiar, Ordelei Nascimento, Pedro Hermano, Sérgio e Tércio de Freitas pelas discussões científicas e pelos inúmeros momentos de descontração que sempre fizeram parte de nossa vida acadêmica.
A todos aqueles que foram involuntariamente esquecidos neste agradecimento e que contribuíram de maneira direta ou indireta para a realização deste trabalho.
RESUMO
Os resultados apresentados neste trabalho envolvem a síntese de compostos de coordenação contendo fosfinas e ligantes redox ativos (ligantes não-inocentes) na esfera de coordenação do rutênio. Este trabalho está inserido em uma linha de pesquisa do Grupo de Bioinorgânica que visa, como objetivo final, a aplicação dos compostos isolados na catálise de reações de hidrogenação. Durante o desenvolvimento das atividades de doutorado, período de março de 2010 a janeiro de 2015, foram sintetizados seis (06) compostos inéditos na literatura, um dos quais sendo classificado como complexo precursor, [RuIICl2(binap)(PPh3)], onde binap = β,β′ -bis(difenilfosfina)-1,1′-dinaftaleno. Todos estes compostos foram caracterizados por ressonância magnética nuclear de fósforo (RMN 31P{1H}), análise elementar e espectroscopias vibracional na região do infravermelho e eletrônica nas regiões do ultravioleta e visível. A despeito das diversas tentativas de formação de cristais dos complexos isolados, apenas o composto trans-[RuIICl2(dppb)(Clcat)], onde dppb = 1,4-bis(difenilfosfina)butano e
opda-Clcat = 4-cloro-1,2-fenilenodiamina, forneceu cristais passíveis de análise por difração de raios X. A partir dos resultados obtidos durante o período citado, dois trabalhos foram publicados em periódicos indexados (Polyhedron 2010, 29, 3349–3354 e Polyhedron 2012, 31, 104–109) e
cinco trabalhos foram apresentados em congressos nacionais e internacionais. Os espectros de RMN 31P{1H} dos compostos sintetizados apresentaram um único sinal indicando que os átomos de fósforo ocupam posições equivalentes e trans aos átomos doadores dos ligantes
não-inocentes. Apenas o composto trans-[RuIICl2(dppb)(opda-Clcat)] apresentou um dubleto de
dubleto que foi atribuído à assimetria do ligante opda-Cl, sendo confirmado pelos dados de difração de raios X. Os dados de espectroscopia eletrônica indicaram o estado oxidado dos ligantes o-fenilênicos após coordenação ao centro metálico sendo possível, portanto, a
observação de interações de retrodoação. Os ensaios de atividade catalítica foram monitorados por cromatografia gasosa acoplada à espectrometria de massa utilizando a reação padrão de hidrogenação da molécula de acetofenona ao álcool 1-feniletanol. Além dos complexos originalmente apresentados nesta tese, [RuIICl2(binap)(PPh3)](1), trans-[RuII Cl2(binap)(opda-Clcat)](2), trans-[RuIICl2(binap)(fenantq)](3), trans-[RuIICl2(PPh3)2(opdaq)](5) e trans
-[RuIICl2(PPh3)2(fenantq)](6), onde fenantq e opdaq são, respectivamente, 9,10-fenantrequinona e 1,2-fenilenodiamina, tais ensaios foram, também, realizados com compostos previamente sintetizados durante a dissertação de mestrado e por outros membros do Grupo de Bioinorgânica, resultando em um total de vinte (20) catalisadores estudados. Destes complexos, dois foram estudados em condições heterogêneas após imobilização sobre esferas híbridas de sílica/quitosana. Dentre os sistemas estudados, os complexos trans
-[RuIICl2(dppb)(Quinone)](10),
cis-[RuIICl2(dppb)(opda-Clq)](13), trans
-[RuIICl2(dppb)(tabq,cat)](15) e
cis-[RuIICl2(dppb)(tabq,cat)](16), onde tabq,cat = γ,γ’,4,4’
-tetraaminobifenil, apresentaram os mais altos valores de conversão (> 90%) em todas as condições analisadas. Os valores de conversão observados para os sistemas heterogêneos, ~ 60%, embora menores que aqueles calculados para os sistemas homogêneos em condições similares, não representam desvantagem, uma vez que implicam na redução da etapa de separação. Os compostos que apresentaram maiores valores de conversão em meio homogêneo apresentam, em comum, a presença de ligantes não-inocentes no estado oxidado. Essa observação indica a presença de efeitos sinérgicos que influenciam na afinidade do substrato, a citar: (i) aumento da acidez de Lewis do metal pela oxidação do ligante e (ii) função de reservatório de densidade eletrônica do ligante redox ativo que permitir o metal estocar (doar) densidade eletrônica no (para o) ligante durante as etapas elementares do ciclo catalítico, evitando a localização excessiva de carga sobre o metal.
ABSTRACT
The results presented in this thesis involve the synthesis of coordination compounds containing phosphine ligands and redox active (non-innocent ligands) in the ruthenium coordination sphere. This work is part of a research line of Bioinorganic Group research aimed, as the ultimate goal, the application of the isolated compounds in catalysis of hydrogenation reactions. During the development of PhD activities, from March 2010 to January 2015, six compounds (06) unpublished in the literature were synthesized; one of which being classified as a precursor complex, [RuIICl2(binap)(PPh3)], where binap = β,β′-bis(diphenylphosphine)-1,1′ -dinaphthalene. All of these complexes were characterized by means of phosphorous nuclear resonance magnetic (RMN 31P{1H}), elemental analysis, infrared spectroscopy and electronic spectroscopy in the ultraviolet and visible regions. Despite several attempts to produce crystals of the synthesized compounds, only the trans-[RuIICl2(dppb)(opda-Clcat)] complex, where dppb
= 1,4-bis(diphenylphosphine)butane and opda-Clcat = 4-cloro-1,2-phenylenediamine, yielded suitable crystals for determination of X-ray structure. From the results obtained during the cited time, two papers were published in indexed journals ((Polyhedron 2010, 29, 3349–3354 and Polyhedron 2012, 31, 104–109) and five works were shown in national and international
meetings. The RMN 31P{1H} spectra of the isolated compounds presented only one signal indicating that the phosphorous atoms lie in equivalent positions and trans in relation to the
donor atoms of the non-innocent ligands. For the trans-[RuIICl2(dppb)(opda-Clcat)] complex,
however, a dublet of dublet was observed and was assigned to the assimetry of the opda-Cl moiety, which was confirmed by X ray diffraction. The electronic spectroscopic data indicated the oxidized state of the o-phenylene ligands upon coordination to the metal atom thus making
possible the back-bonding interaction. The catalytic activity assays were monitored by gas chromatography coupled to mass spectrometry using the standard hydrogenation reaction of the alcohol molecule acetophenone to 1-phenyl ethanol. In addition to the complex originally presented in this thesis, [RuIICl2(binap)(PPh3)](1),
trans-[RuIICl2(binap)(opda-Clcat)](2), trans
-[RuIICl2(binap)(fenantq)](3), trans-[RuIICl2(PPh3)2(opdaq)](5) and trans -[RuIICl2(PPh3)2(fenantq)](6), where fenantq and opdaq are, respectively, 9,10-phenanthraquinone and 1,2-phenylenediamine, such assays were also carried out for compounds which were previously synthesized during the master course and by other researchers of the Bioinorganic Group resulting resulting in a total of twenty (20) studied catalysts. Among these complexes, two were studied in heterogeneous condition upon immobilization on hybrid spheres of silica chitosan. By accounting for all the studied conditions, the highest values of conversion (> 90%) were observed for trans-[RuIICl2(dppb)(Quinone)](10), cis-[RuIICl2(dppb)(opda-Clq)](13), trans-[RuIICl2(dppb)(tabq,cat)](15) and cis-[RuIICl2(dppb)(tabq,cat)](16), where tabq,cat = γ,γ’,4,4’
-tetraaminobiphenyls. The values of conversion observed for the heterogeneous systems, c.a. 60%, although lower than those calculated for the homogeneous systems under similar conditions, do not constitute a disadvantage, since separation step is no longer needed. The compounds that showed the higher conversion values in homogeneous medium feature in common the presence of non-innocent ligands in the oxidized state. This observation indicates, very probably, two synergistic effects which influence the affinity of the substrate: (i) the increase of the Lewis acidity of the metal by the oxidation of the ligand and (ii) the function of electron density reservoir of the redox active ligand that allows the metal to store (donate) electron density from (to) the ligand during the elementary steps of the catalytic cycle by preventing excessive charge density on the metal.
LISTA DE ILUSTRAÇÕES
Figura 1. Ângulo de cone. 24
Figura 2. Estrutura de alguns ligantes bifosfínicos quirais e aquirais. 25 Figura 3. Possíveis estados de oxidação de moléculas da classe das ortobenzoquinonas. 27 Figura 4. Possíveis estados de oxidação de moléculas da classe das ortobenzoquinonas. 28 Figura 5. Estados de oxidação do ligante tabcat,cat. 29 Figura 6. Classificação da reação de redução de ligações duplas polares, onde H = hidrogenação, T = transferência de hidrogênio, I = na esfera interna, E = na esfera externa, L =
auxiliada por ligantes e P = pergunta. 32
Figura 7. Formação de hidretos de rutênio na reação de hidrogênação. 33 Figura 8. Esquema catalítico generalizado para a hidrogenação de duplas polares.[110] 34
Figura 9. Esquema estrutural da sílica.[151] 35
Figura 10. Ligantes o-fenilênicos que foram utilizados no desenvolvimento deste trabalho. 38 Figura 11. Estrutura dos complexos mer-[RuIIICl3(dppb)(H2O)], [RuIICl2(PPh3) 3],
[RuIICl2(dppb)(PPh3)], [RuIICl2(binap)(PPh3)] e dos ligantes fosfínicos pph3, dppb e binap. Os ligantes dppb e binap serão representados neste texto nas cores preta e azul, respectivamente. 39 Figura 12. Estrutura do complexo [RuIICl2(binap)(PPh3)]. 47 Figura 13. Estrutura do complexo trans-[RuIICl2(binap)(opda-Clcat)]. 48 Figura 14. Estruturado do complexo trans-[RuIICl2(binap)(fenantq)]. 49
Figura 15. Estrutura do complexo trans-[RuIICl2(dppb)(opda-Clcat)]. 50
Figura 16. Estrutura do complexo trans-[RuIICl2(PPh3)2(opdaq)]. 51
Figura 17. Estrutura do complexo trans-[RuIICl2(PPh3)2(fenantq)]. 51
Figura 18. Sistema de produção de esferas utilizado neste trabalho. 52 Figura 19. Esquema proposto para modificação das esferas de sílica.[147,151,180] 53 Figura 20. Incorporação do complexo cis-[RuIICl2(dppb)(tabq,cat)] à Matriz de SiCl. 54
Figura 21. Esquema de incorporação do íon complexo [RuCl2(bpy)2] em matriz de
Si-ATPS-ISN. 55
Figura 24. Possíveis isômeros geométricos de complexos do tipo [RuCl2(P-P)(N-N)], sendo
trans-[RuCl2(P-P)(N-N)] (a) e cis-[RuCl2(P-P)(N-N)] (b). 60
Figura 25. Isomerização em consequência da quebra de ligação metal-ligante, sem substituição
de ligante.[191] 61
Figura 26. Torção de Bailar (a) e torção de Ray-Duff (b) para a isomerização de complexos octaédricos sem perda de ligante ou quebra de ligação.[191] 62 Figura 27. Espectro de RMN 31P{1H} do complexo [RuIICl2(binap)(PPh3)], em CDCl3
(500MHz). 63
Figura 28. Espectro de RMN 31P{1H} do complexo trans-[RuIICl2(binap)(opda-Clcat)], em
CDCl3 (60MHz). 63
Figura 29. Espectro de RMN 31P{1H} do complexo trans-[RuIICl2(binap)(fenantq)], em CDCl3
(500MHz). 64
Figura 30. Espectro de RMN 31P{1H} do complexo
trans-[RuIICl2(PPh3)2(opdaq)], em CDCl3
(60MHz). 64
Figura 31. Espectro de RMN 31P{1H} do complexo trans-[RuIICl2(PPh3)2(fenantq)], em CDCl3
(60MHz). 65
Figura 32. Espectro de RMN 31P{1H} do complexo
trans-[RuIICl2(dppb)(opda-Clcat)], em
CDCl3 (500MHz). 65
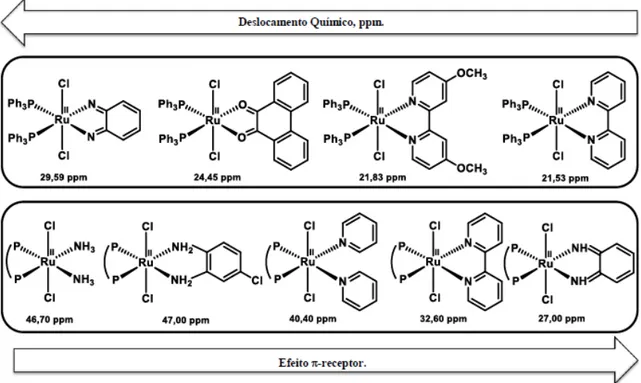
Figura 33. Padrões de separação de um sistema de dois prótons com vários valores de /J e acoplamento de spin do tipo AX2, AB e AX, com transição inicial em AX (a).[192] 74 Figura 34. Efeito do ângulo de cone sobre o deslocamento químico dos pares de complexos
trans-[RuIICl2(PPh3)2(opdaq)](5) / trans-[RuIICl2(dppb)(opdaq)][83] e trans-[RuII
Cl2(binap)(opda-Clcat)](2) / trans-[RuIICl2(dppb)(opda-Clcat)](4). 76
Figura 35. Correlação dos valores de deslocamento químico de alguns complexos fosfínicos -receptor dos ligantes o-fenilênicos e N-heterocíclicos. 77
Figura 36. Estrutura cristalográfica ORTEP[170-175] do complexo trans-[RuII
Cl2(dppb)(opda-Clcat)]. 80
Figura 37. Estrutura cristalográfica ORTEP[170-175] do complexo trans-[RuII
Cl2(dppb)(opda-Clcat)]. 84
Figura 38. Correlação entre o comprimento da ligação Ru – P e a variação de deslocamento químico de fósforo (31P {1H}) para os complexos: (a) [RuCl2(dppb)(PPh3)], (b) cis -[RuCl2(dppb)(phen)], (c) cis-[RuCl2(dppb)(bipy)], (d) trans-[RuCl2(dppb)(py)2], (e)
Figura 40. Espectro eletrônico do complexo trans-[RuIICl2(binap)(opda-Clcat)], em
diclorometano nas concentrações de 2,82 x 10-5 mol L-1 (a) e 1,76 x 10-4 mol L-1 (b). 89 Figura 41. Espectro eletrônico do complexo trans-[RuIICl2(dppb)(opda-Clcat)], em
diclorometano na concentração de 1,83 x 10-4 mol L-1. 90 Figura 42. Espectro eletrônico do complexo trans-[RuIICl2(binap)(fenantq)], em diclorometano
na concentração de 3,33 x 10-4 mol L-1. 91
Figura 43. Espectro eletrônico do complexo trans-[RuIICl2(PPh3)2(opdaq)], em diclorometano
na concentração de 5,29 x 10-5 mol L-1. 92
Figura 44. Espectro eletrônico do complexo trans-[RuIICl2(PPh3)2(fenantq)], em diclorometano
na concentração de 1,84 x 10-6 mol L-1. 93
Figura 45. Espectro vibracional na região do infravermelho dos complexos precursores [RuIICl2(dppb)(PPh3)](a) e [RuIICl2(binap)(PPh3)](b), em pastilha de KBr. 95
Figura 46. Espectros vibracionais na região do infravermelho dos complexos sintetizados
trans-[RuIICl2(binap)(opda-Clcat)](2), trans-[RuIICl2(binap)(fenantq)](3) e trans
-[RuIICl2(dppb)(opda-Clcat)](4), em pastilha de KBr. 97 Figura 47. Espectro vibracional na região do infravermelho dos complexos trans
-[RuIICl2(PPh3)2(opdaq)](5) e
trans-[RuIICl2(PPh3)2(fenantq)](6), em pastilha de KBr. 98
Figura 48. Espectros vibracionais na região do infravermelho de esferas híbridas sílica/quitosana (a), quitosana (b) e para esferas de sílica calcinada (c), em pastilha de KBr. 101 Figura 49. Espectro vibracional na região do infravermelho do sistema Si-cis
-[RuIICl2(dppb)(tabq,cat)], disperso em pastilha de KBr. 102 Figura 50. Isoterma de adsorção de nitrogênio das esferas de sílica (sílica calcinada, SiCl e
Si-cis-[RuIICl2(dppb)(tabq,cat)]). 103
Figura 51. Distribuição de diâmetro de poros das esferas de sílica (sílica calcinada, SiCl e
Si-cis-[RuIICl2(dppb)(tabq,cat)]. 104
Figura 52. Cromatograma da mistura dos compostos feniletanol, acetofenona e 2-feniletanol, com os respectivos tempos de retenção em varias concentrações 106 Figura 53. Espectro de massa obtido com ionização por impacto de elétrons para a molécula
acetofenona. 107
Figura 54. Espectro de massa obtido com ionização por impacto de elétrons para a molécula
feniletanol. 107
Figura 55. Espectro de massas obtido com ionização por impacto de elétrons para a molécula
2-feniletanol. 108
Figura 56. Caminho de fragmentação de alguns íons para as moléculas acetofenona, feniletanol
Figura 57. Cromatograma do experimento catalítico utilizando como catalisador os complexos
trans-[RuIICl2(dppb)(Quinone)](10), cis-[RuIICl2(dppb)(opda-Clq)](13), trans
-[RuIICl2(dppb)(tabq,cat)](15) e
cis-[RuIICl2(dppb)(tabq,cat)](16). 111
Figura 58. Cromatograma do experimento catalítico utilizando como catalisador os complexos sintetizados que não apresentaram conversão total, tal como, trans-[RuII
LISTA DE TABELAS
Tabela 1. Dados cristalográficos, parâmetros de raios X e resultados de refinamento da estrutura do complexo trans-[RuIICl2(dppb)(opda-Clcat)].[73-78]... ...44 Tabela 2. Rampa de temperatura utilizada para eluição dos componentes... ...56 Tabela 3. Especificações técnicas do CG-MS... ...57 Tabela 4. Valores de deslocamentos químicos bem como a sugestão de estrutura dos complexos sintetizados e similares... ...67 Tabela 5. Comprimento de ligação [Å][170-175] do complexo trans-[RuII
Cl2(dppb)(opda-Clcat)]... ... 81 Tabela 6. Ângulo de ligação [Å][170-175] do complexo trans-[RuII
Cl2(dppb)(opda-Clcat)]... ... ...82 Tabela 7. Comprimento de ligação Ru-N [Å] de alguns complexos fosfínico...83 Tabela 8. Dados microanalíticos dos complexos sintetizados... ...86 Tabela 9. Valores obtidos por espectroscopia eletrônica em diclorometano para os
complexos sintetizados...94 Tabela 10. Tentativa de atribuição das principais frequências vibracionais para os complexos precursores [RuIICl2(dppb)(PPh3)] e [RuIICl2(binap)(PPh3)], em pastilha de KBr... ...96 Tabela 11. Tentativa de atribuição das principais frequências vibracionais para os complexos sintetizados, em pastilha de KBr... ...99 Tabela 12. Propriedades texturais dos sistemas obtidos por isotermas de adsorção de nitrogênio...105 Tabela 13. Valores de tempo de retenção... ...106 Tabela 14. Percentuais de conversão catalíticas da reação de hidrogenação do substrato
LISTA DE ABREVIAÇÕES, SÍMBOLOS E ESTRUTURAS
Nome Abreviação
Absortividade molar
Deformação angular assimétrica fora do plano
Deformação angular assimétrica no plano
Eletrodo Normal de Hidrogênio ENH
Fósforo Desacoplado de Próton 31P{1H}
Freqüência de estiramento
Orbital Molecular Desocupado de Mais Baixa Energia LUMO
Orbital Molecular Ocupado de Mais Alta Energia HOMO
Ressonância Magnética Nuclear RMN
Metal to Ligand Charge Transfer Transition MLCT
Ligand to Metal Charge Transfer Transition LMCT
LISTA DE ABREVIAÇÕES, SÍMBOLOS E ESTRUTURAS
Nome Abreviação Estrutura
catecol cat
OH
OH
semiquinona sq
O
-O
-quinona q
O
O
1,2-fenilenodiamina opda
NH2
NH2
4-cloro-1,2-fenilenodiamina
opda-Clcat
NH2
NH2 Cl
NH2
NH2
NH2
NH2
adrenalina adrenalina
OH
OH N
OH H
H3C
γ,γ’,4,4’
-tetraaminobifenil tabcat,cat
9,10-fenantrequinona
fenantq
O
O
benzenoditiol bzditiol
cat
SH
SH
trifenilfosfina PPh
3
P
1,4-bis(difenilfosfina)butano dppb P P
β,β′
-bis(difenilfosfina)-1,1′-dinaftaleno
Binap
piridina py
N
β,β’-bipiridina bipy
N N
1,10-fenantrolina phen
4,4’-dimetóxi-β,β’
-bipiridina MeO-bipy
N N
O O
4’-dinitro-β,β’-bipiridina NO
2-bipy4
N N
O2N NO2
Acetofenona ---
1-Feniletanol ---
2-Feniletanol ---
tolueno deuterado C7D8
SUMÁRIO
1. INTRODUÇÃO ... 21
1.1. Complexos de Rutênio ... 21
1.2. Ligantes Fosfínicos ... 22
1.3. Ligantes o-fenilênicos ... 26
1.4. Aplicação de Complexos de Rutênio como Catalisadores ... 30
1.5. Sílica como Suporte ... 35
2. OBJETIVOS E JUSTIFICATIVA ... 37
3. PARTE EXPERIMENTAL... 41
3.1. Reagentes e Soluções ... 41
3.2. Síntese dos Precursores ... 42
3.3. Instrumentação e Técnicas Experimentais ... 42
3.3.1. Ressonância Magnética Nuclear (RMN) de 31P{1H} ... 42
3.3.2. Difração de raios X[170-175] ... 43
3.3.3. Analise Elememtar ... 45
3.3.4. Espectroscopia Eletrônica nas Regiões do Ultravioleta e Visível ... 45
3.3.5. Espectroscopia Vibracional na Região do Infravermelho ... 45
3.3.6. Cromatografia Gasosa Acoplada a um Espectrômetro de Massa (CGMS)... 46
3.4. Síntese dos complexos do tipo [RuIICl2(dppb)(X)][17,20,83,87,148,155,165-167,176-178]46 3.4.1. Síntese do Complexo [RuIICl2(binap)(PPh3)](1) ... 47
3.4.2. Síntese do Complexo trans-[RuIICl2(binap)(opda-Clcat)](2) ... 48
3.4.3. Síntese do complexo trans-[RuIICl2(binap)(fenantq)](3) ... 48
3.4.4. Síntese do complexo trans-[RuIICl2(dppb)(opda-Clcat)](4) ... 49
3.4.5. Síntese do complexo trans-[RuIICl2(PPh3)2(opdaq)](5) ... 50
3.4.6. Síntese do complexo trans-[RuIICl2(PPh3)2(fenatq)](6) ... 51
3.5.1. Síntese das Esferas de Sílica[150] ... 52
3.5.2. Modificação das Esferas de Sílica: Reação de Cloração (SiCl) ... 53
3.5.3. Incorporação do complexo cis-[RuIICl2(dppb)(tabq,cat)][166] à Matriz de SiCl (Si-cis-[RuIICl2(dppb)(tabq,cat)]) ... 53
3.5.4. Imobilização do complexo [RuCl2(bpy)2][181] em uma matriz de sílica modificada com 3-aminopropiltrietoxisilano (APTS),[155] ... 54
3.6. Metodologia dos Experimentos Catalíticos ... 55
3.6.1. Sistema Utilizando a Molécula de Acetofenona (C8H8O) ... 55
3.6.2. Condições Catalíticas ... 56
3.6.3. Método Cromatográfico ... 56
3.6.4. Método de Quantificação (Padrão Interno) ... 58
4. RESULTADOS E DISCUSSÃO ... 60
4.1. Ressonância Magnética Nuclear de 31P{1H} (RMN 31P{1H})... 60
4.2. Difração de Raios X do complexo trans-[RuIICl2(dppb)(opda-Clcat)] ... 79
4.3. Análise Elementar ... 86
4.4. Espectroscopia Eletrônica nas Regiões do Ultravioleta e Visível ... 87
4.5. Espectroscopia Vibracional na Região do Infravermelho ... 95
4.6. Catalisadores Heterogêneos ... 100
4.6.1. Esferas de Sílica, Modificação e Incorporação ... 100
4.6.2. Espectroscopia Vibracional na Região do Infravermelho ... 100
4.6.3. Isotermas de Adsorção de N2 ... 103
4.7. Ensaios Catalíticos de Conversão da Molécula de Acetofenona ao Álcool 1-Feniletanol ... 105
5. Considerações Finais ... 116
6. Referências ... 117
Anexo A ... 135
Anexo B ... 139
1. INTRODUÇÃO
1.1. Complexos de Rutênio
O átomo de rutênio destaca-se, entre os metais de transição, por sua capacidade de formar complexos assumindo diversos estados de oxidação de (-II) a (+VIII), principalmente (II) e (III) por serem os estados de oxidação mais estáveis. Esta versatilidade confere ao átomo de rutênio uma química muito diversificada em que ocorre a fácil interconversão entre as configurações eletrônicas d6 - d5, estabilizando compostos penta e hexacoordenados, preferencialmente[1].
A capacidade do átomo de rutênio de formar ligações do tipo sigma () ou e pi () torna sua química interessante e atrativa, já que a configuração eletrônica muito versátil permite a interação com ligantes doadores e receptores.[1] Desse modo, o átomo
de rutênio com configuração eletrônica d6 possui 2 orbitais vazios (eg), ávidos por
elétrons (que podem se ligar a ligantes -doadores), e três orbitais d preenchidos (t2g)
(que podem interagir com orbitais de simetrias adequadas, no orbital *, de ligantes -receptores). Embora a interação do átomo de rutênio com ligantes doadores e receptores seja dependente da valência do metal, a mudança no estado de oxidação não altera obrigatoriamente a esfera de coordenação, apresentando assim uma oportunidade de estudar a reatividade de ligantes -insaturados com essa mudança. Um grande número de estudos envolvendo sínteses, caracterizações, reatividades e aplicações de complexos inorgânicos de rutênio tem sido desenvolvidos.[1-24]
homogênea ou heterogênea, envolvendo reações de hidrogenação, oxigenação, carbonilação, hidroformilação, isomerização, polimerização e decarbonilação de substratos orgânicos ou biológicos.[18,19,23,24,27,28] Estes estudos apresentam geralmente, complexos contendo grupos fosfínicos em sua constituição.
Os estudos de compostos de coordenação vêm se multiplicando rapidamente devido à síntese de complexos com uma mistura de ligantes como diiminas simétricas e assimétricas e/ou com ligantes que estejam coordenados ao átomo de rutênio através de outros átomos que não o nitrogênio (C, P, O, S e halogênios).[1,29] Quando ligantes bifosfínicos quelantes são usados, suas propriedades estéricas exercem grande influência na geometria desses complexos. Desta forma, tem-se observado que a combinação de fatores eletrônicos e estéricos determinam a reatividade e estabilidade do centro metálico.[1,30] A somativa dos efeitos descritos tem dado impulso pra uma grande quantidade de estudos contendo complexos metálicos de rutênio com ligantes inocentes e não inocentes (espécies redox-ativas) tem sido extensamente estudado na literatura,[31] por formar composto de coordenação versáteis capazes de atuar em diverso estudos, tais como interação com DNA,[32-34] atividade antiproliferativa contra uma variedade de células de tumores,[32,35,36] atividade promissora contra câncer e Mycobacterium tuberculosis[37-46] e atividade catalítica.[47,48]
1.2. Ligantes Fosfínicos
Ligantes fosfínicos são ligantes neutros e doadores de um par de elétrons que se caracterizam por estabilizar estados de oxidação variados de metais de transição.[49] A ligação dos ligantes fosfínicos com o metal envolve o componente de doação do par de elétrons isolados para o orbital vazio do metal, bem como a retrodoação do metal para o orbital vazio do ligante fosfínico, sendo assim os ligantes fosfínicos possuem um par de elétrons capaz de formar ligações estáveis e orbitais híbridos, do tipo 3p*d
eletronegatividade dos grupos R aumenta o caráter -receptor dos ligantes fosfínicos também aumentar, pois o orbital * é estabilizado.[51] Esta observação tem sido atribuída tanto ao envolvimento de reações de transferência de elétrons quanto à formação das interações de retrodoação entre o metal e o ligante fosfínico.
Ligantes fosfínicos têm desempenhado um importante papel na química organometálica,[52] devido à possibilidade de modulação de suas propriedades eletrônicas e estéricas e, por consequência, do complexo como um todo. Os grupos ligados ao átomo de fósforo podem variar desde grupamentos alquil ou aril até grupamentos orgânicos mais complexos, como derivados de terpenos.[51]
Dentro desse contexto, ligantes mono e bifosfínicos podem coordena-se fortemente a muitos metais de transição em vários estados de oxidação e exercer alterações fundamentais sobre a reatividade do centro metálico, tais como labilização da posição trans, estabilização de estados de oxidação mais baixos e aumento da solubilidade em solventes orgânicos.[28,49,53] Assim a estabilização desses complexos fosfínicos depende da força de ligação metal-ligante que é governada por efeitos eletrônicos, como por exemplo, a harmonização das energias do metal dos orbitais ligantes e de efeitos estéricos, como por exemplo, o grau de aglomeração dos ligantes na esfera de coordenação do metal e sobreposição de orbitais metal-ligante. Segundo Tolman esse efeito estérico pode ser analisado através do ângulo de cone, , que engloba os raios de van Der Waals dos átomos mais externos de um ligante (Figura 1).[54] Desde então, correlações envolvendo ângulo de cone, vem sendo estudadas,[55] pois a presença de ligantes volumosos provoca uma aglomeração em torno do metal, podendo causar uma dissociação mais rápida do ligante, como consequência do alongamento da ligação metal-ligante para aliviar o bloqueio estérico no centro metálico. Tal efeito pode ser observado ao analisar a substituição em fosfinas terceiras, nas quais à medida que o volume dos grupos substituintes aumenta o ângulo de cone também aumenta, por exemplo, os grupos fosfínicos PH3,PF3, P(OCH3)3, P(OC6H5)3 e
P(o-C6H4CH3)3 apresentam valores de ângulo de cone de 87°, 104°, 128°, 155° e 194°,
Figura 1. Ângulo de cone.
Fonte: Elaborada pelo autor.
A velocidade do processo de dissociação depende de fatores eletrônicos e estéricos. Por exemplo, a atividade catalisadora da metátese de olefinas do rutênio depende da velocidade de dissociação, que é o passo de iniciação do ciclo catalítico.[56]
É sabido, que mudanças na estrutura dos grupos ligados ao átomo de fósforo, grupos substituintes, podem causar sensíveis alterações no comportamento do ligante livre e nos seus complexos de metais de transição.[57] Estas mudanças são dependentes de efeitos estéricos e de efeitos eletrônicos e em alguns casos o primeiro efeito é dominante, sendo um efeito dependente do outro. Por exemplo, aumentando os ângulos entre os substituintes ligados ao átomo de fósforo aumentará a porcentagem de caráter
-doador do par de elétrons do átomo de fósforo. Causando uma mudança na eletronegatividade dos mesmo que pode afetar ângulos e distâncias de ligação. Assim como efeitos eletrônicos, sendo difícil isolar as contribuições.
Por estas razões, complexos de rutênio contendo ligantes fosfínicos são amplamente usados no estudo de catálise de hidrogenação,[4,19,22,24,28,53,58] tendo uma crescente importância na área de catálise homogênea e em uma variedade de reações envolvidas nos processos catalíticos.[4,7,19,21-24,47,59-68] Surgindo diversas séries de
Figura 2. Estrutura de alguns ligantes bifosfínicos quirais e aquirais.
Fonte: Elaborada pelo autor.
1.3. Ligantes o-fenilênicos
Um crescente interesse no estudo de complexos metálicos que contêm ligantes o-fenilênicos vem sendo observado,[25,27] pois existe a possibilidade de interações
eletrônicas entre o metal e essa classe de ligantes. O comportamento eletrônico desses complexos depende do grau de superposição entre os orbitais do metal e do ligante. Essa superposição, por sua vez, depende da energia e simetria dos orbitais envolvidos, já que os ligantes o-fenilênicos possuem orbitais p antiligantes vazios e um par de elétrons capaz de formas ligações fortes, sendo adequados à retrodoação. Por tanto, esses ligantes doam elétrons através da ligação e recebem elétrons do metal através dos orbitais p antiligantes vazios.[72]
Os ligantes o-fenilênicos, tais como: o-fenilenodiamina (opdacat),
4-cloro-1,2-fenilenodiamina (opda-Clcat), adrenalina (adrenalinacat), o-aminofenol (o-aminofenolcat),
γ,γ’,4,4’-tetraaminobifenil (tabcat,cat), benzenoditiol (bzditiolcat) e 9,10-fenantrequinona
(fenantq) pertencem a uma classe de moléculas denominadas ortobenzoquinonas e
merecem atenção especial devido às suas estruturas, suas propriedades eletroquímicas e sua importância para sistemas biológicos[25,73-81] e reações de transferência de
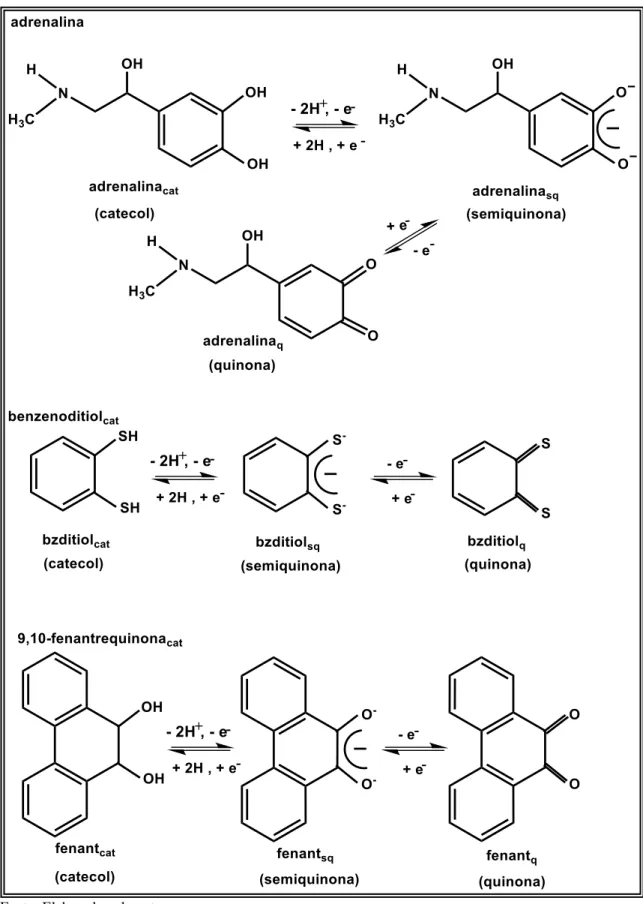
elétrons.[82,83] Classe essa que tem sido utilizada na química de coordenação do átomo do rutênio,[75,78,84,85] pois dependendo das condições reacionais, tais ligantes podem apresentar três estados de oxidação diferentes: a forma completamente reduzida, a parcialmente oxidada e a completamente oxidada, as quais, por analogia a molécula 1,2-dihidroxifenol, são denominadas de forma catecol (cat), semiquinona (sq) e quinona
(q),[25,77,86-88] respectivamente, conforme ilustrações da Figura 3, 4 e 5.
Figura 3. Possíveis estados de oxidação de moléculas da classe das ortobenzoquinonas.
Figura 4. Possíveis estados de oxidação de moléculas da classe das ortobenzoquinonas.
Já para o ligante γ,γ’,4,4’-tetraaminobifenil (tabcat,cat), se observa que cada
metade da molécula pode apresentar três estados de oxidação.[9,18]Este ligante, portanto,
possui seis possíveis estados de oxidação: (cat,cat); (cat,sq); (cat,q); (sq,sq); (sq,q) e (q,q) sendo que a forma (sq,sq) é altamente instável por envolver radicais livres e, portanto, não é observado experimentalmente. Os estados de oxidação do ligante (tabcat,cat) estão descritos na Figura 5.
Figura 5. Estados de oxidação do ligante tabcat,cat.
1.4. Aplicação de Complexos de Rutênio como Catalisadores
A pesquisa em catálise envolve diversas áreas, tais como: materiais, cinética química, organometálicos, química de coordenação, química de sólidos e de superfície, química supramolecular, modelagem e química teórica, nanotecnologia e biotecnologia dentre outras. A aplicação de complexos como catalisadores na indústria é bastante diversificada, podendo-se citar a síntese da amônia, oxidações seletivas, síntese do metanol, produção de olefinas, dentre outras. Nestes casos, os catalisadores são usados em reações de hidrogenação,[22,32,47,61,62,98-102] desidrogenação,[62,82,83] hidroformilação,[103,104] metalase,[105,106] hidrogenólise, oxigenações, clivagem, isomerização, oligomerizações, oxiclorações.[24,107]
A utilização de catalisadores nessa grande variedade de reações é atribuída à alteração da velocidade de conversão de reagentes a produtos, sem ser consumida no
processo e sem alterar o padrão global de energia de Gibbs (ΔG), através da alteração
do mecanismo da reação que tornam viáveis reações termodinamicamente favoráveis, mas que o equilíbrio químico não se estabelece em tempo economicamente aceitável, além de apresentar menor consumo de energia (menores pressões e temperaturas) e permitem maior seletividade nos produtos obtidos.[108,109]
Catalisadores homogêneos, solúveis no meio reacional, são espécies moleculares mais facéis de estudar e direcionar a uma aplicação específica do que catalisadsores heterogêneos. Portanto, complexos de metais de transição vem sendo aplicados como catalisadores homogêneos, pois apresenta uma variedade de estados de oxidação, uma imensa variedade de ligantes possíveis de coordenação ao centro metálico, através de ligação de natureza sigma () e pi (). Possuindo a possibilidade de alteração do número de coordenação e da geometria possibilitando a formação de catalisadores homogêneos altamente seletivos.
ródio e irídio.[122-126] Por exemplo, os complexos de rutênio podem ser utilizados para catálise de hidrogenação de uma grande variedade de ácidos acrílicos e de ésteres.[122]
Certos complexos de rutênio coordenado a aminas são muito mais ativos para reações de hidrogenação de cetonas.[124,125] Esta atividade elevada deve-se, a alta enantiosseletividade na hidrogenação de cetonas pró-quirais e seletividade elevada para a hidrogenação de carbonil sobre os grupos funcionais de olefinas.[127] Tais complexos também apresentam reatividade promissora na hidrogenação de iminas.[123,126] Assim, muitos trabalhos tem demonstrado aplicação de hidretos[123,127-133] e dihidretos[134-136] de rutênio, assim como dicloros complexos contendo rutênio tem sido reconhecidos como pré-catalisadores ativos ou intermediários nos ciclos catalíticos em reações de hidrogênação.[98,114-118,137]
Morris[119] descreve que o mecanismo de hidrogênação envolve a utilização de hidrogênio gasoso (H2) ou a transferência de hidrogênio através de um doador de
hidrogênio (ligante e/ou solvente). Assim, os ciclos catalíticos podem ser divididos em duas partes: (1) a reação do hidreto com o composto insaturado e (2) a regeneração do hidreto de H2 ou do doador de hidrogênio, no caso da transferência de hidrogênio
Figura 6. Classificação da reação de redução de ligações duplas polares, onde H = hidrogenação, T = transferência de hidrogênio, I = na esfera interna, E = na esfera externa, L = auxiliada por ligantes e P = pergunta.
Fonte: Clapham[110] (adaptada pelo autor).
Mecanismos de transferência de hidreto para hidrogênação de duplas polares envolvem a coordenção do substrato (grupos cetona e/ou imina) ao átomo de rutênio (II), ocupando o sítio de coordenação vago pela ocorrência do processo de dissociação de um dos ligantes, possibilitando o ataque eletrofílico aos grupos espefícicos do substrato. Tais catalisadores, geralmente, possuem um sítio de coordenação ocupado por uma ligação fraca, possuindo uma alta barreira de ativação, devido à drástica mudança de geometria. Em alguns casos o uso de um ligante auxiliar, geralmente, um doador de hidrogênio, como grupos ácidos pode favorecer o processo de transferência de hidrogênio.[127]
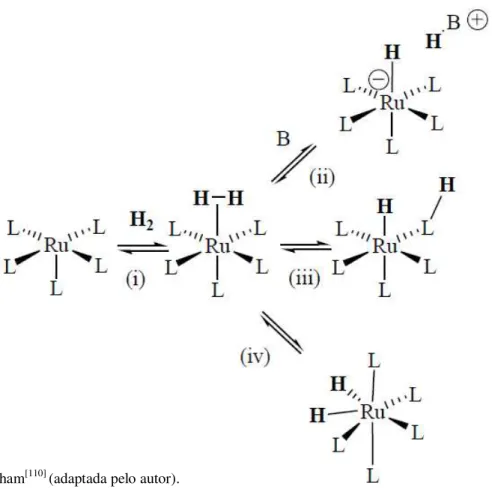
No ciclo catalítico cuja fonte de hidrogênio é o hidrogênio gasoso (H2) a
ocorrer formando um hidreto de rutênio e a protonação de um ligante coordenado ao átomo central (caminho iii). Um terceiro caminho reacional (caminho iv) ocorre com a formação de dihidretos de rutênio.[110]
Figura 7. Formação de hidretos de rutênio na reação de hidrogênação.
Fonte: Clapham[110] (adaptada pelo autor).
Figura 8. Esquema catalítico generalizado para a hidrogenação de duplas polares.[110]
Fonte: Clapham.[110]
O ciclo começa com a adição de um substrato (1) que se coordena na espécie 5, fornecendo o complexo intermediário 6 (etapa I). A espécie hidreto 5 é usualmente formada a partir do precursor catalítico no começo da reação e muitas vezes não é possível isolar o mesmo. A migração do hidreto (etapa II) fornece uma nova espécie insaturada de rutênio 7, que pode aceitar uma molécula de hidrogênio (etapa III) para gerar 8. As etapas I e II são usualmente muito rápidas e apenas o produto 7 pode ser observado em alguns casos. A partir da espécie 8, podem-se seguir dois caminhos: Por um lado, a coordenação do substrato fornece o produto 2 permitindo a regeneração da espécie catalítica 5 (etapa IV). Por outro lado, o dihidrogênio coordenado pode se adicionar oxidativamente no centro de Ru(II) promovendo uma espécie dihidreto rutênio (etapa V), seguido pela eliminação do produto 2 e regeneração da espécie catalítica 5. É importante observar que é praticamente impossível experimentalmente distinguir entre o caminho IV e o caminho V – VI.[111]
Sendo estes uma espécie ativa na hidrogenação do estireno,[140] hidrogenação por transferência de hidrogênio da acetofenona[141] e hidrogenação de iminas.[142]
Complexos de rutênio contendo bifosfinas tornaram-se uma peça chave para reações de hidrogênação catalítica[142] e síntese de novos complexos precursores.[143,144] Assim complexos mono e dihidretos de rutênio contendo grupos fosfínicos, aminas, amidas e piridinas na esfera de coordenação, tais como [RuHCl(P-P)(N-N)], [145] [Ru(H)2
(P-P)(N-N)2],[146] [RuHCl(PPh3)2(bipy)][117] e [Ru(H)2(PPh3)2(bipy)][117] foram
desenvolvidos[116,117,145,146] e descritos como espécies inativas na hidrogenação de iminas e cetonas, mas que podem ser convertidos em complexos ativos através de uma reação com base forte e hidrogênio molecular.[116,117]
1.5. Sílica como Suporte
O estudo das propriedades de superfície de sólidos inorgânicos, principalmente dos que apresentam porosidade, tem aumentado consideravelmente. Tais estudos visam à modificação físico-química da superfície dos mesmos.[147-149] A sílica é um típico exemplo de polímero inorgânico formado por unidades tetraédricas SiO4, onde átomos
de silício internos tendem a manter sua coordenação tetraédrica com o oxigênio formando a ligação siloxano (Si-O-Si). Os átomos de silício mais externos completam seu número de coordenação através da ligação com grupos hidroxilas, formando os chamados grupos silanóis (Si-OH),[150] cuja estrutura está representada na Figura 9.
Figura 9. Esquema estrutural da sílica.[151]
Os grupos silanóis possuem uma desigual distribuição de densidade eletrônica, fazendo com que os mesmos manifestem um comportamento ácido, conhecido como ácido de Bronsted.[147,152] Os sítios ácidos são os responsáveis pelo controle da reatividade que ocorre na superfície da sílica. Na Figura 9 estão representados os centros ácidos que se distribuem aleatoriamente na superfície e dependendo da maneira como os grupos silanóis encontram-se dispostos, são denominados como:
- Vicinais (dois átomos de silício ligados a dois grupos hidroxilas). - Isolados (um átomo de silício ligado a apenas um grupo hidroxila). - Geminais (um único átomo de silício ligado a dois grupos hidroxilas).
A grande resistência a solventes orgânicos, alta estabilidade térmica e a utilização de sua estrutura como suporte para imobilização de uma variedade de agentes sililantes[153] são as principais vantagens dos suportes de sílica sobre os suportes
orgânicos. Além de se apresentarem susceptíveis a síntese, modulação e modificação, sendo, portanto, alvos de inúmeras pesquisas voltadas para aplicação desses materiais em áreas como catálise, sensores, adsorventes, óptica, eletrônica, membranas, camadas protetoras, cromatografia e aplicações biológicas (imobilização, reconhecimento, liberação de drogas, encapsulamento de microorganismos).[149,154-157]
2. OBJETIVOS E JUSTIFICATIVA
O desenvolvimento de catalisadores eficientes e seletivos tem sido um dos principais objetivos da química moderna. A fim de garantir uma sociedade sustentável, novos métodos de preparação de catalisadores têm sido propostos. Nesse sentido, a inserção deliberada de bases de Lewis com propriedades estéricas e eletrônicas específicas na esfera de coordenação de metais de transição permite a formação de compostos de coordenação cujo desempenho catalítico pode ser controlado, ainda que a reatividade esteja centrada no centro metálico e os ligantes atuem como meros espectadores. Em outra perspectiva, bases de Lewis reativas que podem atuar de forma mais proeminente nas etapas elementares de um ciclo catalítico são coordenadas à metais de transição. Nesta abordagem, o centro metálico e o ligante contribuem de forma sinérgica facilitando o processo como um todo. É neste contexto que os chamados ligantes não-inocentes, ou seja, espécies redox ativas, oferecem grandes vantagens no desenvolvimento de novos catalisadores. Compostos de coordenação contendo o átomo de rutênio como centro metálico têm sido provavelmente, um dos sistemas mais estudados na busca de complexos que possam substituir catalisadores a base de ródio ou irídio devido, majoritariamente, ao elevado custo destes metais, pois sais de tricloreto de ródio (RhCl3) e tricloreto de irídio (IrCl3) tem o custo ~ 15 vezes
maior que sais de tricloreto de rutênio (RuCl3). Dessa forma, compreender a interação
entre compostos de rutênio que contêm grupos fosfínicos com ligantes o-fenilênicos, particularmente em complexos, que apresentam efeitos sinergéticos em relação à atividades catalíticas, é altamente relevante do ponto de vista tecnológico e acadêmico. Neste sentido, propõe-se o estudo de complexos contendo fosfinas mono ou bidentadas e ligantes o-fenilênicos na esfera de coordenação do átomo de rutênio.
O objetivo central deste projeto consiste em estudar compostos formados a partir
da reação entre ligantes o-fenilênicos (Figura 10) e os complexos mer-[RuIIICl3(dppb)(H2O)], [RuIICl2(PPh3)3], [RuIICl2(dppb)(PPh3)] e
[RuIICl2(binap)(PPh3)], onde PPh3 = trifenilfosfina, dppb =1,4-bis(difenilfosfina)butano
Adicionalmente, propõe-se a incorporação do complexo contendo o ligante
γ,γ’,4,4’-tetraaminabifenil (tab) em partículas mesoporosas de sílica a fim de produzir catalisadores heterogêneos.
Figura 10. Ligantes o-fenilênicos que foram utilizados no desenvolvimento deste trabalho.
Figura 11. Estrutura dos complexos mer-[RuIIICl3(dppb)(H2O)], [RuIICl2(PPh3) 3], [RuIICl2(dppb)(PPh3)], [RuIICl
2(binap)(PPh3)] e dos ligantes fosfínicos pph3, dppb e binap. Os ligantes dppb e binap serão representados neste texto nas cores preta e azul, respectivamente.
Fonte: Elaborada pelo autor.
Especificamente, os objetivos desse trabalho foram divididos nas seguintes etapas.
1. Síntese e caracterização de complexos de rutênio com ligantes fosfínicos e o-fenilênicos, utilizando como precursores os complexos [RuIICl2(PPh3)3],[163]
[RuIICl
2(dppb)(PPh3)][164] e [RuIICl2(binap)(PPh3)].
2. Síntese e caracterização de complexos de rutênio com ligantes fosfínicos, o-fenilênicos e N-heterocíclicos na esfera de coordenação, que foram sintetizados pelo Grupo de Bioinorgânica para fins diversos, mas cuja análise da atividade catalítica dos mesmos ainda não havia sido realizada.
3. Avaliar a possibilidade de aplicação dos complexos sintetizados como catalisadores homogêneos. Assim como quantificar a atividade catalítica frente à reação de hidrogenação da molécula de acetofenona (substrato) de todos os complexos sintetizados nesse trabalho, além de alguns complexos sintetizados anteriormente no Grupo de Bioinorgânica e reportados na literatura, tais como: trans-[RuIICl2(dppb)(adrenalinaq)],[165] cis-[RuIICl2(dppb)(aminofenolq)],[165]
trans-[RuIICl2(dppb)(Dopq)],[165] trans-[RuIICl2(dppb)(Quinone)],[165]
trans-[RuIICl2(dppb)(Naphtq)],[165] cis-[RuIICl2(dppb)(opdaq)],[83] cis-[RuIICl2
(dppb)(opda-Clq)],[166] trans-[RuIICl2(dppb)(tabcat,cat)],[166] trans-[RuIICl2(dppb)(tabq,cat)],[166]
cis-[RuIICl2(dppb)(tabq,cat)],[166] trans-[RuIICl2(dppb)(bzditiolcat)][167] e
trans-[RuIICl2(dppb)(fenantq)].[167]
4. Realizar a imobilização do complexo cis-[RuIICl2(dppb)(tabq,cat)][166] em uma matriz
de sílica clorado. A fim de, avaliar o rendimento catalítico frente à catálise heterogênea para a reação de hidrogenação da molécula de acetofenona. Assim como avaliar o rendimento catalítico do íon complexo [RuCl(bpy)2(ISN)]+ imobilizado em matriz de
3. PARTE EXPERIMENTAL
3.1. Reagentes e Soluções
Argônio
Argônio de procedência White Martins foi utilizado para a obtenção de atmosfera inerte durante os procedimentos de síntese e análise por técnicas eletroquímicas. Traços de oxigênio foram eliminados da presença do gás pela passagem do mesmo, por um sistema de colunas contendo: o catalisador BTS-R-11.9 (Fluka Chemika) ativado na presença de hidrogênio a 60 °C, sílica gel e cloreto de cálcio.
Solventes Orgânicos
Foram empregados os seguintes solventes: diclorometano (99,5%), éter etílico (99,0%) e hexano (95,0%), procedentes da Synth, os quais foram purificados seguindo-se métodos descritos na literatura.[168] Metanol e etanol procedente da Merck e isopropanol procedente da J. T. Baker foram utilizados sem prévia purificação.
Soluções de Limpeza
Soluções aquosas de K2MnO4/KOH 10:1 e H2SO4/H2O2 4:1 em meio básico e
ácido, respectivamente, foram empregadas na limpeza das vidrarias, principalmente,
para se evitar contaminação com material orgânico. Solução “piranha”
(3H2O2:1H2SO4), extremamente oxidante, foi utilizada na limpeza dos eletrodos
metálicos nos experimentos eletroquímicos. Cuidados devem ser tomados na manipulação e armazenamento desta solução, pois a mesma é corrosiva.
Reagentes
Os ligantes o-fenilenodiamina (opdacat), 4-cloro-1,2-fenilenodiamina
(opda-Clcat), 1,2-dihidroxifenol (catecol), adrenalina (adrenalinacat), o-aminofenol
(o-aminofenolcat), dopamina (dop), naftalenodiol, γ,γ’,4,4’-tetraaminobifenil (tabcat,cat),
benzenoditiol (bzditiolcat), 9,10-fenantrequinona (fenantq), trifenilfosfina (PPh3) e
de 1-feniletanol (99,0%) e 2-feniletanol (99,0%), de procedência Adrich e acetofenona (99%) de procedência Acros Organics. O composto RuCl3.3(H2O), de procedência
Aldrich, foi utilizado nas sínteses dos precursores.
Esferas de Sílica
Utilizou-se os reagentes tetraetilortosilicato (TEOS) (99%), 3-aminopropiltrietoxissilano (APTS, 98%) de procedência Aldrich, quitosana (grau de desacetilação: 86%; MM: 480000g/mol) e sílica pirogênica AEROSIL® R 9200. As soluções de ácido acético 2,5 % v/v e hidróxido de amônio (NH4OH) 15% e etanol
Merck 99 %.
3.2. Síntese dos Precursores
Os complexos precursores [RuIICl
2(PPh3)3],[163] [RuIICl2(dppb)(PPh3)],[164] e
mer-[RuIIICl3(dppb)(H2O)][169] foram preparados de acordo com procedimento descrito
na literatura. O complexo precursor [RuIICl2(binap)(PPh3)], inédito na literatura, foi
sintetizado a partir do procedimento de complexos similares.[164]
3.3. Instrumentação e Técnicas Experimentais
3.3.1. Ressonância Magnética Nuclear (RMN) de 31P{1H}
Os experimentos de ressonância magnética nuclear foram obtidos a fim de determinar as estruturas dos completos sintetizados. Algumas amostras foram analisadas em um espectrômetro BRUKER DRX 500, a 500 MHz. Na obtenção dos espectros de fósforo utilizou-se clorofórmio deuterado (CDCl3) como solvente. Os
deslocamentos químicos foram determinados em relação ao composto H3PO4 (85%,
Algumas amostras foram analisadas em um espectrômetro EFT-60, Varian Anaspect, a 60 MHz. Na obtenção dos espectros de fósforo utilizou-se clorofórmio deuterado (CDCl3) como solvente.
3.3.2. Difração de raios X[170-175]
Para estas medidas utilizou-se um difratômetro com monocromador de grafite ENRAF-NONIUS KAPPA-CCD utilizando radiação da linha K do molibdênio (0,71073 Å). Para o cristal, as dimensões da célula unitária e a orientação do sistema cristalino em relação à cabeça goniométrica, foram determinadas a partir das reflexões medidas.[170-174] As estruturas foram resolvidas pelo Grupo de Cristalografia do Instituto de Física da Universidade de São Paulo, Campus de São Carlos. Os principais parâmetros cristalográficos encontram-se na Tabela 1.
A coleta de dados foi realizada usando o programa COLLECT.[171] A integração e escala das reflexões foram efetuadas com o sistema de programas HKL Denzo – Scalepack[172]. As correções de absorção foram efetuadas usando-se o método “multi
Tabela 1. Dados cristalográficos, parâmetros de raio X e resultados de refinamento da estrutura do complexo trans-[RuIICl2(dppb)(opda-Clcat)].[170-174]
Fórmula empírica C34.50H36Cl4N2P2Ru
Fórmula química [Ru(C34.50H36Cl4N2P2)]
Massa molar 783.46
Temperatura 296 (2) K
Comprimento 0.71073 Å
Sistema cristalino Monoclínico
Grupo espacial P2(1)/n
Unidade e dimensões da célula unitária a = 17.5158(5) Å α = 90°
b = 10.7953(4) Å = 101.01β(β)° c = 19.5295(7) Å = 90°
Volume 3624.8(2) Å3
Célula Unitária, Z 4
Densidade (calculada) 1.436 Mg/m3 Coeficiente de absorção 0.842 mm-1
F(000) 1596
Dimensões do cristal 0.422 x 0.218 x 0.106 mm3 Limites de para col. de dados 1.74 a 25.34°
Razão de h, k, l -20 h 18, -12 k 10, -23 l 20
Reflexões coletadas 22729
Reflexões independentes 6538 [R(int) = 0.0304] Correlação de absorção[154] Gaussian
Método de refinamento Full-matrix least-squares on F[171]
Computação COLLECT[171], HKL Denzo and Scalepack[172] SHELXS-97[173], SHELXL-97[175]
3.3.3. Analise Elememtar
A determinação dos teores percentuais de carbono (C), hidrogênio (H) e nitrogênio (N) foram realizadas em um analisador CHN EA 1108 da FISONS, no laboratório de microanálise do Departamento de Química da Universidade Federal de São Carlos (UFSCar) e no analisador CNH 2400 da Perkin-Elmer da Central Analítica do Instituto de Química na Universidade de São Paulo (USP).
3.3.4. Espectroscopia Eletrônica nas Regiões do Ultravioleta e Visível
Os espectros eletrônicos dos complexos sintetizados foram obtidos a fim de se
atribuir a capacidade de interação “-back-bonding” dos complexos, através da análise das bandas de transferência de carga. Os espectros foram obtidos em um espectrofotômetro Hewlett-Packard, modelo 8453 Diode-Array.
As amostras foram analisadas em soluções de diclorometano utilizando célula de quartzo retangular de caminho óptico de 1,0 cm. As medidas das absorvâncias foram efetuadas pela leitura direta dos espectros, usando-se como branco o respectivo solvente.
3.3.5. Espectroscopia Vibracional na Região do Infravermelho
3.3.6. Cromatografia Gasosa Acoplada a um Espectrômetro de Massa (CGMS)
As análises cromatográficas foram realizadas em um equipamento Shimadzu, modelo CGMS-QP2010 acoplado a uma interfase gráfica, software Shimadzu GC-MS-Glass. Foi utilizada uma coluna capilar de fase apolar (DB5) composta de 5% fenil e 95% dimetilpolisiloxano de procedência Supelco, com injeção direta das amostras solubilizadas em isopropanol (faixa de concentração: 7,56 x 10-5 - 8,60 x 10-3 mol L-1).
3.4. Síntese de complexos do tipo [RuIICl
2(dppb)(X)][17,20,83,87,148,155,165-167,176-178]
Os complexos trans-[RuIICl2(dppb)(adrenalinaq)],[165]
cis-[RuIICl2(dppb)(aminofenolq)],[165] trans-[RuIICl2(dppb)(Dopq)],[165]
trans-[RuIICl
2(dppb)(Quinone)],[165] trans-[RuIICl2(dppb)(Naphtq)],[165]
cis-[RuIICl2(dppb)(opdaq)],[83] foram sintetizados de acordo com procedimentos descritos na
literatura.[83,165] A síntese e caracterização dos mesmos encontram-se descritas no Anexo A, para título de comparação.
Os complexos cis-[RuIICl2(dppb)(opda-Clq)],[166]
trans-[RuIICl2(dppb)(tabcat,cat)],[166] trans-[RuIICl2(dppb)(tabq,cat)],[166]
cis-[RuIICl2(dppb)(tabq,cat)],[166] trans-[RuIICl2(dppb)(bzditiolcat)][167] e
trans-[RuIICl2(dppb)(fenantq)][167] foram sintetizados e devidamente caracterizações por mim
durante a realização do curso de mestrado,[167] sendo que tais procedimentos de síntese e as respectivas caracterização desses complexos já encontram-se publicados e descritas no Anexo B.
Os complexos cis-[RuIICl2(dppb)(tabq,cat)][166] e [RuCl(bpy)2(ISN)](PF6)[155]
foram imobilizados em uma matriz de sílica clorada e em matriz de sílica modificada com 3-aminopropiltrietoxisilano (APTS),[155] respectivamente. Os sistema Si-APTS-ISN-[RuCl(bpy)2(ISN)]+[155] e Si-cis-[RuIICl2(dppb)(tabq,cat)] foram sintetizados de
acordo com procedimentos descritos na literatura[155,147,151] com alterações das condições reacionais descitas nos itens 3.5.2 e 3.5.3.
para a síntese dos complexos, sendo o complexo [RuIICl2(binap)(PPh3)](1) utilizado
como precursor para a síntese dos complexos trans-[RuIICl
2(binap)(opda-Clcat)](2) e
trans-[RuIICl2(binap)(fenantq)](3). O complexo precursor [RuIICl2(dppb)(PPh3)][164] foi
utilizado para a síntese do complexo trans-[RuIICl2(dppb)(opda-Clcat)](4) e o complexo
precursor [RuIICl
2(PPh3)3][163] para as sínteses dos complexos
trans-[RuIICl2(PPh3)2(opdaq)](5) e trans-[RuIICl2(PPh3)2(fenatq)](6).
3.4.1. Síntese do Complexo [RuIICl2(binap)(PPh3)](1)
0,4704 mmol (497,20 mg) do complexo [RuIICl2(PPh3)3]foram dissolvidos em
hexano previamente deaerado. Após a completa dissolução, adicionou-se ao meio reacional um excesso do ligante binap(1,051 mmol; 653,60 mg). A mistura reacional foi agitada por 6 horas na presença de luz, sob atmosfera de argônio e refluxo. Em seguida, a solução foi concentrada por rotoevaporação com a redução do volume a aproximadamente 1mL para promover a precipitação. O sólido resultante foi coletado, lavado com hexano quente e seco em dessecador sob pressão reduzida. O material isolado apresentou um rendimento de 72%. A estrutura proposta para o complexo sintetizado encontra-se ilustrada na Figura 12.
Figura 12. Estrutura do complexo [RuIICl2(binap)(PPh3)].
P Ru P
P Cl
Cl
3.4.2. Síntese do Complexo trans-[RuIICl2(binap)(opda-Clcat)](2)
0,0946 mmol (99,99 mg) do complexo [RuIICl2(binap)(PPh3)] foram dissolvidos
em diclorometano previamente deaerado. Após a completa dissolução adicionou-se ao meio reacional uma quantidade equimolar do ligante opda-Clcat (13,49 mg). A reação
permaneceu sob vigorosa agitação na presença de argônio e temperatura ambiente por 1 hora e 30 minutos.Em seguida, foi concentrada por rotoevaporação a aproximadamente 1 mL. Para promover a precipitação, adicionou-se éter etílico gelado. O sólido resultante foi coletado, lavado com éter etílico e seco em dessecador sob pressão reduzida. O material isolado apresentou um rendimento de 81%. A estrutura proposta para o complexo sintetizado encontra-se ilustrada na Figura 13.
Figura 13. Estrutura do complexo trans-[RuIICl2(binap)(opda-Clcat)].
Ru P
P Cl
Cl
NH2
NH2 Cl
Fonte: Elaborada pelo autor.
3.4.3. Síntese do complexo trans-[RuIICl2(binap)(fenantq)](3)
0,0984 mmol (104,00 mg) do complexo [RuIICl2(binap)(PPh3)] foram
dissolvidos em diclorometano previamente deaerado. Após a completa dissolução adicionou-se ao meio reacional uma quantidade equimolar do ligante fenantq (20,47
O sólido resultante foi coletado, lavado com éter etílico e seco em dessecador sob pressão reduzida. O material isolado apresentou um rendimento de 73%. A estrutura proposta para o complexo sintetizado encontra-se ilustrada na Figura 14.
Figura 14. Estruturado do complexo trans-[RuIICl2(binap)(fenantq)].
O
O Ru P P
Cl
Cl
Fonte: Elaborada pelo autor.
3.4.4. Síntese do complexo trans-[RuIICl2(dppb)(opda-Clcat)](4)
0,122 mmol (105,02 mg) do complexo [RuIICl2(dppb)(PPh3)] foram dissolvidos
em diclorometano previamente deaerado. Após a completa dissolução adicionou-se ao meio reacional uma quantidade equimolar do ligante opda-Clcat (17,39 mg). A reação
Figura 15. Estrutura do complexo trans-[RuIICl2(dppb)(opda-Clcat)].
Ru P
P
Cl
Cl
NH2
NH2 Cl
Fonte: Elaborada pelo autor.
3.4.5. Síntese do complexo trans-[RuIICl2(PPh3)2(opdaq)](5)
0,112 mmol (107,75 mg) do complexo [RuIICl2(PPh3)3] foram dissolvidos em
Figura 16. Estrutura do complexo trans-[RuIICl2(PPh3)2(opdaq)].
Fonte: Elaborada pelo autor.
3.4.6. Síntese do complexo trans-[RuIICl2(PPh3)2(fenatq)](6)
0,113 mmol (108,20 mg) do complexo [RuIICl2(PPh3)3] foram dissolvidos em
metanol e mantido sob refluxo até completa dissolução. Após a completa dissolução adicionou-se ao meio reacional uma quantidade equimolar do ligante fenantq (23,52 mg). A reação permaneceu sob vigorosa agitação na presença de luz e refluxo (85°C) por 6 horas. Em seguida, foi concentrada por rotoevaporação a aproximadamente 1 mL. Para promover a precipitação, adicionou-se éter etílico gelado. O sólido resultante foi coletado, lavado com éter etílico, hexano quente e seco em dessecador sob pressão reduzida. O material isolado apresentou um rendimento de 73%. A estrutura proposta para o complexo sintetizado encontra-se ilustrada na Figura 17.
Figura 17. Estrutura do complexo trans-[RuIICl2(PPh3)2(fenantq)].
Fonte: Elaborada pelo autor.
Ru P
P
Cl
Cl
II O
Ph3

![Figura 8. Esquema catalítico generalizado para a hidrogenação de duplas polares. [110]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15347622.561277/35.893.124.772.143.603/figura-esquema-catalítico-generalizado-para-hidrogenação-duplas-polares.webp)
![Figura 15. Estrutura do complexo trans-[Ru II Cl 2 (dppb)(opda-Cl cat )]. RuP P Cl Cl NH 2NH 2 Cl](https://thumb-eu.123doks.com/thumbv2/123dok_br/15347622.561277/51.893.291.641.129.393/figura-estrutura-complexo-trans-ru-dppb-opda-rup.webp)


 / trans-[Ru II Cl 2 (dppb)(opda q )] [83] e trans-[Ru II Cl 2 (binap)(opda-Cl cat )](2) / trans-[Ru II Cl 2 (dppb)(o](https://thumb-eu.123doks.com/thumbv2/123dok_br/15347622.561277/77.893.107.792.201.713/figura-efeito-ângulo-sobre-deslocamento-químico-pares-complexos.webp)