ELIANE DOS SANTOS PEREIRA
“EXPRESSÃO GÊNICA DE Streptococcus mutans EM
BIOFILMES PRODUZIDOS in vitro SUBMETIDOS À
TERAPIA FOTODINÂMICA ANTIMICROBIANA”
SOBRAL - CE
2011
UNIVERSIDADE FEDERAL DO CEARÁ
CURSO DE MEDICINA- CAMPUS SOBRAL
“EXPRESSÃO GÊNICA DE Streptococcus mutans EM
BIOFILMES PRODUZIDOS in vitro SUBMETIDOS À
TERAPIA FOTODINÂMICA ANTIMICROBIANA”
Dissertação submetida ao Programa de Pós-graduação em Biotecnologia da Universidade Federal do Ceará como requisito parcial para obtenção do título de Mestre em Biotecnologia.
Orientadora: Profa. Dra. Iriana Carla Junqueira Zanin
SOBRAL-CE
P49e Pereira, Eliane dos Santos
Expressão gênica de Streptococcus Mutans em biofilmes produzidos in vitro submetidos à terapia fotodinâmica antimicrobiana. / Eliane dos Santos Pereira. - Sobral (CE), 2011
70p.: il.; 31 cm.
Dissertação (Mestrado) – Universidade Federal do Ceará. Programa de Pós-graduação em Biotecnologia, Sobral (CE), 2011.
Orientação: Profa. Dra. Iriana Carla Junqueira Zanin.
1- CÁRIE DENTÁRIA - TERAPIA. 2- FOTOQUIMIOTERAPIA. 3- BIOFILMES. 4- LASERS SEMICONDUTORES – USO TERAPÊUTICO. 5- STREPTOCOCCUS MUTANS. I- Zanin, Iriana Carla Junqueira (Orient.). II - Universidade Federal do Ceará. Programa de Pós-graduação em Biotecnologia. III - Título.
“ EXPRESSÃO GÊNICA DE Streptococcus mutans EM
BIOFILMES PRODUZIDOS in vitro SUBMETIDOS À
TERAPIA FOTODINÂMICA ANTIMICROBIANA”
Dissertação submetida ao Programa de Pós-graduação em Biotecnologia da Universidade Federal do Ceará como requisito parcial para obtenção do grau de Mestre em Biotecnologia.
Aprovado em: ______/______/______
BANCA EXAMINADORA
________________________________________________________
Profa. Dra. Iriana Carla Junqueira Zanin (Orientadora) Universidade Federal do Ceará - UFC
________________________________________________________
Profa. Dra. Lúcia Betânia da Silva Andrade Universidade Estadual Vale do Acaraú - UVA
________________________________________________________
À DEUS, por ter cuidado de cada passo que dei , das escolhas que fiz e pela vida que me foi dada.
Aos meus pais e irmãos pelo apoio incondicional.
A professora Iriana que me deu a oportunidade de entrar na carreira científica.
À Universidade Federal do Ceará na pessoa do seu Magnífico Reitor Prof. Dr. Jesualdo Pereira Farias.
À Faculdade de Medicina de Sobral, na pessoa de seu diretor Prof. Dr. Gerardo Cristino Filho.
Ao Programa de Pós-graduação em Biotecnologia, representado pelos professores e demais funcionários, pelo empenho na formação científica de seus pós-graduandos.
Ao Prof. Dr. Vicente de Paulo Teixeira Pinto, coordenador do programa de Pós-graduação, pela competente e exemplar função.
À professora Dra. Iriana Carla Junqueira Zanin que acreditou no meu potencial com seus ensinamentos, por suas palavras de apoio e amizade.
Ao Prof. Dr. Francisco César Barroso Barbosa pela preciosa colaboração, ensinamentos e estimada participação na banca examinadora.
À toda família NUBIS, especialmente Prof. Rodrigo Maranguape pela inestimável colaboração.
À Fauzer Deison Araújo, pela parceria e amizade, não medindo esforços pra me ajudar.
À Joseíres Lira de Sousa Fontenelle por sua disponibilidade em colaborar com o andamento da pesquisa.
Aos meus colegas de turma do Mestrado, pela amizade, companheirismo e boa convivência.
de me ajudar em todos os momentos da pesquisa.
Aos meus Amigos Emanuela de Lima Rebouças, e José Jackson do Nascimento Costa pela parceria e amizade e por compartilhar comigo momentos de angústia, alegria e dúvidas .
Aos meus amigos Fernanda Jovino Freitas, Pollyanna Thalia Ferreira e Emanuel Cunha Souza e Iramar Miranda por compartilhar comigo os momentos de angústia, alegrias e pelo apoio dado sempre que necessário.
A todos os funcionários da Faculdade de Medicina de Sobral em especial aos vigilantes que contribuíram para o desempenho da pesquisa.
A Coordenação de Aperfeiçoamento de pessoa de Nível Superior – CAPES, pelo apoio financeiro com a concessão da bolsa de estudos.
A Juliana Paiva Marques Lima, Rafael Nobrega Stipp e Renata de Oliveira Mattos-Graner que contribuíram para finalizar esta pesquisa.
A todos que contribuíram direta ou indiretamente para a concretização deste trabalho, a minha sincera gratidão.
“Se pude ver mais longe foi porque me apoiei em ombros de gigantes”
Os estágios iniciais da formação das lesões de cárie em humanos estão relacionados
diretamente com a presença de Streptococcus mutans no biofilme dental. O tratamento das
doenças ocasionadas por biofilmes orais envolve basicamente a remoção mecânica e o uso
de antibióticos e agentes anti-sépticos os quais podem originar cepas resistentes aos
antimicrobianos tradicionais. A Terapia Fotodinâmica Antimicrobiana (TFDA) apresenta-se
como uma opção alternativa ao tratamento clássico, promovendo a morte bacteriana por
meio da fotossenssibilização dos componentes microbianos. O objetivo dessa dissertação
foi avaliar o potencial antimicrobiano da TFDA e sua capacidade de alterar o padrão de expressão gênica de Streptococcus mutans em biofilmes orais produzidos in vitro utilizando para tanto um diodo emissor de luz (LED) associado ao fotossenssibilizador azul de orto-toluidina (TBO). Para tanto biofilmes de .S. mutans UA159, foram formados sobre discos de hidroxiapatita utilizando um modelo de banhos de cultura e submetidos a TFDA após 5 dias. O material coletado passou por um processo de disrrupção para a dispersão das células e diluição em série decimal, após o que foi plaqueado em meio de cultura e incubado em condições ideais de crescimento. Adicionalmente, e expressão dos genes de virulência gtfB, gtfC e gbpB de S. mutans foram avaliados após a extração do RNA total, síntese de cDNA e realização da técnica da reação da polimerase em cadeia em tempo real utilizando primers específicos. O gene ribossomal 16S foi utilizado com gene de referência.. Reduções significativas (p<0,05) foram observadas na viabilidade das colônias de S. mutans
quanto exposto ao TBO e LED. A expressão gênica de gtfC em biofilme de S. mutans foi significantemente reduzida após a realização da terapia fotodinâmica antimicrobiana enquanto a expressão de gtfB parece ter sido menos influenciada pela terapia. Não houve alterações na expressão de gbpB em função da terapia fotodinâmica antimicrobiana. Assim, outros estudos são necessários para avaliar ação da terapia fotodinâmica antimicrobiana em condições mais semelhantes daquelas encontradas no ambiente clínico, bem como para favorecer o entendimento de seus efeitos na expressão de importantes genes de virulência de S. mutans.
Palavras-chave: Biofilme oral. Streptococcus mutans. Terapia Fotodinâmica. Estudo In
The early stages of the formation of caries lesions in humans are directly related to the presence of Streptococcus mutans in biofilm. The treatment of diseases caused by oral biofilms basically involves mechanical removal and use of antibiotics and antiseptic agents which may lead to strains resistant to traditional antimicrobials. Antimicrobial Photodynamic Therapy (PACT) presents itself as an alternative option to conventional treatment, promoting bacterial killing by photosensitizing of microbial components. The objective of this study was to evaluate the antimicrobial potential of PACT and its ability to alter the pattern of gene expression of S. mutans in oral biofilms produced in vitro using both a LED light (LED) associated with the photosensitizer ortho-toluidine blue ( TBO). To this end, S. mutans UA159 biofilms were formed on hydroxyapatite discs using a model of bathing culture and were subjected to PACT after 5 days. The collected material has gone through sonication for dispersion and dilution of cells in decimal series. After that, material was plated in rich medium and incubated under optimum growth conditions. Additionally, expression of virulence gtfB, and gtfC gbpB genes of S. mutans were evaluated after extraction of total RNA, cDNA synthesis and realization of the technique of polymerase chain reaction in real time using specific primers. The 16S ribosomal gene was used as the reference gene. Significant reductions (p <0.05) were observed in the viability of colonies of S. mutans when exposed to TBO and LED at the same time. Gene expression of gtfC in S. mutans biofilm was significantly reduced after the completion of antimicrobial photodynamic therapy, whereas expression of gtfB seems to have been less influenced by therapy. No change in the expression of gbpB a function of antimicrobial photodynamic therapy was observed. Therefore, further studies are needed to evaluate the action of antimicrobial photodynamic therapy in conditions more like those found in the clinical environment and to encourage understanding of their effects on the expression of important virulence of S. mutans genes.
°C: grau Celsius.
10%CO²: pressão parcial de dióxido de carbono a 10% 16SRNA: gene codificador do RNA ribossômico 16S
Anm: absorbância no comprimento de onda especificado cDNAs: DNAs obtido a partir da transcrição reversa
DNA: ácido desoxirribonucléico genômico (de desoxy-ribonucleic-acid). et al.: e outros (de et alli)
F-L-: Sem corante e sem luz F-L+: Sem corante e com luz F+L-: Com corante e sem luz F+L+: Com corante e com luz
gbpB: gene codificador da proteína ligante de glucano B
GbpB: proteína ligante de glucano B.
Gbps: proteínas ligantes de glucano (de Glucan-binding proteins, deste trabalho). GtfB: proteína glucosiltransferase B.
gtfB: gene codificador da proteína glucosiltransferase B.
gtfC: gene codificador da proteína glucosiltransferase C.
GtfC: proteína glucosiltransferase C.
gtfs: genes glucosiltransferases (deste trabalho).
Gtfs: proteínas glucosiltransferases (deste trabalho). HA: hidroxiapatita
h: horas. µl: microlitro mL: mililitro
ORF: fases abertas de leitura (de Open Reading frame). pb: pares de base.
PCR: reação em cadeia da polimerase (de Polymerase Chain Reaction). Lenth Polymorphism).
RNA: ácido ribonucléico (de Ribonucleic Acid). S. mutans: Streptococcus mutans.
1 INTRODUÇÃO ...16
2 REVISÃO DE LITERATURA...20
2..1 Cárie dental...20
2.2 Biofilme dental...21
2.3 Streptococcus mutans...24
2.4 Fatores de virulência associado aos Streptococcus mutans...26
2.5 Glucosiltransferases...27
2.6 Proteínas ligantes de glucanos...29
2.7 Terapia Fotodinâmica Antimicrobiana...31
2.7.1 Mecanismo de ação...32
2.7.2 Fotossensibilizadores...33
2.7.3 As fontes de luz...34
3 OBJETIVO...35
4 METODOLOGIA...36
4.1 Delineamento experimental...36
4.2 Aspectos éticos...37
4.3 Fotossensilizador e fonte de luz...37
4.4 Preparo dos espécimes...38
4.5 Formação de biofilme in vitro...39
4.6 Terapia Fotodinâmica em biofilmes in vitro...39
4.7 Extração do RNA...41
4.8 Obtenção do cDNA...43
4.9 Reação em Cadeia da Polimerase em Tempo Real...43
5.1 Contagem microbiológica...45
5.2 Extração de RNA...46
5.3 Gene de referência...46
5.4 Comparação da expressão do gene gtfB...48
5.5 Comparação da expressão do gene gtfC...49
5.6 Comparação da expressão do gene gbpb...50
6 DISCUSSÃO...51
7 CONCLUSÕES...56
1 INTRODUÇÃO
Atualmente, cerca de 700 diferentes espécies de bactérias já foram detectadas na cavidade oral dos seres humanos e a grande parte delas encontra-se organizada na forma de biofilmes (AAS et al., 2005). Esses micro-organismos crescidos de forma planctônica ou organizados em biofilmes e associados a fatores de riscos sócio-comportamentais, ao meio-ambiente e a componentes genéticos do hospedeiro, podem, potencialmente, causar doenças bucais sendo a cárie dental e a doença periodontal, as mais comumente relatadas (SBORDONE; BORTOLAIA, 2003).
Os biofilmes bacterianos são formados quando micro-organismos unicelulares se tornam irreversivelmente aderidos a uma superfície sólida e envolvida por uma matriz de polissacarídeos extracelulares, podendo haver a formação de biofilmes a partir de uma ou múltiplas espécies bacterianas (SPRATT; PRATTEN, 2003). A diversidade anatômica existente na cavidade oral e a interdependência entre as suas estruturas tornam o desenvolvimento dos biofilmes particularmente interessante.
Apesar da complexidade da comunidade bacteriana que coloniza o biofilme dental, existem evidências consideráveis de que a presença de Streptococcus mutans esteja diretamente relacionada aos estágios iniciais da formação das lesões de cárie em humanos. Isso se dá devido à produção de ácidos e à capacidade de produzir polissacarídeos extracelulares. Assim, encontra-se estabelecido na comunidade científica o conceito de que o surgimento das duas doenças mais prevalentes na cavidade bucal dos humanos, a cárie dental (LOESCHE, 1986) e a doença periodontal (SOCRANSKY; HAFFAJEE, 1991), estejam intimamente relacionadas à presença dos biofilmes organizados sobre a superfície dos dentes (SBORDONE; BORTOLAIA, 2003).
A cárie dentária é uma patologia crônica caracterizada pela destruição localizada e progressiva dos tecidos duros do dente e está intimamente associada com a microbiota residente do biofilme dental. Após a desmineralização do esmalte, a lesão pode progredir lentamente em direção à dentina, sendo inicialmente caracterizada por uma área de dentina amplamente desmineralizada localizada sob uma zona parcialmente desmineralizada e infectada com bactérias (KIDD; JOYSTON-BECHAL, 2000).
partir da sacarose ingerida na dieta por enzimas extracelulares livres ou associadas à célula bacteriana, as glucosiltransferases (Gtfs). Três Gtfs - GtfB, GtfC e GtfD - foram identificadas em S. mutans, as quais são codificadas pelos genes gtfB, gtfC e gtfD, respectivamente. A GtfB catalisa principalmente a síntese de polímeros insolúveis em água; a GtfC a síntese de glucanos solúveis e insolúveis em água enquanto GtfD, a síntese de glucanos solúveis em água. Apesar deste papel fundamental das Gtfs na virulência de S. mutans, há pouca informação sobre os fatores que regulam a expressão dos genes codificadores dessas enzimas (STIPP, 2006). Não se sabe ainda se a expressão de gtfB e gtfC é policistrônica, se estes genes são coordenadamente expressos ou se são expressos monocistronicamente. Diferentes grupos de pesquisa apresentam resultados divergentes (FUJIWARA et al. 2002; YOSHIDA; KURAMITSU, 2002), enquanto que um promotor de gtfC foi caracterizado experimentalmente através de fusos de transcrição em plasmídeos (GOODMAN; GAO, 2000).
Alguns estudos realizados em S. mutans e outras espécies do gênero Streptococcus têm sugerido a ação de sistemas regulatórios de dois componentes na
regulação de genes envolvidos no crescimento em biofilmes e virulência (QI et al., 2004; SENADHEERA et al., 2005). E outros estudos abordam relações entre tais sistemas e expressão de gtfB, gtfC e gbpB em diferentes genótipos clínicos (STIPP, 2006).
Devido à participação dos S. mutans na etiologia da cárie dental, grande importância tem sido dada ao estudo desses micro-organismos (ARTHUR et al, 2007). Trabalhos indicam que a expressão de genes por enzimas sintetizadas a partir de matriz exopolissacarídica de S. mutans depende diretamente das condições ambientais locais, incluindo tipo e quantidade de nutriente, pH, fonte de carbono e nível de adesão dos micro-organismos à superfície além da idade e espessura dos biofilmes (BURNE, 1998; LI; BURNE, 2001; BURNE, 2004).
intensidade, na presença do corante hidrocloreto de acridina (RAYMOND, 1999). Apesar dos resultados positivos, a utilização da TFDA para obtenção de efeito antimicrobiano caiu em desuso devido ao surgimento dos antibióticos e à popularização da penicilina e sulfonamidas (MAISCH et al., 2005) e só voltou a ser estudada nos últimos anos.
O uso combinado de uma substância fotossensibilizadora (SF) e uma fonte de luz, tem se tornado uma alternativa aos tratamentos convencionais no combate aos micro-organismos bucais em uma técnica conhecida como Terapia Fotodinâmica Antimicrobiana (BEVILACQUA et al., 2007). Durante esse processo, componentes celulares fotossensíveis passam para um estado excitado quando expostos a uma luz de comprimento de onda complementar que é caracterizado pela passagem dos elétrons para níveis de energia superiores. Neste estado excitado, o fotossensibilizador pode interagir com o oxigênio molecular iniciando a formação de oxigênio singleto altamente reativo (fotoprocesso Tipo II) ou interagir com outras moléculas como aceptores de elétrons resultando na produção de hidroxilas e outros radicais orgânicos (fotoprocesso do Tipo I) (MACROBERT et al., 1989; DOUGHERTY et al., 1998). Os produtos dessas reações fotoquímicas podem, então, danificar componentes essenciais das células ou alterar as atividades metabólicas de maneira irreversível resultando na morte bacteriana (MALIK et al., 1990).
Como a maioria das espécies bacterianas não apresenta componentes fotossensíveis, a utilização de um agente cromóforo que atraia para si a luz e inicie a formação de radicais livres é importante para a efetividade da terapia fotodinâmica (WILSON et al., 1992). Assim, células desprovidas de componentes fotossensíveis endógenos podem se tornar sensíveis à luz ao serem coradas com fotossensibilizadores exógenos como derivados das porfirinas, azul de orto-toluidina ou compostos de cloro conjugado (WILSON, 1993; GAD et al., 2004).
que acabam por favorecer a obtenção de efeito antimicrobiano, uma vez que a luz é emitida em todo o espectro de absorção dos fotossensibilizadores durante a realização da terapia fotodinâmica.
Entre as vantagens da terapia fotodinâmica em relação ao uso dos agentes antimicrobianos tradicionais, ressalta-se, primeiramente, que a morte da célula bacteriana pode ser rápida, não sendo necessária a manutenção do agente químico em altas concentrações sobre as lesões por longos períodos de tempo como ocorre com os agentes anti-sépticos e antibióticos. Além disso, a morte celular mediada pela liberação de radicais livres torna o desenvolvimento de resistência pelos microrganismos improvável. Finalmente, o uso do fotossensibilizador ou da luz sozinhos não apresentam efeito significativo sobre a viabilidade das bactérias, de modo que a terapia pode ser confinada à área da lesão pela aplicação tópica cuidadosa do corante e restrição da irradiação por meio do uso de fibra ótica (WILSON, 2004).
A ação antimicrobiana de lasers diodos ou LEDs associados a fotossensibilizadores específicos sobre bactérias crescidas em caldo de cultura está bem documentada na literatura (DOBSON; WILSON, 1992; BURNS et al., 1994; ZANIN et al., 2002; WILLIAMS et al., 2003). Da mesma forma, o efeito antimicrobiano dessa
terapia sobre biofilmes bacterianos já foi estabelecido (WILSON et al., 1996; WOOD et al., 1999; O’NEILL et al., 2002; SOUKOS et al., 2003; ZANIN et al., 2005, 2006). No
entanto, ainda não foi verificada a ocorrência ou não de alterações genotípicas bacterianas em função da utilização da terapia fotodinâmica. Assim, diante do exposto este trabalho teve por objetivo avaliar o padrão de expressão genética de Streptococcus mutans em biofilmes produzidos in vitro submetidos ou não à terapia fotodinâmica,
2 REVISÃO DE LITERATURA
2.1Cárie dental
A cárie dental é uma doença infecto-contagiosa, de caráter multifatorial e biofilme-dependente (SBORDONE; BORTOLAIA, 2003). É a manifestação clínica de um processo patológico de desmineralização que ocorre na superfície dental por meses ou anos, a partir da interação entre bactérias orais e constituintes da dieta, com a superfície do dente (BOWEN, 2002). Esse processo é resultante de um desequilíbrio na microbiota residente que resulta na proliferação de bactérias acidúricas e acidogênicas favorecendo, assim, a desmineralização dental em detrimento da remineralização (MARSH, 1994; 2003).
O processo carioso tem sido intensivamente estudado (HAMADA; SLADE, 1980; LOESCHE, 1986; BOWEN, 2002), sendo caracterizado primariamente como uma desmineralização do tecido dentário mais externo provocado por ácidos, em especial o ácido láctico, produzido através da fermentação de carboidratos por micro-organismos presentes no biofilme bacteriano que se forma na superfície dos dentes (MARSH,2004).
1969; KÖNIG et al., 1968; HEFTI; SCHMID, 1979), estudos in situ (CURY et al., 1997; DUGGAL et al., 2001; PAES LEME et al., 2004) e in vivo (GUSTAFSSON et al.,1954; ARCELLA et al., 2002).
A saliva é um outro fator que tem influência no desenvolvimento da lesão da cárie em humanos (WEYNE, 1992), destacando-se a velocidade de seu fluxo e os componentes salivares (KRASSE, 1988). A saliva secretada na cavidade bucal é uma mistura complexa de vários componentes como (água, íons e glicoproteínas), formada a partir de secreções das glândulas salivares, fluido gengival, células epiteliais descamadas, micro-organismos, leucócitos e resíduos alimentares, dentre outros componentes. Além disso os componentes antimicrobianos da saliva incluem imunoglobinas, lisozimas, lactoferrinas, peroxidases, amilases e proteínas aniônicas (VALDEVITE, 2007), sendo essenciais para manutenção da homeostase bucal.
Neste contexto, um fluxo salivar aumentado pode diminuir a concentração microbiana na cavidade bucal devido a sua alta capacidade de lavagem oral e a deficiência do mesmo pode resultar em uma maior concentração de bactérias na saliva (TENOVUO, 1998). Além disso, a saliva reveste a mucosa oral e a protege contra irritação, forma reservatório de íons para remineralização dentária, apresenta função de tamponamento do pH bucal, participa da formação da película adquirida que recobre o esmalte dental, realiza a digestão enzimática do amido e da sacarose promovendo ainda, as sensações gustativas por sua ação solvente. Por outro lado, seus componentes orgânicos, especialmente as glicoproteínas também funcionam como nutrientes para os micro-organismos bucais. Estima-se que a saliva possua em media 109 bactérias por mililitro e sabe-se que as proteínas salivares podem ser degradadas por proteases produzidas por diversos micro-organismos como S. mutans e S. sanguinis (BARBIERI, 2005).
2.2 Biofilme Dental
micro-organismos é inofensiva, algumas espécies são identificadas como agentes causadores de uma variedade de doenças dentro e fora da cavidade oral como a cárie e a doença periodontal (MEYER; FIVES-TAYLOR, 1998).
Os biofilmes bacterianos são formados quando micro-organismos unicelulares se tornam irreversivelmente aderidos a uma superfície sólida e envolvida por uma matriz de polissacarídeos extracelulares, podendo haver a formação de biofilmes a partir de uma ou múltiplas espécies bacterianas (SPRATT; PRATTEN, 2003). A diversidade anatômica existente na cavidade oral e a interdependência entre as suas estruturas tornam o desenvolvimento dos biofilmes particularmente interessante. Contrariamente ao que ocorre nas superfícies mucosas onde há uma constante descamação do epitélio e conseqüente renovação dos microrganismos aderidos; os dentes constituem superfícies duras favoráveis à formação e maturação do biofilme bacteriano tanto na região supragengival como na região subgengival (MARSH, 1994; MARCOTTE; LAVOIE, 1998). A placa dental é um biofilme bacteriano encontrado naturalmente na superfície dos dentes, apresentando composições bacteriana e bioquímica que podem variar em decorrência de fatores intrínsecos e extrínsecos ao hospedeiro (MARSH, 1992; KOLENBRANDER, 2000; WATNICK; KOLTER, 2000).
Com relação ao desenvolvimento dos biofilmes dentais temos que após a limpeza profissional da superfície dos dentes inicia-se a deposição de uma camada acelular denominada película adquirida (NYVAD, 1993). Os principais constituintes da película são componentes originários da saliva e do fluido gengival como proteínas, glicoproteínas e lipídios, além de componentes bacterianos como as glucosiltransferases (MARCOTTE; LAVOIE, 1998). A colonização bacteriana da película adquirida inicia-se poucas horas após a limpeza profissional, inicia-sendo os estreptococos (Streptococcus sanguinis, Streptococcus oralis e Streptococcus mitis) e em proporções menores
Neisseria e Actinomyces os micro-organismos pioneiros na colonização da película
aumento da diversidade microbiana até o estabelecimento de uma comunidade clímax como ilustrado na figura 1(PRATTEN, & WILSON, 1999).
Figura 1. Diagrama ilustrando os estágios envolvidos no desenvolvimento do biofilme dental a partir
de múltiplas espécies bacterianas. (a) colonizadores primários unicelulares “revestem” o substrato dental ligando-se a compostos de origem salivar e bacteriana como polissacarídeos e proteínas; (b) Células em crescimento e divisão iniciam a produção de polissacarídeos extracelulares (PEC) e o
desenvolvimento de microcolônias; (c) Coadesão de células de diferentes espécies formam uma comunidade jovem de múltiplas espécies no biofilme; (d) Maturação e formação de mosaicos clonais com múltiplas espécies no biofilme. (Adaptado de : RICKAR et al, 2003- Bacterial coaggregation : an integral process in the development of multi-species biofilms).
A análise química de amostras de biofilme dental recolhidas de seres humanos e animais revelou que aproximadamente 20% de sua massa seca é composto por carboidratos (HOTZ et al., 1972; BOWEN et al., 1977; CURY et al., 2000). As células bacterianas podem constituir 60% à 70% da massa do biofilme, o qual pode conter de 105 a 1011 micro-organismos por grama (ORTHE, 1993; RAMBERG et al., 2003; LI et al., 2003).
mastigação, contra os mecanismos de defesa inata e adquirida do hospedeiro bem como contra agentes agressores externos (BOWDEN, 1999). Além disso, os mecanismos de defesa dos microrganismos podem incluir a formação de uma barreira física constituída especialmente por polissacarídeos que pode dificultar a difusão dos agentes antimicrobianos no interior dos biofilmes, a transição para uma taxa de crescimento mais lento decorrente das limitações nutricionais no interior dos biofilmes, a ativação de mecanismos gerais de resposta ao estresse, bem como a expressão de fenótipos específicos para microrganismos organizados na forma de biofilmes (MAH; O’TOOLE, 2001).
Apesar da complexidade da comunidade bacteriana que coloniza o biofilme dental, existem evidências consideráveis de que a presença de Streptococcus mutans esteja diretamente relacionada aos estágios iniciais da formação das lesões de cárie em humanos. Isso se dá devido a sua presença em altos níveis imediatamente antes do surgimento das lesões, a sua habilidade em rapidamente degradar carboidratos fermentáveis promovendo a formação abundante de ácido, além da sua capacidade de tolerar ambientes com baixo pH (SVENSATER et al., 2001). Assim, encontra-se estabelecido na comunidade científica o conceito de que o surgimento de uma das doenças mais prevalentes na cavidade bucal de humanos, a cárie dental (LOESCHE, 1986) esteja intimamente relacionadas a presença dos biofilmes organizados sobre a superfície dos dentes (COSTERTON et al., 1999; SBORDONE; BORTOLAIA, 2003).
2.3 Streptococcus mutans
A literatura tem demostrado consistentemente que o grupo mutans de bactérias gram positivas, particularmente, o Streptococcus mutans, são os micro-organismos sempre presentes no biofilme dental cariogênico, desempenhando papel chave na patogênese da cárie em humanos (HAMADA et al., 1984; LOESCHE, 1986; LI; BURNE , 2001).
descreveram que essas bactérias são capazes de manter a produção de ácidos a partir da glicólise em ambientes com pH menor que 5,0. Essa habilidade em resistir à acidificação do meio está relacionada ao aumento na atividade da bomba translocadora de prótons localizada na membrana plasmática bacteriana.
Esse sistema, denominado FATPase, regula o pH intracelular bacteriano, pois bombeia os prótons, originados na fermentação dos carboidratos, para o meio extracelular, evitando, assim, a acidificação do pH intracelular (BENDER et al., 1986). A estabilidade do pH intracelular torna esses microrganismos capazes de suportar as condições ambientais adversas. Além disso, outros mecanismos de adaptação ao estresse ácido têm sido identificados em S. mutans, como indução de proteínas de estresse (JAYARAMAN et al., 1997; LEMOS et al., 2001) e modificações na composição da membrana celular (QUIVEY et al., 2000; FOZO; QUIVEY, 2004). Tais mecanismos de resistência tornam essas bactérias mais competitivas frente aos demais micro-organismos do biofilme dental durante períodos de acidificação do meio (MARSH, 2003). Outro fator que influência a colonização e acúmulo de S. mutans no biofilme dental é sua capacidade em sintetizar uma matriz extracelular de glucanos, principalmente os insolúveis em água a partir da sacarose (HAMADA et al., 1981). Embora a cavidade oral das crianças seja estéril durante a fase intra-uterina, a colonização inicia-se após o parto estabelecendo-se de maneira transitória nos primeiros meses de vida devido a descamação e consequente deglutição dos tecidos orais. O surgimento dos dentes nesse micro ambiente é um momento decisivo para o estabelecimento da microbiota permanente e nessa fase a criança parece estar mais susceptível a aquisição de micro-organismos de fontes externas.
Estudos usando métodos fenotípicos/genotípicos sugerem fortemente que a “mãe” é a principal fonte de infecção das crianças por Streptococcus mutans e Streptococcus sobrinus (KLEIN et al., 2004) e a saliva é o principal veículo de
2.4Fatores de virulência associado aos Streptococcus mutans
A virulência de uma bactéria consiste em propriedades que promovem ou favorecem sua entrada, colonização e crescimento no organismo do hospedeiro (VALDEVITE, 2007).
A capacidade de S. mutans em desenvolver uma lesão de cárie dentária depende da associação de vários fatores de virulência, incluindo (1) a composição de sua superfície celular (sorotipo), (2) a produção de bacteriocinas (mutacinas) (RODRIGUES et al., 2008), (3) aderência inicial à superfície dos dentes por meio de proteínas de adesão, (4) capacidade de sintetizar polissacarídeos extracelulares insolúveis, por meio de enzimas glucosiltransferases, o que promove o acúmulo e a permanência do micro-organismo na superfície dos dentes, (5) alta capacidade para catabolizar carboidratos e produzir ácidos que desmineralizam o esmalte dental, o que lhe dá o caráter acidogênico e, (6) habilidade para crescer e da continuidade a metabolização de carboidratos em baixo pH, o que lhe confere o caráter acidúrico (KURAMITSU, 1993; BURNE, 1998).
Devido à participação dos S. mutans na etiologia da cárie dental, grande importância tem sido dada ao estudo desse micro-organismo (ARTHUR et al, 2007). Alguns trabalhos têm demonstrado que na cavidade bucal existem diferentes genótipos de S. mutans, tanto na saliva quanto no biofilme dental, (SAARELA et al., 1993; SAARELA et al., 1996; KLEIN et al., 2004; LEMBO; MAYER, 2005). Características genéticas podem estar relacionadas a diferenças na virulência entre as cepas de S. mutans. A habilidade da bactéria em sobreviver e persistir na cavidade bucal irá
depender da sua plasticidade genética, que determina a sua capacidade pra responder às flutuações locais das condições ambientais ou de estresse (DOBRINDT; HACKER, 2001). A microbiota residente do biofilme dental está sujeita a variações, tais como, redução na disponibilidade de nutrientes e redução do pH, devido a exposição aos ácidos orgânicos (CARLSSON, 1989; NASCIMENTO et al., 2004).
2.5Glucosiltransferases
A síntese extracelular de glucano, durante o crescimento de S. mutans no biofilme dentário, ocorre pela ação de enzimas glucosiltransferases (Gtfs), as quais utilizam a sacarose como seu único substrato (GOODMAN; GAO, 2000). A matriz polissacarídea do biofilme dental, formada inicialmente pela ação desses glucanos, funciona ainda como uma forma de proteção frente as bruscas variações de pH do meio, atuando como uma barreira protetora (HOJO et al., 1976), e como reserva de nutrientes em períodos onde a disponibilidade de substratos é insuficiente (GIBBONS,1968).
Diferenças na síntese de glucanos insolúveis podem estar associada aos diferentes genótipos bacterianos e aos diferentes graus de virulência. A produção destes glucanos modifica as propriedades físico-químicas do biofilme dental, resultando em uma menor concentração de cálcio, fósforo e fluoreto (CURY et al., 1997), bem como, o aumento da porosidade da matriz do esmalte dental (ZERO et al., 1992) tornando o dente mais susceptível ao desenvolvimento da cárie dentária.
Três enzimas glucosiltransferases (GtfB, GtfC e GtfD) são codificadas respectivamente pelos genes gtfB, gtfC e gtfD, e suas atividades são distinguidas pelo tipo de ligação glucosídica predominante no glucano sintetizado (AOKI et al., 1986; HANADA; KURAMITSU, 1988). GtfB catalisa a síntese de glucanos ricos em ligações glucosídicas do tipo α-1-3 (AOKI et al., 1986), que resultam em polímeros insolúveis
em água. GtfD catalisa a formação de glucanos ricos em ligações glucosídicas α-1-6,
que resultam em moléculas solúveis em água (HANADA; KURAMITSU, 1988), enquanto que a GtfC está envolvida na síntese de glucanos solúveis e insolúveis em água (HANADA; KURAMITSU, 1988).
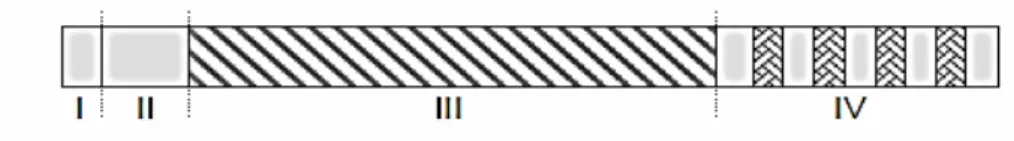
Figura 2 - Representação dos domínios presentes nas seqüências dos precursores das Gtfs de S. mutans: I) peptídeo sinal (42% de homologia entre GtfB, GtfC e GtfD); II) região variável de aproximadamente 200 aminoácidos, que é única a cada Gtf (função
desconhecida); III) região referente ao domínio catalítico de aproximadamente 800 aminoácidos (43% de homologia entre Gtfs); IV) região essencial para ligação de glucanos (domínio C-terminal) (89% de homologia entre as Gtfs). Adaptado de Colby e
Russell, 1997. Escala aproximada.
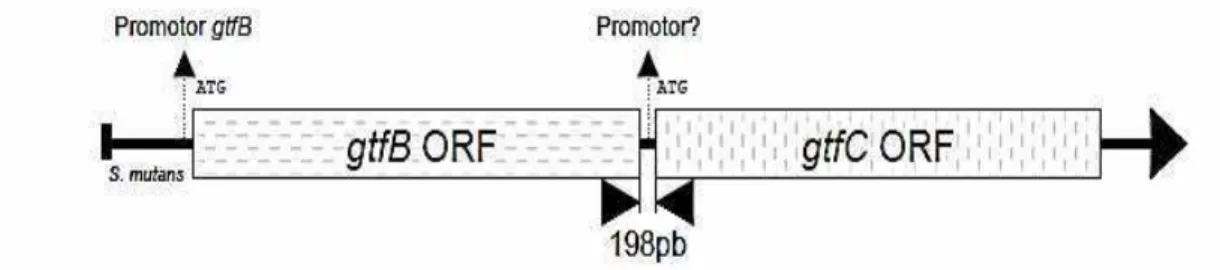
Os genes codificadores das Gtfs (gtfs) são altamente homólogos (GenBank GeneID: 1028336 gtfB; 1028343 gtfC; 1028270 gtfD). As seqüências de aminoácidos
das proteínas precursoras codificadas por estes genes compartilham 50% de identidade, sendo que as proteínas GtfB e GtfC apresentam 75% de homologia nas suas seqüências de aminoácidos (GOODMAN; GAO, 2000). As fases abertas de leitura (ORF) de GtfB e GtfC estão organizadas em um mesmo sentido, estando os genes gtfB e gtfC separados por apenas 198 pares de base no cromossomo do S. mutans (Figura 3). Não há um consenso sobre os promotores envolvidos na transcrição dos genes gtfB e gtfC. Alguns estudos sugerem que a expressão de gtfB e gtfC é policistrônica e que estes genes são coordenadamente expressos (HUDSON; CURTISS, 1990; WEXLER et al., 1993, YOSHIDA; KURAMITSU, 2002). Por outro lado, há dados que indicam que o gene gtfC apresenta um promotor independente (SMORAWINSKA; KURAMITSU, 1995;
Figura 3 - Representação esquemática da organização dos genes gtfB e gtfC no cromossomo de S.
mutans. A transcrição ocorre na fita superior do DNA, onde as fases abertas de leitura (ORFs)
encontram-se próximas e no mesmo sentido. Adaptado de Stipp, 2006.
Apesar deste papel fundamental das Gtfs na virulência de S. mutans, há pouca informação sobre os fatores que regulam a expressão dos genes codificadores dessas enzimas. A compreensão dos mecanismos moleculares envolvidos no estabelecimento da espécie S. mutans no biofilme dentário pode fornecer elementos importantes para o desenvolvimento de novas estratégias para controle de infecção por estes micro-organismos (STIPP, 2006).
2.6Proteínas ligantes de glucanos
As proteínas ligantes de glucano (Gbps de Glucan-binding proteins) compõem um grupo heterogêneo de proteínas extracelulares ou de superfície, que exibem afinidade a glucanos insolúveis em água em ensaios in vitro (STIPP, 2006). Quatro Gbps foram identificadas para a espécie S. mutans, GbpA, GbpB, GbpC e GbpD (SATO et al., 1997; SHAH, RUSSELL, 2004; SMITH et al., 1997). Estas proteínas podem ser secretadas ou associadas às superfícies celulares (GbpA, GbpB e GbpD) ou ligadas covalentemente à parede celular (GbpC) e apresentam diferentes afinidades a polissacarídeos (BANAS; VICKERMAN, 2003).
Pouco se sabe sobre a regulação das Gbps. Recentemente Yoshida et al. (2002) relataram que o rompimento do gene luxS em S. mutans atrapalha a formação de biofilme, talvez devido à maior auto-agregação. Os autores especulam que a expressão de Gtfs e Gbps pode ser regulada pela auto-indução-2 (AI-2) de uma molécula de sinalização para um sistema de “quorum sensing” que é mantida entre muitas espécies de bactérias gram-positivas e gram-negativas (SCHAUDER et al., 2001).
seqüências repetidas ricas em resíduos de tirosina (RUSSEL et al., 1979). A GbpB é composta de 431 a 432 aminoácidos, e não apresenta homologia com outras Gbps, embora apresente cerca de 70% de homologia com hidrolases de mureína (MATTOS-GRANER et al., 2001). A GbpC é um componente da parede celular de S. mutans, cuja expressão parece ser mais intensa em condições de estresse osmótico (SATO et al., 1997).
GbpB foi primeiramente purificada de sobrenadantes de cultura S. mutans; através de sua afinidade por dextrano (SMITH et al.,1994). Até o momento, esta proteína demonstrou ser produzida por todas as cepas de S. mutans testadas, mas as quantidades produzidas e a localização desta proteína parecem ser dependentes do background genético da cepa (MATTOS-GRANER et al., 2001). Entre os 44 genótipos
de S. mutans analisados, foi identificada uma relação positiva entre quantidade de GbpB detectada no sobrenadante de cultura e a formação de biofilme in vitro, através de ensaios de imuno dot-blot com anticorpo policlonal de rato (MATTOS-GRANER et al., 2001).
Inúmeras formas de elaboração de vacinas anticárie vêm sendo desenvolvidas com Gbps em ratos e macacos, através de imunizações sistêmicas, mucosas ou passivas. Embora várias proteínas ligantes de glucano (Gbps) tenham sido descritas (BANAS et al., 2003), somente a GbpB de S. mutans (SMITH et al., 1994) pareceu apresentar
2.7Terapia Fotodinâmica Antimicrobiana
Os primeiros relatos da terapia fotodinâmica ocorreram no inicio do século passado com os experimentos de Raab (1900), no qual é descrito a ação letal do corante acridina quando ativado pela luz de relâmpagos sobre paramécios (RAAB, 1900). Mais tarde, von Tappeiner relatou que esses efeitos tóxicos não se deviam apenas à presença da luz e criou o termo “reação fotodinâmica” (VON, 1904). Vinte anos depois, Policard publicou as primeiras observações clínicas a respeito dessa terapia (POLICARD, 1924). A aplicabilidade dessa técnica foi demonstrada em bactérias, vírus e protozoários bem antes da Segunda Guerra, mas foi abandonada devido à popularização das sulfonamidas e da penicilina (WAINWRIGHT, 1996). O retorno da aplicação antimicrobiana de fotossenssibiizador (FS) nas últimas décadas é resultado da busca de novas terapias antimicrobianas devido ao enorme crescimento de bactérias resistentes aos fármacos. A evolução microbiana tem sido mais veloz do que a capacidade do homem em desenvolver novas drogas e os surtos de resistência microbiana observados recentemente nos hospitais parece ser decorrente do princípio de sobrevivência dos mais adaptados. Assim, as bactérias patogênicas, que em pequena porcentagem são naturalmente resistentes a fármacos (tais como penicilinas), logo se tornam a população dominante.
No Brasil, os estudos em Terapia Fotodinâmica (TFD) começaram a ganhar espaço a partir de 1987 (KIM et al., 2003; ZEZELL, 1987; ZEZELL, 1991). Atualmente, a TFD já ocupa um espaço relativamente grande, com alguns grupos em diferentes universidades e centros de pesquisa realizando estudos nessa área. Além disto, o Hospital Amaral de Carvalho, em Jaú-SP, já conta com um centro de terapia fotodinâmica que vem beneficiando muitos pacientes portadores de câncer. Além desse hospital, a TFD já começa a ser utilizada também pelo Instituto da Visão, ligado à Universidade Federal de São Paulo (Unifesp), para o tratamento da degeneração macular senil, uma doença comum, mas que é considerada a segunda causa de cegueira nos idosos.
2.7.1 Mecanismo de ação
A Terapia Fotodinâmica é um novo e promissor tratamento clínico que emprega a combinação de luz, oxigênio e um composto fotossensibilizador (FS) para o tratamento de uma variedade de patologias de caráter oncológico (MACDONALD; DOUGHERTY, 2001), cardiovascular, dermatológico, oftálmico e microbiológico (SEGALA et al, 2002). O processo fotodinâmico é obtido pela ação da luz sob o fotossensibilizador que, na presença do oxigênio, causa a destruição da célula alvo, seja ela do hospedeiro ou de algum micro-organismo causador de uma infecção.
Durante a terapia antimicrobiana dois processos fotoquímicos podem acontecer: na reação do tipo I, ocorre a transferência de energia do fotossensibilizador excitado a célula alvo, ocorrendo reações de óxidoredução com biomoléculas e produção das espécies reativas de oxigênio, como superóxido, radical hidroxila, etc; na reação do tipo II, a molécula do fotossensibilizador reage com moléculas de oxigênio molecular resultando na formação de oxigênio singleto altamente reativo. Este estado do oxigênio é quimicamente multo ativo e pode induzir várias reações em cadeia com componentes da célula, tais como DNA, proteínas, fosfolipídios da membrana celular, etc, podendo causar danos irreversíveis a célula levando a sua morte (HAYEK et al., 2005).
Por outro lado, a molécula de oxigênio no estado singleto pode perder sua energia por processos de emissão de fótons ou cruzamento intersistemas e voltar para seu estado fundamental sem começar qualquer reação (YAMADA, 2007).
2.7.2 Fotossensibilizadores
Para que a terapia antimicrobiana fotodinâmica exerça algum efeito na célula bacteriana, a luz deve ser absorvida por um ou mais de seus constituintes. Embora algumas bactérias apresentem componentes capazes de absorver parte do espectro de luz visível, a maioria das espécies não apresenta esses componentes, de modo que o uso de fotossenssibilizadores exógenos, que atraia para si a luz, é fundamental ao sucesso dessa terapia (WILSON; DOBSON; HARVEY, 1992).
A essência da TFDA provém da utilização de um fotossensibilizador com banda de absorção ressonante com o comprimento de onda de uma fonte de luz, uma vez que a complementariedade entre esses fatores é o responsável pela morte da célula. Para Wainwright, 2006 o agente fotossensibilizador ideal deve apresentar como características: estabilidade biológica, eficiência fotoquímica, seletividade pela célula alvo e mínimo efeito tóxico às células normais. Dentre os fotossensibilizadores, mais utilizados na terapia fotodinâmica antimicrobiana temos as porfirinas e seus derivados as ftalocianinas, as fenotiazinas, as cianinas, as acridinas, os corantes fitoterápicos e as clorinas (YAMADA, 2007).
A maioria dos fotossensibilizadores que vem sendo estudados para o tratamento do câncer e outras doenças teciduais estão baseadas nas porfirinas, clorinas, bacterioclorinas e nas ftalocianinas (CASTAÑO et al., 2004). No entanto, entre os corantes frequentemente utilizados como fotossensibilizadores antimicrobianos temos o rosa bengal (SCHAFER et al., 2000), as fenotiazinas tais como azul de metileno (BHATTI et al., 1998) e azul de toluidina (GAD et al., 2004). Esses corantes têm grande afinidades com os ácidos nucleicos com espectro de absorção muito semelhante na região do vermelho visível (≈λ = 660nm e 630nm, respectivamente) podendo induzir
reduções nas contagens microbiológicas, in vitro, de 4-5 logs na população após um curto período de tempo (JORI et al., 2006).
bactérias Gram (-) conhecido como membrana externa pode funcionar como uma barreira física e funcional entre a célula e seu ambiente dificultando a captação do fotosssensibilizador durante a terapia (PERUSSI, 2007).
2.7.3 As fontes de luz
Assim como o fotossensibilizador, a escolha da fonte de luz é um importante fator para o êxito da terapia fotodinâmica. As primeiras fontes de luz utilizadas em terapia fotodinâmica foram lâmpadas convencionais, com luz não coerente e policromática, com um forte componente térmico associado. Com o advento dos lasers, este passou a substituir as demais fontes de luz por serem monocromáticos e com isso poderem ser associados a fotossensibilizadores com banda de absorção ressonante ao comprimento de onda do laser, ou seja, capazes de absorver a maior parte da irradiação emitida pela fonte de luz. Assim, a densidade de energia é facilmente calculada e a área de irradiação pode ser bem controlada (ACKROYD et al., 2001).
A emissão de luz advinda de um laser pode ter os mais variados comprimentos de onda dependendo do seu meio ativo (argônio, He-Ne e diodos metálicos). No entanto, os lasers de diodo de emissão em λ= 660nm são os mais utilizados nessa
terapia. Esses equipamentos apresentam potência suficiente para geração do processo fotodinâmico, são compactos, robustos, com sistemas ópticos relativamente simples, e de custo mais acessível, além de possuírem um comprimento de onda ressonante a banda de absorção da maioria dos corantes atualmente utilizados (RIBEIRO et al., 2005).
A mais recente fonte de luz alternativa utilizada são os LEDs (light emitting diodes - diodos emissores de luz), que também podem ser utilizados com sucesso como
3 OBJETIVOS
4 METODOLOGIA
4.1 Delineamento experimental
Para o experimento in vitro, 72 discos de hidroxiapatita estéreis (HA) foram randomicamente alocados em 4 grupos que foram utilizados para permitir a realização de três experimentos independentes a fim de diminuir o viés inerente ao experimento, com 12 unidades experimentais por conjunto de grupo. Biofilmes de Streptococcus mutans UA159 foram crescidos em discos de hidroxiapatita imersos em banho de
cultura em placas de poliestireno contendo 24 poços, onde os 24 discos foram aleatoriamente divididos em quatro grupos experimentais, e submetidos à terapia fotodinâmica antimicrobiana, após 5 dias de formação dos biofilmes. O biofilme formado sobre seis discos referentes a cada tratamento foram então agrupados em grupo de três biofilmes a fim de aumentar a quantidade de biofilme coletada e permitir a realização das técnicas de contagem microbiológica e extração de RNA, de modo que eram obtidos 2 amostras de cada tratamento em cada repetição do experimento (figura 4). Para isolar a habilidade dos micro-organismos em produzir biofilme, alguns discos foram expostos apenas a um caldo não inoculado. Como era esperado, não foi observado crescimento bacteriano e este grupo não foi incluído na avaliação. Os quatros grupos experimentais utilizados nesse estudo estão descritos a seguir:
(F-L-) Biofilmes não foram expostos ao fotossensibilizador ou luz (controle negativo). Os discos foram colocados em água estéril em vez de azul de orto-toluidina (TBO) e esperado 15 minutos em temperatura ambiente afim de simular o tempo de irradiação do LED.
(F+L-) Biofilmes foram expostos somente ao fotossensibilizador. Discos receberam solução TBO e foi deixado 15 minutos em temperatura ambiente a fim de simular o tempo de irradiação do LED.
(F-L+) Biofilmes foram somente expostos à luz. Os discos foram colocados em água estéril em vez de TBO seguido por 55 ± J.cm-2 de irradiação por 15 minuots usando uma luz LED .
Figura 4- Delineamento experimental dos ensaios in vitro
4.2 Aspectos éticos
Este trabalho foi aprovado pelo Comitê de ética em Pesquisa da Universidade Estadual Vale do Acaraú (protocolo 669). Todos os voluntários doadores de saliva assinaram o Termo de Consentimento Livre e Esclarecido para Participação da Pesquisa antes do início dos procedimentos experimentais.
4.3 Fotossensibilizador e fonte de luz
O fotossensibilizador utilizado foi o azul de orto-toluidina (Sigma, CI 52040), ilustrado na figura 5(A), dissolvido em água deionizada na concentração de 100µg/ml e estocado em fraco âmbar em temperatura ambiente. A fonte de luz utilizada foi um diodo emissor de luz–LED (Laserbeam, Rio de Janeiro, Brasil) com espectro de emissão de 620 a 660nm e comprimento de onda predominante em 638.8nm, ilustrado na figura 5(B).
A luz foi distribuída por um cabo de fibra óptica com 9,5mm. A potência de luz LED foi de 40mW e as amostras submetidas a uma densidade de energia de ± 55 Jcm-2 após 15 minutos de irradiação. A densidade de energia foi calculada a partir da formula a seguir utilizando para efeito de cálculo a área do bloco.
DE = densidade de energia (J/cm2) T= tempo
P = potência (W) A= área estimada (cm2) T= segundos
Figura 5. (A) Fotosensibilizador utilizado, azul de orto- toluidina (Sigma-CI 52040). (B) Aparelho de LED Laser Beam com espectro de emissão de 620 a 660nm e comprimento de onda predominante 632.8nm
4.4 Preparo dos espécimes
Discos de hidroxiapatita (Clarkson Chromatography Products Inc.) foram usados nestes estudos. Dispositivos metálicos de fio de aço inoxidável foram desenvolvidos a fim de suportar os discos HA na posição vertical simulando as forças de gravitação encontradas nos biofilmes formados na boca (figura 6). Os discos de HA foram submetidos a um banho ultrasônico por 10 minutos para a remoção do pó de hidroxiapatita, posicionados nos dispositivos metálicos e a seguir foram autoclavados em posição a 121°C, por 15 minutos (DUARTE et al, 2008).
Figura 6- Dispositivo metálico desenvolvido a fim de manter os discos de HA na posição vertical.
4.5 Formação de biofilme in vitro
O micro-organismo utilizado nesse estudo foi Streptococcus mutans UA159. Para preparar o inóculo, S. mutans foi primeiramente crescido por 18 horas em Tryptone- Yeast Broth- TYB (Difco, Kansas City, Missouri) contendo uma concentração final de 1% de glicose em temperatura de 37°C e atmosfera parcial de 5% CO2. Depois da esterilização os discos foram imersos em água Mili-Q por 1 hora em temperatura ambiente para promover a umidificação dos mesmos. Em seguida os discos foram colocados em uma placa de poliestireno de 24 poços contento saliva humana clarificada diluída 1/1 (v/v) com o tampão de adsorção (50 mM KCl; 1.0 mM CaCl; 1.0 mM MgCl2 de pH 6.5) e 0,1 M de fluoreto fenilmetilsufonil na razão de 1:1000. Os discos foram em seguida incubados a 37°C por 1 hora em um agitador orbital para simular a formação de película adquirida. Na sequência os discos HA foram transferidos para outra placa de poliestireno de 24 poços contendo 2 mL de meio TYB contendo 1% de sacarose (figura 7) e 100µl de Streptococcus mutans da cultura overnight para cada 40 mL de meio. Os biofilmes foram então formados nos discos HA por 120 horas com troca periódica do meio de cultura a cada 24 horas (DUARTE et al, 2008). No final do período experimental, os biofilmes foram lavados três vezes com solução NaCl 0,89% e então submetidos a um dos quatro tratamentos inicialmente propostos.
Figura 7- Discos HA em placa de poliestireno de 24 poços contendo 2 mL de meio TYB com 1% de sacarose.
4.6 Terapia Fotodinâmica Antimicrobiana nos biofilmes formados in vitro
expostos a 15 minutos de irradiação por uma fonte luminosa do tipo LED (grupos F-L+ e F+L+) (figura 9A) ou mantidos em temperatura ambiente durante o mesmo período (F+L- e F-L-).
O biofilme formado sobre seis discos referentes a cada tratamento foram então agrupados em grupo de 3, a fim de aumentar a quantidade de biofilme coletada e permitir a realização da técnicas de contagem microbiológica e extração de RNA, de modo que eram obtidas 2 amostras de cada tratamento em cada repetição do experimento. Para a contagem microbiológica, amostras dos biofilmes formados foram coletados em eppendorfs pré-pesados contendo 1 mL de solução de NaCl a 0,89%. O material foi sonicado com 3 pulsos de 10 segundos a 6 watts com intervalo de 1 minutos entre eles. A suspensão foi então diluída em série decimal de (1:10, 1:100, 1:1000, 1:10000) e foi plaqueada em triplicada em placas de Ágar BHI utilizando a técnica da gota após o que foram incubados na temperatura de 37°C, por 48h, em atmosfera parcial de 10% de CO2. Decorrido o tempo de incubação, a contagem das unidades formadoras de colônia (UFC) foi realizada e o número de UFC/mg de biofilme foi estabelecido. Adicionalmente, o restante do biofilme formado foi coletado em um estabilizador de RNA (RNAlater® Ambion Inc., Austin, TX, USA) para posterior extração de RNA e análise da expressão de S. mutans submetido a terapia fotodinâmica antimicrobiana (figura 9B).
Figura 9. (A) Biofilme expostos a 55 Jcm-2 utilizando uma fonte de luz LED durante 15 minutos de irradiação (grupos S-L+ e S+L+). (B) Coleta do biofilme com instrumento afiado estéril para contagem microbiológica e extração de RNA.
4.7 Extração do RNA
O RNA total presente nas amostras de biofilmes submetidos aos diversos tratamentos descritos anteriormente foi extraído pelo método descrito por Stipp et al (2008) com algumas alterações. Inicialmente, as amostras foram retiradas do freezer 80 ºC e parte da solução de RNA later foi removida através de centrifugação a 11.000g, 4ºC, por 1 minuto. Em seguida, 220µl das amostras foram colocados em tubos criogênicos com rosca contendo pequenas pérolas de zircônia. Os tubos criogênicos foram levados para o equipamento “Bead-beater” (Mini bead-beater 16 - BioSpec Products. Bartlesville, OK, USA), a fim de promover disrupção mecânica das células, sendo a amostra misturada por 60 segundos na potência máxima do aparelho. Após esse período, as amostras permaneceram no gelo, por 60 segundos para posterior repetição do processo, 850µl da solução de beta mercapto com RLT (kit Rneasy® Mini Kit da Qiagen) na proporção de 10 µl de beta mercapto para 1 mL de RLT foi adicionada à amostra, vortexada por 30 segundos e centrifugada por 2 minutos, 11.000g a 4ºC. Posteriormente 400 µl do sobrenadante resultante foi transferido para um tubo eppendorf® contendo 285,7 µl de etanol absoluto.
intercalados com centrifugação à 20ºC, 11.000g por 30 s. As amostras foram tratadas com DNase I (Qiagen, Duesseldorf, Germany) para remoção de contaminantes de DNA genômico. Para isso, 80 µl de uma solução contendo 70 µl de RDD e 10 µl de DNase foi adicionada à coluna e incubados à temperatura ambiente por 15 min. Posteriormente, 350µl de RW1 e 500 µl de RPE foram adicionados, intercalando com centrifugação à 20°C, 11.000g por 30 segundos. Neste momento a coluna foi transferida para um tubo eppendorf® de 1,5 ml sem tampa e 30 µl de água livre de DNase e RNase foi adicionada para posterior centrifugação a 20°C, 11.000g por 30 segundos. O processo foi repetido por mais uma única vez, para salvar o eluente resultando em uma quantidade total de 60 µl de RNA extraído.
A concentração, pureza e integridade do RNA foram verificadas através da análise da razão entre as absorbâncias A260/A280 utilizando para isso, NanoDrop 2000 Thermo Scientific (NanoDrop products Wilmington, DE, USA) e um fotodocumentador de eletroforese.
A fim de minimizar a contaminação por DNA genômico a enzima TurboTM DNase (Applied Biosystems/Ambion, Austin, USA) foi utilizada. A amostra de RNA bruto foi adicionada a uma solução contendo 10 µl de tampão da Turbo DNase, 5µl da enzima Turbo DNase, e proporcional quantidade de água livre de DNase e RNase (Sigma) em relação à quantidade de amostra de RNA bruto, resultando em uma solução final de 100 µl. A solução permaneceu por 30 min à 37°C. Em seguida, toda a amostra foi adicionada a um tubo eppendorf ® contendo 350µl de RLT e 250 µl de etanol absoluto. A solução foi misturada e transferida para colunas de purificação do kit Rneasy® MinEluteTM Cleanup Kit (Qiagen) e centrifugada a 20°C, 11.000g por 30 segundos. Em seguida 500µl de RPE e 500µl de etanol 80% foram adicionados individualmente e intercalados por centrifugação a 20°C, 11.000g por 30 segundos. A coluna foi transferida para um tubo eppendorf® sem tampa de 1,5 ml e então adicionado 25µl de água livre de DNase e RNase centrifugado por 1 min, 10.000g e 24ºC . Esse procedimento foi repetido e o eluente foi salvo em uma quantidade total de 50 µl.
4.8 Obtenção do cDNA
Os cDNAs foram sintetizados a partir de RNA purificado oriundo de cada amostra de biofilme utilizando o kit iScriptTM cDNA Synthesis kit (BioRad). As reações de transcriptase reversa foram preparadas a partir de uma mistura contendo 4µl de IScript,1 µl IScript RT, 0,5 µg de RNA purificado da amostra e água livre de DNase e RNase em uma quantidade suficiente para uma solução final de 20 µl. A solução resultante foi misturada por 5 s e em seguida incubada a 25°C por 5 minutos e 42°C por 30 minutos. A reação foi completada com o aquecimento da mistura a 85°C por 5 minutos. Após o processo, 30µl de água livre de DNase e RNase foi adicionada para a solução de cDNA tornar-se em uma concentração final de 10 ng/µl. Logo em seguida as amostras de cDNA foram estocadas a -20°C.
4.9 Reação em Cadeia da Polimerase em Tempo Real
A partir do cDNA obtido, reações de PCR em tempo real foram realizadas para avaliar a expressão dos genes gtfB, gtfC e gbpB. Os pares de primers específicos foram utilizados de acordo com Stipp et al. (2008) os quais delimitam produtos de tamanhos entre 150 e 200pb (Tabela 1).
Tabela 1. Primers utilizados na Reação em Cadeia da Polimerase em Tempo Real
Gene Gene ID1 Orientação Seqüência (5’→3’) Tamanho do produto
16SRNA2 2886106 Forward
Reverse
5'-CGGCAAGCTAATCTCTGAAA-3' 5'-GCCCCTAAAAGGTTACCTCA-3'
190 pb
gtfB2 1028336 Forward Reverse
5'-CGAAATCCCAAATTTCTAATGA-3' 5'-TGTTTCCCCAACAGTATAAGGA-3'
197 pb
gtfC2 1028343 Forward
Reverse
5'-ACCAACCGCCACTGTTACT-3'
5'-AACGGTTTACCGCTTTTGAT-3'
161 pb
gbpB2 1029610 Forward Reverse
5'-CAACAGAAGCACAACCATCA-3' 5'-TGTCCACCATTACCCCAGT-3'
151
1
GenBank: http:// www.ncbi.nlm.gov/entrez/query.fcgi?db=gene
2
Sequência do primer de Stipp,2008.
4.10 ANÁLISE DOS RESULTADOS
5 RESULTADOS
5.1CONTAGEM MICROBIOLÓGICA
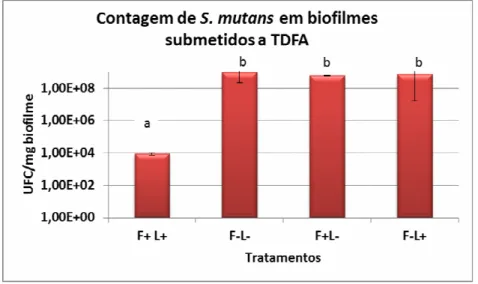
Para determinar a atividade antimicrobiana da terapia fotodinâmica em biofilmes formados in vitro foram comparados os números das unidades formadoras de colônias (UFC mg-1) obtido do controle negativo e os grupos testes. A fotossensibilização letal (F+L+) em biofilmes de S.mutans UA159 formados in vitro com TBO 100µ g/ml e densidade de energia de 55± Jcm-2 resultou em uma média de contagem viável de 8,58 x 103 UFC mg-1, comparando com o grupo controle de 9,48 x 108 UFC mg-1 (F-L-) representando uma redução expressiva na contagem microbiológica. No grupo teste (F+L+) observamos redução de 5 log10 na viabilidade dos biofilmes de S.mutans (Figura 10).
Figura 10. Contagens de Streptococcus mutans no biofilme bacteriano. F-L- indica não exposição ao corante e a luz LED, F-L+ indica exposição somente a luz LED, F+L- indica somente exposição ao corante e F+L+ indica exposição ao corante e a luz
5.2 EXTRAÇÃO DE RNA
O método de extração padronizado neste estudo demonstrou resultados satisfatórios quanto à qualidade e à integridade dos RNAs totais extraídos. A integridade das amostras de RNA foi monitorada em géis de agarose (Figura 11).
Figura 11. Imagem A apresenta RNA Bruto extraído dos diferentes tratamentos realizados. Imagem B apresenta o RNA
purificado das mesmas amostras após a coluna de purificação e utilização das DNases.
5.3
GENE DE REFERÊNCIAFigura 12. (A) Expressão gênica de 16 S na placa 1. (B) Expressão gênica de 16 S na placa 2.(C) Expressão gênica de 16 S na placa 3.
5.4 COMPARAÇÃO DA EXPRESSÃO DO GENE gtfB
Ao analisar os dados da expressão do gene gtfB não houve diferença estatística significativa quando comparamos o grupo F+L+ ao grupo controle F-L-(figura 14A). Já comparando F+L+ com os grupos também controle F-L+ e F+L-, houve diferença
estatística p<0,05 e p< 0,01, respectivamente. Houve redução estatisticamente significativa
na expressão do gene gtfB após a terapia fotodinâmica antimicrobiana comparado aos
grupos F-L+ e F+L- (figuras 14B e14C).
5.5 COMPARAÇÃO DA EXPRESSÃO DO GENE gtfC
Os ensaios com a terapia fotodinâmica para o gene gtfC demonstram diminuição estatisticamente significativa da expressão desse gene no grupo F+L+ em relação a todos os grupos controles F-L- (p<0,05), F-L+ (p<0,01), F+L-(p<0,01). Como ilustrado nas figuras 15.
Figura 15. (A) Comparação da expressão do gene gtfC após a terapia fotodinâmica antimicrobiana em relação ao grupo F-L-. (B) Comparação da expressão do gene gtfC após a terapia fotodinâmica antimicrobiana em relação ao grupo F-L+. (C) Comparação da expressão do gene gtfC após a terapia fotodinâmica antimicrobiana em relação ao grupo F+L-. Dados são médias de 3 repetições ± desvio padrão da média. Médias seguidas de letras distintas diferem entre si pelo teste Tukey- Kramer (p<0,05).
5.6 COMPARAÇÃO DA EXPRESSÃO DO GENE gbpB
O padrão de expressão do gene gbpB não demonstrou diferença estatística entre o grupo experimental e todos os grupos controles testados. Embora, pequenas variações nos valores de expressão tenham sido observadas nos diversos tratamentos testados (Figura 16). Assim, a utilização da terapia fotodinâmica antimicrobiana parece não ter influenciado a expressão desse gene por S. mutans inseridos em biofilmes formados in vitro.
6 DISCUSSÃO
No presente estudo observamos o padrão de expressão genética de Streptococcus mutans em biofilmes orais produzidos in vitro submetidos à terapia
fotodinâmica utilizando um diodo emissor de luz (LED) associado a um fotossenssibilizador azul de orto-toluidina (TBO). Para tanto, biofilme de Streptococcus mutans UA159 formados in vitro foram crescidos em discos de hidroxiapatita.
Atualmente, o tratamento proposto para evitar manifestações causadas por estes micro-organismos, envolve a remoção mecânica do biofilme e o uso de antissépticos e antibióticos. No entanto, devido ao crescente aumento da resistência de patógenos bacterianos a terapêuticos antimicrobianos comuns, a necessidade de alternativas eficientes e tratamentos acessíveis a infecções e doenças causadas por estes patógenos vem despertando um interesse cada vez maior da comunidade científica. A natureza estrutural do biofilme e seus atributos fisiológicos como a dificuldade de penetração do antimicrobiano através da matriz do biofilme, dentre outros, conferem uma inerente resistência a agentes antimicrobianos (DONLAN E COSTERTON, 2002; RICE et al., 2005; ALBUQUERQUE et al., 2010). A terapia fotodinâmica antimicrobiana aparece nesse contexto, com redução da possibilidade de surgimento de resistência microbiana, uma vez que o dano ou morte bacteriana é obtido em curto período de tempo (WAINWRIGHT, 1998) através da ação de oxigênios moleculares reativos gerados nas reações fotoquímicas, os quais podem interagir com proteínas mitocondriais da célula alvo alterando sua estrutura e atividade, provocar desnaturação de proteínas e lipídios da membrana e modificar a estrutura do DNA celular (CHABRIER-ROSELLO et al., 2005).