178
PREPARAÇÃO E CARACTERIZAÇÃO DE FILMES DE
FIBROÍNA PARA IMOBILIZAÇÃO DE EPÍTOPOS DE
Leishmania infantum E SEU USO EM DETECÇÃO
PREPARATION AND CHARACTERIZATION OF FIBROIN
FILMS FOR IMMOBILIZATION OF Leishmania infantum
EPITOPES AND ITS USE FOR DETECTION
PREPARACIÓN Y CARACTERIZACIÓN DE PELÍCULAS DE
FIBROÍNA PARA INMOBILIZACIÓN DE EPÍTOPOS DE
Leishmania infantum Y SU USO EN DETECCIÓN
Laura Camilo Florentino1
Mayra Fagundes Costa2
Adriano Reinaldo Viçoto Benvenho3
Wendel Andrade Alves4
Resumo: Devido às limitações dos ensaios diagnósticos convencionais da leishmaniose, buscam-se novas metodologias de detecção. Neste projeto, apresentamos um imunossensor nanoestruturado com matriz de fibroína para detectar anticorpos específicos anti-leishmania utilizando a Espectroscopia de Impedância Eletroquímica como método de detecção. O imunossensor demonstrou-se eficaz para detectar as propriedades eletroquímicas da interação epítopo-anticorpo e a fibroína apresentou aspectos promissores como matriz. Essa abordagem constitui um processo relevante e inédito, visto que, a literatura não reporta o uso de matrizes híbridas como suporte para antígeno de doenças negligenciadas, tampouco a formulação de biossensores.
Palavras-chave: Fibroína. Imunossensor. Leishmaniose. Espectroscopia de impedância.
Abstract: Due to the limitations of the conventional diagnostic tests of leishmaniasis, new detection methodologies are sought. In this project, we present a nanostructured immunosensor with fibroin matrix to detect specific anti-leishmania antibodies using Electrochemical Impedance Spectroscopy (EIS) as a detection method. The immunosensor was shown to be effective detecting the electrochemical properties of antigen-antibody interaction and fibroin presented promising aspects as a matrix. This approach is a relevant and unpublished process, since the literature doesn’t report the use of hybrid matrices as support for neglected diseases antigen, nor the biosensor formulation.
Keywords: Fibroin. Immunosensor. Leishmaniasis. Impedance spectroscopy.
1 Bolsista PIBIC-Jr. Universidade Federal do ABC. E-mail: laucamilolcf@gmail.com 2 Mestre em Química. Universidade Federal do ABC. E-mail: mayra.costa@ufabc.edu.br 3 Doutor em Ciências. Universidade Federal do ABC. E-mail: adriano.benvenho@ufabc.edu.br
4 Doutor em Química/Bolsista de Produtividade em Pesquisa do CNPq. Universidade Federal do ABC. E-mail:
179
Resumen: Debido a las limitaciones de los ensayos diagnósticos convencionales de la leishmaniasis, se buscannuevas metodologías de detección. En este proyecto, presentamos un inmunosensor nanoestructurado con matriz de fibroína para detectar anticuerpos específicos anti-leishmania, utilizando Espectroscopia de Impedancia Electroquímica como método de detección. El inmunosensor se demostró efectivo para detectar las propiedades electroquímicas de la interacción antígeno-anticuerpo y la fibroína presentó aspectos prometedores como matriz. Eso constituye un proceso relevante y inédito, debido la literatura no reportar uso de matrices híbridas como soporte para antígeno de enfermedades, ni la formulación de biosensores.
Palabras-clave: Fibroina. Inmunosensor. Leishmaniasis. Espectroscopia de impedancia.
180
INTRODUÇÃO
A leishmaniose é uma doença infecto parasitária causada por diversas espécies de protozoários do gênero Leishmania que afeta humanos e cães. (Gay et al., 2015). Dependendo do parasita responsável pela infecção, essa doença pode ser classificada como: leishmaniose tegumentar (LT), leishmaniose mucocutânea, leishmaniose cutânea difusa (LCD) e leishmaniose visceral (LV).Todas as espécies do gênero são transmitidas através de vetor flebotomínio fêmea, denominado Lutzomyia longipalpis e popularmente conhecido como “mosquito palha” (Calderon et al., 2009; Desjeux, 2004). A leishmaniose visceral, que dispõe do agente etiológico Leishmania chagasi, está classificada como a segunda doença parasitária que mais mata no mundo e a forma mais grave da doença (Sundar e Rai, 2002; Perinoto et al., 2010). Dados indicam que 47 países se encontram em situação endêmica, com destaque às regiões geográficas do subcontinente indiano e leste africano. Sendo que, mais de 90% dos novos casos são relatados em 6 países: Bangladesh, Brasil, Etiópia, Índia, Sudão do Sul e Sudão (Werneck, 2016).
Os aspectos clínicos para o diagnóstico de leishmaniose representam um desafio atual devido a não especificidade de sintomas clínicos e ao elevado percentual de casos assintomáticos em humanos e cães. As metodologias mais comuns são o ensaio imunoenzimático (ELISA), utilizando o antígeno impuro, e a reação de imunofluorescência indireta (RIFI) com base em anticorpos IgG (Kar, 1995). Em contrapartida, essas análises não possuem sensibilidade de detecção para casos assintomáticos; existe a possibilidade de ocorrer reações cruzadas com outros tripanossomatídeos, resultando em testes duvidosos; não são medidas adaptáveis ao grande número de exames sorológicos de cães em regiões endêmicas por conta do tempo envolvido em sua execução (Souto et al., 2013; Van Griensven e Diro, 2019; Huang et al., 2010). Neste sentido, um diagnóstico definitivo depende de testes laboratoriais prolongados, incluindo análises parasitológicas e técnicas sorológicas.
As limitações dos ensaios imunológicos incentivaram o desenvolvimento de biossensores baseados em sistemas interdigitados com biomateriais em escala nanométrica. Os biossensores visam utilizar o poder das técnicas eletroquímicas para processos biológicos,
181
produzindo quantitativamente um sinal elétrico que se relaciona com a concentração de um analito biológico (Kimmel et al., 2012; de Castro, 2016). Os imunossensores representam um subgrupo dos biossensores que realizam imunoensaios com base em reconhecimento de antígenos e anticorpos (Pandiaraj et al., 2014). O custo relativamente baixo, a elevada seletividade e sensibilidade, a capacidade de detecção em tempo real, uso de pouco volume de amostra e a possibilidade de miniaturização tornam os imunossensores úteis em uma variedade de campos, incluindo saúde, monitoramento ambiental e análise biológica (Nambiar e Yeow, 2011; Kimmel et al, 2012; Jensen et al., 2013; Guan, Miao e Zhang, 2004).
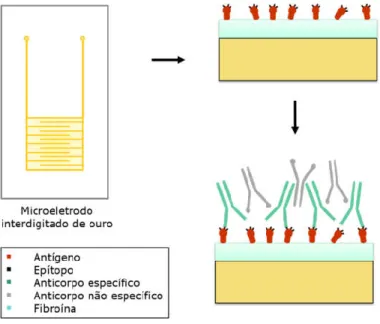
Os eletrodos interdigitados (IDEs) dispõem de uma interface simples que possui um bom desempenho em sistemas de biossensor. Os IDEs são formados por duas placas de metal interligadas, onde cada uma possui um número de dígitos individuais que se sobrepõem com os da outra seção (Fig 1). A largura e o espaçamento dos dígitos são de suma importância, visto que, o uso de um espaçamento pequeno e a presença de matrizes nanométricas de eletrodos resultam em uma maior sensibilidade de detecção (Mackay et al., 2015; Van Gerwen, 1998).
Estruturas auto-organizadas baseadas em peptídeos são candidatos ideais para o desenvolvimento desses imunossensores por conta da presença de um amplo espectro de grupos químicos e capacidade de se manter estáveis em condições biológicas. O casulo do bicho-da-seda (Bombix mori) é constituído por duas proteínas, a fibroína e a sericina. A fibroína é uma proteína hidrofóbica que vêm sendo estudada por diversos pesquisadores, principalmente das áreas biomédicas e biotecnológicas, por conta de apresentar propriedades relevantes como: elasticidade, flexibilidade e resistência a tensão, biocompatibilidade e biodegradabilidade, estabilidade térmica e modificação química (Perdigão, 2015). A sericina é uma proteína hidrofílica constituinte da seda que tem a função de manter duas fibras de fibroína unidas, originando fibras compostas que protegem o verme em crescimento (Altman et al., 2003).
As propriedades da fibroína são ideais para sua utilização como matriz em imunossensores, onde as sequências peptídicas do antígeno são propícias a se estabilizar nas regiões estruturais disponíveis da fibroína. A fabricação em nanoescala pode ser útil para melhorar o desempenho de resposta de biossensores impedimétricos (Guan, Miao e Zhang, 2004). A fibroína possui duas cadeias, uma de baixo peso molecular (leve) e uma de alto peso molecular (pesada), com 25 e 325 kDa, respectivamente, unidas por uma camada de sericina
182
(Hakimi et al., 2007). A estrutura química da fibroína é composta predominantemente por glicina, alanina, serina e, em menor quantidade, tirosina, sendo que a fração molar desses quatro aminoácidos representa 90% de sua estrutura (Vepari e Kaplan, 2007).
Essa proteína dispõe de dois domínios, amorfo (seda I) e cristalino (seda II). As regiões cristalinas são dispostas em estruturas ordenadas na forma de folha-β hidrofóbica (Figura 1). As estruturas folha-β são assimétricas com um lado ocupado com cadeias laterais hidrogenadas da glicina e o outro ocupado com cadeias laterais metiladas das alaninas que povoam os domínios hidrofóbicos. As folhas-β são arranjadas para que os grupos metílicos e grupos hidrogenados de folhas opostas interajam para formar o empilhamento inter-folha nos cristais. Fortes ligações de hidrogênio e forças de van der Waals geram uma estrutura que é termodinamicamente estável (Kundu, Dewan e Ghoshal, 2008; Weska, 2009). As regiões amorfas são responsáveis pelas propriedades físicas do material como retenção de umidade e resistência química (Moraes, Beppu e Weska, 2017).
O presente trabalho apresenta o estudo do desenvolvimento de um biossensor, que a utiliza técnica de espectroscopia de impedância eletroquímica (EIS, do inglês, Electrochemical
Impedance Spectroscopy), como técnica de transdução. Esta técnica permite quantificar o
analito quando este se complexa com uma biomolécula de reconhecimento específico que está imobilizado na superfície de um eletrodo (Iles; Kallichurn, 2012), ocasionando mudanças nas propriedades resistivas e capacitivas do material, enquanto é feita uma pertubação no sistema por meio de um pontecial (Katz; Willner, 2003). Os biossensores que funcionam com o auxílio dessa técnica são denominados biossensores impedimétricos (Yan, et. al.; 2011).
A Figura 1 traz uma ilustração do modelo proposto para a construção do biossensor pela formação do filme na superfície da matriz interdigitada do microelétrodo e a interação epítopo- anticorpo, que é quantificada a partir da alteração das propriedades elétricas que ocorrem no filme durante a interação.
183
Figura 1: Representação esquemática do imunossensor impedimétrico e sua interaçãoantígeno-anticorpo.
Fonte: Acervo pessoal
METODOLOGIA
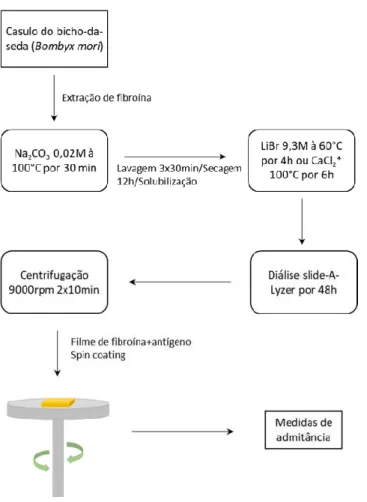
Extração e solubilização da fibroína a partir do casulo do bicho-da-seda (Bombix mori) As fibras do casulo do bicho-da-seda (10,00 g) foram adicionadas a uma solução de Na2CO3 0,02M, em constante agitação e aquecimento à 100°C durante 30 minutos. Em seguida,
o material é lavado 3x30 min com água Milli-Q para remover o Na2CO3 e a sericina residuais.
A fibroína permanece em secagem por 12 horas e, posteriormente, é dissolvida em LiBr 9,3M à 60°C por 4h (1,00g de fibroína para 5mL de LiBr) ou em solução de CaCl2 à 100°C por 6h
(1,00g para 40mL). A solução é dialisada por 48 horas com baixa agitação utilizando o slide-A-Lyzer (Molecular weight cut-off, MWCO 3500, Pierce, USA) e centrifuga-se a 9.000 rpm 2x10min. A concentração foi determinada a partir da diferença de massa inicial e final do
A solução de cloreto de cálcio é preparada com 14,67g de CaCl
2, 20,00 mL de álcool etílico
184
processo de aquecimento em estufa (70°C), o valor determinado foi de 4% em massa. A solução final pode ser armazenada por aproximadamente 30 dias a -7°C, sendo que, algumas amostras foram acidificadas.
Preparação do filme de epítopo-fibroína e anticorpo
A solução estoque (antígeno específico da Leishmania – 1.0 mg mL-1) foi diluída em
fibroína, obtendo a concentração de 0,01 mg mL-1. O pH da solução de fibroína deve ser
equivalente ao pH da solução estoque de epítopo. A solução de epítopo e fibroína (100 μL) foi depositada no microeletrodo interdigitado de ouro e o filme foi formado por spin coating a 1000 rpm por 45 segundos. Em seguida, o IDE é colocado em uma placa de aquecimento para a completa evaporação do solvente (água). Os microeletrodos preparados são levados ao dessecador e armazenados à -7°C. Foram avaliados filmes de fibroína preparados a partir de soluções em pH 7,0 e 5,3.
A solução estoque do anticorpo (AC) específico é diluída em água Milli-Q. As concentrações analisadas foram: 1x10-4 mg mL-1, 5x10-4 mg mL-1, 1x10-3 mg mL-1, 5x10-3 mg
mL-1, 1x10-2 mg mL-1. Foi analisado também, o anticorpo não específico anti -actina foi
preparado sob as mesmas condições que o anticorpo específico.
Para a realização das medias, depositam-se 100 μL de cada diluição de anticorpo na área interdigitada do IDE e após cinco minutos o potencial é aplicado. A figura 2 resume os processos realizados nesse trabalho.
185
Figura 2: Representação esquemática da metodologia aplicada para a preparação e análise do filme defibroína como matriz de um imunossensor.
Fonte: Acervo pessoal
Espectroscopia de Impedância Eletroquímica
As medidas de Espectroscopia de Impedância Eletroquímica foram realizadas utilizando IDE’s de ouro com espaçamento de 10 μm entre as faixas de ouro. Esses dispositivos foram cobertos com o filme de antígeno/fibroína. As análises foram realizadas com o medidor Agilent 4980 LCR, utilizando varreduras de frequência na faixa de 20 Hz 100000 Hz com uma amplitude de sinal de 0,5 V em corrente alternada (0,5 VAC). Sendo que, cada concentração de
186
RESULTADOS E DISCUSSÃO
A admitância complexa (Y) foi medida a partir da deposição das amostras na superfície do microeletrodo e estão representadas utilizando a forma de coordenadas retangulares, expressas por Y = G + jB, onde G é a condutância e B é a susceptância. A detecção imunológica usando IDE’s utiliza o conceito de uma mudança na resistência próxima à superfície devido ao acúmulo de proteína e mudança nas propriedades dielétricas devido à presença de substâncias com constantes dielétricas baixas, que podem polarizar as cargas elétricas. Antes de adicionar a solução de anticorpo aos IDE’s funcionalizados, a condutância foi medida a partir dos IDEs nus e de fibroína + antígeno funcionalizados.
A avaliação dos filmes em diferentes pH’s foi proposta no intuito de comparar a relação da resposta elétrica o processo de reticulação da proteína, uma vez que, devido ao empacotamento da estrutura nessa conformação, a ancoragem do epítopo seria estabilizada pelas ligações de hidrogênio nas cadeias laterais da estrutura (Matsumoto et. al., 2006).
Conforme demonstrado por He et. al. (He et.al., 2002) por meio daespectroscopia de dicroísmo circular, avaliando a fibroína no intervalo de pH 7,0-3,0, o pH exerce grande influência sobre as mudanças conformacionais na estrutura secundária da fibroína. O espectro da análise contendo a fibroína com pH 7,0 exibiu a dominância da estrutura randômica, em contrapartida, com a diminuição do pH para 6,0 observou-se a emergência da conformação em folha-β. Com o pH 3,0, a fração da estrutura em folha-β aumentou aproximadamente 40% e ao retornar o pH para 7,0, retornou-se à conformação randômica.
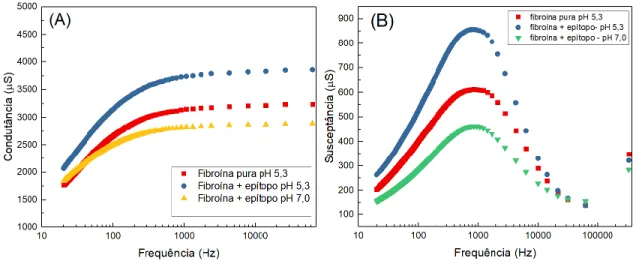
A Figura 3 exibe os gráficos de condutância (3A) e susceptância (3B) versus frequência e apresenta as alterações que ocorrem nos sinais elétricos ao interagir com uma solução de anticorpo em concentração fixa de 5E-4 mg mL-1. As condições de preparação do filme foram
de fiborína pura, modificada com o epítopo em pH 5,3 e fibroína modificado com o epítopo em pH 7,0.
É possível notar neste experimento que a intensidade de sinal elétrico observada durante as medidas varia bastante de um filme para o outro. Um filme não modificado com a sequência peptídica do epítopo apresenta condutância e susceptância aproximadamente uma ordem de
187
grandeza menor quando comparados aos filmes modificados com o epítopo. Essa resposta é esperada e perfeitamente compreendida quando se assume que no momento em que ocorre a interação do anticorpo com os sítios ativos disponíveis do epítopo, acontece uma maior polarização de cargas na superfície do eletrodo, aumentando a condutividade do meio, além de gerar uma capacitância na interface. A condutividade e a capacitância gerada no eletrodo quando a macromolécula de anticorpo interage apenas com a fibroína, é, portanto, demasiadamente menor do que a proveniente da interação epítopo-anticorpo.
Figura 3: Espectroscopia de Impedância Eletroquímica com variação de grandezas eletroquímicas em função da frequência aplicada (20 Hz – 100000 Hz) em concentração fixa de 5E-4 mg mL-1 de anticorpo específico para os filmes em diferentes condições de preparo (A) Condutância (B) susceptância versus frequência.
Fonte: Acervo pessoal
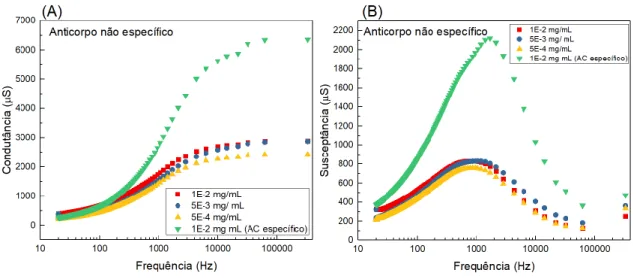
Para confirmar a especificidade da resposta do biossensor, as medidas foram realizadas na presença de um anticorpo não específico como interferente. Um primeiro experimento foi realizado utilizando como interferente o anticorpo especifico anti -actina. Os resultados são apresentados na Figura 4A e 4B a seguir, os quais apresentam condutância e susceptância, respectivamente, versus a frequência.
188
Como pode ser observado pela Figura 4, conforme as soluções contendo o anticorpo específico anti -actina foram adicionadas, não acontecem variações consideráveis e lineares nas respostas elétricas. O imunossensor apresenta uma intensidade de sinal consideravelmente inferior quando comparado um anticorpo específico da leishmaniose, indicando que possivelmente não ocorrem interações específicas, quando adicionado esse interferente ao sensor.
Figura 4: Avaliação da (A) Condutância e (B) susceptância versus frequência para amostras de anticorpo não específico.
Fonte: Acervo pessoal
Em resumo, as medidas de condutância (C), a susceptância (D) apresentam proporcionalidade a concentração de anticorpo específico presente na amostra. Essa relação permite a construção da curva de calibração e determinação dos parâmetros analíticos.
189
CONCLUSÃO
O imunossensor desenvolvido demonstrou-se eficiente para a detecção da interação entre o anticorpo específico e a sequência peptídica do epítopo do antígeno. Ademais, a utilização de microeletrodos interdigitados de ouro contribuiu para a melhor resolução da análise, visto que, possui maior área de contato em sua região interdigitada que auxilia na disposição da matriz.
A conformação estrutural da fibroína em folha-β, a qual facilita a interação entre as ligações de hidrogênio e a estrutura do antígeno, é proporcionada com o pH ácido. Sendo assim, através dos parâmetros analíticos ajustados (pH 5.30), observou-se que a fibroína corresponde a uma ótima matriz imobilizadora do antígeno específico e impede a sua degradação; apresenta porosidade em sua morfologia, facilitando a incorporação do anticorpo na realização da medida e contribuindo para a medição da interação antígeno-anticorpo; não interfere nos sinais elétricos avaliados pela espectroscopia de impedância eletroquímica.
Para se obter uma avaliação plena do imunossensor perante a leishmaniose, exige-se a realização de estudos sobre o comportamento do sistema eletroquímico com sangue infectado a partir dessa protozoose (amostras reais), o qual seria o substituinte do anticorpo específico. Assim como, deve-se avaliar a aplicabilidade do teste in situ, principalmente em alojamentos de animais, e realizar ajustes dos parâmetros estatísticos.
AGRADECIMENTOS
Os autores agradecem à FAPESP (Procs. nos. 2015/24018-1; 2016/50188-4; 2017/02317-2), CNPq (Proc. no. 302923/2015-2) e INCT de Bioanalítica (FAPESP (Proc. no. 2014/50867-3 e CNPq (Proc. no. 465389/2014-7)) pelo apoio financeiro à pesquisa realizada.
190
REFERÊNCIAS
ALTMAN, G. H. et al. Silk-based biomaterials. Biomaterials, v. 24, n. 3, p. 401-416. 2003.
CALDERON, L. et al. Amazonian Biodiversity: A View of Drug Development for Leishmaniasis and Malaria. J. Braz. Chem. Soc., v. 20, n. 6, p. 1011-1023, 2009.
De CASTRO, A. Detecção do gene do vírus da hepatite B e antígeno CA125 para o tumor do ovário: uma plataforma específica para diagnóstico point-of-care. Dissertação (Doutorado em Genética e Bioquímica) – Universidade Federal de Uberlândia, Minas Gerais, Brasil, 2016. DESJEUX, P. Disease watch: In the News. Natural Reviews Microbiology. v. 2, n. 9, p. 692-693, 2004.
GAY, E. et al. Les leishmanioses humaines: parasitoses importées et autochtones. Revue Francophone Des Laboratoires, n. 477, p. 61-65, 2015.
GUAN, J.; MIAO, Y.; ZHANG, Q. Impedimetric Biosensors. Journal of Bioscience and Bioengineering, [S.I], v. 97, n. 4, p. 219-226. 2004.
HAKIMI, O., et al. Spider and mulberry silkworm silks as compatible biomaterials. Composites: Part B, v. 38, n. 3, p. 324-337, 2007.
HE, Y.X., et al. N-Terminal domain of Bombyx mori fibroin mediates the assembly of silk in response to pH decrease. J Mol Biol. V.418, n. 3-4, p.197-207, 2012.
HUANG, K. et al. A disposable electrochemical immunosensor for carcinoembryonic antigen based on nano-Au/multi-walled carbon nanotubes-chitosans nanocomposite film modified glassy carbon electrode. Analytica Chimica Acta. n. 659, p. 102-108, 2010.
ILES, R.K.; KALLICHURN, H. What will be the Future Development of Electrochemical Biosensors for the Detection and Quantification of Biomarkers? Journal of Bioengineering & Biomedical Science. v 2, n.4, 2012.
JENSEN, P. et al. Real-time detection of TDP1 activity using a fluorophore-quencher coupled DNA-biosensor. Biosens Bioelectron, v. 48, p. 230-237, 2013.
KAR, K. Serodiagnosis of Leishmaniasis, Critical Reviews in Microbiology, 21:2, p. 123-152. 1995. KATZ, E.; WILLNER, I. Probing biomolecular interactions at conductive and semiconductive surfaces by impedance spectroscopy: routes to impedimetric immunosensors, DNAsensors and enzyme biosensors. Electroanalysis. v. 15, p. 913–94, 2003.
KIMMEL, D. et al. Electrochemical Sensors and Biosensors. Analytical Chemistry. n. 84, p. 685-707, 2011.
KUNDU, J., DEWAN, M., GHOSHAL, S. Mulberry non-engineered silk gland protein via-a’-vis silk cocoon protein engineered by silkworms as biomaterial matrices. Journal of Materials Science: Materials in Medicine, v. 19, n. 7, p. 2679-2689, 2008.
191
MACKAY, S. et al. Simulations of Interdigitated Electrode Interactions with Gold Nanoparticles forImpedance-Based Biosensing Applications. Sensors. v. 15, p. 22192-22208, 2015.
MATSUMOTO, A., et al. Mechanisms of Silk Fibroin Sol-Gel Transitions. J. Phys. Chem. 110, 21630-21638, 2006
MORAES, M. A; BEPPU, M. M; WESKA, R. F. Blendas e Compósitos Compreendendo Fibroína e Alginato: Processos de Produção e Produtos Obtidos dos Mesmos. Disponível em:
<http://repositorio.unicamp.br/jspui/handle/REPOSIP/84917> Acesso em: 23 de Dezembro de 2017. NAMBIAR, S.; YEOW, J. Conductive polymer-based sensors for biomedical applications. Biosens Bioelectron, v. 26, n. 5, p. 1825-1832, 2011.
PANDIARAJ, M. et al. Designing label-free electrochemical immunosensors for cytochrome c using nanocomposites functionalized screen printed electrodes. Biosens Bioelectron, v. 54, p. 115-21, 2014. PERDIGÃO, A. P. L. Compósito de Hidroxiapatita, Fibroína da Seda e Ácido Hialurônico em Defeitos Ósseos Experimentais na Ulna de Coelhos. Dissertação (Mestrado em Medicina Veterinária) - Universidade Federal de Viçosa, Minas Gerais, Brasil, 2015.
PERINOTO, A. et al. Biosensors for Efficient Diagnosis of Leishmaniasis: Innovations in
Bioanalytics for a Neglected Disease. Analytical Chemistry, [S.I], v. 82, n.23, p. 9763-9768. Dec. 2010.
SOUTO, J. et al. Development of a label-free immunosensor based on surface plasmon resonance technique for the detection of anti-Leishmania infantum antibodies in canine serum. Biosensors and Bioelectronics 46: p. 22-29, 2013.
SUNDAR, S; RAI, M. Laboratory Diagnosis of Visceral Leishmaniasis. Clinical and Diagnostic Laboratory Immunology. v. 9, n. 5, p. 951-958, 2002
VAN GERWEN, P. Nanoscaled interdigitated electrode arrays for biochemical sensors. Sensors and Actuators, B, n. 49, p. 73-80, 1998.
VAN GRIENSVEN, J.; DIRO, E. Visceral Leishmaniasis: Recent Advances in Diagnostics and Treatment Regimens. Infectious Diasease Clinics of North America. v. 33, p. 79-99, 2019. VEPARI, C.; KAPLAN, D. K. Silk as a biomaterial. Progress in Polymer Science, v. 32, p. 991-1007, 2007.
WERNECK, G. The control of visceral leishmaniais in Brazil: end of a cycle? Caderno de Saúde Pública. Rio de Janeiro, v. 32, n. 6, Jun 2016.
WESKA, R. F. Estudo da esterilização e da calcificação in vitro de membranas de fibroína de seda para aplicação como biomaterial. Dissertação (Mestrado em Engenharia Química) – Universidade Estadual de Campinas, Campinas, Brasil, 2009.
YAN, X. F.; WANG, M. H.; AN, D. Progress of Interdigitated Array Microelectrodes Based Impedance Immunosensor. Chin J Anal Chem. V. 39, n. 10, p. 1601–1610, 2011.