UNIVERSIDADE TRÁS-OS-MONTES E ALTO DOURO
Caracterização dos extratos de subprodutos de frutos, Citrus reticulata
Blanco e Cucurbita ficifolia Bouché e avaliação dos seus efeitos biológicos
usando células animais em cultura.
Dissertação de Mestrado em Biologia Clínica Laboratorial
Sandrine Dos Santos Ferreira
Orientador: Prof. Doutora Amélia Maria Lopes Dias da Silva
Coorientador: Prof. Doutor Fernando Hermínio Milheiro Nunes
UNIVERSIDADE TRÁS-OS-MONTES E ALTO DOURO
Caracterização dos extratos de subprodutos de frutos, Citrus reticulata
Blanco e Cucurbita ficifolia Bouché e avaliação dos seus efeitos biológicos
usando células animais em cultura.
Dissertação de Mestrado em Biologia Clínica Laboratorial
Sandrine Dos Santos Ferreira
Orientador: Prof. Doutora Amélia Maria Lopes Dias da Silva
Coorientador: Prof. Doutor Fernando Hermínio Milheiro Nunes
Composição do Júri:
Orientador:
__________________________________________
Prof. Doutora Amélia Maria Lopes Dias da Silva
Co-orientador:
__________________________________________
i
Agradecimentos
Em primeiro lugar quero agradecer à minha família, sem o apoio deles não teria chegado tão longe. Um especial obrigado aos meus pais pela preocupação, pela dedicação, por todo o esforço, pelas noites mal dormidas, pelo cansaço, pelo amor e carinho, para que pudesse concretizar mais uma etapa, por tornar este sonho possível. Obrigada Sis (Christine), por TUDO!! Por seres uma irmã 5* e uma amiga ainda melhor, por estares sempre presente e por me teres ajudado e aturado tanto durante estes anos todos.
Agradeço, também, a Professora Doutora Amélia M. Silva e ao Professor Doutor Fernando Nunes pela disponibilidade em orientarem esta dissertação, assim como por toda a simpatia, paciência e ajuda prestada ao longo do trabalho.
Obrigado ao Sr. Carlos Matos do Laboratório de Análise de Águas, ao André Lemos e ao Pedro, por toda a ajuda, por transmitir o seu conhecimento.
Agradeço a todos os professores do mestrado em Biologia Clinica Laboratorial pelo trabalho e dedicação aos alunos.
E por fim, mas não menos importante, Obrigado Vila Real, cidade que me acolheu de braços abertos, que me conquistou, que me fez sentir em casa mesmo nos momentos mais difíceis, pelas amizades, emoções e momentos. Um especial obrigado à minha segunda família: aos “taludinhos”; ao Tó Santos que me acompanha desde o 10ºano; Leninha por marcares a minha vida; Luís Coelho pelos sábios conselhos e ao Cândido por ser impossível estar mal-humorada ao teu lado. Obrigado Ju, Nor e Inês pelas conversas, pelos momentos, pela amizade! Obrigado Bete e claro Stef.
Obrigado a todos que não mencionei, mas que de algum modo entraram na minha vida positivamente sendo impossível esquecê-los. A todos, um muito obrigado sincero, dedico este trabalho a vocês!
iii
Resumo
Desde os tempos mais antigos que as plantas são utilizadas como remédios para curar determinadas doenças. Com aumento da consciencialização para uma prática de vida mais saudável tem surgido cada vez maior interesse na Medicina Tradicional Chinesa, devido aos seus benefícios farmacológicos. A Citrus reticulata Blanco, mais conhecida por tangerina e a
Cucurbita ficifolia Bouché, a chila, são exemplos de algumas frutas utilizadas na medicina
tradicional, sendo referidas como tendo um efeito antioxidante, anti-carcinogénico, antidiabético, entre outros.
Devido à elevada procura destes frutos e seus derivados, principalmente da tangerina, mundialmente são produzidos milhões de toneladas de resíduos orgânicos por ano. Estes subprodutos são constituídos maioritariamente por cascas, sementes e polpas. Sendo considerados potenciais fontes de compostos bioativos, que apresentam um elevado potencial para as indústrias fitofarmacêuticas, devido ao seu elevado teor em polifenóis, principalmente flavonóides.
O objetivo deste trabalho de investigação foi a obtenção e a caracterização de extratos brutos, aquosos e hidro-etanólico, e respetivas frações obtidas por fracionamento em cartucho de extração em fase sólida de fase reversa (fração do metanol e fração aquosa) da casca, polpa e sumo de tangerina e da casca de chila, bem como avaliar in vitro a citotoxicidade resultante da exposição (24, 48 e 72 horas) dos vários extratos a várias concentrações (50, 100, 200 e 500 µg/mL) em linhas celulares BT-474, Caco-2 e HepG2.
Entre os extratos da tangerina, a casca foi aquela que aparenta ser mais eficiente na redução da viabilidade celular das células BT-474 após uma exposição de 48 horas, nomeadamente a fração de metanol do extrato hidro-etanólico que possui efeito dose dependente com 16 % de viabilidade para 500 µg/mL. O extrato bruto da casca apresentou compostos polifenólicos (12 mg de compostos fenólicos/kg de amostra), acompanhada por uma elevada atividade antioxidante (322 e 327 mmol trolox/kg de amostra, para o extrato bruto hidro-etanólico e aquoso respetivamente). A fração obtida por eluição com metanol no fracionamento por extração em fase sólida apresentavam valores superiores de compostos fenólicos (56 e 55 mg de compostos fenólicos/kg de amostra), tendo atividade antioxidante de 1638 e 1337 mmol trolox/kg de amostra, para o extrato hidro-etanólico e aquoso respetivamente.
iv
Na casca da chila, os teores em polifenóis e atividade antioxidante também aumentaram para a fração obtida por eluição com metanol no fracionamento, por extração em fase sólida, de 7 para 43 mg de compostos fenólicos/kg de amostra e 68 para 1200 mmol trolox/kg de amostra para o extrato hidro-etanólico e de 76 para 902 mg de trolox/kg de amostra para o extrato aquoso. Os melhores valores foram obtidos com a exposição de 72 horas nas células BT-474, para ambos os extratos da fração aquosa (42 e 50 %, hidro-etanólico e aquoso) e para o hidro-etanólico da fracção do metanol (dose dependente, 3 % a 500 µg/mL).
Assim com este trabalho conclui-se que a casca de chila e casca de tangerina, especialmente, a fração obtida por eluição com metanol após o fracionamento por extração em fase sólida em fase reversa, podem constituir uma fonte de polifenóis bioativos, evidenciado pela elevada atividade na viabilidade das células BT-474, apresentando assim um potencial efeito quimiopreventivo e/ou mesmo terapêutico.
Palavra-chave: Citrus reticulata; Cucurbita ficifolia; polifenóis; atividade
v
Abstract
Since the earliest times, plants are used as medicines to treat certain diseases. With the rising of awareness for a healthier life practice, the interest in Traditional Chinese Medicine has been increasing due to their pharmacological benefits. The Citrus reticulate Blanco, known for tangerine and Cucurbita ficifolia, the fig leaf squash, are examples of fruit used in traditional medicine, being described to have antioxidant, anti-carcinogenic, antidiabetic effects, etc.
Due to the high demand for these fruits, especially the tangerine, it is produced worldwide millions of tons of organic waste per year. These sub-products, composed mainly by peels, seeds and pulp, are considered a potential source of bioactive compounds, they have a high potential to the phytopharmaceutical industries because of their high content in polyphenols, mostly flavonoids.
The objectives of this research ware the preparation and characterization of crude extracts, aqueous and hydro-ethanolic, and respective fractions obtained by fractionation SPE solid phase extraction on reverse phase (methanol and aqueous fraction) of peel, pulp and juice of tangerine and peel of fig leaf squash., as well as evaluate the in vitro bioactivity, measures as cell viability, resulting from exposure (24, 48 and 72 hours) of three different cell lines to the various extracts at various concentrations (50, 100, 200 and 500 mg / mL) using cell lines BT- 474, Caco-2 and HepG2.
Among the extracts, tangerine peel was the one that appears to be more effective in reducing cell viability on BT-474 cells, after 48 hour exposure, namely the methanolic fraction of hydro-ethanolic extract showing a dose dependent effect with 16 % viability with 500 μg/mL. The crude extract of peel showed polyphenolic compounds (12 mg phenolic compounds/ kg sample) accompanied by a elevated antioxidant activity (322 and 327 mmol trolox/ kg sample, to the crude hydro-ethanolic and aqueous extract respectively). The fraction obtained by elution with methanol in fractionation by solid phase extraction had higher amounts of phenolic compounds (56 and 55 mg of phenolics / kg sample) and antioxidant activity of trolox 1638 and 1337 mmol / kg sample for the hydro-ethanolic extract and aqueous respectively.
vi
In the fig leaf squash peel, the levels of polyphenols and antioxidant activity also increased for the fraction obtained by elution with methanol in fractionation by solid phase extraction , from 7 to 43 mg of phenolic compounds / kg sample and 68 to 1200 mmol trolox / kg sample for the hydro ethanolic extract and 76 to 902 mg of trolox / kg sample for the aqueous extract . The best values were obtained with exposure of 72 hours using BT-474 cells, for both extracts from the aqueous fraction (42 and 50 %, hydro-ethanolic and aqueous) and the methanol fraction hydro-ethanolic (dose dependent, 3 % to 500μg /mL).
With this work it is concluded that the tangerine peel and fig leaf squash peel , especially the fraction obtained by elution with methanol after fractionation by solid phase extraction reversed phase, can be a source of bioactive polyphenols, evidenced by high activity on the viability of BT-474 cells, thus presenting a potential chemopreventive and / or even therapeutic effect.
Keyword: Citrus reticulata; Cucurbita ficifolia; polyphenols; antioxidant activity; antiproliferative activity; BT -474; Caco-2; HepG2.
vii
Índice
Agradecimentos ... i Resumo ... iii Abstract ... v Índice de figuras ... xiÍndice de tabelas ... xiii
Abreviações ... xv
1. Introdução ... 3
1.1. Caracterização dos frutos tangerina e abóbora chila ... 3
1.1.1. A tangerina (Citrus reticulata Blanco) ... 3
1.1.2. A abóbora chila (Cucurbita ficifolia Bouché) ... 4
1.2. Modos de utilização da tangerina e da chila ... 5
1.2.1. Utilização na alimentação ... 5
1.2.2. Utilização na saúde ... 5
1.2.3. Utilização destes frutos na indústria e aproveitamento dos resíduos ... 7
1.3. Fitoquímicos (compostos bioativos) e o seu papel no stresse oxidativo ... 8
1.3.1. O stresse oxidativo ... 8
1.3.1.1. Papel das espécies reativas ... 9
1.3.1.2. Sistema de defesa antioxidante ... 11
1.3.2. Fitoquímicos (compostos bioativos) ... 12
1.3.2.1. Importância económica dos fitoquímicos ... 13
1.3.2.2. Compostos fenólicos ... 13
1.3.2.2.1. Flavonóides ... 14
1.3.2.2.2. Ácidos fenólicos... 15
1.4. Compostos bioativos presentes nos frutos em estudo ... 16
viii
1.4.2. Compostos bioativos da C. ficifolia ... 18
1.5. Estudos in vivo e in vitro sobre os efeitos dos compostos bioativos presentes nos frutos em estudo ... 20
1.5.1. Efeitos de bioativos da C. reticulata ... 20
1.5.1.1. Efeito antioxidante ... 20
1.5.1.2. Efeito anti-fúngico ... 22
1.5.1.3. Efeito anti-inflamatório ... 22
1.5.1.4. Efeito anti-carcinogénico ... 23
1.5.2. Efeito dos compostos bioativos da Cucurbita ficifolia ... 25
1.5.2.1. Efeito antioxidante e antidiabéticos ... 25
1.6. Culturas de células ... 26
1.6.1. Avaliação da citotoxicidade ... 27
1.6.2. Linhas celulares ... 32
1.7. Objetivos do presente estudo ... 33
2. Material e Métodos ... 37
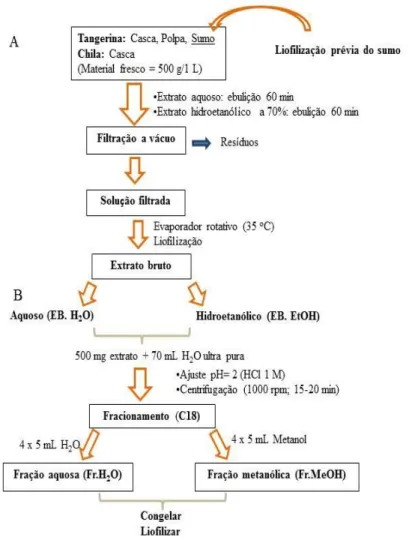
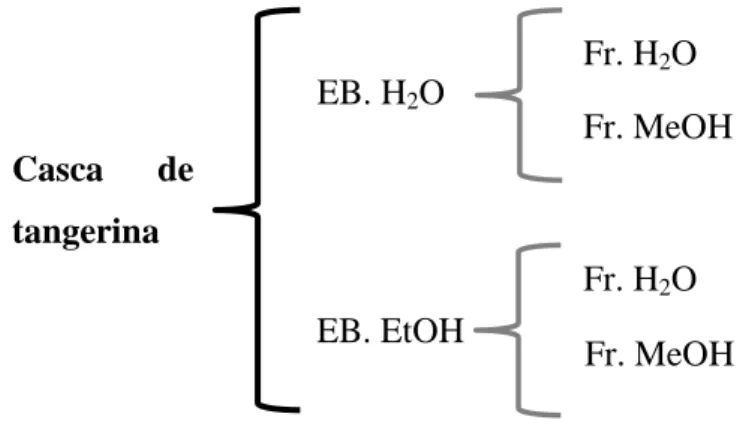
2.1. Obtenção dos extratos brutos e respetivo fracionamento ... 37
2.2. Caracterização dos extratos brutos e dos seus fracionamentos ... 39
2.2.1. Análise dos polifenóis ... 39
2.2.2. Cromatografia líquida de alta eficiência (HPLC) ... 40
2.2.3. Determinação da atividade antioxidante ... 41
2.2.4. Determinação dos açúcares totais ... 43
2.3. Aplicação dos extratos a células em culturas ... 45
2.3.1. Linhas celulares usadas: características e manutenção ... 45
2.3.2. Preparação das soluções mãe dos extratos/fracionamento ... 46
2.3.2. Ensaio de viabilidade celular: ensaio do Alamar blue (AB) ... 47
3. Resultados e Discussão ... 53
ix
3.1.1. Rendimentos obtidos ... 53
3.1.2. Caracterização dos extratos C. reticulata ... 54
3.1.2.1. Análise dos polifenóis totais por espetrofotometria ... 54
3.1.2.2. Análise do perfil fenólico por HPLC... 56
3.1.2.3. Análise da atividade antioxidante ... 65
3.1.2.4. Quantificação dos açúcares totais ... 67
3.1.3. Aplicação dos extratos a células em cultura ... 70
3.1.3.1. Exposição das células aos extratos da casca de tangerina ... 71
3.1.3.2. Exposição das células aos extratos da polpa de tangerina ... 72
3.1.3.3. Exposição das células aos extratos do sumo de tangerina ... 74
3.2. Obtenção de extratos a partir da casca de C. ficifolia... 76
3.2.1. Rendimentos obtidos ... 76
3.2.2. Caracterização dos extratos da C. ficifolia ... 76
3.2.2.1. Análise dos polifenóis totais por espetrofotometria ... 76
3.2.2.2. Análise do perfil fenólico por HPLC... 77
3.2.2.3. Análise da atividade antioxidante ... 80
3.2.2.4.Quantificação dos açúcares totais ... 80
3.2.3. Aplicação dos extratos em culturas de células ... 81
4. Conclusão gerais ... 89
4.1. Extratos da C. reticulata: características e propriedades ... 89
4.2. Extratos da C. ficifolia: características e propriedades ... 91
4.3. Estudos futuros ... 92
xi
Índice de figuras
Figura 1.1. A tangerina e classificação da planta que produz este fruto, Citrus reticulata. ... 4 Figura 1.2. A abóbora chila e classificação da planta que produz este fruto, C. ficifolia. ... 5 Figura 1.3. Estrutura química de um flavonóide (em particular, uma flavona). ... 14 Figura 1.4. Estrutura química dum ácido benzóico, dum ácido cinâmico e duma cumarina. . 16 Figura 1.5. Estrutura química da nobiletina, tangeritina e 5-metilnobiletina. ... 22 Figura 1.6. Estrutura da nobiletina, sinensetina, isosinensetina e tetraetil-o-isoescutelareina. ... 25 Figura 1.7. Conversão de piruvato a lactato pela enzima LDH. Notar que esta reação é reversível, dependendo dos substratos presentes no meio. ... 29 Figura 1.8. Redução da resazurina à resofurina pelos equivalentes redutores de células viáveis (metabolicamente ativas). ... 30 Figura 2.1. Esquema do procedimento realizado para a obtenção dos extratos brutos (A). Esquema do procedimento para a obtenção dos extratos fracionados (B). ... 38 Figura 2.2. Ilustração dos extratos obtidos e seus fracionamentos, bem como as designações que estes terão ao longo do texto. ... 39 Figura 2.3. Esquema do procedimento usado para a avaliação dos polifenóis totais. ... 40 Figura 2.4. Esquema do ensaio para determinação da atividade antioxidante usando o método ABTS. ... 42 Figura 2.5. Esquema do procedimento da hidrólise ácida dos açúcares das amostras e do seu manuseamento até à sua injeção na coluna de cromatografia de troca iónica. ... 44 Figura 2.6. Esquema típico da aplicação dos extratos nas microplacas, P1 verde e P2 branco (ver tabela 2.2.). ... 48 Figura 3.1. Cromatograma obtido para o extrato bruto e Fr.MeOH da casca de tangerina. ... 57 Figura.3.2. Cromatograma obtido para o extrato bruto e Fr.MeOH da polpa de tangerina. ... 60 Figura 3.3. Cromatograma obtido para o extrato bruto e frações do metanol e aquosa do sumo de tangerina. ... 62
xii
Figura 3.4. Efeito da exposição de 48 horas aos extratos de casca tangerina e seu fracionamento, nas 3 linhas celulares. ... 71 Figura 3.5. Efeito da exposição de 48 horas aos extratos de polpa tangerina e seu fracionamento, nas 3 linhas celulares. ... 73 Figura 3.6. Efeito da exposição de 72 horas a Fr.MeOH do extrato aquoso da polpa de tangerina (8) na linha celular BT-474. ... 74 Figura 3.7. Efeito da exposição de 48 horas aos extratos do sumo tangerina, nas 3 linhas celulares. ... 75 Figura 3.8. Cromatograma obtido para o extrato bruto e Fr.MeOH da casca de chila. ... 77 Figura 3.9. Efeito da exposição de 48 horas aos extratos (aquoso e hidro-etanólicos) e fracionamentos da casca de chila nas 3 linhas celulares. ... 83 Figura 3.10. Efeito da exposição de 72 horas aos extratos na linha BT-474. ... 84
xiii
Índice de tabelas
Tabela 1.1. Exemplos de espécies reativas (adaptado de Halliwell 2006). ... 10
Tabela 1.2. Composição química em flavonóides (PMFs, FG e flavonóis) na casca, sumo, sementes e polpa de C. reticulata (García et al 2012; Moulehi et al 2012, Sun et al 2010; Stuetz et al 2010 e Xu et al 2008). ... 17
Tabela 1.3. Composição química em ácidos fenólicos na casca, sumo, sementes e polpa de C. reticulata, (Du et al 2010 ; Moulehi et al 2012 e Tounsi et al 2010). ... 18
Tabela 1.4. Composição química da polpa, casca e sementes das espécies, C. pepo, C. moschata e C. maxima (tabela adaptada de (Kim et al 2012)). ... 19
Tabela 1.5. Composição em tocoferol e carotenóides na polpa, casca e sementes das espécies, C. pepo, C. moschata e C. maxima (tabela adaptada de (Kim et al 2012)). ... 19
Tabela 1.6. Composição em carotenóides na polpa das espécies C. pepo, C. moschata e C. maxima (tabela adaptada de (Kurz et al 2013)). ... 19
Tabela 1.7. Composição química em flavonóides e ácidos fenólicos da C. pepo (tabela adaptada de (Iswaldi et al 2013)). ... 20
Tabela 2.1. Soluções mãe dos extratos: brutos e fracionados, utilizados. ... 47
Tabela 2.2. Monitorização da viabilidade celular do ensaio AB. ... 48
Tabela 3.1. Rendimento obtido para os extratos brutos da C. reticulata. ... 53
Tabela 3.2. Rendimento obtido após o fracionamento dos extratos brutos de C. reticulata usando uma coluna C18. ... 54
Tabela 3.3. Quantificação dos polifenóis totais (PT) presentes nos extratos brutos obtidos da C. reticulata. ... 55
Tabela 3.4. Quantificação dos polifenóis totais (PT) presentes nas fração metanólica e aquosa dos extratos hidro-etanólicos e aquosos da C. reticulata. ... 55
Tabela 3.5. Identificação e áreas dos compostos fenólicos presentes no extrato bruto e Fr.MeOH da casca de tangerina (* p< 0.05). ... 57
Tabela 3.6. Espetros caraterísticos usados na identificação dos compostos fenólicos presentes nas amostras de C. reticulata. ... 58
xiv
Tabela 3.7. Identificação dos compostos fenólicos presentes no extrato bruto e Fr.MeOH da casca de tangerina. ... 60 Tabela 3.8. Identificação dos compostos fenólicos presentes no extrato bruto, Fr.MeOH e Fr.H2O do sumo de tangerina. ... 62 Tabela 3.9. Avaliação da atividade antioxidante nos extratos brutos da C. reticulata. ... 66 Tabela 3.10. Avaliação da atividade antioxidante na fração metanólica e aquosa, após fracionamento das extrações aquosas e hidro-etanólicas da C. reticulata. ... 66 Tabela 3.12. Percentagem de açúcares (monossacáridos) presentes nos extratos brutos de casca de tangerina e na sua Fr.H2O, após a hidrólise ácida dos mesmos. ... 67 Tabela 3.13. Percentagem de açúcares (monossacáridos) presentes nos extratos brutos de polpa de tangerina e na sua Fr.H2O, após a hidrólise ácida dos mesmos. ... 69 Tabela 3.14. Percentagem de açúcares (monossacáridos) presentes nos extratos brutos de sumo de tangerina e na sua Fr.H2O, após a hidrólise ácida dos mesmos. ... 69 Tabela 3.15. Rendimento da extração aquosa e hidro-etanólica e dos seus fracionamentos da
C. ficifolia. ... 76
Tabela 3.16. Quantificação dos polifenóis totais (PT) presentes nos extratos brutos e seu fracionamento de C. ficifolia. ... 77 Tabela 3.17. Identificação dos compostos fenólicos presentes no extrato bruto e Fr.MeOH da casca de chila. ... 78 Tabela 3.18. Espetros caraterísticos usados na identificação dos compostos fenólicos presentes nas amostras da C. ficifolia. ... 78 Tabela 3.19. Avaliação da atividade antioxidante nos extratos e fracionamentos da casca de C.
ficifolia. ... 80
Tabela 3.20. Percentagem em monossacáridos presentes nos extractos brutos (hidro-etanólico e aquoso) e, após o seu fracionamento, na fração aquosa da casca de chila. ... 81
xv
Abreviações
AB Alamar Blue
ABTS 2,2’-azino-bis (ácido 3-etillbenzotiazoline-6-sulfónico) BHA Hidroxianisol butilado
BHT Hidroxitolueno butilado
CAT Catalase
CBB Coosmassie Brillant Blue
COX-2 Ciclo-oxigenase
CUPRAC Capacidade antioxidante - (Cupric ion reducing antioxidant capacity) DPPH 2,2-difenil-1-picril-hidrazila
EB.EtOH Extrato bruto hidro-etanólico EB.H2O Extrato bruto aquoso
FG(s) Flavanona(s) glicosilada(s) Fr.MeOH Fração metanólica
Fr.H2O Fração aquosa
FRAP Poder antioxidante - (Ferric reducing antioxidant power) GPx Glutationa peroxidase
GR Glutationa redutase GSH Glutationa reduzida
GSSG Glutationa oxidada
GSTs Glutationa transferase
iNOS sintase do óxido nítrico induzível LDH Lactato desidrogenase
LDL Lipoproteína de baixa densidade (Low-density lipoprotein) MTT Brometo de 3-[4,5-dimetiltiazol-2-il] -2,5-difeniltetrazólio ORAC Capacidade de absorção - (Oxygen radical absorbance capacity) PGE2 Prostaglandina E2
xvi
PT Polifenóis totais
RNS Espécies reativas de azoto (Reactive Nitrogen Species) ROS Espécies reativas de oxigénio (Reactive Oxigen Species) SO Stresse oxidativo
SOD Superóxido dismutase STZ Estreptozotocina
TRAP Potencial antioxidante - (Total reactive antioxidant potential)
Capítulo 1
3
1. Introdução
No decorrer dos anos, tem-se verificado um aumento da consciência humana para uma prática de vida mais saudável, recorrendo à ingestão preferencialmente de produtos frescos, por exemplo frutas e legumes, tanto para uma dieta rica em fibras, vitaminas e sais minerais como para a prevenção contra determinadas patologias. A utilização da alimentação com vista à obtenção de fitoquímicos ou fito-nutrientes tem revolucionado vários setores, desde a agricultura para a sua produção até à investigação científica para se conhecerem e entenderem a natureza e as propriedades desses compostos. Por outro lado, tem-se descoberto que grande parte dos fitoquímicos não se encontram propriamente nas partes destes alimentos que usualmente se costumam ingerir, sendo as cascas e outros resíduos também grandes fontes de fito-nutrientes. Entre a vasta gama de vegetais, podemos destacar os citrinos e as abóboras, nomeadamente a tangerina e a chila. Sendo sobre estes que incide a investigação para a dissertação de mestrado.
1.1. Caracterização dos frutos tangerina e abóbora chila 1.1.1. A tangerina (Citrus reticulata Blanco)
O género Citrus engloba cerca de 17 espécies de frutas cítricas, entre as quais: C.
sinensis L. (laranja doce), C. aurantium L. (laranja-azeda), C. lemon L. (limão), C. reticulata
Blanco (tangerina), C. paradisi Macfad (toranja), C. megaloxycarpa Lush, C. ichangensis Swingle (limão Ichang) e C. latipes Tanaka, que se localizam em regiões com climas temperados e tropicais (Chutia et al 2009). Estas espécies são originárias da Ásia, prevalecendo na China, verificando-se também o impacto económico e ambiental da sua exploração no Brasil assim como em países mediterrânicos (Espanha, Itália, Grécia, Egipto, Turquia, Marrocos e Tunísia (Aguilar et al 2010 e Tounsi et al 2010) e Portugal).
Os frutos destas espécies, para além de serem uma fonte de ácido ascórbico, ácido fólico, minerais, fibras entre as quais as pectinas, contêm fitoquímicos considerados como compostos bioativos, incluindo essencialmente polifenóis (como os ácidos fenólicos, flavonóides e também carotenóides) essenciais para o reforço do organismo contra agressões e prevenção de patologias (Aruoma et al 2012, Ho et al 2008, Moulehi et al 2012 e Tripoli et
4
Entre os vários citrinos, a tangerina é a espécie mais resistente a temperaturas baixas. As suas árvores são de pequeno porte podendo atingir até 5 metros de altura, produzindo folhas pequenas e alongadas até 7 centímetros de comprimento, a sua classificação encontra-se descrita na figura 1.1. O fruto formado apreencontra-senta a cor laranja (Mazzini et al 2009).
Figura 1.1. A tangerina e classificação da planta que produz este fruto, Citrus reticulata.
1.1.2. A abóbora chila (Cucurbita ficifolia Bouché)
As cucurbitaceaes surgiram há milhares de anos na América, a abóbora chila ou gila (C.
ficifolia Bouché) surgiu mais especificamente no México. Este género inclui cerca de 15
espécies. Para além da C. ficifolia, existe uma grande variedade de abóboras, tais como: C.
maxima Duchesne (abóbora-menina ou abóbora-grande), C. moschata Duchesne (abóbora
cheirosa), C. pepo L. (abobrinha ou curgete) e C. argyrosperma Huber. Com a exceção da C.
ficifolia, todas as abóboras citadas são sensíveis às geadas, consequentemente, as suas zonas
de cultivo localizam-se em zonas temperadas ou quentes. As abóboras possuem um baixo valor calórico, sendo ricas em água e em carotenos, contendo fibras e vários iões (cálcio, fósforo, ferro, sódio e potássio) (Barroso et al 2007).
A C. ficifolia, mais conhecida por Chila ou por “Chilacayote”, no México, é tolerante a temperaturas baixas, pelo que é capaz de se desenvolver no inverno ao contrário das outras abóboras. A chila não apresenta elevada diversidade morfológica nem genética. Ao nível morfológico, apresenta um pedúnculo duro, ligeiramente anguloso e campanulado. Apresentando um caule igualmente duro mas estriado, com folhas lobuladas e redondas. É a única abóbora que possui sementes pretas (ou mais raramente castanhas). É uma planta trepadeira ou rasteira com crescimento anual que atinge um comprimento máximo 10 metros,
5
o seu fruto imaturo assemelha-se a uma esfera com um diâmetro entre 15 a 25 centímetros. O fruto maduro apresenta uma casca dura de cor verde com manchas ou tiras brancas. Relativamente à polpa, esta é branca. A chila é um alimento com baixo valor calórico, 100 g de chila correspondem a 14 kcal, contém fibras, proteínas, cálcio, ferro, ácido ascórbico e tiamina (Barroso et al 2007, Cetto et al 2005 e Patino et al 2005).
Figura 1.2. A abóbora chila e classificação da planta que produz este fruto, C. ficifolia.
1.2. Modos de utilização da tangerina e da chila
A utilização da tangerina e da chila vai muito além da alimentação. Obviamente que grande percentagem engloba a alimentação mas também se observa a utilização destes frutos na saúde, ao nível industrial tanto alimentar como farmacêutica, cosmética entre outros.
1.2.1. Utilização na alimentação
Além da ingestão direta, a C. reticulata é frequentemente utilizada para a confecção de sobremesas e de alguns pratos, compotas e também para sumos mesmo não sendo tão habitual como o sumo de laranja.
A C. ficifolia também é utilizada para sobremesas, doces cristalizados e compotas. Contrariamente, às outras espécies de abóbora não é usual recorrer à chila para a confeção de pratos.
1.2.2. Utilização na saúde
Desde os tempos mais antigos que o Homem utiliza determinadas partes das plantas para curar várias maleitas. Atualmente, as plantas continuam a despertar a atenção da comunidade científica, devidas às suas propriedades fitoquímicas e ao seu papel
químico-6
preventivo. Visando a adição ou mesmo a substituição de fármacos, por determinadas plantas como terapia alternativa (Jung et al 2007). Neste sentido, o interesse pela medicina tradicional Chinesa tem-se expandido nas últimas décadas devido aos seus comprovados benefícios farmacológicos e para além disso devido à sua baixa toxicidade e reduzidas complicações (Su
et al 2008).
A C. reticulata é amplamente utilizada na medicina tradicional Chinesa devido ao seu efeito carcinogénico (reduz a proliferação de algumas células), mutagénico, anti-inflamatório, antioxidante, anti-tumoral, anti-aterosclerose, na redução da expetoração, também tem sido usada por promover o fluxo de energia do fígado, para o tratamento da indigestão, asma, bronquite e vómito (Ho e Lin 2008, Jung et al 2007 e Sun et al 2010).
A medicina tradicional Chinesa usa C. reticulata em várias preparações para diversas aplicações medicinais, que tendo por basefatores, tais como grau de amadurecimento, cultivar e parte usada, têm designações diferentes (Li et al 2012, Su et al 2008 e Zhou et al 2009):
Chen- Pi: casca seca do fruto maduro.
Guang- Chen-Pi: pericarpo seco e maduro da cultivar “Chachi”.
Hu-Qi-Yin: mistura de 7 ervas incluindo a tangerina que possuem efeitos na inibição da atividade da proliferação celular.
Qing- Pi: casca seca e imatura de C. reticulata Blanco.
Na medicina tradicional, em várias regiões do globo, principalmente no continente Asiático, é comum a utilização da C. ficifolia como tratamento da Diabetes Mellitus (Xia et al 2006, 2007, 2009). No México, onde se verifica uma elevada taxa de pacientes com Diabetes
Mellitus, também é frequente a utilização da chila para auxílio no tratamento de doentes
diabéticos tipo 2 (macerar o fruto fresco com água e ingerir) (Aguilar et al 2002). É igualmente usado a C. ficifolia para curar feridas e para o tratamento de hemorroides e febre (Aguilar et al 2002).
A C. ficifolia, assim como a C. pepo, C. maxima, C. moschata possuem atividade diabética e antioxidante. As abóboras, dum modo geral, também possuem atividade anti-microbiana, anti-mutagénica, anti-carcinogénica, imuno-moduladora e atividade hipocolesterolémica (Caili et al 2006).
7
1.2.3. Utilização destes frutos na indústria e aproveitamento dos resíduos
Os frutos cítricos são uma produção de grande importância económica, de facto é o setor de frutas com maior produção. Cerca de 80% da colheita destes frutos é usada pela indústria alimentar de modo a obter sumo (Moulehi et al 2012). Durante o processo de extração do sumo, mais de metade do peso do fruto (55%) não é aproveitado, nomeadamente casca, resíduos membranares e celulares bem como sementes, contribuindo para a formação de subprodutos, que são ricos em compostos bioativos (Khan et al 2010; Moulehi et al 2012; Raman et al 2005). Alguns destes subprodutos podem ser utilizados para a produção de melaço, óleos essenciais até mesmo para alimentação de gado quando desidratados mas não podendo ser utilizados como fertilizantes orgânicos pois o seu elevado teor em compostos fenólicos provoca a inibição do processo de germinação (Chen et al 2012; Raman et al 2005). Assim, as cascas podem representar um potencial material não só para a indústria alimentar mas principalmente para a indústria farmacêutica (e/ou fitofarmacêutica) devido às potenciais propriedades dos componentes bioativos na saúde (Ma et al 2008).
O consequente aumento da procura de frutas cítricas tem-se refletido num aumento de resíduos orgânicos, que têm um impacto negativo sobre o ambiente. Estes resíduos são um perigo iminente, pois aumentam consideravelmente a carência química e bioquímica de oxigénio nos efluentes, dificultando a sua eliminação prejudicando o meio ambiente (Raman
et al 2005). No mundo inteiro são produzidas anualmente mais de 100 milhões de toneladas
de resíduos de frutas cítricas (Moulehi et al 2012).
A utilização da chila é predominante nos países mediterrânicos, sendo escassos os dados relativamente ao seu uso ao nível industrial bem como aos seus resíduos produzidos.
A indústria alimentar DouroMel (sediada em Trás-os-Montes) aponta para um desperdício de chila na ordem dos 64% correspondendo a 33.265,00 toneladas de casca, já a tangerina apresenta 7,4 % de desperdício com cerca de 1.500,00 toneladas de desperdício (sumo do produto aquando picado e tangerinas de pequenas dimensões).
8
1.3. Fitoquímicos (compostos bioativos) e o seu papel no stresse oxidativo
Em situação de normalidade, os organismos aeróbios precisam de oxigénio para a produção de energias nas mitocôndrias, contudo as células produzem constantemente substâncias, radicais livres, que podem promover o stresse oxidativo (SO) (Halliwell 2006). Os radicais livres, uma vez produzidos, podem ser eliminados por sistemas de defesa antioxidante das células, por mecanismos de defesa enzimáticos ou não enzimáticos, podendo ser fornecidos pela alimentação. O equilíbrio entre a produção e eliminação dos radicais livres é fundamental para o bom funcionamento do organismo. Quando a célula está parente uma situação de desequilíbrio, com elevada produção de radicais livres a célula pode entrar uma situação de SO se os mecanismos de defesa não forem eficientes (Ferreira e Abreu 2007).
O facto de o ser humano e grande parte dos animais serem organismos aeróbios, e consequentemente terem a necessidade inata de estar em ambientes com oxigénio para a sua sobrevivência, devido a importância do oxigénio no metabolismo e as quantidades de oxigénio necessário para o bom funcionamento do organismo, devido ao paradoxo do oxigénio, apesar de ser o predominante e mais nefasto, pensamos muitas vezes erradamente, que só existe SO devido a espécies reativas de oxigénio (ROS; Reactive Oxigen Species). Contudo, como veremos a posteriori, existem outras, obviamente devido a sua importância, daremos mais ênfase aos ROS.
1.3.1. O stresse oxidativo
O SO pode ser definido como um desequilíbrio de pró-oxidantes e antioxidantes no organismo devido a dois tipos de causas (Chen et al 2012):
Naturais, causas internas ao organismo, tal como exercício físico extremo ou processos de inflamação, e
Não naturais, externas ao organismo, tal como a presença de xenobióticos. Este desequilíbrio pode ter origem numa produção anormal de espécies reativas, pela diminuição da defesa antioxidante ou até mesmo pelo aumento de moléculas biológicas suscetíveis à oxidação e exposição a diversos agentes tóxicos ou patogénicos (Santos et al 2007). Quando este equilíbrio falha, verifica-se uma cascata de acontecimentos que podem levar à morte celular.
9
1.3.1.1. Papel das espécies reativas
Um radical livre pode ser qualquer espécie que possua um eletrão ou eletrões desemparelhados, com capacidade de existência própria e independente, apresentando desta forma uma elevada reatividade para com outras espécies químicas (Ferreira e Abreu 2007; Halliwell 2006). Os radicais livres podem ser provenientes de moléculas radicalares (radicais) ou não radicalares.
Os principais pró-oxidantes são os ROS (Chen et al 2012), podendo também haver outras espécies reativas como as de azoto (RNS; Reactive Nitrogen Species), cloro e bromo como podemos visualizar na tabela 1.1.
A formação dos ROS ocorre em vários compartimentos, tais como na mitocôndria, lisossomas, peroxissomas, núcleo, retículo endoplasmático, no citoplasma e nas membranas plasmáticas (Santos et al 2007).
O oxigénio molecular é um potente agente oxidante e um radical livre que possui dois eletrões desemparelhados (Halliwell 2006). Dos radicais livres que provêm do oxigénio, podemos destacar o anião superóxido (O2•) produzido em vários sistemas enzimáticos e ao nível das mitocôndrias, devido à fuga de eletrões (1 a 3%) da cadeia transportadora de eletrões. O O2• é considerado um ROS primário que pode interagir com outras espécies reativas, tais como o peróxido de hidrogénio (H2O2) e o radical hidroxilo (OH•).
Entre os ROS secundários, o radical OH• por de possuir um reduzido tempo de vida é o mais reativo, causando desta forma maior dano principalmente ao nível do DNA, danificando as bases azotadas (purinas e pirimidinas) e a estrutura do açúcar (desoxirribose). Se os danos causados ao nível do DNA não forem reparados, podem ocorrer mutações com consequências graves, principalmente se forem mutações permanentes ao nível de sequências consensus, alterando toda a maquinaria genética sendo o primeiro passo para o aparecimento do cancro (Ferreira e Abreu 2007).
O principal RNS é o radical óxido nítrico (NO•), produzido em tecidos biológicos pela oxidação da arginina através da enzima óxido nítrico sintase. Este radical é essencial para numerosos processos de sinalização fisiológicos: neurotransmissão, regulação da pressão sanguínea, mecanismos de resposta imunitária (defesa e regulação). Um excesso desse radical
10
pode provocar a inibição da função das proteínas através de nitrosilação das mesmas (Ferreira e Abreu 2007).
Tabela 1.1. Exemplos de espécies reativas (adaptado de Halliwell 2006).
Durante o processo da resposta inflamatória, o organismo pode produzir um forte agente oxidante, derivado da conjugação de dois radicais livres ligados covalentemente, o anião O2• e o radical NO• dando origem ao peroxinitrilo (ONOO), por sua vez este, provoca a
Espécie reativa Radicalares Não radicalares
Oxigénio
Superóxido O2•
Hidroxilo OH• Hidroperoxilo HO2•
Radical dióxido de carbono CO2
•
Carbonato CO3•
Peróxido de hidrogénio H2O2
Ácido hipocloroso HOCl Ácido hipobromoso HOBr
Peroxinitrito ONOO Ácido peroxinitroso ONOOH Peroxomonocarbonato HOOCO2 Ozono O3 Azoto Oxido nítrico NO• Dióxido de azoto NO2• Nitrato NO3•
Ácido nitroso HNO2
Peroxinitrito ONOO Ácido peroxinitroso ONOOH Peroxomonocarbonato HOOCO2
Tetróxido de azoto N2O4
Trióxido de azoto N2O3
Cloreto de nitrilo NO2Cl
Nitrato peroxiacetilo CH3C(O)OONO2
Cloro Átomo cloro Cl•
Ácido hipocloroso HOCl Cloreto de nitrilo NO2Cl
Cloreto de bromo BrCl Dióxido de cloro ClO2
Bromo Átomo bromo Br• Ácido hipobromoso HOBr
11
fragmentação do DNA, a oxidação dos lípidos, danos nas proteínas e danos por sofrer fissão homolítica originando produtos mais nocivos (Ferreira e Abreu 2007; Halliwell 2006).
Assim, em baixas concentrações as espécies reativas são importantes pois estão envolvidas em vários processos fisiológicos que permitem manter a homeostase. Numa situação de equilíbrio, ou seja sem SO, estas concentrações reduzidas são obtidas através de mecanismos de defesa. Em elevadas concentrações, as espécies reativas têm como principais alvos as membranas lipídicas através da peroxidação lipídica, as proteínas, os glúcidos e os ácidos nucleicos. Estando, as espécies reativas, por de traz de várias patologias, como doenças cardiovasculares, desordens do foro neurológico, vários tipos de cancros, doenças crónicas, doenças hepáticas, aterosclerose, até o envelhecimento (Ferreira e Abreu 2007).
1.3.1.2. Sistema de defesa antioxidante
O sistema de defesa antioxidante encontra-se espalhado por todo o organismo, tanto no meio intracelular como no meio extracelular. Encontrando-se uma grande concentração destes sistemas nas mitocôndrias uma vez que são o primeiro local da formação dos radicais (Ferreira e Abreu 2007).
Assim, o sistema de defesa antioxidante têm como função (Halliwell 2006):
Manter baixos os níveis dos radicais livres,
Minimizar os efeitos tóxicos do excesso de oxigénio impedindo a conversão para ROS,
Permitir a alguns radicais realizar as suas funções biológicas sem causar dano.
Podendo haver duas classes de sistemas de defesa (Ferreira e Abreu 2007; Santos et al 2007):
1) Sistemas de defesa antioxidantes enzimáticos: que recorre a enzimas para a eliminação dos radicais livres. Como exemplo: SOD (superóxido dismutase), CAT (catalase), glutationa peroxidase (GPx), glutationa redutase (GR), glutationa transferase (GSTs). 2) Sistemas de defesa antioxidantes não enzimáticos: constituídos por compostos como a
12
vitamina C (ácido ascórbico), ácido úrico, glutationa (GSH), ácido lipóico, flavonóides, etc.
No interior das membranas mitocondriais existem proteínas desacopladoras, sendo um mecanismo de defesa, por impedir a formação de ROS (assim com as outras espécies reativas) pois atuam como antioxidantes. A formação de determinados radicais livres, tal como o radical O2•, ativa as proteínas desacopladoras que, consequentemente, provocam uma diminuição do potencial membranar limitando a formação deste radical.
Algumas proteínas quando ligadas a iões metálicos como o ferro e o cobre, podem atrasar a peroxidação lipídica (Halliwell 2006). No caso do ferro, quando ligado à hemoglobina, transferrina ou ferritina torna-se incapaz de reagir com H2O2. Contudo, quando este se encontra na forma livre:
Participa em várias fases da peroxidação lipídica (iniciação, reiniciação e quebra dos peróxidos lipídicos), e
Acelera o processo de formação de ROS, através do incremento da produção de OH• pelas reações de Fenton e Haber-Weiss (Santos et al 2007).
Numa situação de SO, a falha no sistema de defesa antioxidante pode desenrolar um conjunto de acontecimento muito crítico para a célula, tal como o aumento do cálcio intracelular, a inibição da síntese de ATP, esgotamento dos recursos energéticos e por último a morte celular (Santos, et al 2007).
1.3.2. Fitoquímicos (compostos bioativos)
Como vimos anteriormente, as defesas antioxidante não enzimática na maioria dos casos são obtidas através da dieta, pelo consumo de frutos e legumes. Assim moléculas que fazem parte da composição das plantas podem ter uma mais-valia para o combate dos ROS, fornecendo uma ajuda adicional, funcionando como uma defesa exogénea essencial.
Fitoquímicos são definidos como substâncias encontradas em várias partes das plantas: sementes, fruto, caule, folha e raízes, em cereais, especiarias e ervas, que quando ingeridos, podem modular o metabolismo humano de modo favorável para a prevenção de doenças crónicas e degenerativas, sendo também designados por compostos bioativos (Ferreira e
13
Abreu 2007, Tripoli et al 2007). Os compostos bioativos englobem carotenóides, ácidos
fenólicos, flavonóides, estilbenos, cumarinas, taninos, alcalóides, compostos azotados e compostos organossulforados (Ferreira e Abreu 2007).
1.3.2.1. Importância económica dos fitoquímicos
Estudos epidemiológicos têm demonstrado um elevado potencial dos fitoquímicos para combater doenças associadas ao SO e ainda que o consumo de flavonóides na dieta tem uma relação inversa com o risco de doenças cardiovasculares (Tripoli et al 2007). Devido às propriedades farmacológicas dos flavonóides, estes compostos são conhecidos como nutracêuticos (Tripoli et al 2007).
A preocupação crescente com a saúde tem vindo a eliminar aditivos sintéticos, tais como o hidroxitolueno butilado (BHT) e o hidroxianisol butilado (BHA) muitas vezes tóxicos e até mesmo considerados carcinogénicos, substituindo estes por antioxidantes naturais como compostos presentes na casca de espécies cítricas, de modo a preservar as qualidades alimentares (Anagnostopoulou et al 2006).
Assim, subprodutos que são desperdiçados podem apresentar grandes quantidades de compostos bioativos e podendo ser reaproveitados, digamos, reciclados, pois possuem um elevado potencial para as indústrias, quer alimentar quer farmacêutica.
1.3.2.2. Compostos fenólicos
Entre os vários fitoquímicos existentes, podemos destacar os compostos fenólicos ou polifenóis. Assim, os polifenóis são compostos bioativos e como tal podem ser moléculas sintetizadas pelo metabolismo secundário das plantas, que participam na defesa contra agressões ambientais, sendo considerados fito-micronutrientes. Podem ser divididos em várias categorias, tais como, ácidos fenólicos, flavonóides e taninos (Edeas 2007). A composição fenólica, isto é a natureza e o teor dos polifenóis dos frutos e vegetais são determinadas por fatores genéticos e ambientais (variam de espécie para espécie, de órgão para órgão e dependem do grau de desenvolvimento), estando sujeitos a modificações devido a reações oxidativas (Edeas 2007; Machado et al 2008). Outros fatores abióticos podem influenciar o
14
metabolismo e a produção dos polifenóis, entre estes podemos destacar a radiação solar, raios UV, períodos de seca/chuva, nutrientes, estação do ano e ainda poluentes (Machado et al 2008).
1.3.2.2.1. Flavonóides
Os flavonóides não podem ser sintetizados pelo ser humano e portanto só podem serem adquiridos pela alimentação. A preparação dos alimentos pode levar a perdas de compostos e propriedades, contudo, os flavonóides são compostos estáveis, resistentes à oxidação, resistentes a temperaturas altas e resistentes a variações de acidez moderadas (Machado et al 2008). Os flavanóides são sintetizados pela via dos fenilpropanóides bem como pela via do chiquimato. Sendo substâncias químicas compostas por um núcleo comum de fenilcromanona com um ou mais grupos hidroxilo (Machado et al 2008). A estrutura química básica dos flavonóides consiste em quinze átomos de carbono em três anéis. Sendo dois deles anéis aromáticos (A e B) e um anel pirano (cadeia heterocíclica C) acoplado ao anel A. A numeração dos carbonos é feita com numeração árabe seguida nos anéis A e C, e com números seguidos de linha (’) no anel B, como podemos ver na figura 1.3 (Robards et al 1999).
Figura 1.3. Estrutura química de um flavonóide (em particular, uma flavona).
Consoante os diferentes substituintes em diferentes posições podemos classificar os flavonóides em: flavanonas, flavonas, flavonóis, antocianimas, chalconas e isoflavonas (Robards et al 1999). Os flavonóides podem ser encontrados na forma glicosilada ou livre. Sendo a primeira, a forma mais frequente nas plantas, ou seja flavonóides ligados a açúcares
15
tais como a ramnose e rutinose. A atividade biológica dos flavonóides depende da sua estrutura química e dos vários substituintes, a estrutura básica pode sofrer hidrogenação, esterificação, amidação, hidroxilação, metilação, malonilação, sulfatação e glicosilação influenciando a polaridade e toxicidade (Machado et al 2008; Robards et al 1999).
Várias funções são atribuídas aos flavonóides pois estes possuem atividades: antioxidante (elimina os radiais livres e atua como quelante de metais), inflamatória, anti-alérgica, anti-trombótica, anti-viral, anti-carcinogénica, antimicrobiano e hépato-protetora, proteção contra a incidência dos raios ultravioleta, ação alelopática e podendo inibir enzimas (Edeas 2007; Machado et al 2008). Alguns flavonóides são potentes inibidores da oxidação das moléculas de LDL (lipoproteína de baixa densidade, low-density lipoprotein), reduzem a agregação plaquetária, inibem a produção de tromboxano (Edeas 2007). Estes efeitos podem estar relacionados com a interação dos flavonóides com sistemas enzimáticos (hidrolases, fosfatases, isomerases, oxigenases, polimerases, etc) (Machado et al 2008).
1.3.2.2.2. Ácidos fenólicos
Os ácidos fenólicos são caraterizados por possuírem um anel benzóico, um grupo carboxílico e um ou mais grupos hidroxilos e/ou metoxilo. Assim podem ser divididos em três grupos tendo em conta a estrutura molecular (figura 1.4):
Ácidos benzóicos (C6-C1): dependendo dos grupos substituintes podemos ter ácido salicílico, gentísico, p-hidroxibenzoico, vanílico, gálico, siríngico e protocatecuico.
Ácidos cinâmicos (C6-C3): com por exemplo ácido cinâmico, caféico, ferúlico e sinápico.
Cumarinas: derivadas dos ácidos cinâmicos por ciclização da cadeia lateral do ácido o-cumárico.
16 Figura 1.4. Estrutura química dum ácido benzóico, dum ácido cinâmico e duma cumarina.
Após a análise das seções anteriores verificamos que os compostos fenólicos possuem propriedades antioxidantes, sendo capazes de eliminar os radicais livres formados, tanto pelo nosso organismo como formados pela resposta a uma agressão do ambiente. Desde modo, eles reforçam as defesas naturais contra o SO e previnem diversas patologias crónicas (cancro, doenças cardiovasculares e neurodegenerativas). Contudo, é necessário não ingerir quantidades excessivas de polifenóis pois pode produzir um efeito pro-oxidante, podendo inibir a absorção de ferro. Sendo estes não armazenados no organismo ao contrário de outros componentes das plantas tal como vitaminas e carotenóides (Edeas 2007). Assim, a maioria do tempo, os polifenóis estão em transformação química. A eficácia da absorção intestinal depende da natureza dos flavonóides, e nomeadamente da glucosilação que afeta a biodisponibilidade (Edeas 2007). Mas acima de tudo verificamos que os fitoquímicos, tais como os flavonóides tem um papel importantíssimo no ser humano que vai muito além das suas propriedades antioxidantes.
1.4. Compostos bioativos presentes nos frutos em estudo 1.4.1. Compostos bioativos da Citrus reticulata
Alguns dos compostos já identificados na casca, no sumo, nas sementes e polpa estão descritos nas seguintes tabelas, sendo estes principalmente polifenóis (Anagnostopoulou et al 2006) incluído flavonóides como flavonas polimetoxiladas (PMFs), flavanonas glicosiladas
17
(FG) e flavonóis, ácidos fenólicos e carotenóides polifenóis (Moulehi et al 2012; Tounsi et al 2011; Sun et al 2010; Stuetz et al 2010; Du et al 2010 e Xu et al 2008).
Tabela 1.2. Composição química em flavonóides (PMFs, FG e flavonóis) na casca, sumo, sementes e polpa de C. reticulata (García et al 2012; Moulehi et al 2012, Sun et al 2010; Stuetz et al 2010 e Xu et al 2008).
Compostos Casca Sumo/Polpa Sementes
5- Dimetil nobiletina x Apigenina x Crisoeriol x Didimina x x x Diosmetina x Eriodictiol x Heptametoxiflavona x Hesperidina x x x Hexametoxiflavona x Isorhamnetina x Isosakuranetina x Isosinenseina x Kaempferol x Luteolina x Naringina x x x Narirutina x x Neo-hesperedina x Nobiletina x x Quercetina x x x Rutina x x Sinensetina x x Tamarixetina x Tangeretina x x
Tetra metil o-escutelareina x
18 Tabela 1.3. Composição química em ácidos fenólicos na casca, sumo, sementes e polpa de C. reticulata, (Du et al 2010 ; Moulehi et al 2012 e Tounsi et al 2010).
Compostos:
Ácidos Casca Sumo/Polpa Sementes
Gálico x x Ferúlico x x x Trans- 2- hidroxicinâmico x x Caféico x p-coumarico x x Sinápico x x Protocatecuico x p-hidroxibenzoico x Vanílico x x Siríngico x x Rosmárico x
1.4.2. Compostos bioativos da C. ficifolia
Não existe disponível na literatura a composição química descriminada da C. ficifolia. Contudo existe a descrição de outras espécies de abóboras, tais como, C. pepo, C. moschata e
C. maxima. Observando as tabelas seguintes, facilmente conseguimos verificar que os
constituintes são muito similares variando principalmente ao nível da concentração de cada composto, e variando também pelos mesmos fatores da C. reticulata, como o clima, variedade da fruta, estado de desenvolvimento e órgão. Alterando-se desde modo a composição química de cultivar para cultivar.
19 Tabela 1.4. Composição química da polpa, casca e sementes das espécies, C. pepo, C. moschata e C. maxima (tabela adaptada de (Kim et al 2012)).
Compostos
Carbo-hidratos Proteína Fibras Humidade
C. pepo Polpa 26,23 ± 0,20 2,08 ± 0,11 3,72 ± 0,02 967,70 ± 0,15 Casca 43,76 ± 0,74 9,25 ± 0,12 12,28 ±0,15 935,98 ± 0,27 Sementes 122,20 ± 7,47 308,83± 12,06 148,42 ± 0,55 74,06 ± 0,91 C. moschata Polpa 43,39 ± 0,84 3,05 ± 0,65 7,41 ± 0,07 942,31 ± 0,08 Casca 96,29 ± 1,11 11,30 ± 0,99 34,28 ± 1,37 871,86 ± 0,09 Sementes 140,19 ± 19 298,11 ±14,75 108,51 ± 8,36 51,79 ± 6,04 C. maxima Polpa 13,53 ± 1,44 11,31 ± 0,95 10,88 ± 0,35 840,43 ± 0,17 Casca 206,78 ± 3,25 16,54 ± 2,69 22,35 ± 0,01 756,79 ± 0,44 Sementes 129,08 ± 8,25 274,85± 10,04 161,54 ± 6,79 27,51 ± 0,21
Tabela 1.5. Composição em tocoferol e carotenóides na polpa, casca e sementes das espécies, C. pepo, C. moschata e C. maxima (tabela adaptada de (Kim et al 2012)).
Tocoferol Carotenóides
α-tocoferol γ-tocoferol β-caroteno β-criptoxantina
C. pepo Polpa 1,40 ± 0,01 X 1,48 ± 0,05 X Casca 4,49 ± 0,72 0,66 ± 0,09 39,48 ±0,24 0,15 ± 0,02 Sementes 21,33 ± 3,65 61,65 ±17,66 17,46 ± 18,29 0,16±0,16 C. moschata Polpa 1,54±0,99 0,52±0,01 5,70±0,39 X Casca 6,17±2,19 X 68,30±2,02 0,13±0,03 Sementes 25,74±0,73 66,85±4,90 7,15±1,50 X C. maxima Polpa 2,31± 0,03 X 17,04±12,18 0,65±0,02 Casca 9,62±0,79 3,55±0,17 123,19±30,61 6,57±1,87 Sementes 20,79±1,33 28,70±2,13 31,40±3,02 0,21±0,06
Tabela 1.6. Composição em carotenóides na polpa das espécies C. pepo, C. moschata e C. maxima (tabela adaptada de (Kurz et al 2013)).
Carotenóides na
polpa C. pepo C. moschata C. maxima
α- caroteno x
β-caroteno x x x
Anteraxantina x
Luteína x x x
20 Tabela 1.7. Composição química em flavonóides e ácidos fenólicos da C. pepo (tabela adaptada de (Iswaldiet al 2013)).
Flavonóides Ácidos fenólicos
Isoramnetina Kaempferol Luteolina Quercetina Robinina Benzóico Caféico Caftarico Chicorico Clorogénico Ferulico p-coumárico p-hidroxibenzóico Sinápico Vanílico
1.5. Estudos in vivo e in vitro sobre os efeitos dos compostos bioativos presentes nos frutos em estudo
1.5.1. Efeitos de bioativos da C. reticulata 1.5.1.1. Efeito antioxidante
Xu e colaboradores (2008) investigaram os minerais, compostos fenólicos e a capacidade antioxidante da casca de tangerina (das cultivares Satsuma e Ponkan) através duma extração em água quente. Observaram que as cascas continham elementos maioritários como o potássio, o cálcio e o magnésio, e vestigiais tal como o cobre, ferro, zinco e manganês. Verificaram que o aumento da temperatura ou o aumento do tempo de extração pode aumentar o rendimento dos minerais obtidos, com a exceção do cobre. E ainda observaram uma melhor extração de metais quando o fruto é fervido em vez de apenas mergulhado na água quente. Identificaram nos extratos quatro flavonóides (narirutina, hesperidina (FG), e nobiletina e tangeretina (PMFs)) e sete ácidos fenólicos (4 ácidos cinâmicos: ácido caféico, p-coumárico, sinápico, ferúlico, e 3 ácidos benzóicos: protocatecuico, p-hidroxibenzóico e o ácido vanílico). Ao nível da atividade antioxidante, realizaram dois ensaios: FRAP (Ferric reducing antioxidant power) e DPPH (2,2-difenil-1-picril-hidrazila), verificaram que o tempo ou a temperatura de extração não afeta significativamente a capacidade antioxidante do extrato. Concluíram que a extração por água
21
quente é eficaz para extrair compostos antioxidantes da casca, apresentando capacidade antioxidantes semelhantes à de extratos metanólicos. Concluíram ainda, por esse processo de extração a casca de Ponkan era melhor como fonte para Chen-Pi uma vez que tinha maiores teores de ácidos fenólicos, de flavonóides e maior capacidade antioxidante que a Satsuma.
Tounsi e colaboradores (2010) avaliaram o aroma, ácidos gordos, composição fenólica, ácido ascórbico e capacidade antioxidante (por dois ensaios: DPPH e sistema β-caroteno – ácido linoleico) de quatro sumos de citrinos: laranja doce e amarga, limão e tangerina. Os componentes maioritários responsáveis pelo aroma na tangerina são limoneno, γ- e α-terpineno e α-pineno. Ainda verificaram que δ-3-careno e α-felandreno foram apenas identificados na tangerina e α-terpineol e p-cimeno-8-ol os únicos presentes nos outros sumos. Identificaram na tangerina 7 ácidos gordos, sendo este sumo aquele que possuía menor quantidade de ácidos gordos totais (16,74 µg/mL). Observaram que o sumo de tangerina era aquele que apresentava menor concentração de compostos fenólicos (106,22 mg GAE/L) e a menor atividade antioxidante. Identificaram neste sumo: 10 ácidos fenólicos (ácido gálico, sinápico, dihidrobenzóico, vanílico, sinríngico, p-comárico, ferúlico, rosmarínico, trans-2-dihidrocinâmico e ácido cinâmico) e 8 flavonóides (catequina, epicatequina galato, quercetina-3 rhamnoside, luteolina, coumarina, quercetina e amentoflavona).
Moulehi e colaboradores (2012) investigaram a composição fenólica e a atividade antioxidante das sementes de tangerina e de laranja amarga, avaliando as alterações destes parâmetros durante o processo de amadurecimento dos frutos, usando o metanol como solvente de extração. Concluíram que a composição fenólica era diferente entre os dois citrinos e que esta se alterava com o amadurecimento, tendo a tangerina maior teor em flavonóides em qualquer estágio de maturação. Em relação a capacidade antioxidante (pelo ensaio DPPH e sistema β-caroteno – ácido linoleico) ambos os frutos apresentavam atividade semelhante e esta aumentava com o grau de amadurecimento, sendo o estado maduro aquele que apresentavam maior capacidade antioxidante. Este estudo demonstrou ainda que a laranja amarga exibiu maior atividade do que a tangerina.
22
1.5.1.2. Efeito anti-fúngico
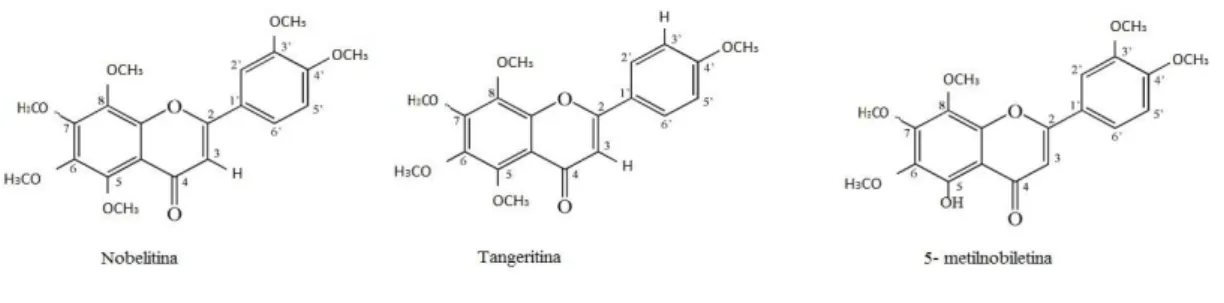
Liu e colaboradores (2012) isolaram, purificaram e identificaram PMFs da casca de Ponkan para avaliar a sua atividade antifúngica contra Aspergillus niger (contaminante fúngico comum dos alimentos) usando o ensaio de diluição microbroth. Identificaram três PMFs (figura 1.5) e verificaram que os valores de MIC (concentração inibitória mínima) foram: nobiletina 0,8 mg/L, tangeretina 0,4 mg/L e 5-demetilnobiletina com 0,1 mg/L. Neste estudo concluíram que existe uma relação entre a estrutura e a atividade antifúngica dos PMFs:
O grupo 5-OH no anel A desempenha um papel importante na atividade inibitória, produzindo maior atividade antifúngica.
A troca entre 5-OH por –OCH3 resulta numa diminuição da atividade inibitória.
O grupo metoxilo em 3’ do anel B não favorece o efeito inibitório, reduzindo a atividade antifúngica.
Em suma os PMFs têm efeito inibitório contra a Aspergillus niger, tendo um grande potencial como conservante natural.
Figura 1.5. Estrutura química da nobiletina, tangeritina e 5-metilnobiletina.
1.5.1.3. Efeito anti-inflamatório
Ho e Lin (2008) utilizaram extratos metanólicos de casca de Ponkan para investigar a duração óptima do tratamento térmico a 100 oC, de modo a aumentar a atividade anti-inflamatória. Determinaram:
O efeito da duração do tratamento térmico na eliminação da produção de NO (óxido nítrico),
23
O efeito do tratamento térmico na atividade anti-inflamatória e antioxidante (pelo método DPPH).
Observaram que quanto maior a duração do tratamento térmico:
Maior o conteúdo total de flavonóides extraídos,
Maior a capacidade de eliminação do radical DPPH,
Maior a capacidade de eliminação de NO.
Concluíram que o tempo de duração óptimo de 2 horas impulsionou a maior libertação de compostos anti-inflamatórios, aumentando deste modo a atividade anti-inflamatória e consequentemente a atividade antioxidante do extrato.
Outros investigadores (Huang e Ho, 2010) estudaram em cascas de sete frutas cítricas os principais componentes que contribuem para a atividade anti-inflamatória, neste estudo incluía-se a C. reticulata. Determinaram a quantidade de flavonóides totais e avaliaram a atividade anti-inflamatória com base na inibição da PGE2 (prostaglandina E2) e NO, usando células RAW 264.7 (linha celular de macrófagos de murganho). Demonstraram pela primeira vez, que as PMFs, especialmente a nobiletina, presentes nas cascas de citrinos, eram responsáveis pela atividade inibidora da produção de PGE2. Demostraram que estas flavonas exercem a sua atividade inibitória sobre a produção de NO e PGE2 principalmente através da regulação da transcrição dos genes COX-2 (ciclo-oxigenase-2) e iNOS (sintetase do óxido nítrico induzível). Verificaram haver correlação nos valores de PGE2 e NO às diferentes concentrações testadas, pelo que qualquer um pode ser utilizado como indicador de avaliação da atividade anti-inflamatória. Concluíram que a casca de tangerina possui elevadas quantidades de flavonóides, que são ricas em PMFs sendo estas responsáveis pela capacidade anti-inflamatória.
1.5.1.4. Efeito anti-carcinogénico
Kang e colaboradores (2005) utilizaram extratos da casca de C. reticulata Blanco imatura para avaliar o efeito apoptótico em células SNU-C4 (na linha celular de carcinoma colorretal). Após 24 horas de incubação, células tratadas com extrato, mostraram
24
características de apoptose quando utilizado a coloração DAPI e o ensaio de TUNEL. Os resultados mostram que a exposição a este extrato:
Regulou a expressão de genes reguladores da apoptose. Diminuindo a expressão de
BCl-2 (anti-apoptótico) e aumentando a expressão de Bax (pró-apoptótico).
Aumentou a expressão do gene da caspase-3 (principal gene da apoptose), assim como, a atividade da proteína caspase-3.
Induziu a morte celular nas células SNU-C4, através da via apoptótica regulada pela Bax.
O extrato de casca de tangerina modulou vias intracelulares específicas da apoptose, induzindo apoptose em células SNU-C4 e, portanto seria um possível coadjuvante no tratamento de pacientes com cancro do cólon ou na sua prevenção (Kang et al., 2005).
Du e Chen (2010) isolaram quatro PMFs de casca de tangerina (isosinensetina, sinensetina, nobiletina e tetrametil-o-escutelareina) e avaliaram o efeito anti-proliferativo em várias linhas celulares (A590, MCF-7, HL-60 e HO8910). Observaram que as células mais sensíveis aos PMF foram HO8910 e MCF-7 (linhas carcinogénicas do ovário e da mama, respetivamente). A isosinensetina foi o PMF que teve maior atividade anti-proliferativa e sinensetina a atividade menor, para todas as linhas celulares. Verificando assim que a redução da proliferação dependente da estrutura do PMF (figura 1.6):
O grupo metoxilo na posição 8 do anel A, é essencial para a atividade anti-proliferativa.
O aumento da atividade anti-proliferativa é acompanhado pelo aumento do número de grupos metoxilo no anel C.
E assim sugeriram que as cascas Ponkan são uma excelente fonte de PMFs funcionais que podem ajudar na prevenção de cancros do ovário e da mama.
25 Figura 1.6. Estrutura da nobiletina, sinensetina, isosinensetina e tetraetil-o-isoescutelareina.
1.5.2. Efeito dos compostos bioativos da Cucurbita ficifolia
Os estudos desta espécie focam-se no seu efeito hipoglicémico/antidiabético, não havendo disponível na literatura (do que foi possível apurar) estudos sobre os seus efeitos antifúngicos, antiviral, antibacteriano, antimicrobiano, inflamatório ou mesmo anti-mutagénico e anti-carcinogénico ou carcinogénico.
1.5.2.1. Efeito antioxidante e antidiabéticos
Xia e Wang (2007) recorreram a extratos de polpa da chila para investigar a sua ação hipoglicémica em ratos diabéticos induzidos com STZ (estreptozotocina), medindo os níveis de glucose, de insulina plasmáticos, o efeito na peroxidação lipídica e o número de células β pancreáticas. Observaram que o grupo de ratos diabéticos alimentados com extrato de chila durante 30 dias consecutivos exibiu uma redução na glicemia bem como uma redução da peroxidação lipídica dos tecidos pancreáticos e um aumento dos níveis de insulina plasmáticos, indicativo duma ação antioxidante e hipoglicémica. Mostraram ainda que o extrato melhorou marcadamente a viabilidade das células β (por exercer um efeito preventivo ou por permitir a recuperação parcial destas). O extrato de chila mostrou ter efeito benéfico