UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
Transferência de embriões em equinos:
Estudo de fatores que influenciam o sucesso da técnica
Dissertação de Mestrado Integrado em Medicina Veterinária
Gabriel Vasconcelos Palla Beirão
Orientador
Prof. Doutora Ana Celeste Andrade Martins de Carvalho Bessa
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
Transferência de embriões em equinos:
Estudo de fatores que influenciam o sucesso da técnica
Dissertação de Mestrado Integrado em Medicina Veterinária
Gabriel Vasconcelos Palla Beirão Orientador: Prof. Doutora Ana Celeste Andrade Martins de Carvalho Bessa
Composição do Júri:
_____________________________________________________________________________ _____________________________________________________________________________ _____________________________________________________________________________
i
Nota de responsabilidade do autor:
Os fundamentos apresentados neste trabalho são da exclusiva responsabilidade do autor.
ii
Agradecimentos
A felicidade que a conclusão do curso me transmite tem todas as pessoas que me apoiaram durante este percurso como pilares da sua sustentação. Desejo prestar o meu sincero agradecimento:
À Professora. Doutora Ana Celeste Andrade Martins de Carvalho Bessa pela orientação, apoio, dedicação e profissionalismo prestados, não só durante a elaboração deste trabalho mas durante todo o curso.
Ao Professor Doutor Luís Miguel Martins Lucas Cardoso pela disponibilidade, paciência e dedicação prestados durante a realização deste trabalho e do curso.
Ao Doutor Miguel Bliebernicht pela disponibilização do período de estágio, pela partilha de conhecimentos, apoio e amizade.
A todos os professores da U.T.A.D. pela transmissão de conhecimentos e experiências. Ao meu querido Pai, a minha fonte inesgotável de apoio, amor e carinho, para o qual as palavras se tornam pequenas e insuficientes para explicar a importância na minha vida. À minha querida Mãe, pela importância que representa na minha vida, por todo o carinho e amor, por estar sempre do meu lado e me ensinar a ser sempre o melhor.
À minha adorada Avó, sem a qual este objetivo não seria cumprido, por todo o carinho, dedicação e amor que me deu durante toda a vida.
Ao meu Avô, que desde o início se tornou a minha referência e que estará para sempre no meu coração.
À Andreia, pela compreensão, pelo carinho, pela companhia, por representar na minha vida tudo o que eu considero belo.
Ao meu estimado amigo Carlos Cruz, pelo apoio, pela amizade, por ser um tio que o meu coração escolheu.
Aos meus irmãos, Rafael e Vicente, os meus amigos para a vida, por serem um prolongamento de mim e da minha vida.
Ao Miguel, Nuno e Bruno, meus grandes amigos que se confundem com irmãos. A todos os meus amigos que partilharam comigo esta aventura, em especial ao Tiago, ao Francisco, ao Guilherme, à Joana, à Mariana, à Raquel, à Teresa e ao Filipe.
iii
Resumo
A eficácia de um programa de TE está dependente de inúmeros fatores pelo que se torna importante identificar aqueles que exercem uma influência negativa, por forma a minimizá-los. Este trabalho teve como objetivo avaliar as diferenças entre as proporções da taxa de recolha embrionária, de gestação aos 12 e 24 dias e de mortalidade embrionária, por forma a identificar e relacionar a influência que certos fatores relacionados com esta biotecnologia reprodutiva exercem sobre as mesmas.
O presente estudo foi realizado num Centro de Reprodução Equina situado em Portugal (Embriovet ®), entre 1 de Fevereiro e 31 de Julho de 2017. Foram realizadas 69 recolhas embrionárias em éguas da raça Puro-Sangue Lusitano, das quais resultou a recolha de 33 embriões, sendo que 32 foram posteriormente transferidos para éguas da mesma raça. A taxa de recolha embrionária foi de 47,8% (33/69), a taxa de gestação aos 12 dias foi de 65,6% (21/32), aos 24 foi de 50% (16/32) e a taxa de mortalidade embrionária foi de 15,6% (5/32).
Para realizar a apreciação da influência na taxa de recolha embrionária foram consideradas as seguintes variáveis: (a) idade da dadora, (b) ovário ovulatório (esquerdo ou direito), (c) tipo de ovulação, (d) existência de patologia uterina prévia da dadora, (e) presença de endometrite pós-cobrição, (f) existência de partos anteriores, (g) idade do garanhão, (h) método de criopreservação do sémen, (i) momento da inseminação relativamente ao momento da ovulação, (j) dia da recolha do embrião e, (k) altura da época reprodutiva. Para avaliar a influência na taxa de gestação aos 12 e aos 24 dias, e na taxa de mortalidade embrionária foram analisadas as seguintes variáveis: (l) qualidade morfológica do embrião, (m) idade da recetora, (n) existência de patologia uterina prévia da recetora, (o) existência de partos anteriores, (p) dia pós-ovulação da recetora em que a TE foi realizada, (q) sincronia da recetora com a dadora, (r) ciclo éstrico utilizado para realizar a TE. A influência das variáveis dependentes foi avaliada através da comparação de proporções com recurso aos testes de Qui quadrado e exato de Fisher, bem como através da comparação de medianas com o uso do teste U de Mann-Whitney. As diferenças foram consideradas estatisticamente significativas quando p <0,05.
O tipo de ovulação influenciou a taxa de recolha embrionária, em que ovulações duplas levaram a um aumento da taxa (p <0,05), o que, embora pareça demasiado previsível, revelou um bom aproveitamento das ovulações. Relativamente às diferenças não significativas, podemos aferir que se deve à qualidade e semelhança dos animais presentes no estudo.
iv A qualidade morfológica de embriões de grau 1 foi responsável pelo decréscimo da morte embrionária e pelo aumento da taxa de gestação aos 24 dias. Relativamente à sincronia da recetora com a dadora, verificou-se associação estatisticamente significativa entre a positividade no diagnóstico de gestação aos 24 dias e a mediana dos valores de sincronia, e, inversamente, entre sincronia e morte embrionária.
Para as restantes variáveis não foram reveladas diferenças significativas, o que pode justificar estudos futuros realizados com uma maior amostra populacional.
Palavras-chave: Embrião; Transferência de embriões; Taxa de recolha embrionária;
v
Abstract
The effectiveness of an Embryo Transfer program relies on many factors, so it is important to identify those who have a negative impact in order to minimize them. The objective of this study was to evaluate the differences between the rates of embryo collection, gestation at 12 and 24 days and embryo mortality in order to identify and relate the influence that certain factors related to this reproductive biotechnology have on them. This study was carried out at an Equine Reproduction Center located in Portugal (Embriovet ®), between February 1 and July 31 of 2017. 69 embryo collections were carried out in Puro-Sangue Lusitano mares, resulting in the collection of 33 embryos, 32 of which were later transferred to mares of the same breed. The embryo collection rate was 47.8% (33/69), the gestation rate at 12 days was 65.6% (21/32), at 24 it was 50% (16/32) and the rate of embryonic mortality was 15.6% (5/32).
In order to evaluate the influence on the embryo collection rate, the following variables were considered: (a) age of donor, (b) ovulation ovary (left or right), (c) ovulation type, (d) previous uterine pathology (g) age of the stallion, (h) method of cryopreservation of semen, (i) moment of insemination relative to the moment of ovulation, (e) the presence of post-breeding endometritis, j) day of collection of the embryo and, k) height of the reproductive season. The following variables were analyzed to assess the influence on pregnancy rate at 12 and 24 days, and on embryo mortality rate: (1) morphological quality of the embryo, (m) age of the recipient, (n) existence of previous uterine pathology of the recipient, (o) the existence of previous deliveries, (p) post-ovulation day of the recipient in which the ET was performed, (q) synchronization of the recipient with the donor, (r) estrous cycle used to perform the ET. The influence of the dependent variables was assessed by comparing proportions using Chi-square and Fisher exact tests, as well as by comparing medians with the use of the Mann-Whitney U test. Differences were considered statistically significant when p <0.05.
The type of ovulation influenced the rate of embryo collection, in which double ovulations led to an increase in the rate (p <0.05), which, although it seems too predictable, demonstrated a good exploitation of ovulations. Regarding the non-significant differences, we can verify that it is due to the quality and similarity of the animals present in the study.
The morphological quality of grade 1 embryos was responsible for the decrease in embryonic death and the increase in the gestation rate at 24 days. Concerning the synchronization of the recipient with the donor, there was a statistically significant
vi association between the positivity in the gestation diagnosis at 24 days and the median of the synchrony values, and, conversely, between synchrony and embryonic death. For the remaining variables, no significant differences were found, which may justify future studies performed with a larger population sample.
Keywords: Embryo; Embryo transfer; Rate of embryo collection; Gestation rate; Rate of
vii
Índice Geral
Nota de responsabilidade do autor: ... i
Agradecimentos ... ii
Resumo ... iii
Abstract ... v
Índice de figuras ... x
Índice de tabelas ... xi
Lista de siglas e abreviaturas ... xii
Parte I – Revisão Bibliográfica ... 1
1 Introdução ... 2
1.1 Fisiologia Reprodutiva da égua ... 2
1.1.1 Ciclo éstrico ... 2
1.1.2 Regulação endócrina do ciclo éstrico ... 4
1.1.3 Fisiologia da gestação ... 6
1.1.4 Desenvolvimento embrionário precoce ... 8
1.2 Transferência de embriões em equinos ... 12
1.2.1 Nota histórica ... 12
1.2.2 Indicações ... 13
1.2.3 Inconvenientes ... 14
1.3 Procedimentos realizados num programa de TE ... 14
1.3.1 Seleção e maneio da égua dadora ... 14
1.3.2 Seleção e maneio da égua recetora ... 16
1.3.3 Sincronização da égua dadora com a recetora ... 18
1.3.4 Inseminação da dadora ... 20
1.3.5 Transferência transcervical do embrião ... 20
1.4 Fatores envolvidos na eficiência de um programa de TE ... 26
1.4.1 Fatores que influenciam a taxa de recolha embrionária ... 26
1.4.2 Fatores que influenciam taxa de gestação e morte embrionária após a transferência ... 31
1.5 Principais limitações da técnica ... 39
1.5.1 Criopreservação de embriões ... 39
1.5.2 Superovulação ... 40
Parte II - Trabalho experimental ... 42
1. Objetivos... 43
2 Material e métodos ... 43
2.1 Caracterização da exploração ... 43
viii
2.3 Análise estatística ... 50
3 Resultados ... 52
3.1 Taxa de recolha embrionária e a sua relação com as variáveis em estudo .. 53
3.1.1 Idade da dadora ... 53
3.1.2 Ovário ovulatório ... 54
3.1.3 Tipo de ovulação ... 54
3.1.4 Existência de patologia uterina prévia da dadora ... 55
3.1.5 Presença de endometrite pós-cobrição ... 55
3.1.6 Existência de partos anteriores da dadora ... 56
3.1.7 Idade do garanhão ... 56
3.1.8 Método de preservação de sémen ... 56
3.1.9 Momento da inseminação relativamente ao momento da ovulação ... 57
3.1.10 Dia da recolha do embrião ... 58
3.1.11 Altura da época reprodutiva ... 58
3.2 Taxa de gestação aos 12 e 24 dias e taxa de mortalidade embrionária e a sua relação com as variáveis em estudo ... 58
3.2.1 Qualidade morfológica do embrião ... 58
3.2.2 Idade da recetora ... 59
3.2.3 Patologia uterina prévia da recetora ... 59
3.2.4 Existência de partos anteriores da recetora ... 60
3.2.5 Dia pós-ovulação da recetora em que a TE foi realizada ... 60
3.2.6 Sincronia da recetora com a dadora ... 61
3.2.7 Ciclo éstrico utilizado ... 61
4 Discussão ... 62
4.1 Taxa de recolha embrionária ... 62
4.1.1 Idade da dadora ... 62
4.1.2 Ovário ovulatório ... 63
4.1.3 Tipo de ovulação ... 63
4.1.4 Existência de patologia uterina prévia da dadora ... 63
4.1.5 Presença de endometrite pós-cobrição ... 64
4.1.6 Existência de partos anteriores da dadora ... 64
4.1.7 Idade do garanhão ... 64
4.1.8 Método de criopreservação de sémen ... 65
4.1.9 Momento da inseminação relativamente ao momento da ovulação ... 66
4.1.10 Dia da recolha do embrião ... 66
4.1.11 Altura da época reprodutiva ... 67
4.2 Taxa de gestação aos 12 e 24 dias e taxa de mortalidade embrionária ... 67
ix
4.2.2 Idade da recetora ... 68
4.2.3 Patologia uterina prévia da recetora ... 68
4.2.4 Existência de partos anteriores da recetora ... 69
4.2.5 Dia pós-ovulação da recetora em que a TE foi realizada ... 69
4.2.6 Sincronia da recetora com a dadora ... 69
4.2.7 Ciclo éstrico ... 70
Conclusão ... 71
x
Índice de figuras
Figura 1- Égua demonstrando sinais de estro como abaixamento da garupa, cauda
levantada, micção e eversão do clitóris... 3
Figura 2 - Representação esquemática do controlo hormonal ovárico da égua. ... 5
Figura 3- Visão endoscópica dos cálices endometriais ... 7
Figura 4- Esquema e foto de mórula (grau 1) ... 10
Figura 5 - Esquema e foto de blastocisto jovem (grau 1) ... 11
Figura 6 - Esquema e foto de blastocisto (grau 1). ... 11
Figura 7 – Esquema e foto de blastocisto expandido (grau 1). ... 11
Figura 8 – Oócitos não fertilizados ... 12
Figura 9 - Ilustração do posicionamento do cateter no útero da égua previamente ao “flushing”. Após a inserção do cateter através da cérvix, o balão é insuflado com ar e o cateter é retraído até ao óstio interno da cérvix.. ... 22
Figura 10- Placa escavada de 5 poços contendo meio de manutenção usado para a lavagem dos embriões ... 23
Figura 11- Palhinha com embrião (seta) posicionado entre ar e colunas de fluido ... 25
Figura 12- Limpeza da zona perineal da égua. ... 45
Figura 13- Caixa contendo água à temperatura de 37ºC e 4L de LR. ... 46
Figura 14 - Cateter de “Foley” conectado ao tubo em “Y” pronto a ser introduzido na vagina. ... 46
Figura 15- Insuflação com ar, através de seringa, do balão do cateter de “Foley”. ... 47
Figura 16- Embrião retido no filtro no final da lavagem contendo alguma quantidade de detritos. ... 48
Figura 17- Pesquisa de embrião através de microscópio lupa. ... 48
Figura 18 - Observação à lupa de dois embriões procedentes de ovulação dupla. .... 49
xi
Índice de tabelas
Tabela 1. Classificação dos embriões em relação ao seu estado de desenvolvimento.
... 10
Tabela 2. Sincronia entre égua dadora que ovulou 7 dias antes da recolha e as potenciais recetoras que ovularam entre 2 dias antes até 3 dias depois da dadora .... 19
Tabela 3. Sistema modificado de classificação de embriões equinos ... 24
Tabela 4. TG no D16 por grau e por ano de época reprodutiva. ... 33
Tabela 5. Relação da idade, grau e tónus uterino da recetora com a TG D12 e D50 e TME ... 35
Tabela 6. Efeito do grau de sincronização na TG D60. ... 36
Tabela 7. TG no D12, D50, D60 e TME ... 37
Tabela 8. Descrição das fórmulas usadas para determinar a TRE, TG e TME ... 51
Tabela 9. Identificação e descrição dos fatores com eventual influência sobre a TRE, TG e TME. ... 51
Tabela 10. TRE em função do tipo de ovulação. ... 54
Tabela 11. TRE em função da idade do garanhão. ... 56
Tabela 12. TRE em função do dia da recolha do embrião ... 58
Tabela 13. TRE em função da altura da época reprodutiva. ... 58
Tabela 14 - TG D12, TG D24 e TME em função da qualidade morfológica do embrião. ... 59
Tabela 15. TG D12, TG D24 e TME em função da idade da recetora ... 59
Tabela 16. TG D12, TG D24 e TME em função da presença de patologia uterina prévia da recetora. ... 59
Tabela 17. TG D12, TG D24 e TME em função da existência de partos anteriores da recetora. ... 60
Tabela 18. TG D12, TG D24 e TME em função do dia pós-ovulação da recetora em que a TE foi realizada. ... 60
Tabela 19. TG D12, TG D24 e TME em função da sincronia da recetora com a dadora. ... 61
Tabela 20. TG D12, TG D24 e TME em função da existência do ciclo éstrico utilizado. ... 61
xii
Lista de siglas e abreviaturas
APSL Associação Portuguesa de Criadores do Cavalo Puro-Sangue Lusitano
CL Corpo Lúteo
D Dia (s)
eCG Gonadotropina Coriónica Equina
EPE Extrato pituitário equino
FSH Hormona Folículo-estimulante
GnRH Hormona Libertadora de gonadotrofinas
hCG Gonadotrofina coriónica humana
IA Inseminação Artificial
ICSI Injeção intracitoplasmática de sémen
LH Hormona Luteinizante LR Lactato de Ringer ml Mililitro (s) mm Milímetro (s) PGE2 Prostaglandina E2 PGF2α Prostaglandina-F-2-alfa PSL Puro-Sangue Lusitano TE Transferência de embriões
TG Taxa de gestação após a transferência de embrião
TRE Taxa de recolha embrionária
UFO Oócito não fertilizado (s)
UFP Unidade feto-placentária
UI Unidades Internacionais
ZP Zona pelúcida
1
Parte I – Revisão Bibliográfica
2
1 Introdução
1.1 Fisiologia Reprodutiva da égua 1.1.1 Ciclo éstrico
A égua apresenta múltiplos ciclos éstricos durante a época reprodutiva pelo que é considerada poliéstrica sazonal (Blanchard et al., 2011). No hemisfério Norte estende-se de Abril a Setembro. Tem início na Primavera por forma a coincidir com o aumento de luz natural, da temperatura e da disponibilidade de alimento (Nagy et al., 2000). Existem diversos fatores externos responsáveis pela regulação do ritmo reprodutivo endógeno, nomeadamente o fotoperíodo, a temperatura, a qualidade do alimento, a condição corporal do animal, a idade e o estado reprodutivo (Aurich, 2011), sendo que o fotoperíodo é reconhecido como o mais importante (Nagy et al., 2000). Entre Outubro e Março, a maioria dos animais não apresenta ciclicidade. Este período anovulatório é dividido em transição de Outono, em que a atividade cíclica vai diminuindo gradualmente até entrar em anestro profundo, e em transição de Primavera em que a ciclicidade é retomada ao longo de 30 a 90 dias (Aurich, 2011). A puberdade tem início entre os 12 a 24 meses de idade, altura em que ocorre a primeira ovulação (Evans et al., 2007). O ciclo éstrico é definido como o intervalo entre duas ovulações consecutivas e tem uma duração de 21 a 22 dias, embora possa durar de 18 a 24 dias, e é dividido em duas fases, a fase folicular ou estro e a fase lútea ou diestro (Blanchard et al., 2011c), sendo que a ovulação é considerada como sendo o dia zero (D0) do ciclo (Riera, 2011). O estro, que dura entre 4 a 7 dias caracteriza-se pelo crescimento folicular e consequente produção de estrogénios. Verifica-se o início de maturação de vários folículos mas normalmente apenas um se vai tornar dominante e posteriormente ovular. O diâmetro folicular verificado à ovulação costuma variar entre os 30 e os 50 mm, no entanto é mais frequente a aproximação a valores entre os 40 a 45 mm (Blanchard et al., 2011c), sendo que os folículos dominantes apresentam diâmetros pré-ovulatórios semelhantes entre ciclos consecutivos (Cuervo-Arango & Newcombe, 2008). O desenvolvimento folicular comumente ocorre em uma ou duas ondas foliculares durante o ciclo. Uma onda folicular corresponde ao crescimento simultâneo de um grupo de folículos até que um folículo (ou dois, ou até mais em casos raros) se torna dominante em relação aos outros. Nas éguas que apresentam apenas uma onda durante o ciclo, denominada de folicular primária, a onda emerge a meio do ciclo, aproximadamente no décimo dia e resulta num folículo dominante facilmente identificável à ecografia sete
3 dias antes da ovulação. Nas éguas em que se verifica também uma onda folicular secundária, o folículo dominante selecionado na onda primária que tem início tardiamente no estro, ou cedo no diestro, por vezes ovula, ocorrendo uma ovulação de diestro. Embora não seja muito comum, podem ocorrer ovulações múltiplas, principalmente duplas, sendo que é mais frequente em certas raças e éguas nulíparas (Evans et al., 2007).
Os níveis elevados de estrogénios produzidos tornam a égua sexualmente recetiva ao garanhão (McCue et al., 2011). O abaixamento da garupa, afastamento dos membros posteriores, desvio da cauda com exposição da região perineal, eversão rítmica do clitóris e a micção frequente fazem parte do comportamento normal de uma égua nesta fase quando é exposta a um garanhão (Figura 1) (Crowell-Davis, 2007).
No entanto, nem todas as éguas demonstram este comportamento quando em estro, seja por questões sociais, como a presença de éguas dominantes ao seu redor, ou por simplesmente não se identificarem com o garanhão (Crowell-Davis, 2007). Habitualmente, a ovulação ocorre 24 a 48 horas antes do fim da fase folicular, em que se dá a formação do corpo lúteo (CL) responsável pelo aumento dos níveis de progesterona e a consequente cessação do comportamento de recetividade (McCue et al., 2011). As éguas podem apresentar ciclos éstricos curtos em caso de endometrite ou endotoxemia, em que regressam ao estro mais cedo que o esperado (Evans et al., 2007).
A variação da duração do diestro é menor e encontra-se entre os 14 e os 15 dias (Blanchard et al., 2011). As concentrações de progesterona vão aumentando nesta fase
Figura 1- Égua demonstrando sinais de estro como abaixamento da garupa, cauda levantada, micção e eversão do clitóris. Adaptado de Blanchard et al. (2011).
4 e atingem a concentração máxima aquando da completa maturação do CL por volta do dia 5 após a ovulação. Durante esta fase, na maior parte dos animais há uma ausência de recetividade sexual (Lofstedt, 2011). Nos 13 a 16 dias pós-ovulação o endométrio produz prostaglandina F2α (PGF2α) que vai ser responsável pela lise do CL e consequente decréscimo acentuado das concentrações de progesterona (Blanchard et al., 2011).
O prolongamento do diestro é muito comum em éguas e pode ser causado por uma ovulação tardia resultante de uma onda folicular secundária que origina um CL que ainda é imaturo e, portanto, refratário à libertação normal de PGF2α pelo endométrio, quer seja por doença uterina severa em que o endométrio não é capaz de produzir PGF2α ou pela ocorrência de mortalidade embrionária precoce após o reconhecimento materno da gestação, entre o D14 e D16 dia de gestação (Evans et al., 2007).
1.1.2 Regulação endócrina do ciclo éstrico
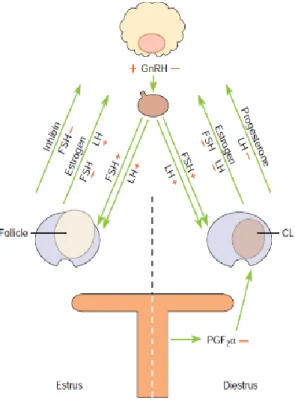
O ciclo éstrico resulta do equilíbrio das hormonas produzidas pelo hipotálamo, hipófise, glândula pineal, ovários e endométrio (Blanchard et al., 2011). A glândula pineal traduz os sinais do fotoperíodo registados através do olho do animal em sinais endócrinos (Nagy et al., 2000), ao controlar a atividade do eixo hipotálamo-hipófise-ovário através da produção de melatonina, hormona produzida durante o período noturno e que é responsável, na égua, pela inibição do eixo em dias curtos. A inibição do eixo é removida à medida que o número de horas de luz aumenta, desencadeando a produção da hormona libertadora de gonadotrofinas (GnRH) pelo hipotálamo que, por sua vez, estimula a hipófise a produzir a hormona folículo-estimulante (FSH) e a hormona luteinizante (LH) (Morel, 2002). Após a entrada na circulação sistémica, estas hormonas atuam diretamente no ovário, sendo a FSH responsável pelo recrutamento folicular e a LH responsável pela maturação folicular, ovulação, luteinização das células da granulosa do CL e manutenção do CL (Blanchard et al., 2011).
Os estrogénios de origem folicular predominam no início do estro, em relação à concentração sérica de progesterona, que se encontra baixa, altura em que a égua exibe sinais de cio. Após a seleção do folículo dominante, as células da granulosa, sob influência dos estrogénios, produzem inibina que induz a atresia dos folículos subordinados. É então que os pulsos de GnRH aumentam, devido à influência dos estrogénios por forma a favorecer a secreção de LH em relação à FSH, em que os níveis de LH aumentam (aumenta o número de recetores de LH nas células da teca dos folículos) e os de FSH diminuem drasticamente. O pico de concentração de LH acontece de forma gradual, relativamente a outras espécies, em que a concentração de LH atinge
5 o seu máximo após a ovulação. Foi colocada a hipótese de que este pico ocorre após a ovulação porque, para além de contribuir para a maturação folicular e induzir a ovulação, é importante na formação do CL. À medida que os níveis de LH aumentam e o folículo se aproxima da ovulação, as células da teca iniciam a sua degeneração e a produção de estrogénios começa a decrescer antes da ovulação. Os estrogénios e a inibina regressam a valores basais entre 1 a 2 dias após a ovulação, que coincide com o fim do comportamento de estro da égua (Evans et al., 2007; Morel, 2002).
Resumindo, quando a concentração de progesterona plasmática é baixa, a produção de estrogénios por parte dos folículos em maturação, principalmente pelo folículo dominante, exerce um mecanismo de “feedback” positivo na libertação de LH que permite uma libertação adicional da hormona. Por outro lado, os folículos em crescimento vão exercer um mecanismo de “feedback” negativo sobre a libertação de FSH através da produção de inibina e estrogénios, enquanto a produção de progesterona pelo CL inibe a hipófise de libertar LH na corrente sanguínea (Figura 2) (Blanchard et al., 2011).
Figura 2 - Representação esquemática do controlo hormonal ovárico da égua. Adaptado de Blanchard et al. (2011).
6
1.1.3 Fisiologia da gestação
Com a finalidade de se verificar uma gestação, devem ocorrer interações embrio-maternas com o intuito de interromper o ciclo éstrico normal e permitir uma placentação adequada que provisiona um apoio endócrino e metabólico à gestação. A sua duração varia entre os 310 e os 380 dias e tem início após a fecundação (Evans et al., 2007). O CL é responsável pelo aumento da concentração sérica de progesterona após a ovulação e, caso a égua esteja gestante, pela manutenção da gestação, pois não ocorre a sua luteólise e continua a secretar progesterona. É então denominado como o CL primário da gestação (Kelleman, 2014). Após a libertação pelo folículo, o oócito é conduzido até à ampola do oviduto, onde ocorre a fecundação (Morel, 2002b). O embrião é transportado seletivamente através do oviduto até ao útero, ao sexto dia, altura em que é atingido o pico de concentração sérica de progesterona de origem lútea, que providencia um ambiente uterino adequado para o desenvolvimento embrionário (Evans et al., 2007). Este mecanismo de passagem é desencadeado pela produção de prostaglandina E2 (PGE2) pelo embrião em desenvolvimento, que evita assim a passagem de oócitos não fertilizados (UFO) (Betteridge, 2011). A migração embrionária pelo útero, entre o D11 e o D15 é fundamental para que ocorra reconhecimento materno de gestação, evitando que a égua torne ao estro. Este mecanismo ainda não é claro nos dias de hoje (Kelleman, 2014), porém, pensa-se que o embrião móvel produz uma proteína responsável pela inibição da produção de PGF2α pelo endométrio (Blanchard et al., 2011a), e é conhecido como a primeira resposta lútea da gestação (Evans et al., 2007). Por volta do D16 a D17, o embrião perde a mobilidade e ocorre a sua fixação, normalmente na base de um dos cornos uterinos, devido a uma combinação de fatores como o aumento do diâmetro embrionário e do tónus uterino, possivelmente causado pela secreção de estrogénio pelo embrião (Kelleman, 2014).
Por volta do D30 o nível de progesterona de origem lútea começa a diminuir, devido à diminuição do tamanho do CL e, aproximadamente no D35, há a formação de cálices endometriais (Figura 3) incumbidos da secreção de gonadotropina coriónica equina (eCG). As células que formam a base dos cálices têm origem embrionária, mais concretamente no cordão coriónico de trofoblastos (Evans et al., 2007; Kelleman, 2014). Os cálices são identificados como protuberâncias de crescimento irregular, dispostas em arranjo circular na superfície do lúmen do corno uterino gravídico (Blanchard et al., 2011a), e a sua secreção de eCG estimula a produção de progesterona pelo CL, que se mantém ativo e secreta mais progesterona, sendo esta fase conhecida como segunda resposta lútea da gestação.
7 Esta hormona é ainda responsável pela estimulação ovárica, proporcionando o desenvolvimento folicular que origina uma ovulação ou uma luteinização (sem ovulação) desses folículos, em que surgem estruturas lúteas, denominadas de corpos lúteos suplementares, que levam à subida da concentração sérica de progesterona, sendo esta fase conhecida como terceira resposta lútea da gestação (Evans et al., 2007; Kelleman, 2014). A progesterona de origem ovárica é necessária para a manutenção da gestação até ao D45, altura em que a unidade feto-placentária (UFP) inicia o seu papel na manutenção da gestação com a produção de progestagénios, sendo que na mesma altura se inicia também a produção de estrogénios. Estes também são produzidos a nível ovárico e, embora não sejam fundamentais na manutenção da gestação, são importantes no aumento da circulação sanguínea fetal e da tonicidade uterina. Os CL’s continuam a sua produção de grandes quantidades de progesterona, atingindo o seu pico a nível sistémico entre o D60 e D120, sendo que se mantêm ativos até regredirem aproximadamente entre o D150 e o D180, altura em que concentração sérica de progesterona é muito baixa e a UFP é a única estrutura responsável pela produção de progestagénios. Durante o segundo e o terceiro trimestre da gestação a UFP produz grandes quantidades de progestagénios e estrogénios, sendo que a produção hormonal tem origem nas gónadas e glândulas adrenais fetais e tecidos placentários. Os níveis de estrogénios decrescem durante o último trimestre enquanto os de progestagénios aumentam, sendo que o aumento é grande durante as últimas semanas de gestação, atingindo o seu pico antes do parto (Evans et al., 2007; Kelleman, 2014).
Antes do final da gestação, o crescimento rápido do feto torna o útero distendido, transformando o miométrio mais contrátil. A grande concentração de progestagénios é necessária para manter um estado de quiescência uterina até à altura antes do parto e também pela estimulação de enzimas inativadoras das prostaglandinas, bloqueando os
8 seus efeitos ecbólicos. No final da gestação os níveis de progestagénios decrescem abruptamente coincidindo com a maturação do eixo hipotálamo-hipófise-adrenal fetal, necessário para o feto sinalizar o momento adequado para o parto. A produção de cortisol pelo feto nesta fase ativa as enzimas sintetizadoras de prostaglandinas, que vão aumentado à medida que os progestagénios decrescem, período em que se iniciam contrações do miométrio. O aumento do nível de estrogénios que se verifica na última semana antes da gestação aumenta a recetividade uterina às prostaglandinas e promovem a sua produção. Por fim, o reflexo de “Ferguson” provoca a distensão da cérvix e da vagina, originando uma grande libertação de oxitocina e consequente expulsão do feto (Kelleman, 2014; Blanchard et al., 2011a).
1.1.4 Desenvolvimento embrionário precoce 1.1.4.1 O oócito
Após a ovulação, o oócito é captado pelo infundíbulo e é rapidamente conduzido até à junção da ampola e do istmo, onde irá ocorrer a fertilização (Vanderwall, 1996). Encontra-se rodeado por uma matriz celular gelatinosa, o “cumulus oophorus”. Acredita-se que tem a função de facilitar o transporte até ao oviduto, atrair o espermatozoide e fornecer as substâncias necessárias para a sua capacitação. Tendo em conta o seu estado de desenvolvimento, o oócito é denominado de oócito secundário que é formado pela conclusão da primeira divisão meiótica com a extrusão do primeiro corpo polar, com o seu desenvolvimento interrompido em metafase II, sendo que não requer mais desenvolvimento até ao momento da fecundação (McKinnon & Squires, 1988). A duração da viabilidade do oócito não é precisa, apresenta uma variação entre as 4 e as 36 horas (Morel, 2002b).
1.1.4.2 Desenvolvimento embrionário até ao dia 9 pós-ovulação
Após a fecundação, o “cumulus oophorus” é perdido e forma-se o segundo corpo polar. A primeira clivagem ocorre aproximadamente após 24 horas e as clivagens seguintes ocorrem em intervalos entre 12 e 24 horas e os embriões são designados de acordo com o número de células, nominadas de blastómeros, tal como embrião de duas células, de quatro, e assim por diante. Encontram-se revestidos pela camada acelular externa, a zona pelúcida (ZP) (McCue & Squires, 2015). O oócito secundário assume uma forma esférica, o embrião de 2 e de 4 células uma forma elipsoidal, e o embrião de 8 células novamente uma forma esférica. Entre o desenvolvimento do embrião de 8 para um embrião de 16 células, inicia-se uma agregação dos blastómeros devido à formação de junções do tipo “gap”, que leva a uma compactação das células em detrimento da
9 disposição aposicional que apresentavam entre elas (Vanderwall, 1996), reduzindo a permeabilidade à passagem livre de líquidos (McKinnon & Squires, 1988). A divisão celular continua, o que leva à formação de uma mórula compacta, caracterizada como uma massa compacta de 32 blastómeros, que corresponde à última fase de desenvolvimento no oviduto (Vanderwall, 1996). Segundo Freeman et al. (1991), o transporte seletivo do embrião até ao útero dá-se entre as 130 e 142 horas pós-ovulação (5 dias e 10 horas a 5 dias e 22 horas), e o tamanho do embrião não aumenta significativamente até chegar ao lúmen uterino. O transporte do embrião até ao útero, como demonstrado por Weber et al. (1991), é desencadeado através da secreção de PGE2 pelo embrião.
Após a entrada no útero, passa a estar disponível a sua recolha através de lavagem uterina (Betteridge, 2011) e continua o seu desenvolvimento, desenvolve-se em blástula, que se caracteriza pelo início da formação de uma cavidade repleta de fluido, o blastocélio, altura em que se denomina blastocisto jovem. Após a formação do blastocélio, o embrião começa a crescer rapidamente de tamanho, e é denominado de blastocisto expandido, em que o blastocélio se encontra delimitado por uma camada de células, os trofoblastos (Vanderwall, 1996), que têm a função de absorver nutrientes e de induzir mudanças no revestimento uterino na altura da implantação e que vão formar grande parte da placenta fetal (McKinnon & Squires, 1988), e por outra camada de células, localizada em um dos polos, que se projeta pelo blastocélio formando uma massa celular interna, que originará o embrião propriamente dito (Vanderwall, 1996). Durante o seu desenvolvimento precoce, o embrião é revestido por vários invólucros extracelulares. Na altura da ovulação, o oócito é revestido pela ZP de dupla camada, por sua vez revestida pelo “cumulus oophorus”, de origem folicular e subsiste apenas de um a dois dias, exceto em UFO’s. Após a entrada no útero, é disposta uma camada fina na superfície interior da ZP, uma cápsula acelular, que ocorre conjuntamente com a formação do blastocélio. Cerca de um dia depois a ZP desprende-se, e à medida que o blastocisto se vai expandindo, a cápsula aumenta de espessura (Vanderwall, 1996; Betterrigde, 2010). Muitos aspetos relativos à formação da cápsula são ainda desconhecidos. Possui uma estrutura forte e é essencial à continuação da gestação, aparentemente valiosa na proteção que fornece após o desprendimento da ZP (Betterrigde, 2011).
De seguida encontra-se a descrição dos vários estados de desenvolvimento embrionário, bem como de UFO (Tabela 1), assim como o esquema e foto dos mesmos (Figura 4 a 8).
10
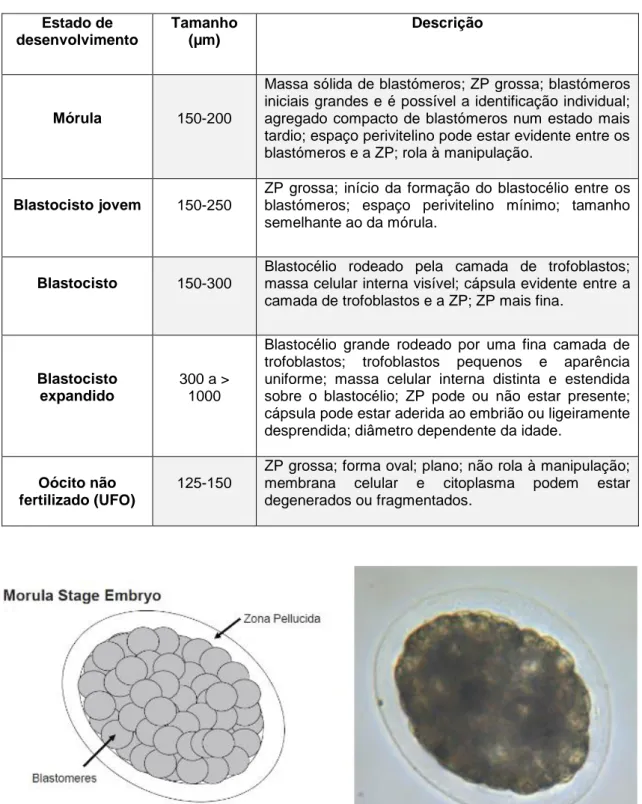
Tabela 1. Classificação dos embriões em relação ao seu estado de desenvolvimento. Adaptado de McCue et al. (2009). Estado de desenvolvimento Tamanho (µm) Descrição Mórula 150-200
Massa sólida de blastómeros; ZP grossa; blastómeros iniciais grandes e é possível a identificação individual; agregado compacto de blastómeros num estado mais tardio; espaço perivitelino pode estar evidente entre os blastómeros e a ZP; rola à manipulação.
Blastocisto jovem 150-250
ZP grossa; início da formação do blastocélio entre os blastómeros; espaço perivitelino mínimo; tamanho semelhante ao da mórula.
Blastocisto 150-300
Blastocélio rodeado pela camada de trofoblastos; massa celular interna visível; cápsula evidente entre a camada de trofoblastos e a ZP; ZP mais fina.
Blastocisto expandido
300 a > 1000
Blastocélio grande rodeado por uma fina camada de trofoblastos; trofoblastos pequenos e aparência uniforme; massa celular interna distinta e estendida sobre o blastocélio; ZP pode ou não estar presente; cápsula pode estar aderida ao embrião ou ligeiramente desprendida; diâmetro dependente da idade.
Oócito não fertilizado (UFO)
125-150
ZP grossa; forma oval; plano; não rola à manipulação; membrana celular e citoplasma podem estar degenerados ou fragmentados.
11
Figura 5 - Esquema e foto de blastocisto jovem (grau 1). Adaptado de McCue et al. (2009).
Figura 6 - Esquema e foto de blastocisto (grau 1). Adaptado de McCue et al. (2009).
12
1.2 Transferência de embriões em equinos 1.2.1 Nota histórica
O cavalo foi, possivelmente, das espécies pecuárias, a primeira em que se desenvolveu a Inseminação Artificial (IA), no entanto, no que diz respeito à recolha e transferência de embriões, foi talvez a última espécie em que se iniciou esta técnica (Allen, 2005). A
transferência de embriões (TE) evoluiu de forma considerável desde os primeiros
trabalhos realizados com sucesso (Hinrichs, 1993). Oguri & Tsutsumi (1975) realizaram as primeiras tentativas de TE não cirúrgica, através da cérvix da égua recetora, mas sem sucesso, talvez devido à manipulação cervical durante a transferência. Oguri & Tsutsumi, (1975) usando outra técnica que não envolvia a estimulação da cérvix no momento da TE, conseguiram produzir os primeiros poldros vivos. Allen & Rowson (1975) conseguiram obter gestações utilizando uma técnica cirúrgica e outra não cirúrgica.
Só depois dos anos 80 é que se conheceram métodos que permitiam a refrigeração e o armazenamento a curto prazo de embriões recolhidos, o que abriu portas ao transporte de longa distância, muitas vezes para centros de reprodução especializados (McCue & Squires, 2015b). Em 1982 nasceu o primeiro poldro resultante da transferência de um embrião previamente congelado (Czlonkowska et al., 1985). Após os anos 80, poucas foram as mudanças, sendo que a principal foi a disponibilidade de meios de lavagem uterina para recolha de embriões a nível comercial (Squires, 2013).
No início, as restrições práticas da técnica e os falsos rumores de que a capacidade atlética dos poldros obtidos através de TE seria influenciada pela égua recetora contribuíram para um grande atraso no desenvolvimento da técnica, bem como as
13 regras rigorosas, que impediam o registo de poldros oriundos de TE e o limite de registo de apenas um poldro por égua dadora, que permaneceram durante muitos anos, assim como a dificuldade para induzir a superovulação, a tolerância reduzida dos embriões à criopreservação e as taxas de gestação pouco razoáveis após TE não cirúrgica (Stout, 2006).
O interesse na TE tem vindo a aumentar em consequência da consciencialização dos criadores para o melhoramento genético que proporciona, bem como o aperfeiçoamento da técnica que permitiu melhorar a relação custo-benefício (Stout, 2006), e atualmente é permitida na maioria das raças, sendo que os Estados Unidos da América, a Argentina e o Brasil são os países que têm vindo a liderar a afluência à utilização desta biotecnologia reprodutiva (Squires et al., 1999). Abriu portas ao desenvolvimento de novas tecnologias reprodutivas como a transferência de oócitos, injeção intracitoplasmática de sémen (ICSI) e transferência nuclear (clonagem) (Coutinho da Silva, 2008).
No tocante à raça Puro-Sangue Lusitano (PSL), foi em 2009 que a Associação Portuguesa de Criadores do Cavalo Puro-Sangue Lusitano (APSL) aprovou e, em 2010, a Fundação Alter Real homologou o registo de poldros nascidos através de TE, impondo um limite no registo de 3 poldros por égua dadora em cada ano, com a égua recetora a ser obrigatoriamente PSL, registada no livro da raça (APSL, 2016).
1.2.2 Indicações
A TE permite salvaguardar e aumentar o potencial reprodutivo das éguas, obtendo um poldro com elevado potencial económico (Stout, 2003). Entre as grandes vantagens da técnica encontram-se a possibilidade de obter gestações de embriões provenientes de: éguas com fertilidade reduzida, seja pela idade avançada, que abortam frequentemente e são incapazes de produzir descendência após cobrição natural ou IA (Squires et al., 2003; Squires, 2013), seja devido a patologia uterina, como é o exemplo da endometriose severa (Stout, 2003), éguas com problemas músculo-esqueléticos (Hartman, 2011), éguas impossibilitadas de acomodar uma gestação devido a anomalias estruturais, como fratura pélvica ou hérnia ventral (Stout, 2003), éguas de grande valor genético ou éguas de desporto, que não precisam assim de interromper a competição para ficar gestantes (Squires, 2013), éguas jovens, com 1 e 2 anos de idade, que ainda são incapazes de levar uma gestação a termo, permitindo assim antecipar a produção de descendência (entre 1 e 2 anos), e por fim obter descendência de animais pertencentes a espécies em via de extinção (McKinnon & Squires, 2007).
Esta técnica possibilita a obtenção de vários poldros por ano, confere aos criadores a oportunidade de cruzar a égua dadora com vários garanhões em cada época
14 reprodutiva (Squires, 2013), permite avaliar a fertilidade da égua dadora e do garanhão (que pode também ser influenciada pelos métodos de criopreservação do sémen), avaliando a eventual recolha de um embrião, 7 a 8 dias após a ovulação (Stout, 2006) e disponibiliza a possibilidade de refrigerar e congelar embriões, possibilitando assim o seu armazenamento e o transporte (Squires et al., 2003).
1.2.3 Inconvenientes
A eficiência do procedimento é influenciada por inúmeros fatores, pelo que é exigida uma grande capacidade de organização e coordenação em relação aos mesmos, desde o maneio da dadora, qualidade da recetora, a sincronização entre ambas, a técnica aliada às capacidades técnicas do operador (Hinrichs & Choi, 2005), sendo que a dificuldade em controlar todas as variáveis é tanto maior quanto maior for a dimensão do centro de TE (Riera, 2011b). Um programa de TE acarreta custos elevados. Tendo em conta a necessidade de existir uma sincronização entre a recetora e dadora, tarefa laboriosa, complexa e ao mesmo tempo indispensável num programa de TE, cada centro requer no mínimo 2 a 3 recetoras por cada dadora (Stout, 2003). O controlo reprodutivo e a alimentação das recetoras inflaciona o custo do programa, principalmente quando a taxa de recolha embrionária (TRE) é baixa (Squires, 2013). A égua dadora é, na maior parte dos casos, selecionada pelo cliente. Se a escolha incidir sobre uma égua velha, é necessário aconselhar e alertar para o facto de a probabilidade de ocorrer morte embrionária (ainda no oviduto) ser maior com o avançar da idade, principalmente em éguas com idade superior a 16 anos, tendo em conta que a fertilidade dos oócitos tende a diminuir (Squires, 2013). O aconselhamento ao cliente deve incluir os critérios de escolha do garanhão, dado que o uso de garanhões de fertilidade reduzida, muitas vezes selecionados pelo cliente, deve ser evitado tendo em conta o impacto negativo que pode exercer sobre os resultados obtidos (Riera, 2011b). Por outro lado sendo um procedimento que diminui a variabilidade genética, pode levar a problemas de consanguinidade (Morel, 2002a).
1.3 Procedimentos realizados num programa de TE 1.3.1 Seleção e maneio da égua dadora
A dadora ideal deve apresentar uma boa saúde reprodutiva, boa condição corporal e não deve estar sujeita a condições de stress (Mccue & Squires, 2015c), pelo que a sua seleção, para além da história reprodutiva, deve ter em conta a fertilidade e localização do garanhão escolhido, ou do seu sémen, as regras de registo da raça, o valor potencial do poldro e o número de gestações desejadas (Squires et al., 1999). A escolha recai na
15 maioria das vezes em éguas de idade avançada, que já demonstraram o seu valor, principalmente com idade superior a 20 anos (Ball, 2000).
A avaliação do aparelho reprodutivo deve atentar à presença dos seguintes critérios: crescimento de folículos ováricos com consequente ovulação de oócitos saudáveis, um oviduto capaz de realizar o transporte adequado dos gâmetas e de contribuir para a fecundação e transporte do embrião até ao útero, um ambiente uterino adequado que permita o desenvolvimento embrionário e uma cérvix com funcionamento apropriado (Coutinho da Silva, 2008). O controlo reprodutivo deve ser realizado diariamente, através de palpação retal e de controlo ecográfico, avaliando o desenvolvimento folicular, a ovulação e o ambiente uterino (Hartman, 2011). É essencial determinar o momento da ovulação para precisar o momento ótimo de IA com sémen fresco, refrigerado ou congelado (Vanderwall & Woods, 2007) e para planear o dia da recolha do embrião (Stout, 2003).
Éguas que apresentem patologias como lacerações cervicais sem resolução, endometrite pós-cobrição persistente, aderências uterinas ou do oviduto pós-distócia, não devem ser selecionadas, tendo em conta que este tipo de afeções pode afetar a conceção e provocar uma morte embrionária precoce (Hinrichs & Choi, 2005). As éguas velhas que apresentem um diagnóstico de gestação positivo e posteriormente perdem o embrião são melhores candidatas do que éguas que apresentam ciclos éstricos curtos (Squires & Seidel, 1995). Idealmente, éguas no cio do poldro não devem ser selecionadas dado que a lavagem uterina revela grande quantidade de detritos (McCue & Squires, 2015c).
O maneio apropriado da dadora é fundamental para obter um embrião o mais limpo possível e de um tamanho adequado à transferência. É cada vez mais frequente recolher vários embriões de uma dadora na mesma época reprodutiva. A repetição do processo de inseminação e lavagem uterina aumenta a probabilidade de endometrite bacteriana (Hartman, 2011), e estão associadas ao aparecimento de alterações inflamatórias crónicas (Carnevale et al., 2005). Na presença de uma endometrite, deve ser realizado o devido tratamento antes do procedimento (Vanderwall & Woods, 2007). Pode ser feito através de lavagem uterina com solução fisiológica ou com lactato de Ringer (LR) e oxitocina (endovenosa) após a lavagem (Riera, 2011b), obtendo assim um meio uterino adequado. A antibioterapia recorrente para resolver estes casos deve ser evitada uma vez que pode levar ao crescimento de fungos (Vanderwall & Woods, 2007). Em certos casos é aconselhado deixar passar um ciclo éstrico por forma a realizar um tratamento adequado (McCue & Squires, 2015c).
16 Se o objetivo for congelar o embrião, a monitorização reprodutiva deve ser realizada pelo menos duas vezes ao dia, para possibilitar a recolha do embrião logo após a sua entrada no útero, por volta do início do dia 6, para que o seu diâmetro seja adequado à congelação, sabendo que após 12 horas ultrapassa o diâmetro que inviabiliza essa hipótese (Stout, 2003).
Após a recolha embrionária, não se deve menosprezar o controlo reprodutivo da égua pois podem surgir algumas contrariedades. Embora a administração de PGF2α seja um procedimento habitual após a recolha, a égua pode ficar gestante caso tenha ocorrido uma ovulação secundária mais atrasada responsável pelo aparecimento de um embrião que se encontra no oviduto e, portanto, impossível de recolher, e pela formação de um CL, que, por ser imaturo, é refratário à ação luteolítica da PGF2α. Uma lavagem uterina inadequada, em que o embrião não é recolhido e fica retido no lúmen uterino também pode resultar numa gestação. A retenção de fluido de recolha após a lavagem predispõe a contaminação uterina, que por sua vez resulta em endometrite. Posto isto, o comportamento ideal após a recolha é realizar o controlo no dia seguinte, para despistar a presença de endometrite, e alguns dias após para comprovar que a dadora retornou ao estro (Blanchard et al., 2011a).
1.3.2 Seleção e maneio da égua recetora
A seleção, maneio e qualidade das recetoras é considerada o fator mais importante de um programa de TE tendo em conta que influencia a eficiência do mesmo (Riera, 2011a). A sua importância foi menosprezada durante muitos anos, pelo que não lhe eram prestados os cuidados ideais de sanidade e alimentação em relação às dadoras. Hoje em dia ocupa um papel importante em todos os programas de TE, é reconhecida a sua importância e a sua maior procura e maior custo reflete a sua valorização (Losinno & Alvarenga, 2006).
A recetora deve apresentar uma boa condição corporal, com o seu peso entre os 400 e os 500 Kg (Riera, 2011a), pois éguas magras apresentam uma má conformação perineal que pode facilitar uma contaminação bacteriana na altura da transferência e posteriormente uma morte embrionária (Blanchard et al., 2011a). A alimentação é muito importante, sendo que as éguas para além de apresentarem uma boa condição corporal devem estar em balanço energético positivo, o que se torna mais importante em recetoras gestantes. A idade deve estar compreendida entre os 3 e os 14 anos, no entanto a idade ideal situa-se entre os 5 e os 9 anos (Losinno & Alvarenga, 2006; Riera, 2011a), diminuindo assim os casos de endometrite crónica que interferem com a manutenção da gestação. Deve evidenciar um carácter dócil, saúde dental (Blanchard
17 et al., 2011a) e possuir habilidade materna (Fleury et al., 1989) aliada a um bom desenvolvimento mamário que permita fornecer um bom aleitamento ao poldro (Blanchard et al., 2011a). O tamanho é muito importante e deve ser adequado ao da dadora, tendo em conta que tem efeito no tamanho do poldro. Os requisitos de seleção podem variar entre centros de reprodução equina. Alguns dão preferência a éguas que já demonstraram que são capazes de levar uma gestação a termo, sendo que 2 meses após o parto podem ser usadas, e éguas nulíparas, pois não apresentam lacerações cervicais nem intervenções uterinas prévias (Hinrichs, 1993). A recetora não precisa de apresentar valor genético sendo que não tem influência sobre a genética do embrião transferido (Morel, 2002a).
É muito importante avaliar se o aparelho reprodutivo da égua é adequado para a receção do embrião (Blanchard et al., 2011a). Previamente à seleção devem ser sujeitas a um exame reprodutivo rigoroso, o que apesar de ser caro é fundamental para não escolher éguas que não estão aptas reprodutivamente. O exame deve incluir biópsia do endométrio, exame ecográfico, avaliação da integridade do aparelho genital externo e da competência cervical. Muitas vezes são escolhidas apenas por não apresentarem líquido uterino, o que não descarta a presença de um processo inflamatório. No mínimo deve ser realizado um exame citológico (Losinno & Alvarenga, 2006). Deve apresentar ciclos éstricos normais e regulares e apresentar-se livre de patologias ováricas, como tumores, e uterinas, como inflamação, quistos, presença de ar e detritos (Squires et al., 1999). As éguas cíclicas devem ser examinadas regularmente, e diariamente quando em estro, através de palpação e ecografia transretal, para avaliar o crescimento folicular, o dia da ovulação, que é fundamental determinar, a presença de CL, edema e fluido uterino. A avaliação da presença de líquido deve ser feito pelo menos até um dia após a ovulação para garantir que não têm enquanto entram em diestro (Blanchard et al., 2011a).
Devem ser evitados todos os fatores causadores de stress, como mudança de ambiente antes da transferência, que é considerado um fator crítico responsável pela diminuição da taxa de gestação (TG) ao afetar a manutenção do CL e impedindo a manutenção de uma gestação precoce. Posto isto, as recetoras devem estar inseridas no mesmo grupo de animais durante toda a época reprodutiva (Riera, 2011a). Quando gestantes devem dispor de cuidados redobrados, dispor de sombra, e não estar sujeitas a temperaturas altas, com alimentação adequada (Fleury et al., 1989).
No momento de selecionar uma recetora para realizar a transferência, é considerada aceitável se o CL é bem definido e tónus uterino e cervical de bom a excelente, razoável
18 se têm CL pequeno/mal definido ou tónus entre o razoável e o pobre, e inaceitável na presença de patologia uterina, sem CL, ou edema uterino marcado, (Carnevale et al., 2000) pois as éguas que apresentam excelentes tónus uterino e cervical apresentam taxas de gestação superiores (Squires et al., 2003).
O maneio das recetoras após a TE e as possíveis terapêuticas são os aspetos mais controversos da TE. Inicialmente pensava-se que a manipulação cervical na altura da transferência estimulava a libertação de PGF2α que por sua vez induzia a regressão do CL, porém mais recentemente constatou-se que isso não acontece. No entanto, a TE está sempre associada ao risco de contaminação uterina e consequente endometrite, que é a causa mais comum de luteólise do CL e diminuição dos níveis séricos de progesterona. Por forma a reduzir a probabilidade de uma eventual perda de gestação, alguns autores optam por realizar antibioterapia sistémica antes e após a transferência para evitar uma eventual perda de gestação, com ou sem a associação de flunixina meglumina (anti-inflamatório não esteroide) imediatamente antes da transferência e progestagénios durante 2 a 3 semanas com o objetivo de reduzir o risco de perda de gestação pela libertação de PGF2α e indução da luteólise (Stout, 2006). Alguns autores optam pela administração de progesterona de longa duração na altura da TE, por acreditarem que a suplementação de progesterona é importante, principalmente no final da época reprodutiva para diminuir a taxa de mortalidade embrionária (TME) (Riera, 2011a).
Após a transferência a recetora deve ser monitorizada regularmente, aos 11, 13, 17, 23 e 29 dias pós-ovulação e mais regularmente se aparecerem problemas de gestação. O aparelho reprodutivo deve ser examinado: o útero, em busca de sinais de endometrite, em que se pode iniciar antibioterapia, o CL e sinais indicativos de níveis baixos de progesterona como a diminuição do tónus uterino e cervical, em que se pode recorrer à suplementação de progesterona (Hartman, 2011).
1.3.3 Sincronização da égua dadora com a recetora
Comparando a égua com outras espécies domésticas, a sincronização da ovulação entre dadora e recetora na altura da TE assume uma maior dificuldade dada à complexidade do ciclo éstrico, que dificulta o procedimento. No entanto a sincronização não necessita de ser demasiado rigorosa o que acaba por contrabalançar (Stout, 2006; Allen, 2005). É a tarefa mais morosa de todo o programa de TE. As dadoras em estro devem ser monitorizadas regularmente após a deteção de um folículo dominante para determinar a altura da inseminação e o dia da ovulação, que é sempre considerado o dia 0 (Riera, 2011a).
19 Vários estudos definiram que a ovulação da recetora deve acontecer entre um dia antes (+1) até 3 dias depois (-3) da dadora para aumentar a probabilidade de manutenção de gestação após a transferência do embrião. Fora deste intervalo a TG baixou acentuadamente (Stout, 2006; Allen & Rowson, 1975; Squires & Seidel, 1995). Uma assincronia de 4 a 5 dias depois (-4 ou -5 dias) acaba por aumentar a probabilidade de resultar numa perda de gestação (Stout, 2006).
Tabela 2. Sincronia entre égua dadora que ovulou 7 dias antes da recolha e as potenciais recetoras que ovularam entre 2 dias antes até 3 dias depois da dadora. Adaptado de McCue & Squires (2015c).
Dia da recolha Dia da ovulação da recetora Sincronia Avaliação D9 +2 Não aceitável D8 +1 Usar se necessário D7 D7 0 3ª escolha D6 -1 1ª escolha D5 -2 2ª escolha D4 -3 Usar se necessário
A necessidade de existirem no mínimo 2 recetoras por cada dadora, aumenta a probabilidade de haver uma sincronização entre a dadora e uma recetora que tenha ovulado espontaneamente sem recorrer à utilização de hormonas. No entanto, nem sempre é possível, pelo que a sincronização da ovulação é normalmente conseguida através de hormonoterapia (McKinnon & Squires, 2007).
A sincronização pode ser conseguida através de diferentes metodologias: interrupção da fase lútea, prolongamento da fase lútea, indução da ovulação e inibição da fase folicular. Alguns dos fármacos mais utilizados são as prostaglandinas, os progestagénios, a gonadotrofina coriónica humana (hCG), o acetato de deslorelina e o estradiol-17β.
A administração de PGF2α deve ser realizada na presença de um CL maduro, 5 dias pós-ovulação, por forma a causar a sua lise e interromper assim a fase lútea, permitindo que a égua torne ao estro, 5 a 7 dias depois, sendo que a ovulação ocorre 9 a 11 dias após administração. Todavia, o intervalo entre a administração e o início do estro e da ovulação pode ser variável, consoante o tamanho e tipo de folículos presentes no momento da administração.
20 Entre os fármacos utilizados para induzir a ovulação, os mais utilizados são a hCG e o acetato de deslorelina. Na presença de uma égua em estro com um folículo com ≥ 35 mm, deve ser administrado hCG ou acetato de deslorelina, que resulta na ovulação após 36 ± 4 horas ou após 41 ± 3 horas, respetivamente (Riera, 2011a; Bradecamp, 2007; Squires, 2008).
1.3.4 Inseminação da dadora
A inseminação da dadora no momento certo é um fator importante e influenciador do sucesso num programa de TE (Riera et al., 2000). A indução da ovulação permite prever a altura da ovulação, ou seja, a altura ideal para realizar a inseminação, o que permite aumentar a fertilidade e minimizar a quantidade de IA realizadas em cada ciclo éstrico. Atualmente há uma grande procura de sémen de garanhões populares e, por norma, recorre-se ao uso de sémen refrigerado e congelado, o que torna a quantidade de sémen disponível por cada ciclo éstrico reduzida e realça a importância de realizar a IA no momento certo e apenas uma vez (Squires, 2008). A IA com sémen congelado, dada a sua reduzida longevidade, deve ser realizada dentro do intervalo que vai das 12 horas antes até às 6 horas após a ovulação, no entanto o ideal é a égua ser monitorizada a cada 6 horas, 24 horas após a indução da ovulação, para realizar a inseminação no momento em que se deteta a ovulação (Bradecamp, 2007). Éguas suscetíveis a desenvolver endometrites pós-cobrição devem ser inseminadas através de um procedimento com a menor contaminação possível (Riera, 2011a).
1.3.5 Transferência transcervical do embrião 1.3.5.1 Recolha do embrião
A técnica de recolha do embrião mantém-se praticamente inalterada desde que foi estabelecida, tirando o facto de atualmente existirem meios de lavagem a nível comercial (Squires, 2013).
Após a entrada do embrião no útero este pode ser recolhido. A recolha pode ser realizada entre o D6 e o D9 embora a altura ideal seja no D7 ou no D8, em que a TRE é maior e a maioria dos embriões são blastocistos expandidos, facilmente visíveis ao microscópio. Por vezes são recolhidas mórulas de éguas velhas ou de éguas inseminadas com sémen congelado que podem não estar presentes em dias anteriores ao D7 a D8. A recolha no D6 apenas é vista como vantajosa caso o objetivo seja a congelação do embrião. A recolha no D9 não é aconselhável, pois o dano durante a manipulação é muito provável, devido ao grande diâmetro que o embrião apresenta nesta fase, sendo que a taxa de transferência com sucesso é menor em relação ao D7 e D8 (Vanderwall & Woods, 2007; Stout, 2006; McCue et al., 2003). A recolha no D8 e
21 no D9, caso não haja dano embrionário pela manipulação, tem a vantagem de os embriões serem facilmente visualizados macroscopicamente o que acelera todos os passos seguintes como a identificação e avaliação do embrião e a transferência, reduzindo assim a manipulação da dadora, o custo, o tempo despendido pelo operador e a exposição do embrião a condições desfavoráveis fora do ambiente uterino (De Paula Lopes et al., 2011).
Previamente à recolha a dadora deve ser contida, a cauda revestida e desviada para um dos lados, as fezes evacuadas e avaliado o tamanho do útero, o tónus uterino e cervical, realizada a desinfeção da zona perineal, da vulva e do vestíbulo vaginal, para evitar a contaminação do cateter. A tranquilização não é sempre necessária, no entanto pode recorrer-se a uma ligeira sedação com a administração endovenosa de xilazina. Há inúmeros meios de lavagem a nível comercial, no entanto a escolha costuma recair sobre o LR, dado o seu baixo preço e a boa avaliação macroscópica do embrião que proporciona. A recolha do embrião é feita através de uma lavagem uterina transcervical, com um cateter de silicone flexível do tipo “Foley” unido a um sistema em “Y” onde estão conectados numa ponta superior o meio de lavagem e na outra inferior um filtro coletor poroso de 75 µm. É inserido o cateter através da cérvix até ao corpo do útero e o balão da extremidade é insuflado com 60 a 80 ml de ar e deslocado caudalmente até ao óstio interno da cérvix, ocluindo assim o lúmen uterino (Figura 9). O meio de lavagem deve estar a uma temperatura entre os 30 e os 35ºC e por meio da força da gravidade são introduzidos entre 1 a 2 litros em cada lavagem, o suficiente até encher o lúmen uterino e permitir que o líquido chegue a todas as partes do útero, sendo que este procedimento deve ser realizado entre 3 a 4 vezes. Após a repleção do útero deve-se permitir que o fluido retorne, por meio da força da gravidade, através da outra via do “Y” e passe através do filtro onde o embrião fica retido recoberto de fluido, sendo que para facilitar o processo pode-se realizar uma massagem uterina via retal ou uma administração endovenosa de oxitocina (Squires et al., 2003; Blanchard et al., 2011a; Vanderwall & Woods, 2007; McCue et al., 2010).
Deve ser recolhido no mínimo 95% do fluido e de uma maneira contínua enquanto o operador move o útero com os dedos para causar turbulência, sendo que em algumas recolhas pode ser complicado recolher a totalidade do fluido (Riera, 2011b).
22
Figura 9 - Ilustração do posicionamento do cateter no útero da égua previamente ao “flushing”. Após a inserção do cateter através da cérvix, o balão é insuflado com ar e o cateter é retraído até ao óstio interno da cérvix. Adaptado de Blanchard et al. (2011a).
1.3.5.2 Identificação e avaliação do embrião
Os últimos 20 a 50 ml do fluido são retidos no filtro e geralmente é possível observar macroscopicamente embriões de maior tamanho, D8 e D9, sendo que embriões mais pequenos normalmente só conseguem ser observados ao microscópio. O conteúdo é então transferido para uma placa de Petri estéril com uma grelha na base para ajudar a pesquisa do embrião através do microscópio, sendo que todo o procedimento é realizado em ambiente estéril dentro de uma câmara de fluxo laminar. É considerado normal o aparecimento de detritos neste fluido, principalmente quando se trata de éguas velhas e éguas lactantes. A não transparência do fluido pode ser indicativo de endometrite. Caso não se encontre um embrião, o conteúdo pode ser recolocado no filtro e ser transferido de novo para a placa de Petri para uma nova pesquisa. Quando o embrião é identificado deve ser sujeito a várias lavagens, num meio de manutenção, com o auxílio de uma pipeta manipuladora de embriões e posteriormente transferido para uma placa escavada com poços contendo o mesmo meio (Figura 10). Este meio constitui um ambiente adequado para o embrião, que se torna útil caso a transferência não seja realizada no momento. A lavagem ajuda a diluir qualquer microrganismo que tenha sido introduzido durante a recolha ou que estivesse presente no útero da dadora. Através de uma maior ampliação, o embrião deve ser classificado em relação ao grau de qualidade, tamanho e ao seu estado de desenvolvimento (Vanderwall & Woods, 2007; Stout, 2006; Blanchard et al., 2011a; McKinnon & Squires, 2007). É necessário
23 um microscópio de boa qualidade, com micrómetro para medir o embrião. O embrião é lavado duas a 3 vezes com o meio de manutenção. O fluido inicial pode conter grande quantidade de detritos celulares e o objetivo é transferir o embrião daquele meio inicial e ir removendo detritos durante as lavagens. No final da lavagem é mantido no meio de manutenção e avaliado antes da transferência, transporte ou congelação (McCue et al., 2009).
Figura 10- Placa escavada de 5 poços contendo meio de manutenção usado para a lavagem dos embriões. Adaptado de McCue & Squires (2015a).
Quanto à fase de desenvolvimento, os embriões podem ser classificados em mórula, blastocisto jovem, blastocisto ou blastocisto expandido. A maioria dos embriões recolhidos são de excelente ou boa qualidade devido ao transporte seletivo de embriões viáveis através do oviduto, no entanto em alguns casos pode ser encontrado um UFO (ao contrário do embrião não “rolam” com a manipulação da placa), que é normalmente retido no oviduto, pelo que se assume que seja proveniente de uma ovulação de um ciclo éstrico anterior e tenha acompanhado um embrião durante a sua descida até ao útero. Quando tal acontece é necessário continuar a pesquisa do embrião tendo em consideração que pode estar retido no lúmen uterino ou ainda no oviduto da dadora, e que uma nova tentativa de recolha pode resultar na recolha do embrião (Stout, 2006; McCue et al., 2009). A diferenciação de estruturas não embrionárias como detritos celulares, material orgânico e outros tipos de detritos deve ser baseada na presença ou ausência de ZP, forma e tamanho (McCue et al., 2009).
O grau de qualidade pode ser medido de acordo com uma escala que através da morfologia e viabilidade permite avaliar desde o grau 1 (excelente) até ao grau quatro (degenerado ou morto) ou em UFO (Tabela 3). Por forma a serem classificados são observadas as seguintes características: 1) forma (esférico, oval, colapsado, entre outros), 2) espessura da ZP, 3) uniformidade dos blastómeros (tamanho, cor, estrutura), 3) presença/ausência de blastómeros extrusados ou degenerados, 5) compactação dos