Qualidade microbiológica do kefir
Microbiological quality of kefir
DOI:10.34117/bjdv6n1-309Recebimento dos originais: 30/11/2019 Aceitação para publicação: 28/01/2020
Tamara Gomes Machado Ghedini
Formação acadêmica mais alta: Graduada em Nutrição Instituição: Universidade de Franca
Endereço: Av. Dr Armando Salles Oliveira, 201. Parque Universitário – Franca – SP. CEP 14404-600
E-mail: ttamaramachado@yahoo.com.br
Laiane Vanessa Bento
Formação acadêmica mais alta: Graduada em Nutrição Instituição: Universidade de Franca
Endereço: Rua Maira Gomes Carrion, 6650. Franca Pólo Clube – Franca-SP. CEP 14412-318 E-mail: laianevbf@hotmail.com
Lenita Simões Mioto
Formação acadêmica mais alta: Graduada em Biomedicina Instituição: Universidade de Franca
Endereço: Rua Duque de Caxias, 562. Ipuã-SP. CEP 14610-000 E-mail: lenita_simoes@hotmail.com
Letícia Caroline de Oliveira
Formação acadêmica mais alta: Graduada em Biomedicina Instituição: Universidade de Franca
Endereço: Rua Coronel Joaquim Barbosa de Salles Pinto, 1750. Franca-SP. CEP 14407-262 E-mail: leticiaoliveiratorres23@gmail.com
Maria Anita Lemos Vasconcelos Ambrosio
Formação acadêmica mais alta: Mestre em Ciências Instituição: Universidade de Franca
Endereço: Avenida São Vicente, 3371, apto. 24, bloco 1. Franca-SP. CEP 14403-720 E-mail: malvasconcelos@yahoo.com.br
Carlos Henrique Gomes Martins
Formação acadêmica mais alta: Doutor em Análises Clínicas Instituição: Universidade Federal de Uberlândia
Endereço: Av. Pará, 1720, bloco 4C. Umuarama 38400-902. Uberlândia-MG E-mail: carlos.martins2@ufu.br
Maria Gorete Mendes de Souza Carrijo
Formação acadêmica mais alta: Doutora em Ciências Instituição: Universidade de Franca
Endereço: Av. Dr Armando Salles Oliveira, 201. Parque Universitário – Franca – SP. CEP 14404-600
Taila Freitas Magrin
Formação acadêmica mais alta: Mestre em Ciências Nutricionais pelo programa de Pós-Graduação em Alimentos e Nutrição da Faculdade de Ciências Farmacêuticas da Universidade Estadual
Paulista Júlio de Mesquita Filho (UNESP). Instituição: Universidade de Franca
Endereço: Av. Dr Armando Salles Oliveira, 201. Parque Universitário – Franca – SP. CEP 14404-600
E-mail: taila.freitas@hotmail.com
RESUMO
Objetivo: Avaliar a qualidade microbiológica de grãos de Kefir cultivados em leite e água, quanto à presença de microrganismos contaminantes. Metodologia: Foram avaliadas 7 amostras de grãos de Kefir doadas voluntariamente (sendo amostras 1, 2 e 3 cultivadas em água e 4, 5, 6 e 7 em leite integral UHT). Foram pesadas 25g dos grãos em sacos esterilizados, adicionando 225mL de água peptonada para homogeneização (diluição 1). Em seguida, foram realizadas diluições 2 e 10-3 em tubos de água peptonada. Para o ensaio de coliformes, 1 mL de cada diluição foi inoculado em tubos de Caldo LST (incubação a 37°C/24-48 hs). Alíquotas desses tubos foram inoculadas em tubos de caldo VB e EC. Para a leitura, foi consultada a tabela do NMP (14). O cultivo de aeróbios mesofilos foi realizado em ágar PCA, semeando 100 ul de cada diluição com incubação a 37ºC/24 horas para a contagem em UFC/g. Do mesmo modo, foi realizado o ensaio de psicrotróficos, porém, com incubação das placas por 10 dias sob refrigeração. O ágar Rosa Bengala foi utilizado para contagem bolores/levedura (UFC/g) incubando a 25°C/5 dias. Resultados: Dentre as amostras analisadas, a maioria não apresentou coliformes, com exceção das amostras 1 e 3 que demonstraram a presença de coliformes totais. Já para aeróbios mesófilos, foram detectados em todas as amostras, destacando-se a 3 e a 7 com valores acima de 105 UFC/g. Os psicrotróficos não foram isolados somente na amostra 2, no entanto, novamente nas amostras 3 e 7 foram obtidas contagens acima do permitido. Para bolores, somente na amostra 3 houve crescimento. Enquanto que, para leveduras, houve ausência nas amostras 1 e 4, porém, destaca-se mais uma vez a amostra 3 com valores não tolerados pela legislação. Conclusão: Os dados obtidos vêm alertar que os repasses contínuos dos grãos de Kefir alteram a sua composição original, favorecendo a presença de microrganismos contaminantes provavelmente pela manipulação, higienização e armazenamento deficientes, não descartando a ocorrência de patógenos, o que representa riscos à saúde dos consumidores.
Palavras-chave: Kefir, Análise microbiológico, Alimento funcional ABCTRACT
Objective: To evaluate the microbiological quality of Kefir grains grown in milk and water, for the presence of contaminating microorganisms. Methods: A total of 7 samples voluntarily donated kefir grains (sample being 1, 2 and 3 in cultured water and 4, 5, 6 and 7 in full UHT milk). 25g of the grains were weighed in sterile bags, adding 225ml of homogenization peptone water (dilution 10-1). Then, dilutions 10-2 and 10-3 were performed in peptone water tubes. For testing of coliforms, 1 ml of each dilution was inoculated into LST broth tubes (incubation at 37 ° C / 24-48 hours). Aliquots of these tubes were inoculated into VB and EC broth tubes. For reading, the table was referred to MPN (14). The mesophilic aerobic cultivation was performed in the PCA agar, spreading 100 ul of each dilution with incubation at 37 ° C / 24 hours for the count of CFU / g. Similarly, it performed the assay psychrotrophic, however, with incubation of the plates for 10 days under refrigeration. Rose Bengal Agar was used to count mold / yeast (CFU / g) incubating at 25 ° C / 5 days.-Results: Of the samples tested, most showed no coliforms, except for samples 1 and 3 which demonstrated the presence of coliforms. As for mesophilic aerobic, They were detected in all samples, highlighting to 3 and 7 to values above 105 CFU / g. The psychrotrophic were not isolated only in sample 2, however, again in the samples 3:07 counts were obtained above allowed. For molds, the only sample 3 was
growing. While for yeast, there was absence in the samples 1 and 4, however, stands out once again sample 3 with values not tolerated by legistation. Conclusion: The data obtained warn that the continuous transfers of Kefir grains alter their original composition, favoring the presence of contaminating microorganisms probably due to poor handling, hygiene and storage, not ruling out the occurrence of pathogens, which represents health risks to consumers-
Key words: Milk kefir, Analysis Microbiological, Functional foods
1 INTRODUÇÃO
O Kefir consiste em um leite fermentado a partir de grãos de uma mistura específica e complexa de bactérias e leveduras que vivem em uma simbiose. É constituído por uma microbiota com presença de aproximadamente 35 espécies diversificadas, composta por Lactobacillus casei
Bilidobacterium sp, Streptococcus salivarius subsp Thermophilus, Leuconostoc, Lactococcus e Acetobacter, com produção de ácido lático, etanol e dióxido de carbono. Estes grãos também são
constituídos por leveduras fermentadoras de lactose (Kluyveromyces marxianus) e leveduras não fermentadoras de lactose (Saccharomyces exiguus), mantidos juntos pela matriz de polissacarídeos, proteínas e lipídeos que formam seus grãos, variando conforme a região de origem e o tempo de utilização1,2.
A palavra quefir ou Kefir é de origem turca e o termo significa "bem-estar" ou "sentir-se bem". Conhecido a mais de 2000 a.C., na região do Cáucaso, como um presente de Alá (Deus), pois descobriram que os leites frescos carregados em bolsas de couro poderiam fermentar, resultando em uma bebida efervescente, de cor branca, com grãos gelatinosos irregulares de 1 a 2 cm de diâmetro e aparência de couve flor3,4,5.
Existe também o kefir de água que pode ser cultivado em água contendo açúcar mascavo ou em sucos de frutas. A composição microbiana de ambos e sua fermentação são similares aos grãos cultivados no leite, podendo o de água ficar na coloração parda ou ocre, enquanto o de leite fica na coloração amarelada6,7,8.
O preparo do kefir, tanto em água ou em leite, é o mesmo. O procedimento mais tradicional da produção da bebida ocorre pela adição de 5% dos grãos de kefir na base de preferência. No leite ou na água com açúcar mascavo necessitam ser fervidos ou pasteurizados e posteriormente resfriado a 25°C em temperatura ambiente para que ocorra a inoculação dos grãos 9,6.
Quando consumidos regularmente e em quantidades adequadas, conferem benefícios a saúde do hospedeiro, reduzindo o risco de doenças e melhorando o bem-estar, o que gerou um grande interesse por aqueles que buscam alternativas para promover a saúde. Portanto o Kefir, além de nutrir, é considerado um alimento funcional, capaz de afetar beneficamente o corpo e a saúde 10.
desempenhar um papel importante na redução dos riscos de doenças crônicas não transmissíveis11,12. Sendo que o grupo destes alimentos que recebem grande destaque são os prebióticos, constituídos pelas fibras dietéticas, que estimulam a proliferação das bactérias desejáveis no intestino, e os probióticos, que contem microrganismos vivos que colaboram na manutenção da flora intestinal, como os leites fermentados, os quais são resultantes da fermentação microbiológica do leite, no qual o Kefir se enquadra13,14.
Ademais estudos demonstram que o consumo de kefir, pode modular favoravelmente a microbiota intestinal, diminuindo a inflamação sistêmica, o estresse oxidativo, melhorando a digestão da lactose e condições clinicas como doenças intestinais inflamatórias, diabetes e dislipidemias15,16,17. Para os indivíduos intolerantes à lactose, o Kefir produzido no leite de vaca, ou em outros leites, como de ovelha, cabra ou búfala, não oferecem risco de consumo, ou oferecem risco menor, pois o iogurte preparado a partir do Kefir melhora a digestão da lactose, pelo o alto nível da atividade da enzima beta-galactosidase encontrada no Kefir, reduzindo o teor de lactose na fermentação. Outro fator que colabora é que o leite fermentado acelera o trânsito intestinal, comparado ao leite tradicional 18.
Sua composição nutricional varia dependentemente da composição do leite em que é produzido e dos grãos de kefir. O kefir, comparado ao leite não fermentado, obtém um valor nutricional maior de amônia, serina, lisina, alanina, treonina, triptofano, valina, metionina, fenilalanina e isoleucina. No processamento de fermentação, a proteína é digerida mais rápidamente, devido ao ácido da coagulação provocando a proteólise12,19.
O consumo do kefir no Brasil tem obtido exponencial aumento, devido aos seus benefícios e baixo custo. A sua principal forma de aquisição para o consumo consiste na doação dos grãos de kefir, feito através de repasse em potes de vidros ou saquinhos, podendo ser preparado e manuseados em casa. Por meio destes múltiplos repasses, pela forma de armazenamento e pelo método de manuseio, os quais não seguem nenhum critério de boas práticas de higiene e manipulação de alimentos, o produto final pode ser alterado, originando produtos não padronizados, podendo apresentar alterações em sua composição e na sua qualidade microbiológica.
A Agencia Nacional de Vigilância Sanitária (ANVISA) publicou uma Resolução da Diretoria Colegiada (RDC) N° 241, DE 26 DE JULHO DE 2018, dispõe sobre os requisitos para comprovação da segurança e dos benefícios à saúde dos probióticos para uso em alimentos, porém ainda não foram estabelecidos critérios para a padronização do cultivo de Kefir e para os repasses entre a população20. Portanto, o objetivo do presente trabalho foi avaliar a qualidade microbiológica nestes cultivos artesanais do Kefir, produzidos em leite e em água, verificando a presença de possíveis microrganismos contaminantes provenientes de repasses entre consumidores na cidade de Franca/SP.
2 MATERIAIS E MÉTODOS
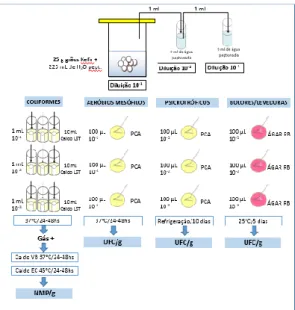
Para a pesquisa, foram coletadas sete amostras de Kefir doadas voluntariamente por consumidores na cidade de Franca/SP, denominadas de 1 a 7 (sendo 1, 2 e 3 cultivadas em água e 4, 5, 6 e 7 cultivada em leite integral UHT para descartar possíveis contaminações veiculadas por leite. As amostras foram coletadas em dias alternados, sendo transportadas em recipientes de vidro em caixas isotérmicas para serem analisadas no Laboratório de Pesquisa em Microbiologia Aplicada da Universidade de Franca (LaPeMa).
Para as análises microbiológicas, a metodologia para diluição das amostras seguiu os padrões definidos pela Internacional Organization for Standardization (ISO) 21.
Inicialmente foram pesadas 25g de cada amostra (contendo os grãos acrescidos de uma parte do líquido) em sacos plásticos esterilizados e, posteriormente 225 mL de água peptonada foram adicionados para homogeneização. A partir dessa primeira diluição (10-1), foi transferido 1 mL para um tubo de ensaio contendo 9 mL de água peptonada, correspondendo a diluição de 10-2. Por fim, desta diluição (10-2), 1 mL do líquido foi transferido para outro tubo para se obter a diluição 10-3. Para o ensaio de coliformes totais e termotolerantes (ISO 4831:2006), no teste presuntivo, de cada diluição, 1 mL foi retirado e inoculado em três tubos com 10 mL de Caldo Lauril Sulfato Triptose (LST) contendo tubos de Duhran. Após a incubação a 37°C por 24 a 48 horas, os tubos que apresentaram crescimento (turbidez) com presença de gás nos tubos, foram considerados positivos. Para o teste confirmativo para coliformes termotolerantes, uma alçada dos tubos positivos foi transferida para um tubo contendo 10 mL de caldo EC com incubação a 44° C (banho-maria) por 24 a 48 horas. Do mesmo modo, para confirmação dos coliformes totais, uma alçada dos tubos positivos foi transferida para um tubo de Caldo Verde Brilhante (VB) a 2% incubando a 37 C por 24 a 48 horas. Após a leitura dos tubos foi consultada a tabela do Número Mais Provável para a quantificação dos coliformes 21.
O cultivo de aeróbios mesofilos viáveis foi realizado em ágar Plate Count (PCA), semeando alíquotas de 100 µL de cada diluição com auxílio da alça de Drigalski. Procedeu-se a incubação das placas a 37C por 24 horas com posterior contagem das colônias em UFC/g 21.
Já para o cultivo de aeróbios psicrófilos foi realizado também em ágar Plate Count (PCA), semeando alíquotas de 100 µL de cada diluição com auxílio da alça de Drigalski. Procedeu-se a incubação das placas por 10 dias sob refrigeração com posterior contagem das colônias em UFC/g 21. A contagem de bolores e leveduras foi realizada em ágar Rosa Bengala com semeadura de 100 µL de cada diluição com o auxílio da alça de Drigalski e com incubação a 25°C por 5 dias. Após esse período foi realizada a contagem de bolores e leveduras em UFC/g21.
Figura 1. Avaliação microbiológica do Kefir de água e de leite.
3 RESULTADOS
Os resultados obtidos das análises microbiológicas das sete amostras de kefir avaliadas foram demonstrados no Quadro 1.
Primeiramente, vale ressaltar que além das bactérias isoladas, obteve-se a presença majoritária de leveduras e bolores nas amostras analisadas. Diante disso, optou-se pela identificação bacteriana afim de detectar possíveis contaminações cruzadas, que geralmente acontece por manipulação inadequada, falta de higiene e até mesmo através de recipientes mal higienizados.
As análises microbiológicas revelaram que em todas as amostras houve ausência de coliformes termotolerantes (45º/g), no entanto, nas amostras 1 e 3 foram encontrados coliformes totais (35º/g) com valores de 43 NMP/g. Segundo o Regulamento Técnico de Identidade e Qualidade de Bebidas lácteas do Ministério da Agricultura e Abastecimento, os parâmetros mínimos e máximos de contagem para coliformes a 35ºC/g são de 10 a 100 respectivamente. Para a amostra indicativa (única amostra) como foi analisada no presente trabalho, atribui-se o valor máximo permitido, correspondendo a 100 coliformes 35ºC/g., no entanto, observa-se que as amostras 1 e 3 ultrapassaram o valor aceitável de 10 coliformes 35ºC/g, demonstrando que, caso as análises fossem replicadas conforme sugere o regulamento, provavelmente, essas amostras de kefir seriam classificadas como inaceitáveis para consumo humano 22.
O grupo de coliformes totais pertence à família Enterobacteriaceae compreendendo bacilos Gram-negativos aeróbicos ou anaeróbicos facultativos, com maior predomínio do gênero Escherichia, Enterobacter e Klebsiella.23, 24. A presença dessas bactérias não significa que teve uma contaminação recente exclusivamente com material fecal, podendo ser encontradas também em reservatórios ambientais, como solo e água 21, 25.
Quadro 1. Resultados das análises microbiológicas de amostras de Kefir Cultivo Amostras Kefir Coliformes Totais (NMP/g) Coliformes Termotolerantes (NMP/g) Aeróbios Mesófilos (UFC/g) Psicrotróficos (UFC/g) Bolores e Leveduras (UFC/g) Leveduras Bolores Água
1 43 Ausente 7,2 x 103 1,3 x 103 Ausente Ausente
2 Ausente Ausente 5,3 x 104 Ausente 7,5 x 104 Ausente
3 43 Ausente 1,0 x 107 1,0 x 107 8,2 x 106 1,6 x
105
Leite
4 Ausente Ausente 1,0 x 102 Ausente Ausente Ausente
5 Ausente Ausente 3,5 x 103 5,8 x 103 6,4 x 104 Ausente
6 Ausente Ausente 3,6 x 104 1,3 x 104 2,0 x 105 Ausente
7 Ausente Ausente 1,0 x 105 9,5 x 106 1,3 x 105 Ausente
A detecção de coliformes totais está associada a uma possível falha na higienização no processo de fabricação, falhas de processamento ou contaminação após processamento.
Já os coliformes termotolerantes são classificados do subgrupo de coliformes totais, que são capazes de fermentar a lactose com a produção de gás mesmo quando incubados à temperatura de 45,5°C. Assim a contagem de coliformes termotolerantes fornece com segurança, informações sobre a qualidade e condições higiênico sanitárias do produto, já que a E. coli é a principal bactéria deste grupo, sendo considerada indicadora de contaminação fecal recente.
Segundo a FAO (Food and Agricultural Organization) e a OMS (Organização Mundial da Saúde) relatam que não é possível avaliar a segurança de alimentos em virtudes dos níveis de E.coli, coliformes totais e termotolerantes. Já se sabe que sua ausência nem sempre significa que o produto seja de boa qualidade ou livre de bactérias patogênicas26.
Ribeiro analisou amostras de bebida de kefir artesanal no Rio Grande do Sul detectando coliformes totais em todas as amostras, as quais estavam acima dos valores máximos permitidos pela legislação brasileira (0,6 log 10 UFC/mL)27,28. Os autores ressaltaram que, os coliformes são indicativos de condições higiênico-sanitárias em alimentos lácteos e populações acima de 2log10 UFC/mL, são resultantes de mas práticas de higiene e contaminação ambiental25. Para a contagem dos coliformes termotolerantes, nenhuma das amostras sofreu divergência o que corrobora com o presente trabalho, visto que é um importante indicativo no ponto de vista sanitário. Por outro lado, os autores destacam que o processo fermentativo do kefir desempenha a função de bioconservação e estabilização microbiológica, porém, necessita de mais estudos aprofundados para a sua elucidação, pois os dados encontrados no presente estudo demonstram que essa função não foi capaz de retardar o crescimento de microrganismos contaminantes.
Já Caetano et al., utilizou grãos de kefir obtidos através de doações na cidade de Curitiba/PR. Estes grãos foram preparados diariamente como segue a cultura do kefir, por meio de repasses no período de 2 meses, os quais foram contaminados com a bactéria Escherichia coli (principal
representante dos coliformes termotolerantes e principal indicador de higiene em alimentos). Os resultados mais uma vez confirmaram que o processo fermentativo não foi capaz de inibir o crescimento de E. coli29.
Em outro trabalho, Dias et al., relataram que o Kefir apresenta um potente efeito antimicrobiano, o que contradiz o trabalho de Caetano et al., no qual mostraram um efeito contrário, ressaltando o perigo de se manipular alimentos de forma inadequada, e principalmente se tratando de um leite fermentado onde o seu resultado final pode ser alterado, devido as condições de preparo e manuseio.29, 30.
Na fabricação dos produtos lácteos fermentados, as leveduras têm um papel importante no processo fermentativo, além de proporcionar nutrientes essenciais para o crescimento, como aminoácidos e vitaminas, alteram o pH, expelir etanol e produzir CO2, além de produzir metabólitos, o que favorece de forma positiva o sabor do kefir3. Destaca-se algumas das leveduras benéficas presentes no kefir como Kluyveromyces marxianus (fermentadoras de lactose) e Saccharomyces
omnisporus, Saccharomyces cerevisiae e Saccharomyces exiguss (não fermentadoras de lactose) 32. Porém, o excesso de leveduras em bebidas fermentadas pode deteriorar e consequentemente desencadear algumas patologias como reações alérgicas33.
Dentre as amostras de Kefir analisadas no presente estudo, somente as amostras 1 e 4 não apresentaram crescimento de leveduras, enquanto que as demais, demonstraram contagens consideráveis destacando-se a amostra 3 com a maior contagem de 8,2 x 106 UFC/g. Ressalta-se que a mesma amostra 3, foi a única a apresentar a contagem de bolores a 1,6 x 105 UFC/g.
A contagem de leveduras é de grande importância no kefir, visto que a legislação estipula um valor máximo de 105 UFC/g, o que reforça a má qualidade das amostras 3, 5 e 7 pelos valores acima do permitido, demonstrando também que não há padronização entre as amostras, provavelmente pelos repasses contínuos o que possibilitou alterações na constituição desses probióticos28.
No trabalho de Fusieger analisou-se amostras indicativas de kefir, onde as contagens obtidas para leveduras foram 7,5 x 105 UFC/g. Segundo o autor, estes valores são esperados, devido ao Kefir se tratar de grãos compostos por bactérias lácticas em simbiose com leveduras, o que de fato comprovou que não é comum o crescimento de bolores neste alimento, o que em parte corrobora com o presente trabalho, no qual na maioria das amostras houve o crescimento de leveduras com exceção das amostras 1 e 4 e somente na amostra 3 detectou-se a presença de bolores34. Esses dados mostram que a ausência de leveduras, não condiz com o perfil microbiológico que deve ser encontrado em kefir, como também, a presença de bolores representa uma qualidade insatisfatória para o consumo humano.
porém, dependendo das espécies, podem ser prejudiciais à saúde por serem produtores de micotoxinas, com efeitos hepatotóxico, nefrotóxico, neurotóxico, teratogênico e carcinogênico33.
Para reforçar a presença majoritária de leveduras em kefir, todas as suas amostras estavam com a contagem acima de 105 UFC/g para leveduras, apresentando diferenças relevantes entre as amostras27. Magalhaes et al., ao analisarem amostras de kefir, encontraram divergências na contagem, sendo de 6 a 8 log10 das amostras, indicando uma certa semelhança entre os estudos independente das regiões35. Estudos afirmam que a fermentação com grãos de kefir acontece em temperaturas ambientes 25⁰C, e que a mesma temperatura favorece o crescimento de leveduras36,37.
Para aeróbios mesófilos, em todas as sete amostras houve a presença desses microrganismos variando de 1,0 x 102 a 1,0 x 107 UFC/g, o que demonstra diferenças nos perfis das amostras e mais uma vez, a amostra 3 destacou pelo máximo valor encontrado. O Regulamento Técnico de Identidade e Qualidade de Bebidas Lácteas do Ministério da Agricultura e Abastecimento relata 100 UFC/g como o valor máximo estabelecido para a contagem de aeróbios mesofilos a 35°C28. Portanto, de acordo com o Regulamento, todas as amostras são consideradas impróprias para o consumo humano, com exceção da amostra 4 que está em conformidade (1,0 x 102 UFC/g).
Os aeróbios mesófilos são classificados como microrganismos indicadores de qualidade e higiene em alimentos, o que reflete as condições do controle da temperatura, transporte e armazenamento38. Essas bactérias se multiplicam entre 10 e 45°C, sendo que sua temperatura ideal é de 30°C. Considerando que essa temperatura inclui a maioria dos contaminantes, altas contagens podem ser atingidas nos alimentos, por serem mantidos em temperatura ambiente, como acontece no processo fermentativo do kefir.
A contagem total de aeróbios mesófilos não diferencia os tipos de bactéria, sendo utilizado para se obter informações gerais sobre a qualidade de produtos, práticas de manufatura, matérias primas utilizadas, condições de processamento, manipulação e vida de prateleira. Na literatura cita-se que não é um indicador de cita-segurança, já que não está relacionado a precita-sença de patógenos ou toxinas, podendo ser útil na avaliação da qualidade, entretanto populações altas de bactérias é indicativo de deficiências de sanitização ou no controle do processo ou até dos ingredientes21.
No estudo de Fusieger et al., também obtiveram aeróbios mesofilos com valores de 7,2 x 105 UFC/g e relataram que é comum essas contagens em kefir, porém no presente trabalho, optou-se por seguir as recomendações do Regulamento Técnico citado anteriormente, o qual classificaria essa contagem não permitida de acordo com o parâmetro estabelecido de 100 UFC/g34.
Segundo Almeida, ao analisarem grãos de Kefir de leite de vaca e de cabra, observaram que os dois leites tiveram uma contagem de aeróbios mesofilos acima de 2,5 x 106 UFC/Ml39. Os autores levaram em consideração que a análise microbiológica foi feita no início da ativação dos grãos, o que
pode ter influenciado o resultado. Além disso, outros resultados semelhantes foram encontrados por Garcia Fontán et al., os quais encontraram no início do processo fermentativo, contagens na ordem de 10 UFC/ mL aumentando continuamente até o limite de 103 UFC/ mL.(40) Esses estudos demonstraram variações nas contagens de aeróbios mesófilos enfocando que o tempo necessário para o processo fermentativo do kefir associado à permanência do produto em temperatura ambiente influenciam de modo significativo no aumento desses microrganismos.
Os psicrotróficos são bactérias que se multiplicam em temperatura entre (0-7°C), mas apresentam temperatura ótima acima de 20 ºC21. São considerados agentes de deterioração de leite cru e seus derivados, contaminando através da água com qualidade inadequada ou deficiência nos procedimentos de higiene durante a ordenha e mastite41. As principais bactérias psicrotróficas encontradas em produtos lácteos são espécies dos gêneros Acinetobacter, Aeromonas, Alcaligenes,
Arthrobacter, Bacillus, Brochothrix, Carnobacterium, Chromobacterium, Citrobacter, Clostridium, Corynebacterium, Enterobacter, Escherichia, Flavobacterium, Klebsiella, Lactobacillus, Leuconostoc, Listeria, Microbacterium, Micrococcus, Moraxella, Pseudomonas, Psychrobacter, Serratia, Shewanella, Streptococcus e Weissella. Algumas dessas bactérias são associadas às
intoxicações alimentares após consumo de leite ou produtos lácteos. Podem ser eliminadas em altas temperaturas, porém, os esporos de Bacillus cereus são termoresistentes, além da produção de enzimas como a protease e a lipase que atuam em leite cru e pasteurizado e derivados lácteos, causando alterações indesejáveis no leite21, 42.
Neste presente estudo, somente as amostras 2 e 4 apresentaram ausência de psicrotróficos, já as demais amostras apresentaram valores altos variando de 1,0 x103 a 1,0 x 107 UFC/g, destacando novamente a amostra 3 com os valores máximos encontrados. Ressalta-se que no Brasil não existe legislação para microrganismos psicrotróficos, considerando que altas contagens desses microrganismos refletem negativamente na qualidade final dos produtos lácteos43.
Também no estudo de Fusieger et al., foram avaliados psicrotróficos, os quais praticamente não foram detectados (<10 UFC/g), o que reforça a má qualidade encontrada nas amostras analisadas no presente estudo, que obtiveram valores de até 1,0 x 107 UFC/g.34
Portanto, diante dos dados obtidos, não se considera significativa a diferença entre perfis microbiológicos em amostras de kefir de água e de leite. Entretanto, nota-se que os coliformes totais foram encontrados somente nas amostras 1 e 3 que são de água, podendo sugerir que essa contaminação seja proveniente dos manipuladores e não propriamente da água, visto que, por mais que os usuários utilizem água de torneira sem passar por nenhum filtro, sabe-se que a água de Franca/SP é considerada uma das melhores do Brasil. 44
bacteriológico das mesmas amostras analisadas identificando espécies deteriorantes e patogênicas. Neste trabalho, as autoras Mioto & Oliveira isolaram das amostras de kefir, bactérias patogênicas como Globicatella sanguinis, Brevibacillus brevis, Staphylococcus saprophyticus, Aerococcus urinae, Streptococcus bovis, Corynebacterium species e Aeromonas hydrophila, as quais podem estar relacionadas à microbiota de ruminantes possivelmente vinculada ao leite utilizado em repasses anteriores, associadas à água ou aos recipientes mal higienizados e ainda relacionadas à microbiota dos manipuladores.34 Diante dos resultados obtidos, as autoras concluíram que entre as amostras analisadas foi constatada uma grande variação no perfil bacteriológico, visto que em algumas amostras, não continham os microrganismos benéficos desejados.
4 CONCLUSÃO
Os dados obtidos no presente estudo vêm alertar que os repasses contínuos dos grãos de Kefir alteram a sua composição original, favorecendo a presença de microrganismos contaminantes provavelmente pela manipulação, higienização e armazenamento deficientes, não descartando a ocorrência de patógenos, o que representa riscos à saúde dos consumidores.
REFERÊNCIAS
1. BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Resolução nº46, de 23 outubro de 2007. Padrões de Identidade e Qualidade (PIQ) de Leites Fermentados {acesso em 21 de set 2018}. Disponível em:http://www.cidasc.sc.gov.br/inspeção/
2. Magalhães KT, Pereira GVM, Campus CR, Dragone G, Schwan RF. Brazilian Kefir: structure, microbial communities and chemical composition, Brazilian Journal of Microbiology. 2011;42(2):693-702.
3. Irigoyen A, Arana I, Castiella M. Torre P, Ibánêz FC. Microbiological, physicochemical, and sensory characteristics of kefir during storage.Departamento de Ciencias del Medio, Área de Nutricíon y Bromatología, Natural, Universidad Pública de Navarra, Campus de Arrosadía s/n, 31006 Pamplona (Navarra), Spain, Food Chemistry. 2005;90:613-620.
4. Luíz LMP, Bernades PC, Lopes JP, Correia LO, Fernandes PE, Pimentel NJF, Ferreira CLLF. Microbiota de grãos de Kefir de diferentes origens. REVI. Instituto de Laticínio Cândido Tostes – Anais do XXIII congresso nacional de laticínios. 2006;61:117-119.
5. COSTA, N. M. B.; ROSA, C. O. B. Alimentos Funcionais: Componentes Bioativos e Efeitos Fisiológicos. 2ª edição revisada e ampliada. Rio de Janeiro: Rubio, 2016
of Nutrition. 2003;2(2):54-59.
7. Witthuhn RC, Schoeman T, Cilliers A, Britz TJ. Impact of preservation and different packaging conditions on the microbial community and activity of Kefir grains Department of Food Science, Stellenbosch University, Private Bag X1, Matieland, 7602, South Africa. Food Microbiology. 2005;22:337-344.
8. Weschenfelder S, Pereira GM, Carvalho HHC, Wiest J M. Caracterização físico-química e sensorial do Kefir tradicional e derivados. Arquivo Brasileiro de Medicina Veterinária e Zootecnia. 2011;63(2):473-480. 9. Ferreira CLLF. O leite fermentado do Kefir. Catálago Brasileiro de Produtos e Serviços. 1999;7:17-19. 10. Capriles VD, Silva KEA, Fisberg M. Prebióticos, probióticos e simbióticos: nova tendência no mercado de
alimentos funcionais. Rev. Nutrição Brasil. 2005:4(6):327-335.
11. Santos FL, Pereira FS, Souza AC. Avaliação da aceitação de kefir natural produzido com leite de vaca. In: Congresso latino-americano de analistas de alimentos, Cuiabá. Anais. Cuiabá, 2011. CD-ROM.
12. Vieira ACP, Cornelio AR, Salgado JM. Alimentos funcionais: aspectos relevantes para o consumidor. Jus
Navigandi. 2006;54:256.
13. Bastos MSR. Informações de sistema de qualidade NB 9.000 em laticínios em produção de iogurte e leite longa vida (UHT). Dissertação (Mesrado em Ciência e Tecnologia de Alimentos) -Universidade- de Federal de Viçosa, 1995:243.
14. FAO/WHO. Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria. Joint Food and Agricultural Organization of the United Nations and World Health Organization Expert Consultation Report, Córdoba, Argentina. 2001.
15. Deeseenthum S, Jhon S. Properties and benefits of Kefir-A review. Songklanakarin J.Sci. Technol., Maha Sarakham. 2015;37(3):275-282.
16. Bourrie B, Willing B, Cotter P. The Microbiota and Health Promoting Characteristics of the Fermented Beverage Kefir. Frontiers in Microbiology, Suiça. 2016;7:1-17.
17. Hsu YJ, Huang WC, Lin JS,Chen YM, Ho S,Huang CC,Ung Y. Kefir Supplementation Modifies Gut Microbiota Composition, Reduces Physical Fatigue, and Improves Exercise Performance in Mice. Nutrients, 2018; 4; 10(7).
18. Ahmed Z, Wang Y, Ahmad A, TariqKhan S, Nilsa M, Ahmad H, Afreen A. .Kefir and health: acontemporary perspective. Crit Rev Food Sci Nutr. 2013;53:422–434.
19. Ferreira C. Quefir como alimento funcional. In Alimentos Funcionais – Componentes Bioativos e Efeitos Fisiológicos [NMB Costa and CO Rosa, editors]. Rio de Janeiro: Editora Rubio LTDA 2010;1:111–122.
20. BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução RDC n°241, de 26 julho de 2018. Dispõe sobre os requisitos para comprovação da segurança e dos benefícios à saúde dos probióticos para uso em alimentos (acesso em 06 nov 2018). Disponível em http://pesquisa.in.gov.br/imorensa/
21. Silva N, Junqueira VCA, Silveira NFA, Taniwaki MH, Santos RFS, Gomes RAR. Manual de Métodos de Análises Microbiológicas de Alimentos e Água. 4 ed. São Paulo: Varella; 2010.
22. MINISTÉRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO. Resolução – n° 5 de 13 de novembro de 2000. Padrões de identidade e qualidade (PIQ) de leites fermentados. 2000.
23. Franco BDGM, Landgraf M. Microbiologia dos Alimentos. São Paulo: Atheneu, 2007.
24. Martins LSP. Monitoramento da produção de ácidos orgânicos em amostra de leite fermentado pelos grãos do Kefir do Tibet utilizando técnicas voltamétricas e HPLC. São Carlos: Instituto de Química de São Carlos da USP. 2006:176. (Tese, Doutorado em Ciências – Química Analítica).
25. Ortolani MBT. Bactérias ácido-láticas autóctones de leite cru e queijo minas frescal: Isolamento de culturas bactericinogênicas, caracterização da atividade antagonista e identificação molecular. 2009. Dissertação (Mestrado em Medicina Veterinária), Universidade Federal de Viçosa, Minas Gerais.
26. FAO. Food and Agriculture Organization of the United Nations. Food and agricultural commodities production. Disponível em : http://faostat.fao.org/site/339/default.aspx. Acesso em 18 de novembro de 2018. 27. Ribeiro AS. Caracterização de micro-organismos com potencial probiótico isolados a partir de kefir produzidos na região noroeste do estado do Rio Grande do Sul. 2015. 78 f. Dissertação (Mestrado em Ciência e Tecnologia dos Alimentos) – Universidade Federal de Santa Maria, Santa Maria, 2015
28. MINISTÉRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO. Resolução – n° 5 de 13 de novembro de 2000. Padrões de identidade e qualidade (PIQ) de leites fermentados. 2000
29. Caetano DR, Montanhini MTM. Análise microbiológica de leite fermentado Kefir produzido com leite contaminado por Escherichia coli. Rebrapa. 2014;5(1):33-38.
30. Dias PA, Rosa JV, Tejada TS, Timm CD. Propriedades antimicrobianas do Kefir.ArqInst Biol. 2016;83:1-5. 31. Farnworth, E. R. Kefir- a complex probiotic. Food Science and Technology Bulletin, 2005;2:1-17.
32. BRASIL. Ministério da Agricultura, Pecuária e Abastecimento (MAPA). Instrução normativa nº 46, de 23 de outubro de 2007. Adota o Regulamento Técnico de Identidade e Qualidade de Leites Fermentados, anexo à presente Instrução Normativa. Diário Oficial da República Federativa do Brasil, Brasília, 24 out 2007;1:4. 33. FREIRE, Francisco das Chagas Oliveira; VIEIRA, Icaro Gusmão Pinto; GUEDES, Maria Isabel Florindo;
MENDES, Francisca Noélia Pereira. Micotoxinas:Importância na Alimentação e na Saúde Humana e Animal. Embrapa Agroindústria Tropical, Fortaleza. Documentos 110, 1.ed. 2007
34. Fusieger A, Piovesan DM, Ecke J, Bayer VML, Laer AEV. Avaliação microbiológica de grãos de kefir artesanal.
35. Magalhães KT, Pereira GVM, Campus CR, Dragone G, Schwan RF. Brazilian Kefir: structure, microbial communities and chemical composition, Brazilian Journal of Microbiology. 2011;42(2):693-702.
36. Luíz LMP, Bernades PC, Lopes JP. Correia LO, Fernandes PE, Pimentel NJ, Ferreira CLLF. Microbiota de grãos de Kefir de diferentes origens. REVI. Instituto de Laticínio Cândido Tostes – Anais do XXIII congresso nacional de laticínios. 2006;61:117-119.
37. Otles S, Cagindi O. KEFIR: a probiotic dairy – composition, natural and therapeutic aspects, Pakistan Journal of Nutrition. 2003;2(2):54-59.
38. Silva MC. Avaliação da qualidade microbiológica de alimentos com a utilização de metodologias convencionais e do sistema SimPlate. São Paulo. Dissertação (Mestrado)- Escola Superior de Agricultura Luiz de Queiroz, Universidade de São Paulo, 2012.
39. Almeida FA, Angelo FF, Silva CS. Análise sensorial e microbiológica de kefir artesanal produzido a partir de leite de cabra e de leite de vaca. Rev. Inst. Latic. “Cândido Tostes”, Jan/Fev. 2011;378(66):51-56.
40. Fontán MCG, Marínes S, Franhco I, Carvalho J. Microbiological and chemical changes during the manufacture of Kefir made from cows´ milk, using a commercial starter culture. Àrea de TecnologÍa de los alimentos Facultad de Ciencias de Orense, Universidad de Vigo, 32004 Orense, Spain, Internacional Dairy Journal. 2006;16:762-767.
41. Pinto CJO, Martins ML, Vanetti MCD. Qualidade microbiológica de leite cru refri ger ado e isolamento de ba ctérias psicrotróficas proteolíticas. Ciência e Tecnologia de Alimentos, Campinas. 2006;26(3):645- 651. 42. Oliveira DT, Moreira A, Urnau L, Noskoski L, Cereser ND. Psicrotróficos na indústria de laticínios. XV
Amostra de Iniciação Científica. UNICRUZ, RS. 2012.
43. Bastos PB., Gonsales, JM., Almeida, L. M. N., Martins, R. S. & Florentino, E. R. (2012). Contagem de bactérias psicrotróficas e diferenciação comparativa pós-termização em leites pasteurizados. Paper presented at the ENECT, Anais do Encontro Nacional de Educação, Ciência e Tecnologia UEPB, João Pessoa, Paraíba, Brasil.
44. Oliveira G, Scazufca P, Pires RC. Ranking do saneamento instituto trata BRASIL 2018. [Internet]. [Local não informado: publicador não informado].São Paulo, abril de 2018. Disponível em: http://www.tratabrasil.org.br/blog/2018/05/17/resultados-saneamento-incriveis/
45. Mioto LS, Oiveira LC, Carrijo MGMS. Comparação do perfil bacteriológico em amostras de kefir na cidade de Franca/SP; 2018.