UNIVERSIDADE FEDERAL DO CEARÁ FACULDADE DE MEDICINA
PROGRAMA DE POS-GRADUAÇÃO EM CIÊNCIAS MÉDICAS
MARIA CLARA BRASILEIRO BARROSO
EFEITOS DA EXPOSIÇÃO À LUZ NAS ALTERAÇÕES MOTORAS E NÃO MOTORAS DA DOENÇA DE PARKINSON- UM ESTUDO RANDOMIZADO E
CONTROLADO COM PLACEBO
MARIA CLARA BRASILEIRO BARROSO
EFEITOS DA EXPOSIÇÃO À LUZ NAS ALTERAÇÕES MOTORAS E NÃO MOTORAS DA DOENÇA DE PARKINSON: UM ESTUDO RANDOMIZADO E
CONTROLADO COM PLACEBO
Dissertação apresentada ao Programa de Pós-graduação em Ciências Médicas da
Universidade Federal do Ceará como requisito parcial para obtenção do título de Mestre em Ciências Médicas. Área de
concentração: Doenças crônico-degenerativas.
Orientadora: Profa. Dra. Veralice Meireles Sales de Bruin.
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca de Ciências da Saúde
B285e Barroso, Maria Clara Brasileiro.
Efeitos da exposição à luz nas alterações motoras e não motoras da doença de Parkinson – um estudo randomizado e controlado com placebo./ Maria Clara Brasileiro Barroso. – 2014.
112 f.: il. color., enc.; 30 cm.
Dissertação (mestrado). – Universidade Federal do Ceará, Faculdade de Medicina, Departamento de Fisiologia e Farmacologia, Programa de Pós-Graduação em Ciências Médicas, Mestrado em Ciências Médicas, Fortaleza, 2014.
Área de Concentração: Doenças Crônico-degenerativas. Orientação: Profa. Dra. Veralice Meireles Sales de Bruin.
1. Doença de Parkinson. 2. Fototerapia. 3. Fases do Sono. 4. Sono. I. Título.
MARIA CLARA BRASILEIRO BARROSO
EFEITOS DA EXPOSIÇÃO À LUZ NAS ALTERAÇÕES MOTORAS E NÃO MOTORAS DA DOENÇA DE PARKINSON: UM ESTUDO RANDOMIZADO E
CONTROLADO COM PLACEBO
Dissertação apresentada ao Programa de Pós-graduação em Ciências Médicas da Universidade Federal do Ceará como parte dos requisitos para obtenção do título de Mestre em Ciências Médicas. Área de concentração: Doenças crônico-degenerativas.
Orientador: Profa. Dra. Veralice Meireles Sales de Bruin.
Aprovada em: _____ /_____ /_____
BANCA EXAMINADORA
_________________________________________
Profa. Dra. Veralice Meireles Sales de Bruin (orientadora) Universidade Federal do Ceará (UFC)
_________________________________________
Prof. Dr. Pedro Braga Neto Universidade Estadual do Ceará (UECE)
_________________________________________
AGRADECIMENTOS
Agradeço à Deus por me permitir chegar até aqui, aos meus pais Vicente e Elizabeth pelo apoio e compreensão, principalmente na fase final dedicando uma parte do tempo livre para estarem com minha filha enquanto escrevia a dissertação.
À professora orientadora Veralice Meireles Sales de Bruin, pela oportunidade, paciência e compreensão
Ao meu marido Gabriel pelo apoio durante a coleta dos dados, confiança e paciência comigo. E à minha pequena Maria Fernanda que me deu força para continuar mesmo sem saber falar, apenas com o seu sorriso e carinho.
À CAPES pelo apoio financeiro.
Aos colegas de turma e funcionários da secretária do Programa pelo apoio e paciência,
Aos alunos de graduação Emily Mourão Lopes e Iago Farias Jorge por colaborarem na coleta de dados juntamente com a colega terapeuta ocupacional Juliana Pessoa.
SUMÁRIO
1 INTRODUÇÃO... 9
1.1 Considerações gerais... 9
1.2 Aspectos históricos da doença de Parkinson... 11
1.3 Sintomas motores e diagnóstico... 13
1.4 Sintomas não motores... 14
1.4.1 Distúrbios do sono... 15
1.4.2 Distúrbios do ritmo circadiano... 16
1.4.3 Alterações cognitivas... 16
1.4.4 Depressão e sintomas psiquiátricos... 18
1.5 Terapias disponíveis... 18
1.5.1 Terapias farmacológicas... 19
1.5.2 Terapias não farmacológicas... 21
1.5.2.1 Terapia ocupacional... 22
1.5.2.2 Terapia com luz... 25
1.5.2.3 Outras terapias não farmacológicas... 26
2 JUSTIFICATIVA... 28
3 OBJETIVOS... 29
3.1 Objetivo geral... 29
3.2 Objetivos específicos... 29
4.1 Local do estudo... 30
4.2 População e amostra... 30
4.3 Período de realização da pesquisa... 30
4.4 Critérios de inclusão e exclusão... 30
4.5 Aspectos éticos e de segurança... 31
4.6 Delineamento do estudo... 31
4.6.1 Medidas de desfecho... 32
4.6.2 Fluxograma... 33
4.6.3 Instrumentos... 34
4.7 Análise estatística... 36
5 RESULTADOS... 37
5.1 Características gerais dos pacientes... 37
5.2 Características dos pacientes por grupo de tratamento... 38
5.3 Desempenho funcional... 39
5.4 Alterações do sono... 45
6 DISCUSSÃO... 46
6.1 Desempenho funcional da pessoa com Parkinson... 46
6.2 Qualidade de vida da pessoa com Parkinson... 47
6.3 Efeito da luz nas perturbações do sono... 48
6.4 A luz regulando o ritmo circadiano da pessoa com parkinson... 48
6.5 Efeito da luz nos sintomas depressivos... 49
7 CONCLUSÃO... 52
REFERÊNCIAS... 53
ANEXOS... 58
RESUMO
Anormalidades do ritmo circadiano podem contribuir para as alteracões do ritmo sono-vigília na doença de Parkinson (DP). Trata-se de uma doença degenerativa do sistema nervoso central que acomete predominantemente pessoas a partir da sexta e sétima décadas. Os sintomas variam de acordo com o estágio da doença podendo manifestar-se com os sinais clássicos de tremor, rigidez, bradicinesia e instabilidade postural. Inicialmente, os sintomas podem ser essencialmente motores. Sintomas não motores como alterações do sono, déficit cognitivo, depressão e problemas psiquiátricos podem ocorrer no decorrer da doença. O objetivo deste estudo foi avaliar os efeitos da exposição à luz vespertina sobre as alterações motoras e não motoras na DP. Trata-se de estudo randomizado e controlado com placebo, no qual os pacientes com DP foram randomizados para terapia com brilhante luz (10.000 lux) ou placebo (<500 lux) no final da tarde. Os pacientes foram testados no início e após a terapia com luz utilizando as seguintes escalas: Loewenstein Occupational Therapy Cognitive Assesment versão geriátrica (LOTCA-G), Parkinson’s Disease Sleep Scale (PDSS), Unified Parkinson’s Disease Rating Scale (UPDRS I, II, III e IV), Epworth Sleepiness Scale (ESS), escala Hospitalar de Ansiedade e Depressão (HAD) e questionário da doença de Parkinson (PDQ-39). Dezenove pacientes (65,1% do sexo masculino), com idade entre 55-68 anos (67,0±7,0) foram estudados. Hipertensão arterial (42,1%), diabetes (21,0%) e discinesia (57,9%) foram encontrados. Distúrbios do sono (PDSS≤100, 57,9%) e sonolência excessiva diurna (ESS> 10, 21,1%) foram diagnosticados. Na linha de base, as variáveis clínico-demográficas e escalas de comportamento não foram diferentes entre os casos e controles. Terapia com luz brilhante à tarde melhorou o escore total do Lotca-G (F=12,8, p=0,006) e vários domínios do PDSS. A terapia com luz brilhante à tarde melhorou a dificuldade em manter o sono, o sono inquieto, as alucinações noturnas e os episódios súbitos de início de sono durante o dia (p<0,05). A percepção da cognição avaliada no PDQ-39 também melhorou após o tratamento (F = 7,2, p = 0,007). Este estudo apoia a evidência de que a terapia com luz à tarde é benéfica para pacientes com DP, melhorando o desempenho cognitivo, a percepção da cognição e diversos aspectos dos distúrbios do sono, incluindo a dificuldade em manter o sono, inquietação na cama, alucinações noturnas e episódios súbitos de início de sono durante o dia.
ABSTRACT
Circadian abnormalities may contribute to sleep/wake alterations, cognitive and motor fluctuations in PD patients. The objective of this study is to test the effects of evening bright-light therapy on sleep disturbances, cognitive performance, disease severity and quality of life in PD patients. Patients with PD were randomized to bright-light therapy (10000 lux) or placebo (<500 lux) at evening. They were tested at baseline and after therapy with the Loewenstein Occupational Therapy Cognitive Assessment (LOTCA),
the Parkinson’s Disease Sleep Scale (PDSS), Unified Parkinson’s Disease Rating Scale
(UPDRS I, II, III and IV), Epworth Sleepiness Scale (ESS), Hospital Anxiety and Depression scale (HAD) and Parkinson’s Diseases Questionnaire (PDQ-39). Nineteen (65.1 % male), aged from 55 to 68 years (67.0±7.0) were studied. Arterial hypertension (42.1%), diabetes (21.0%) and dyskinesia (57.9%) were found. Overall, sleep
disturbances (PDSS≤100, 57.9%) and excessive daytime sleepiness (ESS>10, 21.1%) were found. At baseline, clinical demographic variables and behavioral scales were not different between cases and controls. Bright-light therapy at evening improved LOTCA-G scores (F=12.8, p=0.006) and several PDSS domains. Difficulty staying asleep, fidgetiness in bed, nocturnal hallucinations and sudden daytime sleep onset were all improved after bright-light therapy at evening (p<0.05). PDQ-39 perception of cognition was also reported as ameliorated after treatment (F=7.2, p=0.007). This study supports the evidence that evening bright-light therapy at evening is beneficial for PD patients improving cognitive performance, perception of cognition and several sleep disturbances, including difficulty staying asleep, fidgetiness in bed, nocturnal hallucinations and daytime somnolence.
Keywords: Light therapy; Parkinson’s disease; somnolence, cognitive performance;
1 INTRODUÇÃO
1.1. Considerações gerais
A doença de Parkinson (DP) afeta preferencialmente indivíduos com idade mais avançada e também acomete pessoas jovens como já amplamente demonstrado. Com o avançar da idade da população, tem sido observado um aumento de casos de pessoas acometidas tanto pela DP quanto pela doença de Alzheimer. Tem sido relatado que a DP atinge aproximadamente 10 milhões de pessoas no mundo e em torno de trezentos mil no Brasil (GONÇALVES, ALVAREZ E ARRUDA, 2007). Estima-se que em 2030 o número de pessoas com DP no mundo terá dobrado (Chen et al, 2013). Considerando que trata-se de uma doença comum em idosos e que o número de idosos é progressivamente maior, torna-se importante a compreensão do quadro clínico e a descoberta de agentes terapêuticos (CHEN et al, 2013).
Um conhecimento sobre a fisiopatologia da DP é importante para a compreensão das manifestações clínicas. Deve ser considerado que a DP é uma doença que frequentemente se apresenta de forma assimétrica e tem um caráter flutuante observando-se grande variabilidade de gravidade entre os pacientes (NYHOLM, et al, 2002).
Sintomas como perda do controle postural, dificuldade a marcha e episódios de
“freezing” ocorrem de forma mais ou menos imprevisível no decorrer da doença (BOONSTRA ET AL, 2014).
Dado que os primeiros sinais da doença podem ser de caráter sutil, algumas vezes, os pacientes com DP procuram ajuda médica quando até 50% dos neurônios dopaminérgicos já foram perdidos (CHEN et al, 2013). Sabe-se que a DP é uma doença progressiva apesar da reposição exógena através de Levodopa. Até a presente data, uma terapia que definitivamente confira uma neuroproteção não foi demonstrada. Diversos sintomas não-motores, tais como, déficit cognitivo, distúrbios do sono, depressão, ansiedade e disfunção autonômica podem cursar com os sintomas motores no decorrer da doença (CHEN et al, 2014).
Quadro1- Características clínicas da Doença de Parkinson
Critérios clínicos para diagnóstico da Doença de Parkinson segundo o Banco de Cérebros da Sociedade de Parkinson do Reino Unido
I. Critérios necessários para o diagnóstico da Doença de Parkinson: Bradicinesia associada a pelo menos um dos seguintes sintomas:
a) Rigidez muscular
b) Tremor de repouso com frequência de 4-6HZ (avaliado clinicamente) c) Instabilidade postural não causada por distúrbios visuais, vestibulares, cerebelares ou proprioceptivos.
II. Critérios negativos (excludentes) para Doença de Parkinson: a) História de AVC de repetição
b) História de traumatismo craniano grave c) História definida de encefalite
d) Crises oculogíricas
e) Tratamento prévio com neurolépticos f) Remissão espontânea dos sintomas g) Quadro clinico unilateral após três anos h) Paralisia supranuclear do olhar
i) Sinais cerebelares
j) Sinais autonômicos precoce k) Demência precoce
l) Liberação piramidal com sinal de Babinski
m) Presença de tumor cerebral ou hidrocefalia comunicante n) Resposta negativa à altas doses de L-Dopa
o) Exposição a metilfeniltetraperidinium.
III. Critérios de suporte positivo para o diagnóstico de Doença de Parkinson: a) Início unilateral
b) Presença de tremor de repouso c) Doença progressiva
d) Persistência da assimetria dos sintomas e) Boa resposta a L-Dopa
f) Presença de dicinesias induzidas pela L-Dopa g) Resposta à L-Dopa por 05 anos ou mais h) Evolução clínica de 10 anos ou mais
Dessa forma, uma investigação sobre os fatores que influenciam a gravidade dos sintomas e melhoram a qualidade de vida dos pacientes é importante. Diversos aspectos como a redução das atividades diárias, do déficit cognitivo, a presença de sintomas depressivos e as alterações do sono permanecem por ser melhor estudados (RODRÍGUEZ-VIOLANTE et al, 2011).
Universalmente, os pacientes relatam “dias bons” e “dias ruins” e isso tem sido relacionado às alterações do humor. Porém, desconhece-se o mecanismo intrínseco que regula essa variação. Uma variação da neurotransmissão dopaminérgica, gabaérgica, glutamérgica entre outras podem ser influenciadas por alterações circunstanciais. Possivelmente, as alterações do sono e/ou do ritmo circadiano presentes na DP podem influenciar tais variações. Terapias medicamentosas e comportamentais têm sido utilizadas para alivio dos sintomas, no entanto, maiores recursos são necessários.
1.2. Aspectos históricos da Doença de Parkinson
A DP foi originalmente descrita por James Parkinson em 1817. James Parkinson nasceu em Londres no ano de 1755, formou-se médico pelo Hospital de Londres, casou-se com Mary Dale, com quem teve casou-seis filhos e aos 62 anos de idade publicou a monografia denominada “A essay of shaking palsy”, na qual consta a primeira descrição detalhada da enfermidade que hoje leva o seu nome. As características
principais relatadas por Parkinson foram: “presença de movimentos tremulantes
involuntários, diminuição da força muscular, tendência em inclinação para frente e alteração da marcha” (PARKINSON, 1817)
Após esta publicação, a doença permaneceu sem descobertas por mais de 50 anos, quando Jean Martin Charcot realizou outro estudo confirmando as características de James Parkinson e modificou o nome da patologia para Doença de Parkinson (CHARCOT, 1872).
Em 1895, Brissaurd levantou a hipótese de que uma lesão na substância negra poderia ser a base anatômica da moléstia (ALBIN, YOUNG E PENNEY, 1989)
Em 1913, Lewy encontrou inclusões eosinófílicas em neurônios nigrais em pacientes com DP. Hoje, isto constitui um marcador histopatológico da doença. Deve-se lembrar que os corpúsculos de Lewy não são um apanágio exclusivo da DP (HOLDORFF, 2002).
Posteriormente, uma redução dos níveis de dopamina nos gânglios da base foi identificada. Tal fato possibilitou uma mudança terapêutica e a partir desses estudos substâncias que aumentavam os níveis de dopamina no sistema nervoso ou agonistas dopaminérgicos tornaram-se o alvo do tratamento (HORNKIEWICZ, 1975).
Quadro 2- Aspectos históricos da Doença de Parkinson
Ano Fato Autor
1817 Publicação da monografia “Ensaio sobre a
paralisia agitante” com a primeira descrição
detalhada da DP
James Parkinson
1861 Publicação de um artigo importante intitulado
“A Paralisia Agitante” no qual ele diferencia a
Doença de Parkinson de outras afecções neurológicas
Jean Martin Charcot
1879 Evidência de que a atropina diminui o parkinsonismo
1911 Primeira síntese da Dopamina
1940 Primeira série de cirurgias nos gânglios da base para tratar distúrbios do movimento
Meyers
1950 Primeiro uso de drogas anticolinérgicas sintéticas para tratamento da Doença de Parkinson
Fahn
1960 Primeira evidência de que a deficiência de dopamina é a causa da Doença de Parkinson
Ehringer & Homykiewicz 1962 Primeiro uso da L-Dopa por via oral, mesmo em
doses baixas foi encontrado efeito antiparkinsoniano.
Barbeau e colaboradores
1969 Primeira evidência de que a amantadina é eficaz no tratamento dos sintomas da DP.
Schwab e colaboradores
1989 Primeira evidência de que a estimulação talâmica diminui o tremor em pacientes com Parkinson.
Benabid e colaboradores
1997 Descoberta do gene Park 1 que causa uma das formas de Parkinson genético.
Limousin e colaboradores 2011 Primeira publicação com triagem duplo cega
utilizando a terapia gênica.
Lewitt e colaboradores
Fonte: SMITH et al, 2012.
1.3. Sintomas motores e diagnóstico
Frequentemente, o diagnóstico da Doença de Parkinson (DP) depende da presença de sinais motores que são causados principalmente pela deficiência de dopamina no sistema nervoso. A presença de tremor de repouso assimétrico é encontrada na maioria dos casos, indicando o diagnóstico de DP. As formas rígido-acinéticas, com ausência de tremor podem apresentar um diagnóstico clínico mais difícil.
tremor e instabilidade postural. Deve ser observado que tais sintomas podem ocorrer em diversas outras doenças como na atrofia multisistêmica, na paralisia supranuclear progressiva e na degeneração cortico basal, entre outras. Um diagnóstico diferencial é realizado a partir de bases clínicas e da resposta terapêutica a Levodopa, que está presente na DP.
Entre todos os sintomas, o mais frequente é o tremor, que é caracteristicamente de repouso e melhora com os movimentos. Embora o tremor não seja o sintoma mais incapacitante, é a principal razão dos pacientes procurarem ajuda médica. Portanto, o tremor parkinsoniano possui características bem peculiares que direcionam o diagnóstico (DOVZHENOK E RUBCHINSKY, 2012). Deve ser lembrado que conforme os critérios clínicos estabelecidos (Quadro 1), é necessário que o tremor esteja associado a pelo menos mais um dos outros sintomas: bradicinesia, rigidez muscular ou instabilidade postural.
Bradicinesia ou lentidão dos movimentos é uma manifestação precoce e quase sempre presente. Observa-se uma redução da velocidade dos movimentos de forma assimétrica, ou seja, o paciente percebe-se mais lento ao realizar atividades simples do cotidiano. A caligrafia torna-se caracteristicamente pequena e isso pode ser utilizado na avaliação clínica e terapêutica. Além da bradicinesia dos membros, observa-se também, uma lentidão da marcha e em alguns casos o indivíduo assume uma atitude típica em flexão. A marcha é descrita como lenta ou em pequenos passos. Há uma lentidão nos movimentos alternados como sentar-se e levantar-se de uma cadeira. Reações paradoxais como ativação rápida da marcha ou marcha festinante podem ser observadas (LING et al, 2012).
1.4. Sintomas não motores
Os sintomas não motores da DP são vários e para facilitar a compreensão discutir-se-á de maneira separada cada um dos sintomas avaliados neste estudo.
funcional, emocional e social” (CAMARGOS et al 2004, P.268). A partir desta definição, é possível compreender que a manutenção da qualidade de vida é de fundamental importância no tratamento de doenças crônico-degenerativas como a DP. Pensando nisso, surgiram os instrumentos de medição da qualidade de vida relacionada à saúde.
No caso da DP existe o Parkinson’s Disease Questionnaire 39 (PDQ-39). De acordo com Lana et al ( 2007), existem outros instrumentos úteis para medir a qualidade de vida em pessoas com DP. Nesse estudo, o PDQ-39, um instrumento largamente utilizado e que considera a magnitude de sintomas nos pacientes portadores de DP foi aplicado (JENKINSON et al, 1996).
1.4.1 Distúrbios do sono
Os distúrbios do sono são frequentes e manifestam-se em até 90% dos casos com DP (Leu e Arnulf (2008); Boeve 2013). Diversas manifestações como insônia, sonolência excessiva diurna, transtorno comportamental do sono REM e transtornos respiratórios no sono podem ocorrer.
Recentemente foi mostrada que a síndrome das pernas inquietas pode ocorrer precocemente na DP e afeta mais o sexo masculino. Até o momento desconhece-se a razão pela qual a síndrome das pernas inquietas ocorre mais em homens (ZOCCOLELLA et al, 2011).
O estudo de Gao et al (2010) mostra que tanto a DP quanto a síndrome das pernas inquietas relacionam-se com à deficiência de dopamina. Evidências indicam que esta síndrome poderá vir a ser um marcador da DP (GAO et al, 2010).
Tem sido descrito que tais alterações não-motoras apresentam associações entre si, e.g., as alterações autonômicas, a depressão e a ansiedade (CHUNG et al,2013). Uma associação entre a sonolência excessiva diurna e os sintomas não motores avaliados pela UPDRS foi observada e tal associação foi inversamente proporcional à idade (CHUNG et al, 2013).
1.4.2 Distúrbios do ritmo circadiano
O sistema circadiano é constituído por três elementos principais: oscilador endógeno localizado no núcleo supraquiasmático, um agente de arrastamento ou
“Zietgebers” e o relógio interno para ritmo em fisiologia e comportamento (Videnovic e Golombek, 2013).
Dentro desse sistema, ocorre a neurotransmissão dopaminérgica em vários níveis. A dopamina (DA) tem uma importante ação na adaptação de luz, regulando as células ganglionares da retina interagindo assim com os agentes de arrastamento. Além disso, as células dopaminérgicas participam da regulação do ritmo circadiano expressando as mudanças de iluminação do ambiente entre o dia e a noite. Portanto, na DP, possivelmente ocorre uma interação multidirecional entre a dopamina, o sistema motor, as alterações não-motoras e o ritmo circadiano em vários níveis (VIDENOVIC; GOLOMBEK, 2013).
Deve ser considerado ainda que a atividade dopaminérgica tem uma interação com a melatonina sendo assim importante para a regulação do relógio interno responsável pela fisiologia e comportamento. Tem sido postulado que as alterações dopaminérgicas na DP justificam a desregulação do sistema vigília-sono. Possivelmente, o comprometimento cerebral na DP contribui para as alterações do sono e do ritmo circadiano observadas (YILDIRIM et al, 2014)
Além das alterações do sono e de vários outros sintomas não-motores, alterações do ritmo circadiano também têm sido descritas na DP (VIDENOVIC et al, 2014
14.3 Alterações cognitivas
Comprometimento cognitivo leve (CGL) é comum na DP. Diversos estudos mostram que a DP cursa com alterações importantes da cognição. Tem sido relatado também que a idade, de forma semelhante a outras síndromes demenciais, é um fator de risco para o desenvolvimento de comprometimento cognitivo na DP.
“span” atencional e déficit de memória. Melo, Barbosa e Caramelli (2007) enfatizam ainda que as alterações cognitivas da DP têm grande impacto na qualidade de vida dos pacientes. O teste Loewenstein Occupational Therapy Cognitive Assessment (LOTCA) que possui várias versões é específico para idosos e é sensível a pequenos déficits, de acordo com o estudo de validação de Erez e Katz (2004).
Outro teste comumente utilizado em pessoas com alto nível de escolaridade na DP é o “Montreal Cognitive Assessment TEST” (MOCA TESTE) traduzido e validado em diversas línguas, inclusive o português brasileiro. Há também o Mini Exame do Estado Mental, um teste universalmente aceito, validado no Brasil e largamente utilizado em muitas situações clínicas.
Quadro 3- Critérios clínicos para Déficit Cognitivo na Doença de Parkinson. Critérios de inclusão Declínio cognitivo gradual no contexto da DP.
Déficit cognitivo em teste neuropsicológico formal ou em escala de habilidades cognitivas globais.
Dificuldades nas atividades de vida diária. Critérios de Exclusão Diagnóstico de demência associada à Parkinson
de acordo com os critérios da Task Force MDS. Comobirdades associadas à DP que interfiram no desempenho cognitivo em escalas de avaliação.
Subtipos Déficit cognitivo leve em apenas um domínio. Déficit cognitivo leve em dois ou mais domínios.
Fonte: LITVAN, ET AL (2012)
1.4.4 Depressão e sintomas psiquiátricos
Sintomas depressivos são comuns em idosos com DP. Sabe-se que a depressão associa-se, também, a fatores externos à DP como o apoio familiar e a aposentadoria, entre outros. De acordo com Wilkinson e Izmeth ( 2012), os sintomas depressivos manifestam-se em até 50% dos pacientes com DP. Este dado é preocupante do ponto de vista tanto pela influência potencial sobre a qualidade de vida quanto sobre a variação e gravidade dos sintomas motores e não-motores.
1.5. Terapias disponíveis
O tratamento da DP é variado e complexo devido ao caráter progressivo e degenerativo da doença e aos efeitos colaterais que podem ser precoces ou tardios dependendo das características de cada paciente. Atualmente e de forma geral, o tratamento utilizado é sintomático e o objetivo é a redução de manifestações da doença (Brasil (2010).
1.5.1 Terapia farmacológica
Atualmente o tratamento convencional farmacológico consiste na reposição exógena de dopamina utilizada em adição a um inibidor periférico da dopa-descarboxilase. Pode-se dizer que a dopamina é a pedra angular do tratamento medicamentoso. O seu surgimento ocorreu no final da década de 60, quando pacientes que estavam gravemente comprometidos recuperaram a função motora (COTZIAS, 1971).
Estudos revelaram que, em alguns casos, quando a dopamina encontra-se em níveis elevados no organismo, pode-se observar o surgimento de complicações motoras como as dicinesias. Portanto, um acompanhamento médico regular deve ser realizado para monitorar os efeitos colaterais e as complicações clínicas do desenvolvimento da DP (ROCHA ET AL, 1995).
A reposição de dopamina possibilita a redução de diversos sintomas motores: rigidez, tremor e bradicinesia. Sabe-se hoje que a oferta sináptica de dopamina é também influenciada pelos níveis de receptores que podem estar muito reduzidos em função da doença. Sendo assim, o equilíbrio da função dopaminérgica e da oferta medicamentosa na DP é complexo e depende tanto da ação medicamentosa quanto de alterações de diversas regiões cerebrais que são naturais ao processo crônico-degenerativo. Mais ainda, a Levodopa apresenta meia vida reduzida associando-se a flutuações importantes da oferta de dopamina na fenda sináptica (MARTINS ET AL, 2013).
pacientes. Os efeitos neuroprotetores dos medicamentos na DP são ainda controversos (VU;NUTT;HOLFORD, 2012).
Diversos outros medicamentos como a Amantadina, inicialmente um antiviral e sabidamente uma droga com propriedades anti-glutamatérgicas, podem ser utilizados. Sabe-se que a Amantadina é capaz de reduzir as discinesias na DP (SILVA-JUNIOR, et al, 2005). Deve ser mencionado, também, que os anticolinérgicos foram e ainda são utilizados na terapia inicial da DP. Deve ser ressaltado que os anticolinérgicos potencialmente afetam a função cognitiva e de uma maneira geral devem ser evitados (MIYASAKI et al., 2002). Portanto, desde a comprovação que os anticolinérgicos interferem com a função cognitiva, esses medicamentos não estão na lista preferencial para o tratamento da DP (Brasil, 2010).
Sabe-se que após alguns anos de utilização da Levodopa, complicações como flutuações motoras e não motoras e discinesias apareceme. Precocemente e/ou nas fases mais avançadas da doença, diversos agentes terapêuticos coadjuvantes a Levodopa tais como os agonistas dopaminérgicos podem ser usados com o objetivo de reduzir o prejuízo funcional (Brasil, 2010).
Flutuações motoras caracterizadas por períodos “on-off” ocorrem com freqüência no decorrer da doença. O período “on” é definido como o intervalo de tempo no qual o paciente com boa função motora responde e tolera bem o medicamento e o
período “off” seria quando há o retorno da sintomatologia parkinsoniana e portanto bradicinesia.
As discinesias, podem manifestar-se tanto na fase on quanto na fase off e são definidas como movimentos involuntários, anormais e descoordenados. As discinesias manifestam-se tanto na fase avançada da doença quanto precocemente e com frequência relacionam-se com o período de administração e a dose da medicação. Tais alterações motoras e redução da resposta medicamentosa coincidem com as alterações cerebrais que ocorrem de forma progressiva na DP. A característica da fase grave é uma resposta medicamentosa com flutuações ou não satisfatória e nessa fase a utilização de vários medicamentos para controlar os sintomas é comum
forma heterogênea. O uso de Levodopa e de outros agentes medicamentosos coadjuvantes é comum.
1.5.2 Terapia não farmacológica
Quadro 4- Exemplos de abordagens terapêutica na Doença de Parkinson
Sintoma Profissional
recomendado
Objetivo
Apatia, tristeza Psicólogo Avaliação psicológica para verificar a ocorrência de depressão, ansiedade e estigma da DP
Bradicinesia Terapeuta Ocupacional Reorganizar o cotidiano de acordo com as fases on e off do tratamento medicamentoso a fim de facilitar a execução das atividades da vida diária
Rigidez articular, freezing e instabilidade postural
Fisioterapeuta ou Educador Físico
Promover a atividade física de modo a aumentar a amplitude de movimento e diminuir os freeze de início da marcha.
Disartria e disfagia Fonoaudiólogo Promover exercícios de conversação através de técnicas específicas para minimizar os sintomas.
1.5.2.1 Terapia Ocupacional
A Terapia Ocupacional (TO) é uma ciência da área da saúde cujo objetivo principal é a reinserção social de sujeitos com deficiência temporária ou permanente decorrente de problemas físicos, psicológicos, sociais ou sensoriais que afetam o desempenho ocupacional.
O indivíduo com DP apresenta déficit em todas as áreas do desempenho ocupacional, podendo inclusive, necessitar de adaptações que são prescritas e confeccionadas unicamente por terapeutas ocupacionais. Mas, para identificá-las é necessária uma avaliação completa englobando a anamnese, histórico ocupacional e avaliação físico-funcional. Portanto, o terapeuta ocupacional é um profissional importante para o tratamento da pessoa com DP e as intervenções deste se iniciam na avaliação e se estendem por tempo indeterminado.
Mello e Mancini (2007) explicam que a TO possui avaliações específicas para verificar o nível de dependência do sujeito com DP nas AVD e o estudo de Faria (2007) exemplifica o tratamento terapêutico ocupacional na DP e relata que o mesmo deve ter
os seguintes objetivos: reorganização da rotina de acordo com os períodos “on-off” com
as atividades mais importantes no período “on”, atividades de fortalecimento da musculatura facial, atividades repetitivas para fortalecer a autoestima e reduzir o tremor, utilização de técnicas de conservação de energia principalmente no período “off” e favorecer a estabilidade postural.
Para atingir tais objetivos, o terapeuta ocupacional realiza atividades que devem ser significativas ao paciente. Conforme a pesquisa de Lima, Okuma e Pastore (2013) a atividade terapêutica se diferencia da atividade humana por ter um objetivo, a orientação do terapeuta ocupacional e um produto final.
Os autores explicam ainda que na TO a atividade é um meio de formação de vínculo, reinserção social e promoção de autonomia e independência. Portanto, na TO o fazer simples não é interessante e sim o fazer com sentindo e sentimento. É importante para o processo terapêutico que o paciente saiba o objetivo de cada atividade.
A partir do exposto, torna-se necessário a compreensão da historicidade e da individualidade de cada paciente na escolha da atividade e da abordagem terapêutica que variará de acordo com o tipo de atendimento e o “setting” terapêutico. No caso do tratamento terapêutico ocupacional na DP, Almeida e Cruz (2009) explicam que os terapeutas ocupacionais se orientam em estruturas aplicadas de referências e abordagens que variam de acordo com a formação do profissional e com as informações coletadas no processo avaliativo.
sobre a história de vida, história da doença, medicamentos utilizados e tratamentos já realizados.
Sobre a avaliação funcional com idosos, Bispo, Rocha e Reys (2012) a definem como uma tentativa de mensurar os níveis de capacidade de desempenho em diferentes áreas e atividades: na anamnese, no Histórico Ocupacional e avaliação físico-funcional.
Para finalizar o processo avaliativo, Chaves et al (2010) relata que uma escala cognitiva como o Loewenstein Occupational Therapy Cognitive Assessment (LOTCA) é importante para investigar os componentes cognitivos do desempenho ocupacional que por vezes passam despercebidos na anamnese e na avaliação funcional.
Após coletar todas estas informações, o terapeuta ocupacional elaborará um plano de tratamento considerando: os interesses e habilidades, o nível de funcionalidade e independência e o desejo do paciente em relação ao tratamento, não esquecendo a família e o ambiente domiciliar.
O momento seguinte da intervenção terapêutica ocupacional é a escolha de
atividades que variará de acordo com o “setting terapêutico”. Quando o atendimento é domiciliar, a terapeuta deve considerar a independência e a autonomia do sujeito com DP dentro do ambiente doméstico, através da reeducação motora e escuta terapêutica, de acordo com os dados coletados na anamnese e no Histórico Ocupacional e com os recursos disponíveis. Neste ambiente, também, é importante a avaliação ambiental, para verificar se há fatores de risco para quedas. Quando há, a profissional deve orientar à família quanto à necessidade de remoção dos objetos e, se necessário, confeccionar adaptações ambientais que promovam o aumento da independência do parkinsoniano dentro de casa.
No caso do atendimento ambulatorial, a variedade de recursos é maior, porém, faz-se necessário um vínculo terapêutico bem estabelecido para conhecer as atividades mais significativas para o paciente. Neste caso, é necessária a avaliação com o cuidador e com o familiar responsável pelo paciente com o objetivo de conhecer a rotina da pessoa com DP.
1.5.2.2 Terapia com Luz Brilhante
Doença de Parkinson os estudos datam a partir de 2007, com Willis e Turner (2007), que obtiveram resultados positivos para a terapia com luz na DP. Os autores estudaram uma série de casos constituída por um grupo reduzido de 12 pacientes com faixa etária entre 46 e 83 anos. Estes pacientes foram submetidos à luz fluorescente branca de intensidade entre 1000 e 1500 lux durante uma semana, exatamente uma hora antes do horário habitual de dormir. Quanto às avaliações, todos foram examinados antes e após o uso da luz. O estudo revelou que a terapia com luz diminuiu a bradicinesia e a rigidez articular de todos os pacientes. No tocante ao sono, apenas 50% obtiveram melhora na qualidade do sono.
Outro estudo realizado sobre os efeitos da terapia com luz em sintomas motores, depressão e sono na DP foi o de Paus et al., (2007). Trata-se de um estudo randomizado, controlado com placebo e duplo-cego envolvendo 36 pacientes, utilizando as seguintes escalas: UPDRS, Inventário de Depressão de Beck e Escala de sonolência de Epworth. Todos os pacientes receberam luz branca de 7500 lux durante 15 dias, no período da manhã, 30 min por dia; no grupo placebo a intensidade da luz foi de 950 lux. Apesar de haver pequena diferença entre os grupos, o estudo revelou uma melhoria significativa do tremor e da depressão no grupo tratado com luz e a terapia foi muito bem tolerada por todos.
A explicação dos mecanismos biológicos envolvidos na exposição à luz é mais recente e encontrada na pesquisa de Zesiewicz e Evatt (2009). Estes autores relatam que a luz branca é um agente modulador exógeno da produção de melatonina. Tais resultados estão de acordo com as pesquisas sobre o ritmo da melatonina e indicam que o esse ritmo está comprometido na DP.
Deve ser considerado que os horários de utilização da exposição à luz são variáveis de acordo com o objetivo do estudo e com a população estudada (RUTTEN ET AL, 2012). Frequentemente, a exposição à luz no período da manhã tem o objetivo de controlar o atraso da fase do sono (dormir e acordar tarde), comuns em adolescente. A exposição no final do dia é utilizada para reduzir o avanço da fase do sono (dormir e acordar cedo) comum nos idosos. Portanto, a exposição à luz potencialmente interfere com o ritmo circadiano modificando o padrão de secreção da melatonina, a temperatura corporal e o ritmo do sono. Tem sido observado que os pacientes com DP têm dificuldade de iniciar e manter o sono, sonhos vívidos, despertares frequentes, parassonia associada ao sono REM e hipersonia diurna (MEDEIROS, 2005).
Apesar desses achados, Artemenko e Levin 1996 explicam que a melatonina, ainda, não pode ser administrada como um neuroprotetor, pois sua eficácia nos sintomas motores ainda não foi comprovada. Entretanto, a eficácia da melatonina nos sintomas não motores foi validada por vários autores (Artemenko e Levin, 1996; Wills e Turner, 2007; Zesiewicz e Evat, 2009; Medeiros et al 2007). A administração exógena de melatonina é atualmente muito utilizada no tratamento sintomático da parassonia associada ao sono REM (KUNZ; MAHLBERG, 2010).
1.5.2.3 Outras terapias não farmacológicas
Além dos diversos tratamentos anteriormente mencionados, há também a fisioterapia e a acupuntura. Deve ser enfatizado que uma das principais formas de tratamento não medicamentoso na DP é a atividade física.
Tem sido aventado que a acupuntura, uma técnica tradicional chinesa, pode apresentar alguns resultados terapêuticos (YAEDU, 2011).
2. JUSTIFICATIVA
A DP é uma doença neurodegenerativa crônica e progressiva que afeta o sistema nervoso e acomete preferencialmente os idosos. Frequentemente, os pacientes com DP apresentam uma heterogeneidade de sintomas, flutuações diurnas e gravidade variável que não são ainda bem compreendidos. Os transtornos do ciclo vigília-sono, as anormalidades do ritmo circadiano, as alterações cognitivas, psiquiátricas e motoras podem estar inter-relacionados. O uso de medidas terapêuticas que modifique o sono e o ritmo circadiano pode influenciar outras alterações motoras e não-motoras.
3. OBJETIVOS
3.1 Objetivo geral
Estudar os efeitos da terapia com luz brilhante na doença de Parkinson
3.2 Objetivos específicos
4. MATERIAL E MÉTODO 4.1 Local do estudo
O estudo foi realizado em pacientes com diagnóstico clínico de DP acompanhados no Ambulatório de Distúrbios do Movimento do Hospital Universitário Walter Cantídio (HUWC). Inicialmente, foi feita uma triagem de todos os pacientes para averiguar os critérios de elegibilidade. Em seguida procedeu-se a uma randomização e o procedimento, ou seja, a terapia com luz foi administrada na residência de cada paciente.
4.2 População e amostra
A população consistiu de 19 pacientes com diagnóstico clínico de DP, selecionados de forma consecutiva. Foram recrutados 40 pacientes, e após análise 19 preencheram os critérios de elegibilidade. Conforme exposto no Fluxograma, a seguir, entre os 21 excluídos, cinco (23,8%) não residiam em Fortaleza, 10 (47,6%) obtiveram escore menor que 18 pontos no Mini-Exame do Estado Mental, quatro (19%) recusaram-se a participar do estudo e um (4,7%) desistiu durante a aplicação dos testes.
4.3 Período de realização da pesquisa
A coleta dos dados foi realizada no período de março a junho de 2013.
4.4 Critérios de inclusão e exclusão
tiveram alterações da medicação nos últimos 30 dias e/ou tinham história compatível
com risco de suicídio.
4.5 Aspectos éticos e de segurança
Os aspectos éticos foram utilizados na pesquisa conforme a Resolução 466/12 do Ministério da Saúde (CNS,2012). O projeto foi submetido ao Comitê de Ética e aprovado com o parecer de nº223871 em 25/03/2013. Após a liberação do comitê, os pacientes assinaram o termo de consentimento livre e esclarecido, o qual explica sobre o uso de questionários e a exposição à luz. Portanto, o estudo apresentou boa segurança e não envolveu medidas invasivas.
4.6 Delineamento do estudo
Trata-se de um estudo de coorte prospectivo e randomizado de pacientes com diagnóstico clínico de DP (Parkinson’s Disease Society Brain Bank). Os pacientes foram recrutados a partir do Ambulatório de Distúrbios do Movimento do HUWC da Faculdade de Medicina da Universidade Federal do Ceará (UFC) e o tratamento foi realizado diariamente na residência do paciente durante duas semanas. A randomização foi do tipo permutada, em blocos.
Recomendou-se que a exposição fosse através do uso da caixa de luz, da marca Day light Classic (Foto 1) com lâmpadas brancas brilhantes de 10.000 lux. A caixa foi posicionada a uma distância mínina de 30 cm da visão do paciente. Recomendou-se ao paciente que não olhasse diretamente para a caixa de luz e sim que ficasse sentado, realizando alguma atividade da dia-a-dia como alimentação ou leitura de um jornal sem utilizar óculos.
O tempo recomendado da exposição à luz foi de 20-30 minutos todos os dias (durante 2 semanas), iniciando a exposição às 17:30. A aderência ao procedimento e o tempo estimado que obteve de exposição à luz foi interrogado com o paciente ou com o acompanhante por telefone.
tendo em vista que os pacientes eram expostos à luz a tarde, então na manhã seguinte a pesquisadora reaplicava todos os testes.
4.6.1 Medidas de Desfecho
Medidas de desfecho primário Atenção e função cognitiva Alterações do sono
Função motora
Medidas de desfecho secundárias Sintomas depressivos
4.6.2 FLUXOGRAMA
Abordagem inicial
N=40
Recrutamento (N=19)
Dia 0: Aplicação dos testes: MMSE-Folstein, LOTCA-G,
PDQ-39, ESE, UPDRS, PDSS e HAD.
Randomização dos pacientes
Alocados para exposição à luz
N=10
Grupo Controle N=9
Uso da caixa de luz Day Light Classic
com lâmpadas de 10.000 lux por 20
minutos todo dia durante 2 semanas.
Reaplicação dos testes no dia 14
MMSE-Folstein, LOTCA-G, PDQ-39, ESE, HAD,
Uso da caixa placebo confeccionada de 500 lux por 20 minutos todo dia durante 2 semanas.
4.6.3 Instrumentos
Os seguintes instrumentos foram utilizados: Mini Mental State Examination
(Minimental), Epworth Sleepiness Scale (ESS), Parkinson’s Disease Questionaire
(PDQ39), Hospital Anxiety and Depression (HAD), Loewenstein Occupational Therapy Cognitive Assesment geriatric version (LOTCA-G), Parkinson’s Disease Sleep Scale
(PDSS) e Unified Parkinson’s Disease Rating Scale (UPDRS) antes e após a exposição
à luz.
Mini Exame do Estado Mental (Mini Mental State Examination, MMSE)
Este teste (Anexo B) é um questionário com 13 perguntas dividias em cinco clategorias: orientação, registro, atenção e cálculo, evocação e linguagem. A pontuação pode variar entre 0 e 30 de acordo com a escolaridade (ALMEIDA, 1998). Para pessoas consideradas iletradas a pontuação ideal deve ser igual ou maior a treze, com o ensino fundamental completo a pontuação mínima passa a ser dezoito e com o ensino médio completo 26 pontos. Pontuações inferiores a estes escores indicam uma possível demência e deverá ser analisada de acordo com os itens errados para a identificação do tipo de demência. No entanto, este teste não pode ser utilizado como diagnóstico. Portanto, uma pontuação baixa deve ser averiguada com outros exames.
Escala de Sonolência de Epworth (Epworth Sleepiness Scale, ESS)
A ESS (vide anexo C) foi utilizada para avaliação da sonolência diurna. Trata-se de um questionário de fácil aplicação, onde se pergunta sobre a probabilidade de adormecer em oito situações diferentes. Os pacientes atribuíram valores de zero (nenhuma chance), um (pequena chance), dois (chance moderada) ou três (grande chance) para cada questão. O escore máximo a ser atingido é de 24 pontos e significa que o sujeito tem grande sonolência diurna.
estigma (4 itens); apoio social (3 itens); cognição (4 itens); comunicação (3 itens) e desconforto corporal (3 itens). A pontuação varia de 0 a 100 . Neste caso quanto maior a pontuação significa pior qualidade de vida, tendo em vista que esta pontuação é em porcentagem de comprometimento (GOULART E PEREIRA, 2005).
Escala Hospitalar de Ansidedade e Depressão (Hospital Anxiety and Depression Scale, HAD):
A escala HAD (vide anexo E) é constituída por 14 questões do tipo múltipla escolha. Compõe-se de duas subescalas, para ansiedade e depressão, com sete itens cada. A pontuação global em cada subescala vai de 0 a 21 (BOTEGA ET AL, 1995). Os autores relatam também que análise da pontuação deve ser realizada separadamente dividindo a escala em Ansiedade (HAD-A) e Depressão (HAD-D). Sendo as questões impares pertencentes à HAD-A e as ímpares à HAD-D. O ponto de corte utilizado foi de 8 para ansiedade e 09 para depressão.
Lowenstein Occupational Therapy Cognitive Assessment Geriatric Version
(LOTCA-G).
A primeira versão deste instrumento foi criado em 1974 por Noomi Katz em Israel, no entanto, a versão geriátrica é datada de 2003 e sua validação de 2004 (EREZ E KATZ, 2004). Este teste consiste em várias perguntas classificadas em quatro categorias: orientação espaço-temporal, percepção viso-espacial, operações lógicas e memória. Para cada pergunta e tipo de resposta há uma pontuação específica no manual do teste. (Folha de resposta no Anexo F). A pontuação máxima deste teste é 104 e a mínima de 24. O ponto de corte em idosos sem diagnóstico clínico é de 84 pontos. No caso de idosos com demência, as autoras diminuem o ponto de corte para 80 que foi o utilizado nesse estudo.
Escala de Distúrbios do Sono da Doença De Parkinson (Parkinson’s Disease Sleep Scale, PDSS)
semana. A pontuação máxima é de 150 e ocorre quando o sujeito encontra-se livre sem sintomas, ou seja, com uma noite de sono sem perturbações.
Escala Unificada dos Níveis da Doença de Parkinson (Unified Parkinson’s Disease Rating Scale, UPDRS)
Escala criada em 1987 (Anexo H) para acompanhar a progressão da doença e o efeito do tratamento (GOULART E PEREIRA, 2005). Os autores complementam que a escala é composta por 42 itens divididos em 04 partes: atividade mental, comportamento e humor, atividades da vida diária e exploração motora e complicações da terapia medicamentosa. A pontuação em cada item varia de 0 a 4 com a pontuação máxima significando maior comprometimento pela doença e a mínima a normalidade.
4.7 Análise Estatística
As análises foram realizadas pelo programa Statistical Package for Social Sciences V16. 0 [SPSS Inc, Chicago (IL), E.U.A.] e os dados expressos em valores absolutos, de frequência, média e desvio padrão (DP).
Os dados foram comparados entre pacientes e controles. O teste de Levene foi utilizado para examinar a igualdade de variâncias e o teste Kolmogorov-Smirnov para avaliar a normalidade da amostra.
5 RESULTADOS
5.1 Características gerais dos pacientes.
Foram estudados 19 pacientes com diagnóstico clínico de DP e idade entre 50 e 80 anos. De acordo com os critérios de inclusão previamente definidos, a gravidade da doença oscilou entre os estágios de 1 e 3 da escala de Hoehn & Yahr modificada. Nessa amostra, a idade média foi de 67 (±7,0) anos e a duração da doença variou de seis meses a 21 anos, com média de 8,7 (±6,3) anos. Os dados demográficos da população estudada estão apresentados na tabela 1 a seguir.
Tabela1: Comparação de dados clinico-demográficos dos pacientes com doença de Parkinson de acordo com o grupo: terapia com luz brilhante ou placebo
Todos os pacientes N=19 Terapia com Luz Brilhante N=10 Placebo N=9
valor de p
Gênero Masculino N (%) 12 (65.1) N (%) 8 (80) N (%) 4 (44.4) 0,17
Feminino 7 (36,8) 2 (20) 5 (55,5)
Idade (Média, dp) 67.0 (7.0) 69.9 (7.2) 65.0 (6.6) 00,24
LED 307.8 (123.8) 295.0 (130.0) 322.2
(122.7)
0,64
Hipertensão Arterial N (%)
8 (42.1) 6 (60) 2 (22.2) 0,90
Diabetes N (%) 4 (21.0) 3 (30) 1 (11.1) 0.21
Duração da doença (Média, dp)
8.7 (6.3) 19 (5.8) 6.3 (6.3) 0,12
História Familiar N (%)
5 (26.3) 3 (30) 2 (22.2) 0,43
Discinesia 11 (57.9) 5 (50) 6 (66.7) 0,65
UPDRS I, Média (dp)
2.7 (1.7) 2.3 (1.7) 3.2 (1.7) 0,25 UPDRS II, Média
(dp).
11.1 (4.8) 12.2 (5.6) 10.0 (3.8) 0,34
UPDRS III, Média (dp).
11.8 (5.6) 13.5 (6.9) 10.0 (3.1) 0,23 UPDRS IV, Média
(dp).
2.4 (2.6) 2.5 (3.2) 2.3 (1.9) 0,75 LOTCA-G, Média
(dp).
89.1 (8.6) 91.0 (5.8) 87.0 (11.0) 0,32
PDQ, Média (dp) 47.4 (21.8) 48.0 (21.5) 46.8 (23.5) 0,35 HAD-depressão,
Média (dp)
7.4 (5.1) 5.9 (3.1) 9.1 (5.0) 0,12 HAD-ansiedade,
Média (dp)
4.3 (3.7) 4.2 (3.4) 6.2 (4.0) 0,25
PDSS,Média (dp) 97.5 (29.4) 98.5 (31.0) 96.5 (29.4) 0,66
Abreviaturas: LED= Levodopa Equivalente dose; UPDRS= Unified Parkinson’s Disease Rating Scale; Lotca-G= Loewenstein Occupatinal Therapy Cognitive Assesment version geriatric; PDQ= Parkinson’s Disease Questionnaire; HAD= Hospital Anxiety Depression; ESS= Epworth Sleepiness Scale PDSS= Parkinson’s Disease Sleep Scale
5.2 Características dos pacientes por grupo de tratamento
Os pacientes foram randomizados para placebo ou terapia com luz brilhante após a triagem na qual foi utilizada uma entrevista semi-estruturada para coletar os dados
clínico-demográficos e o Mini Exame do Estado Mental (MiniMental). Portanto, a randomização ocorreu apenas com os pacientes que estavam de acordo com os critérios
de inclusão e de maneira aleatória, permutada em blocos, de maneira que o grupo placebo foi composto por nove pacientes e o grupo tratamento com dez pacientes.
A idade média no grupo placebo foi de 65 (±6,6) anos e no grupo da luz
brilhante 69,9 (±7,2) anos.
No que diz respeito à análise das escalas por grupo a tabela 2 mostra um
Tabela 2:Comparação entre os grupos placeboo e tratamento (exposição à luz brilhante) (Teste de Mann-Whitney) .
Abreviaturas: UPDRS= Unified Parkinson’s Disease Rating Scale; Lotca-G= Loewenstein Occupational
Therapy Cognitive Assesment version geriatric; PDQ= Parkinson’s Disease Questionnaire; HAD= Hospital Anxiety Depression; ESS= Epworth Sleepiness Scale PDSS= Parkinson’s Disease Sleep Scale
*P<0.05
5.3 Desempenho funcional
O desempenho funcional abrange vários domínios importantes para a determinação da qualidade de vida e foi uma das variáveis que evoluiu positivamente com a terapia com luz brilhante à tarde. Para isso, foram utilizados duas escalas cognitivas, o MiniMental e o LOTCA-G. Encontrou-se variação significativa nos seguintes domínios do LOTCA-G: organização visuomotora, orientação temporal, praxias, memória e operações mentais conforme as tabelas e figuras a seguir.
Variáveis Placebo (N=9)_ Terapia com Luz (N=10)
Antes Depois P Antes Depois
UPDRS I, Média (DP) 3.2 (1.7) 2.7 (1.7) 0,20 2.3 (1.7) 2.5 (1.8) 0,45 UPDRS II, Média (DP) 10.0 (3.8) 9.4 (2.6) 0,31 12.2 (5.6) 12.1 (4.9) 0,93 UPDRS III,Média (DP) 10.0 (3.1) 11.0 (3.6) 0,05 13.5 (6.9) 12.7 (6.9) 0,49 UPDRS IV,Média (DP) 2.3 (1.9) 2.1 (2.0) 0,65 2.5 (3.2) 2.6 (3.3) 0,56 LOTCA, Média (DP) 87.1 (11.) 94.5 (6.5) 0,21 91.0 (5.8) 90.1 (6.2) 0,01* PDQ, Média (DP) 43.8(23.5) 42.2(19.9) 0,47 48.0 (21.5) 45.6 (19.1) 0,61
HAD-Depressão, Média (DP) 9.1 (5.0) 9.1 (5.1) 1.00 5.9 (3.1) 6.3 (3.1) 0,43 HAD-ansiedade, Média (DP) 6.2 (4.0) 6.5 (4.3) 0,45 4.2 (3.4) 3.7 (3.1) 0,91
ESS 6.8 (5.2) 6.4 (4.6) 0,67 9.1 (2.7) 9.2 (2.8) 0,94
Tabela 3: Análise dos domínios do PDQ-39 antes a após a exposição à luz.
O teste utilizado foi o Teste de Wilcoxon Signed
Tabela 4- Variação dos Domínios do LOTCA-G antes e após a exposição à luz
Domínio Antes (M,dp) Depois (M,dp) P valor
Orientação temporal
8 (±1) 8 (±1) 0,05
Orientação espacial
8 (±8) 8 (±8) 0,33
Percepção visual 15 (±12) 15 (±28) 0,32
Percepção espacial 12 (±9) 12 (±9) 0,69
Praxias 11 (±1) 12 (±1) 0,01
Organização visuomotora
17 (±5) 18 (±4) 0,00
Operações Mentais
6 (±2) 6 (±2) 0,00
Memória 9 (±3) 6 (±2) 0,03
Atenção e Concen-tração
4 (±1) 4 (±1) 0,12
Variáveis Placebo (N=9)_ Terapia com Luz Brilhante (N=10) Domínios do
PDQ-39
Antes Depois P valor Antes Depois Pvalor
Mobilidade 12(11,29) 10,4(8,26) 0,40 15,8(9,95) 13,1(9,61) 0,14 Atividades da
Vida Diária
15,1(8,51) 12,5(7,25) 0,50 11,8(9,33) 13,3(8,25) 0,53 Estigma 4,2(3,73) 4,1(3,78) 0,10 1,2(1,4) 1,6(2,10) 0,67 Suporte
Social
6,5(2,26) 7,0(2,21) 0,50 7,0(2,36) 6,9(2,42) 0,77
Cognição 4,3(1,94) 3,0(2,35) 0,06 4,9(2,42) 4,1(2,42) 0,10 Comunicação 3,1(2,60) 2,1(2,88) 0,10 1,7(1,95) 2,3(2,49) 0,17 Desconforto
Corporal
Figura 1: Variação do escore total do LOTCA-G após a intervenção com a luz brilhante e placebo em Fortaleza, Ceará 2013.
LOTCA-G Bas eline
LOTCA-G afte r Bright Light
70 80 90 100 110 L O T C A -G s c o r e s
LOTCA-G Basel ine
LOTCA-G after P lacebo 70 80 90 100 110 L O T CA-G s c o r e s
Figura 2- Resultados do LOTCA_G antes e após a terapia com luz
p = 0 , 0 0 0 2
op . m
en t .a
nt . t ra
t
op . m
en t .a
nt . pl a
op . m
en t .d
p. t r a
t
op . m
en t .d
p. p l a 0 2 4 6 8 1 0
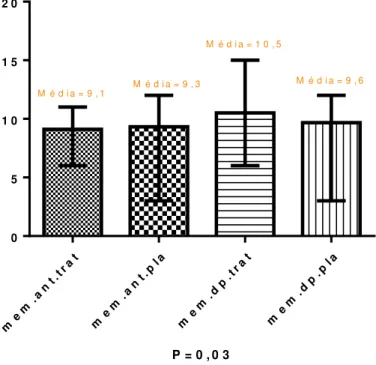
Figura 3- Variação do domínio memória do LOTCA-G antes e após a exposição à luz
P = 0 , 0 3
me m. a
nt . t ra
t
me m
. an t .p
l a
m em
. dp . tr a
t
me m. d
p. p l a
0 5 1 0 1 5 2 0
M é d i a = 9 , 1
M é d i a = 9 , 3
M é d i a = 1 0 , 5
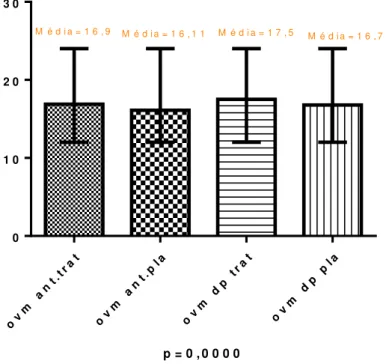
Figura 4- Variação do domínio organização visuomotora do Lotca-g antes e após a luz.
p = 0 , 0 0 0 0
ov
m
an
t .t r
at
ov
m a
nt .
pl a
ov
m
dp
tr a
t
ov
m
dp
pl a
0 1 0 2 0 3 0
Figura 5- Variação do domínio orientação temporal do LOTCA-G antes e após a luz
or i en
t .t e mp
. an t .t r
at
or i en
t .t e m
p. a nt .
pl a
or i en
t .t e mp
. dp . tr a
t
or i en
t .t e mp
. dp . pl a
0 2 4 6 8 1 0
5.4 Alterações do Sono
As alterações do sono foram analisadas através de duas escalas: PDSS (Escala de Sono da Doença de Parkinson) e ESE (Escala de Sonolência de Epworth).
A análise estatistica revelou que quatro domínios do PDSS apresentaram variações significativas após a exposição à luz no grupo tratamento (tabela 5).
Tabela 5: Análise dos domínios do PDSS antes e após a intervenção com a luz brilhante à tarde em Fortaleza, Ceará 2013.
1.WilcoxonSigned Rank Sum.
Variáveis Placebo (N=9) Bright light (N=10)
Antes Depois P Antes Depois P
Domínios do PDSS
Qualidade do sono 5.7 (4.1) 6.1 (4.1) 0,08 7.6 (1.6) 7.6 (1.9) 0,00 Dificuldade em adormecer 5.4 (4.2) 5.6 (4.3) 0,41 7.6 (3.2) 8.4 (3.1) 0,46 Dificuldade em manter o sono 6.1 (3.4) 6.1 (3.4) 0,00 6.6 (3.0) 7.4 (2.5) 0,03* Interrupção do sono por
movimentos
7.4 (3.7) 6.1 (4.0) 0,41 6.8 (4.5) 7.4 (4.0) 0,31
Inquietação na cama 2.5 (3.2) 4.1 (4.7) 0,08 4.0 (3.5) 6.2 (3.4) 0,01*
Pesadelos 6.3 (3.4) 7.4 (2.6) 0,23 6.2 (4.1) 7.0 (3.1) 0,27
Alucinações noturnas 6.4 (4.0 6.3 (4.0) 0,44 6.2 (2.7) 8.5 (2.7) 0,00**
Noctúria 1.5 (2.7) 2.2 (3.6) 0,08 1.9 (3.3) 2.1 (3.6) 0,15
Incontinência Urinária 8.3 (2.3) 8.5 (2.3) 0,10 8.4 (2.0) 7.4 (3.5) 0,46 Sintomas Sensoriais 8.8 (3.3) 9.1 (1.8) 0,65 6.0 (4.3) 6.9 (3.9) 0,65 Cãimbras noturnas 6.3 (3.5) 7.7 (2.4) 0,24 7.1 (3.2) 7.3 (3.1) 0,91 Distonia ao amanhecer 8.4 (3.2) 7.2 (4.2) 0,28 7.6 (3.8) 8.2 (3.1) 0,18 Tremor matutino 8.5 (2.1) .0 (3.5) 0,28 5.4 (4.5) 0.5 (4.1) 0,07 Cansaço e sonolência ao
acordar
4.6 (4.9) 5.4 (3.7) 0,19 6.0 (4.0) 7.1 (1.5) 0,07 Repentino início do sono
diurno
6 DISCUSSÃO
Esse estudo analisou os efeitos da exposição à luz brilhante sobre: sono, humor, cognição, qualidade de vida e a função motora de pessoa com DP. Os resultados mostraram que a terapia com luz brilhante à tarde melhora as medidas de desempenho funcional com ênfase nos seguintes domínios: organização visuomotora, orientação temporal, praxias, memória, operações mentais e distúrbios específicos do sono. Observou-se também uma melhora de diversos aspectos relacionados ao sono e da percepção da qualidade de vida relacionada a cognição. Para facilitar a compreensão detalharemos em tópicos.
6.1 Desempenho Funcional da pessoa com Parkinson
O desempenho funcional abrange várias áreas e contextos do cotidiano, que vão desde as atividades da vida diária, até habilidades sociais. De acordo com Alves, Leite e Machado (2008) o mesmo compreende as atividades de autocuidado, locomoção e função social. Sendo assim, é importante ter as habilidades cognitivas preservadas.
No caso de pessoas com DP esse desempenho encontra-se comprometido. Dible et al (2010) explica que após o diagnóstico de Parkinson inicia-se um processo de deterioração, no qual o sujeito passa a ter dificuldade em realizar as atividades da vida diária e consequentemente, uma perda da auto-estima associada à sintomas depressivos, ansiedade e diminuição das atividades de lazer e sociais.
Pensando nisso, torna-se importante verificar o nível funcional da pessoa com DP e o teste utilizado nesse estudo foi o LOTCA-G que é uma escala neuropsicológica de alta sensibilidade e de aplicação restrita aos terapeutas ocupacionais. Não foi encontrado nenhum estudo relacionando o uso desta escala para verificar o efeito da luz brilhante em pessoas com DP.
No entanto, esta versão do LOTCA foi validada em 2004 no estudo de Erez e Katz (2004). Para aumentar a credibilidade, neste estudo o teste foi aplicado por duas pesquisadoras onde a segunda foi treinada pela primeira que aprendeu o método de aplicação em um curso de especialização lato-sensu. Portanto, todos os dados foram devidamente analisados antes da estatística, tendo em vista que a análise é também qualitativa e subjetiva.
déficit cognitivo antes da exposição à luz. Destes 92% melhoraram a função cognitiva após o tratamento com a luz brilhante.
Ainda sobre a análise dos resultados, foi encontrada uma variação significativa em cinco domínios do LOTCA-G que foram: organização visuomotora, orientação temporal, praxias, memória e operações mentais.
A organização visuomotora tem aspectos variados e próprios de acordo com o ciclo de vida da pessoa. No caso de idosos, Irigaray (2009) explica que relaciona-se com o bem estar psicológico e no LOTCA-G abrange atividades nas quais exige o uso das funções executivas. O déficit nessa área possivelmente relaciona-se a alterações cerebrais relativas aos circuitos dopaminérgicos no córtex associativo e pré-frontal carcaterísticos da DP (GALHARDO;AMARAL;VIEIRA, 2009; IRIGARAY, 2009). Vale ressaltar que diversas outras alterações neurais e de sistemas de neurotransmissão já foram descritos na DP.
Além disso, na DP, observa-se uma redução progressiva da função cognitiva e do desempenho funcional que podem ser ou não pararelos a deterioração motora da doença. Nesse estudo, foi utilizado a UPDRS que avalia o grau de disfunção motora quanto a percepção do paciente, e quanto a percepção do examinador, as funções mentais e as atividades da vida diária (Shenckman et al. 2011).
Todas estas evidências reforçam os efeitos benéficos da terapia com luz brilhante e lançam esclarecimentos sobre os possíveis mecanismos subjacentes. Tais resultados terapêuticos são importantes pois trata-se de uma intervenção não-medicamentosa, comportamental, que pode acrescentar um benefício para o paciente sem que haja sobrecarga farmacológica e sem custo excessivo para o sistema de saúde. Em resumo, a melhora do resultado funcional com terapias alternativas é desejável.
6.2 Qualidade de Vida na pessoa com Parkinson
A qualidade de vida é um conceito abrangente e que muda de acordo com o autor. Para a Organização Mundial de Saúde abrange o bem-estar biopsicossocial e no caso de pessoas com Parkinson, é uma construção multi-dimencional que abrange os seguintes domínios da vida do parkinsoniano: físico, social e mental (OPARA, et al, 2012)
que esta pesquisa representa o primeiro uso da terapia com luz brilhante à tarde com parkinsonianos. De forma interessante, os pacientes em uso da luz brilhante referiram uma perecepcao de melhora da função cognitiva. Apesar de não ter havido alterações no garu de sonolência, uma mudança do grau de vigília e/ou reatividade durante o dia não pode ser descartada e estar associada a este aumento da percepção da cognição que foi encontrada. Estudos posteriores podem vir a esclarecer melhor esse aspecto.
6.3 Efeito da luz nas perturbações do sono
Para verificar os distúrbios do sono, foi utilizada a ESS e a PDSS. Vários domínios relacionados aos distúrbios do sono melhoraram após a terapia com luz brilhante (Chaudhuri ET AL, 2002).
Após as verificações realizadas com os testes supracitados, foi constatado que o tratamento com a luz brilhante vespertina diminuiu as alucinações noturnas, a dificuldade em permanecer dormindo e a inquietação na cama. Portanto, a luz brilhante auxiliou na regulação do sistema vigilia-sono.
Previamente, achados semelhantes foram descritos. No entanto, os estudos anteriores encontrados utilizando a luz brilhante vespertina não foram realizados em pacientes com DP mas em outras doenças como a depressão sazonal, demência do tipo Alzheimer e insônia. O único estudo que relaciona o efeito da luz brilhante no ritmo circadiano de pessoas com DP é o de Willis e Turner, 2007 que a utilizou a noite (30 minutos antes de dormir). Há também, outros três estudos sobre o uso da luz brilhante na DP, mas nos mesmos, a luz é utilizada pela manhã ao acordar.
No estudo atual, não foram utilizadas medidas objetivas de medidas do sono e o uso de polissonografia e/ou actigrafia podem contribuir para um maior esclarecimento sobre a terapia com luz brilhante a tarde sobre o sono.
6.4 Luz regulando o ritmo circadiano da pessoa com Parkinson
Considerou-se, também, que a terapia com luz brilhante vespertina auxilia na regulação do ritmo circadiano ao amenizar o agravamento do ritmo sono-vigília, sendo assim uma alternativa viável de tratamento complementar em todos os tipos de ambientes (Most, 2010).