UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
Hipercalcemia em Animais de Companhia
Dissertação de Mestrado em Medicina Veterinária
Sara Duarte de Queirós Moreira Alves
Orientador: Professora Dra. Maria João Miranda Pires Co-orientador: Dra. Teresa Sofia Fernandes Horta
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
Hipercalcemia em Animais de Companhia
Dissertação de Mestrado em Medicina Veterinária
Sara Duarte de Queirós Moreira Alves
Orientador: Professora Dra. Maria João Miranda Pires Co-orientador: Dra. Teresa Sofia Fernandes Horta
I
II
Aos meus pais e mano Diogo, Pelo apoio incondicional
“It doesn’t matter how many resources you have. If you don’t know how to use them, they will never be enough.” (Autor deconhecido)
III
Agradecimentos
À professora Dra. Maria João Pires, por ter aceitado ser minha orientadora, por toda a ajuda na escolha do tema, pela disponibilidade, críticas e sugestões que tanto contribuíram para a realização desta dissertação e por toda a motivação que me transmitiu.
À Dra Teresa Horta, minha co-orientadora, por toda a paciência e conhecimentos transmitidos ao longo do estágio, pela disponibilidade no auxílio da elaboração desta dissertação, pelas críticas e sugestões pertinentes, e pela amizade.
Ao Dr. Vasco Braga, pela exigência e boa disposição ao longo do estágio, pelos conhecimentos importantes partilhados, por toda a colaboração nesta dissertação e pela amizade.
Ao Dr. Sérgio Alves e a toda a maravilhosa equipa do HVG (Dr. Vasco Braga, Dra. Teresa Horta, Dr. Flávio Alves, Dra. Ana Sousa, Rita, Marlene, Sónia e Vânia), por me receberem sempre de braços abertos, por toda a responsabilidade que me incutiram, pelo crescimento pessoal e profissional que me proporcionaram e por serem um exemplo a seguir no trabalho em equipa. Um bem hajam!
Ao Dr. Alfred Legendre, pela oportunidade de estagiar no HVUT e por toda a preocupação e carinho.
A toda a equipa do HVUT, (em particular à Dra. Shelly Olin, Dra. Sara Frazier e Dra Dianne Hendrix) por toda a partilha de conhecimentos, acessibilidade, entusiasmo e espírito positivo demonstrado, sendo para mim um exemplo a seguir em termos profissionais e pessoais.
À Megan, Rachel e Allison, pela ajuda preciosa na integração e por me fazerem esquecer que estava num país estrangeiro.
À Dani, Anão, Patrícia, Denise, Ana e Jojó por todo o apoio, companheirismo e bons momentos passados ao longo do estágio.
À Jojó, por termos crescido juntas e por ter estado sempre presente nos momentos importantes da minha vida. Foi um privilégio poder partilhar esta fase tão importante da nossa vida académica contigo.
À Sara, Josie, Anão, Ângela e Filipa, por me acompanharem em todo o percurso académico, pelas horas de estudo que pareciam não acabar, pelos bons momentos que passaram num abrir e fechar de olhos, pelos sorrisos e pelas lágrimas. Sem vocês não teria valido a pena!
À Sara, Filipa, Xabier, Alvar, Michael, Mathias, Tugce e Nilay por terem contribuído para que a minha experiência Erasmus fosse inesquecível.
IV
À Sofy, por fazer questão de estar sempre presente, pelas palavras amigas e pela amizade.
Ao Luís, por nunca duvidar que sou capaz, por toda a paciência, amizade e amor. Ao Billy, meu fiel companheiro ao longo da elaboração desta dissertação, pelos momentos de distração e pelos disparates que acabam quase sempre por me fazer sorrir.
Ao Snoopy, porque tudo começou contigo, és a minha estrelinha e eu nunca me esqueço de ti.
À Vovó Lili, à Vó Celeste, aos tios, tias, padrinhos, primos e primas, por serem a melhor família de sempre, por todo o apoio, carinho e preocupação.
Ao meu meu mano, Diogo, por ter enriquecido a minha infância e por toda a amizade.
Aos meus pais, por me fazerem acreditar que “querer é poder”, por me proporcionarem a possibilidade de concretizar o sonho de ser veterinária, pelo apoio e amor incondicionais.
V RESUMO
A hipercalcemia é definida como um aumento da concentração sérica do cálcio total e/ou do cálcio ionizado, cuja importância está relacionada com o facto de ser um marcador de determinadas doenças. O objetivo deste trabalho foi desenvolver e consolidar os conhecimentos relativos à hipercalcemia nos animais de companhia, nomeadamente no que diz respeito às várias etiologias e à abordagem diagnóstica. A origem da hipercalcemia pode ser classificada em causas não patológicas, transitórias e patológicas. Nesta dissertação, é dado destaque às etiologias patológicas devido a apresentarem maior importância clínica.
No Hospital Veterinário da Universidade do Tennessee, durante o estágio no serviço de Medicina Interna, foram acompanhados alguns casos clínicos de hipercalcemia. A seleção dos quatro casos incluídos nesta dissertação teve como objetivo eleger uma amostra com causas de hipercalcemia diferenciadas. O primeiro caso clínico diz respeito a hipercalcemia idiopática felina; o segundo refere-se a hipercalcemia secundária a hipoadrenocorticismo num cão; o terceiro aborda a hipercalcemia como síndrome paraneoplásica num cão; e, por último, é discutido um caso de hiperparatiroidismo secundário a insuficiência renal crónica num cão.
Apesar de a hipercalcemia não ser uma alteração frequentemente observada nos animais de companhia, esta é mais comum em cães do que em gatos, o que se verifica igualmente pelos casos acompanhados no Hospital Veterinário da Universidade do Tennessee. O diagnóstico da origem da hipercalcemia é geralmente um desafio devido à complexa fisiologia deste ião, contudo, o aperfeiçoamento das técnicas laboratoriais relativas à avaliação da homeostase do cálcio permitiu um melhor conhecimento e compreensão das suas causas. Um reconhecimento eficaz da hipercalcemia, através da história clínica, exame físico e exames complementares, é essencial para a instituição de uma terapêutica adequada de modo a prevenir a mineralização dos tecidos moles.
Palavras-chave: hipercalcemia; cão; gato; etiologia; abordagem diagnóstica; tratamento.
VI ABSTRACT
Hypercalcaemia is defined as an increase of serum concentration of total calcium and /or ionized calcium, its importance being related to the fact that it is an important marker of some diseases. This dissertation aimed at developing and consolidating the knowledge in regards to hypercalcaemia in small animals, and mainly concerning the multiple etiologies and the diagnostic approach. The origin of hypercalcaemia may be classified in non-pathological, transitory and pathological causes. This dissertation highlights pathological etiologies, as these present a greater clinical importance.
During the externship at the service of Internal Medicine of the College of Veterinary Medicine of the University of Tennessee some clinical cases of hypercalcaemia were accompanied. The selection of the four cases included in this dissertation aimed at electing a sample of differentiated causes of hypercalcaemia. The first clinical case regards feline idiopathic hypercalcaemia; the second one refers to secondary hypercalcaemia due to hypoadrenocorticism in a dog; the third case approaches hypercalcaemia as a paraneoplastic syndrome in a dog; lastly, a case of secondary hyperparathyroidism due to chronic renal failure in a dog is discussed.
Although hypercalcaemia is not a frequently observed alteration in small animals, it is more common in dogs than in cats, a fact that can equally be verified in the cases accompanied at the College of Veterinary Medicine of the University of Tennessee. The diagnosis of the origin of hypercalcaemia is usually a challenge, due to the complex physiology of this ion; however, the improvement of the laboratorial techniques concerning the evaluation of calcium homeostasis has allowed a better knowledge and understanding of its causes. An effective recognition of hypercalcaemia, by means of clinical history, physical and complementary exams, is essential to the definition of an adequate therapy in order to prevent the mineralization of soft tissue.
VII ÍNDICE GERAL PÁGINA INTRODUÇÃO... -1- I.REVISÃOBIBLIOGRÁFICA ... -2- 1. DEFINIÇÃO DE HIPERCALCEMIA ... -2-
2. REGULAÇÃO FISIOLÓGICA DO CÁLCIO ... -2-
2.1 HORMONA PARATIROIDE ... - 3 - 2.2 CALCITRIOL ... - 5 - 2.3 CALCITONINA ... - 6 - 3. ETIOLOGIA ... -6- 3.1 HIPERPARATIROIDISMO PRIMÁRIO ... - 7 - 3.2 NEOPLASIA MALIGNA ... - 8 -
3.2.1 HIPERCALCEMIA HUMORAL MALIGNA ... - 8 -
3.2.2 NEOPLASIAS MALIGNAS DA MEDULA ÓSSEA ... - 10 -
3.2.3 TUMORES ÓSSEOS PRIMÁRIOS OU METASTASES ÓSSEAS ... - 10 -
3.3 HIPERCALCEMIA IDIOPÁTICA FELINA ... - 10 -
3.4 HIPOADRENOCORTICISMO ... - 11 -
3.5 HIPERPARATIROIDISMO SECUNDÁRIO A INSUFICIÊNCIA RENAL ... - 12 -
3.6 DOENÇAS GRANULOMATOSAS ... - 13 - 3.7 HIPERVITAMINOSE D ... - 14 - 3.8 CAUSAS RARAS ... - 15 - 4. SINAIS CLÍNICOS ... -15- 5. ABORDAGEM DIAGNÓSTICA ... -16- 5.1 IDENTIFICAÇÃO DO ANIMAL ... - 17 - 5.2 ANAMNESE ... - 17 - 5.3 EXAME FÍSICO ... - 17 -
5.4.1 HEMOGRAMA E PARÂMETROS BIOQUÍMICOS ... - 18 -
5.4.2 CONFIRMAÇÃO DA HIPERCALCEMIA ... - 19 -
5.4.2.1 MEDIÇÃO DO CÁLCIO TOTAL ... - 19 -
5.4.2.2 MEDIÇÃO DO CÁLCIO IONIZADO ... - 20 -
5.4.3 ANÁLISE DE URINA ... - 21 -
5.5 IMAGIOLOGIA ... - 21 -
5.5.1 RADIOGRAFIA TORÁCICA ... - 21 -
5.5.2 RADIOGRAFIA ABDOMINAL ... - 22 -
VIII
5.5.4 ECOGRAFIA DAS GLÂNDULAS PARATIROIDES ... - 22 -
5.6 MEDIÇÃO DAS HORMONAS QUE CONTROLAM A HOMEOSTASE DO CÁLCIO ... - 23 -
5.6.1 MEDIÇÃO DA HORMONA PARATIROIDE ... - 23 -
5.6.2 MEDIÇÃO DA PROTEÍNA RELACIONADA COM A HORMONA PARATIROIDE ... - 24 -
5.6.3 MEDIÇÃO DOS METABOLITOS DA VITAMINA D ... - 24 -
5.7 OUTROS EXAMES COMPLEMENTARES ... - 25 -
6. TRATAMENTO ... -26- 6.1 TRATAMENTO DE SUPORTE ... - 26 - 6.1.1 TRATAMENTO AGUDO ... - 27 - 6.1.1.1 FLUIDOTERAPIA ENDOVENOSA ... - 27 - 6.1.1.2 DIURÉTICOS ... - 27 - 6.1.1.3 CORTICOSTEROIDES ... - 27 - 6.1.1.4 CALCITONINA ... - 28 - 6.1.1.5 BISFOSFONATOS ... - 28 - 6.1.1.6 BICARBONATO DE SÓDIO ... - 29 - 6.1.1.7 MITRAMICINA ... - 29 - 6.1.1.8 EDTA ... - 30 - 6.1.1.9 DIÁLISE ... - 30 - 6.1.2 TRATAMENTO CRÓNICO ... - 30 - 6.1.2.1 DIETA ... - 30 - 6.1.2.2 CORTICOSTEROIDES ... - 31 - 6.1.2.3 BISFOSFONATOS ... - 32 - 6.1.2.4 FLUIDOTERAPIA SUBCUTÂNEA ... - 32 -
6.2 ABORDAGENS TERAPÊUTICAS FUTURAS ... - 33 -
7. PROGNÓSTICO ... -33-
II.CASOSCLÍNICOS ... -34-
CASO CLÍNICO Nº1– HIPERCALCEMIA IDIOPÁTICA FELINA ... -35-
CASO CLÍNICO Nº2–HIPOADRENOCORTICISMO ... -40-
CASO CLÍNICO Nº3–LEUCEMIA/LINFOMA ... -45-
CASO CLINICO Nº 4–HIPERPARATIROIDISMO SECUNDÁRIO A INSUFICIÊNCIA RENAL CRÓNICA -51- DISCUSSÃO ... -56-
CONCLUSÃO ... -78-
BIBLIOGRAFIA ... -79- ANEXOI–RESULTADOS DE HEMOGRAMA E DO PERFIL BIOQUÍMICO REALIZADOS NO
VETERINÁRIO DE REFERÊNCIA DO CASO CLÍNICO Nº1 ... XII ANEXOII–PROTOCOLO DE QUIMIOTERAPIA DA UNIVERSIDADE DE WISCOSIN –MADISON XIII
IX
ÍNDICE DE FIGURAS E TABELAS
Figura 1. Funções da hormona paratiroide ……….… 4
Figura 2. Insuficiência renal crónica e a homeostase do cálcio ………...4
Figura 3. Funções do calcitriol ………...5
Figura 4. Orgãos alvo dos fatores tumorais ……….9
Figura 5. Radiografia abdominal com projecção latero-lateral direita………..37
Figura 6. Líquido livre abdominal………..38
Figura 7. Intestino delgado……….38
Figura 8. Linfonodos mesentéricos………...38
Figura 9. Linfonodos mesentéricos………...38
Figura 10. Pâncreas……….38
Figura 11. Baço……….38
Figura 12. Baço………...…………..38
Figura 13. Fígado………..38
Figura 14. Rim esquerdo……….39
Figura 15. Bexiga………..39
Figura 16. Radiografia abdominal com projecção latero-lateral direita……….43
Figura 17. Radiografia abdominal ventrodorsal………43
Figura 18. Glândula adrenal direita………....44
Figura 19. Glândula adrenal esquerda………..44
Figura 20. Baço……….48
Figura 21. Linfonodo ilíaco………..48
Figura 22. Rim esquerdo……….48
Figura 23. Rim direito………...48
Figura 24. Radiografia abdominal com projecção latero-lateral direita………....54
Figura 25. Fígado………..55
Figura 26. Vesícula biliar………..55
Figura 27. Rim esquerdo………..55
Figura 28. Rim direito………55
Figura 29. Bexiga………..55
Figura 30. Estômago……….55
Tabela 1. Causas de hipercalcemia ………..6
X
Tabela 3. Alterações na concentração do cálcio e das hormonas envolvidas na sua
na sua homeostase ……….25
Tabela 4. Casuística de casos observados durante o período de estágio na rotação de Medicina Interna…….………...34
Tabela 5. Resultados dos parâmetros bioquímicos.………..36
Tabela 6. Resultados da analíse da urina………...36
Tabela 7. Resultados do hemograma………..41
Tabela 8. Resultados dos parâmetros bioquímicos………...42
Tabela 9. Resultados da analíse da urina………42
Tabela 10. Resultados do teste de estimulação com ACTH………....43
Tabela 11. Comparação dos parâmetros alterados antes e depois do tratamento……..44
Tabela 12. Resultados do hemograma………....46
Tabela 13. Resultados dos parâmetros bioquímicos……….46
Tabela 14. Resultados da análise da urina……….47
Tabela 15. Resultados do hemograma de acompanhamento……….49
Tabela 16. Resultados dos parâmetros bioquímicos de acompanhamento.……….50
Tabela 17. Resultados do hemograma………....52
Tabela 18. Resultados dos parâmetros bioquímicos……….52
Tabela 19. Resultados da análise da urina..………...53 Tabela 20. Resultados do hemograma realizado no veterinário de referência do caso clínico nº 1………XII Tabela 21. Resultados dos paramêtros bioquímicos realizado no veterinário de
referência do caso clínico nº1 ………..………XII Tabela 22. Protocolo de quimioterapia da Universidade de Wiscosin – Madison ……...XIII
XI
LISTA DE ABREVIATURAS, SIGLAS, SÍMBOLOS E ACRÓNIMOS
m2 – metro quadrado MCHC – concentração de hemoglobina corpuscular média mEq - milequivalentes mg – miligrama mL – mililitro mm – milímetro mmHg – milímetros de mercúrio NaCl – cloreto de sódio
ng – nanograma
RDW – coeficiente de distribuição de volume dos eritrócitos
RNA – ácido ribonucleico rpm – respirações por minuto PGE – prostaglandina
pmol – picomol PO – per os
ppm – pulso por minuto PTH- hormona paratiroide
PTHrP – proteína relacionada com a hormona paratiroide
SC - subcutâneo SID – uma vez ao dia tCa – cálcio total TID – três vezes ao dia
TNF – fator de necrose tumoral TRC – tempo de repleção capilar
TPLO- Osteotomia de Nivelamento da Meseta Tibial UI – unidades internacionais UV – ultravioleta VD - ventrodorsal µg – micrograma % – percentagem
® – símbolo de marca registada ºC – graus Celcius
< - menor > - maior
A/G – albumina/globulina ABS - absoluto
ACTH – hormona adrenocorticotrópica ADH – hormona antidiurética
ALT – alanina aminotransferase AST – asparto aminotransferase BID – duas vezes ao dia
bpm – batimentos por minuto CO2 – dióxido de carbono
DOCP - Pivalato de desoxicorticosterona EDTA - ácido etilenodiamino tetra-acético dL - decilitro
iCa – cálcio ionizado FA – fosfatase alcalina FEC – fluido extracelular
FeLV – Vírus da imunodeficiência felina h - hora
HHM – hipercalcemia humoral maligna HIF – hipercalcemia idiopática felina
HVUT - hospital veterinário da universidade do Tennessee
IBD – inflammatory bowel disease IL – interleucina
IM - intramuscular
IRA – insuficiência renal aguda IRC – insuficiência renal crónica IV – Intravenosa
Kg – quilograma L – litro
- 1 - INTRODUÇÃO
A escolha do tema “Hipercalcemia em Animais de Companhia”, prende-se com o facto de a hipercalcemia ser uma alteração eletrolítica pouco frequente e que por isso, é desvalorizada na prática clínica. Contudo, é importante a realização de uma investigação metódica da sua causa primária devido às várias etiologias que podem estar na sua origem. O objetivo principal deste trabalho foi desenvolver e consolidar conhecimentos relativos à hipercalcemia em cães e gatos, nomeadamente no que diz respeito às diversas etiologias e à abordagem diagnóstica, através do acompanhamento de casos clínicos. Para isso, foram estabelecidos objetivos mais específicos: o acompanhamento de procedimentos clínicos e meios complementares de diagnóstico; o tratamento e monitorização da evolução clínica dos casos observados e a interpretação e discussão de todos os dados clínicos, para cada caso, através da comparação com a informação disponível na literatura.
Na primeira parte deste trabalho é apresentada uma revisão bibliográfica do tema, desde a homeostasia do cálcio no organismo, até à abordagem diagnóstica e tratamento, passando pelas diferentes causas de hipercalcemia, desde as mais frequentes às mais incomuns. Na segunda parte do trabalho apresentam-se quatro casos clínicos de hipercalcemia, todos eles com diferentes etiologias: hipercalcemia idiopática felina, hipercalcemia secundária a hipoadrenocorticismo, hipercalcemia como síndrome paraneoplásica e hiperparatiroidismo secundário a insuficiência renal crónica. Nos diferentes casos clínicos é, numa primeira fase, apresentada uma descrição do quadro clínico na data de apresentação do animal à consulta, que inclui também os diagnósticos diferenciais, a totalidade dos exames complementares realizados, a descrição do tratamento e da evolução do caso. De seguida é apresentada uma breve discussão de cada um deles, onde se compara o caso clínico com o que está descrito na literatura, de modo a justificar a forma como foi efetuada a abordagem diagnóstica e o respetivo tratamento.
- 2 - I.REVISÃOBIBLIOGRÁFICA
1. DEFINIÇÃO DE HIPERCALCEMIA
A hipercalcemia é definida como um aumento da concentração sérica de cálcio total (tCa) e/ou de cálcio ionizado (iCa) na corrente sanguínea (Schenck e Chew, 2006; Fan, 2007; Nelson e Couto, 2009a). A importância da hipercalcemia prende-se com o facto de ser um marcador importante de determinadas doenças, como por exemplo, neoplasias malignas e hipoadrenocorticismo (Schenck et al., 2006a).
Com base num estudo no qual foram analisados 10 000 amostras de soro canino durante um período de 6 meses, concluiu-se que a prevalência da hipercalcemia nos cães é cerca de 1,5% (Caldin et al., 2001; Schenck et al., 2006a). Nos gatos não há estudos que quantifiquem a incidência da hipercalcemia (Schenck et al., 2006b).
2. REGULAÇÃO FISIOLÓGICA DO CÁLCIO
O cálcio é um ião intra e extracelular, vital, uma vez que é essencial nas seguintes funções: reações enzimáticas, transporte e estabilidade membranares, coagulação sanguínea, condução nervosa, transmissão neuromuscular, tónus da musculatura lisa vascular, secreção hormonal, formação e reabsorção óssea, controlo do metabolismo do glicogénio hepático e divisão e crescimento celular (Rosol e Capen, 1997). Além disso, a concentração de iCa no fluido extracelular (FEC), regula as funções de determinadas células nas glândulas paratiroides, rins e células C da tiroide, através da sua ligação a um recetor sensível ao iCa (Schenck et al., 2006a).
No organismo, o cálcio está armazenado sob três diferentes formas: no esqueleto ósseo (99%) e nos fluidos intra e extracelulares (1%) (Greco, 2012).
O cálcio existente no esqueleto, é armazenado como hidroxiapatite, Ca10(PO4)6(OH)2,
uma substância composta não só por cálcio, como também por fostato e água (Greco, 2012). A maioria do cálcio no esqueleto não está imediatamente disponível para trocas intra-celulares, sendo que menos de 1% é considerado disponível (Vasilopulos e Mackin, 2003a). A pequena quantidade de cálcio que pode ser rapidamente envolvida nas trocas intracelulares tem origem no FEC existente entre os osteoblastos e os osteócitos na matriz óssea (Greco, 2012).
A segunda maior reserva de cálcio é intracelular, e está sequestrada em organelas (mitocôndria, retículo endoplasmático) ou ligado a células ou proteínas membranares (calbindina, calmoduina e troponina C) (Greco, 2012). A fração de cálcio intracelular é mantida a concentrações bastante reduzidas relativamente à fracção extracelular, uma vez que elevadas concentrações deste ião dentro das células interferem com o seu
- 3 -
metabolismo, levando a disfunção e morte celular por excessiva ativação de sistemas enzimáticos dependentes do cálcio e através da ligação a fosfato intracelular (Vasilopulos e Mackin, 2003b).
A menor reserva de cálcio é o cálcio extracelular, e engloba o cálcio intersticial, o cálcio sanguíneo e o FEC existente entre o tecido ósseo (Greco, 2012). O cálcio extracelular é composto por 3 frações distintas: ionizado, em complexo (ligado a fosfato, bicarbonato, sulfato, citrato e lactato) e ligado a proteínas (Alenza, 2012). Nos cães clinicamente normais, estas frações correspondem a 56%,10% e 34% do tCa, respetivamente (Brown et al., 2003). Nos gatos, estas frações, correspondem a 52%, 8% e 40%, respetivamente (Schenck et al., 2006b). O iCa é a fração biologicamente ativa, sendo assim a mais importante para a avaliação quantitativa deste ião (Brown et al., 2003; Schenck e Chew, 2008a). A fração de cálcio não ligada a proteínas é filtrada no glomérulo e posteriormente cerca de 98% é reabsorvido nos túbulos renais (Vasilopulos e Mackin, 2003b).
A complexa regulação da concentração de cálcio é feita num intervalo de referência bastante estreito (Brown et al., 2003). A sua homeostasia é regulada pelo eixo endócrino que envolve a hormona paratiroide (PTH), a forma ativa da vitamina D (1,25- dihidroxicolecalciferol ou calcitriol) e a calcitonina (Green e Chew, 2009). Estas hormonas, que coletivamente são designadas como hormonas calcitrópicas, atuam principalmente na regulação de cálcio extracelular (Barber, 2001). Os órgãos alvo destas hormonas são o intestino delgado (calcitriol), os rins (calcitriol e PTH) e os ossos (caltriol, calcitonina e PTH) (Vasilopulos e Mackin, 2003b). Existem ainda outras hormonas, que incluem os corticosteroides, o estrogénio, a tiroxina, a somatotropina e o glucagon que contribuem em menor escala para a manutenção da homeostase do cálcio em determinadas situações (Maxie, 2007).
2.1 HORMONA PARATIROIDE
A PTH é uma hormona polipeptídica constituída por 84 aminoácidos, sendo sintetizada pelas células principais das glândulas paratiroides (Cline, 2012).
A PTH intervém perante reduzidas oscilações na quantidade de cálcio, atuando minuto a minuto (Vasilopulos e Mackin, 2003). Os níveis de cálcio sanguíneo são monitorizados por recetores específicos localizados na superfície das células principais, que promovem a síntese e secreção de PTH perante uma concentração de iCa abaixo do limite de referência ou de elevados níveis de fosfato (Stillion e Ritt, 2009). Após a sua secreção, a PTH tem uma semivida bastante curta (3 a 5 minutos) no soro, tornando necessário que esta secreção seja efetuada a um ritmo uniforme para a manutenção da sua concentração sérica (Schenck
- 4 -
IRC
Fósforo
Calcitriol
Cálcio
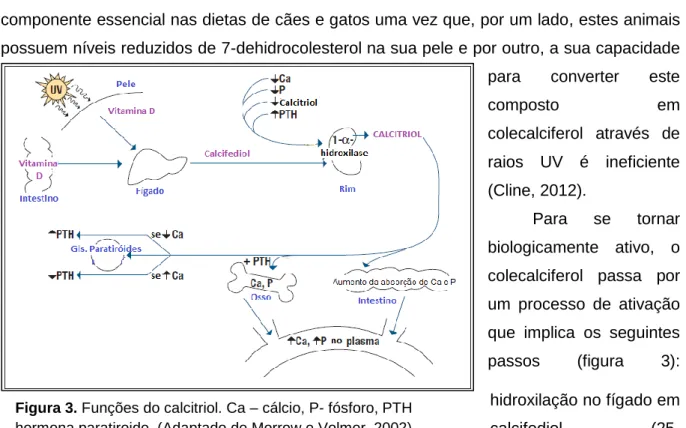
PTH
Figura 1. Funções da PTH. Ca – cálcio, P- fósforo, PTH hormona paratiroide (Adaptado de Morrow e Volmer, 2002).
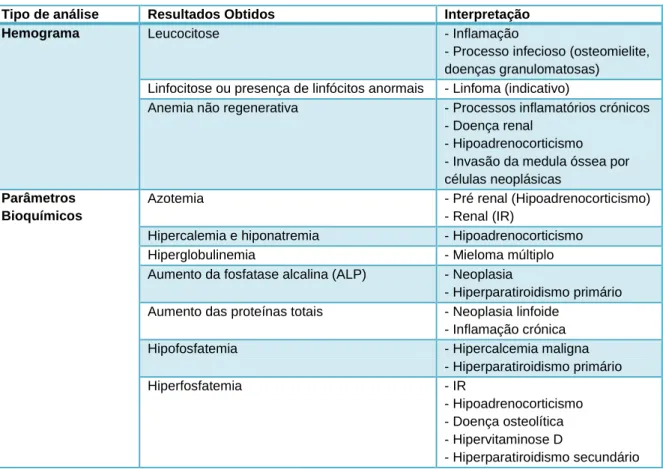
Figura 2. Insuficiência renal crónica e homeostase do cálcio. PTH – hormona paratiroide.
As ações biológicas da PTH incluem (figura 1): a estimulação da reabsorção osteoclástica da matriz óssea, libertando cálcio e fósforo do osso para a corrente sanguínea; a estimulação da absorção do cálcio e inibição da absorção de fósforo nos túbulos renais; e estimulação da produção renal de calcitriol, que por sua vez vai aumentar a absorção de cálcio e fósforo a nível intestinal (Cline, 2012).
O calcitriol também tem um papel importante na regulação da síntese e secreção de PTH, uma vez que bloqueia a produção desta hormona e estimula a síntese de recetores de cálcio nas glândulas paratiroides face a elevadas concentrações deste ião (Schenck et al., 2006a).
A concentração de fósforo regula a secreção de PTH indiretamente: em casos iniciais de insuficiência renal crónica (IRC), devido a ligeira hiperfosfatemia, a produção renal de calcitriol é reduzida, levando à diminuição da concentração de cálcio; quando há um grande aumento da concentração de fósforo (como em casos de insuficiência renal graves/prolongados), a concentração de iCa pode diminuir drasticamente, resultando num aumento da secreção de PTH (figura 2) (Stillion e Rit, 2009).
A concentração sérica de magnésio tem pouca influência no controlo da secreção de PTH em condições normais, contudo a sua secreção pode ser inibida por uma elevada concentração sérica de magnésio (Greco, 2012). Paradoxalmente, a hipomagnesemia também resulta na inibição da secreção de PTH, e apesar deste mecanismo celular não ser totalmente conhecido, pensa-se que pode ser causado pela diminuição da sensibilidade dos recetores de iCa na membrana celular (Schenck et al., 2006a).
- 5 -
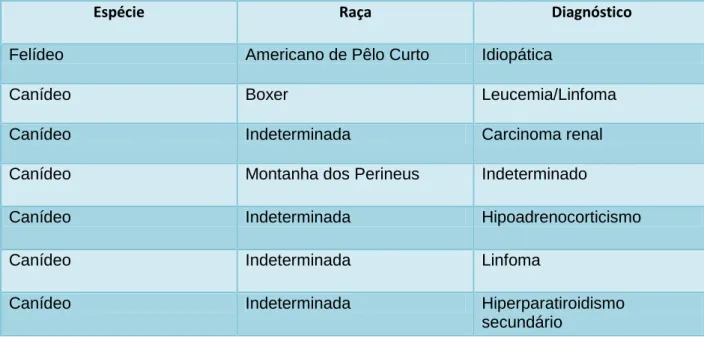
Figura 3. Funções do calcitriol. Ca – cálcio, P- fósforo, PTH
hormona paratiroide. (Adaptado de Morrow e Volmer, 2002). 2.2 CALCITRIOL
O calcitriol é o metabolito ativo da vitamina D. A vitamina D, hormona esteroide, é um componente essencial nas dietas de cães e gatos uma vez que, por um lado, estes animais possuem níveis reduzidos de 7-dehidrocolesterol na sua pele e por outro, a sua capacidade para converter este
composto em colecalciferol através de raios UV é ineficiente (Cline, 2012). Para se tornar biologicamente ativo, o colecalciferol passa por um processo de ativação que implica os seguintes passos (figura 3): hidroxilação no fígado em calcifediol (25- hidroxicolecalciferol) e hidroxilação no rim, pela enzima 1-α-hidroxilase, originando assim o calcitriol (Morrow e Volmer, 2002). Esta reação é estritamente regulada por mecanismos hormonais e iónicos que modulam a atividade das enzimas que realizam a hidroxilação renal (Greco, 2012). A atividade renal da enzima 1-α-hidroxilase, e consequentemente a quantidade de calcitriol, é mediado pela concentração sanguínea de cálcio, fósforo, PTH e do próprio calcitriol (figura 3) (Morrow e Volmer, 2002).
O calcitriol, estimulado pela secreção de PTH em resposta à hipocalcemia, atua nos enterócitos para promover a absorção de cálcio e fósforo a nível intestinal (Stillion e Ritt, 2009). O calcitriol atua também no tecido ósseo, permitindo a deslocação de cálcio da matriz óssea para a corrente sanguínea, e promovendo a ação da PTH no metabolismo ósseo do cálcio (Greco, 2012). Nos rins, o calcitriol aumenta a absorção de cálcio e fósforo nos túbulos renais, e exerce um mecanismo de retroação negativo sob a síntese de mais calcitriol no rim e de PTH nas glândulas paratiroides (Stillion e Ritt, 2009). Ao contrário da PTH, o calcitriol atua na regulação do cálcio a longo prazo, uma vez que o seu efeito a nível intestinal depende da ativação da síntese de proteínas nas células da mucosa intestinal (Greco, 2012).
- 6 - 2.3 CALCITONINA
A calcitonina é uma hormona polipeptídica constituída por 32 aminoácidos, sintetizada nas células C ou parafoliculares da tiróide, e cuja principal função é limitar o grau de hipercalcemia pós-prandial (Green e Chew, 2009). Atua a nível do tecido ósseo para diminuir o nível de cálcio no sangue, estimulando os osteoblastos a aumentar a absorção e deposição deste ião no esqueleto e diminuir a reabsorção óssea realizada pelos osteoclastos (Stillion e Ritt, 2009). Perante elevadas concentrações de cálcio, a calcitonina pode ainda promover a excreção de cálcio e fosfato a nível urinário (Greco, 2012).
Num animal saudável, a ação da calcitonina é muito menos importante do que a ação da PTH na regulação do cálcio, contudo assume maior importância em animais em crescimento, gestantes e em lactação, nos quais protege os ossos de uma perda de cálcio excessiva (Schenck et al., 2006; Stillion e Ritt, 2009).
3. ETIOLOGIA
Existem várias causas para a hipercalcemia, podendo ser categorizadas em diversos grupos de acordo com a gravidade e o processo de origem (Fan, 2007). As principais categorias incluem causas não patológicas,
causas transitórias e causas
patológicas/persistentes (tabela 1) (Schenck et al., 2006a).
Num estudo no qual foram analisadas 10 000 amostras de soro canino, durante um período de 6 meses, 148 amostras apresentavam hipercalcemia, 28% das quais eram de animais em crescimento, 62% apresentavam hipercalcemia transitória e 8% apresentavam hipercalcemia persistente e relacionada com causas patológicas (Caldin et al., 2001; Schenck
et al., 2006a).
No âmbito do presente trabalho, será dado maior destaque às causas patológicas da hipercalcemia, devido a terem maior importância clínica.
Causas de Hipercalcemia Não Patológicas
Amostra colhida sem jejum
Animal em crescimento
Erro laboratorial
Lipemia
Contaminação da amostra ou do tubo
Transitórias
Hemoconcentração
Hiperproteínemia
Hipotermia grave (raro)
Patológicas (principais) Dependentes da paratiroide - Hiperparatiroidismo primário o Adenoma (comum) o Adenocarcinoma (raro) o Hiperplasia (invulgar) Independentes da paratiroide - Neoplasia maligna o Hipercalcemia humoral maligna o Neoplasias malignas da medula óssea
o Metástases ósseas ou tumor ósseo primário - Idiopática (gatos) - Hipoadrenocorticismo - IRC - Doenças granulomatosas - Hipervitaminose D Tabela 1. Causas de hipercalcemia
- 7 -
A principal causa patológica de hipercalcemia nos cães é a presença de neoplasias malignas em cerca de 50% dos casos (Messinger et al., 2009). Estudos iniciais indicavam que a neoplasia seria igualmente a principal causa de hipercalcemia nos gatos (Savary et
al., 2000), contudo atualmente há evidência de que é a hipercalcemia idiopática a que
ocorre mais frequentemente nesta espécie (Schenck e Chew, 2009). 3.1 HIPERPARATIROIDISMO PRIMÁRIO
Nos cães, o hiperparatiroidismo primário é a terceira causa mais comum de hipercalcemia (Messinger et al., 2009), sendo mais rara a sua ocorrência nos gatos (Savary
et al., 2000). Num estudo retrospetivo com 71 gatos hipercalcémicos, apenas 4 foram
diagnosticados com hiperparatiroidismo primário (Savary et al., 2000).
Nos animais com hiperparatiroidismo primário, a hipercalcemia é consequência da produção autónoma de PTH pelas glândulas paratiroides, sendo que a produção não está relacionada com os níveis de cálcio circulante (Bonczynski, 2007). Neste caso, as glândulas paratiroides sofrem alterações no seu parênquima, podendo ser classificadas em 3 categorias histopatológicas: carcinoma, adenoma (massa tipicamente solitária) e hiperplasia da paratiroide (que geralmente envolve o aumento simultâneo de mais do que uma das glândulas) (Schaefer e Goldstein, 2009). Os tumores mais comuns são os adenomas (Sakals et al., 2010).
Ao contrário de outras doenças que podem causar hipercalcemia, o hiperparatiroidismo primário está sempre associado a um aumento do cálcio, como foi comprovado num estudo realizado com 210 cães (Feldman et al., 2005).
A secreção independente de PTH provoca uma aceleração da reabsorção óssea, induzindo hipercalcemia (Bonczynski, 2007). Para além disso, a PTH inibe a excreção urinária de cálcio, promovendo a sua acumulação no organismo (Schaefer e Goldstein, 2009). A PTH estimula a produção de calcitriol a nível renal que por sua vez vai promover a absorção de cálcio intestinal (Bonczynski, 2007). Por último, a hipercalcemia resulta dos reduzidos níveis de fósforo existentes devido à estimulação da excreção urinária deste composto pela PTH, limitando a formação de complexos com o iCa (Schaefer e Goldstein, 2009).
Todas estas interações resultam nas alterações bioquímicas típicas desta doença: hipercalcemia, hipofosfatemia e hiperfosfatúria (Schaefer e Goldstein, 2009).
Concentrações de PTH acima do limite de referência, associadas a hipercalcemia e função renal normal, permitem um diagnóstico definitivo de hiperparatiroidismo primário (Schenck et al., 2006b). Uma vez que, perante elevadas concentrações de cálcio, a secreção de PTH deve ser suprimida, concentrações de PTH dentro dos limites de
- 8 -
referência, associadas a hipercalcemia e a função renal normal, também sugerem a presença de hiperparatiroidismo primário, sendo que cerca de 75% dos cães afetados têm concentrações normais de PTH (Feldman e Nelson, 2004; Goldstein, 2010).
3.2 NEOPLASIA MALIGNA
A hipercalcemia associada a neoplasia maligna é definida como uma elevação patológica do cálcio em resposta a um processo maligno, podendo ser associado a três mecanismos fisiopatológicos distintos: produção de fatores humorais pelo tumor (hipercalcemia humoral maligna - HHM); tumores ósseos primários/metástases de tumores sólidos para os ossos; e neoplasias malignas da medula óssea (Maxie, 2007). Estas duas últimas levam a hipercalcemia devido aos efeitos osteolíticos locais, enquanto que a hipercalcemia humoral maligna é mediada por fatores humorais que, apesar de serem produzidos pelo tumor, exercem o seu efeito num local distante da neoplasia, representando um exemplo clássico de uma síndrome paraneoplásica (Vasilopulos e Mackin, 2003b).
3.2.1 HIPERCALCEMIA HUMORAL MALIGNA
Nos cães, a HHM é associada mais frequentemente à presença de linfoma (geralmente das células T, com predileção pelo mediastino) ou com o adenocarcinoma apócrino do saco anal (Galvão et al., 2011). Num estudo retrospetivo com 109 cães com hipercalcemia ionizada, 58% foram diagnosticados com neoplasia; desses, 78% tinham linfoma, 11% carcinoma (diferentes localizações) e 6% adenocarcinoma apócrino do saco anal (Messinger
et al., 2009). Adicionalmente, casos esporádicos de HHM ocorrem em cães com timoma,
mieloma, melanoma, feocromocitoma ou carcinomas com origem nos pulmões, pâncreas, glândula tiroide, pele, glândula mamária, cavidade nasal e medula da glândula adrenal (Pressler et al., 2002; Schenck et al., 2006a).
Os tumores associados com HHM nos gatos incluem o linfoma, o carcinoma das células escamosas (nomeadamente na cabeça e no pescoço) e o mieloma múltiplo (Vasilopulos e Mackin, 2003b). Num estudo retrospetivo envolvendo 71 gatos com hipercalcemia, 21 foram diagnosticados com neoplasia, sendo que 7 tinham linfoma e outros 7 tinham carcinoma das células escamosas (Savary et al., 2000). Há ainda casos menos comuns de HHM felina associada a carcinoma/adenocarcinoma broncogénico, osteossarcoma, fibrossarcoma, sarcoma indiferenciado, carcinoma renal indiferenciado, carcinoma dos pulmões e do diafragma e carcinoma da tiroide (Schenck et al., 2006a).
- 9 -
Figura 4. Órgãos alvo dos fatores humorais. IL –
interleucina, TNF- fator de necrose tumoral, PTHrP – proteína relacionada com a hormona paratiroide (Adapatado de Vasilopulos e Mackin, 2003b).
A proteína relacionada com a hormona paratiroide (PTHrP) é a principal responsável pela HHM, estando também envolvidos outros fatores humorais (figura 4) tais como a interleucina (IL) -1, o fator de necrose tumoral (TNF) – α, fatores de crescimento transformantes (TFGs)-α e β, prostaglandinas (especialmente a PGE2), fatores ativadores
dos osteoclastos e possivelmente o calcitriol (Vasilopulos e Mackin, 2003b; Schenck et al., 2006a). Existe uma correlação entre os níveis de PTHrP e a magnitude da hipercalcemia em casos de animais com adenocarcinoma apócrino do saco anal (Williams et al., 2003), contudo o mesmo não se verifica em animais com linfoma (Schenck et al., 2006a). Estes resultados sugerem que mecanismos adicionais se encontram envolvidos na HHM no caso do linfoma, incluindo possivelmente a IL-1 e 6, TGF-α e β e a produção de calcitriol através da enzima 1α-hidroxilase (Vasilopulos e Mackin, 2003b). Em animais com aumento dos níveis de calcitriol, pensa-se que os linfócitos malignos possuem a mesma atividade que a 1α-hidroxilase, que é a mesma enzima encontrada nas mitocôndrias renais (Vasilopulos e Mackin, 2003a). Noutro estudo, concluiu-se que não havia correlação entre as concentrações de tCa e iCa e a concentração de PTHrP, quer em cães com linfoma (n=8), quer nos com adenocarcinoma apócrino do saco anal (n=3), contudo, a sua validade é questionável devido à reduzida dimensão da amostra(Mellanby et al., 2006).
A PTHrP é produzida em vários locais no organismo, mas é apenas detetada a concentrações séricas bastante reduzidas (< 1 pmol/L) em animais saudáveis, uma vez que é rapidamente metabolizada numa forma inativa e posteriormente eliminada pelos rins (Vasilopulos e Mackin, 2003b). Nos adultos, a sua função está relacionada com a comunicação celular parácrina (Gajanayake et al., 2010), enquanto que nos fetos é a principal hormona responsável pela regulação do cálcio (Maxie, 2007). A PTHrP contribui também para o transporte de cálcio para o leite durante a lactação (Maxie, 2007).
A porção da PTHrP (terminal N, aminoácidos 1 – 34), que se liga aos recetores tem uma homologia de 70% com a PTH, e por esse motivo, a PTHrP apresenta afinidade de ligação e funções semelhantes à PTH (Bergman, 2012).
- 10 -
Concentrações de PTHrP detetáveis no soro estão quase sempre associadas a processos malignos, sendo raro encontrar hipercalcemia associada a um processo benigno (Gajanayake et al., 2010). No entanto, houve dois casos descritos de cães com hipercalcemia associado a esquistossomose (Heterobilharzia americana) na qual a identificação de PTHrP foi possível sem que houvesse neoplasia (Fradkin et al., 2001).
Os cães e os gatos com HHM tipicamente têm baixos níveis de PTH e elevadas concentrações de PTHrP, contudo a causa da HHM pode geralmente ser determinada através de meios de diagnósticos adequados antes de se recorrer medições hormonais (Bergman, 2012).
3.2.2 NEOPLASIAS MALIGNAS DA MEDULA ÓSSEA
Algumas neoplasias malignas hematológicas presentes na medula óssea provocam hipercalcemia através da estimulação da reabsorção óssea local, principalmente em tumores como o linfoma e o mieloma múltiplo (Rogers, 2006).
A atividade de fatores parácrinos e citoquinas, nomeadamente a IL-1, TNF-α e β, promove a reabsorção óssea neste tipo de neoplasias (Rosol e Capen, 1997).
3.2.3 TUMORES ÓSSEOS PRIMÁRIOS OU METASTASES ÓSSEAS
Os tumores ósseos primários (muito raro) ou metástases para o osso podem provocar hipercalcemia através da indução da reabsorção óssea local associada ao crescimento tumoral, não sendo uma situação particularmente comum nos animais de companhia (Maxie, 2007).
Os mecanismos fisiopatológicos incluem: a secreção de citoquinas ou fatores que estimulam a reabsorção óssea local e a estimulação indireta da reabsorção óssea pela estimulação tumoral da produção de citoquinas por células do sistema imunitário ou ósseas (Schenck et al., 2006a).
3.3 HIPERCALCEMIA IDIOPÁTICA FELINA
A hipercalcemia idiopática felina (HIF) refere-se a uma condição na qual existe uma concentração de iCa aumentada sem etiologia identificada, mesmo após uma extensiva avaliação médica (Chew e Schenck, 2009). Atualmente, a hipercalcemia idiopática é considerada a principal forma de hipercalcemia nos gatos nos Estados Unidos da América havendo igualmente alguns case reports na Europa (Chew e Schenck, 2009).
Num estudo com 20 gatos que apresentavam HIF, o intervalo de idades era dos 2 aos 13 anos (sendo a média de 5.8 anos) (Midkiff et al., 2000). Noutro estudo com 427 gatos, o intervalo de idades era dos 0.5 aos 20 anos, com uma média de 9.8 anos (Chew e Schenck, 2006). Não foi reconhecida qualquer predisposição entre géneros, havendo contudo uma
- 11 -
maior representação de gatos com pelo comprido, quer em animais sem raça definida, quer animais de raça pura, como os persas e os himalaias, sugerindo a existência de um fator genético associado a esta condição (Midkiff et al., 2000; Galvão et al., 2011).
Vários fatores têm sido considerados relativamente à causa subjacente deste tipo de hipercalcemia. Atualmente, ainda não é claro se resulta do aumento da absorção intestinal de cálcio, do aumento da reabsorção óssea, da diminuição da excreção renal do cálcio ou de uma combinação destes três fatores (Baral e Little, 2011).
Acredita-se que rações acidificantes (dietas com restrição de magnésio) predispõem os gatos para a hipercalcemia idiopática (Midkiff et al., 2000; Schenck et al., 2006b; Baral e Little, 2011). Num estudo com 5 gatos que apresentavam hipercalcemia idiopática e urólitos de oxalato de cálcio, todos foram alimentados com uma dieta acidificante ou medicados com um acidificante urinário (McClain et al., 1999). Contudo, nem todos os gatos alimentados com este tipo de dietas desenvolvem hipercalcemia, por isso, suspeita-se da existência de um mecanismo adicional que predispõe determinados gatos ao aumento do cálcio sanguíneo (Midkiff et al., 2000).
Outra hipótese plausível é a de que o excesso de vitamina D na dieta, em alguns alimentos para gatos, pode contribuir para esta síndrome, independentemente destes animais apresentarem concentrações normais de calcifediol (Schenck et al., 2006b). Contudo, é pouco provável que concentrações normais de calcifediol induzam hipercalcemia uma vez que existe um controlo bastante rigoroso da transformação deste composto no metabolito ativo da vitamina D (calcitriol) (Schenck et al., 2006b).
A relação entre a HIF e a IRC não está totalmente compreendida; por um lado a doença renal pode surgir em gatos com hipercalcemia idiopática persistente, por outro, gatos com doença renal podem apresentar hipercalcemia após prolongados períodos de normocalcemia (Baral e Little, 2011). Há ainda gatos nos quais é diagnosticada doença renal e simultaneamente hipercalcemia idiopática (Schenck et al.,2006b).
Em casos de hipercalcemia idiopática, as concentrações plasmáticas de cálcio podem estar aumentadas durante meses a anos sem aparecimento de sinais clínicos, sendo muitas vezes um achado ocasional de análises sanguíneas realizadas a gatos assintomáticos (Baral e Little, 2011).
3.4 HIPOADRENOCORTICISMO
O hipoadrenocorticismo (ou doença de Addison) pode provocar várias alterações eletrolíticas, sendo uma delas uma hipercalcemia ligeira a moderada (Goodson e Randell, 2009). A hipercalcemia foi observada em 28% a 31% dos cães com hipoadrenocorticismo primário (Peterson e Feinman, 1982; Schenck et al., 2006a) e em apenas um gato com
- 12 -
hipoadrenocorticismo primário num estudo com 10 gatos (Peterson et al., 1989). Noutro estudo com 36 cães com hipoadrenocorticismo, 42% tinham aumento no tCa, mas apenas 22% demonstraram aumento tanto do tCa como do iCa (Adamantos e Boag, 2008).
Embora o mecanismo exato da hipercalcemia associada ao hipoadrenocorticismo não esteja completamente esclarecido, há algumas teorias postuladas. Em animais saudáveis, os corticosteroides promovem a calciurese. A excessiva absorção renal do cálcio em cães sujeitos a adrenalectomia sugere que a calciurese é um fator importante no aparecimento da hipercalcemia (Lathan e Tyler, 2005a). Por outro lado, a hiperproteinemia secundária à hemoconcentração pode também contribuir para a hipercalcemia em alguns animais adisonianos (Goodson e Randell, 2009). Acrescente-se ainda que através da inibição da vitamina D, os corticosteroides diminuem a absorção intestinal de cálcio; por esse motivo, a hipocortisolemia pode originar um aumento da absorção intestinal de cálcio (Lathan e Tyler, 2005a).
3.5 HIPERPARATIROIDISMO SECUNDÁRIO A INSUFICIÊNCIA RENAL
A hiperplasia das glândulas paratiroides e o hiperparatiroidismo podem ocorrer secundariamente a IRC tanto no cão como no gato (Galvão et al., 2011). Num estudo com 109 cães com aumento do iCa determinou-se que a IRC era a segunda causa mais comum da hipercalcemia (Messinger et al., 2009). Relativamente aos gatos, a incidência desta síndrome varia de 11.5% (Barber e Elliott, 1998) a 58% (Baral e Little, 2011).
No início do desenvolvimento da IRC, a taxa de filtração glomerular diminuí, causando um aumento do fósforo plasmático e uma eventual inibição da enzima 1-α-hidroxilase (Monteiro et al., 2012). A inibição da atividade desta enzima origina uma diminuição da produção de calcitriol e uma diminuição dos níveis plasmáticos de cálcio, devido à contribuição do calcitriol na absorção de cálcio intestinal (Graves, 2010). As glândulas paratiroides são sensíveis a diminuições iniciais da concentração de cálcio e respondem aumentando a produção e secreção de PTH, o que permite ultrapassar a inibição causada pelo fósforo e estimular a atividade da enzima 1-α-hidroxilase, levando, por fim, a uma elevação da absorção intestinal de cálcio e o consequente aumento deste ião no plasma (Morrow e Volmer, 2002). A PTH contribui ainda para a normalização dos valores de fosfato através do aumento da sua excreção pela via urinária e da diminuição da sua absorção ao nível do tubulo proximal renal (Brown et al., 2006).
Com a progressão da lesão renal, a fosfatúria induzida pela PTH não é suficiente para diminuir os elevados níveis de fósforo plasmático, originando uma hiperplasia das glândulas paratiroides de modo a permitir um aumento da produção de PTH (Morrow e Volmer, 2002). De igual modo, com a contínua diminuição da taxa de filtração glomerular, a atividade da
- 13 -
enzima 1-α-hidroxilase torna-se reduzida ou ausente e sem o sinergismo do calcitriol, o cálcio por si não consegue bloquear a síntese e secreção de PTH, contribuindo ainda mais para a hiperplasia das glândulas paratiroides (Stillion e Ritt, 2009). Devido aos seus efeitos no rim e nos intestinos, a única estrutura na qual a PTH pode atuar para manter a homeostase do cálcio é o osso, podendo haver desmineralização óssea em casos de IRC prolongada devido à estimulação crónica de PTH – osteodistrofia renal (Barber, 2001; Morrow e Volmer, 2002). Esta síndrome designa-se de hiperparatiroidismo secundário e é caracterizada pela presença de hiperfosfatemia, normo, hipo ou hipercalcemia, diminuição do calcitriol e aumento da produção de PTH (Monteiro et al., 2012).
Outros fatores que podem contribuir para o desenvolvimento de hiperparatiroidismo secundário a IRC incluem diminuição da eliminação da PTH pelos rins e alteração no set
point da resposta das glândulas paratiroides a variações do nível de cálcio (Stillion e Ritt,
2009).
As concentrações de tCa em animais com hiperparatiroidismo secundário a IRC podem estar normais, elevadas ou diminuídas (Stillion e Ritt, 2009). Um aumento do tCa foi observado em cerca de 10% dos cães com IRC e a sua prevalência parece aumentar com a gravidade da azotemia (Schenck e Chew, 2003; Schenck et al., 2006a). Em contraste com um possível aumento do tCa, a hipercalcemia ionizada é um achado relativamente pouco frequente em animais com IRC devido à concorrente hiperfosfatemia e diminuição da produção de calcitriol pelos rins (Stillion e Ritt, 2009). Num estudo com 490 cães com IRC, 9% tinham hipercalcemia, 55% estavam normocalcémicos e 36% estavam hipocalcémicos, tendo por base a medição do iCa (Schenck e Chew, 2005). Os gatos com IRC aparentam ter uma maior incidência de hipercalcemia ionizada, em comparação com os cães (Schenck et
al., 2006a). Num estudo realizado com 102 gatos com IRC, 29% estavam hipercalcémicos,
61% normocalcémicos e 10% hipocalcémicos, com base nas concentrações de iCa (Schenck e Chew, 2010).
Quando a doença renal atinge um estadio terminal, a excreção mineral decresce radicalmente, resultando em concentrações muito elevadas de fósforo e cálcio plasmáticos (Morrow e Volmer, 2002). Esta condição, que é caracterizada pela presença de hipercalcemia ionizada que não consegue inibir a excessiva secreção de PTH, designa-se de hiperparatiroidismo terciário (Baral e Little, 2011).
3.6 DOENÇAS GRANULOMATOSAS
Existem várias doenças granulomatosas capazes de originar hipercalcemia incluindo, micoses sistémicas, tuberculose, blastomicose, esquistossomose, coccidiomicose, histoplasmose e dermatites granulomatosas (Neiger, 2007). Nestas situações, a
- 14 -
hipercalcemia pode resultar da produção de calcitriol pelos macrófagos ativados durante a infeção (Baral e Little, 2011). Os macrófagos mimetizam a atividade da 1α-hidroxilase (que converte o calcifediol em calcitriol) quando estimulados pelo interferão ou lipopolissacarídeos (Fan, 2007). Existe alguma especulação no fato da hipercalcemia não ocorrer em todos os animais que apresentam doenças granulomatosas; as possíveis razões que justificam esta situação prendem-se com o número e o tamanho dos granulomas, a sua atividade imunológica, o agente, fatores genéticos e ambientais e o desenvolvimento concomitante de insuficiência renal (Rohrer et al., 2000).
A blastomicose é uma doença granulomatosa que ocasionalmente (5% a 14% dos casos) se encontra associada a hipercalcemia nos cães (Schenck et al., 2006a). Num estudo que incluiu 38 cães com blastomicose, 5% tinham concentrações elevadas de iCa, mas apenas 2.6% apresentavam elevação na concentração de tCa (Crews et al., 2007). A hipercalcemia associada a doenças granulomatosas está descrita num cão com infeção gástrica por Pythium insidiosum (LeBlanc et al., 2008), num com linfadenite adenomatosa (Mellanby et al., 2006) e dois com esquistossomose (Fradkin et al., 2001).
Nos gatos, concentrações elevadas de calcitriol estão documentadas em casos de Nocardia e infeção micobacteriana atípica (Maeley et al., 1999; Schenck et al., 2006a). Alguns gatos com blastomicose, criptococose, actinomicose e granulomas no local de vacinação apresentavam hipercalcemia (Maeley et al., 1999; Savary et al., 2000; Storms et
al., 2003).
Nos animais com hipercalcemia associada a doenças granulomatosas espera-se um aumento tanto no tCa como no iCa, e valores normais de PTH e PTHrP (Allen et al., 2010). Contudo, há registo de dois cães com hipercalcemia e valores elevados de PTHrP cujo diagnóstico foi infeção por Heterobillharzia americana (Fradkin et al., 2001).
3.7 HIPERVITAMINOSE D
A hipervitaminose D é uma causa de hipercalcemia bem reconhecida em cães e gatos e está associada a intoxicações por rodenticidas contendo colecalciferol, ingestão de cremes para tratamento de psoríase constituídos por calcipotrieno (análogo sintético do calcitriol), excessiva suplementação de vitamina D alimentar ou ingestão de determinadas espécies de plantas (Cestrum diurnum, Solanum malacoxylon, Triestum flavescens) que contêm análogos da vitamina D (Mellanby et al., 2005; Allen et al., 2010). Existe uma grande variação entre indivíduos na suscetibilidade ao colecalciferol que não é necessariamente dependente da dose ingerida (Peterson e Fluegeman, 2013).
No fígado, o colecalciferol, adquirido através da ingestão de qualquer umas das substâncias acima referidas, é metabolizado em calcifediol (Greco, 2012). Uma vez que esta
- 15 -
conversão tem um mecanismo de retroação negativo quase inexistente (figura 3), a ingestão de grandes quantidades de colecalciferol vai originar um aumento na concentração de calcifediol (DeClementi e Sobczak, 2012). O calcifediol é posteriormente metabolizado pelo rim em calcitriol, que é o metabolito ativo da vitamina D (Dee e Hovda, 2012). Com o aumento da concentração de calcitriol, o mecanismo de retroacção negativo diminuí a sua produção, contudo o calcifediol continua a ser produzido em quantidades suficientemente elevadas, suscetíveis de causar sinais clínicos (Morrow e Volmer, 2002).
Na hipervitaminose D, os níveis de PTH estão diminuídos, a PTHrP encontra-se ausente e o calcifediol está aumentado (Schenck et al., 2006a). Note-se ainda que os resultados do perfil analítico da vitamina D dependem do análogo ingerido e da forma da vitamina D testada pelo laboratório; assim, muitas vezes o calcipotrieno não é detetado pois a maioria dos laboratórios medem apenas o calcifediol e o calcitriol (Morrow e Volmer, 2002).
3.8 CAUSAS RARAS
Situações pouco comuns associadas a hipercalcemia em cães incluem: lesões esqueléticas não malignas, aspergilose, septicemia neonatal, ingestão de uvas e insuficiência renal aguda (IRA) (Schenck et al., 2006a). Está também descrita hipercalcemia numa cadela com retenção fetal e endometrite (Hirt et al., 2000), em cachorros com hipotiroidismo congénito e num cão adulto com hipotiroidismo (Lobetti, 2011) .
Nos gatos, há bibliografia referente a um caso de hipotermia e outro de pancreatite, sendo que nesta doença é mais comum a ocorrência de hipocalcemia (Schenck et al., 2006b). Na literatura encontram-se ainda referências de hipertiroidismo felino e hipercalcemia concomitante: num estudo identificou-se um aumento do tCa com o iCa normal em 2 gatos incluídos numa amostra de 26 gatos hipertiroides (Barber e Elliott, 1996); noutro estudo envolvendo 71 gatos que apresentavam hipercalcemia, 2 foram diagnosticados com hipertiroidismo (Savary et al., 2000).
4. SINAIS CLÍNICOS
Os sinais clínicos associados a aumentos patológicos do cálcio estão diretamente relacionados, não só com a magnitude da hipercalcemia, como também com a rapidez do seu aumento (Fan, 2007). Os sinais clínicos apresentados por um animal com hipercalcemia resultam da hiperpolarização das membranas celulares, tendo consequências ao nível dos sistemas neuromuscular, gastrointestinal, cardíaco e renal (Fan, 2007; Greco, 2012).
A anorexia, poliúria/polidipsia (PU/PD), letargia e fraqueza são os sinais clínicos mais frequentes nos cães com hipercalcemia (Galvão et al., 2011). No entanto, para valores semelhantes de hipercalcemia, cada animal apresenta, diferenças notáveis nos sinais clínicos.
- 16 -
Ao contrário do cão, os sinais clínicos mais frequentes no gato são a anorexia e a letargia, com a PU/PD a serem raramente notadas (Barber, 2001). Nesta espécie, os sinais clínicos variam de ausentes a graves, mas são normalmente insidiosos e, muitas vezes, não são observados pelos donos (Schenck et al., 2006b).
A PD/PU têm causas multifatoriais. A poliúria é causada pela redução da hipertonicidade medular (diminuição da reabsorção renal de sódio, por competição com o cálcio), e insensibilidade à ADH por parte dos túbulos renais distais devido à alteração nos gradientes de concentração dos solutos – diabetes insípida nefrogénica (Greco, 2012). A polidipsia ocorre como mecanismo compensatório da poliúria, e também por estimulação direta do centro da sede pela hipercalcemia (Schenck et al., 2006a). A alteração da permeabilidade das membranas vai originar uma diminuição da excitabilidade do sistema nervoso central e periférico e uma concomitante diminuição da excitabilidade do músculo liso gastrointestinal, causando letargia, anorexia, vómito, constipação, fraqueza e, por vezes, convulsões (Nelson e Couto, 2009a). Devido à diminuição da eliminação renal da gastrina, o aumento da secreção de ácido gástrico acompanha frequentemente a hipercalcemia, e pode intensificar as manifestações gastrointestinais, tal como a hematemese observada em alguns cães (Groman, 2012). Os sinais clínicos relacionados com o sistema cardiovascular são raramente observados em cães e gatos e incluem diminuição do intervalo Q-T, aumento do intervalo P-R e bradicardia (Nelson e Couto, 2009a). Estes sinais são mais frequentemente observados quando a concentração plasmática de cálcio excede os 18 mg/dL (Nelson e Couto, 2009a). A hipertensão associada a hipercalcemia está descrita em humanos e ratos, contudo ainda não há evidências concretas relativas à sua presença em cães e gatos (Schenck et al., 2006a). Aumentos moderados e persistentes da concentração de cálcio (12-14 mg/dL) podem originar urólitos e consequentemente sinais de doença trato urinário inferior, como hematúria e estrangúria (Greco, 2012). A presença de uma hipercalcemia grave (> 14 mg/dL) pode progredir rapidamente para IRA devido à mineralização do parênquima renal (Greco, 2012).
5. ABORDAGEM DIAGNÓSTICA
Como já foi referido anteriormente, a hipercalcemia pode ter diversas causas, por isso é fundamental que a abordagem diagnóstica seja sistemática, metódica e rigorosa (Ward, 2008).
Nos cães, após uma extensiva avaliação diagnóstica, geralmente encontra-se uma causa para a hipercalcemia (Schenck et al., 2006b). Contudo, estima-se que em 2-3% dos cães e em 12-13% dos gatos não se consegue descobrir a causa da hipercalcemia (Rogers, 2006).
- 17 -
O diagnóstico da origem da hipercalcemia é geralmente um desafio devido à complexa fisiologia deste ião, na qual intervêm uma diversidade de fatores (Morrow e Volmer, 2002). Contudo, o aperfeiçoamento das técnicas laboratoriais relativas à avaliação da homeostase do cálcio (medição da concentração sérica de iCa, da PTH, da PTHrP e dos metabolitos da vitamina D) permitiu um melhor conhecimento e compreensão das causas da hipercalcemia, simplificando o seu diagnóstico (Schenck et al., 2006a; Greco, 2012).
5.1 IDENTIFICAÇÃO DO ANIMAL
Devido à variedade de doenças que pode estar na origem da hipercalcemia, a prevalência de idade, raça e género, é bastante variável. Assim, as cadelas adultas estão mais predispostas ao hipoadrenocorticismo, cães e gatos adultos a geriátricos são mais suscetíveis ao desenvolvimento de neoplasias e de doenças renais, cães jovens de raças de desporto estão mais sujeitos a doenças granulomatosas, especialmente blastomicose, e nos cães de raça Keeshond e nos gatos siameses existe uma predisposição genética para o hiperparatiroidismo primário (Brown et al., 2003). Há ainda estudos que apontam para a predisposição genética de gatos com pelo comprido para a hipercalcemia idiopática (Midkiff
et al. 2000; Galvão et al., 2011).
5.2 ANAMNESE
Através da anamnese, pode descartar-se causas como: a possibilidade de hipervitaminose D devido a contacto com rodenticidas, excesso de suplementação na dieta ou ingestão de determinadas espécies de plantas (Cestrum diurno, Solanum malacoxylon,
Triestum flavescens) ou de cremes para tratamento da psoríase (Brown et al., 2003; Sakals et al., 2010). É importante averiguar se o animal tem dor articular/óssea (indicativo de lesão
osteolítica), se apresenta PU/PD, ou se demonstra dificuldade em alimentar-se (possível azotemia, osteodistrofia renal) (Feldman, 2007).
5.3 EXAME FÍSICO
A realização de um exame físico minucioso é fundamental na abordagem diagnóstica da hipercalcemia uma vez que permite a obtenção de dados clínicos importantes, assim como a exclusão/inclusão de determinadas etiologias da hipercalcemia (Feldman, 2007).
O exame físico deve incidir nos seguintes parâmetros: avaliação dos linfonodos relativamente ao tamanho e consistência (linfoma ou doença fúngica disseminada), palpação dos sacos anais (adenocarcinoma das glândulas apócrinas), palpação abdominal (averiguar possíveis alterações de tamanho de órgãos e presença de massas abdominais), palpação das glândulas mamárias (avaliar a presença de massas), exame do fundo do olho (granulomas, sinais de hipertensão), palpação da coluna vertebral e dos ossos longos
- 18 -
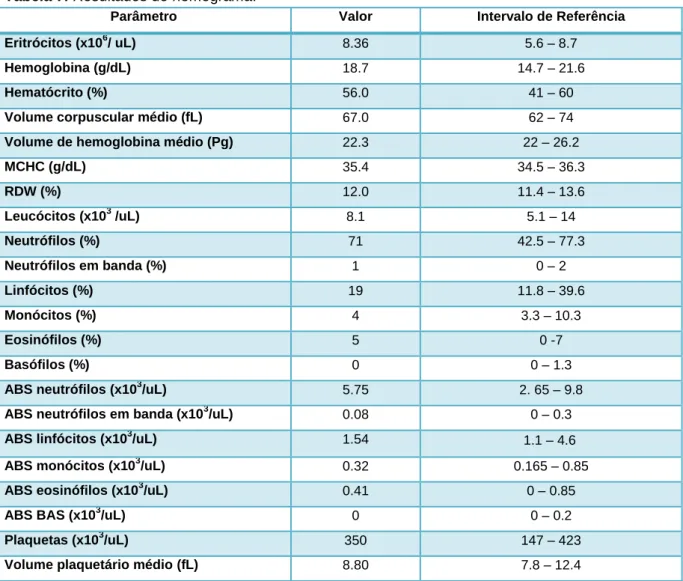
Tabela 2. Alterações no hemograma e nos parâmetros bioquímicos.
(identificação de dor óssea associada a lesões osteolíticas), avaliação da frequência cardíaca e do pulso (bradicardia e pulso fraco associados a hipoadrenocorticismo em cães), averiguação da presença de odor urémico (insuficiência renal) e avaliação do grau de hidratação (presença de desidratação em animais com crises addisonianas, insuficiência renal e alterações gastrointestinais) (Brown et al., 2003; Bonczynski, 2007; Fan, 2007; Feldman, 2007; Ward, 2008).
Em animais com hiperparatiroidismo primário o exame físico geralmente não revela alterações e raramente é possível palpar as glândulas paratiroides nos cães, sendo mais comum a presença de uma massa cervical nos gatos (Miller e Chew, 2008).
5.4 ANÁLISE AO SANGUE E URINA
A realização de um hemograma, bioquímica e análise de urina permite não só a obtenção de uma base de dados mínima do animal, como também podem revelar alterações típicas de determinadas causas de hipercalcemia (Panciera, 2007).
5.4.1 HEMOGRAMA E PARÂMETROS BIOQUÍMICOS
Na tabela 2 estão descritas as alterações mais frequentes no hemograma e nos parâmetros bioquímicos, em situações de hipercalcemia, e a respetiva interpretação.
Tipo de análise Resultados Obtidos Interpretação
Hemograma Leucocitose - Inflamação
- Processo infecioso (osteomielite, doenças granulomatosas) Linfocitose ou presença de linfócitos anormais - Linfoma (indicativo)
Anemia não regenerativa - Processos inflamatórios crónicos - Doença renal
- Hipoadrenocorticismo - Invasão da medula óssea por células neoplásicas
Parâmetros Bioquímicos
Azotemia - Pré renal (Hipoadrenocorticismo)
- Renal (IR)
Hipercalemia e hiponatremia - Hipoadrenocorticismo Hiperglobulinemia - Mieloma múltiplo Aumento da fosfatase alcalina (ALP) - Neoplasia
- Hiperparatiroidismo primário Aumento das proteínas totais - Neoplasia linfoide
- Inflamação crónica
Hipofosfatemia - Hipercalcemia maligna
- Hiperparatiroidismo primário Hiperfosfatemia - IR - Hipoadrenocorticismo - Doença osteolítica - Hipervitaminose D - Hiperparatiroidismo secundário
- 19 - 5.4.2 CONFIRMAÇÃO DA HIPERCALCEMIA
O primeiro passo na abordagem diagnóstica de um animal no qual foi detetada hipercalcemia através da análise bioquímica do sangue, é confirmar se esta é real, uma vez que existem vários fatores não patológicos que podem interferir com a concentração de cálcio (Ward, 2008; Alenza, 2012; Greco, 2012). Para tal, é recomendado repetir-se a medição do tCa e, idealmente, realizar também a medição do iCa (Schenck e Chew, 2008b).
5.4.2.1 MEDIÇÃO DO CÁLCIO TOTAL
Apesar do iCa ser a fração biologicamente ativa, a avaliação dos níveis do cálcio dos animais é geralmente iniciada pela medição do tCa (Bonczynski, 2007).
De modo a evitar falsos negativos e positivos, a amostra de sangue deve ser obtida após 12 horas de jejum, porque a hiperlipemia pode induzir hipercalcemia moderada (Green e Chew, 2009). Os tubos utilizados para armazenamento do sangue devem conter heparina uma vez que o cálcio se liga a outros anti-coagulantes como o oxalato, o citrato e o EDTA, diminuindo falsamente a concentração de cálcio (Schenck, 2007). A diluição de amostras e a hiperbilirrubinemia podem também contribuir para a diminuição da concentração de tCa (Schenck et al., 2006a).
Os métodos analíticos utilizados para a determinação clínica da concentração de tCa, geralmente incluem reações colorimétricas ou espectrofotometria (Schenck et al., 2006a). Na amostra analisada, a presença de hemólise pode resultar na formação de complexos de hemoglobina que vão aumentar falsamente a concentração de cálcio pois interferem na medição colorimétrica deste composto (Baral e Little, 2011).
Os valores normais de tCa variam de 9.0 – 11.5 mg/dL em cães e de 8.0- 10.5 mg/dL em gatos (Schenck e Chew, 2008a). Contudo, estes valores podem ser influenciados pelo método de análise utilizado, sendo por isso fundamental que cada laboratório estabeleça o seu próprio intervalo de referência (Green e Chew, 2009). A variabilidade nos valores de concentração do cálcio pode ainda resultar das diferenças da idade (animais em crescimento podem ter valores elevados de cálcio que são considerados fisiológicos), duração do jejum antes da colheita e tempo entre colheita e posterior análise (Schenck e Chew, 2008b).
Uma vez que o tCa é composto por três frações, alterações em qualquer uma destas frações podem influenciar a medição do tCa, principalmente a concentração de proteínas plasmáticas e de albumina (Schenck e Chew, 2008b). Para prever a concentração de iCa com base apenas na medição do tCa, existem duas fórmulas que servem para ajustar a concentração de tCa à concentração de albumina e à de proteínas totais (Schenck et al., 2006a). Estas equações assumem que concentrações de tCa ajustadas que se encontram