ALEXANDRA PAIVA ARAÚJO
A INFLUÊNCIA DE FATORES NUTRICIONAIS NA
RESPOSTA AO TESTE DE MONTENEGRO, EM
INDIVÍDUOS VACINADOS ANTI LEISHMANIOSE
TEGUMENTAR AMERICANA
UNIVERSIDADE FEDERAL DE OURO PRETO
OURO PRETO
A663i Araújo, Alexandra Paiva.
A influência de fatores nutricionais na resposta ao teste de Montenegro, em indivíduos vacinados anti leishmaniose tegumentar americana [manuscrito] / Alexandra Paiva Araújo. – 2007.
xxiii, 125 f.: il., color; graf., tabs.
Orientador: Prof. Dr. George Luiz Lins Machada Coelho.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas em Ciências
Biológicas.
Área de concentração: Imunobiologia de protozoários.
1. Leishmaniose - Teses. 2. Vacinas - Teses. 3. Elementos traços - Teses. I. Universidade Federal de Ouro Preto. II. Título.
UNIVERSIDADE FEDERAL DE OURO PRETO INSTITUTO DE CIÊNCIAS EXATAS E BIOLÓGICAS NÚCLEO DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS
A INFLUÊNCIA DE FATORES NUTRICIONAIS NA RESPOSTA AO TESTE DE
MONTENEGRO, EM INDIVÍDUOS VACINADOS ANTI LEISHMANIOSE
TEGUMENTAR AMERICANA
ALUNA: ALEXANDRA PAIVA ARAÚJO
ORIENTADOR: Prof. Dr. GEORGE LUIZ LINS MACHADO COELHO
Dissertação apresentada no Programa de
Pós-Graduação do Núcleo de Pesquisas em Ciências
Biológicas da Universidade Federal de Ouro
Preto, como parte integrante dos requisitos
para obtenção do título de Mestre em Ciências
Biológicas, área de concentração:
Imunobiologia de protozoários.
Ouro Preto
Aos meus pais e meus heróis,
Stephenson e Leila,
“Tudo quanto te vier à mão para fazer,
Faze-o conforme as tuas forças.
Porque na sepultura, para onde vais,
Não há obra, nem indústria,
Nem ciência e nem sabedoria alguma.”
A Deus, fonte inesgotável de amor e sabedoria.
Ao Professor Doutor George Luiz Lins Machado Coelho, pela confiança em mim depositada, pela oportunidade a mim concedida de desenvolvimento e crescimento profissional, pelos ensinamentos, pela paciência, respeito e amizade desde a Iniciação Científica, pelo valioso incentivo e cuidado na orientação deste trabalho. Muitíssimo obrigada!
À Doutora Olguita Geralda Ferreira Rocha, pelos ensinamentos e colaboração imprescindíveis ao desenvolvimento deste trabalho, pela confiança e paciência, pelo carinho e atenção.
Ao Professor Doutor Wilson Mayrink, pela oportunidade a mim concedida de fazer parte de sua equipe, desenvolvendo este trabalho na região de Caratinga. Além de tudo, agradeço o enriquecimento intelectual e a confiança.
Ao Sr. Jair Cecílio de Paula, do Centro de Tratamento de Leishmanioses - Caratinga, pela atenção e importantíssima colaboração nos trabalhos de campo realizados na região de Caratinga.
À equipe da Unidade Descentralizada de Caratinga – Jane, Edna Cristina, Walter, José Lúcio e Rogério, pela ajuda preciosa nos trabalhos de campo.
Aos funcionários do Laboratório de Traços Metálicos do CETEC, MG, pela atenção, apoio e ótima convivência durante meu treinamento e análises laboratoriais das amostras. Em especial ao Sr. Geraldo do Carmo, pela atenção e paciência nas análises realizadas no ICP OES e a Susan Joyce por dividir comigo as tensões do FIAS MHS.
Ao Professor Roney pela disponibilização do LAPAC, para a realização dos hemogramas.
Ao Alekson, um grande companheiro de mestrado e amigo. Obrigada pelo auxílio nas coletas das amostras e realização dos hemogramas, pelas extensas horas de convívio no LEPI ou estudando Bioestatística, as Protozoologias, Imuno e Epidemiologia.... E a todos do LEPI pelo apoio constante, pela alegria, pelo bom trabalho em equipe, pelas risadas, pelo companheirismo e amizade. Em especial à Ana Paula (Apcc), Gabriela Lanna, Liliane, Paulinha, Josy e Cléia... grandes amigas... enfim, Deus coloca em nossa vida pessoas capazes de tornar os caminhos menos árduos e nos fazer sorrir em meio às dificuldades. Obrigada!!!
Aos voluntários participantes deste ensaio clínico, residentes nas áreas de Córrego do Emboque, Fazenda Caetana e Patrocínio, região rural de Caratinga, MG, pela boa vontade na vacinação, realização do TM e coletas de sangue.
Aos Professores do curso de Pós-Graduação em Ciências Biológicas pela valiosa contribuição na minha formação, em especial à Prof. Dra. Maria Terezinha Bahia; Prof. Dr. Luiz Carlos Crocco Afonso; Prof. Dra. Marta de Lana e ao Prof. Dr. Alexandre Barbosa Reis.
À Cida, nossa querida secretária do NUPEB.
À Universidade Federal de Ouro Preto, onde tive a oportunidade iniciar minha formação profissional desde a graduação em Farmácia e onde hoje completo mais uma etapa desta caminhada.
Aos meus amados pais Stephenson e Leila, pelo amor, incentivo em todos os momentos, por me ensinarem o gosto pelas letras, pela confiança, por me acolherem nos momentos de desespero e por vibrarem comigo frente às conquistas. Obrigada por não medirem esforços para a realização deste nosso sonho.
Ao Olívio, meu amor, pela amizade, paciência, amor e pelo incentivo na etapa final deste trabalho. Obrigada por estar ao meu lado, trazendo um novo colorido à minha caminhada.
A todos os amigos que estiveram ao meu lado, torcendo e apoiando. Muito obrigada!
À Ouro Preto, um lugar mágico, pela oportunidade de viver o passado e o futuro no presente.
ÍNDICE DE FIGURAS
ÍNDICE DE TABELAS
ÍNDICE DE TABELAS DOS ANEXOS
SUMÁRIO
Resumo...xviii
Abstract...xxi
1. Introdução………...………1
2. Revisão bibliográfica………...………...4
2.1. Leishmaniose Tegumentar Americana e sua epidemiologia...5
2.1.1. Espécies do gênero Leishmania, vetores e reservatórios...6
2.2.Formas clínicas ...8
2.3.Imunidade...10
2.3.1. Aspectos nutricionais e resposta imune...13
2.3.1.1. Cobre...14
2.3.1.2. Ferro……….………...……...…...16
2.3.1.3. Selênio...19
2.3.1.4. Zinco...22
2.4. Diagnóstico da LTA...24
2.4.1. Diagnóstico clínico e epidemiológico...24
2.4.2. Diagnóstico parasitológico……...…...…...…..25
2.4.3. Diagnóstico imunológico…...26
2.4.4. Diagnóstico molecular…...27
2.5.Tratamento...28
2.6.Controle da LTA...30
2.7.Vacina anti-leishmaniose tegumentar americana...31
3. Justificativas...37
4. Objetivos...39
5. Materiais e Métodos...41
5.1. Desenho e população do estudo...42
5.2. Cálculo do tamanho da amostra...43
5.3. Vacina...44
5.4. Teste de Montenegro...44
5.6. Coleta de amostras e mascaramento...45
5.7. Realização dos Hemogramas…...……...……..45
5.8. Determinação dos teores séricos de cobre, ferro, selênio e zinco...46
5.8.1. Reagentes utilizados...47
5.8.2. Equipamentos...48
5.8.3. Preparo das amostras...48
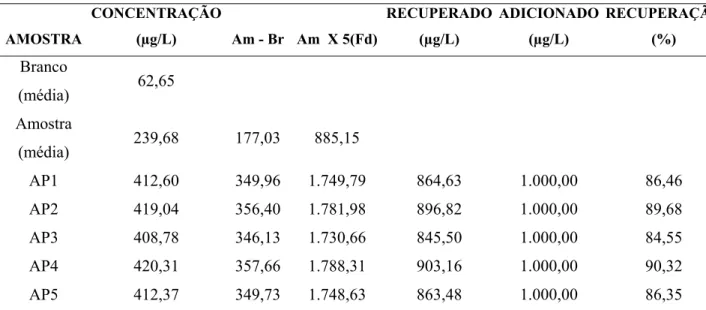
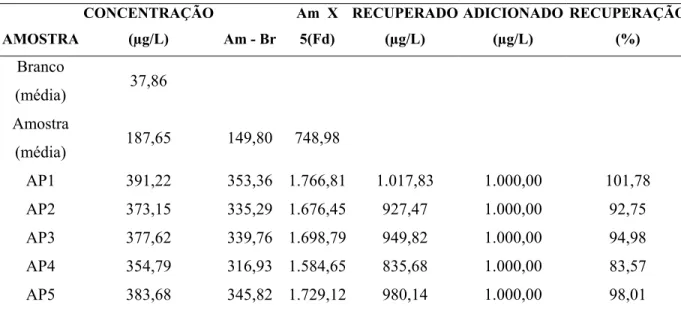
5.8.4. Determinação de selênio sérico por espectrometria de absorção atômica com geração de hidretos acoplado ao sistema de injeção de fluxo...48
5.8.4.1. Princípio do método...48
5.8.4.2. Validação do método para determinação de selênio em soro humano utilizando espectrometria de absorção atômica com geração de hidretos e sistema de injeção de fluxos...49
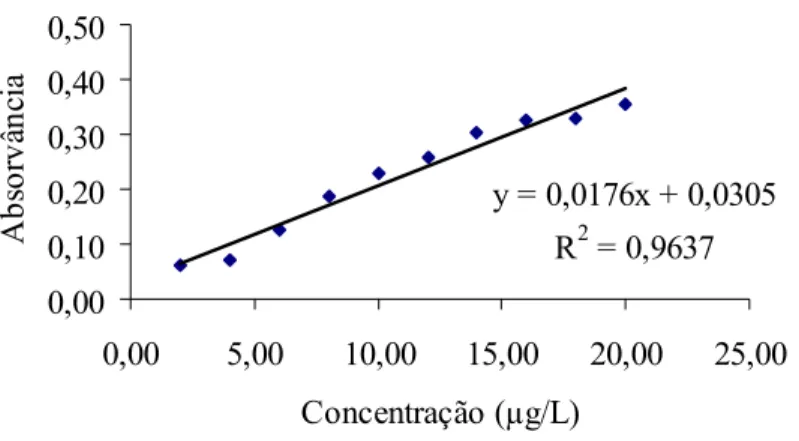
5.8.4.3. Linearidade da faixa de trabalho...49
5.8.4.4. Teste de Seletividade…………...………...50
5.8.4.5. Limites de detecção e quantificação...50
5.8.4.6. Estimativa da exatidão e repetitividade...51
5.8.5. Determinação de cobre, ferro e zinco séricos por espectrometria de emissão por plasma indutivamente acoplado...51
5.8.5.1. Princípio do método...51
5.8.5.2. Estimativa da exatidão do método...52
5.9. Procedimento operacional...52
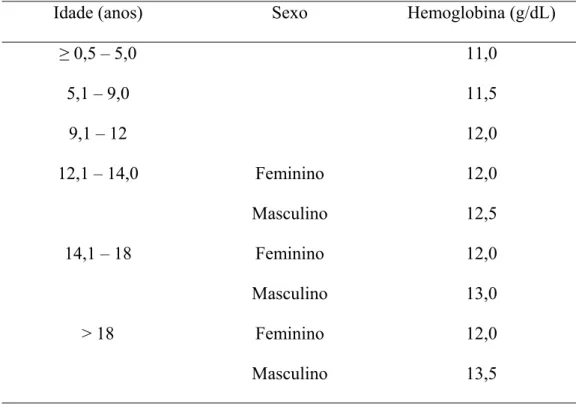
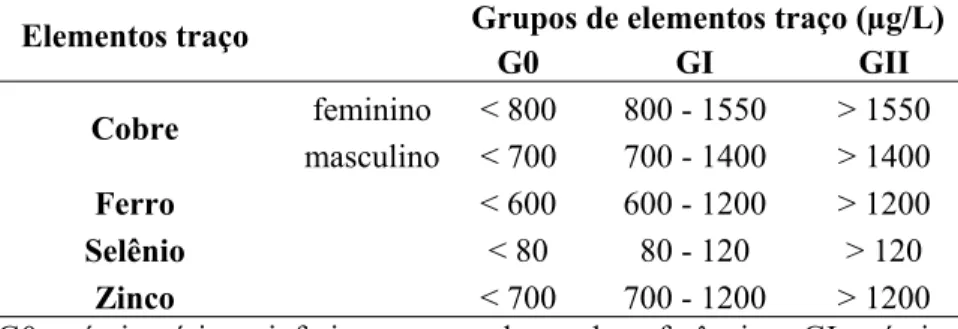
5.10. Valores de referência para os níveis séricos de elementos traço...53
5.11. Processamento e análise de dados...53
6. Resultados...55
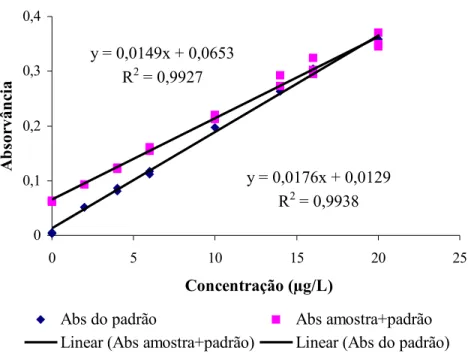
6.1.1.Linearidade da faixa de trabalho...56
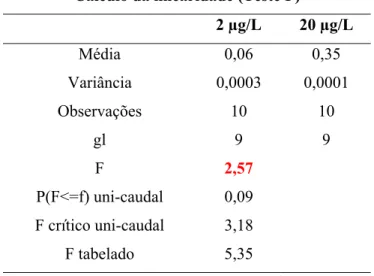
6.1.2.Seletividade e exatidão...57
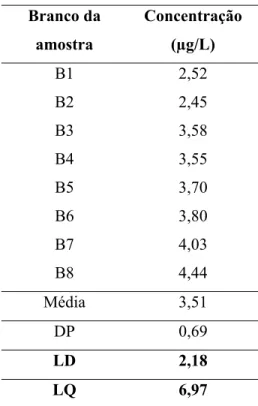
6.1.3. Limite de detecção e limite de quantificação...59
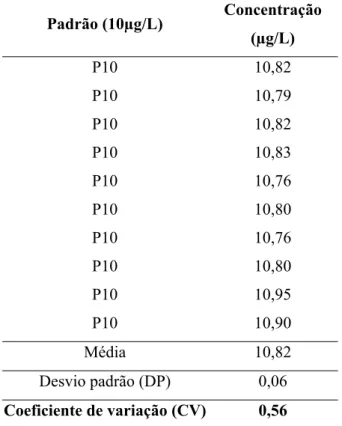
6.1.4. Repetitividade...60
6.2. Estimativa da exatidão do método para a determinação de cobre, ferro e zinco séricos por espectrometria de emissão por plasma indutivamente acoplado...60
6.3. Análise descritiva dos indivíduos em relação ao TM...63
6.4. Análise descritiva dos níveis séricos dos elementos traço...64
6.5. Análise descritiva dos níveis séricos dos elementos traço por gênero, idade e IMC...67
6.6. Relação da contagem de hemácias e os níveis séricos de hemoglobina com os níveis séricos dos elementos traço. ...69
6.7. Relação da contagem de leucócitos e do percentual de linfócitos e monócitos com os níveis séricos de elementos traço...70
6.8. Relação entre o TM e os níveis séricos de cobre, ferro, selênio e zinco...71
7. Discussão...76
7.1. Limitações do estudo...83
8. Conclusões...86
9. Anexos...88
10. Referências Bibliográficas...97
LISTA DE ABREVIATURAS E SIGLAS
Ca Cálcio
Cd Cádmio
CMSP Células mononucleares do sangue periférico
Cu Cobre
DP Desvio padrão
Fe Ferro
FI-HGAAS Espectrometria de absorção atômica por gerador de hidretos acoplado ao sistema de injeção de fluxos
ICP OES Espectrometria de emissão por plasma indutivamente acoplado IgG Imunoglobulina G
IL Interleucina
INF-γ Interferon gama
LTA Leishamaniose tegumentar americana LV Leishmaniose visceral
Mg Magnésio
Ni Níquel
NO Óxido nítrico
Se Selênio
TM Teste de Montenegro TNF-α Fator de necrose tumoral alfa TLR Toll like receptor
Zn Zinco
A leishmaniose tegumentar americana (LTA) é uma doença crônica causada por espécies do gênero Leishmania e altamente prevalente em regiões tropicais e subtropicais do mundo. No Brasil, é considerada altamente endêmica, com uma incidência de 40.000 casos em 2002 (Desjeux, 2004). Uma vacina composta por promastigotas mortas de Leishmania (Leishmania) amazonensis foi desenvolvida por Mayrink e colaboradores e é, atualmente, uma das possibilidades que se tem para a prevenção da LTA. No entanto esta tem apresentado uma baixa imunogenicidade quando avaliada pelo Teste de Montenegro (TM), com aproximadamente 20 a 30% de não conversão do TM em indivíduos após vacinação.
Vários fatores poderiam estar relacionados a esta baixa conversão do TM. Dentre estes, fatores nutricionais como os elementos traço (cobre, ferro, selênio e zinco) apresentam uma relação com a resposta imunológica, tanto pela necessidade destes para a proliferação e maturação das células do sistema imune, quanto da mudança de seus níveis séricos em processos inflamatórios e infecciosos.
Diante destes dados e da não existência de estudos sobre a influência desses elementos traço na resposta imunológica humana induzida pela vacina anti-LTA, o objetivo deste estudo foi avaliar a relação entre fatores nutricionais e a resposta ao TM em indivíduos vacinados anti-LTA.
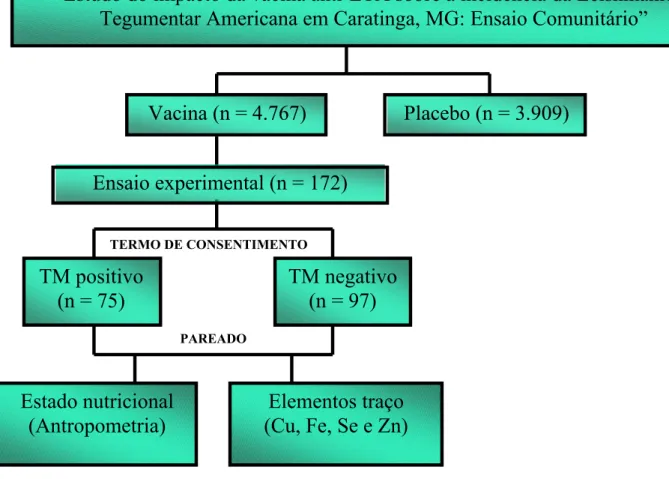
O estudo foi realizado em uma subamostra (n = 172) de um ensaio comunitário para avaliação da eficácia da vacina anti-LTA, na microrregião de Caratinga, Minas Gerais. Dois grupos foram selecionados para participarem deste ensaio experimental mascarado, a partir da resposta ao TM, definido por uma enduração maior ou igual a 5 mm, 48 horas após sua aplicação. Um grupo foi composto por indivíduos que apresentaram TM negativo (n = 97) e outro por indivíduos que apresentaram TM positivo (n = 75). De todos os participantes foram obtidos dados antropométricos e amostras sanguínea.
classe ISO 7 em capelas e módulos de fluxo laminar ISO 5, utilizando-se métodos validados.
A partir dos dados laboratoriais os indivíduos foram divididos em grupos com níveis séricos baixos (G0), normais (GI) e elevados (GII) de cobre, ferro, selênio e zinco de acordo com seus valores de referência. Para fins de análise estatística o diâmetro do TM foi categorizado em negativo e o grupo do TM positivo foi subdividido em 5 a 8 mm; 8,1 a 9 mm; 9,1 a 12 mm e > 12,0 mm.
O diâmetro do TM apresentou valores médios de 10,347 ± 4,64 mm (média ± DP) entre os indivíduos TM positivos. Os níveis séricos médios e o desvio padrão observados foram de 1.433,7 ± 665,7 µg/L para o cobre, 1.431,6 ± 791,5 µg/ L para o ferro, 88,6 ± 39,0 µg/ L para o selênio e 999,2 ± 366 µg/ L para o zinco.
O log do diâmetro do TM foi significativamente maior (p=0,021) no GII (0,66 ± 0,53) para o selênio quando comparado ao GI (0,38 ± 0,51) e significativamente menor (p=0,033) para o GII do zinco (0,23 ± 0,43) em relação ao GI (0,48 ± 0,53). Já para o cobre e o ferro não foi observada diferença significativa do diâmetro do TM entre GI e GII. Quanto a avaliação dos níveis séricos dos elementos traços por quartis do diâmetro do TM somente o selênio apresentou uma relação significativa (p=0,019), com um aumento dos níveis séricos de selênio do terceiro ao quinto quartil.
Níveis séricos elevados de zinco estão relacionados a uma baixa resposta a vacina anti-LTA, avaliada pelo Teste de Montenegro, ao contrário de cobre e ferro que não apresentaram associação com a resposta ao TM entre os indivíduos vacinados anti-LTA. Níveis séricos elevados de selênio estão associados a um maior diâmetro do TM, evidenciando uma melhor resposta imune celular induzida pela vacina anti-LTA.
American cutaneous leishmaniasis (ACL) is caused by several Leishmania species. It is more prevalent in tropical and subtropical regions of the world. This disease is highly endemic in Brazil, where it is considered an important health problem and where around 40,000 cases have been reported in 2002 alone (Desjeux, 2004). The development of a safe and effective vaccine still remains the most promising approach to prevent ACL (Desjeux, 1996; Kedzierski et al., 2006).
Mayrink and collaborators developed and evaluated ACL vaccine candidates composed by killed promastigotes of Leishmania (Leishmania) amazonensis (Marzochi et al., 1998, De Luca et al., 2001; Mayrink et al., 2002; Armijos et al., 2004; Vélez et al., 2005). The main problem observed in the most recent studies using the vaccine was its low immunogenicity. Particularly, it was observed that after vaccination of volunteers, 30% of subjects showed no sign of protection when using the Montenegro skin test (MST) as immunological marker (i.e. their MST response was negative).
Trace elements, such as copper, iron, selenium and zinc, can influence the innate and adaptive immunity; by modifying these immune cells activities (natural killer, macrophages, neutrophils and lymphocytes) and cytokines production (Erickson et al., 2000; Mocchegiani et al., 2000). Several studies have recently shown that the levels of these trace elements can change with the different clinical presentations of ACL and the others infectious process (Faryadi et al., 2003; Koçygit et al., 1998; Koçygit et al., 1999; Van Weyenbergh et al., 2004). But there are no data on the influence of the trace elements in the immune response induced by vaccination against ACL.
Thus, the aim of this study presented here was to investigate the association of those trace elements and the immune response induced by vaccination against ACL, and whether this could explain the varying degree of responsiveness observed in some of the ACL vaccine trials.
The trace elements were determinate by inductively coupled plasma atomic emission spectrometry (ICP-OES) (i.e. copper, iron and zinc) or by flux injection coupled hydride generation atomic absorption spectrometry (FIAS MHS) (i.e. selenium). All assays were performed in the metallic trace laboratory of CETEC, in two clean area ISO 7 and laminar airflow ISO 5 class cabinets using validated methods.
The groups were composed by low (G0), normal (GI) and high (GII) serum levels of each trace element according to reference values. For statistical analysis purposes the subjects with a positive MST were classified into four groups, corresponding to the four quartiles of the observed diameter size distribution of positive MST respondents (i.e. 5 to 8 mm; 8.1 to 9 mm; 9.1 to 12 mm; > 12 mm).
Among the subjects that had a positive MST response, the mean diameter was 10.35 ± 4.64 mm (mean ± SD). For all tested subjects the mean serum levels of copper, iron, selenium and zinc were 1433.7 ± 665.7 µg/L (mean ± SD; n = 171), 1431.6 ± 791.5 µg/ L (mean ± SD; n = 144), 88.6 ± 39.0 µg/L (mean ± SD; n = 157) and 999.2 ± 365.7 µg/L (mean ± SD; n = 171), respectively.
The logarithm (log) MST diameter was significantly higher for subjects in GII (0.66 ± 0.53 mm) than G0/I (0.38 ± 0.51 mm) to selenium (p = 0.021). To zinc, the log MST diameter was significantly lower for subjects in GII (0.23 ± 0.43 mm) than in G0/I (0.48 ± 0.53 mm) (p = 0.033). No significant difference in log MST diameter was observed in copper and iron levels between GII and G0/I subject groups. The selenium levels also differed with the quartiles of the MST diameters of individuals testing positive (p = 0.019), with a tendency of increasing selenium serum levels associated with increasing MST diameter.
Serum levels of zinc are associated to lower response induced by vaccine against ACL, available by MST. But the serum levels of selenium was associated an improvement of cellular response induced by vaccine against ACL.
A Leishmaniose tegumentar americana (LTA) é uma doença infecciosa causada por protozoários do gênero Leishmania, apresenta evolução crônica e manifestações clínicas multifacetadas o que a torna importante quanto à morbidade. Seu caráter zoonótico e sua ampla distribuição no Novo mundo, com grande diversidade ecoepidemiológica, dificulta a implementação de um conjunto de medidas comuns para seu controle, tornando-a um sério problema de saúde pública. Além disso, o tratamento com antimoniais e outros quimioterápicos apresenta vários efeitos colaterais, alto custo, longa duração, contra-indicação a indivíduos com doenças cardíacas, renais e hepáticas, a idosos, gestantes e ainda estão sendo relatados casos de resistência à estas drogas. Diante disso, uma vacina segura, efetiva e barata seria a medida mais adequada para a prevenção da leishmaniose tegumentar humana, representando um avanço significativo em saúde pública.
Salles Gomes (1939) e Pessoa & Pestana (1940) realizaram as primeiras avaliações de uma vacina anti-LTA utilizando extrato de promastigotas mortas como antígenos imunizantes. Posteriormente, Mayrink e colaboradores em uma série de ensaios demonstraram a segurança, imunogenicidade e eficácia, de aproximadamente 50%, de uma vacina anti-LTA, preparada com um pool de cinco cepas de promastigostas inativadas. Mas segundo recomendações da OMS, uma nova composição de vacina foi proposta a partir de uma única cepa (IFLA/BR/67/PH8) de Leishmania amazonensis, por ser a cepa que apresentava maior resposta proliferativa de células mononucleares do sangue periférico (CMSP), da produção de INF-γ e uma taxa de conversão em torno de 70 % do Teste de Montenegro (TM) nos indivíduos vacinados, além de apresentar fácil cultivo em meio de cultura.
sendo definido com Th3 diante da produção de citocinas regulatórias, sendo a principal a TGF-β (Mills, 2004).
A proteção conferida pela vacina anti-LTA, testada em animais, está associada ao desenvolvimento da resposta protetora do tipo Th1, com aumento de proliferação CMSP e produção de INF-γ, além da diminuição de IL-4. Segundo Nascimento et al. (1990) essa resposta proliferativa CMSP apresenta uma correlação de 90% com a positividade do TM. Isto faz deste teste imunológico o mais utilizado para auxílio no diagnóstico e para a seleção de indivíduos aptos a receberem a vacina, além de marcador de imunogenicidade pós-vacinação devido sua facilidade operacional.
Entre os fatores nutricionais, vários autores têm observado uma relação entre a resposta imune e elementos traço (cobre, ferro, selênio e zinco) (Behar et al., 1999; Koçyigit et al., 1999; Erickson et al., 2000; Mocchegiani et al., 2000). Estes elementos atuam participando de diversas etapas da proliferação e maturação de fagócitos, bem como na capacidade citotóxica dos mesmos e na indução da resposta imune do tipo Th1, a mesma induzida pela vacina, capaz de promover proteção ao hospedeiro.
2.1 Leishmaniose Tegumentar Americana e sua epidemiologia
As Leishmanioses são doenças infecciosas, causada por protozoários do gênero Leishmania. Mais de 20 espécies de Leishmania capazes infectar o ser humano já foram descritas e outras espécies estão emergindo, especialmente em associação com HIV/AIDS (Desjeux, 1996). São prevalentes em quatro continentes, mais predominantes em regiões de clima quente e úmido, como áreas tropicais e subtropicais do mundo, sendo considerada endêmica em 88 países, dos quais 21 são do Novo Mundo e 66 do Velho Mundo. Destes países, 16 são desenvolvidos, 72 estão em desenvolvimento e 13 estão entre os menos desenvolvidos (Desjeux, 1996). A estimativa mundial da incidência anual das leishmanioses é de 1,5 – 2,0 milhões de novos casos, com uma população de risco estimada de aproximadamente 350 milhões de pessoas e uma prevalência de 12 milhões de casos.
Dentre as leishmanioses, a leishmaniose tegumentar americana (LTA) apresenta uma ampla distribuição nas Américas, onde é considerada uma zoonose em expansão geográfica, ocorrendo em forma endêmico-epidêmica, podendo apresentar diferentes padrões de transmissão. Ela constitui um dos cinco principais problemas de saúde pública diante de sua magnitude e pouca vulnerabilidade às medidas de controle. No Brasil, sua incidência foi estimada em aproximadamente 60.000 casos novos em 2003, sendo caracterizada como altamente endêmica em muitas partes do país (Desjeux, 2004).
O gênero Leishmania compreende protozoários com um ciclo de vida digenético (heteroxênico), com parte de sua vida em hospedeiro vertebrado e parte em hospedeiro invertebrado (insetos vetores). Cerca de 30 espécies de insetos (vetores) já foram descritas como responsáveis pela transmissão das leishmanioses aos mamíferos, que ocorre durante o repasto sanguíneo das fêmeas infectadas de dípteros pertencentes ao gênero Lutzomya, no Novo Mundo. Quando um flebotomíneo se infecta através da ingestão de macrófagos contendo formas amastigotas (aflageladas), estas se diferenciam em formas promastigotas (flageladas), em meio extracelular na luz do trato digestivo do inseto, e se multiplicam por divisão binária, parte destas formas flageladas sofrem maturação gerando a forma metacíclica, infectante aos vertebrados (Desjeux, 1996; Gontijo & Carvalho, 2003).
Dentre os hospedeiros vertebrados encontramos o homem, reservatórios domésticos (cão e eqüinos) e selváticos (marsupiais, pequenos roedores e desdentados), nos quais os parasitas são encontrados na forma amastigota, arredondada e imóvel, no interior de células do sistema monocítico fagocitário, obrigatoriamente. Por meio de divisão binária as amastigotas vão se multiplicando no vacúolo parasitóforo dos macrófagos, até que estas células sejam rompidas liberando novos parasitas que são fagocitados por novos macrófagos (Gontijo & Carvalho, 2003).
2.1.1 Espécies do gênero Leishmania, vetores e reservatórios
Cerca de 20 espécies de Leishmania foram descritas até o ano de 1993, no Novo Mundo. De acordo com Lainson e Shaw (1987) o gênero Leishmania é subdividido em dois subgêneros: Leishmania e Viannia. No Novo Mundo já foram encontradas 11 espécies do subgênero Leishmania, mas apenas cinco foram observadas parasitando o homem. Parasitas do subgênero Viannia ocorrem apenas no Novo Mundo e das nove espécies já descritas, oito infectam o homem (Shaw, 1994).
A L. (V.) braziliensis é a espécie mais prevalente no homem, podendo causar lesões cutâneas únicas ou múltiplas, além do acometimento mucoso. Apresenta uma ampla distribuição no Brasil, sendo encontrada em todas as zonas endêmicas do país, tanto em áreas de colonização antigas quanto recentes, sendo associada a ambientes rurais e peri-domiciliares (Marzochi & Marzochi, 1994; Gontijo & Carvalho, 2003).
Seus principais vetores são Psychodopigus wellcomei, altamente antropofílico (Marzochi & Marzochi, 1994), Lutzomyia whitmani, Lutzomyia wellcomei, Lutzomyia migonei e Lutzomyia intermedia (Lainson & Shaw, 1987; Marzochi & Marzochi, 1994; Domingos et al., 1998; Ferreira et al., 2001; Alexander et al., 2002; Dias et al., 2007). Sendo este último abundante em áreas endêmicas, como a região Sudeste do Brasil e é antropofílico com boa adaptação domiciliar e peridomiciliar (Aguiar et al., 1987; Rangel et al., 1990; São Tiago & Guida, 1990; Falqueto et al 1991; Marzochi & Marzochi, 1994; Domingos et al., 1998; Ferreira et al., 2001; Dias et al., 2007).
Como reservatórios têm sido descrito o cão (Falqueto et al., 1991; Hermeto et al., 1994; Marzochi & Marzochi, 1994; Reithinger & Davies, 1999), equinos e mulas (Aguilar et al., 1987; Falqueto et al., 1987; Rosa et al., 1988) e roedores domésticos ou sinantrópicos (Vasconcelos et al., 1987), roedores (Akodon arviculoides e Proechimys dimidiatus) no vale do Rio Doce (Dias et al., 1977; Magalhães-Rocha et al., 1987) e em preguiças (Bradypus variegatus) (Pirmez et al., 1997).
identificados como hospedeiros naturais da L. (V.) guyanensis. (Lainson, 1985; Barret & Senra, 1989; Lainson & Shaw, 1998; Guerra et al., 2006).
A L. (L.) amazonensis é responsável por formas cutâneas, mucosa (raramente) e difusa. É encontrada principalmente na região Amazônica, mas também já foi encontrada nos estados da Bahia (Bittencourt et al., 1989; Barral et al 1991), Minas Gerais (Mayrink et al., 1979), Paraná (Silveira et al., 1990), Santa Catarina (Steindel et al., 1997) e Mato Grosso (Lainson & Shaw, 1970). Seus principais vetores são Lutzomya flaviscutellata, Lutzomya reducta, Lutzomya olmeca, estes apresentam hábitos noturnos, vôo baixo e são pouco antropofílicos. E seus hospedeiros naturais são marsupiais e principalmente o roedor P. guyanensis, além de roedores do gênero Oryzomys que, às vezes, apresenta o parasita na pele sem lesões cutâneas (Lainson, 1985).
2.2 Formas clínicas
Duas principais manifestações clínicas da leishmaniose tegumentar americana são encontradas no ser humano - leishmaniose cutânea e leishmaniose mucosa. Estas formas clínicas ocorrem na dependência da relação entre o parasita e o hospedeiro, a partir de fatores inerentes ao parasita (características genéticas e virulência) e ao hospedeiro (fatores nutricionais, estado imunológico, fatores genéticos), além de uma interação destes com o ambiente.
A leishmaniose cutânea pode ser classificada como forma cutânea única ou múltipla, forma cutânea disseminada (lesões muito numerosas em várias partes do corpo) e forma cutânea difusa. A forma cutânea única é caracterizada pelo aparecimento de uma lesão circunscrita com borda elevada, contendo poucas amastigotas, fundo granuloso com ou sem exsudação, geralmente indolor, conhecida popularmente como “Úlcera de Bauru”. É a forma clínica mais comum (90%), de menor gravidade da LTA e apresenta-se em indivíduos com uma efetiva resposta imune celular. A presença mais comum é de lesão única (74%), mas segundo o número de picadas infectantes do vetor é possível o aparecimento de múltiplas lesões (26%) nas partes mais descobertas do corpo, como cabeça, pés, braços e pernas, predominando nas duas últimas (Oliveira-Neto et al., 1988).
formas clínicas é frequente, na fase inicial, o aparecimento de linfangite e/ou adenopatia satélite que poderia preceder as lesões de pele e no cordão linfático é possível sobressair nódulos eritematosos que por vezes também se ulceram (Marzochi, 1992; Barral et al., 1992; Barral et al., 1995). No Brasil, estas formas são causadas principalmente por L. (V.) braziliensis, L. (V.) guyanensis e L. (L.) amazonensis. (Weigle & Saraiva, 1996).
Raramente por disseminação hematogênica ou linfática das amastigotas a doença pode evoluir para uma variante cutânea com pequenas ulcerações múltiplas disseminadas conhecidas como forma cutânea disseminada. Esta forma clínica se agrava em indivíduos portadores da Síndrome da Imunodeficiência Adquirida (SIDA) e infectados com L. (V.) braziliensis. (Coura et al., 1987; Da-Cruz et al., 1992).
A forma cutânea difusa está associada à infecção por L. (L.) amazonensis, é rara e as lesões podem se apresentar como eritematosas, múltiplas, sob a forma de pápulas, tubérculos, nódulos e infiltrações difusas, e, menos freqüentemente, sob a forma tumoral, não se ulceram e aparecem distante do sítio de inoculação se assemelhando a hanseníase virchowiana (Marzochi & Marzochi, 1994). Além disso, esta forma é resistente ao tratamento medicamentoso convencional, caracterizando uma forma grave da LTA.
A forma mucosa é também uma condição de difícil tratamento e de prognóstico reservado quanto à possibilidade de cura. É caracterizada por uma progressiva destruição do tecido mucoso e submucoso, principalmente das cavidades nasal e bucal, seguidas da faringe e laringe, devido a uma exagerada reação de hipersensibilidade celular do tipo tardia, causando lesões desfigurantes, mutilação de face com grande sofrimento à vida. No Novo Mundo o principal agente etiológico é L. (V.) braziliensis, mas mais raramente a L. (V.) panamensis, L. (V.) guyanensis e L. (L.) amazonensis também levam ao desenvolvimento desta forma (Desjeux, 1996; Gontijo & Carvalho, 2003).
2.3 Imunidade
A resposta imunológica do indivíduo é um fator determinante no resultado da infecção por Leishmania. Esta resposta pode ser dividida em resposta imune inata e resposta imune adaptativa, sendo esta mais específica contra o patógeno. O resultado clínico de uma infecção por Leishmania é variável e dependente da relação entre fatores do parasito e do hospedeiro, o que pode ser observado pela manifestação de mais de uma forma clínica causada pela mesma cepa de Leishmania (Rogers et al., 2002).
Quando o indivíduo entra em contato com o parasita, macrófagos/monócitos e células dendríticas atuam fagocitando o parasita (formas promastigotas) e são as principais células apresentadoras de antígeno, capazes de induzir eficientemente a diferenciação e ativação de células T. Além disso, as células dendríticas são importantes na regulação da resposta efetora e na manutenção do mecanismo de memória. Estas células são capazes de distinguir diferentes tipos de patógenos e assim promover um sinal para as células T, via MHC II, a fim de iniciar uma resposta imune apropriada. Campos et al. (2001) sugere que o alvo de ativação das células dendríticas por protozoários, bem como para produtos bacterianos, seja pelo reconhecimento de moléculas do patógeno através de membros da família de receptores como toll-like receptor (TLR). Essa ativação concomitante a produção de IL-12 e outras citocinas aumentam a expressão de moléculas co-estimulatórias e de quimiocinas que promovem a migração de mais células dendríticas ao tecido periférico e aos órgãos linfóides (Scott & Hunter, 2002).
A produção de IL-12 é crítica ao desenvolvimento de uma resposta imune protetora (tipo 1), sendo sua principal fonte as células dendríticas. No entanto, a infecção dos macrófagos por Leishmania prejudica o estímulo a produção de IL-12 por estas células, mas este mecanismo ainda é desconhecido (Carrera et al., 1996; Belkaid et al., 1998; Scott & Hunter, 2002). Outras citocinas como TNF-α e INF-α/β são produzidas pelas células dendríticas ativadas, e assim como IL-12 induzem a produção INF-γ pelas células NK e células T (Awasthi et al., 2004; Hamerman et al., 2005).
TNF-α, IL-6, IL-18 e IL-12 e INF-α/β (INF do tipo 1) atuam sinergicamente com o INF- γ no controle do parasita (Mattner et al., 1996; Rogers et al., 2002; Awasthi et al., 2004).
Estudos em modelos experimentais demonstraram que o controle da infecção por Leishmania é dependente de células T, e que após a apresentação de antígeno a resistência do organismo ao parasito ocorre diante de uma ativação e diferenciação seletiva das células T CD4+ para o tipo 1. Esta resposta é caracterizada pela presença de citocinas, como INF-γ, IL-2, IL-12, IL-18, TNF-α, que induzem a ativação de macrófagos e aumentam a produção de óxido nítrico e intermediários reativos de oxigênio, no interior dos fagócitos, promovendo destruição de parasitas intracelulares (Afonso & Scott, 1993; Ribeiro-de-Jesus et al., 1998; Rogers et al 2002; Awasthi et al., 2004).
Entretanto, quando há uma diferenciação das células T CD4+ para o tipo 2, em animais experimentais, com uma expressiva produção de citocinas como IL-4, IL-5 e IL-6, estas atuam inibindo a ativação de macrógagos e permitindo a multiplicação e desenvolvimento do parasita, além de promoverem produção de anticorpos específicos contra o mesmo tornando estes hospedeirso susceptíveis ao desenvolvimento da leishmaniose (Afonso & Scott, 1993; Riberio-de-Jesus et al., 1998; Rogers et al., 2002).
Citocinas como IL-10, IL-13 e TGF-β atuam na imunomodulação da resposta imune, diminuindo a reposta tipo 1, sendo caracterizada por resposta tipo 3. O grupo celular Th3 é gerado a partir de células T imaturas (Th0) e produzem citocinas que inibem a produção de INF-γ, impedindo danos ao tecido e promovendo um equilíbrio entre as respostas tipos 1 e 2 (Rogers et al., 2002; Mills, 2004).
Ji et al. (2005) avaliando a quantidade de células reguladoras naturais na infecção por L. amazonensis, em camundongos, observaram um rápido acúmulo destas células no sítio de infecção correlacionadas com o aumento da expressão de TGF- β e IL-10, evidenciando o papel destas no controle da resposta tipo 1 e na progressão da doença.
A presença de uma maior proporção de células T já foi observada em pacientes curados quando comparados com a proporção anterior à terapia (Da-Cruz et al., 1994). Nos processos efetores o subsítio de células T CD4+ é crucial para a resistência do indivíduo à infecção por Leishmania. Já as células T CD8+ têm sido encontradas participando dos eventos de memória imunológica, independente da presença do antígeno (Müller, 1992; Huber et al., 1998; Belkaid et al., 2002; Rhee et al., 2002) e isto pode ser uma alternativa para explicar a maior proporção da linhagem destas células entre indivíduos vacinados contra LTA (De Luca et al., 1999).
A forma cutânea da LTA apresenta uma forte resposta imune mediada por células T, caracterizada por uma alta resposta linfoproliferativa e desenvolvimento de uma reação de hipersensibilidade tardia frente aos antígenos de Leishmania, além da produção de INF-γ (Ribeiro-de-Jesus et al., 1998). Entretanto, no início da infecção há uma menor produção de INF-γ e uma maior produção de IL-10, o que permite a sobrevivência e multiplicação do parasita (Almeida et al., 1995; Ribeiro-de-Jesus et al., 1998). Porém, 60 dias em média após o início da infecção uma forte produção de INF-γ nos infectados é observada, com predomínio de uma resposta tipo 1, em pacientes com forma cutânea da LTA (Ribeiro-de-Jesus et al, 1998).
Na forma mucosa uma alta resposta tipo 1 com produção exacerbada de INF-γ e TNF-α estão associados à destruição tecidual, sendo assim responsáverl pela patogênese desta forma de LTA (Ribeiro-de-Jesus et al, 1998).
Já na forma cutâneo-difusa ocorre uma anergia, onde há uma intensa multiplicação do parasita e uma dificuldade no tratamento, evidenciando a influência das células apresentadoras de antígeno, moléculas co-estimulatórias e o ambiente de citocinas presentes no organismo na diferenciação das células T (Convit et al., 1993).
2002), estando diretamente relacionada a ativação de macrófagos, mediante a presença de citocinas (INF-γ e TNF-α), com a produção de óxido nítrico, que leva a destruição dos parasitas intracelulares (Ribeiro-de-Jesus et al, 1998).
Já o agravamento da infecção, ocorre pelo bloqueio da atividade fagocitária pela ação de citocinas como IL-4 e IL-10 que atuam, permitindo a proliferação intracelular das amastigotas (Afonso & Scott, 1993; Launois et al., 1997; Ribeiro-de-Jesus et al, 1998; Kane & Mosser, 2001; Rogers et al., 2002).
2.3.1 Aspectos nutricionais e resposta imune
O conhecimento da relação entre aspectos nutricionais e a resposta imunológica vêm sendo ampliada em diversos estudos e a desnutrição é um fator importante para a morbi-mortalidade de doenças infecciosas e sistêmicas. As primeiras evidências de desnutrição protéico-calórica e o desenvolvimento de LV foram descritas em camundongos (Actor, 1960). Harrison et al. (1986) observaram uma maior freqüência de LV em crianças com desnutrição protéico-calórica quando comparado as eutróficas. Cerf et al. (1987) observaram uma associação entre a desnutrição e a gravidade do calazar, onde crianças com desnutrição moderada a grave apresentavam um risco relativo de desenvolvimento da LV de 8,7 quando comparado a crianças como o estado nutricional normal.
A relação entre a deficiência nutricional e a LTA tem sido pouco estudada. Perez et al.(1979) observaram que camundongos alimentados com dieta pobre em proteínas e vitaminas apresentaram uma maior suscetibilidade à infecção pela L. (L.) mexicana. Weigle et al. (1995) observaram uma maior incidência de leishmaniose cutânea localizada entre crianças equatorianas com anemia ferropriva ou com desnutrição protéico-calórica.
Dentre os fatores nutricionais, os elementos traço têm sido fatores chave para designar uma melhor proteção em animais e humanos contra infecções, sendo os principais relacionados a esta proteção o cobre, ferro, selênio e zinco (Munoz et al., 1995; Percival, 1998; Brock & Mulero, 2000; Erickson et al., 2000; Fraker et al., 2000; Rink & Haase, 2007).
neutrófilos, na imunidade inata e células B e T, na adaptativa. (Erickson et al., 2000; Ibs & Rink, 2003). Estas células requerem uma suplementação adequada de alguns elementos traço para expressão e preservação da estrutura e função de metaloproteínas, essenciais à produção de energia (como ferro nos citocromos a, b e c, NADH e succinato desidrogenase) e proteção das células contra espécies reativas de oxigênio altamente tóxicas (como cobre e zinco na superóxido desmutase, ferro na catalase e o selênio na glutationa peroxidase). Além disso, alguns elementos são componentes estruturais de enzimas requeridas na replicação de DNA e divisão celular e atuam na manutenção de inúmeras enzimas ligadas diretamente ao processo de defesa do organismo (Erickson et al., 2000; Linder, 2001; Rink & Haase, 2007).
Características nutricionais do indivíduo, como níveis séricos de elementos traço, têm um papel relevante no desenvolvimento da resposta imunológica específica ao antígeno de Leishmania, apresentando diferentes perfis séricos nas diferentes formas clínicas da LTA (Faryadi & Mohebali, 2003; Kocygit et al., 1998; Machado-Coelho et al., 2005) e a resposta ao tratamento ou às vacinas (Kocygit et al., 1998).
2.3.1.1 Cobre
O cobre é o 29º elemento da tabela periódica e é distribuído nos sistemas biológicos no estado cúprico (oxidação +2). Em indivíduo adulto saudável cerca de 50 a 120 mg de cobre são distribuídos pelo corpo, apresentando uma concentração sanguínea aproximada de 1000 µg/L. Em geral, ele se encontra no organismo complexado a proteínas, peptídeos, aminoácidos e outras substâncias orgânicas, sendo necessário às atividades estruturais e catalíticas das metaloenzimas que o contém (Linder et al., 2001; Alexandrova et al., 2003). O cobre é um cofator essencial de muitas enzimas que participam nos processos de óxido-redução, como citocromo c oxidase, superóxido desmutase, catecol oxidase, dopamina-b-monoxigenase entre outras. (Tainer et al., 1983; Palumbo et al., 1990; Yoshikawa et al., 1995).
excreção de cobre endógeno ocorre através da bile no interior do trato gastrointestinal (Turnlund et al., 1998). Alguns defeitos metabólicos como Síndrome de Menkes e Doença de Wilson, gravidez e inflamação influenciam no metabolismo do cobre no organismo (Beshgetoor & Hambidge, 1998).
A deficiência de cobre é freqüentemente resultado de uma dieta inadequada, síndromes de má absorção, condições que predispõe uma grande perda do elemento ou que aumentam a sua necessidade, como o crescimento rápido, prematuros com baixo peso e crianças que se alimentam frequentemente com leite enriquecido com altas concentrações de carboidratos refinados, pois a frutose e outros açúcares refinados levam a menor absorção do cobre (Turnlund et al., 1998). Já o aumento das concentrações séricas deste elemento é relatado em resposta ao estresse, inflamação e infecção, na Doença de Parkinson, Diabetes mellitus e em condições envolvendo obstrução do fluxo da bile (Milne, 1994; Beshgetoor & Hambidge, 1998).
Em experimentos com animais deficientes de cobre foi observado um quadro de anemia e diminuição do timo e baço. Em humanos, a neutropenia, sinal clínico da deficiência deste elemento, associado a uma diminuição da capacidade do neutrófilo em produzir ânions superóxido e destruir microorganismos fagocitados foi relatada por alguns autores (Graham & Cordano, 1976; Williams et al., 1983; Kelley et al., 1995; Percival et al., 1998). Mudanças similares são encontradas nos macrófagos (Babu & Failla, 1990). Essa neutropenia se deve a uma menor produção de células pela medula óssea diante da morte das células progenitoras da linhagem de polimorfonucleados, diminuição do tempo de vida dos neutrófilos periféricos circulantes e uma alteração da distribuição de células sanguíneas para os tecidos e órgãos ou alteração nos padrões de maturação da população de leucócitos, como o aumento de mastócitos (Percival et al., 1995). Além disso, Higushi et al, (1991) detectou anticorpos anti-neutrófilos no soro de indivíduos deficientes de cobre, o que pode indicar um mecanismo de perda destas células.
IL-2, alterando o padrão de citocinas da resposta imune. (Koller et al., 1987; Lukasewycz et al., 1990; Hopkins & Failla, 1997).
Em um processo inflamatório uma alteração dos níveis séricos de cobre têm sido relatada por vários autores (Klassing et al., 1987; El- Khoyl et al., 1990; Mastousek et al., 1993; Beshgetoor & Hambidge, 1998; Kocyigit et al., 1998; Faryadi & Mohebali, 2003) e uma relação entre estas mudanças e o aumento da síntese de proteínas de fase aguda (como a ceruloplasmina) vem sendo bem estabelecida como parte de uma estratégia de defesa do organismo induzidas por substâncias, liberadas por macrófagos ativados, como IL-1,
TNF-α e IL-6 (Barber & Cousins, 1988; Klassing et al., 1988). A IL-1 por sua vez induz ao aumento de ceruloplasmina, importante na absorção do cobre, associado a seu aumento sérico durante processos inflamatórios e infecciosos (Klassing et al., 1987, 1988), como observado na leishmaniose cutânea causada por L. major (Faryadi & Mohebali, 2003; Kocyigit et al., 1998). Este aumento de cobre sérico também foi observado na LTA (formas cutânea e mucosa) e na leishmaniose visceral (LV) por Van Weyenbergh et al. (2004) ao avaliarem indivíduos com LTA e LV, no Brasil. Porém após tratamento convencional os níveis séricos de cobre voltaram a níveis semelhantes aos de indivíduos saudáveis (Kocyigit et al., 1998; Van Weyenbergh et al., 2004).
2.3.1.2 Ferro
O ferro é o metal mais abundante no corpo humano, com uma concentração aproximada de 30 a 40 mg/Kg em um adulto saudável, variando em função da idade e do sexo (Bothwell et al., 1979). Cerca de 2/3 do ferro corporal está associada à hemoglobina nos eritrócitos, o restante permanece em estoque na forma de ferritina e hemossiderina e menos de 0,1% se encontra ligado a transferrina no plasma (Bricks et al., 1994). O fígado é o principal órgão de estoque de ferro, contendo cerca de 60% de ferritina, que é diariamente utilizada quando há necessidade de suprir demanda das células mediante uma ingestão insuficiente deste elemento.
lactentes, crianças e mulheres em idade fértil (Damsdaran et al., 1979; Dallman et al., 1986; Bricks, 1994; Handler et al., 2002).
Os dados da literatura são conflitantes em relação à associação dos processos infecciosos com as deficiências nutricionais de ferro. A carência de ferro aumenta a susceptibilidade às infecções por prejudicar o sistema imunológico do hospedeiro. No entanto, o excesso de ferro no organismo promove a formação intracelular de radicais livres, gerando um dano oxidativo nas células (Cardier et al., 1995) e favorece o crescimento intracelular e multiplicação de patógenos, por reduzir a produção de citocinas importantes a ativação celular e inibir a ação de fagócitos, neste caso sua deficiência tem até um valor protetor contra infecções (Bricks et al., 1994, Mencacci et al., 1997).
Como este elemento é essencial ao organismo e ao mesmo tempo apresenta uma toxicidade potencial às células, faz-se necessário um esquema regulatório sofisticado e complexo, a fim de suprir a demanda das células e impedir um acúmulo deletério. Um suprimento adequado de ferro é necessário para muitos processos biológicos, como reações de transferência de elétrons, regulação gênica, ligação e transporte de oxigênio, regulação do crescimento e diferenciação celular. Sua homeostase envolve a regulação de absorção, distribuição, estocagem em ferritina, incorporação em proteínas e regulação da liberação de ferro dos transportadores para outras células ou órgãos (Beard, 2001).
alterações são corrigidas com a reposição deste elemento (Spear & Sherman, 1992; Kuvibidila et al., 1999; Cunningham-Rundles et al., 2000;).
Como a síntese de DNA requer uma enzima ferro dependente, ribonucleotídeo redutase, a multiplicação de células pode ser limitada diante da deficiência deste elemento. E o controle e diferenciação das células são influenciados pela biodisponibilidade do ferro e seu transporte para o interior das mesmas, via receptor de transferrina, sendo este um possível mecanismo que explica um dos efeitos da deficiência de ferro no sistema imune (Beard et al., 2001).
Citocinas como IL-1, TNF-α e INF-γ influenciam o movimento do ferro no organismo, reduzindo seu pool intracelular disponível por diminuir o receptor de transferrina na superfície da célula, aumentando os estoques de ferritina e ativando os sistemas de síntese de óxido nítrico levando a um diminuição sérica do ferro e um aumento da resposta tipo 1 (Sussman et al., 1974; Murray et al., 1978; Damsdaran et al., 1979; Kochanowski & Sherman, 1985; Ike et al., 1992; Hallquist et al., 1992; Fishbane et al., 1999, Brock & Mulero, 2000).
A imunidade humoral parece ser menos afetada pela deficiência de ferro que a imunidade celular. Em indivíduos com carência de ferro a produção de anticorpos em resposta a imunização, com vários antígenos, é preservada. (Hallquist et al., 1992; Spear & Sherman, 1992).
Durante os processos inflamatórios e infecciosos, como na LTA, os níveis séricos de ferro encontram-se diminuídos quando comparados a um grupo de indivíduos saudáveis (Kocyigit et al., 1998; Faryadi & Mohebali, 2003). Como muitos patógenos (fungos, bactérias e protozoários) necessitam do ferro para replicação e desenvolvimento, proposto por alguns autores uma estratégia de defesa do organismo seria uma redistribuição deste elemento, tornando-o indisponível aos parasitas. Estas mudanças são induzidas por citocinas como IL-1, TNF-α e IL-6 liberadas dose-dependente por macrófagos ativados (Klassing et al., 1988; Brock & Mulero, 1994; Kocyigit et al., 1998).
Este mecanismo foi evidenciado em pacientes com tuberculose (Schaible & Kaufmann, 2002), candidíase (Tanida et al., 2001; Ueta et al., 2001), cólera e infectados com algumas enterobactérias (Yamaushi et al., 1993; Walker & Walker, 2000), sugerindo um provável mecanismo para tornar o ferro indisponível à utilização de microorganismos invasores podendo explicar assim os casos de anemia em infecções crônicas.
Em experimentos com camundongos, Bisti et al (2000) observou que o excesso de ferro também modula a infecção por L. major, resultando em uma menor multiplicação do parasita, com uma redução de IL-4, IL-6 e IL-10 e aumento de INF-γ e expressão de óxido nítrico sintetase (iNOS). O contrário foi observado em pacientes com excesso de ferro, medido pela saturação de transferrina, altos níveis de citocinas antiinflamatórias como IL-4, IL-6 e IL-10, além de um bloqueio na expressão de iNOS (Weiss, 1999), sugerindo que a susceptibilidade a infecções promovida pelo excesso dos níveis sérios deste elemento se deve, não somente a sua disponibilidade aos patógenos favorecendo seu crescimento, como também a uma alteração na imunidade inata e adquirida.
Pedrosa et al., (1990a) avaliando os efeitos da suplementação e deficiência de ferro na evolução da Doença de Chagas em camundongos, observaram resultados discordantes em relação as cepas de Trypanosoma cruzi. A deficiência de ferro foi correlacionada a baixa parasitemia e baixa mortalidade de camundogos infectados com a cepa YuYu, mas apresentou-se maléfica quando camundongos eram infectados com a cepa CL e Y. Os autores sugerem que estas diferenças podem ser consideradas a variadas expressões intraespecíficas entre as cepas. Porém a suplementação de ferro foi correlacionada a alta parasitemia e mortalidade dos camundongos infectados pelas cepas Y, CL e YuYu.
2.3.1.3 Selênio
O nível de selênio nos produtos agrícolas varia proporcionalmente ao teor do elemento no solo onde são cultivados e são refletidos nos níveis séricos deste elemento na população, como demonstrado em alguns estudos nas regiões da Finlândia, Nova Zelândia, costa leste dos EUA e China (Thomson et al., 1996; Burk et al., 1999). Um estudo ecológico desenvolvido em quatro províncias do Iran, com baixos níveis de selênio no solo, demonstrou a relação de maior ocorrência de câncer gástrico na província onde a população apresentou menores valores de selênio sérico entre a população, com uma correlação de 76% (Nouraie et al., 2004).
Os alimentos contêm formas orgânicas de selênio como a selenometionina e a selenocisteína, mas muitos experimentos que utilizam suplementação têm usado formas inorgânicas como selenito, embora as orgânicas sejam melhor biodisponibilizadas no organismo. Entretanto o selenito reage rapidamente com a glutationa peroxidase presente nos eritrócitos para formar as selenoglutationas, ou seja, ativando a enzima que possui atividades anticarcinogênicas e induz a apoptose de células tumorais humanas (Mckenzie et al., 1998).
Estudos realizados em Linxian, China, onde os níveis de selênio são baixos no solo e nos alimentos, observou-se uma correlação entre altos níveis de carcinomas no esôfago e no estômago em indivíduos com baixa concentração sérica deste elemento (Blot et al., 1985; Li et al., 1993), mas com o uso de suplementação de selênio foi observado uma redução do risco de um desenvolvimento destes tipos de cânceres (Mark et al., 2000). Com base em resultados de estudos animais e boas correlações encontradas em avaliações nas populações humanas, o selênio tem demonstrado exercer um efeito anticarcinogênico, através de alguns mecanismos (Fleming et al., 2001). Sua ação antioxidante é responsável pela redução dos danos no DNA pelos radicais livres e modulação de enzimas que atuam na degradação de xenobióticos envolvidos no metabolismo carcinogênico, reduzindo o impacto de substâncias carcinógenas exógenas provenientes da dieta e prevenindo a degeneração do tecido e a ocorrência de doenças cardiovasculares.
prejudica a síntese de prostaciclina e promove um aumento de tromboxana, que leva a uma maior agregação plaquetária nas doenças cardiovasculares (Mckenzie et al., 1998).
Um grande avanço no entendimento do papel do selênio no organismo humano aconteceu com a descoberta de selenoenzimas responsáveis pela conversão periférica da tiroxina (T4) para sua forma ativa 3,3’,5-triiodotironina (T3), a iodotironina deiodinase, tipos I, II e III. Além disto, a glutationa peroxidase é altamente expressa nas células foliculares da tireóide. Estas selenoenzimas são capazes de modular muitos aspectos do metabolismo do hormônio da tireóide como iodinação da tireoglobulina na glândula tireóide, síntese periférica de T3 a partir de T4, degradação de T4, inativação de T3 e regulação da atividade da tireóide via eixo hipotálamo-pituitária (Hawkes & Keim, 2003).
Imunologicamente a habilidade das selenoproteínas, junto com a vitamina E, em proteger o hospedeiro do estresse oxidativo, durante processos inflamatórios, é de vital importância, sendo uma das formas do hospedeiro para minimizar os danos celulares que a geração de radicais livres no interior de neutrófilos e macrófagos ativados pode causar. A regulação da expressão de receptor IL-2 de alta afinidade nas células T, proliferação e citotoxicidade destas células são algumas das funções do selênio no sistema imune, e como estas células são componentes chave na ativação de células B para síntese de anticorpos, isto pode explicar o efeito estimulatório deste elemento na produção de anticorpos (Roy et al., 1994; Mackenzie et al., 1998). E de fato uma diminuição da imunidade celular relativa à idade pode ser parcialmente revertida com suplementação de selênio aumentando a resposta para IL-2 (Roy et al., 1994). Experimentos com suplementação de selênio demonstram um aumento da atividade de células NK, macrófagos e células T citotóxicas, em camundongos e humanos (Mckenzie et al., 1998).
dos intermediários reativos do oxigênio, produzidos na degradação do peróxido de hidrogênio no interior dos fagócitos, durante o estresse oxidativo, aumentando o estresse oxidativo e levando a morte de parasitas intracelulares. Além disso, sua deficiência “in vitro” limita o crescimento de microorganismos como Salmonella typhimurium (Boyne et al., 1984), P. bergueii e L. monocytogenes (Murray et al., 1985).
2.3.1.4 Zinco
O zinco é um elemento traço relevante ao funcionamento do organismo humano, uma vez que ele é cofator de mais de 300 enzimas, atuando como componente catalítico ou como constituinte estrutural, além de sua função antioxidante neutralizando os radicais livres (Coleman et al., 1992; Rink & Gabriel, 2000). Todd et al. (1934) foi o primeiro a apresentar a necessidade do zinco para o crescimento e desenvolvimento de camundongos. Aproximadamente 30 anos depois, Prasad et al. (1963) descreveu a síndrome da deficiência de zinco em crianças da Pérsia que praticavam geofagia e se caracterizava por anemia, hipogonadismo, hepatoesplenomegalia, alterações na pele e no crescimento e retardo mental.
O total de zinco em um organismo humano saudável varia entre 2 a 4 g; este é predominantemente ligado a albumina (60%), α2-macroglobulina (30%) e transferrina (10%) (Scott & Bradwell, 1983). Sua biodisponibilidade é dependente da composição da dieta. Alimentos ricos em fitato e fosfatos quelam o zinco, diminuindo sua absorção, assim como dietas ricas em cátions bivalentes, como Cu, Mg, Cd, Ca, Ni e Fe. Durante períodos de gravidez, amamentação e crescimento há um maior requerimento deste elemento, uma vez que ele é necessário à proliferação das células (Ziegler et al., 1989) sendo fundamental ao desenvolvimento e manutenção dos sistemas com alta proliferação celular como a pele, sistema imune e reprodutor (Chandra et al., 1984; Rink & Gabriel, 2000).
apoptose, dentre eles a inibição da caspase-3 pelo zinco, indução da síntese de DNA e antagonismo de cálcio inibindo a endonuclease Ca2+/Mg2+ (Maret et al., 1999; Rink & Gabriel, 2000).
Na imunidade inata a quantidade dos neutrófilos, células NK e macrófagos encontram-se diminuídos na deficiência de zinco, bem como o recrutamento, a capacidade fagocítica e citotóxica destas células (Allen et al., 1983; Keen et al., 1990; Prasad et al., 2000). As células NK ainda requerem o zinco para interação entre p58, um receptor inibitório das células NK, e de moléculas do complexo de histocompatibilidade maior classe I (MHC I) nas células T alvo, resultando na inibição da atividade de morte pelas células NK (Rajagopalan et al., 1995). Aliado a esta alteração das funções das células NK e células T, a capacidade fagocítica de células mononucleares é reduzida na infecção por Trypanosoma cruzi, observado em indivíduos com estados deficientes de zinco (Wirth et al., 1989; Cook-Mills et al., 1990).
As evidências iniciais relativas ao papel essencial do zinco na imunidade relacionavam-o ao desenvolvimento de células T, visto que sua deficiência leva a uma atrofia tímica, por ser cofator da timulina, hormônio secretado pelas células epiteliais do timo que induz a diferenciação de células T imaturas. Este elemento também modula secreção de citocinas por células mononucleares do sangue periférico e induz proliferação de células T CD8+ em combinação com IL-2 (Coto et al., 1992), anergia, redução da resposta linfoproliferativa a mitógenos. Estas mudanças são reversíveis após suplementação de zinco (Fraker et al., 1995; Mocchegiani et al., 1995). Na produção de citocinas este elemento traço está relacionado à manutenção do equilíbrio entre as células T “helper” (Th1 e Th2), induzindo a produção de IL -1, IL-6, TNF-α e INF-γ, além de aumentar a expressão de receptores de alta afinidade para IL-2 nas células mononucleares do sangue periférico (Salas & Kirchner, 1987; Rink & Gabriel, 2000).
(40.000µg/L) de suplemento de zinco foram administradas a pacientes foi observada uma diminuição das funções imunológicas, como por exemplo, a redução da reação de hipersensibilidade tardia (Chandra et al., 1984; Patterson et al., 1985; Provinciali et al., 1998; Reinhold et al., 1999; Rink & Gabriel, 2000). Este efeito inibitório do excesso de zinco tem se tornado uma nova ferramenta para o uso na terapia imunossupressora de baixa toxicidade, onde uma supressão seletiva das funções linfocitárias é desejável, como no tratamento da artrite reumatóide e transplante de órgãos (Rink & Gabriel, 2000).
Os níveis séricos de zinco avaliados entre indivíduos com leishmaniose cutânea (LC) aguda e crônica, comparados aos de indivíduos saudáveis, estavam significativamente diminuídos (Faryadi & Mohebali, 2003). Resultados semelhantes foram encontrados por Van Weyenbergh et al., (2004) em um estudo realizado no Brasil, entre indivíduos com as formas cutânea e mucosa da LTA. Estes autores também observaram níveis deficientes deste elemento entre os indivíduos com LV. Entretanto, após três meses do tratamento com antimonial houve um retorno dos níveis séricos de zinco a níveis semelhantes aos do grupo controle. Semelhantemente a este estudo, Kocyigit et al. (1998) observaram uma hipozincemia entre os indivíduos infectados com L. major, que também era revertida após o tratamento convencional com antimonial.
Vários autores sugerem que esta hipozincemia encontrada entre indivíduos infectados por Leishmania ou com qualquer outro processo inflamatório, seja resultado de uma redistribuição sérica do elemento no organismo, assim como no caso do cobre e ferro, induzido principalmente por citocinas como IL-1, IL-6 e glicocorticóides, ativando a síntese hepática de metalotioneína, sob controle da proteína kinase C. Este aumento da metalotioneína, capaz de se ligar ao zinco sérico retirando-o da circulação, é sugerido, por alguns autores, como mecanismo responsável pela hipozincemia observada durante processos infecciosos (Rofe et al., 1996; Mocchegiani et al., 1998).
2.4 Diagnóstico da LTA
2.4.1 Diagnóstico clínico e epidemiológico
circunscritas com borda elevada, fundo granuloso com ou sem exsudação, geralmente indolores. Podem se apresentar na forma localizada (única ou múltipla) ou numerosas lesões em várias partes do corpo (forma disseminada) (Pearson & Souza, 1996; Gontijo & Carvalho, 2003).
Em um exame clínico de forma cutânea crônica, a mucosa deve sempre ser avaliada bem como a história pregressa da lesão cutânea, uma vez que a forma mucosa geralmente é secundária a cutânea e pode aparecer meses ou anos após a resolução das lesões de pele. As áreas mais atingidas são as cavidades nasais, seguidas da faringe, laringe e cavidade oral. É possível observar no exame clínico das mucosas atingidas infiltração, ulceração, perfuração do septo nasal, e lesões ulcero destrutivas na mucosa oronasal (Gontijo & Carvalho, 2003).
Na anamnese, devem ser considerados, ainda, os dados epidemiológicos, como a existência de casos de LTA na região, procedência de área endêmica (viagem de lazer ou trabalho, residência anterior), referência de cães ou eqüinos com lesões e residindo nas proximidades ou inserção em áreas florestais (Rodriguez et al., 1988; Gontijo & Carvalho, 2003).
2.4.2 Diagnóstico parasitológico
O exame parasitológico consiste na utilização de exames diretos (escarificação, punção aspirativa e biópsia com impressão por aposição ou histopatologia) ou indiretos (cultivo e inoculação em animais de laboratório) que evidenciem a presença do parasita (Marzochi & Marzochi, 1994; Gontijo & Carvalho, 2003).
Na histopatologia o material retirado por biópsia deve ser fixado em formol a 10%, e os parasitas, quando presentes, são encontrados em vacúolos intracitoplasmáticos dos macrófagos ou nos espaços intercelulares, geralmente isolados. O diagnóstico de certeza pela histopatologia somente é dado quando se identifica o parasita nos tecidos (Medeiros et al., 2002).
2.4.3 Diagnóstico imunológico
O Teste de Montenegro (TM) é baseado na reação de hipersensibilidade tardia, onde há aplicação intradérmica do antígeno de Leishmania padronizado, na porção anterior do antebraço. A formação de uma enduração no local da aplicação após 48 a 72 indica produção de uma resposta celular contra o antígeno em questão (Melo et al., 1977; da Costa et al., 1996).
O TM é um teste auxiliar no diagnóstico da LTA e possui uma sensibilidade variando de 86 a 100% e uma especificidade de aproximadamente 100% em área endêmica, o que a consagrou como uma das provas mais utilizadas na confimação da LTA ativa (Furtado, 1980; Guedes et al., 1990; Silveira et al., 1999). Um resultado positivo evidencia presença de LTA ou exposição prévia ao parasito com ou sem aquisição da doença, mantendo-se positivo mesmo após cicatrização de lesão cutânea tratada ou curada espontaneamente (Salman et al., 1999). Em caso de lesões mucosas a reação do TM é tão intensa que pode levar até a ulceração e necrose local. Já na forma cutâneo-difusa, leishmaniose visceral, pacientes imunodeprimidos ou indivíduos nos primeiros 30 dias após início da lesão cutânea o TM pode apresentar-se negativo (Melo et al., 1977; da Costa et al., 1996). A negatividade do TM tem sido utilizada como critério de inclusão de indivíduos em estudos de caracterização da resposta imune e avaliação da eficácia da imunização após utilização de vacinas contra leishmaniose (Antunes et al., 1986; Armijos et al., 1998; Marzochi et al., 1998; Mayrink et al., 1979; Nascimento et al., 1990), principalmente por possuir uma ótima correlação com a proliferação de células mononucleares do sangue periférico (Nascimento et al., 1990).
de LTA, no entanto é útil como critério adicional no diagnóstico quando há lesões extensas e múltiplas e em casos de lesões mucosas. Além do diagnóstico diferencial com outras doenças, especialmente quando não há demonstração do parasita.
2.4.4 Diagnóstico molecular
A Polymerase chain reaction (PCR) vem sendo desenvolvida e utilizada desde a década de 90, A reação é baseada na detecção de DNA ou RNA de Leishmania em amostras clínicas humanas e de outros animais suspeitos de apresentarem infecção (Rodgers et al., 1990; Pirmez et al., 1999; Marques et al., 2001; Weigle et al., 2002). Mas sua utilização deve considerar o contexto clínico e epidemiológico da doença (Harris et al., 1998).
2.5 Tratamento
Apesar do uso medicinal de compostos de antimônio já ser conhecido desde a Antigüidade, séculos antes da era cristã, para diversos fins terapêuticos, somente em 1912, Gaspar de Oliveira Vianna observou que o tártaro emético era eficaz na terapêutica da LTA (Vianna, 1912). Porém diante da intolerância, toxicidade e graves efeitos colaterais indesejáveis estes antimoniais trivalentes foram substituídos por antimoniais pentavalentes (Rath et al., 2003).
Atualmente o arsenal terapêutico contra a LTA é restrito e possui severas limitações diante dos efeitos colaterais. Mas o tratamento convencional preconizado pela OMS se baseia na utilização de antimoniais pentavalentes, existentes sob duas formas: o antimonial N-metil glucamina e o stibogluconato de sódio, não sendo o último distribuído no Brasil (Gontijo & Carvalho, 2003).
O Ministério da Saúde preconiza o antimonial pentavalente como droga de primeira escolha no tratamento da LTA, com variação de dose entre 10 a 20 mg Sb/Kg/dia via IM tanto para adulto ou criança por 20 dias consecutivos para as formas cutânea localizada, disseminada e difusa. Para a forma mucosa uma dose de 20 mg Sbv/Kg/dia via IM por 30 dias, com repetição do esquema terapeutico até completa cicatrização (Gontijo & Carvalho, 2003). Na ausência de resposta ao tratamento convencional a utilização de drogas de segunda escolha é recomendada (Gontijo & Carvalho, 2003).
Os antimonais pentavalentes possuem mecanismo de ação ainda desconhecido e são contra-indicados a gestantes e indivíduos portadores de doenças crônicas (cardiopatias, nefropatias, hepatopatias, Doença de Chagas) e nos casos de indivíduos com tuberculose, malária e alergias. Além disso apresentam vários efeitos colaterais graves (Berman, 1997) e resistência a estes tem sido reportada (Olliario & Bryceson, 1993).
As drogas de segunda escolha podem ser administradas quando não se obtém resposta ao tratamento com antimonial ou na impossibilidade de seu uso. A Anfotericina B, um antibiótico poliênico de reconhecida ação leishmanicida, deve ser administrada sob vigilância, em serviços especializados, com paciente hospitalizado. Esta possui alto custo, muitos efeitos colaterais e é contra indicada a gestantes, cardiopatas, nefropatas e hepatopatas (Machado-Pinto et al., 2002). A anfotericina B pode ser incorporada em lipossomas carregadores sendo absorvida pelo sistema reticuloendotelial onde o parasita da leishmania reside, e é assim pouco absorvido pelos rins, o maior órgão alvo para a toxicidade da anfotericina B, mas seu alto custo limita seu uso pelos pacientes (Rath et al., 2003; Amato et al., 2004).
A Pentamidina é outro medicamento com o qual se tem bons resultados, com baixas doses, na infecção por L. (V.) guyanensis, embora tenha as mesmas contra-indicações da Anfotericina B e vários efeitos colaterais como hipoglicemia, hipotensão, alterações cardiológicas e nefrotoxicidade, o que inviabiliza o amplo tratamento de todos os indivíduos afetados pela LTA. Este fármaco também é eficaz para o tratamento e cicatrização das lesões na forma mucosa onde houve falha terapêutica com antimoniais, anfotericina B e cetoconazol (Amato, 1997).
O efeito terapêutico de outros fármacos vêm sendo testados em indivíduos com LTA, como Miltefosina, um agente oral, utilizado no tratamento de câncer, que tem demonstrado eficácia semelhante aos antimoniais frente a L. panamensis, na Colômbia. Na Guatemala, este mesmo fármaco apresentou aproximadamente 50% de eficácia no tratamento de indivíduos infectados por L. braziliensis e L. mexicana. Embora superior ao placebo sua eficácia é muito inferior aos antimoniais (Soto & Berman, 2006).