Relação entre a capacidade funcional, variáveis demográficas e
cognitivas de idosos com défice cognitivo e doença de alzheimer
Dissertação de Mestrado em Gerontologia: Atividade Física e Saúde no Idoso
Ana Catarina Freitas Martins
Orientadora: Professora Doutora Maria Paula Gonçalves da Mota
Relação entre a capacidade funcional, variáveis demográficas e
cognitivas de idosos com défice cognitivo e doença de alzheimer
Dissertação de Mestrado em Gerontologia: Atividade Física e Saúde no Idoso
Ana Catarina Freitas Martins Orientadora: Professora Doutora Maria Paula Gonçalves da Mota
Composição do júri:
________________________________________________________________
________________________________________________________________
________________________________________________________________
Mestre em Gerontologia: Atividade Física e Saúde no idoso, pela Universidade de Trás-os-Montes e Alto Douro, sob orientação da Profª. Dra. Maria Paula Gonçalves da Mota.
Aos meus avós: Joaquim e Emília,
Por saber que vos fizestes presentes nestas linhas. Agradeço-vos por todos os momentos e por acreditarem em mim. Iniciaram ao meu lado esta etapa mas hoje mesmo sabendo que vós estarias aqui, se o céu não fosse tão longe, tenho a certeza que vos orgulharás por mais uma caminhada que terminei. A vocês dizer um obrigado do tamanho do mundo não chega.
Sem particularizar, um muito obrigado a todos os que embarcaram comigo e que contribuíram para a realização desta dissertação, seja com palavras, ações ou ajudas.
Um obrigado muito especial à minha orientadora, professora Doutora Paula Mota, pela competência científica evidenciada e pela sua disponibilidade. As suas sugestões, opiniões e conselhos foram muito importantes para a minha evolução assim como as críticas construtivas e todas as correções foram essenciais para a concretização desta dissertação.
Um grande obrigado à instituição CISDEC por ceder o espaço para a concretização das sessões. Agradeço às instituições por terem autorizado a participação dos seus residentes neste projeto de intervenção, com um agradecimento especial aos técnicos que me auxiliaram em todo o tempo que estive e aos participantes que sempre se mostraram disponíveis para colaborar comigo. Sem eles, este trabalho não se teria realizado nestes moldes.
Agradeço igualmente à Associação Alzheimer Guimarães pela prestabilidade logo imediata, permitindo a realização do estudo de caso.
À participante do estudo de caso assim como à sua cuidadora, vocês inspiraram-me! Foi uma honra vos ter conhecido e ter partilhado o meu conhecimento convosco assim como partilharam o vosso comigo.
O meu maior agradecimento é para os meus pais, Rosa e Manuel. Aos meus exemplos de todos os dias e que estão ao meu lado em todos os momentos. Que me ensinam que devemos todos os dias ser um pouco melhores. Estou certa que o vosso esforço e incentivo foi determinante para eu conseguir terminar este Mestrado.
Ao Rui, que me acompanhou desde o início desta etapa, pelo seu incentivo, motivação, companheirismo, horas e horas que despendeu e pelo apoio incondicional, o meu sincero agradecimento.
Aos amigos que me acompanham nesta viagem, e aos que estavam no porto sempre de braços abertos. Em especial às minhas miúdas: Ana, Sílvia e Andreia, a bagagem que acumulamos desde o primeiro ano até agora já é grande, mas a leveza dela fazem-nos pessoas mais completas. Um obrigado gigante a vocês todos.
Com o aumento da esperança média de vida, Portugal destaca-se como um país envelhecido, onde o número de idosos é cada vez mais crescente. As alterações provenientes do envelhecimento poderão afetar o perfil cognitivo do sujeito, que por sua vez poderá desenvolver Défice Cognitivo Ligeiro (DCL) e doença de alzheimer (DA). Deste modo, é pretensão deste estudo investigar quais as variáveis mais suscetíveis a influenciar o DCL assim como alternativas não farmacológicas que facultem mais conhecimento para a promoção da qualidade de vida do sujeito e promovam a independência nas atividades básicas de vida diária (ABDV). Deste modo, esta investigação teve por base 2 estudos. O primeiro pretendeu verificar a influência da capacidade funcional e das variáveis demográficas no DCL e nas ABVD, em idosos com idade igual ou superior a 60 anos e que apresentem DCL. A amostra foi constituída por 46 participantes (36 mulheres e 10 homens) com idades compreendidas entre os 71 e os 95 anos (83,46 ± 5,99). No momento da recolha de dados foram utilizadas as seguintes formas de avaliação: Escala de Equilíbrio de Tinetti; Six Minute Walk Test; Teste de Preensão Manual com um Dinamómetro; Mini Mental State Examination; Índice de Barthel e o Questionário de Estilos de Vida. Como principais resultados verificou-se que a escolaridade se relaciona com o DCL. Constatou-se que existe uma associação positiva entre as variáveis funcionais, cognitivas e as ABVD e que o estilo de vida relacionou-se com a independência nas ABVD, assim como com o DCL. Deste modo conclui-se que menor capacidade cardiovascular, menores níveis de força e de equilíbrio, assim como o DCL correlacionam-se com maior dependência nas ABVD. Num segundo estudo pretendeu-se verificar se uma intervenção com base num programa de exercício físico multimodal e psicomotor induz alterações na funcionalidade/atividades da vida diária e na função cognitiva de uma participante diagnosticada com DA leve a moderado e com 85 anos de idade. Nos momentos pré e pós intervenção foram utilizadas as seguintes formas de avaliação: Índice de Barthel; Mini Mental State Examination; Escala de Equilíbrio de Tinetti;
Six Minute Walk Test e Cornnel Scale for Depression in Dementia. Como principais resultados
na avaliação pós teste verificou-se um aumento nos parâmetros da marcha, do equilíbrio assim como da função cognitiva. Concluindo-se assim que um programa de exercício multimodal e psicomotor aplicado ao longo de 8 semanas influenciou positivamente a cognição, o equilíbrio e a marcha de uma participante com DA, assim como induziu um aumento da capacidade cardiovascular e de força.
With the increase in average life expectancy, Portugal stands out as an aging country, where the number of elderly is increasing.Changes from aging may affect the cognitive profile of the subject, which in turn may develop Mild Cognitive Impairment (MCI) and Alzheimer's disease (AD). Thus, it is the intention of this study to investigate which variables are most likely to influence MCI as well as non-pharmacological alternatives that provide more knowledge to promote the quality of life of the subject and promote independence in basic activities of daily living (Basic ADL). Thus, this research was based on 2 studies. The first aimed to verify the influence of functional capacity and demographic variables on MCI and Basic ADL in elderly aged 60 years and over and presenting with MCI.The sample consisted of 46 participants (36 women and 10 men) aged between 71 and 95 years (83.46 ± 5.99). At the time of data collection the following forms of assessment were used: Tinetti balance scale; Six Minute Walk test; Hand grip Strength Dynamometer; Mini Mental State Examination; Barthel index and the Lifestyles questionnaire. As main results, it was found that education is related to the MCI. It was found that there is a positive association between functional, cognitive variables and Basic ADL, and that lifestyle was related to independence in Basic ADL as well as to MCI. Thus, it is concluded that cardiovascular capacity, lower strength and balance levels, as well as MCI correlate with greater dependence on Basic ADL. A second study aimed to verify whether an intervention based on a multimodal and psychomotor exercise program induces changes in the functionality / activities of daily living and cognitive function of a participant diagnosed with mild to moderate AD aged 85 years.In the pre and post intervention moments the following evaluation forms were used: Barthel index; Mini Mental State Examination; Tinetti balance scale; Six Minute Walk Test and Cornell Depression scale. The main results in the post-test evaluation were an increase in gait parameters, balance as well as cognitive function. In conclusion, an 8-week multimodal and psychomotor exercise program positively influenced the cognition, balance and gait of a participant with AD, as well as induced an increase in cardiovascular capacity and strength.
Dedicatória ... vii
Agradecimentos ... ix
Resumo ... xi
Abstract ... xiii
Índice figuras ... xvii
Revisão de literatura ... xvii
Estudo I ... xvii
Estudo II ... xvii
Índice tabelas ... xix
Estudo I ... xix
Estudo II ... xix
Índice quadros ... xxi
Revisão de literatura ... xxi
Lista de Abreviaturas, siglas, símbolos e acrónimos ... xxiii
I- Introdução Geral ... 25
II- Revisão da literatura ... 29
2.1- Envelhecimento ... 31
2.2- Do défice cognitivo ligeiro à demência ... 36
2.3- Demência ... 39
2.4- Doença de Alzheimer ... 42
2.4.1- Causas da DA ... 44
2.4.2-Diagnóstico da DA ... 45
2.4.3- Tratamento da DA ... 46
2.5- Exercício físico em doentes com DA ... 47
2.6- Psicomotricidade ... 55
III- Estudos experimentais ... 57
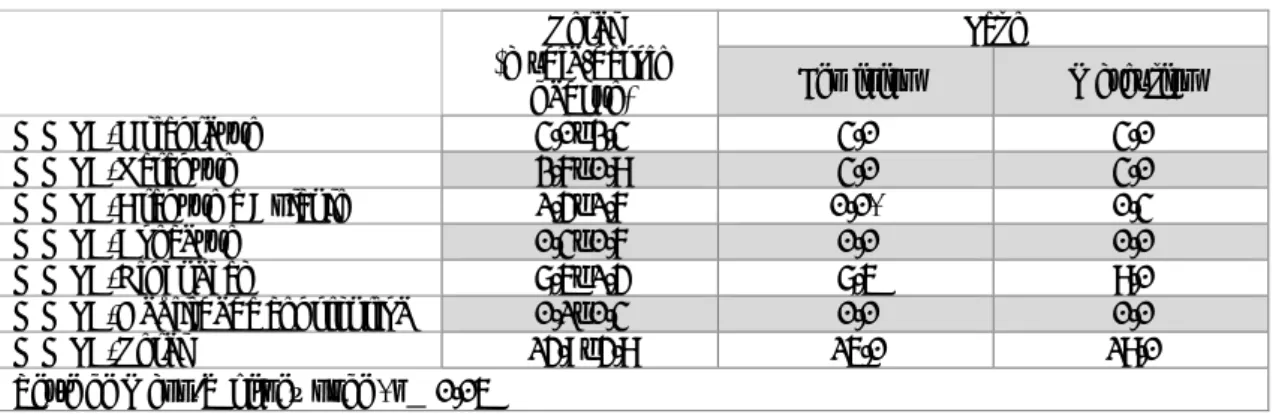
Estudo I: Influência da capacidade funcional e das variáveis demográficas no défice cognitivo ligeiro e nas atividades básicas da vida diária (ABVD) em idosos. ... 59
Resumo ... 59
Abstract ... 61
Procedimentos ... 66 Instrumentos ... 67 Tratamento estatístico ... 70 Resultados ... 71 Discussão ... 77 Conclusão ... 84 Limitações do estudo ... 84
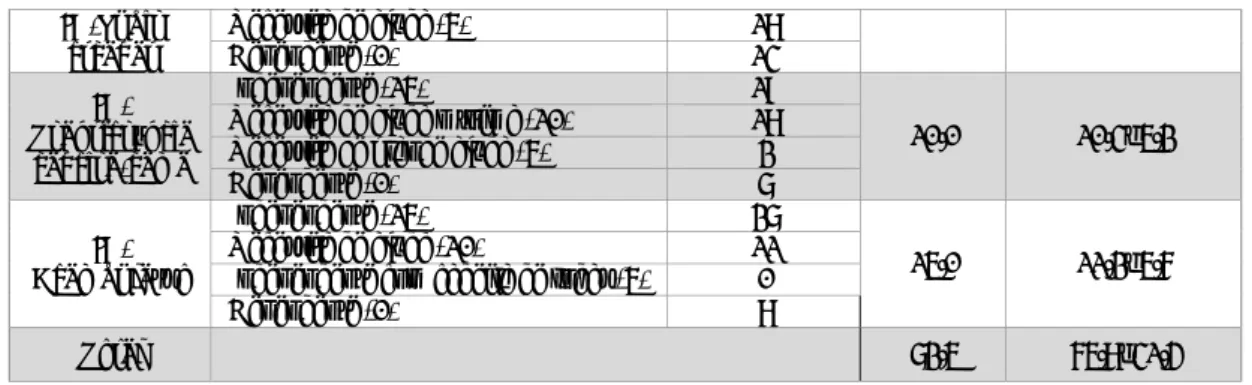
Estudo II: Efeitos de um programa de exercício físico multimodal e psicomotor na funcionalidade/atividades básicas da vida diária e na função cognitiva de uma participante com DA- Um estudo de caso ... 85
Resumo ... 85 Abstract ... 87 Introdução ... 89 Metodologia ... 91 Estudo de caso ... 91 Procedimentos ... 93 Instrumentos ... 93 Programa de intervenção ... 96 Resultados ... 103
Discussão / Reflexões críticas do estudo de caso ... 109
Conclusão ... 114
Limitações do estudo ... 114
IV- Discussão Geral ... 115
V- Conclusão Geral ... 119
VI- Referências Bibliográficas ... 123
VII- Anexos ... 141
Anexo A- Consentimento informado do estudo I ... 143
Anexo B- Anamnese estudo I ... 145
Anexo C- Consentimento informado do estudo II ... 147
Anexo D- Anamnese estudo II ... 149
Anexo E- Plano de sessão aplicado no estudo II ... 151
Revisão de literatura
Figura 1- Representação da relação entre os diferentes conceitos: envelhecimento normal; DCL; demência…36 Figura 2- Sintomas registados em pacientes com DA……….…………43
Estudo I
Figura 3- Flowchart da amostra……….……65
Figura 4- Distribuição da amostra por valor do nível de dependência do IB……….73 Figura 5- Nº de sujeitos por valor de corte da escala de equilíbrio de Tinetti……….74
Estudo II
Figura 6- Representatividade do processo de aplicação do programa de intervenção………96
Figura 7-Programa de intervenção psicomotora………...………97
Figura 8- Resultados do treino aeróbio durante as 8 semanas de intervenção………...…….106 Figura 9- Resultados do plano de treino de força nas 3 sessões semanais durante as 8 semanas de
Estudo I
Tabela 1.1-Valores absolutos de referência dos valores absolutos registados de acordo à faixa etária e sexo do
indivíduo……….….………68
Tabela 1.2- Análise descritiva da amostra………..…………..71
Tabela 1.3- Resultados obtidos no MMSE de acordo com o sexo e a totalidade da amostra……...………72
Tabela 1.4- Resultados obtidos no IB de acordo com as respostas dadas nos vários itens……….….72
Tabela 1.5- Resultados obtidos na capacidade funcional, de acordo com o sexo e a totalidade da amostra…74 Tabela 1.6- Resultados da Escala Estilos de Vida, de acordo com o sexo e a totalidade da amostra………..75
Tabela 1.7- Apresentação dos resultados em função do tipo de instituição……….…75
Estudo II Tabela 2.1:Programa de intervenção………...…………...…..100
Tabela 2.2- Resultados obtidos no MMSE na AI e na AF……….…………103
Tabela 2.3- Resultados obtidos no Índice de Tinetti e o 6MWT na AI e na AF………104
Tabela 2.4-Resultados obtidos no IB na AI e na AF………105
Revisão de literatura
Quadro 1: Alterações nos sistemas: esquelético, cardiovascular e muscular com o envelhecimento…….….33 Quadro 2:Resumo da evolução dos diagnósticos aplicados ao Défice Cognitivo Ligeiro….……….38
Quadro 3: Possíveis causas da DA……….……44
Quadro 4:Variedade de abordagens e ferramentas para ajudar a fazer um diagnóstico da DA……….45 Quadro 5: Resumo dos programas de intervenção de exercício físico aplicados a população idosa e
AB- Beta-amiloide
ABVD- Atividades básicas da vida diária AF-Avaliação final
AI- Avaliação inicial
ACSM- American College of Sports Medicine APA- American Psychiatric Association APOE- Apolipoproteína E
CID-10 - 10ª Revisão da Classificação Estatística Internacional de Doenças e Problemas Relacionados com Saúde
cm³- centímetros cúbicos
CSDD- Cornnel Scale for Depression in Dementia DA- Doença de alzheimer
DCL- Défice Cognitivo Ligeiro
DSM-V- Manual de diagnóstico estatístico de transtornos mentais EEV- Escala estilos de vida
EF- Exercício físico IB- Índice de Barthel
INE- Instituto Nacional de Estatística MMSE - Mini Mental State Examination m/s- metros por segundo
NIA - Association e National Institute on Aging NIH- National Institutes of Health
OCDE-Organização para a Cooperação e Desenvolvimento Económico OMS- Organização Mundial de Saúde
PET- Tomografia de emissão de positrões 6MWT - Six Minute Walk Test
I-Introdução
Portugal tem vindo a sofrer profundas alterações na estrutura etária da população residente e tem enfrentado um duplo envelhecimento demográfico: aumento do número de idosos e diminuição da natalidade do número de jovens e de pessoas em idade ativa (Santana, Farinha, Freitas, Rodrigues, & Álvaro, 2015). Em Portugal em 2015, a esperança média de vida chegou aos 81,3 anos (OECD, 2017) fazendo correspondência de 78 anos para os homens e 82 anos para as mulheres (Portada, 2018). As projeções do INE (2018) apontam para que a esperança média de vida à nascença venha a atingir em 2060, para Portugal, os valores de 84,21 anos para homens e 89,88 anos para mulheres (Santana et al., 2015).
O aumento da expectativa de vida e envelhecimento populacional é uma realidade (INE, 2018), porém com o processo de envelhecimento tenderá a desencadear-se o declínio das funções cognitivas, sendo fundamental discriminar o declínio cognitivo relacionado com a idade, associado a um processo de envelhecimento normal, de um declínio cognitivo patológico associado à possibilidade de evolução para demência (Hugo & Ganguli, 2014).
Neste sentido, surge o conceito de Défice Cognitivo Ligeiro (DCL), como entidade de transição entre envelhecimento normal e a demência (Petersen, 2004; Petersen et al., 2001). Sendo este extremamente relevante, uma vez que diagnosticado devidamente, torna-se o melhor preditor de uma futura demência (Tangalos & Petersen, 2018).
A demência refere-se a um declínio na cognição significativamente suficiente para interferir no funcionamento da vida diária do indivíduo (Peralta, Barranco, & Sebastian, 2019; Prado & Jiménez-Huete, 2019). Segundo a OECD (2017) Portugal foi considerado a nível da prevalência de demência como o 4º país de um total de 36 países (integrantes da organização) com mais casos de diagnóstico de demência.
Segundo Dening e Sandilyan (2015) são vários os tipos de demência, porém a doença de alzheimer (DA) é considerada a causa mais comum de demência (cerca de 60% a 80% dos casos) (Alzheimer Association, 2018). Em 2013, em Portugal, segundo uma estimativa de Santana et al. (2015) o número de indivíduos diagnosticados com DA foi entre 80144 e 112201. A DA caracteriza-se pelo declínio cognitivo progressivo, que provoca a perda de autonomia e de independência, nas funções da vida diária (Reitz, Brayne, & Mayeux, 2011). Assim sendo, os danos sofridos pelo avanço da demência e as alterações sofridas no processo normal do
envelhecimento vão interferir com o desempenho nas atividades básicas da vida diária (ABVD) (Nakano, Otonari, Takara, Carmo, & Clarice, 2014; Rantanenl et al., 2002).
Frente a estes problemas crescentes que a nossa sociedade tem encarado, esta investigação tem por base dois estudos. Num primeiro estudo pretende-se compreender como a capacidade funcional e as variáveis demográficas se relacionam com a capacidade cognitiva e ABVD em idosos com idade igual ou superior a 60 anos e que apresentem DCL. Ou seja, de modo a averiguar como essas variáveis se relacionam e quais as mais suscetíveis a influenciar o DCL, no sentido de compreender em quais aspetos poderá incidir uma intervenção, de modo a alcançar uma maior qualidade de vida para o idoso com DCL.
Num segundo estudo pretende-se aplicar um programa de exercício físico multimodal e psicomotor a uma participante com DA, de modo a verificar se este induz alterações na funcionalidade/ABVD e na função cognitiva. Deste modo, pretende-se investigar quais as intervenções mais benéficas para a população com DA, quer a nível do exercício físico assim como da psicomotricidade, assim como, desenvolver mais conhecimento acerca de intervenções específicas para a população com DA.
Para tal, esta dissertação foi dividida em diferentes capítulos: no segundo capítulo é realizada uma revisão da literatura sobre os diferentes temas abordados neste estudo, tais como, envelhecimento, DCL, demência, DA e intervenção com o exercício físico e psicomotricidade.
No terceiro capítulo são apresentados dois estudos: o primeiro referente à influência da capacidade funcional e das variáveis demográficas no DCL e nas ABVD em idosos com DCL e o segundo estudo pretende verificar o efeito de um programa de exercício físico multimodal e psicomotor na funcionalidade/ABVD e na função cognitiva de uma participante com DA. Neste capítulo são apresentadas as principais limitações dos dois estudos. Por último no quarto e quinto capítulo, é feita uma discussão geral sobre os resultados obtidos nos estudos e são apresentadas as principais conclusões.
II- Revisão da Literatura
2.1- EnvelhecimentoAlguns gerontologistas estimam que o limite máximo para o ser humano viver pode variar entre os 110 e os 120 anos, sendo o ponto de partida para entrar na terceira idade os 65 anos (Santos, Andrade, & Bueno, 2009).
O envelhecimento, visto numa perspetiva demográfica, segundo o INE (2017) é estimado que aumente até 2080 o índice de envelhecimento da população residente em Portugal. O INE (2018) refere que de 2017 para 2080 o número de jovens diminuirá de 1,4 para 0,9 milhões e o número de idosos passará de 2,2 para 2,8 milhões. Perspetivando-se segundo INE (2017) que o número de idosos ronde os 317 por cada 100 jovens, o que levará ao aumento da idade média da população geral que reside em Portugal para os 52 anos. Face ao registado em 2017, onde a população geral detém cerca de 44,2 anos de idade média (INE, 2018).
O envelhecimento do ser humano resulta da interação simultânea entre aspetos fisiológicos, psicológicos e sociais que ocorrem ao longo da vida e que resultam numa perda progressiva da capacidade de adaptação (Mota, Figueiredo, & Duarte, 2004). Por outras palavras, o envelhecimento é a combinação entre os processos inerentes ao indivíduo (endógenos e exógenos) que interagem com a herança genética, e relacionam-se com os fatores físicos, psíquicos e sociais do indivíduo (Gonçalves, 2015; Santos et al., 2009). Em paralelo, esses mesmos fatores ainda são influenciados pelo contexto que o sujeito vive, ou seja, por alguns aspetos tais como o estilo de vida, o género, a profissão, o rendimento económico e a acessibilidade aos serviços de saúde (Gonçalves, 2015).
Chegar à terceira idade não indica necessariamente que a partir desse marco se desencadeie de imediato o aparecimento de patologias, sendo possível e através de medidas preventivas, o indivíduo manter-se saudável nos domínios físico e cognitivo e com autonomia por um longo período de tempo (Santos et al., 2009). Porém, associado ao processo de envelhecer dá-se a acumulação de células senescentes, sendo este processo, marcado por um declínio no funcionamento corporal (Davidovic et al., 2010; Faragher, McArdle, Willows, & Ostler, 2017). O envelhecimento celular caracteriza-se pela perda da capacidade de entrar em mitose e redução da reparação (Faragher et al., 2017), resultando numa acumulação de danos que se repercutem num aumento do atrito fisiológico do organismo, perda de funcionalidade e
morte (Mota et al., 2004). Deste modo, o envelhecimento desencadeia-se de uma forma gradual e progressiva no organismo, possuindo um efeito cumulativo (Fechine & Trompieri, 2012).
As mudanças físicas que acontecem ao longo do envelhecimento são transversais a todos os indivíduos, sendo as mais comuns: a pele machada e enrugada, o declínio no funcionamento sensorial nomeadamente na visão, audição, olfato e paladar, aparecimento de cabelos grisalhos e declínio no funcionamento psicomotor nomeadamente na força, resistência, equilíbrio e tempo de reação (Netto, 2004).
Segundo Sgarbieri e Pacheco (2017) com o envelhecimento são registadas mudanças corporais relativas ao tamanho, peso e composição corporal, idênticas em todos os indivíduos com o aumento da idade. Essa alteração na composição corporal representa-se pelo aumento da gordura visceral, pela diminuição da massa muscular, mineral e de percentagem de água (Sgarbieri & Pacheco, 2017).
A nível fisiológico além das alterações já referidas, ocorrem juntamente outras alterações, nomeadamente a redução do número de células, a deterioração das proteínas dos tecidos, a atrofia dos tecidos, a diminuição da taxa metabólica, a redução dos fluidos corporais e anormalidades no metabolismo do cálcio (Park & Yeo, 2013). Levando a um aumento da concentração osmótica plasmática (Hahr, 2019). Este declínio progressivo e heterogéneo na reserva fisiológica afeta todos os sistemas de órgãos e as funções que estes desempenham, embora numa taxa variável no próprio indivíduo, assim como entre os indivíduos da mesma espécie (Navaratnarajah & Jackson, 2017).
Alguns dos sistemas mais afetados são o sistema respiratório, o renal, o gastrointestinal, o endócrino, o imunitário e o orofaríngeo. Além desses, também ocorrem alterações nos sistemas, esquelético, cardiovascular e muscular (Navaratnarajah & Jackson, 2017; Park & Yeo, 2013; Sgarbieri & Pacheco, 2017), estando as principais alterações discriminadas no Quadro 1.
O sistema nervoso também sofre modificações com o envelhecimento (Park & Yeo, 2013). Algumas dessas alterações estendem-se a nível da estrutura cerebral (Raz & Rodrigue, 2006). Estima-se que exista uma perda de cerca de 30% da massa cerebral aos 80 anos de idade (Navaratnarajah & Jackson, 2017). Essa perda está associada à redução do número de células nervosas (Hahr, 2019), o que gera diminuição do peso e tamanho do cérebro (Sgarbieri & Pacheco, 2017). Esta perda neuronal segundo Walhovd et al. (2011) localiza-se em maior escala no cerebelo e no córtex cerebral.
Driscoll et al. (2009), com base em resultados obtidos por neuroimagem, descreve menores volumes cerebrais globais com o envelhecimento, havendo um decréscimo de volume em torno de 7 cm³ por ano após os 65 anos de idade, incindindo essas perdas, de um modo geral, nos lobos frontais e temporal.
Acresce ainda a estas alterações, uma redução na produção dos neurotransmissores centrais, incluindo as catecolaminas, a serotonina e a acetilcolina, com efeitos secundários no humor, memória e função motora (Navaratnarajah & Jackson, 2017; Seidler et al., 2010).
Redução da densidade mineral óssea;
Detioração e desgaste das articulações e das cartilagens; Perda da elasticidade das cartilagens.
(Park & Yeo, 2013; Sgarbieri & Pacheco, 2017)
Sistema esquelético
Sistema cardiovascular
Aumento na espessura das paredes das artérias;
Aumento do colagénio e da rigidez nas grandes artérias; Diminuição do bombeamento sanguíneo;
Dilatação da artéria aórtica e hipertrofia e dilatação do ventrículo esquerdo do coração, associado a um ligeiro aumento da pressão arterial;
Atraso no relaxamento ventricular; Aumento do peso do coração.
(Navaratnarajah & Jackson, 2017; Park & Yeo, 2013; Sgarbieri & Pacheco, 2017)
Sistema muscular
Atrofia das fibras de contração rápida;
Diminuição do número e tamanho das fibras musculares; Transformação das fibras rápidas em fibras lentas; Redução das células satélite;
Aumento do tecido adiposo intermuscular e intramuscular; Redução do número de mitocôndrias;
Perda do conteúdo mitocondrial;
Irregularidade na estrutura dos sarcómeros.
(Miljkovic & Lim, 2015; Navaratnarajah & Jackson, 2017; Park & Yeo, 2013; Sgarbieri & Pacheco, 2017)
Com o envelhecimento as alterações na composição sanguínea são afetadas pela perda de água corporal, que leva ao aumento da concentração osmótica plasmática e ao aumento da viscosidade do sangue, afetando a circulação sanguínea no sistema nervoso (Hahr, 2019). Como consequência, regista-se uma diminuição de aproximadamente 20% no fluxo sanguíneo cerebral (Park & Yeo, 2013). Como o fluxo sanguíneo não é fornecido na quantidade desejável existe uma redução no aporte de oxigênio e nutrientes, resultando na morte das células cerebrais por hipoxia e por falta dos nutrientes essenciais (Hahr, 2019).
As alterações que ocorrem no sistema nervoso também se relacionam com as disfunções que ocorrem a nível motor (Rosso et al., 2013). Segundo Seidler et al. (2010) as mudanças na motricidade dos idosos podem dever-se à disfunção do sistema nervoso central e periférico e do sistema neuromuscular. Mais concretamente as regiões corticais motoras, cerebelo e gânglios basais, são aquelas em que os declínios estruturais e funcionais, têm maior influência no declínio motor, levando ao aparecimento de défices no equilíbrio e na marcha, défices na coordenação e na velocidade dos movimentos (Seidler et al., 2010). Simultaneamente, resultante da degradação diferencial do córtex pré-frontal e do corpo caloso anterior, existe também a redução de outras capacidades, tais como, a capacidade de atenção, memória de trabalho, processamento visuoespacial e outras funções que contribuem para o controlo motor (Seidler et al., 2010).
Associado ao envelhecimento também surgem as alterações na função cognitiva (Blazer, Wallace, & Carolina, 2016).
Segundo Morrison e Baxter (2013) as alterações na função cognitiva estão ligadas não só à morte das células cerebrais, mas também resultam de alterações sinápticas no hipocampo e no córtex pré-frontal. Algumas das modificações da função cognitiva compreendem as alterações na memória, na atenção, no pensamento, na compreensão, nas recordações, na resolução de problemas, tomada de decisões, bem como na capacidade de armazenar informação (Blazer et al., 2016). As alterações a nível da memória são as que mais se evidenciam (Morrison & Baxter, 2013). A memória é uma função do sistema nervoso central, onde se processa a aquisição, o armazenamento e a evocação das informações (Cançado, Alanis, & Horta, 2011).
Existem vários tipos de memória, no que se refere à memória sensorial, esta é responsável por reter as informações que chegam aos órgãos dos sentidos, provenientes de
estímulos visuais, auditivos, gustativos, olfativos, táteis ou propriocetivos (Alberto, Júnior, & Faria, 2015).
A memória de trabalho caracteriza-se por ter curta duração (Alberto et al., 2015). Esta permite percecionar a realidade e decidir quais as memórias que vamos formar ou evocar (Cançado et al., 2011). Ou seja, esta memória permite armazenar uma informação apenas enquanto estamos a fazer uso dessa mesma informação (Alberto et al., 2015). Sendo responsável por assinalar o início e o fim de cada informação, assim como decidir se a informação foi processada ou não, e se essa informação processada é relevante e requer uma resposta imediata (Alberto et al., 2015; Cançado et al., 2011). Mas por outro lado, a memória de trabalho é fundamental na evocação das memórias e na comparação das novas informações com as que já estão consolidadas e armazenadas na memória a longo prazo, ou seja, permite gerir as memórias que já existem, evocando-as de maneira sequencial e ordenada, de modo a criar um pensamento coeso em consonância com as novas informações (Alberto et al., 2015).
A memória a longo prazo permite armazenar informações por longos períodos de tempo (Alberto et al., 2015). Esta memória classifica-se em duas categorias, a memória declarativa que é aquela que podemos evocar através das palavras e a memória não declarativa que é a que se situa a nível do inconsciente e só pode ser evocada através de ações (Alberto et al., 2015). A memória declarativa ainda pode subdividir-se em memória episódica, que é responsável por armazenar os conhecimentos autobibliográficos, e em memória semântica que é a que se destina a armazenar conhecimentos e factos (Cançado et al., 2011). Ainda dentro da memória a longo prazo, surge a memória motora e o priming (Alberto et al., 2015). A memória motora caracteriza-se por ser de difícil aprendizagem e necessitar de alguma repetição para se tornar consolidada, porém quando consolidada ela torna-se automática, inconsciente e extremamente resistente ao esquecimento. O priming é um tipo de memória que só é induzido por pistas ou dicas, que por vezes nem são processadas de forma consciente, mas poderão influenciar as nossas escolhas (Alberto et al., 2015).
Num estudo conduzido por Slavin et al. (2010) cerca de 95,5% dos participantes idosos efetuaram alguma queixa referente à perda de memória. Na verdade, com o envelhecimento genericamente a memória altera-se, porém existem diferentes tipos de memória e desse modo, pode-se esperar que o envelhecimento as afete em diferentes medidas (Park et al., 2002).
No que se refere à memória de trabalho, esta sofre modificações com o envelhecimento (Park et al., 2002). Segundo Park e Reuter-Lorenz (2009) com o envelhecimento é observado
um declínio na velocidade de processamento, na resposta imediata, na função inibitória e na evocação da memória a longo prazo.
Relativamente à memória a longo prazo, esta sofre igualmente um declínio com o envelhecimento (Hedden & Park, 2001; Park, Polk, Mikels, Taylor, & Marshuetz, 2001), sendo a memória declarativa, a mais afetada (Nyberg, 2017; Nyberg et al., 2003). Os autores Ronnlund, Nyberg, Backman e Nilsson (2005) referem que existem decréscimos substanciais especialmente na memória episódica, uma vez que esta é mais sensível com passagem dos anos do que a memória semântica, existindo uma forma diferencial no modo como o envelhecimento afeta estes dois tipos de memória (Nyberg et al., 2003).
Algum tipo de declínio cognitivo é típico no envelhecimento normal (Hugo & Ganguli, 2014). Porém, quando as mudanças cognitivas são clinicamente significativas surge o Défice Cognitivo Ligeiro (DCL) (Ash & Korczyn, 2011; Cid-Fernandez, Lindin, & Dıaz, 2017). 2.2- Do défice cognitivo ligeiro à demência
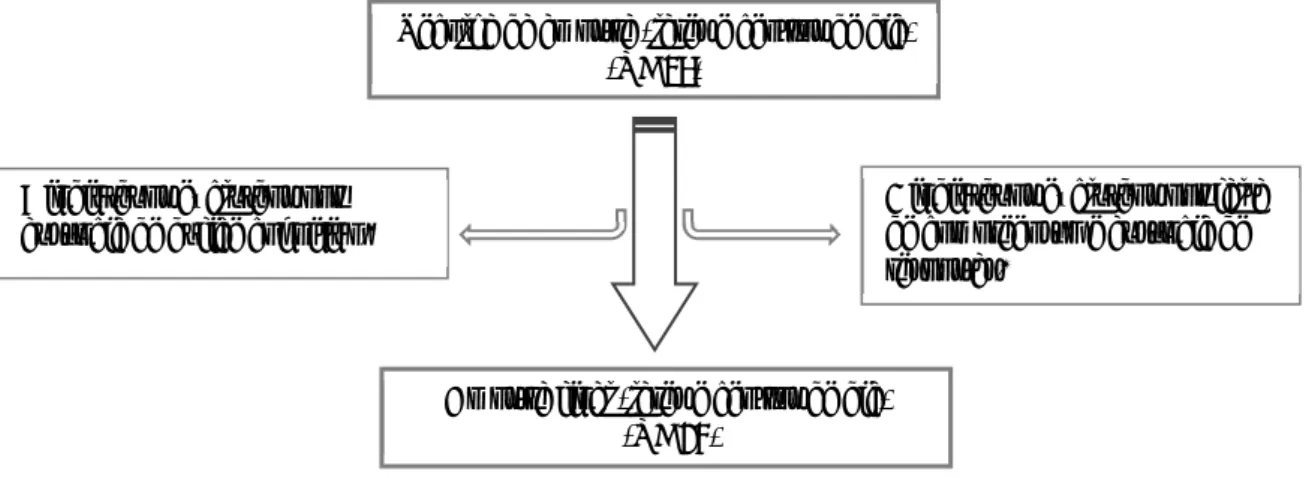
A origem do termo Défice Cognitivo Ligeiro (DCL) emergiu da necessidade de dar resposta à zona de transição patológica entre o envelhecimento normal e a demência, na qual os défices na codificação de novas memórias são aparentes, mas a deterioração funcional é ausente ou questionável (Ash & Korczyn, 2011; Tangalos & Petersen, 2018) (Figura 1).
Na figura 1, existe a ligeira sobreposição do DCL com o envelhecimento e com a demência, por duas razões em específico, primeiramente devido à dificuldade associada a este diagnóstico, uma vez que as mudanças cognitivas podem ser relacionadas somente ao
Envelhecimento
normal DCL Demência
Figura 1- Representação da relação entre os diferentes conceitos: Envelhecimento normal; DCL e Demência.
envelhecimento normal, e em segundo porque a transição específica entre DCL e demência precoce também pode ser difícil de identificar (Petersen, 2004; Petersen et al., 2001).
A prevalência do DCL de acordo com a faixa etária é de 6,7% entre os 60-64 anos, 8,4% entre os 65-69 anos, 10,1% entre os 70-74 anos, 14,8% entre os 75-79 anos e 25,2% entre os 80-84 anos (Petersen et al., 2018). Em Portugal, num estudo realizado na zona norte do país foi concluída uma prevalência ajustada de 4,1% de indivíduos com DCL (Ruano et al., 2019).
O diagnóstico do DCL inicia-se quando o próprio indivíduo nota mudanças cognitivas em si mesmo, sendo realizado o diagnóstico clínico do DCL com base na análise das observações diárias de alguém próximo ao paciente ou com a análise de um médico (Alberta et
al., 2011; Knopman & Petersen, 2014). A partir desse ponto verifica-se se o indivíduo cumpre os restantes critérios presentes no Quadro 2 (Ash & Korczyn, 2011; Petersen et al., 2001; Petersen & Morris, 2005). Estes critérios são oriundos da Mayo Clinic, sendo publicados por Petersen et al. (2001) com o enfoque no comprometimento da memória, uma vez que o objetivo era elucidar acerca dos primeiros estágios sintomáticos da DA (Petersen, 2016).
Em 2003 no Key Symposium foram introduzidos critérios mais abrangentes, cumprindo essencialmente os objetivos de ampliar o esquema de classificação para além da memória e reconhecer que o DCL poderia resultar numa variedade de etiologias e não apenas na DA (Winblad et al., 2004). Assim sendo, tendo em apontamento que o funcionamento cognitivo é
tipicamente caracterizado em um ou mais domínios: aprendizagem e memória, linguagem, capacidade visuo-espacial, função executiva e na capacidade psicomotora (Knopman & Petersen, 2014). Foram introduzidas novas classificações de DCL dependendo dos domínios afetados (Petersen, 2004, 2016; Petersen & Morris, 2005; Tangalos & Petersen, 2018).
Amnésico: Existe quase exclusivamente o comprometimento da memória, principalmente da episódica;
Amnésico multidomínio: Existe o comprometimento da memória e de outros domínios (frequentemente a função executiva);
Não amnésico: Existe comprometimento da capacidade executiva, capacidade visuo-espacial, velocidade de processamento ou linguagem, porém a memória não é afetada.
Não amnésico multidomínio: Existe comprometimento de dois ou mais domínios, não incluindo a memória.
Anos mais tarde, o Instituto Nacional do Envelhecimento e a Associação de Alzheimer desenvolveram novos critérios para a classificação do DCL (Alberta et al., 2011; Sperling et al., 2011). Foram adotados os critérios apresentados no Key Symposium, porém com um diagnóstico mais explícito. A esses critérios foram adicionados biomarcadores para a fisiopatologia subjacente à DA, denominando-se DCL devido a DA, na tentativa de refinar a etiologia subjacente e, assim, predizer a melhor terapia (Quadro 2) (Alberta et al., 2011; Petersen, 2016).
Quadro 2 -Resumo da evolução dos diagnósticos aplicados ao Défice Cognitivo Ligeiro (DCL)
Definição Terminologia aplicada Critérios de diagnóstico
Mayo Clinic
(Petersen et al., 2001) DCL
- Preocupação com uma mudança cognitiva por parte do indivíduo, informante que o conhece bem ou médico;
- Função cognitiva normal;
- Comprometimento objetivo da memória;
- Realização das atividades da vida diária preservadas; - Ausência de demência. National Institute on Aging- Alzheimer’s Association Workgroup (Alberta et al., 2011) DCL
- Preocupação com uma mudança cognitiva por parte do indivíduo, informante que o conhece bem ou médico;
- Comprometimento cognitivo em um ou mais domínios; - Preservação de independência em habilidades funcionais; - Ausência de demência;
DCL devido a DA
- Resultado positivo ou negativo nos biomarcadores refletem a neuropatologia (proteína β-amiloide (Aβ)) e Tau/ ou lesão neuronal:
Alta probabilidade: biomarcador positivo de proteína Aβ e lesão neuronal.
Probabilidade intermedia: biomarcador positivo de proteína Aβ (biomarcador de lesão neuronal não testado) ou biomarcador negativo de lesão neuronal (biomarcadores Aβ não testados)
Improvável: biomarcadores negativos para Aβ e lesão neuronal DSM-5 (American Psychistric Association, 2013) Transtorno neurocognitivo leve
- Preocupação com uma mudança cognitiva por parte do indivíduo, informante que o conhece bem ou médico;
- Prejuízo no desempenho cognitivo, de preferência corroborado por testes neuropsicológicos padronizados ou por outra avaliação quantificada;
- O comprometimento cognitivo não interfere na independência ou na realização nas atividades da vida diária;
- Défices cognitivos não ocorrem exclusivamente em contexto de delirium;
Os critérios para o diagnóstico do DCL, paralelamente também foram publicados no Manual Diagnóstico e Estatístico de Transtornos Mentais, Quinta Edição (DSM-5) (APA , 2013). O DCL surge na categoria dos transtornos neurocognitivos, nomeadamente como transtorno neurocognitivo leve (Sachs-Ericsson & Blazer, 2015). Segundo Petersen (2016) a base dos critérios é semelhante aos critérios do Key Symposium.
É importante referir também que o DCL poderá ser reversível, caso seja originado por outros fatores como: fármacos, depressão, hipotiroidismo, défice na vitamina B12; hipo ou hiperglicemia, desidratação, apneia obstrutiva do sono, perda sensorial e entre outros (Sanford,
2017). Porém o DCL, diagnosticado devidamente, torna-se o melhor preditor de futura demência (Tangalos & Petersen, 2018).
2.3- Demência
As preocupações relativas ao aumento da população demencial em Portugal já trazem consigo um longo trajeto, existindo registos desde 1994 baseados em estudos do grupo EURODEM e nos censos da população portuguesa de 1991 que referem 92470 casos com demência e cerca de 48706 casos com uma demência específica, nomeadamente a DA (Garcia et al., 1994). Santana et al. (2015) referem a existência de 160287 casos de demência em Portugal no ano de 2013. Sucessivamente em 2017 no relatório Health at a Glance a OECD (2017) posiciona Portugal como o 4º país de um total de 36 países (integrantes da organização) com mais casos de demência, sendo estimado que por cada mil habitantes se registem 19,9 casos com demência.
O número de casos com demência tem vindo a aumentar ao longo das décadas, e a OCDE (2017), não refere a existência de um melhor cenário, estimando que em Portugal existirá uma subida para os 322 mil casos de demência até 2037.
A demência refere-se a um grupo de distúrbios cerebrais progressivos que levam a um declínio cognitivo no indivíduo, resultando num comprometimento das suas funções sociais e funcionais (Parmera & Nitrini, 2015; Prado & Jiménez-Huete, 2019).
Segundo Prado e Jiménez-Huete (2019), as definições dadas para a demência recaíam sempre no envolvimento da memória recente e em outra função cognitiva porém, os autores consideram que o comprometimento da memória é um elemento secundário ou tardio em algumas demências. Assim, atualmente, o comprometimento da memória não é considerado o
elemento principal da definição, uma vez que o sujeito poderá ser afetado em outros domínios cognitivos, como visto no DCL (Knopman & Petersen, 2014).
Deste modo, várias são as propostas para definir demência, entre as quais a do DSM-5 (APA, 2013) que assim como no DCL, está integrada nos transtornos neurocognitivos, sendo tal nomenclatura justificada por este termo ser mais amplo, do que o termo demência. Os critérios de diagnóstico para a demência segundo o DSM-5 estão divididos em transtornos neurocognitivos Maiores e Leves (APA, 2013).
As diretrizes presentes na 10ª Revisão da Classificação Estatística Internacional de Doenças e Problemas Relacionados com Saúde (CID-10) (Organização Mundial de Saúde, 2014) para diagnosticar a demência vão ao encontro das presentes no diagnóstico do DSM-5 (APA, 2013). Inicialmente o diagnóstico começa pela evidência de um declínio, tanto na memória (nomeadamente no registo, armazenamento e evocação de novas informações) como no pensamento (capacidade de raciocínio), na qual este é suficiente para comprometer as atividades da vida diária do sujeito (OMS, 2014).
Também integra no diagnóstico o comprometimento do processamento das informações, ou seja, o indivíduo tem progressivamente mais dificuldade em responder a mais de que um estímulo simultaneamente (OMS, 2014). Os sintomas e comprometimentos acima mencionados devem ser evidentes pelo menos durante 6 meses para ser realizado um diagnóstico clínico confiável de demência (OMS, 2014).
São vários os tipos de demência (Dening & Sandilyan, 2015). No que se refere às demências reversíveis, estas têm origem numa doença subjacente tratável e potencialmente curável (Little, 2018). Alguns fatores que poderão estar na origem desta são a baixa atividade física, o tabagismo, a perda auditiva, a depressão, o aumento do índice de massa corporal, a baixa escolaridade, a hipertensão arterial, a diabetes (Aguirre-milachay & Alva-díaz, 2018), a utilização de drogas/medicamentos, a apneia do sono, infeção no sistema nervoso central e défice na vitamina B12 (Little, 2018).
Relativamente à demência frontotemporal, esta caracteriza-se pela degeneração seletiva dos lobos frontal e temporal (Gale, Acar, & Daffner, 2019). Nesta demência o principal fator de risco é a genética familiar dado que poderá influenciar aproximadamente de 25 a 50% no aparecimento da mesma (Holmes & Amin, 2016). Dois dos grandes fatores genéticos localizam-se no cromossoma 17, onde um está ligado ao gene codificador da proteína Tau e outro ligado ao gene Gramíina (APA, 2013; Holmes & Amin, 2016). Alguns dos
sinais/sintomas nesta demência assentam em alterações comportamentais, problemas na fala e na linguagem (afasia progressiva primária), mudanças de comportamento, alterações na personalidade desde falta de inibições, falta de empatia até à adoção de rotinas rígidas por falta de flexibilidade mental e dificuldade no planeamento (Dening & Sandilyan, 2015).
Outro tipo de demência é a demência com Corpos de Lewy (Gale et al., 2019). Esta afeta essencialmente as regiões do córtex e regiões subcorticais (Holmes & Amin, 2016). As lesões conhecidas como corpos de Lewy são estruturas que contém uma proteína, que provocam a degeneração neuronal generalizada (Holmes & Amin, 2016). A nível da sintomatologia o indivíduo poderá ter quedas repetidas e alguns episódios de perda de consciência sem explicação. Possui disfunção autonómica, como hipotensão ortostática e incontinência urinária. O aparecimento de alucinações auditivas e não visuais também são comuns, assim como problemas no sono (APA, 2013; Gale et al., 2019).
É importante realçar que os sintomas desta demência poderão também ser associados à doença de Parkinson, porém difere a história clínica, uma vez que na demência com corpos de Lewy o défice cognitivo aparece mais cedo no mínimo um ano do que os sintomas motores (o aparecimento da doença de Parkinson) (Gale et al., 2019; Nitrini & Dozzi, 2012).
A doença de Parkinson é uma doença neurodegenerativa progressiva caracterizada essencialmente pelos sintomas a nível motor, estando incluídos o tremor, bradicinesia e acinesia (Hayes, 2019). Porém pode também incluir sintomas como o declínio cognitivo, depressão, ansiedade e distúrbios do sono (Hayes, 2019). A doença de Parkinson é comum entre algumas demências, sendo por isso de extrema importância a história clínica para o diagnóstico da mesma (Gale et al., 2019). A sua distinção baseia-se no momento do aparecimento dos sintomas e na sequência dos mesmos (APA, 2013). Nesta doença, a nível patológico regista-se uma despigmentação e perda neuronal na substância negra, estando a perda neuronal associada muitas vezes ao aparecimento dos corpos de Lewy (Hayes, 2019).
A demência vascular tem origem quando o aporte de sangue para o cérebro é comprometido pela doença arterial e devido à acumulação de múltiplos enfartes cerebrais também denominados por acidentes isquémicos transitórios, existe a redução da função neuronal e, eventualmente, a morte das células cerebrais (Dening & Sandilyan, 2015; Holmes & Amin, 2016). De um modo menos comum, a demência pode surgir de lesões focais únicas ou de isquemia subcortical generalizada que afeta a substância branca (APA, 2013). São vários os fatores de risco associados à demência vascular, como a hipertensão, a hiperlipemia, a
diabetes, o tabagismo, a dieta alimentar e a obesidade (Dening & Sandilyan, 2015; Holmes & Amin, 2016).
A demência de Alzheimer é a forma mais comum de demência e devido à importância imposta da mesma neste estudo, ela será descortinada de um modo mais abrangente seguidamente.
2.4- Doença de Alzheimer
Burns e Iliffe (2009) sugerem que a neurodegeneração na DA tem início uma década ou antes dos problemas se tornarem evidentes, sendo denominado estádio pré-clínico. Durante este estádio apesar de ainda não haverem sintomas já começam a existir mudanças no cérebro do indivíduo, entre as quais aparecem os primeiros depósitos anormais de proteína amiloide que vão dar origem às placas amiloides e aos emaranhados neurofibrilares, levando a que os neurónios saudáveis comecem também a perder eficiência na funcionalidade e na comunicação com outros neurónios, acabando por morrer (Burns & Iliffe, 2009).
Os emaranhados neurofibrilares (proteína Tau) e as placas beta-amiloides (Aβ) são duas das características neurofisiopatológicas da DA (Burns & Iliffe, 2009; Hamdan, 2008).
As placas de Aβ e os emaranhados neurofibrilares contribuem para a morte celular de forma distinta: as placas de Aβ interferem na comunicação entre neurónios, e proteína Tau que vai dar origem aos emaranhados neurofibrilares bloqueia o transporte de nutrientes e de outras moléculas essenciais para dentro dos neurónios (Alzheimer Association, 2018). A severidade da demência está correlacionada com o aumento do aparecimento dos fusos neurofibrilares e com o aumento do aparecimento das placas de Aβ, (Hamdan, 2008), registando-se o avanço das duas características neurofisiopatológicas de forma semelhante, tendo padrões de disseminação no cérebro de um modo análogo nos pacientes com DA (Cho et al., 2016), estando este aspeto também correlacionado com a progressão do declínio cognitivo (Jagust, 2018).
Burns e Iliffe (2009) referem que a DA só pode ser completamente diagnosticada depois da morte do indivíduo, com uma amostra do tecido cerebral após uma autopsia, onde são visíveis os efeitos provocados pela proteína Aβ e pelos emaranhados neurofibrilares. Porém estudos mais recentes revelam que é possível determinar o padrão de disseminação cortical in vivo da proteína Tau e da proteína Aβ, através de uma imagem por tomografia de emissão de positrões (PET) (Cho et al., 2016).
Outro aspeto primário no aparecimento da DA é o distúrbio da falha sináptica (Querfurth & LaFerla, 2010), onde as sinapses do hipocampo sofrem um declínio, inicialmente registado em pacientes com comprometimento cognitivo leve (Burns & Iliffe, 2009). Essa perda sináptica poderá representar a correlação do declínio cognitivo na DA (Burns & Iliffe, 2009).
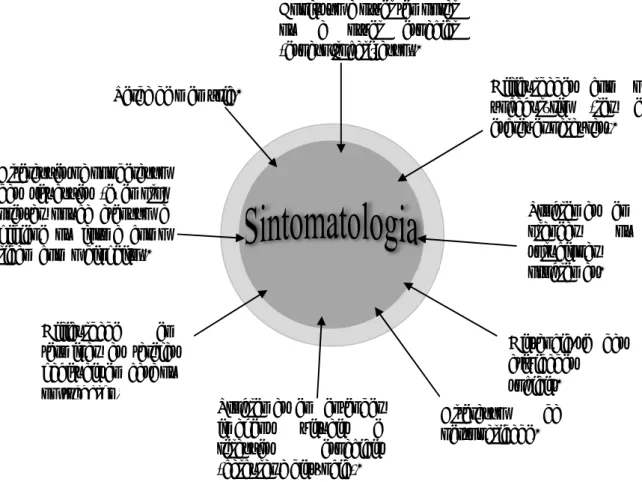
Os sintomas mais frequentes registados pelos pacientes com DA estão descritos na figura 2 (Alzheimer Association, 2018).
O aparecimento dos sintomas surge de forma sistematizada de acordo com a progressão da DA, sendo possível destaca-los nos diferentes estádios da doença. As alterações nomeadamente a perda de memória e de habilidades cognitivas, levam a problemas no dia-a-dia do indivíduo, tais como, perder-se, dificuldade em lidar com problemas, repetir perguntas, levar mais tempo para completar as tarefas diárias normais, fazer julgamentos e ter algumas mudanças de humor e personalidade. Estes problemas são característicos do estágio leve da DA (Alzheimer Association, 2018; Burns & Iliffe, 2009).
Perda de memória. Problemas em planear ou solucionar problemas. Dificuldade em terminar as tarefas habituais em casa ou no trabalho.
Confusão a nível temporal ou a nível espacial (espaço/localização). Problemas em entender imagens visuais e relações espaciais (calcular a distância). Dificuldades com o vocabulário (ler e escrever palavras). Alterações na ponderação das situações (exemplo: prestar pouca atenção a higiene ou forma como lidam com o dinheiro).
Distancia-se das atividades sociais.
Alteração da personalidade.
O estádio moderado da doença caracteriza-se pelo dano que atinge nas áreas que controlam a linguagem, o raciocínio, o processamento sensorial e o pensamento consciente (Burns & Iliffe, 2009). As perdas de memória neste estádio e a confusão mental pioram e o doente começa a ter dificuldades em reconhecer a família e os amigos (Alzheimer Association, 2018; Burns & Iliffe, 2011).Os problemas começam a aumentar e os doentes tornam-se incapazes de aprender coisas novas, de realizar tarefas que envolvam várias etapas (como vestir-se) ou lidar com novas situações.
No estádio severo da doença, as placas e os emaranhados neurofibrilares espalham-se pelo cérebro e o tecido cerebral encolhe significativamente. Os indivíduos com a DA severa não conseguem comunicar e são completamente dependentes de outros (Burns & Iliffe, 2009). Frequentemente encontram-se acamados e com necessidade de atendimento 24 horas por dia (Alzheimer Association, 2018). No estádio final da DA o dano é generalizado, e o tecido cerebral encolheu significativamente (Burns & Iliffe, 2009).
2.4.1- Causas da DA
As causas da DA ainda permanecem indefinidas (Hamdan, 2008). Os especialistas acreditam que DA é o resultado de múltiplos fatores (Quadro 3). Constam assim como causas principais a idade, história familiar, portadores do gene e4 da apolipoproteína E (APOE) (Alzheimer Association, 2018), fatores ambientais e estilo de vida (Burns & Iliffe, 2009).
Quadro 3- Possíveis causas da DA
Idade História familiar APOE Fatores ambientais e
estilo de vida * Maior fator de risco;
* Após os 65 anos aumenta o risco de desenvolver DA (Alzheimer Association 2018);
* Sintomatologia inicial registada por volta dos 65 anos segundo Burns e Iliffe (2009) e 40 anos segundo Hamdan (2008).
* Indivíduos com pai/mãe, irmão/ã com DA, tem maior probabilidade de desenvolver DA (Green et al., 2002, cit in Alzheimer Association , 2018).
* O gene APOE é responsável por codificar uma proteína que transporta o colesterol na corrente sanguínea e existe nas formas do gene de APOE - e2, e3 ou e4 (Association Alzheimer, 2018), na presença do gene APOE e4 o indivíduo tem maior probabilidade de ter DA (Burns & Iliffe, 2009).
* Interferem no aparecimento da DA, mas também exercem um papel ativo na sua prevenção (Burns & Iliffe, 2009).
Mais discriminadamente os fatores de risco ambientais e o estilo de vida, se forem alterados ou modificados, podem reduzir o risco de declínio cognitivo e de demência. Alguns exemplos desses riscos são os fatores que aumentam o risco cardiovascular (diabetes, obesidade, tabagismo e hipertensão), uma má alimentação, a pouca habilitação académica, uma vida social pouco ativa e a presença de lesão cerebral traumática (Alzheimer Association, 2018).
A saúde do cérebro está intrinsecamente ligada à saúde do coração, uma vez que um sistema circulatório eficaz garante um bom aporte sanguíneo rico em oxigénio e nutrientes ao cérebro, para que ele possa funcionar normalmente (Alzheimer Association, 2018). A inatividade física é também um dos fatores de risco mais fulcrais para a DA, além disso, a atividade física surge como uma medida preventiva que permite manter esta relação cérebro coração o mais eficaz possível (Alzheimer Association, 2018).
2.4.2-Diagnóstico da DA
Para realizar o diagnóstico de DA existe uma variedade de abordagens e ferramentas (Quadro 4) (Burns & Iliffe, 2009). Contudo, o diagnóstico da DA só pode ser totalmente determinado se realizar uma necropsia (ou biópsia) com a identificação do número apropriado de placas de Aβ e de emaranhados neurofibrilares em regiões específicas do cérebro, porém este tipo de exame não é recomendado (Burns & Iliffe, 2009; Hamdan, 2008; Ministério da Saúde, 2017).
Quadro 4- Variedade de abordagens e ferramentas para ajudar a fazer um diagnóstico da DA (Alzheimer
Association, 2018; Burns & Iliffe, 2009; Hamdan, 2008).
Obter a história médica e familiar do indivíduo, incluindo o histórico psiquiátrico e o histórico de alterações cognitivas e comportamentais.
Informações de um membro familiar acerca das mudanças de personalidade e comportamento, assim como aspetos que remetam à capacidade de realizar as atividades básicas da vida diária.
Realização de testes cognitivos (memória, resolução de problemas, atenção, contagem e linguagem), exames físicos e neurológicos.
Realização de testes médicos estandardizados: exames ao sangue e à urina. Para identificar outras possíveis causas do problema.
Realização de exames de neuroimagem como a tomografia computadorizada ou a ressonância magnética. Estes exames permitem distinguir a DA de outras possíveis causas com igual sintomatologia, como é o caso do
A PET e a Tomografia computadorizada por Emissão de Fóton Único (SPECT) também podem ser utilizadas para avaliação diferencial da demência em indivíduos sem evidência de alterações estruturais na tomografia computadorizada ou na imagem por ressonância magnética (APA, 1995 cit in Hamdan, 2008).
Segundo o CID-10 (OMS, 2014), os aspetos considerados para o diagnóstico de DA são, ter demência, ter existido um início insidioso e com deterioração lenta, existir ausência de evidência clínica que sugira que o estado mental pode ser decorrente de outra doença sistémica ou cerebral, na qual possa resultar uma demência (p. ex., hipotireoidismo, hipercalcemia, deficiência de vitamina B12, hidrocefalia de pressão normal ou hematoma subdural). Também é considerada a ausência de início súbito, apoplético, ou de sinais neurológicos de lesão focal, tais como hemiparesia, perda sensorial, defeitos do campo visual e incoordenação, ocorrendo precocemente na doença (embora esses fenômenos possam-se sobrepor mais tarde).
O DSM-5 detém a categoria de transtorno neurocognitivo para a DA, podendo esta ser incluída em 3 categorias: delírio, transtorno neurocognitivo ligeiro e transtorno neurocognitivo Maior. Estes diferem de acordo com a intensidade dos sintomas, impacto na vida do paciente e ainda com os resultados dos testes neuropsicológicos (APA, 2013).
O diagnóstico precoce permite um imediato tratamento da doença podendo ajudar a preservar a função cognitiva por um maior período de tempo, mesmo que o processo subjacente da doença não possa ser alterado, por outro lado, também permite ajudar as próprias famílias a planear o futuro, cuidar das questões financeiras e desenvolver redes de apoio (Burns & Iliffe, 2009).
2.4.3- Tratamento da DA
O tratamento da DA deve ser multidisciplinar, devendo fazer uma ponte na sua intervenção com os diversos sinais e sintomas do paciente (Ministério da Saúde, 2017). Ainda não há cura ou reversão da DA, mas existe uma série de recursos que auxiliam seu tratamento (Burns & Iliffe, 2009), como alternativas farmacológicas e não farmacológicas.
O objetivo do tratamento farmacológico é propiciar a estabilização do comprometimento cognitivo e do comportamento (modificar as manifestações da doença), com o mínimo de efeitos adversos (Burns & Iliffe, 2009; Ministério da Saúde, 2017).
As alternativas farmacológicas englobam a utilização de drogas que melhoram temporariamente os sintomas, aumentando e regulando a quantidade de neurotransmissores no cérebro. A eficácia desses medicamentos varia de pessoa para pessoa e tem duração limitada (Alzheimer Association, 2018; Burns & Iliffe, 2009).
Segundo o Ministério da Saúde (2017) os fármacos mais recomendados para o tratamento da DA são donepezila, memantina, galantamina e a rivastigmina. Estes vão ter intervenções específicas, sendo que os fármacos donepezila, galantamina e rivastigmina são inibidores da acetilcolinesterase o que permitirá melhorar os sintomas no campo cognitivo e na função global, sendo por isso recomendados para o tratamento da DA leve a moderada. O fármaco memantina revela bastante eficácia, uma vez que a DA está associada ao aumento da perda dos neurónios glutaminérgicos, com distúrbios nos receptores N-metil-D-aspartato (receptor glutaminérgico) e na expressão do receptor do ácido a-amino-3-hidroxi-5-metil-4-isoxazolepropionico (permite imitar os efeitos do neurotransmissor do glutamato) no córtex cerebral e hipocampo. A ingestão deste permite uma redução na velocidade de progressão da doença e melhoria na memória e na atenção (Ministério da Saúde, 2017).
No entanto, estas soluções não impedem a destruição neuronal e por isso só intervém apenas por tempo limitado (Burns & Iliffe, 2009).
Dentro das intervenções não farmacológicas muitas modalidades se mostraram benéficas sobre a cognição de pacientes com demência devido a DA (Ministério da Saúde, 2017). Dentro delas tem-se evidenciado a prática de exercício físico, tendo um importante papel na função cognitiva e na capacidade funcional dos idosos com demência (Hernandez et al., 2010).
2.5- Exercício físico em doentes com DA
O exercício físico (EF) refere-se à atividade física planeada, estruturada e sistematizada com o propósito de melhorar, ou manter, pelo menos uma das componentes da aptidão física (Chodzko-Zajko et al., 2009). Pereira, Cipriano, Costa e Saraiva (2019) referem o exercício físico como uma ferramenta não-farmacológica eficaz para combater positivamente o declínio cognitivo nos idosos.
O EF, em geral, desempenha um papel benéfico na função cerebral, permitindo a melhoria da função cognitiva e o aumento da saúde no cérebro (Groot et al., 2016; Shen & Li,
2016). A realização do treino aeróbio revela melhorias na neurogénese, angiogénese e plasticidade cerebral (Chodzko-Zajko et al., 2009; Groot et al., 2016; Shen & Li, 2016). Sendo possível observar um aumento do fluxo sanguíneo no cérebro, da oxigenação, da regulação dos fatores neurotróficos e preservação das áreas que influenciam a cognição (Lista, Faltraco, Prvulovic, & Hampel, 2013; Venturelli, Scarsini, & Schena, 2011).
Karssemeijer et al. (2017) referem que intervenções combinadas de EF e de exercícios cognitivos são benéficas e propiciam um melhor desempenho nas atividades da vida diária em idosos com DCL ou demência. Neste sentido a prática de EF regular, orientada e controlada na DA, preferencialmente associada à estimulação cognitiva, contribui para a estabilização ou melhoria transitória de vários domínios cognitivos, entre os quais, a atenção, a função executiva e a linguagem (Coelho, Santos-Galduroz, Gobbi, & Stella, 2008).
É de notar que vários estudos referem uma correlação positiva entre a prática de exercício físico e o aumento da função cognitiva, como pode ser observado no Quadro 5. Diversos autores como Andrade et al. (2013), Coelho et al. (2013), Ferreira et al. (2017), Guerra et al. (2017), Nascimento et al. (2014), Nascimento, Teixeira, Gobbi e Stella (2012), Ohman et al. (2016), Pedroso et al. (2012) e Vreugdenhil, Cannell, Davies e Razay (2012) referem a prática de EF multimodal benéfica e com resultados positivos na função cognitiva, em pessoas idosas com diagnóstico de DA leve a moderado. Por outro lado, Yu, Vock e Barclay (2018) concluíram que uma dose bem quantificada de exercício aeróbio, pode ser efetiva na manutenção da função executiva na DA. Lista e Sorrentino (2010) também referem que de acordo com os resultados dos estudos epidemiológicos transversais, existe uma clara evidência dos benefícios do EF na cognição, assim como Hoffmann et al. (2016) que após a aplicação de um programa de exercício aeróbio com intensidade moderada a alta em pacientes com DA, obteve melhoria na cognição e na manutenção da atividade cognitiva (melhores habilidades intelectuais).
Independentemente do modo ou duração do exercício, a realização de apenas uma sessão pode melhorar o desempenho cognitivo e, em particular, o funcionamento executivo nos idosos (Johnson et al., 2016; Wilke et al., 2019). Sendo considerado por Wilke et al. (2019) o exercício aeróbio mais benéfico que o exercício resistido, mesmo numa única sessão.
Ainda existem incertezas quanto à dose-resposta do EF para a população com DA. As recomendações relativas ao exercício físico divulgadas por American College of Sports
idoso, recaem numa dimensão multimodal, sendo recomendada a prática semanal de 150 minutos de atividade aeróbia de intensidade moderada ou 75 minutos de intensidade vigorosa com exercícios adicionais de fortalecimento muscular abrangendo as componentes de força, equilíbrio e flexibilidade (Chodzko-Zajko et al., 2009).
Porém, e apesar de até à presente data alguns estudos terem aplicado programas de treino a idosos com DA, a duração do programa de exercício, assim como a dose necessária à obtenção dos benefícios físicos, funcionais e cognitivos permanece em dúvida aquando prescrito um programa de exercício físico destinado à população idosa com diagnóstico de DA. Contudo, é expectável que após um curto espaço de tempo, a população idosa fragilizada obtenha benefícios com a prática de EF (Sampaio et al., 2016).
Outro aspeto importante a ser referido é a relação entre a intensidade do EF e a gravidade da DA. Foi possível observar que em doentes no estádio leve a moderado da doença da DA, muitos estudos optaram por escolher a intensidade de lev a moderado por questões de saúde e segurança dos participantes (Hakansson et al., 2017). Hoffmann et al. (2016) aplicou um programa de intensidade moderada a vigorosa, porém os participantes encontravam-se num estádio leve da DA. Esta relação encontrada parece ser justificativa da não realização de EF com intensidade moderada a vigorosa na população de alzheimer, uma vez que, esta é uma população que sofre um declínio funcional e cognitivo com o avançar da DA e por isso apesar de se obter bastantes benefícios (Hoffmann et al. 2016), só é possível aplicar em doentes no estádio leve da DA, dado que os problemas consequentes da doença são mais ligeiros. Desta forma, o exercício aeróbio de leve a moderado de intensidade parece ser a escolha mais recomendada e referenciada nos estudos para esta população como se pode verificar no Quadro 5.
No que se refere ao modo de exercício, apesar das evidências de que o exercício aeróbio trás benefícios para a função cognitiva, em doentes com alzheimer, serem bastante consistentes (Groot et al., 2016), com a análise dos estudos presentes no Quadro 5, foram encontradas intervenções muito distintas, sendo por isso importante salientar a dificuldade de encontrar uma “fórmula” que funcione com todos os doentes com alzheimer. Ozbeyli et al. (2017) sugerem que o exercício de resistência e exercícios combinados próximos ao exercício aeróbio deviam ser incluídos na abordagem terapêutica à DA. Desse modo, a dose-resposta encontrada nos artigos foi diversa, mas com o apoio de algumas evidências científicas apresentadas por
de prevalência apresentada pelos artigos no Quadro 5, pode-se deduzir que o exercício físico multimodal tem mais eficácia na população demencial.
Quanto às intervenções, tendo também em conta o grau de prevalência apresentada pelos artigos no Quadro 5, e tendo em vista resultados positivos na função cognitiva, a duração das sessões deve estar compreendida entre os 40 e os 60 minutos, apesar de Petrella, Belfry, e Heath (2019) verificarem que uma duração de exercício tão breve quanto 10 min fornece um benefício para a função executiva em idosos.
A prática regular de EF deve ser um comportamento adquirido na vida diária, até porque a sua interrupção resulta numa perda de capacidades adquiridas. Deste modo podemos aferir que o exercício físico confere-se numa ferramenta não-farmacológica eficaz e positiva que permite modular positivamente o declínio da função cognitiva em idosos, quando prescrito de um modo personalizado e tendo por base uma estrutura multimodal (Pereira et al., 2019).
Modo de exercício Estudo População Duração Frequência Intensidade Progressão cognitiva Função *Aeróbio-Caminhada ou na esteira (Venturelli et al., 2011) 21 idosos com DA 1- Grupo de treino (n= 11 de idade média de 83 anos). 2- Grupo de controlo (n=10 de idade média de 85 anos).
30minutos por sessão durante 6 meses 4x por semana Moderada NR (Arcoverde et al., 2014) 16 idosos com DA e 4 idosos com demência 1- Grupo de treino (n= 10 de idade média de 78,5 anos). 2- Grupo de controlo (n=10 de idade média de 79 anos).
30 minutos por sessão durante 4 meses 2x por semana Moderada com 10 minutos iniciais a 40% da FC máxima e 20 minutos a 60% da FC máxima Iniciou os primeiros 4 meses com intensidade
a 40% da FC máxima e com duração de 20minutos (Morris et al., 2017) 76 Indivíduos com DA 1- Grupo de treino (n= 37 de idade média de 74,4 anos). 2- Grupo de controlo (n=39 de idade média de 71,4 anos).
60 minutos por sessão durante 26 semanas De 3 a 5x por semana NR Iniciou a 1 semana com 60minutos e aumentou a duração por semana perto dos 21minutos até alcançar
os 150minutos *Aeróbio- ciclo ergómetro (Sampaio et al., 2016) 37 idosos com DA 1- Grupo de treino (n= 19 de idade média de 84,4 anos). 2- Grupo de controlo (n=18 de idade média de 83,3 anos).
45-55 minutos por sessão durante 6 meses 2x por semana Exercício aeróbio feito a intensidade moderada NR (Hoffmann et al., 2016) 200 participantes com DA 1- Grupo de treino (n= 107 de idade média de 69,8 anos). 2- Grupo de controlo (n=93 de idade média de 71,3 anos).
60 minutos por sessão durante 4 meses 3x por semana Moderada a alta (70-80% da FC máxima) Últimas 12 semanas iniciou exercício aeróbio (Yu et al., 2018)
28 idosos com DA leve a moderado de idade média de 78.1
anos. 55minutos por sessão durante 6 meses 3x por semana Moderada (65% e 75% da FC máxima)
Iniciou aos 25 minutos até atingir os 55 minutos de duração