UNIVERSIDADE FEDERAL DO CEARÁ FACULDADE DE MEDICINA
DEPARTAMENTO DE SAÚDE COMUNITÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM SAÚDE PÚBLICA
DOUTORADO EM SAÚDE COLETIVA
CAROLINE MARY GURGEL DIAS FLORÊNCIO
PADRÕES ESPACIAIS, TEMPORAIS E
CLÍNICO-EPIDEMIOLÓGICOS DA HANSENÍASE NO BRASIL, 2001
A 2015
CAROLINE MARY GURGEL DIAS FLORÊNCIO
PADRÕES ESPACIAIS, TEMPORAIS E CLÍNICO-EPIDEMIOLÓGICOS DA HANSENÍASE NO BRASIL, 2001 A 2015
Defesa de Doutorado apresentada ao Programa de Pós-graduação em Saúde Pública do Departamento de Saúde Comunitária da Faculdade de Medicina da Universidade Federal do Ceará, como requisito parcial para obtenção do título de Doutor em Saúde Coletiva. Área de concentração: Epidemiologia das Doenças Transmissíveis e não Transmissíveis.
Orientador: Prof. Dr. Carlos Henrique Morais de Alencar
CAROLINE MARY GURGEL DIAS FLORÊNCIO
PADRÕES ESPACIAIS, TEMPORAIS E CLÍNICO- EPIDEMIOLÓGICOS DA HANSENÍASE NO BRASIL, 2001 A 2015
Defesa de Doutorado apresentada ao Programa de Pós-graduação em Saúde Coletiva do Departamento de Saúde Comunitária da Faculdade de Medicina da Universidade Federal do Ceará, como requisito parcial para obtenção do título de Doutor em Saúde Coletiva. Área de concentração: Epidemiologia das Doenças Transmissíveis e não Transmissíveis.
Orientador: Prof. Dr. Carlos Henrique Morais de Alencar.
Aprovada em: ___/___/______.
BANCA EXAMINADORA
_______________________________________________ Prof. Dr. Carlos Henrique Morais de Alencar (Orientador)
Universidade Federal do Ceará – UFC
________________________________________________ Profa. Dra. Larissa Fortunato Araújo
Universidade Federal do Ceará – UFC
_________________________________________________ Profa. Dra. Paula Sacha Frota Nogueira
Universidade Federal do Ceará - UFC
__________________________________________________ Dr. Antônio Lima Silva Neto
Aos meus pais: Antônio e Maria José (in memorian) que sempre se dedicaram e investiram na educação dos filhos. Aos meus irmãos Karine, Katharine, Leandro e Leonardo
AGRADECIMENTOS
Ao meu orientador, professor Dr. Carlos Henrique Alencar pela excelente orientação, por me capacitar e fazer com que eu me apaixone cada vez mais pela carreira docente. Além de orientador, é um amigo que levarei para vida toda.
À professora Dra. Paula Sacha Frota Nogueira por toda a motivação e ensinamentos sobre atuação do enfermeiro no controle da transmissão da hanseníase.
Aos membros da banca professora Dra. Larissa Fortunato Araújo, ao Dr. Antônio Lima pelas valiosas considerações e sugestões para a melhoria do trabalho final.
Aos professores do Programa de Pós-graduação em Saúde Pública da Universidade Federal do Ceará pelos ensinamentos transmitidos.
Aos secretários, Dominik Fontes e José Hemison, do Programa de Pós-graduação em Saúde Pública por nos ouvir e propor soluções para os problemas nossos de cada dia, muito obrigada.
Aos amigos e integrantes do Grupo de Estudos em Doenças Antropozoonóticas (GEDA) por toda amizade e cumplicidade.
Aos amigos e membros da Liga Acadêmica em Doenças Estigmatizantes (LADES-UFC).
Às minhas amigas Valéria Paiva e Carolina Cavalcante por compartilhar minhas alegrias e angústias.
“Quem ficar leproso, apresentando
quaisquer desses sintomas, usará roupas rasgadas, andará descabelado, cobrirá a parte inferior do rosto e gritará:
‘Impuro! Impuro!’
Enquanto tiver a doença, estará impuro.
Viverá separado, fora do acampamento.”
RESUMO
Uma das questões importantes, mas pouco abordadas é o padrão epidemiológico desigual de ocorrência da hanseníase nos municípios brasileiros. Este estudo objetivou caracterizar os padrões epidemiológicos e clínico-operacionais da hanseníase, bem como a tendência temporal e a distribuição espacial dos seus principais indicadores, no Brasil, por município de residência, de 2001 a 2015. A análise se deu através da caracterização de indicadores epidemiológicos e operacionais da hanseníase, além se sua tendência, através do método de pontos de inflexão. Para a análise espacial foram utilizadas as técnicas de abordagem descritiva, Bayesiana Local e estatística Scan espacial dos indicadores coeficiente de detecção geral, detecção em menores de 15, detecção em casos com grau 2 de incapacidade física (GI2) e proporção de casos multibacilares (MB), com a finalidade de encontrar agregados de alto risco para a presença, transmissão e diagnóstico tardio. No período de estudo foram registrados 612.850 casos novos da doença, sendo 46.448 (7,5%) em crianças. O coeficiente de detecção apresentou redução no período, variando de 25,9 (2001) a 14,2 (2015) casos por 100.000 habitantes (Average Annual Percent Change AAPC: 4,2; IC95%: 5,3 a -3,1). Os demais indicadores também mostraram tendência de redução e estabilização. O coeficiente em menores de 15 anos reduziu de 6,78 em 2001 para 4,55 em 2015 (AAPC: -1,3; IC95%: -4,6 a 2,1), e o de detecção com GI2 reduziu de 1,37 em 2001 para 0,92 em 2015 (AAPC: -2,7; IC95%: -3,6 a -1,7). No entanto, os indicadores de proporção de casos em crianças, GI2 e MB mostraram um aumento significativo. Foram identificados na análise espaço-temporal agregados espaciais com risco elevado para a transmissão da doença, principalmente em municípios localizados nos estados do Pará, Tocantis, Maranhão, Mato Grosso, sul da Bahia e norte do Espírito Santo. O estado do Tocantins e Ceará apresentaram um comportamento singular, visto que no primeiro possui áreas de risco para todos os indicadores, exceto para o MB; já o segundo, não havia áreas de risco, e surgiu uma na região centro-norte após a análise com a proporção de MB. Foi constatado que os municípios que se destacaram como risco para a ocorrência da hanseníase são aqueles que apresentam grandes desigualdades sociais mostrando uma distribuição heterogênea da doença.
ABSTRACT
One of the important but little discussed issues is the unequal epidemiological pattern of occurrence of leprosy in Brazilian municipalities. This study aimed to characterize the epidemiological and clinical-operational patterns of leprosy, as well as the temporal tendency and the spatial distribution of its main indicators in Brazil, by municipality of residence, from 2001 to 2015. The analysis was done through the characterization of indicators epidemiological and operational aspects of leprosy, in addition to its tendency, through the inflection point method. For the spatial analysis, the techniques of Descriptive Approach, Local Bayesian and Statistical Analysis were used. Spatial analysis of the indicators general detection coefficient, detection in under 15, detection in cases with degree 2 of physical incapacity (GI2) and proportion of multibacillary cases (MB ), in order to find clusters of high risk for presence, transmission and late diagnosis. During the study period, 612,850 new cases of the disease were registered, of which 46,448 (7.5%) were children. The coefficient of detection showed a reduction in the period, ranging from 25.9 (2001) to 14.2 (2015) cases per 100,000 inhabitants (Average Annual Percent Change - AAPC: -4.2; 95% CI: -5.3 a - 3.1). The other indicators also showed a tendency of reduction and stabilization. The coefficient for children younger than 15 years decreased from 6.78 in 2001 to 4.55 in 2015 (AAPC: -1.3, 95% CI: -4.6 to 2.1), and the GI2 detection reduced from 1 , 37 in 2001 to 0.92 in 2015 (AAPC: -2.7; 95% CI: -3.6 to -1.7). However, the indicators of the proportion of cases in children, GI2 and MB showed a significant increase. Spatial aggregates with high risk for disease transmission were identified in the spatio-temporal analysis, mainly in municipalities located in the states of Pará, Tocantis, Maranhão, Mato Grosso, southern Bahia and northern Espírito Santo. The state of Tocantins and Ceará presented a singular behavior, since in the first one there are risk areas for all the indicators, except for MB; the second, there were no risk areas, and one emerged in the center-north region after the analysis with the MB ratio. It was found that the municipalities that stood out as risk for the occurrence of leprosy are those that present great social inequalities showing a heterogeneous distribution of the disease.
LISTA DE QUADRO E TABELAS
Quadro 1: Diagnósticos diferenciais da hanseníase relacionando com as formas clínicas desta enfermidade... 31 Tabela 1 - Caracterização demográfica dos casos novos de hanseníase no Brasil, 2001 a 2015... 54 Tabela 2 - Características clínicas dos casos novos de hanseníase no Brasil, 2001 a
2015... 56 Tabela 3 - Indicadores para monitoramento e avaliação da hanseníase no Brasil, 2001 a 2015... 57 Tabela 4 - Tendência dos indicadores epidemiológicos e operacionais da hanseníase, segundo modelo Joinpoint. Brasil, 2001 a 2015... 59 Tabela 5 - Agregados estatisticamente significantes de casos novos de hanseníase
por 100.000 habitantes definidos utilizando o StaScan, Brasil, 2001 – 2015... 77
Tabela 6 - Agregados estatisticamente significantes de casos novos de hanseníase por 100.000 habitantes em menores de 15 anos definidos utilizando o StaScan,
Brasil, 2001 – 2015... 79
Tabela 7 - Agregados estatisticamente significantes de casos novos de hanseníase com grau 2 de incapacidade por 100.000 habitantes definidos utilizando o
StaScan, Brasil, 2001 – 2015... 81
LISTA DE FIGURAS
Figura 1 - Distribuição global dos casos novos de hanseníase em 2016. Fonte: World Health Organization, Weekly Epideliological Record, 2017... 16 Figura 2 - Distribuição dos casos de hanseníase notificados (quatro primeiros meses de 2017) e casos confirmado em 2016 por região de saúde da OMS... 17 Figura 3 - Distribuição temporal da prevalência da hanseníase entre 1985 a 2014.... 19 Figura 4 - Distribuição de casos novos da hanseníase entre 1985 a 2014, OMS, 2015 ... 20 Figura 5 - Médicos fundadores dos centros de Convivência de Redenção, Dr. Antônio Diogo (à esquerda) e do centro de Convivência de Maracanaú, Dr. Antônio Justa (à direita). Fonte: arquivo próprio, 2017... 21 Figura 6 - Centro de Convivência Antônio Diogo, Redenção, Ceará. A: Fachada da
instituição; B: Portão por onde familiares poderiam “visitar” os pacientes internos
através do vidro do portão; C: Pavilhão onde internamente se dividem vários alojamentos de uso comum; D: exemplo de alojamento dentro de um pavilhão... 22 Figura 7 - Paciente acompanhado no Centro de Dermatologia Dona Libânia
utilizando férula de Haris para o “pé caído”, sequela da infecção no nervo tibial
posterior... 23 Figura 8 - Representação da variação da resposta imunológica ao longo do espectro da classificação de Madri em relação à forma clínica do Ministério da Saúde... 24 Figura 9 - Processo patológico com os três desfechos após infecção pelo M. leprae. 24
Figura 19 - Esquema terapêutico para tratamento da hanseníase multibacilar (dimorfa e virchowiana)... 34 Figura 20 - Distribuição dos casos novos de hanseníase por municípios, Brasil, 2000 a 2002. A: taxa média de detecção de hanseníase; B: Taxa média de detecção de hanseníase em menores de 15 anos de idade; C: percentual médio de casos novos com forma tuberculóide... 37 Figura 21 - Figura 21 - Primeiros 10 clusters de risco identificados no Brasil, 2008... 39 Figura 22 - Tendência temporal dos indicadores da hanseníase- coeficiente de
LISTA DE ABREVIATURAS E SIGLAS
AAPC Average Annual Percent Change APC Annual Percent Change
BCG Bacilo de Calmette-Guérin Coef Coeficiente
DATASUS Departamento de Informática do SUS
Detec Detecção
Esp Espontânea
Exam Examinado
GI Grau de Incapacidade Física GI0 Grau de Incapacidade Física 0 GI1 Grau de Incapacidade Física 1 GI2 Grau de Incapacidade Física 2
Hab Habitantes
IB Índice baciloscópico
IBGE Instituto Brasileiro de Geografia e Estatística
IC Imunidade Celular
IC95% Intervalo de Confiança de 95% Indet Indeterminado
MB Multibacilar
NLEP National Leprosy Erradication Programme
N Número
SIG Sistema de Informação Geográfica
SINAN Sistema de Informação de Agravos de Notificação SUS Sistema Único de Saúde
USA United States of America OMS Organização Mundial da Saúde
PNAD Pesquisa Nacional de Amostra de Domicílio PQT Poliquimioterapia
SUMÁRIO
1 INTRODUÇÃO ... 15
1.1 Aspectos gerais da hanseníase... 15
1.1.1 Epidemiologia da hanseníase no mundo ... 16
1.1.2 Aspectos históricos da hanseníase ... 20
1.1.3 Aspectos clínicos e classificação operacional da hanseníase ... 23
1.1.4 Complicações da hanseníase ... 29
1.1.5 Diagnóstico da hanseníase ... 30
1.1.6 Tratamento da hanseníase ... 32
1.2 Uso do espaço como unidade de análise ... 36
1.3 Justificativa... 41
2 OBJETIVOS ... 43
2.1 Objetivo Geral ... 43
2.2 Objetivos Específicos ... 43
3 MATERIAL E MÉTODOS ... 44
3.1 Tipo de estudo ... 44
3.2 Local do estudo ... 44
3.3 Fonte de dados ... 44
3.4 Caracterização das etapas do estudo ... 45
3.5 Aspectos éticos ... 48
4 RESULTADOS ... 49
4.1 Análise descritiva dos indicadores de monitoramento e avaliação da hanseníase 49 4.2 Análise de tendência temporal dos principais indicadores epidemiológicos e operacionais da hanseníase... 58
4.3 Análise espaço-temporal por grupos ... 64
4.4 Identificação dos agregados espaço-temporais ... 76
5 DISCUSSÃO ... 82
5.1 Caracterização epidemiológica da hanseníase ... 82
5.2 Tendência dos indicadores da hanseníase ... 85
5.3 Dados espaciais dos principais indicadores da hanseníase ... 89
5.4 Limitações do estudo ... 93
6 CONCLUSÕES ... 94
7 REFERÊNCIAS ... 95
8 APÊNDICES...104
1 INTRODUÇÃO
1.1 Aspectos gerais da hanseníase
A hanseníase é uma doença negligenciada, infectocontagiosa causada pelo Mycobacterium leprae. Manifesta-se por sinais e sintomas dermatológicos e neurais, resultando em incapacidades físicas e deformidades (BRASIL, 2017). Devido à elevada carga da doença no mundo [cerca de dois milhões de acometidos ou 12 casos por 10.000 habitantes (hab.) em 1985], a Organização Mundial da Saúde (OMS; World Heathy Organization- WHO) propôs o controle da enfermidade que seria a redução para 1 caso por 10.000 hab (WHO, 2002). Desde o ano 2000 a meta foi alcançada, no entanto, houve a percepção de que a doença se distribuia de forma desigual entre os países, e dentro dos próprios países haviam áreas de endemicidade bastante elevada (ALENCAR et al., 2012; JOSHUA, 2018; OMS, 2017; PENNA et al., 2008).
Por isso, como a meta não foi alcançada em vários países (22 são considerados como
grupo “prioritário” pela OMS), a renovação de uma nova proposta de eliminação vem ocorrendo a cada cinco anos, sendo que até o momento tem-se quatro propostas reformuladas: eliminação da doença até 2005; posteriormente, até 2010 (Estratégia Global 2006 a 2010); seguida da Estratégia Global 2011- 2015 que além da meta de redução, propõe a prestação de serviços de alta qualidade para todas as comunidades afetadas, assegurando que os princípios de equidade e justiça social sejam seguidos (OMS, 2005; OMS, 2009).
1.1.1 Epidemiologia da hanseníase no mundo
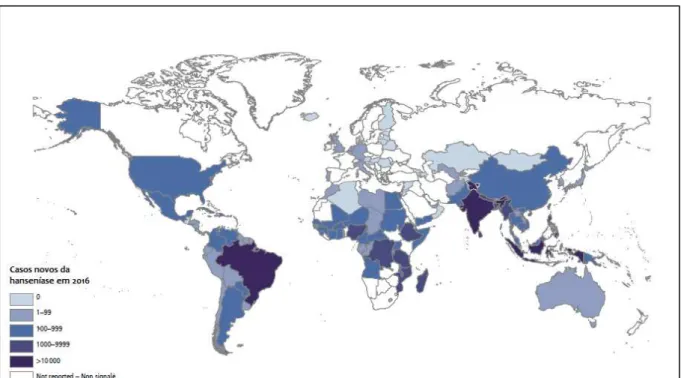
Em 2016, foram diagnosticados 214.783 casos novos da hanseníase que correspondem a uma prevalência de 0,23 casos por 10.000 hab. Observou-se que 95% dos casos ocorreram em 22 países denominados prioritários para controle da enfermidade e que 86% deste total concentram-se na Índia (135.485 casos), no Brasil (25.218) e na Indonésia (16.826) (WHO, 2017). Sendo que nas Américas, o Brasil tem lugar de destaque, pois possuí 92% do total de casos (BRASIL, 2017) (Figura 1).
Figura 1 - Distribuição global dos casos novos de hanseníase em 2016.
Fonte: WHO,2017.
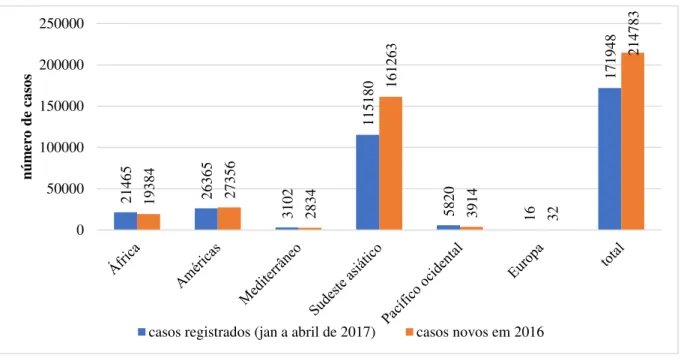
Figura 2 - Distribuição dos casos de hanseníase notificados (quatro primeiros meses de 2017) e casos confirmado em 2016 por região de saúde da OMS.
Fonte: (OMS, 2017)
No geral desde 1985, o número de casos vem reduzindo, quando se contabilizaram 550.224 casos novos neste ano para 214.783 no ano de 2016. No mesmo período, o coeficiente de detecção variou de 29 por 100.000 hab. para 2,9 por 100.000 hab.). Analisando a serie temporal de 2007 a 2016 houve um decréscimo no total de casos, no entanto, em 2016 foi percebido um acréscimo de 4.043 casos sendo atribuído à busca ativa (WHO, 2017). O fato da doença ter sido “erradicada”, ou melhor, controlada (prevalência < 1/10.000 habitantes) pode ser entendida pelos gestores da saúde como a ausência de casos, como é o caso do continente europeu, e que pode ter consequências graves como a falta de investimentos em novas pesquisas na área como também a escassez na mobilização dos profissionais de saúde na atenção básica (COSTA E OLIVEIRA, 2009; WANG et al., 2018).
No Brasil, o estado de Minas Gerais não fornecem informações atuais sobre a enfermidade fato que pode ser explicado pela influência de saber que a doença está erradicada ou que os casos são esporádicos não merecendo devida atenção (ARAÚJO et al., 2004; FERREIRA & ALVAREZ, 2005; LANA et al., 2007; MIRANZI et al., 2010). Para evitar que isso aconteça é interessante considerar a hanseníase como doença sob controle, pois, devido ao caráter crônico da doença, pessoas podem estar em período de incubação e os serviços
21465 26365 3102 115180 5820 16 171948 19384 27356 2834 161263 3914 32 214783 0 50000 100000 150000 200000 250000 nú m er o de ca so s
precisam estar atentos para as manifestações clínicas inicias da doença, como a forma indeterminada (BERNARDES FILHO et al., 2017).
Para o monitoramento da hanseníase existem os indicadores de saúde preconizados pela OMS sendo que os principais são: o coeficiente de detecção de casos novos por 100.000 hab.; o coeficiente de detecção em menores de 15 anos por 100.000 hab.; e o coeficiente de grau 2 de incapacidade física (GI2) por 100.000 hab. Estes indicadores avaliam a carga da doença, a magnitude de transmissão e a qualidade do serviço de saúde (através da quantidade de pacientes com GI2 percebe-se o diagnóstico tardio que evidencia falha no sistema de captação de casos na forma indeterminada ou precoce), respectivamente.
Figura 3 - Distribuição temporal da prevalência da hanseníase entre 1985 a 2014.
Fonte: (SCHREUDER et al., 2015)
Figura 4 – Distribuição de casos novos da hanseníase entre 1985 a 2014, OMS, 2015
Fonte: OMS, 2015.
Para a redução dos casos, desafios surgem atrelados aos aspectos epidemiológicos como a necessidade de qualificação do processo de vigilância epidemiológica, englobando não apenas a captação de casos e a coleta de dados, mas também a consolidação no Sistema de Informação de Agravos de Notificação (SINAN), com posterior análise (ALENCAR et al., 2012; BRITO et al., 2016; SOUZA & MATOS, 2018). Portanto, considerando-se a especificidade do M. leprae pelo acometimento de nervos periféricos bem como o potencial para gerar alterações motoras e sensoriais, existem impactos significativos do ponto de vista físico, psicológico, social e econômico que ampliam a carga deste processo infeccioso. Por sua natureza incapacitante, a baixa gravidade e o estigma relacionado, um grande contingente de pessoas que vivem com hanseníase apresenta necessidades marcantes com vistas à reabilitação ao longo de suas vidas (NEDER et al., 2015).
1.1.2 Aspectos históricos da hanseníase
A hanseníase é uma das doenças mais antigas da humanidade, inclusive relatada na Bíblia. Associada à presença confirmatória do pecado no indivíduo, a doença foi vista como castigo e assim carrega o estigma e o preconceito que atravessaram séculos, apesar da descrição clínica da doença, do agente etiológico e da existência de tratamento (BÖRENSTEIN et al., 2008; CRESPO E GONÇALVES, 2014).
como leprosário (ARAÚJO et al., 2004). Até em então conhecida como uma doença existente em meio a concentração humana, com o avanço da agricultura para o interior do país e a necessidade de mão-de-obra para trabalho nas lavouras, a doença se espalhou por todo o país (MARINHO et al., 2015).
Durante muito tempo a hanseníase permaneceu sem o conhecimento do seu agente etiológico, até que em 1873 o médico norueguês Armauer Hansen identificou o M. leprae
como o agente causal. A doença anteriormente denominada lepra (“lepros”, do grego escamoso) foi substituída em 1976 por hanseníase ou doença de Hansen, por esforços do médico hansenologista paulista, Prof. Abrãao Rotberg, posteriormente tornando-se lei no Brasil. Apesar da mudança na denominação, a doença ainda é motivo de estigma e exclusão da sociedade (MAGALHÃES & ROJAS, 2007).
Ainda existem as marcas do isolamento que era instituído à época em que a doença não tinha cura. Atualmente no Brasil existem 33 ex-colônias que abrigam ex-pacientes que por problemas de reinserção social ou por opção, permanecem residindo nestas instituições. No Ceará, existem dois centros: Centro de Convivência Antônio Justa, no município de Maracanaú e o Centro de Convivência Antônio Diogo, fundado em 1928, no município de Redenção (Figura 5), referência para o tratamento da hanseníase; ambos na região metropolitana de Fortaleza. Residem no Centro Antônio Diogo 152 pessoas entre ex-pacientes e seus familiares (Figura 6).
Figura 5 - Médicos fundadores dos centros de Convivência de Redenção, Dr. Antônio Diogo (à esquerda) e do centro de Convivência de Maracanaú, Dr. Antônio Justa (à direita).
Na área interna do Centro de Convivência Antônio Diogo funciona ainda uma Unidade Básica de Saúde onde atua uma equipe da Estratégia Saúde da Família mantida pelo SUS através da Prefeitura de Redenção. A unidade também realiza diagnóstico da hanseníase para todos os municípios da região (SESA-CE, 2013).
Figura 6 - Centro de Convivência Antônio Diogo, Redenção, Ceará. A: Fachada da
instituição; B: Portão por onde familiares poderiam “visitar” os pacientes internos através do
vidro do portão; C: Pavilhão onde internamente se dividem vários alojamentos de uso comum; D: exemplo de alojamento dentro de um pavilhão.
Fonte: arquivo próprio, 2017.
Figura 7 - Paciente acompanhado no Centro de Dermatologia Dona Libânia utilizando férula
de Haris para o “pé caído”, sequela da infecção no nervo tibial posterior.
Fonte: arquivo próprio, 2017.
1.1.3 Aspectos clínicos e classificação operacional da hanseníase
A hanseníase apresenta várias formas clínicas de manifestação, cujo principal diagnóstico baseia-se na presença de lesões de pele com alteração da sensibilidade e acometimento neural. Por sua vez a hanseníase, na sua forma grave, é uma doença extremamente incapacitante fazendo com que o acometido não exerça suas atividades cotidianas, o que acaba comprometendo sua qualidade de vida causando uma auto-estigmatização e constragimento. Esses problemas se agravam pelo fato da patologia estar historicamente relacionada a preconceitos, o que mantém ainda hoje uma representação errônea de ideia de uma doença incurável e mutilante, causando atitudes de rejeição e discriminação ao doente, e consequente exclusão da sociedade (ALVES et al., 2010;
Figura 8 - Representação da variação da resposta imunológica ao longo do espectro da classificação de Madri em relação à forma clínica do Ministério da Saúde.
Fonte: Adaptado de Misch et al. 2010.
O M. leprae tem tropismo pelas células de Shwann nos nervos periféricos, onde se
instalam e passam a agredir através de um processo patológico a bainha de mielina dos nervos acometidos e resultam em degradação deste nervo e perda da sua função (MISCH et al.,
2010).
Figura 9 – Processo patológico com os três desfechos após infecção pelo M. leprae.
Para fins terapêuticos, no ano de a OMS 1988, estabeleceu critérios clínicos com base no número de lesões de hanseníase, em que é considerado paucibacilar pacientes com até 5 lesões cutâneas ou um tronco nervoso acometido e multibacilares aqueles com mais de 5 lesões cutâneas ou com mais de um tronco de nervo acometido, se disponível o exame baciloscópico pode ser utilizado para a classificação (BRASIL, 2017).
• Forma clínica indeterminada
A forma clínica indeterminada é considerada a fase de início da doença e todos os pacientes passam por ela. Por apresentar sinais por vezes imperceptíveis (geralmente manchas pouco expressivas) ou facilmente confundidas com dermatofitoses é difícil a doença ser diagnosticada neste estágio. São mais comuns em crianças com idade inferior a 10 anos que tenham contraído a doença de um adulto multibacilar. A lesão na maioria das vezes é única, hipocrômica, sem alteração de relevo, bordas mal delimitadas e que apresenta ausência de
sudorese (“não pega poeira”). As sensibilidades térmica e dolorosa podem estar afetadas, mas ainda está preservada a sensibilidade tátil. Quanto aos exames, a prova da histamina endógena é incompleta, a biopsia de pele não é útil e a baciloscopia é negativa, não afastando o diagnóstico (BRASIL, 2017).
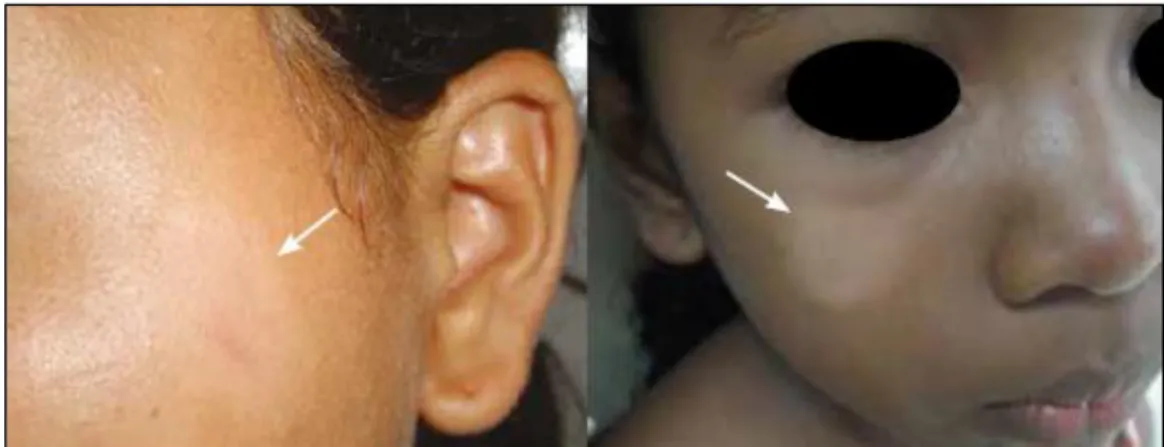
Figura 10 - Paciente com forma clínica indeterminada, lesão hipocrômica e hipoanestésica em face.
• Forma clínica tuberculóide
É a forma clínica da hanseníase onde o indivíduo possui o sistema imunológico celular capaz de destruir os bacilos. Assim como na forma indeterminada também pode acometer crianças. O período médio de incubação até a manifestação dos sintomas é de 5 anos. Independente disso pode se manifestar em crianças de colo (hanseníase nodular da infância). Comumente, manifesta-se como uma placa totalmente anestésica com bordas elevadas, bem delimitadas e centro hipocrômico e circular. Juntamente a lesão em placa pode haver o espessamento de um único nervo com perda total da sensibilidade no seu dermátomo. Pode-se realizar os exames para fazer correlação clínica com o resultado da baciloscopia e/ ou biopsia, mas devido a perda total da sensibilidade associada ou não a alteração motora facilmente se conclui o diagnóstico (ALVES et al., 2010).
Figura 11 - Lesão única em placa totalmente anestésica na face de uma criança, caracterizando a hanseníase tuberculóide.
Fonte: Instituto Lauro Souza de Lima
• Forma clínica dimorfa
comum de apresentação da doença (ocorre em mais de 70% dos casos). O período de incubação é bastante longo, 10 anos em média. A baciloscopia da borda da lesão é frequentemente positiva, exceto em casos raros onde a doença esta confinadas aos nervos (forma neural pura) (BRASIL, 2017).
Figura 12 - Paciente com múltiplas lesões com bordas elevadas avermelhadas e centro claro com perda total da sensibilidade.
Fonte: Instituto Lauro Souza de Lima
• Forma clínica virchowiana
É a forma mais contagiosa da doença. Juntamente com a forma dimorfa é o que sustenta a transmissão ativa entre os indivíduos susceptíveis. O paciente não mostra manchas visíveis, mas características de acometimento nervoso autônomo (pele avermelhada, ressecada, poros dilatados) poupando as áreas mais quentes do corpo. Os hansenomas são caroços escuros, endurecidos e indolores comuns a esta forma clínica. Nos estágios mais avançados pode haver madarose (perda das sobrancelhas) e queda de outros pelos do corpo, exceto o couro cabeludo. A fase é lisa devido à infiltração, o nariz congestionado, mãos e pés com coloração arroxeada.
Figura 13 - Paciente com forma clínica virchowiana acompanhado no Centro de referência Dona Libânia. A- Infiltrado difuso em face, B- infiltrado difuso em orelha, C- espessamento do nervo auricular, D- mão em garra (nervo ulnar), E- amiotrofia dos músculos da mão, F- ressecamento e lesões devido à queimadura, F- mal perfurante plantar.
1.1.4 Complicações da hanseníase
As reações hansênica ou estados reacionais (tipo 1 e 2) são tipos de alterações do sistema imunológico que apresenta manifestações inflamatórias agudas e subagudas, podendo ocorrer em qualquer paciente, porém são mais frequentes em pacientes multibacilares. Elas podem surgir no início, durante ou depois do tratamento com poliquimioterapia (BRASIL, 2017).
Figura 14 – Esquema apresentando o processo imunológico envolvido nas reação tipo 1 (à esquerda) e reação tipo 2 (à direita).
Fonte: Adaptado de Misch et al., 2010.
A reação do tipo 1 ou reação reversa ocorre em dimorfos e tuberculóides. Relaciona-se à resposta do tipo imunocelular, reação reversa e conhecido como a melhora do paciente ou agravamento chamado de reação de degradação. E caracterizado pelo aparecimento de eritêmato-edematosas, descamam, em alguns casos ulceraram. Na maioria das vezes há edema das extremidades e neurite, com menores manifestações sistêmicas (Lastória e Abreu, 2011).
Figura 15 - Reação hansênica do tipo 1.
A reação do tipo 2 aparece subitamente em pacientes virchowianos e dimorfo-virchowianos, a manifestação cínica mais frequente é o Eritema Nodoso Hansênico (ENH), caracterizado pelo surgimento de nódulos subcutâneas dolorosos, que pode ser acompanhado de manifestações do tipo sistêmica como: dor articular, febre, orquite, mal-estar, com ou sem espessamento dos nervos e dor em nervos periféricos (neurite) (BRASIL, 2017).
Figura 16 - Reação hansênica do tipo 2.
Fonte: BRASIL,2017
1.1.5 Diagnóstico da hanseníase
O diagnóstico da hanseníase é alicerçado em um exame clínico completo de inspeção e palpação nervosa, seguido principalmente dos testes ou provas clínicas complementares que tem por objetivo principal verificar a viabilidade do nervo. Os principais testes dermatoneurológicos envolvem a busca de alterações de sensibilidade tátil, dolorosa e diferenciação térmica quente/frio; alterações autonômicas circunscritas quanto à reflexia à histamina e/ou sudorese. Por essa característica ímpar, não é raro a doença ser facilmente confundida com outras doenças de pele antes de ser de fato diagnosticada corretamente. Um estudo realizado pelo Núcleo de Hansenologia da Universidade de São Paulo demonstrou que o doente percorre, em média, oito médicos para enfim ser dignosticado com a enfermidade (MARGARIDO & RIVITTI et al. 2009). O Quadro 1 apresenta as formas clínicas da
Quadro 1: Diagnósticos diferenciais da hanseníase relacionando com as formas clínicas desta enfermidade.
Forma clínica Dignóstico diferencial
indeterminada (manchas hipocrômicas) Vitiligo, nevo acrômico, pitiríase alba, acromias parasitárias, pitiríase versicolor tuberculóide e dimorfa (placas róseas,
eritematosas, bordas irregulares, circinadas)
Sífilis tardia, dermatofitoses, leishmania cutânea, micoses superficiais e profundas, histoplasmose, blastomicose
Tuberculóide, lesões nodulares Histoplasmose, neurofibroma, leiomioma Virchowiana, lesões espessadas róseas,
difusas, simétricas, com ou sem pápulas, placas ou nódulos
Erupção acneiforme, sífilis tardia, dermatite seborreica, blastomicose, líquen plano, linfomas, dermatomiosite.
Reação hansênica tipo 1 Urticárias, tinhas de pele, psoríase
Eritema nodoso hansênico Farmacodermia, eritema nodoso estreptocócico.
Fonte: MARGARIDO & RIVITTI, 2009
No momento do diagnóstico se faz necessário avaliar a integridade da função neural. O exame neurológico compreende a inspeção, palpação/percussão, avaliação funcional (sensibilidade, força muscular) dos nervos; a partir disso, podemos classificar o grau de incapacidade física. Para verificar a integridade da função neural é utilizado o formulário de Avaliação Neurológica Simplificada (ANEXO 1).
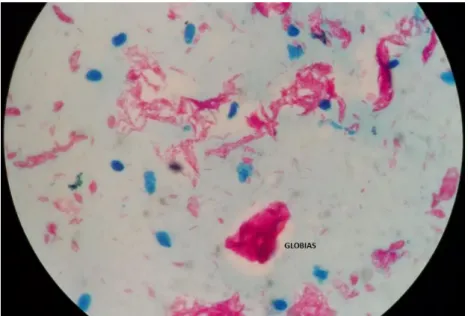
Figura 17 - Microscopia óptica de esfregaço linfático corado pela técnica de Ziehl-Neelsen apresentando globias de diversos tamanhos.
Fonte: Arquivo próprio, 2017.
1.1.6 Tratamento da hanseníase
O primeiro tratamento eficaz contra a hanseníase foi através da utilização da sulfona em meados da década de 40. Essa descorberta foi marcante, pois não se fazia mais necessário o isolamento compulsório dos doentes, procedimento realizado por séculos na história (CABRAL, 2013). No entanto, com o surgimento da resistência à dapsona no início da década de 60 percebeu-se a fragilidade da utilização desta ferramenta na luta contra o bacilo. Desde então, a resistência aos medicamentos é uma preocupação e uma ameaça a muitos programas de intervenção para as doenças infecciosas, especialmente aqueles que utilizam o tratamento farmacológico (prevenção secundária) como principal componente de sua estrátegia de controle (WHO, 2017a).
Como a rifampicina é a droga mais importante do regime de PQT, é importante monitorar o surgimento de cepas resistentes à esta droga, já que foi comprovada recentemente a existência da resistência à rifampicina em várias áreas endêmicas (CAMBAU et al., 2012). Em caso de resistência à rifampicina, as fluoroquinolonas passam a ser a categoria preferida dos medicamentos de segunda linha. Infelizmente, cepas de M. leprae resistentes às quinolonas também foram relatadas em vários países, provavelmente devido ao uso extensivo de quinolonas para tratar vários tipos de infecções. A resistência à clofazimina ainda é rara, mas este antimicrobiano não pode ser administrado isoladamente. Para enfrentar o desafio de conter a doença e ser capaz de responder a um aumento na circulação de cepas resistentes aos medicamentos, é essencial avaliar os padrões de sensibilidade aos medicamentos em todo o mundo, bem como monitorar a resistência entre os casos novos e de retratamento (WHO, 2017a).
No Brasil, a PQT foi instituída em 1993 e é gratuito. Os esquemas terapêuticos são padronizados de acordo com sua classificação operacional e seguem normas restritas obedecendo à portaria de número 3.125, de 07 de outubro de 2010, elaborado pelo Ministério da saúde (BRASIL, 2010). O tratamento é conduzido em regime ambulatorial, independente da forma clínica, nos serviços de atenção básica, e em casos de intercorrências clínicas ou cirúrgicas, o paciente deverá ser atendido em serviço especializado ou de referência para os portadores de hanseníase.
O esquema terapêutico é prescrito de acordo com a classificação operacional do paciente, ou seja regime de seis meses para paciente PB [são 6 cartelas contendo Rifampicina com dose mensal de 600 mg (2 cápsulas de 300 mg)] com sua administração supervisionada pelo profissional de saúde (enfermeiro); a dapsona com dose mensal de 100 mg supervisionada e a dose diária de 100 mg auto-administrada (Figura 16). Para os pacientes MB, o período de tratamento é de um anos e tem a adição de mais um fármaco, a clofazimina. Assim como a dose de rifampicina, ela é administrada com dose mensal de 300 mg (3 cápsulas de 100 mg) supervisionada e uma dose diária de 50 mg auto-administrada (Figura 17) (BRASIL, 2017).
pessoas, cerca de cinco delas manifestaram a doença por ano (MARGARIDO & RIVITTI et
al. 2009). Após a completude do tratamento, o Ministério da Saúde prevê a alta por cura dos
pacientes portadores da enfermidade.
Figura 18 - Esquema terapêutico para tratamento da hanseníase paucibacilar (indeterminada e tuberculoíde).
Fonte: (BRASIL, 2014).
Figura 19 - Esquema terapêutico para tratamento da hanseníase multibacilar (dimorfa e virchowiana).
1.1.7 Medidas de prevenção e controle
A prevenção de incapacidades inclui um conjunto de medidas que visam evitar a ocorrência de danos físicos, emocionais e socioeconômicos. A principal forma de prevenir as incapacidades é através do diagnóstico precoce. A prevenção das incapacidades sejam elas transitórias ou permanentes não devem ter relação com o início do tratamento da PQT. Para tanto o acompanhamento do paciente é fundamental, por isso a cada dose supervisionada o paciente realiza a prevenção de incapacidade com o preenchimento da ficha de Avaliação Neurológica Simplificada. A prevenção e o tratamento das incapacidades físicas são realizadas pelas unidades de saúde, mediante a utilização de técnicas simples (educação em saúde, exercícios físicos, uso de calçados adaptados, férulas e cuidados com os olhos e narinas. Os pacientes com grau de incapacidade 2 e perda de membros devem ser encaminhados a unidades especializadas para uma reabilitação (BRASIL, 2017).
Outra forma importante de controle da doença é o exame de contatos. O exame de todos os contatos (independente da classificação operacional) deve ser conduzido com o objetivo de se obter o diagnóstico na fase inicial da doença, visando quebrar a cadeia de transmissão e evitar a ocorrência de incapacidades. Atenção especial deve ser dadas às crianças e idosos, pois são mais susceptíveis a manifestar mais rapidamente a doença e fazer parte da cadeia de transmissão.
1.2 Uso do espaço como unidade de análise
Uma das questões importantes, ainda pouco exploradas, é o padrão epidemiológico desigual de ocorrência da hanseníase e de outras endemias nos territórios. Conhecer melhor essas regiões, em termos de espaço físico e social para ocorrência de doenças, é um tema abordado em muitos estudos (MATOS et al., 1999; KERR-PONTES et al., 2004; BRASIL, 2013).
Para demonstrar a influência do espaço na transmissão de doenças foram se moldando teorias que se baseavam, principalmente, nas transmissíveis (COSTA & TEIXEIRA, 1999). Uma das mais importantes foi a teoria do foco natural das doenças por Pavlovsky, na década de 1930. Esta teoria afirmava que um foco natural existe quando se tem um meio com clima e solo específicos favoráveis à ocorrência da doença, atrelados à presença de doadores, vetores e receptores de determinada infecção (PAVLOVSKY, 1963; FERREIRA, 1991).
Dessa forma, o estudo da distribuição espacial das doenças vem se moldando, levando em consideração fatores determinantes, relacionando os aspectos biológicos aos aspectos ambientais e às relações sociais, que vão se modificando a depender do momento histórico e de fatores que os permeiam (COSTA & TEIXEIRA, 1999; LEMOS & LIMA, 2002).
A relação entre saúde e espaço pode ser analisada a partir de estudos em escalas ecológicas, para identificar fatores que possam estar associados a distribuição de doenças. O processo de organização do espaço geográfico, em diferentes momentos, se caracteriza como uma forma específica das populações humanas conhecerem a dinâmica das doenças. Esse processo permite entender o papel da organização do espaço na origem e na distribuição das doenças, bem como estabelecer um processo de vigilância adequado (LEMOS & LIMA, 2002).
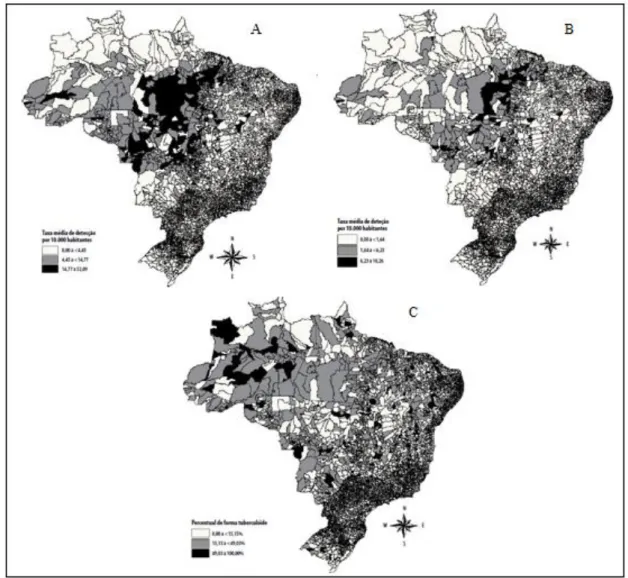
assim como a identificação dos espaços críticos de produção da doença. Os resultados sugeriram que há uma expansão da hanseníase em focos localizados nas regiões Norte, Centro-oeste e Nordeste relacionados ao crescimento de cidades e colonização agrícola da Amazonia (MAGALHÃES & ROJAS, 2007).
Figura 20 - Distribuição dos casos novos de hanseníase por municípios, Brasil, 2000 a 2002. A: taxa média de detecção de hanseníase; B: Taxa média de detecção de hanseníase em menores de 15 anos de idade; C: percentual médio de casos novos com forma tuberculóide.
Fonte: Adaptado de Magalhães & Rojas, 2007
e de prevalência de hanseníase, reforçando que indicadores socioeconômicos e ambientais também se mostram importantes preditores da doença (ALBUQUERQUE et al., 1989; ALENCAR et al., 2012a).
Dados referentes às condições de habitação, número de habitantes por domicílio, tamanho da família, escolaridade, fatores nutricionais, bem como fatores ambientais, influenciam diretamente no processo de determinação da ocorrência da doença em populações humanas (ANDRADE et al., 1994; LAPA et al., 2001; LOCKWOOD e SUNEETHA, 2005; KERR-PONTES et al., 2006).
Quando se conhece o espaço que envolve a doença, especificamente a hanseníase, pode-se identificar e limitar focos de transmissão. A partir disso, pode-se atuar na detecção precoce dos casos, que está intimamente ligada à prevenção de incapacidades dos indivíduos acometidos, sabendo-se que se trata de um dos grandes agravantes que envolvem a doença (BRASIL, 2010).
Estudos epidemiológicos, com desenho de agregados espaciais, estão sendo também utilizados nesse processo de conhecimento do espaço que interfere na ocorrência das doenças. Esse método se torna eficaz à medida que pode refletir uma análise mais perspicaz de fatores determinantes, quando visa captar informações em proporções coletivas, podendo produzir resultados, antes imperceptíveis, se analisados no âmbito individual (COSTA & TEIXEIRA, 1999; AMARAL &LANA, 2008; ALENCAR et al., 2012a).
Figura 21 - Primeiros 10 clusters de risco identificados no Brasil, 2008.
Fonte: PENNA et al, 2008.
• Análise espacial de dados
O uso do geoprocessamento na área da saúde é uma prática relativamente recente. Esse método vem se expandido, pois permite a organização de dados espaciais e construção de mapas temáticos (SANTOS & BARCELOS, 2006). Nesse processo, o Sistema de Informações Geográficas (SIG) se apresenta como ferramenta chave para alavancar tais informações, pois é um conjunto de sistemas computacionais utilizado para obter, guardar, gerenciar e analisar informações adquiridas por meios geográficos (SANTOS & BARCELOS, 2006; GAUY et al., 2007). Sem dúvida, é uma poderosa ferramenta que vem sendo reconhecida pela OMS como um importante componente no processo adicional à vigilância em saúde das doenças (GARNELO et al., 2005).
A análise da distribuição espacial de doença se mostra com pontos positivos e significantes no que tange à melhoria das ações de vigilância, monitoramento das doenças com incremento de dados geoestatísticos, organização espacial dos serviços de saúde e recursos humanos (CÂMARA et al., 2004; SANTOS & BARCELOS, 2006; GAUY et al., 2007; ALENCAR et al., 2012a).
entendimento e visualização da situação de uma população, obtendo informações acerca de regiões mais vulneráveis e/ou que tenham maior risco para acometimento de doenças, além de reconhecimento de fatores que influenciam nesse processo. Mais importante ainda é identificar se há uma semelhança de riscos entre populações diferentes, sabendo que nenhuma região é igual à outra. Assim, pode-se investigar melhor a relação desses fatores determinantes, planejar ações específicas e intervenções mais efetivas (GARNELO et al., 2005; SANTOS & BARCELOS, 2006). Pode-se assim, monitorar a distribuição espacial da hanseníase, conhecer suas características epidemiológicas por meio de análises gráficas a partir dos indicadores da doença e identificar áreas com maior risco de transmissão (GAUY et al., 2007).
• Método de suavização de dados espaciais
A utilização de mapas temáticos descritivos, principalmente na área da saúde, permite a visualização detalhada da distribuição de um determinado evento, a fim de identificar áreas semelhantes que predisponham a maior ocorrência do mesmo (SANTOS & SOUZA, 2007).
Algumas vezes pode-se optar por não utilizar os dados expressos por pontos exatos dos casos, mas contagem de áreas circunvizinhas aos casos, formando agregados espaciais, por delimitações geográficas ou administrativas. Essa agregação pode se dar por conveniência ou por representação da forma como os dados foram disponibilizados. Geralmente, esses mapas temáticos são apresentados a partir de coeficientes de incidência de uma determinada doença ou por meio de alguma outra medida epidemiológica de risco (ASSUNÇÃO et al., 1998; SANTOS & SOUZA, 2007).
Pode-se utilizar o método Bayesiano completo para estimar a função de densidade de probabilidade do risco relativo analisado espacialmente, levando em consideração fatores socioeconômicos e ambientais, além de indicadores de atenção à saúde. Sob a hipótese de não haver diferenças entre os coeficientes de incidência nas regiões, pode-se estimar o vetor de casos esperados para cada área, pela simples aplicação do coeficiente médio de incidência do setor censitário, município, unidade da federação, ou país, à população de cada uma destas áreas, no período de estudo estabelecido (SANTOS & SOUZA, 2007).
1.3 Justificativa
Apesar de todo o conhecimento científico sobre a história natural da doença; diagnóstico e tratamento hanseníase, ela permanece como um problema de saúde pública devido ao seu alto poder incapacitante, deformante, bem como ao estigma associado à esta enfermidade. Baseado no princípio de que a doença não ocorre ao acaso e que sua distribuição se dá de maneira desigual no espaço sendo estes os princípios mais importantes da epidemiologia, estudar o comportamento da hanseníase no espaço e tempo tendo como unidades de análise os municípios do Brasil se faz necessário. Isto poderá levar a identificação de áreas de maior risco bem como seu comportamento ao longo do tempo, buscando uma melhor compreenção da endemicidade da doença.
Informações epidemiológicas sobre a hanseníase, em particular sua distribuição geográfica tem se mostrado de grande valia para operacionalizar ações de controle direcionadas. No Brasil, os estudos abordam geralmente por macrorregiões e estados, não havendo um conhecimento sistematizado de sua distribuição espacial por municípios. Através de ferramentas disponíveis nos Sistemas de Informação à Saúde, representado pelo Departamento de Informática do SUS (DATASUS) e de uma das suas plataformas de dados, o SINAN e, em conjunto com as Secretarias de Vigilância em Saúde, é possível desenvolver uma análise mais detalhada até o nível municipal. E com os dados locais ainda pode ser possível identificar agregados de maior risco dentro dos próprios municípios.
2 OBJETIVOS
2.1 Objetivo Geral
Analisar os padrões espaciais, temporais e clínico-epidemiológicos da hanseníase no Brasil, 2001 a 2015.
2.2 Objetivos Específicos
1) Descrever os indicadores epidemiológicos e clínico-operacionais da hanseníase no Brasil de 2001 a 2015;
2) Analisar a tendência temporal da magnitude, transmissão recente e diagnóstico tardio da hanseníase no período de estudo;
3) Analisar a distribuição espacial de indicadores epidemiológicos e clínico-operacionais da hanseníase por município brasileiro.
3 MATERIAL E MÉTODOS
3.1 Tipo de estudo
Foi realizado um estudo ecológico sobre tendências espaciais e temporais com três cortes temporais da transmissão da hanseníase, com a identificação de áreas de alto risco. Foi analisada a distribuição espacial e quantificada a dependência espacial de diversos indicadores epidemiológicos e operacionais da hanseníase e sua relação com fatores socioeconômicos.
3.2 Local do estudo
O estudo foi conduzido através de informações coletadas a partir das informações obtidas das fichas de notificação compulsória para hanseníase (ANEXO 2) depositadas no SINAN. As secretarias municipais repassam as fichas para as estaduais que posteriormente alimentam o banco de informações do SINAN.
O Brasil é o quinto maior país do mundo em extensão territorial com 8.515.759,090 km 2 (BRASIL, 2017a). Está localizado na América Latina possuindo fronteiras com todos os
países, exceto Equador e Chile. Outro aspecto relevante é sua posição geográfica quanto às coordenadas geográficas, o território brasileiro estende-se desde aproximadamente 5º Norte até cerca de 33º Sul. Em termos longitudinais, a extensão vai desde os 35º Oeste até um pouco menos que os 75º Oeste. Segundo a Divisão Político Administrativa Brasileira, o país é dividido em 5.570 municípios, em 27 unidades administrativas, sendo 26 estados e um Distrito Federal (IBGE, 2016).
3.3 Fonte de dados
Os dados foram coletados a partir do SINAN, plataforma de dados contidas dentro do DATASUS. Foram incluídos casos novos de hanseníase notificados no período de 1o de
estão sujeitas e contribui para a caracterização da realidade epidemiológica de determinada área geográfica. O SINAN fornece, portanto, informação para a análise do perfil de morbidade permitindo o alerta de qualquer evento de caráter inusitado como surto ou epidemia. Como funções realiza o acompanhamento do perfil da morbidade e necessidade de intervenção (redução da carga de doenças imunopreviníveis e a cobertura vacinal) ou determina o comportamento sazonal para definir caráter endêmico e epidêmico. E ainda, permite identificar a desigualdade no padrão de morbidade entre diferentes áreas e avalia programas e serviços.
Os dados populacionais foram obtidos a partir do IBGE, baseados no censo populacional nacional de 2000, 2010 e nas estimativas oficiais das Pesquisas Nacionais das Amostras por Domicílio (PNAD).
3.4 Caracterização das etapas do estudo
O estudo foi subdivido em etapas de acordo com os objetivos e as características de desenho em que se desenvolvem.
Etapa 1: Análise descritiva dos indicadores de monitoramento e avaliação da hanseníase.
Tendo como base a Estratégia Global Aprimorada para Redução Adicional da Carga da Hanseníase (2016-2020), preconizada pela OMS, foram selecionados os indicadores, a saber:
a) indicadores que monitoram o progresso:
– coeficiente de detecção geral por 100.000 habitantes;
– coeficiente de detecção em menores de 15 anos de idade por 100.000 habitantes;
– coeficiente de casos novos com grau 2 de incapacidade física por 100.000 habitantes;
– proporção de pacientes que completaram o tratamento no tempo previsto.
b) indicadores que avaliam a detecção:
– proporção de casos novos com grau 2 de incapacidade física;
– proporção de casos novos em crianças < 15 anos;
– proporção de casos do sexo feminino entre casos novos;
c) indicadores que avaliam a qualidade dos serviços em hanseníase:
– proporção de casos novos com diagnóstico correto;
– proporção de abandono; -proporção de cura
O banco de dados foi trabalhado a fim de manter apenas os casos novos da doença, ou seja, quando a ficha de notificação entra no sistema e é confirmada o caso. A partir de então, os dados foram analisados através do programa Stata 15 (Stata Corporation, College Station, USA). Para o cálculo dos indicadores serão acrescentados os dados populacionais dos municípios para cada ano do estudo. Os cálculos foram feitos segundo orientações do SINAN Net Hanseníase (ANEXO 3).
No caso das séries temporais foram formados três quinquênios: 1) 2001 a 2005; 2) 2006 a 2010; 3) 2011 a 2015. As médias dos indicadores para cada quinquênio foram calculadas utilizando os valores populacionais do ano central, ou seja os dados dos anos 2003, 2008 e 2013. Para o periodo todo (2001 a 2015) foi utlizado os dados obtidos do censo de 2010.
Etapa 2: Análise de tendência temporal dos principais indicadores epidemiológicos e
operacionais da hanseníase.
Foi realizada a análise de tendência temporal através do cálculo do incremento percentual anual [do inglês, Annual Percent Change (APC)], dos indicadores do período total, 2001 a 2015, a partir do modelo de regressão por pontos de inflexão através dos Joinpoint Regression Program (versão 4.0.4). Este programa utiliza um algoritmo que testa se uma linha de múltiplos segmentos é significativamente melhor do que uma linha reta ou uma linha com menos segmentos. A análise de regressão do Joinpoint se une a uma série de linhas retas em uma escala logarítmica, a fim de detectar a tendência do valor anual do indicador. Cada joinpoint (se houver) indica uma alteração estatisticamente significativa no declive.
Etapa 3: Análise espaço-temporal por grupos
identificando possíveis áreas de maior risco para transmissão da doença. Foi aplicada a estratégia de dados de análise de áreas em polígonos. Primeiramente, foram confeccionados mapas descritivos da região com os indicadores brutos. Em seguida, os indicadores foram re-estimados por meio do método Bayesiano empírico local a partir da suposição de que taxas de áreas vizinhas são autocorrelacionadas (SANTOS & SOUZA, 2007).
Para tanto foi utilizada a ferramenta “Bayes Empírico Local”, disponível no programa Terraview (programa de domínio público) (Terraview 3.6.0., 2010). Também foi utilizado o programa SatScan (programa de domínio público) (Martin Kulldorf, Harvard Medical School, Boston andInformation Management Service Inc, Silver Spring, Maryland, USA) (KULLDORFF, 2006) para realizar a identificação de possíveis agregados, tendo como base o número de casos novos diagnosticados durante o período de estudo, por local de residência, e estimativas da população para o mesmo período.
Para a análise da autocorrelação espacial foi utilizado o Índice de Moran Local. Os métodos de análises gráficas deste índice foi realizada através dos Moran Maps, que mostraram apenas as áreas que apresentaram significância estatística (p<0,05), porém distribuídos em seus respectivos quadrantes.
Etapa 4: Identificação dos agregados através do método Scan espacial
Foi utilizado o programa SatScan (KULLDORFF, 2006) para realizar a identificação dos agregados tendo como base o número de casos novos diagnosticados durante o período de estudo por município de residência e estimativas da população para o mesmo período, obtidas a partir do IBGE (Censo, 2010). Para esta análise os dados foram organizados de forma diferenciada, sendo necessário criar um arquivo com todas as coordenadas das sedes municipais composto de todos os códigos dos municípios e as identificações de latitude e
longitude em graus, salvo com a extensão “.geo”. Um segundo banco necessário para a análise foi composto com todas as populações dos municípios de todos os anos de estudo, da mesma forma há a identificação do código do município seguido da população e do respectivo
ano, salvo na extensão “.pop”.
Em seguida, para a análise a ser realizada foi criado um banco específico para cada indicador do estudo. Este banco foi composto pelo código do município e o número absoluto de casos de acordo com cada variável e em cada ano do estudo. Este banco foi salvo na
A identificação de aglomerados foi feita pelo método proposto por Kulldorff e Nagarwalla (KULLDORFF, 1997; KULLDORFF & NAGARWALLA, 1995), que é uma estatística espacial de varredura. Identificação de agregados espaciais foi realizada no período completo de 2001 a 2015 com uma análise de cunho puramente espacial utilizando-se o modelo de distribuição de Poisson. Para ter maior segurança nos resultados foram realizadas 9999 interações, obtendo-se um valor p de maior validade estatística.
Este método varre uma área para identificar agregados, sem conhecimentos prévios de sua localização ou tamanho. O programa move uma janela circular em um mapa com o seu centro nas coordenadas das sedes municipais. Em cada posição, o raio da janela utilizado foi de 500 Km, e cada janela inclui diferentes grupos de municípios vizinhos, o método utilizado na definição do raio empírico.
Após a análise, o programa traz seis arquivos: um no formato “.txt” e cinco no formato
dBase, com informações diferenciadas sobre o risco relativo de cada agregado identificado, bem como dos municípios individualmente. Estes arquivos foram unidos à base geográfica inicial para a confecção de mapas temáticos através do ArcGis 10 (ESRI, 2010).
3.5 Aspectos éticos
4 RESULTADOS
4.1 Análise descritiva dos indicadores de monitoramento e avaliação da hanseníase
No período de 2001 a 2015, um total de 612.850 casos de hanseníase foi detectado no Brasil. O coeficiente médio de detecção geral de casos novos foi de 21,6 por 100.000 hab. ao ano. O ano de 2003 foi o que apresentou o maior coeficiente de detecção (28,70 casos por 100.000 hab) e o de 2015 o menor, com 14,21 casos por 100.000 hab. Até 2009, o país foi
classificado como “muito alto”, no entanto, a partir desse ano, vem decrescendo o número de casos e consequentemente este coeficiente. Mesmo com o decréscimo, o Brasil continua com este indicador sendo classificado como “alto” (Figura 22 e Apêndice 1).
Dentre o total de casos, 153.094 (24,98%) apresentaram algum grau de incapacidade no momento do diagnóstico. Uma observação importante é que 9,06% dos pacientes não foram avaliados quanto à presença GI. Em números absolutos 56.242 pessoas não foram avaliadas. Dentre os avaliados, 6% (36.826 casos) foram diagnosticados com GI2, sendo o coeficiente médio deste indicador de 1,29 por 100.000 hab., o Brasil é classificado como
“baixo”. Em 2007, pode ser observado um aumento deste indicador para 1,71 casos por 100.000 hab. Em todo o período de estudo este coeficiente mostrou-se estável (Figura 22 e Apêndice 1).
Figura 22 - Tendência temporal dos indicadores da hanseníase- coeficiente de detecção geral de casos novos e coeficiente de detecção de casos novos com grau 2 de incapacidade física. Brasil 2001 a 2015.
Fonte: próprio autor
0,0 0,5 1,0 1,5 2,0 0,0 5,0 10,0 15,0 20,0 25,0 30,0 35,0
2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 2015 Co
ef . ca so s no vo s co m G I2 Co ef icient e de det ec çã o ger al Ano
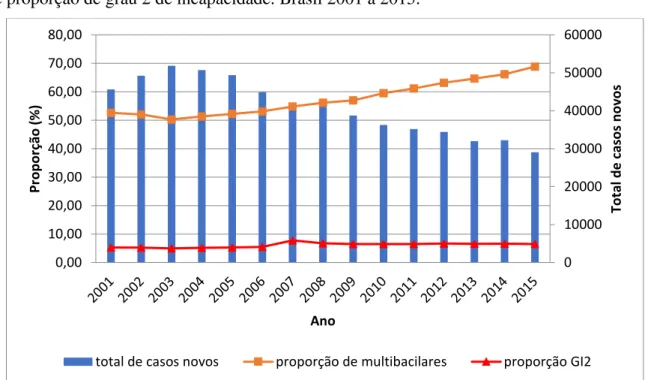
A proporção de casos com GI2 tem uma tendência de aumento, assim como a proporção de casos multibacilares. Nota-se que a partir do ano de 2007 houve um incremento de casos em ambos os indicadores. O país é classificado como “médio” para a proporção de
GI2. Não existe parâmetro para a proporção de multibacilares, mesmo sendo um indicador que alerta para o risco de complicações (GI2) (Apêndice 1). A proporção de casos entre as mulheres é inferior à ocorrência da doença em homens e segue uma tendência de estabilização. As Figura 23 e 24 apresentam a tendência temporal da proporção de GI2 e de multibacilares e casos no sexo feminino. Observa-se uma estabilidade no primeiro indicador e do último, no entanto a proporção de multibacilares vem aumentando chegando a quase 70% dos casos.
Figura 23 - Tendência temporal dos casos novos e o indicador proporção de multibacilares e de proporção de grau 2 de incapacidade. Brasil 2001 a 2015.
Fonte: arquivo próprio
0 10000 20000 30000 40000 50000 60000 0,00 10,00 20,00 30,00 40,00 50,00 60,00 70,00 80,00 To tal d e c asos n o v o s Pr o p o rç ão (% ) Ano
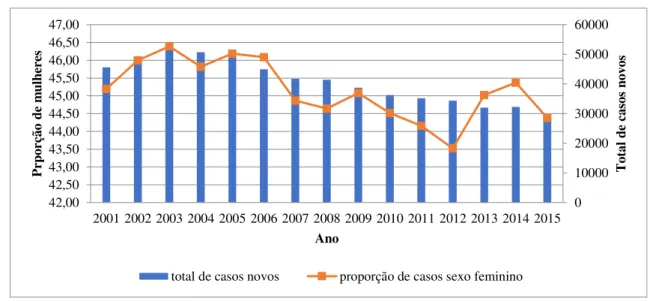
Figura 24 - Tendência temporal dos casos novos e o indicador proporção de casos novos femininos. Brasil 2001 a 2015.
Fonte: arquivo próprio
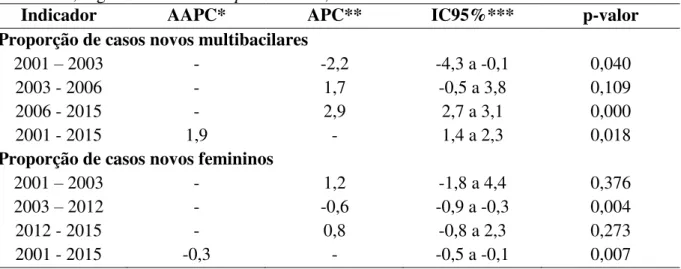
Em menores de 15 anos de idade, houve um total de 46.448 casos de hanseníase (7,5% do total) e o coeficiente médio de detecção de casos novos nesta população foi de 6,13 por 100.000 hab. (Apêndice 1). Os anos de 2003, 2004 e 2005 foram os que apresentaram os coeficientes de detecção mais elevados com 7,86 por 100.000, 7,94 casos por 100.000 hab. e 7,76 casos por 100.000 hab., respectivamente. Esses valores mensuram a força de transmissão recente da endemia e são considerados “muito altos”. Os coeficientes mais baixos foram identificados nos anos de 2011, 2012 e 2015, sendo 4,94/100.000, 4,81/100.000 e 4,55/100.000 habitantes, respectivamente. No último ano da análise o país ainda apresentou
este coeficiente considerado “alto” (Apêndice 1).
A Figura 25 mostra a tendência temporal dos dois indicadores (coeficiente de detecção geral e proporção de casos em menores de 15). Observa-se uma queda em ambos os indicadores após o ano de 2005 até o ano de 2012 e uma nova ascenção de casos que se manteve estável. 0 10000 20000 30000 40000 50000 60000 42,00 42,50 43,00 43,50 44,00 44,50 45,00 45,50 46,00 46,50 47,00
2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 2015
To ta l d e ca so s no vo s Prp or çã o de m ulh er es Ano
Figura 25 - Tendência temporal dos indicadores da hanseníase- coeficiente de detecção de casos novos e proporção de casos novos em menores de 15 anos. Brasil 2001 a 2015.
Fonte: arquivo próprio
A Figura 26 apresenta os indicadores que monitoram a qualidade do serviço para o controle da hanseníase. A proporção de pacientes com diagnóstico correto e tratados em tempo adequado apresentam uma colinearidade. A média dos dois primeiros indicadores
citados foi de 98,8%. A proporção de abandono é classificado como “bom”, pois a média deste indicador foi de 3,4%. Os valores referentes à proporção de abandono mostra uma queda importante, chegando a 0,3% o que faz com o Brasil seja classificado como “bom”.
6,00 6,50 7,00 7,50 8,00 8,50 0,00 1,00 2,00 3,00 4,00 5,00 6,00 7,00 8,00 9,00 P rop or ção de c asos Coe ficie nte d e d ete ção
Anos de estudo
Figura 26 - Tendência temporal dos indicadores da hanseníase- proporção de pacientes tratados em tempo adequado, proporção de diagnóstico correto e proporção de abandono. Brasil 2001 a 2015.
Fonte: arquivo próprio
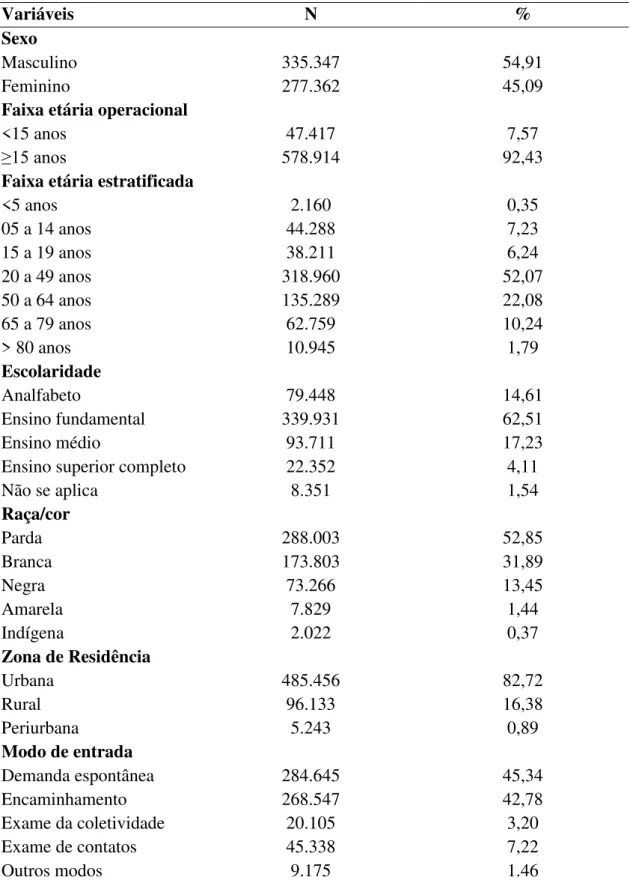
A maioria dos casos foram em pessoas do sexo masculino (54,9%) e a razão foi de aproximadamsnte 1,2 caso masculino para cada caso feminino. A faixa etária mais acometida foi a adulta jovem (20 a 49 anos) com 52,1% do total, seguida da adulta/idoso (50 a 64 anos) com 22,1%. A maioria dos acometidos tinha baixa escolaridade, 62,5% possuíam até o ensino fundamental e quando somado aos analfabetos, o valor foi de 76,2% do total dos casos. A raça/cor mais acometida foi a parda com 52,8%. A maioria das pessoas residiam em zona urbana (82,7%). O modo de entrada no serviço foi através da demanda espontânea com 45,3%. Além disso, 42,8% dos casos entraram no serviço através do encaminhamento (42,8%) (Tabela 1).
0 10000 20000 30000 40000 50000 60000 0 20 40 60 80 100 120
2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 2015
T ot al de ca so s Pro po rçã o (%) Ano
Tabela 01 - Caracterização demográfica dos casos novos de hanseníase no Brasil, 2001 a 2015.
Variáveis N %
Sexo
Masculino 335.347 54,91
Feminino 277.362 45,09
Faixa etária operacional
<15 anos 47.417 7,57
≥15 anos 578.914 92,43
Faixa etária estratificada
<5 anos 2.160 0,35
05 a 14 anos 44.288 7,23
15 a 19 anos 38.211 6,24
20 a 49 anos 318.960 52,07
50 a 64 anos 135.289 22,08
65 a 79 anos 62.759 10,24
> 80 anos 10.945 1,79
Escolaridade
Analfabeto 79.448 14,61
Ensino fundamental 339.931 62,51
Ensino médio 93.711 17,23
Ensino superior completo 22.352 4,11
Não se aplica 8.351 1,54
Raça/cor
Parda 288.003 52,85
Branca 173.803 31,89
Negra 73.266 13,45
Amarela 7.829 1,44
Indígena 2.022 0,37
Zona de Residência
Urbana 485.456 82,72
Rural 96.133 16,38
Periurbana 5.243 0,89
Modo de entrada
Demanda espontânea 284.645 45,34
Encaminhamento 268.547 42,78
Exame da coletividade 20.105 3,20
Exame de contatos 45.338 7,22
Outros modos 9.175 1.46
Tabela 2 - Características clínicas dos casos novos de hanseníase no Brasil, 2001 a 2015.
Variável N %
Classificação operacional
Paucibacilar 269.667 42,68
Multibacilar 362.130 57,32
Forma clínica
Dimorfa 218.372 36,20
Tuberculóide 138.649 22,98
Indeterminada 119.675 19,84
Virchowiana 102.765 17,03
Não classificado 23.799 3,95
Grau de incapacidade no momento do diagnóstico
Grau 0 403.898 65,04
Grau 1 122.162 19,67
Grau 2 38.744 6,24
Não avaliado 56.242 9,06
Baciloscopia
Negativa 108.998 38.98
Não realizada 97.742 34.96
Positiva 72.868 26,06
Esquema terapêutico
PB/6 doses 266.531 42,26
MB/12 doses 320.717 50,86
Esquemas alternativos 43.379 6,88
A tabela 3 apresenta os valores médios, mínimos e máximos de cada indicador avaliado no estudo.
Tabela 3 - Indicadores para monitoramento e avaliação da hanseníase no Brasil, 2001 a 2015.
Indicadores Brasil
Média Mínimo Máximo Indicadores para monitoramento do progresso da hanseníase
Coeficiente de detecção geral por 100.000 habitantes 21,6 14,2 28,7 Coeficiente de detecção em menores de 15 anos 6,1 4,5 7,9 Coeficiente de detecção de casos com grau 2 1,3 0,9 1,7 Proporção de pacientes com tratamento completo 98,8 99,3 98,4 Indicadores para avaliação da detecção de casos
Proporção de casos novos com grau 2 6,1 4,9 7,7
Proporção de casos novos em menores de 15 7,5 6,8 8,1
Proporção de casos femininos 45,1 43,5 46,4
Proporção de multibacilares 57,5 50,2 68,8
Indicadores que avaliam a qualidade do serviço em hanseníase
Proporção de casos com diagnóstico correto 98,8 98,4 99,3
Proporção de abandono 3,4 0,32 5,54