O
CROMO NA INDÚSTRIA DE CURTUMES DE
M
ATO
G
ROSSO DO
S
UL
,
B
RASIL
:
A
SPECTOS ECOLÓGICOS
T
ÂNIAC
HRISTINAM
ARCHESI DEF
REITASO
CROMO NA INDÚSTRIA DE CURTUMES DE
M
ATO
G
ROSSO DO
S
UL
,
B
RASIL
:
A
SPECTOS ECOLÓGICOS
Tese apresentada ao Programa Multiinstitucional de Pós-graduação em Ciências da Saúde – Rede Centro-Oeste, convênio Universidade de Brasília, Universidade Federal de Goiás e Universidade Federal de Mato Grosso do Sul, como parte dos requisitos necessários à obtenção de grau de Doutor em Ciências da Saúde
Orientador: Prof. Dr. Petr Melnikov
Freitas, Tânia Christina Marchesi de
O cromo na indústria de curtumes de Mato Grosso do Sul, Brasil: Aspectos ecológicos / Tânia Christina Marchesi de Freitas; orientador: Petr Melnikov. 2006
118 f. + xiv: il.
Tese (Doutorado) – Programa Multiinstitucional de Pós-Graduação em Ciências da Saúde – Rede Centro-Oeste, convênio Universidade de Brasília, Universidade Federal de Goiás e Universidade Federal de Mato Grosso do Sul. Campo Grande, 2006.
Inclui bibliografia.
Título em inglês: Chromium in the tanning industry in Mato Grosso do Sul, Brazil: ecological issues
TÂNIA CHRISTINA MARCHESI DE FREITAS
O CROMO NA INDÚSTRIA DE CURTUMES DE MATO GROSSO DO SUL,BRASIL:
ASPECTOS ECOLÓGICOS
B
ANCAE
XAMINADORAPRESIDENTE:
Prof. Dr. Petr Melnikov UFMS
TITULARES:
Prof.a Dr.a Emilia Maria Silva UEMS
Prof. Dr. Gilson Arimura Arima UCDB
Prof. Dr. Leonardo Rigo
Prefeitura Municipal de Campo Grande
Prof. Dr. Silvio César de Oliveira UFMS
SUPLENTE:
Prof.a Dr.a Maria de Fatima Cepa Matos UFMS
Ao meu amado filho, Pedro, o sentido mais profundo de minha vida.
A
GRADECIMENTOSMeus agradecimentos especiais aos que me ajudaram concretamente a elaborar e desenvolver esta pesquisa.
Entre eles, em primeiro lugar, está meu orientador, Prof. Dr. Petr Melnikov, a quem agradeço pela competência, sabedoria, abnegação e generosidade em dividir suas experiências. O verdadeiro professor-mestre, sempre disposto a ensinar. Um privilégio em minha vida acadêmica.
Também sou muito grata aos professores Dr. Carlos Nobuyoshi Ide e Mestre Jorge Gonda, da UFMS, pelo estímulo e, principalmente, por haverem viabilizado o acesso ao Laboratório LAQUA dessa Instituição, para a realização da maior parte das análises desse experimento. Quero destacar meus agradecimentos especiais ao Mestre José Luiz Gonçalves, incansável no trabalho do Laboratório LAQUA, pela presteza na realização das análises e pelas proposições que enriqueceram este trabalho. Agradeço, igualmente, à coordenação e aos professores do programa Multiinstitucional de Pós-graduação em Ciências da Saúde da UFMS na pessoa do Dr Ricardo Dutra Aydos.
Gostaria, ainda de agradecer pela significativa colaboração dos funcionários do Laboratório da Bioagri Ambiental, em Piracicaba, SP, que se colocaram amavelmente a minha disposição durante a realização de parte desta pesquisa, pelo carinho, gentileza e alegria nos dias compartilhados.
Aos responsáveis técnicos e funcionários dos curtumes, que entenderam a proposta deste trabalho e gentilmente me auxiliaram a desenvolvê-lo, pela ajuda nas coletas e pelos ensinamentos sobre a prática diária desse setor industrial.
A meus colegas da Universidade Estadual de Mato Grosso do Sul, pela compreensão e apoio.
Aos colegas de trabalho da SANESUL, pela contribuição espontânea, valiosa e efetiva, juntamente com o apoio e a compreensão que sempre demonstraram desde o início deste Doutorado. Em especial, aos amigos do Laboratório Central, pela ajuda constante e diária na realização das análises e pelo apoio incondicional durante o desenvolvimento deste trabalho.
Aos meus pais, Chiquinho (in memoriam) e Zuleika, pelos valores repassados
sustentáculo da família. Às minhas irmãs, Márcia, Angélica, Luiza e Claudia, por me incentivarem a realizar este sonho e a concluir mais uma etapa de minha vida.
À minha amiga e colega de Doutorado, Sandra, companheira de todas as horas, pelos longos telefonemas, discussões, ensinamentos, dicas, conferências filosóficas, apoio moral, desabafos... Às minhas grandes amigas e comadres Vera Lúcia e Maria Maciel, com quem compartilhei todos os momentos desta jornada.
Ao Yves, que apesar da distância geográfica que nos separa esteve sempre presente nos meus dias.
R
ESUMOTodas as formas de cromo podem ser tóxicas, mas o cromo VI na forma de cromatos é mais perigoso do que o cromo III. Conseqüentemente, todos os tipos de cromo e seus compostos são de grande importância nos estudos ambientais, uma vez que, em concentrações excessivas, o elemento é prejudicial à saúde, podendo estar relacionado com a patogenia de uma série de doenças. No estado de Mato Grosso do Sul, a poluição por cromo decorre do processo de curtimento do couro. Nesse tipo de indústria, a maior concentração de cromo é encontrada no lodo, embora ainda estejam pouco documentados as formas e tipos de componentes do cromo que vêm sendo incorporados aos efluentes líquidos de curtumes.
Neste estudo, as concentrações de cromo III e cromo VI foram avaliadas nos efluentes de três curtumes localizados no estado de Mato Grosso do Sul, designados por A, B e C. Os compostos de cromo foram detalhadamente caracterizados nos efluentes dos curtumes estudados, bem como nas águas naturais e sedimentos dos rios que recebem esses efluentes. Foram também realizados testes microbiológicos de toxidade aguda por cromo III.
Os procedimentos analíticos incluíram técnicas de absorção atômica e colorimetria. Verificou-se que o único tipo de cromo presente nos efluentes dos curtumes avaliados é o cromo III, não sendo detectado cromo VI. Quanto aos níveis de cromo III encontrados nas emissões desses curtumes, conclui-se que, na maioria das amostras, estes não satisfaziam as exigências da legislação em vigor.
No que se refere às águas e sedimentos das nascentes dos corpos receptores, nenhuma contaminação por cromo foi observada. A análise das alterações provocadas nos corpos hídricos após a incorporação dos efluentes dos curtumes revelou degradação da qualidade da água, mais pronunciada no curtume A. A análise das alterações provocadas pelos efluentes nos sedimentos dos rios a jusante dos lançamentos dos curtumes A e C indicou certo aumento da concentração de cromo. A concentração
efetiva que causa efeito tóxico agudo a Daphnia similis mostrou-se maior que o valor
estipulado para cromo na legislação.
Para minimizar os efeitos indesejáveis do cromo emitido pela indústria de processamento de couro, foi elaborada uma série de recomendações técnicas.
A
BSTRACTAll forms of chromium can be potentially toxic, but chromium VI in the form of chromate is more dangerous than chromium III. Consequently total chromium and its components are of great importance in environmental studies, since its excessive concentration is detrimental to health, as it could be involved in the pathogenesis of a series of diseases. In the Brazilian state of Mato Grosso do Sul, the largest source of chromium pollution is the tanning process. The highest concentrations of chromium are found in sludge, but the forms and fate of chromium compounds discharged as liquid effluents from tanneries are less well documented.
In this study the concentrations of Cr (III) and Cr (VI) were evaluated in the effluents of the tanneries A, B and C located in Mato Grosso do Sul. Chromium was fully speciated in the final effluent of tanneries as well as in natural waters and sediments. Microbiological tests for chromium III toxicity were also performed. Analytical determinations were carried out using atomic absorption and colorimetric techniques.
It was shown that chromium III is the only chromium species present in the effluents of the tanneries selected to study metal emissions. Meanwhile, no trace of chromium VI was detected. With respect to the levels of chromium III, these cannot be considered as fitting to the requirements of the existing legislation. No contamination of waters and sediments from upstream to tanneries was observed.
It was shown that after discharge of the effluents the water quality degraded downstream to the tanneries, in particular after the mixing of wastewaters from tannery A. The analysis of alterations provoked by the wastewaters in the sediments downstream to tanneries A and C indicated a slight increase in chromium content. The
acute toxic effect measured by the surviving population of Daphnia similis was found to
be much lesser than that stipulated by the legislation.
A series of recommendations has been proposed in order to minimize undesirable effects of chromium from the leather processing industry.
L
ISTA DE TABELASTabela 1. Reduções obtidas após tratamento físico-químico (Centro Tecnológico do Couro, RS) ... 32 Tabela 2. Insumos que caracterizam o processo de curtimento do couro do
curtume A ... 43 Tabela 3. Insumos que caracterizam o processo de curtimento do couro do
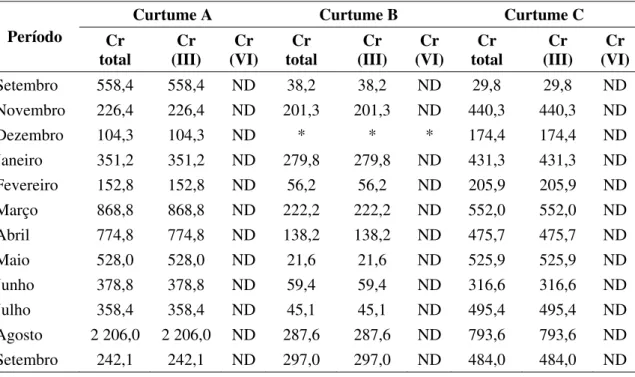
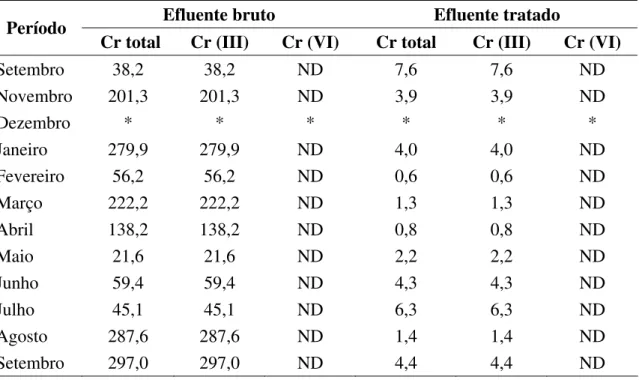
curtume B ... 44 Tabela 4. Concentrações de cromo (mg/L) nos efluentes brutos de três curtumes, (mg/L). Mato Grosso do Sul, 2004-2005 ... 59 Tabela 5. Valores máximos, mínimos e medianos das concentrações de cromo
III nos efluentes brutos de três curtumes. Mato Grosso do Sul, 2004-2005 ... 60
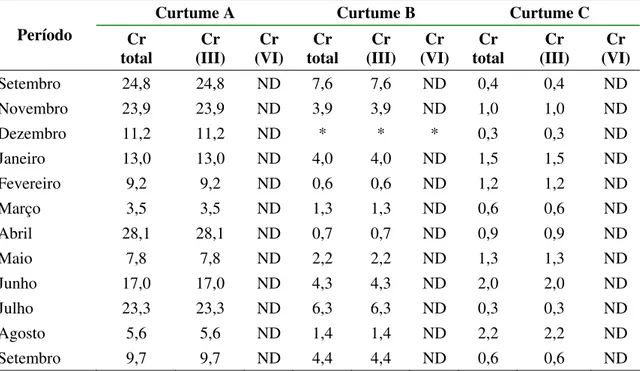
Tabela 6. Concentrações de cromo (mg/L) nos efluentes tratados de três
curtumes. Mato Grosso do Sul, 2004-2005 ... 60 Tabela 7. Valores máximos, mínimos e medianos das concentrações de cromo
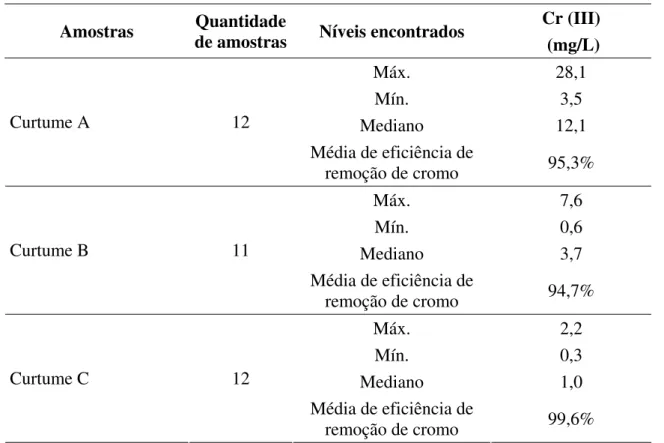
III nos efluentes tratados de três curtumes e percentuais médios de eficiência de
remoção de cromo nos processos de tratamento. Mato Grosso do Sul, 2004-2005 61
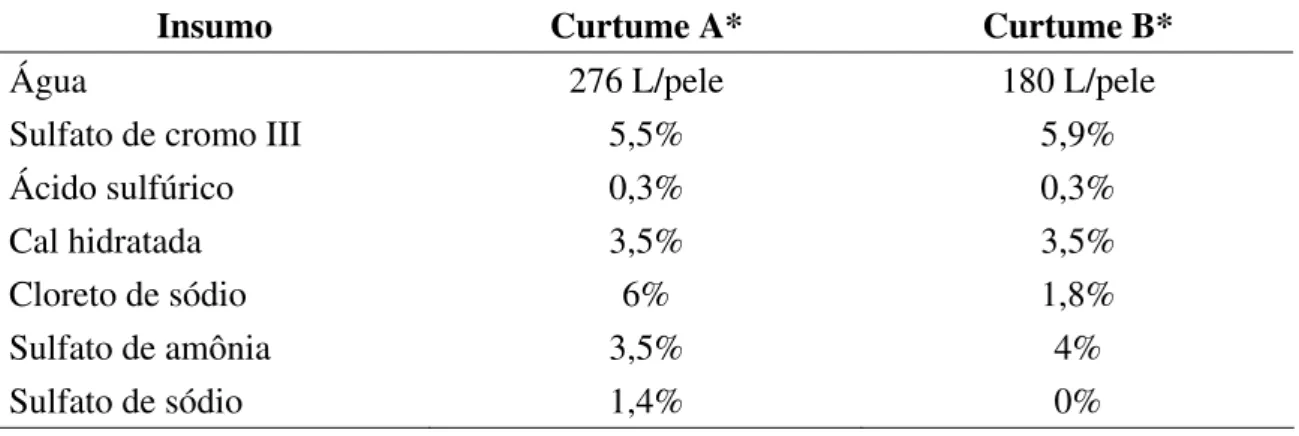
Tabela 8. Insumos utilizados no curtimento de peles em dois curtumes. Mato
Grosso do Sul, 2004-2005 ... 70 Tabela 9. Concentrações de cromo (mg/L) nos efluentes brutos e tratados do
curtume A. Mato Grosso do Sul, 2004-2005 ... 71 Tabela 10. Concentrações de cromo (mg/L) nos efluentes brutos e tratados do
curtume B. Mato Grosso do Sul, 2004-2005 ... 71 Tabela 11. Estatísticas descritivas para as concentrações de cromo III (mg/L)
nos efluentes brutos dos curtumes A e B e resultados do teste de Kruskal–Wallis 72
Tabela 12. Estatísticas descritivas para as concentrações de cromo III (mg/L) nos efluentes tratados dos curtumes A e B e resultados do teste de Kruskal–
Wallis ... 72 Tabela 13. Concentrações de cromo (mg/L) em função das taxas de mistura.
Simulação do processo ... 74 Tabela 14. Concentrações de cromo (mg/L) no corpo receptor dos efluentes do
curtume A. Mato Grosso do Sul, 2004-2005 ... 82 Tabela 15. Concentrações de cromo (mg/L) no corpo receptor dos efluentes do
curtume B. Mato Grosso do Sul, 2004-2005 ... 84 Tabela 16. Concentrações de cromo (mg/L) no corpo receptor dos efluentes do
curtume C. Mato Grosso do Sul, 2004-2005 ... 85 Tabela 17. Concentrações de cromo nos sedimentos de dois rios que recebem
L
ISTA DE QUADROSQuadro 1. Concentrações médias de cromo no ambiente, segundo dados
internacionais ... 4
Quadro 2. Toxicidade do cromo a organismos vivos ... 15
Quadro 3. Curtumes instalados em Mato Grosso do Sul ... 23
Quadro 4. Caracterização de efluentes brutos em sistemas sem reciclagem de cromo ... 27
Quadro 5. Caracterização de efluentes brutos em sistemas com reciclagem de cromo ... 28
Quadro 6. Remoção de cromo de efluentes tratados provenientes de curtumes ... 62
Quadro 7. Padrões de lançamento de cromo em corpos d’água ... 64
Quadro 8. Requisitos de ensaio de toxicidade aguda com Daphnia similis ... 106
Quadro 9. Resultados do teste definitivo com Daphnia similis ... 106
L
ISTA DE FIGURAS,
FLUXOGRAMAS,
DIAGRAMAS E GRÁFICOS Figura 1. Ciclo do cromo no solo e na água ... 21Fluxograma 1. Tratamento primário de efluentes de curtumes ... 30
Fluxograma 2. Tratamento de efluentes do curtume A, Mato Grosso do Sul ... 55
Fluxograma 3. Tratamento de efluentes do curtume B, Mato Grosso do Sul ... 57
Fluxograma 4. Tratamento de efluentes do curtume C, Mato Grosso do Sul ... 58
Diagrama 1. Sistema redox do cromo ... 5
Diagrama 2. Caminhos eventuais de cromo III no corpo humano, com base em dados humanos e animais ... 13
Diagrama 3. Processo de produção de couro ... 25
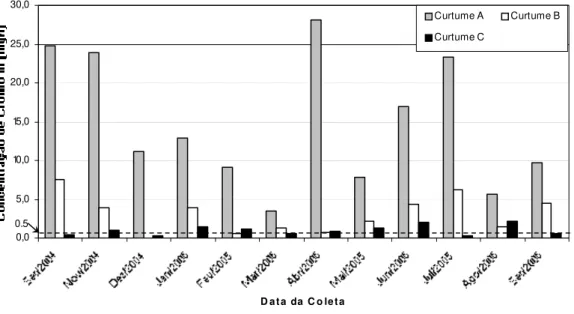
Gráfico 1. Concentração de cromo III em relação ao valor-padrão (0,5 mg/L) nos efluentes tratados de três curtumes de Mato Grosso do Sul durante 12 meses de acompanhamento (2004-2005) ... 65
Gráfico 2. Concentração de cromo III em relação ao valor de referência (76 mg/L) nos efluentes brutos de dois curtumes de Mato Grosso do Sul durante 12 meses de acompanhamento (2004-2005) ... 73
L
ISTA DES
IGLASAlém dos símbolos que designam elementos químicos, dos que fazem parte do Sistema Internacional de Unidades e de representações correntes nos estudos químicos, fez-se uso das seguintes notações neste trabalho:
APHA American Public Health Association
CE50 Concentração efetiva média
CECA Conselho Estadual de Controle Ambiental
Cetesb Companhia de Tecnologia de Saneamento Ambiental
CONAMA Conselho Nacional do Meio Ambiente
DBO5;20 Demanda bioquímica de oxigênio (5 dias, a 20°C)
DQO Demanda química de oxigênio
EAA Espectrofotometria de absorção atômica
EIA Estudo de impacto ambiental
EPA Environmental Protection Agency
OD Oxigênio dissolvido
RIMA Relatório de impacto ambiental
SEMA Secretaria de Estado de Meio Ambiente e Recursos Hídricos de Mato
Grosso do Sul
S
UMÁRIOResumo ... vi
Abstract ... vii
Lista de tabelas ... viii
Lista de quadros ... ix
Lista de figuras, fluxogramas, diagramas e gráficos ... ix
Lista de siglas e símbolos ... x
1. INTRODUÇÃO... 1
2. REVISÃO BIBLIOGRÁFICA... 3
2.1. BREVE NOÇÃO SOBRE A QUÍMICA INORGÂNICA DO CROMO... 3
2.1.1. Propriedades do cromo... 3
2.1.2. Ocorrência... 4
2.1.3. Química do cromo... 4
Cromo III ... 6
Tipos de complexos de cromo III ... 7
Cromo VI ... 8
2.2. ASPECTOS BIOQUÍMICOS DO METABOLISMO DO CROMO... 9
2.2.1. Interação com moléculas bioativas ... 9
Interação com proteínas e enzimas ... 9
Interação com polinucleotídeos ... 10
2.2.2. Interação com tecidos... 10
Absorção, distribuição e excreção do cromo... 11
Absorção ... 11
Absorção pela pele ... 11
Absorção gastrointestinal... 12
Distribuição e excreção... 12
2.3. ASPECTOS TOXICOLÓGICOS... 15
2.3.1. Toxicidade ao homem... 15
Toxicidade aguda ... 16
Toxicidade crônica... 16
2.3.2. Carcinogenicidade... 17
2.3.3. Toxicidade a organismos aquáticos ... 18
2.4. COMPORTAMENTO DO CROMO NO MEIO AMBIENTE ... 19
2.4.1. Água ... 19
Solubilidade em água dos íons acompanhantes do cromo... 19
Solubilidade dos complexos de cromo III... 20
2.4.2. Solo ... 20
Oxidação e redução do cromo no solo... 20
2.4.3. Comportamento do cromo a respeito de vários organismos vivos ... 22
2.5. O CROMO E SEUS COMPOSTOS NO SETOR INDUSTRIAL DE MATO GROSSO DO SUL... 22
2.5.1. Processo de industrialização envolvendo o cromo ... 24
2.6. CARACTERIZAÇÃO DOS RESÍDUOS LÍQUIDOS E FORMA DE ELIMINAÇÃO DO CROMO NAS INDÚSTRIAS... 27
2.6.2. Tratamento secundário (biológico) ... 32
2.7. MECANISMOS DE DETECÇÃO DE CROMO... 33
2.7.1. Técnicas de análise química ... 33
Método da 1,5-difenilcarbazida – DR/2000 Hach ... 33
Espectrofotometria de absorção atômica ... 34
Método DPC colorimétrico da 1,5-difenilcarbazida ... 34
2.7.2. Teste de toxicidade aguda com Daphnia similis (NBR 12713/2004) ... 35
2.8. MECANISMOS LEGAIS DE CONTROLE DO CROMO... 36
2.8.1. Legislação sobre o controle da poluição por cromo ... 36
Padrão de qualidade de cromo nas águas superficiais ... 36
Padrões de emissão de cromo ... 37
2.8.2. Controle do cromo na água para consumo humano... 38
2.8.3. Fiscalização ... 38
3. JUSTIFICATIVA... 40
4. OBJETIVOS ... 41
Objetivo geral ... 41
Objetivos específicos ... 41
5. MATERIAL E MÉTODOS ... 42
5.1. IDENTIFICAÇÃO DOS CURTUMES ... 42
Descrição do curtume A ... 42
Descrição do curtume B ... 43
Descrição do curtume C ... 44
5.2. COLETA E PREPARAÇÃO DAS AMOSTRAS ... 45
5.2.1. Efluentes líquidos ... 45
Cromo total ... 46
Cromo hexavalente ... 46
5.2.2. Água ... 46
Cromo total ... 47
Cromo hexavalente ... 48
5.2.3. Sedimentos de superfície ... 48
Cromo total ... 49
5.2.4. Teste de toxicidade aguda a Daphnia similis utilizando amostras contaminadas com cromo trivalente ... 49
5.3. REALIZAÇÃO DAS ANÁLISES ... 50
5.4. ANÁLISE ESTATÍSTICA DOS DADOS... 50
6. RESULTADOS E DISCUSSÃO ... 51
6.1. EMISSÃO DE CROMO POR CURTUMES EM MATO GROSSO DO SUL... 51
6.1.1. Introdução ... 51
6.1.2. Sistemas de tratamento de efluentes líquidos ... 53
Curtume A ... 53
Curtume B ... 56
Curtume C ... 58
6.1.3. Resultados e discussão ... 59
6.1.3.1. Concentração de cromo nos efluentes brutos dos curtumes A, B e C ... 59
6.1.3.2. Concentração de cromo nos efluentes tratados dos curtumes A, B e C ... 60
Espécies de cromo ... 61
Remoção de cromo ... 62
Emissão de cromo III ... 63
Fatores externos que intervêm na emissão do cromo ... 67
6.1.4. Conclusões ... 68
6.2. O USO E OS IMPACTOS DA RECICLAGEM DE CROMO NAS INDÚSTRIAS DE CURTUME EM MATO GROSSO DO SUL ... 68
6.2.1. Introdução ... 68
6.2.2. Resultados e discussão ... 70
6.2.2.1. Quantidade de insumos utilizados nos processos industriais dos curtumes A e B ... 70
6.2.2.2. Concentração de cromo nos efluentes dos curtumes A e B ... 70
6.2.2.3. Flutuação dos dados de efluentes ... 73
6.2.3. Conclusões ... 74
6.3. CONTAMINAÇÃO POR CROMO NAS ÁGUAS DE RIOS RECEPTORES DE EFLUENTES DE CURTUMES EM MATO GROSSO DO SUL... 75
6.3.1. Introdução ... 75
6.3.2. Parâmetros e padrões de qualidade da água ... 77
6.3.3. Caracterização dos corpos receptores dos efluentes dos curtumes ... 80
Corpo receptor dos efluentes dos curtumes A e C ... 80
Corpo receptor do efluente do curtume B ... 80
6.3.4. Resultados e discussão ... 80
6.3.4.1 Qualidade das águas do corpo receptor do curtume A... 81
6.3.4.2. Qualidade das águas do corpo receptor do curtume B ... 83
6.3.4.3. Qualidade das águas do corpo receptor do curtume C ... 85
6.3.4.4. Análise dos possíveis impactos sobre o meio ambiente e sobre a saúde pública decorrentes da contaminação das águas por cromo ... 86
6.3.5. Conclusões ... 87
6.4. AVALIAÇÃO DA CONCENTRAÇÃO DE CROMO EM SEDIMENTOS DE RIOS RECEPTORES DE EFLUENTES DE CURTUMES EM MATO GROSSO DO SUL ... 89
6.4.1. Introdução ... 89
6.4.2. Presença de cromo em sedimentos ... 90
Padrões de referência para cromo em sedimentos ... 91
6.4.3. Resultados e discussão ... 93
6.4.3.1. Análise de cromo nos sedimentos dos corpos receptores dos efluentes dos curtumes A, B e C ... 93
6.4.4. Conclusões e recomendações ... 95
6.5. AVALIAÇÃO DA TOXICIDADE AGUDA DE CROMO III EM RELAÇÃO A DAPHNIA SIMILIS ... 96
6.5.1. Introdução ... 96
6.5.2. Metodologia ... 98
Organismos-teste ... 99
Reagentes ... 100
Teste de referência e viabilidade ... 102
Viabilidade da água de cultivo e diluição para o teste ... 103
Manutenção e cultivo de Daphnia similis ... 103
6.5.3. Resultados e discussão ... 104
6.5.3.1.Ensaio de avaliação da toxicidade aguda de cromo III (CE50;48h) a Daphnia similis ... 104
6.5.3.3. Teste definitivo ... 105
6.5.3.4. Determinação da medida CE50;48h ... 106
6.5.4. Conclusões ... 108
7. CONCLUSÕES E RECOMENDAÇÕES ... 109
7.1 CONCLUSÕES ... 109
7.2. RECOMENDAÇÕES ... 110
Referências ... 111
O cromo é um elemento bioativo que, embora presente no organismo em pequenas quantidades, realiza importantes funções, particularmente no metabolismo da glicose. No entanto, quando em concentrações elevadas, e sobretudo em estado de oxidação diferente de III, é potencialmente perigoso à saúde e ao equilíbrio ambiental (NRIAGU; NIEBOER, 1988).
Dada a toxicidade de seus compostos hexavalentes (mais tóxicos e mais voláteis) e das formas trivalentes (de toxicidade essencial), o uso de cromo nas atividades domésticas e industriais tem sido objeto de interesse, particularmente em termos de sua circulação e de suas emissões na atmosfera, assim como de seu transporte e transformações.
Seus usos mais comuns e, por conseguinte, suas principais fontes no meio ambiente são a mineração e as indústrias de cromagem e de curtimento de couro para confecção de bens de consumo. Ressalte-se que a legislação brasileira impõe uma série de regras rigorosas aos projetos industriais que utilizam esse elemento.
O cromo é usado em grande escala para a transformação de peles de animais em um produto resistente à biodegradação: o couro. O composto usado nesse processo é
o sulfato de cromo III — Cr2(SO4) ⋅ xH2O —, comumente referido como sal de cromo.
O composto promove o enrijecimento da pele, garantindo a preservação do produto final.
Em Mato Grosso do Sul, o estado com maior produção de bovinos no Brasil, estão atualmente instalados 11 curtumes, na maioria dos quais a produção de couro se
estende até o produto pré-fabricado conhecido como wet-blue. O couro wet-blue é
positivo, ela gera uma preocupação quanto aos compostos de cromo, pois a ausência de um adequado controle das emissões e difusões pode ocasionar poluição e levar a conseqüente risco à saúde pública.
Que seja de nosso conhecimento, não se dispõe ainda de nenhum estudo a respeito do impacto do lançamento de cromo em cursos d’água em Mato Grosso do Sul. Isso leva à necessidade de avaliar as concentrações de cromo nesse tipo de atividade industrial, suas emissões e os impactos causados por esse poluente. Faz-se, portanto necessário contar com um conhecimento profundo das fontes e do comportamento desse elemento.
Este estudo visa investigar o transporte e transformações característicos do cromo emitido pelo setor industrial e suas interações no meio ambiente, de modo a poderem-se avaliar tanto os mecanismos de produção e tratamento utilizados pelas indústrias quanto o impacto de seus efluentes no meio ambiente.
2.
R
EVISÃO
B
IBLIOGRÁFICA
2.1.
B
REVE NOÇÃO SOBRE A QUÍMICA INORGÂNICA DO CROMO2.1.1. Propriedades do cromo
Cromo (Cr):
– Metal branco, brilhante, que se deixa limar e polir e que é duro e resistente à corrosão.
– Massa atômica: 52,0.
– Ponto de fusão: 1 890 °C.
– Ponto de ebulição: 2 482 °C.
– Densidade: 7,14 g/cm3.
– É insolúvel na água, mas solúvel em ácidos fortes.
– Não se oxida ao ar à temperatura ambiente.
– Forma três séries de compostos que derivam do protóxido, sesquióxido e óxido de cromo VI (respectivamente, CrO, Cr2O3 e CrO3).
– É considerado um metal pesado devido a sua densidade1 e metal de transição por
possuir a propriedade de formar compostos de coordenação (INTERNATIONAL LABOUR OFFICE, 1974).
2.1.2. Ocorrência
O cromo não é encontrado em forma livre na natureza. Seu mais importante minério é a cromita, amplamente distribuída na superfície terrestre. O cromo é o 17.º elemento não-gasoso mais abundante na crosta terrestre, apresentando concentração de
cerca de 80 a 200 mg/kg, com média de 125 mg/kg (SCHOEREDER, 1970, apud
NRIAGU; NIEBOER, 1988).
Embora o cromo apresente graus de oxidação de Cr2+ a Cr6+, a forma trivalente é a mais comum na natureza. O elemento está presente no ar, em alguns alimentos e faz parte de muitos sistemas biológicos, sendo reconhecido como elemento-traço essencial para o homem. No solo, é encontrado naturalmente em concentrações variáveis, porém inferiores às consideradas tóxicas para os diversos organismos. A presença de cromo na água é atribuída a atividades humanas que têm esse elemento como subproduto que acaba sendo transportado direta ou indiretamente para os corpos d’água (KOTAS; STASICKA, 2000).
O cromo tem sido reconhecido como potencialmente perigoso à saúde humana e à biota aquática por agências de controle ambiental de todo mundo, e estando entre as mais freqüentes descargas de fontes pontuais de poluição (KOTAS; STASICKA, 2000).
O Quadro 1 apresenta dados genéricos sobre a presença de cromo no solo, no ar e nas águas. A concentração média de cromo encontrada nos solos do Brasil varia de
4 a 145 mg/kg (ANDREOLI et al., 2001).
Quadro 1. Concentrações médias de cromo no ambiente, segundo dados internacionais.
Ar Água superficial abastecimento Água de Solo
2 a 5 ng/m3 1,0 a 10 µg/L < 5 µg/L 5 a 1 500 mg/kg
Fontes: Andreoli et al. (2001); Canadian Water Guidelines (1993); Helou (2000); WHO (1996), apud Andreoli et al. (2001).
2.1.3. Química do cromo
quanto em soluções aquosas naturais e nas de uso industrial. As inter-relações entre os estados de oxidação são apresentadas no Diagrama 1.
Diagrama 1. Sistema redox do cromo.
≥ 1,2 V –0,74 V
+2 e (+2 e)
< 1,0 V > 1,2 V > 1,5 V –0,41 V –0,91V CrO42–--- CrO43–---Cr (IV)---Cr (III)---Cr (II)---Cr0
(VI) +1 e (V) +1 e +1 e +1 e +2 e
E0 (pH 7,4) = 0,3 - 0,5V
+3 e
Fonte: Weatheimer (1949), apud Nriagu e Nieboer (1988).
Nos aspectos termodinâmicos, os valores positivos do potencial-padrão elétrico
(E0) indicam que a forma reduzida é favorecida, enquanto os valores negativos denotam
que as espécies oxidadas são relativamente mais estáveis. Desse modo, o diagrama de potencial de redução revela que o cromo III é a forma mais estável de cromo em solução, pois seria consideravelmente alta a energia requerida para convertê-lo em estado de oxidação mais alto ou mais baixo.
Apesar de o íon CrO42– ser relativamente estável, seu alto potencial de redução
mostra que ele é fortemente reduzível e instável em solução ácida e na presença de
elementos doadores de elétrons, tais como Fe2+, H3AsO3 e moléculas orgânicas com
grupos oxidáveis (aldeídos, acetona, ácidos carboxílicos e mercaptanas) (WIBERG,
1965, apud NRIAGU; NIEBOER, 1988; BEATTIE; HAIGHT, 1972, apud NRIAGU;
NIEBOER, 1988). Em valores de pH fisiológicos ou maiores, CrO42– é a forma menos
reativa.
As formas do cromo V são derivadas do ânion CrO43– e têm longevidade
recobrimento das fitas magnéticas, em forma de CrO2. O íon cromo IV e seus
compostos em soluções não são estáveis e, devido a suas vidas curtas, desafiam a detecção com reações intermediárias entre CrO42– e cromo III.
Como regra, os elementos nos estados de oxidação mais baixos comportam-se
como espécies básicas (Cr2+) e, nos estados de oxidação mais altos, como ácidos
(CrO42– e Cr2O72–). Os estados intermediários — neste caso, os compostos de Cr (III) e
Cr (IV) — são anfóteros, dependendo da substância com que reajam:
Cr2O3 + 6HCl → 2CrCl3 + 3H2O (comportamento básico)
Cr2O3 + 2NaOH → 2NaCrO2 + H2O (comportamento ácido)
Os valores negativos de E0 para cromo III e cromo II indicam que este último é
um forte agente redutor, doando elétrons prontamente e, em conseqüência, oxidando-se a cromo III. Somente sob condições anaeróbias estritas o cromo II é estável em solução aquosa. Mesmo assim, ele e seus compostos decompõem-se vagarosamente por meio de redução da água, com liberação de gás hidrogênio (GREENWOOD; EARNSHAW, 1998)
Cromo III
A afinidade do cromo III por íons óxidos e hidróxidos é consideravelmente baixa, e numerosos complexos com outros ligantes são possíveis. Muitas espécies complexas de cromo III podem ser isoladas ou são estáveis em solução. Na verdade, espécies de cromo III são consideradas não-lábeis, e o deslocamento dos ligantes é lento, estendendo-se por horas ou dias à temperatura ambiente.
Não se deve considerar, porém, que reações do íon hidratado de cromo III
Cr(OH2)63+ ou de outros complexos não ocorram. Certas condições (por exemplo, na
presença de catalisadores ou sob temperatura elevada) podem induzir a troca de seus ligantes mais rapidamente, sendo esta uma característica muito utilizada na indústria. Em particular, na indústria de cromo usam-se alumes, que são sulfatos complexos de
cromo e metal alcalino, tais como K2SO4 ⋅ Cr2(SO4)3 ou KCr(SO)2 (NRIAGU;
Tipos de complexos de cromo III
Como os demais íons metálicos trivalentes — por exemplo, Fe (III) e Al (III)
—, o íon hidratado de cromo III, Cr(H2O)63+, apresenta tendência à hidrólise, que é
freqüentemente acompanhada de polimerização. Tem-se identificado a existência, entre
outras, das seguintes espécies: Cr(OH)2+, Cr(OH)2+, Cr(OH)3(S), Cr2(OH)24+,
Cr3(OH)45+ e Cr4(OH)66+ (SMITH; MARTELL, 1976, apud NRIAGU; NIEBOER,
1988).
Nas espécies poliméricas, os íons cromo são unidos por ligações de hidrogênio. Em pH 4, cerca de metade dos íons hidratados de cromo III consiste em
complexos monoidratados: Cr(OH)2+. Para impedir esse processo de hidrólise, as
soluções de cromo III devem ser estocadas sob condições ácidas (pH < 3).
O cromo III, como outros íons metálicos, é designado como íon de transição, apresentando consideráveis características da classe A. A classificação mostra que esse
íon tem a capacidade de se combinar com O–, N– e S–, sendo que os chamados doadores
de elétrons são o ponto de ligação. Essa afinidade por ânions é a base para a multiplicidade dos possíveis complexos já mencionados. Uma característica significativa de classe A, apresentada pelo cromo, assim como pelo ferro III, é que a
estabilidade de seus complexos segue a ordem F– > Cl– > Br– > O livre > S livre
(EARLY; CANNON, 1965, apud NRIAGU; NIEBOER, 1988). Assim, Cr (III) e Fe
(III) freqüentemente comportam-se como Al (III), Ca (II) e Mg (II), que em sistemas biológicos procuram preferencialmente um centro de oxigênio carregado
(ROLLINSONET et al., 1969, apud NRIAGU; NIEBOER, 1988).
Cromo VI
O cromo VI é fortemente oxidante em soluções ácidas e se apresenta somente
em óxidos, tais como CrO3 (óxido de cromo VI, ou trióxido de cromo, comumente
chamado ácido crômico), CrO2Cl2 (cloreto de cromila), CrO42–(íon cromato) e Cr2O72–
(íon dicromato). CrO3 é altamente solúvel em água e em solução básica, formando o íon
cromato amarelo. Dissoluções em meio ácido produzem pH negativo e espécies concentração-dependentes.
Como pode ser deduzido da equação 1, H2CrO4 é um ácido forte (pKa1 = 0,6) e
é a principal espécie encontrada em pH inferior a 0,6 (COTTON; WILKINSON, 1980,
apud NRIAGU; NIEBOER, 1988):
H2CrO4 ⇄ H+ + HCrO4– Ka1 = 10 -0,6 (1)
HCrO4– ⇄ H+ + CrO42– Ka2 = 10 -5,9 (2)
Diferentemente, o íon cromato monoidrogenado (HCrO4–) é um ácido fraco
(pKa2 = 5,9; equação 2), sendo encontrado em valores de pH de 1 a 6, enquanto CrO42– é
predominante em pH maior que 6. Em concentrações de cromo VI acima de 10–2 M, o
íon HCrO4– se dimeriza para dar o íon dicromato:
2HCrO4– ⇄ Cr2O72– + H2O K = 10–2,2 (3)
Assim sendo, em pH ≥ 7,0 há ânions CrO42– e em pH < 7,0 há íons Cr2O72–.
Em sistemas biológicos, as concentrações de cromato parecem ser
consideravelmente inferiores a 10–2 M, e por isso a presença de dicromato não é
significante, especialmente em valores de pH fisiológicos.
Como descrito, a química do cromo VI é essencialmente aquela do ânion
cromato (CrO42–). Em soluções ácidas, é difícil deslocar o átomo de oxigênio desse
2.2.
A
SPECTOS BIOQUÍMICOS DO METABOLISMO DO CROMOEm quantidades-traço, o cromo não traz prejuízo à saúde humana. É um micronutriente que desempenha papel essencial no metabolismo da glicose, formando um complexo com ácido nicotínico que auxilia os processos de degradação do açúcar por ação da insulina (DUFFUS, 1980).
Estudos recentes indicam que a administração de cromo pode corrigir a intolerância à glicose em pacientes com diabetes tipo 2 e hipoglicemia. A suplementação alimentar com cromo aumenta o nível de lipoproteínas de alta densidade em seres humanos, protegendo o aparelho cardiovascular. A administração de 50 a 200 µg/dia de cromo III inorgânico pode diminuir os níveis de colesterol. O picolinato de cromo é usado com êxito no tratamento de obesidade (OLSZEWER, 1997).
Em um estudo realizado em oito pacientes com depressão que receberam suplementação com cromo, descreve-se melhora nos sintomas e funções. O efeito antidepressivo do cromo pode ser devido ao aumento da utilização de insulina e estar relacionado com o aumento do triptofano disponível no sistema nervoso central e/ou com o efeito do cromo na liberação da noradrenalina (McLEOD; GOLDEN, 2000).
2.2.1. Interação com moléculas bioativas
É apresentada a seguir uma breve descrição das principais interações do cromo com proteínas, enzimas e polinucleotídeos.
Interação com proteínas e enzimas
Devido às aplicações no curtimento do couro, a interação de cromo III com colágeno é indiscutivelmente a mais estudada das reações do elemento com proteínas. Estudos das transformações químicas têm mostrado que o elo de ligação predominante de cromo III são os grupos carboxílicos das cadeias polipeptídicas do colágeno, embora a polimerização do íon Cr (III) hidratado pelo íon hidroxila seja também requerida
(GUSTAVSON et al., 1958, apud NRIAGU; NIEBOER, 1988). Outros sistemas
ligações entre DNA e proteína in vitro quando os constituintes são misturados em
solução ou quando núcleos isolados são tratados com Cr (III). O cromato é ineficiente nesses experimentos. Entretanto verifica-se, no caso de ratos e células de mamíferos tratados com cromato, uma ligação semelhante ao de DNA protéico celular. Seja qual for a forma inicial, hoje é amplamente aceito que o cromato é reduzido
intracelularmente a Cr (III). Fornace et al. (1980, apud NRIAGU; NIEBOER, 1988)
sugerem que, in vivo, Cr (III) pode afetar a atividade de polimerização durante a
duplicação ou reparo de DNA, com resultados mutagênicos e conseqüências carcinogênicas. Neste caso, o cromo danifica as estruturas de ácidos nucléicos.
Interação com polinucleotídeos
Uma das primeiras indicações de que o cromo pode interagir com ácidos
nucléicos foi relatada por Hermann e Speck (1954, apud NRIAGU; NIEBOER, 1988),
que observaram que em tecidos homogeneizados tratados com cromato há menor extração de ácido nucléico para a solução de ácido tricloroácetico quente. Esses autores concluíram, baseando-se em técnicas colorimétricas, que o cromato é reduzido a cromo III pelos tecidos (como mencionado anteriormente) e que a forma reduzida interage com ácidos nucléicos. Estudos em laboratório indicam que o cromo III liga-se aos ácidos
nucléicos devido à afinidade dos íons trivalentes com o íon PO4-3 (EINSINGER et al.,
1962, apud NRIAGU; NIEBOER, 1988). A razão Cr (III):DNA-P observada é de 1:1.
Além disso, o cromo III apresenta a tendência de precipitar polinucleotídeos e, tal como
Ni (III) e Zn (II), tornar-se mais termoestável. Ono et al. (1981, apud NRIAGU;
NIEBOER, 1988) examinaram a distribuição de vários metais em núcleos e nucléolos de ratos alimentados com uma dieta convencional contendo cromo em concentrações de 0,3 µg/g. Constataram que, diferentemente do que ocorre com Ca, Zn, Cu e Mn, as proporções de Ni e Cr no núcleo são relativamente altas (20%) se comparadas com as de células intactas (1% a 3%).
2.2.2. Interação com tecidos
Absorção, distribuição e excreção de cromo
a) Entrada e absorção.
b) Transporte, distribuição e acumulação.
c) Excreção.
Absorção
Para as formas tóxicas do cromo, são três as vias básicas de absorção: pela pele, pelo trato gastrointestinal e pelas vias aéreas. Pouco é conhecido sobre a fixação do cromo nos pulmões.
Absorção pela pele
Os principais dados referentes ao transporte de compostos de cromo para dentro da pele são:
a) Os compostos de cromo VI penetram na pele mais prontamente que os de cromo III.
b) A penetração dos compostos de cromo VI aumenta com a elevação do pH.
c) A penetração dos sais de cromo III depende da natureza do ânion presente no composto.
d) A diferença na penetração dos compostos de cromo III e VI parece ser determinada pela camada da epiderme, que forma a principal barreira.
e) A pele e seus componentes favorecem o processo de redução do cromo VI a cromo III.
f) Os compostos de cromo III se ligam fortemente à pele e às proteínas nela contidas
(PEDERSEN, 1982; POLAK, 1983, apud NRIAGU; NIEBOER, 1988).
Há consideráveis evidências de que o íon cromato se difunde livremente
através da epiderme, ao passo que o movimento do íon cromo III é inibido (MALI et al.,
1963, apud NRIAGU; NIEBOER, 1988). A difusão de cromo III é retardada por várias
razões. O cromo III, diferentemente do cromato, liga-se fortemente a tecidos da derme e a seus constituintes moleculares de baixo peso. Além disso, a espécie presente em solução é altamente dependente do sal de cromo III dissolvido. Por exemplo, soluções de [Cr(H2O)6]Cl3, assim como as de KCr(SO4)2 ⋅ 12H2O, geram o íon totalmente
[CrCl2(H2O)4]Cl ⋅ 2H2O, gera o íon CrCl2(H2O)4+. A carga bem definida da espécie de
cromo III influencia a taxa de difusão e a capacidade de ligação aos tecidos. O grau de hidrólise, e conseqüentemente a polimerização com redução paralela, são altamente dependentes da natureza do sal de cromo III selecionado. A polimerização aumenta com o aumento do pH do meio. Essas diferenças explicam adequadamente por que a pele humana intacta é pouco penetrada pelos sulfatos e nitratos de cromo III disponíveis comercialmente, enquanto os cloretos penetram quase tanto quanto o dicromato
(POLAK, 1983, apud NRIAGU; NIEBOER, 1988). A observação de que a difusão do
cromato aumenta com o pH está em concordância com a concomitante diminuição de seu poder de oxidação.
Absorção gastrointestinal
Em geral, devido ao grande tamanho do íon hidratado [Cr(H2O)6]3+, o cromo é
mal absorvido, como ocorre igualmente com o alumínio. Entretanto, sua absorção também depende do ânion acompanhante, e em certo grau ele chega a atravessar a parede intestinal.
Donald e Barrera (1992, apud MOTA, 2001) demonstraram que os fluidos
gástricos humanos efetivamente reduzem o cromato a cromo III, e nessa via a absorção é diminuída. Portanto, ele não é facilmente absorvido pelo sistema digestivo.
Embora os compostos de cromo VI sejam mais absorvidos que os de cromo III (NRIAGU; NIEBOER, 1988), a diferença é menor do que a esperada para a grande afinidade do cromo VI pelas membranas celulares. No nível do duodeno, a absorção de cromo é parcialmente bloqueada pelo pH alcalino, já que nessas condições formar-se-iam os sais básicos e até hidróxido, Cr(OH)3.
Distribuição e excreção
Diagrama 2. Caminhos eventuais de cromo III no corpo humano, com base em dados humanos e animais.
Absorção Cr (III) Trato gastrointestinal
Fígado, baço
Músculo, tecido adiposo, fígado,
baço e osso Sangue Transporte
Depósito
Absorção
Excreção Células mortas Rins
Fezes, urina, bile, suor, pele,
cabelo (eliminação
lenta)
Urina (eliminação
rápida)
Fonte: Lim et al. (1972), apud Nriagu e Nieboer (1988).
O cromo III é transportado ligado à fração molecular do plasma, principalmente pela transferrina plasmática, imitando o transporte do ferro. O cromo pode formar complexos com diferentes ligantes, entre eles os grupamentos amino,
fosforila, carboxila e hidroxila (TAVARES et al., 1992). A longo prazo, parece ocorrer
A administração a seres humanos de hemossiderina marcada com cromo III e introduzida em eritrócitos sugere que Cr (III), tal como Fe (III), se deposita como parte da ferritina em tecidos. Nesse caso, falar-se-ia em “cromitina”, mesmo que a substituição possa ser apenas parcial.
O Diagrama 2 indica dois caminhos para a excreção do cromo: em um deles, a parte não-ligante do plasma é excretada pelos rins em 3,5 h; no outro, o cromo é removido pela descamação celular e eliminado pelas fezes, com tempo de 7 dias (LIM
et al., 1983, apud NRIAGU; NIEBOER, 1988). Esses dois modos de excreção são
fortemente apoiados em dados obtidos em animais, apesar de haver muitas
confirmações indicando que a excreção urinária é o único caminho (VISEK et al., 1953,
apud NRIAGU; NIEBOER, 1988), o que, infelizmente, é com freqüência aceito sem
discussão.
Um estudo realizado com dois trabalhadores expostos a elevada concentração de sulfato de cromo III, em curtumes, revelou alta concentração de cromo na urina. Mesmo após as férias desses trabalhadores, a concentração se manteve elevada, o que demonstra a acumulação de cromo no organismo. A concentração no ar, localmente
medida com metodologia-padrão, foi de 30 mg/m3. Na circulação sangüínea o cromo foi
2.3.
A
SPECTOS TOXICOLÓGICOSA toxicidade do cromo depende da espécie química. Seus efeitos também estão associados à forma química e à exposição. Os dados referentes à toxicidade do cromo para os organismos vivos estão resumidos no Quadro 2.
Quadro 2. Toxicidade do cromo a organismos vivos. Toxicidade indireta
Homem
Animais Vegetais Flora do lodo
Toxicidade direta (escala
de Sax) Cr III < 0,005
mg/L
< 1 mg/L de Cr2O3 para
peixes
Cr III < 0,05 mg/L
Cr (III) < 40 mg/L (lodo ativado)
Cr (III): 3 C o n c e n t r a ç ã o
Cr (VI) é
cancerígeno LD550 mg/kg para 50 Cr (VI) = mamíferos
Cr (VI) é o
mais tóxico Cr (VI) < 1 mg/L (lodo ativado)
Cr (VI): 3
Fonte: Rouph (1998).
2.3.1. Toxicidade ao homem
Em ambientes industriais, os trabalhadores são continuamente expostos a certo número de compostos de cromo. Entre estes, figuram os chamados compostos
hexavalentes: cromato de sódio (Na2CrO4); dicromato de sódio (Na2Cr2O7⋅2H2O);
cromato de cálcio (CaCrO4); os pigmentos de dicromato, em que se incluem aqueles
com zinco — ZnO ⋅ ZnCrO4 ⋅ xH2O, 3ZnCrO4 ⋅ K2CrO4 ⋅ Zn(OH)2 ⋅ 2H2O — e chumbo
(por exemplo, PbCrO4, PbO ⋅ PbCrO4); e as soluções de bicromato em H2SO4,
comumente designadas como ácido sulfocrômico.
Os compostos formados por cromo trivalente são encontrados em várias
formas: óxido misto de ferro e cromo (FeO ⋅ CrO3); cromato de cálcio (CaCrO4); óxido
de cromo III (Cr2O3); sulfatos básicos de cromo, como por exemplo Cr(OH)SO4. O
cromo metálico é uma espécie à parte.
– mineração;
– produção de ligas resistentes à corrosão;
– cromagem eletrolítica de peças metálicas, banhos de “cromo”;
– fabricação de cromato e bicarbonato a partir de cromato de ferro para aplicação em litografia, indústria têxtil, de borracha, de vidro, imprensa, tinturaria, fotografia e pintura;
– adição de cromo a tijolos refratários para altos-fornos;
– utilização de anidrido crômico como pesticida, para tratamento de madeira;
– produção de óleos lubrificantes;
– agentes anticorrosivos em sistemas em contato com água (por exemplo, sistemas de ar condicionado);
– curtimento de couro;
– solda de liga à base de cromo;
– produção de pigmentos de cromo usados na indústria de couro, de corantes e de preservativos de madeira, na forma de dicromato de sódio;
– traços em numerosos produtos: cimento, água sanitária etc.
Toxicidade aguda
A toxicidade aguda pode ocorrer após o contato por via oral, levando à inflamação do tubo digestivo e seguindo-se de necrose extensa. Desenvolvem-se também necrose hepática e renal.
Quando o cromo é absorvido por via respiratória, pode causar irritação aguda e levar a laringite, bronquite e pneumonia aguda química.
Os sintomas característicos do envenenamento por exposição aguda a cromo são: vômito, diarréia, diátese hemorrágica e perda de sangue no trato gastrointestinal,
causando choque cardiovascular (NRIAGU; NIEBOER, 1988; DUBEY et al., 2001)
Toxicidade crônica
mucosa nasal, ulceração e até mesmo perfuração não-dolorosa do septo nasal. Outros efeitos não-alérgicos e inflamatórios no sistema respiratório, associados ao cromo incluem rinite crônica e sinusite crônica. Nas mucosas, também pode levar ao aparecimento de bronquite crônica obstrutiva, esofagite e gastrite. Efeitos da intoxicação por exposição crônica ao cromo incluem alterações na pele e membranas mucosas, dermatites alérgicas e efeitos broncopulmonares. Entre os efeitos cutâneos figuram as dermatites eczematiformes, muito freqüentes em trabalhadores com cimento, e ulcerações crônicas indolores na pele, com cerca de 5 a 10 mm de diâmetro
(NRIAGU; NIEBOER, 1988; DUBEY et al., 2001).
Outros tecidos afetados incluem os do fígado, rins, trato gastrointestinal e sistema circulatório. Ainda como efeito da exposição crônica ao cromo, os dentes e a
língua adquirem coloração amarelada (ROBBINS et al., 1994; DUBEY et al., 2001).
2.3.2. Carcinogenicidade
Diferentemente dos compostos de cromo III, quase todos os compostos de cromo VI têm-se revelado como potentes agentes mutagênicos, talvez devido a seu poder oxidante e a seu acesso direto às células. A maioria dos testes de genotoxicidade
in vitro e in vivo reproduziu tal resposta para esses dois estados mais comuns de
oxidação do cromo. A grande diferença de efeito mutagênico entre o cromo trivalente e o hexavalente deve-se às diferenças de afinidade com o fosfato extracelular, à difusão
através das membranas e à interação com o DNA (LANGERWERF et al., 1985). O
cromo III penetra as membranas com maior dificuldade. In vivo, o metabolismo, a
distribuição e transporte do cromo hexavalente e do cromo trivalente também são bastante diferentes, tendo-se como resultado um menor efeito genotóxico do cromo III, pelo menos em roedores.
Um estudo realizado com quatro linhagens de Salmonella typhimurium,
comparando os efeitos mutagênicos de compostos de cromo trivalente e cromato de potássio, demonstrou que os compostos de cromo III não foram, em sua maioria, mutagênicos para essas quatro linhagens em concentrações de até 50 mol/placa. O cloreto de cromo III foi o único levemente mutagênico para uma das linhagens. No entanto, o cromato de potássio apresentou altos efeitos mutagênicos em três das
Os efeitos comprovadamente danosos ao DNA causados pela maioria dos compostos de cromo VI parecem ter relação com a carcinogênese humana. Há evidências de que todas as formas de cromo VI, tanto em compostos solúveis quanto insolúveis em água, são carcinogênicas para os órgãos respiratórios humanos. No entanto, não há evidência de que os compostos de cromo III aumentem o risco de câncer respiratório. Essas informações são coerentes com a resposta muito mais fraca do cromo
III nos sistemas in vitro já mencionados (NRIAGU; NIEBOER, 1988).
2.3.3. Toxicidade a organismos aquáticos
A toxicidade do cromo para a vida aquática varia grandemente com a espécie, temperatura, pH, estado de oxidação, concentração de oxigênio dissolvido e efeitos sinérgicos e antagônicos. De forma geral, o estado de oxidação depende do composto no qual o cromo é introduzido e das condições do corpo receptor. Em condições normais de pH e de oxigênio dissolvido, há predominância da forma hexavalente, que é mais tóxica para peixes já na concentração de compostos de cromo de 5 ppm. Os organismos aquáticos apresentam grande variação na sensibilidade ao cromo, em concentrações que variam de 0,03 a 118 mg/L. O cromo VI causa, em concentração de 0,005 mg/L, a
morte de Daphnia magna em seis dias (BRANCO, 1972). TRABALKA e GEHRS
(2002) demonstrou em seu estudo que 50 µg de cromo VI por litro causam imobilidade (CE50) de Daphnia magna jovens e adultas em cinco dias.
PORTMANN (1970) considera que os compostos de cromo são tóxicos para peixes de água doce na concentração de 5 ppm, não especificando, porém, a espécie de cromo. Os peixes parecem mais tolerantes ao cromo que alguns invertebrados aquáticos mais sensíveis. A toxicidade varia com a espécie, o estado de oxidação do cromo e o pH.
2.4.
C
OMPORTAMENTO DO CROMO NO MEIO AMBIENTE2.4.1. Água
Solubilidade em água dos íons acompanhantes do cromo
Pelo fato de o potencial carcinogênico do cromo estar relacionado com a solubilidade de seus compostos em água, faz-se aqui um breve resumo das informações disponíveis até o presente sobre esse aspecto.
Todas as formas de cromo podem ser tóxicas em altos níveis de concentração, mas a hexavalente é mais tóxica que a trivalente e a tetravalente. Os compostos de
cromo VI são mais solúveis em água que as formas III e IV, porque o íon Cr+6 se
hidrolisa rapidamente, de modo que somente as formas neutras ou aniônicas ocorrem em água. Em sistemas biológicos, o cromo hexavalente é muito móvel, sendo por isso o mais importante nos estudos ambientais, de contaminação de alimentos e de saúde (DUBEY et al., 2001).
Os compostos de cromo podem ser classificados em três categorias arbitrárias. O grupo dos compostos designados como pouco solúveis ou insolúveis inclui os cromatos de zinco, chumbo, bário e estrôncio. Os solúveis intermediários são o cromato de cálcio, o dicromato de potássio e, aparentemente, os pigmentos de cromato de estrôncio industrial. Note-se que soluções de cromato de cálcio e de dicromato de potássio de concentrações significantes (0,2 a 1,0 mol/L) são estáveis à temperatura ambiente. A terceira categoria, dos compostos altamente solúveis, abrange os cromatos de sódio e de potássio e os dicromatos de cálcio e de sódio.
Meios biológicos, como soro e citosol, têm alta afinidade por íons metálicos
(por exemplo, Zn2+, Pb2+, Ba2+) e contêm agentes redutores que podem reagir com os
cromatos. Por isso, o cromo pode apresentar maior solubilidade em soluções biológicas. O aumento de solubilidade por formação de complexos já foi claramente demonstrado pela dissolução de compostos de níquel em soro e citosol renal de ratos. No entanto, não se dispõe ainda de nenhum estudo específico sobre o cromo (KUEHN; SUDERMAN,
Solubilidade dos complexos de cromo III
O óxido de cromo III, até mesmo quando hidratado (Cr2O3 ⋅ xH2O), é insolúvel
em água. Complexos de cromo III com o íon fosfato são também praticamente insolúveis. Complexos anidros de ânions comuns, tais como CrBr3, CrCl3 e Cr2(SO4)3,
apresentam baixa solubilidade, enquanto as formas hidratadas têm solubilidade
considerável — por exemplo, [Cr(H2O)6]Br3, [Cr(H2O)4Cl2]Cl ⋅ 2H2O e
Cr2(SO4)3 ⋅ 15H2O). Acetato, oxalato e nitrato, que ocorrem somente em formas
hidratadas, são também solúveis. Estudos adicionais são necessários para estabelecer a condição definitiva de risco toxicológico dos complexos de cromo solúveis (NRIAGU; NIEBOER, 1988).
2.4.2. Solo
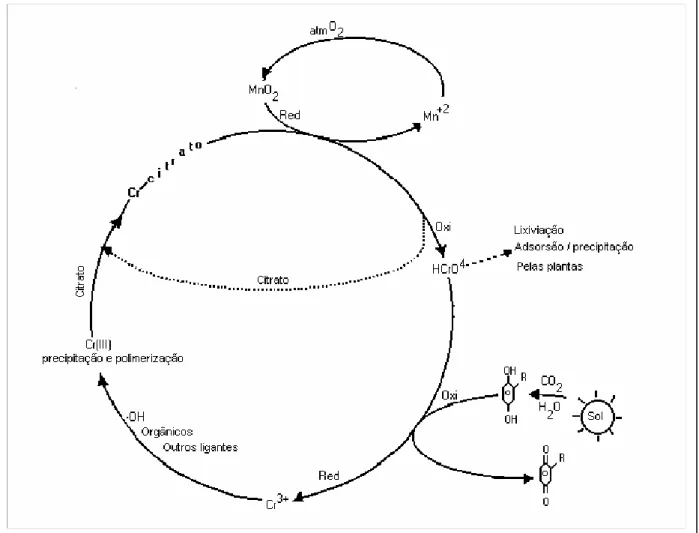
Oxidação e redução do cromo no solo
A oxidação e a redução do cromo constituem um processo cíclico. O ciclo completo do cromo (Figura 1) é termodinamicamente estável em um sistema em equilíbrio com o ar e com a água, mas no solo é menos estável. Isso nos leva a fazer
suposições a respeito do comportamento desse elemento no solo. O ânion HCrO4–
(Cr6+) é temporariamente retirado do ciclo, sendo absorvido, precipitado ou lixiviado
para dentro do sistema solo–água, ou extraído por organismos vivos. Por fim retorna ao ciclo, provavelmente em forma reduzida (NRIAGU; NIEBOER, 1988). Esse íon é reduzido num processo conhecido como decromificação, análogo à denitrificação, que é
a parte mais importante do ciclo do nitrogênio. Tal redução do Cr6+ é realizada pelo
carbono, por meio da fotossíntese.
Após redução do cromo VI, o cromo III formado reage com diversos ligantes que podem torná-lo não-reativo. Ligantes móveis, como o citrato, complexam o cromo III e o juntam ao óxido de manganês da superfície do solo, local em que cromo e citrato são oxidados. Também é possível a oxidação pelo oxigênio do ar sob a radiação UV.
Quando os ligantes orgânicos estão presentes em excesso em relação ao cromo
Mn3+. Esse íon pode prevenir a formação de cromo IV ou reduzi-lo assim que este se forme, acelerando a rotação do ciclo (BARTLETT, 1986, NRIAGU; NIEBOER, 1988).
Figura 1. Ciclo do cromo no solo e na água.
Fonte: Nriagu e Nieboer (1988). Red: redução
2.4.3. Comportamento do cromo a respeito de vários organismos vivos
Os estudos já demonstraram claramente que o cromo III e o cromo VI se acumulam em células microbianas. Já foi também demonstrada a capacidade de redução do cromo hexavalente por organismos vivos: diversos sistemas metabólicos da minhoca
Eisenia foetida, por exemplo, realizam intracelularmente a redução do cromo VI
(ATTILIO; MELODIA, 2004). Este achado sugere a possibilidade de uso de biorremediação em locais em que o solo tenha sido contaminado com cromo VI. Um
estudo realizado com Escherichia coli NfsA demonstra que a flavoproteína é a
responsável pela redução de cromo VI em cromo III (ACKERLEY et al., 2004).
Um dos aspectos mais graves da contaminação com cromo é sua biomagnificação nas cadeias tróficas, processo que leva a altos níveis de cromo nas espécies superiores da cadeia alimentar, muito acima dos níveis de cromo encontrados no ar e na água (LEITE, 2002).
Em sistemas naturais, o cromo pode acumular-se nas populações microbianas, as quais freqüentemente se apresentam associadas com formas de vida mais elevadas (NRIAGU; NIEBOER, 1988). É o que ocorre, por exemplo, em bactérias associadas a caranguejos, que permitem demonstrar não só a bioconcentração do cromo, mas também explicar sua passagem pela cadeia alimentar, já que em seguida o caranguejo se
associa ao peixe (JOHNSON et al., 1981, apud NRIAGU; NIEBOER, 1988). Durante a
maré baixa, esses caranguejos fazem buracos na areia ou no sedimento, onde se presume que fiquem expostos ao cromo. No meio aquático há, portanto, acúmulo de
cromo em todos os níveis tróficos. Saccharomyces carlsbergensis é provavelmente o
melhor exemplo de formação de complexos orgânicos com cromo III. Nesse sistema celular, o cromo III é passivamente difundido dentro da célula.
2.5.
O
CROMO E SEUS COMPOSTOS NO SETOR INDUSTRIAL DEM
ATOG
ROSSO DOS
ULo sulfato crômico, Cr2(SO4)3 ⋅ xH2O, também denominado sulfato de cromo trivalente e
conhecido no jargão industrial como sal de cromo (MOTA, 2001).
Segundo informações obtidas nos processos de licenciamento e fiscalização da Secretaria de Estado de Meio Ambiente e Recursos Hídricos de Mato Grosso do Sul (MATO GROSSO DO SUL, 2004), havia até março de 2004 onze curtumes em funcionamento em Mato Grosso do Sul. Os principais pólos de curtimento no estado localizam-se no município de Campo Grande e nas regiões sudoeste e sudeste do estado. Todos os curtumes estão situados na bacia hidrográfica do rio Paraná. Mato Grosso do Sul não possui nenhuma indústria que processe couro até o acabamento final, ou seja, que produza couro acabado: os curtumes sul-mato-grossenses, em sua maioria, processam o couro até o wet-blue2; poucas são as industrias que processam o couro até o
estágio de produto semi-acabado, denominado crust3.
O Quadro 3 lista os curtumes instalados em Mato Grosso do Sul.
Quadro 3. Curtumes instalados em Mato Grosso do Sul.
Curtume Município Couros/mês
Couro Azul Campo Grande 3 000
Induspan Campo Grande 2 500
BMZ Couros Dourados 1 500
BMZ Couros Campo Grande 1 000
Curtume Três Lagoas Três Lagoas 2 000
Braspelco Paranaíba 2 500
Curtume Independência Nova Andradina 4 000
Bertin Naviraí 2 500
Bertin Rio Brilhante 1 800
Panorama Iguatemi 1 200
Panorama Amambaí 1 500
Fonte: Mato Grosso do Sul (2004), Paulo (2006).
2 Os chamados “curtumes wet-blue” processam desde o couro cru até o curtimento com cromo
(PACHECO, 2005).
3 Os chamados “curtumes de semi-acabado” utilizam o couro wet-blue como matéria-prima e o
2.5.1. Processo de industrialização envolvendo o cromo
O Diagrama 3 apresenta o processo típico de curtimento com cromo, desde a pele salgada até o couro acabado, pronto para ser usado na fabricação de calçados ou outros produtos.
– Como mostra o diagrama, após o recebimento da pele salgada esta é hidratada com água enriquecida com detergentes, umectantes e bactericidas, etapa essa denominada remolho. Essa etapa é realizada em tambores rotativos denominados fulões e gera como efluente águas contendo cloreto de sódio, sangue, sebo e outras matérias orgânicas.
– O pré-descarne é feito no processo de curtimento para remover mecanicamente o tecido subcutâneo constituído de tecido adiposo, tecido muscular e vasos sangüíneos. Esses componentes, principalmente os tecidos adiposos, constituem uma barreira à penetração dos reagentes aplicados em etapas posteriores.
– O remolho consiste na adição de água e detergentes às peles salgadas.
– A depilação, ou caleiro, é a etapa em que ocorre remoção dos pêlos da epiderme e a abertura da estrutura fibrosa. Nessa etapa, há destruição da queratina (responsável pela fixação dos pêlos) por ação do hidróxido de sódio formado pela dissociação do sulfeto de sódio em presença de hidróxido de cálcio. O efluente produzido no caleiro é responsável por cerca de 70% da demanda bioquímica de oxigênio (DBO) produzida em todo o processo.
– O redescarne, assim como o pré-descarne, é uma operação que remove a hipoderme. É realizado usualmente em máquina e produz resíduo sólido composto de proteína, tecido adiposo, tecido muscular e pequena quantidade de efluentes líquidos resultante do beneficiamento do sebo, com elevada quantidade de matéria orgânica e sólidos em suspensão.
Diagrama 3. Processo de produção de couro.
– A desencalagem é a preparação das peles para o curtimento. Essa etapa envolve lavagens com água limpa, visando ajustar o pH e remover a cal e sulfetos.
– A operação de purga é iniciada em seguida à desencalagem, com o emprego de enzimas proteolíticas e sais de amônio. Nessa etapa a pele se torna flexível, macia e porosa.
– O píquel é a etapa de preparo da pele para o curtimento, e consiste em sua acidulação com ácido sulfúrico e cloreto de sódio, para evitar o inchamento e a precipitação de sais de cromo (CLAAS; MAIA, 1994, HOINACKI, 1994).
– O curtimento, a mais importante etapa da produção do couro, é realizado em ambiente aquoso, em fulões. Durante a operação, o colágeno, principal proteína da pele, é fixado com um agente curtidor, o que torna as peles tenazes e resistentes à putrefação. Os produtos mais utilizados para esse fim são os sais de cromo III, tais como o sulfato de cromo III. Para se obter couro de boa qualidade, é necessária uma
quantidade de cromo correspondente a 2% a 2,5% (calculado para Cr2O3) da massa
de pele que será curtida. Isso envolve o uso de 8% a 10% do produto comercial
contendo aproximadamente 25% de Cr2O3 (BOSSCHE et al., 1997).
Como já mencionado, a maioria dos curtumes de Mato Grosso do Sul produz
couro wet-blue e a duração do processo de curtimento varia de 4 a 24 h. Após o
curtimento, é realizado o processo de escorrimento, ou deságua, que visa retirar o excesso de umidade, usando tambores especiais de secagem. O efluente líquido proveniente do processo de curtimento contém compostos de cromo III. Caso esses líquidos não sejam convenientemente tratados, o cromo, em sua forma solúvel, poderá alcançar o meio ambiente.
As etapas seguintes ao curtimento constituem o acabamento. Essas operações têm os seguintes objetivos:
a) Rebaixamento: definir a espessura final do couro, conforme a aplicação a que se destine.
b) Neutralização: eliminar os ácidos livres provenientes da etapa de curtimento.
c) Recurtimento: completar o curtimento e conferir ao couro suas características finais.
d) Tingimento: dar cor final ao couro, utilizando corantes e ácido fórmico.
f) Lixamento: corrigir os defeitos superficiais do couro.
2.6.
C
ARACTERIZAÇÃO DOS RESÍDUOS LÍQUIDOS E FORMA DE ELIMINAÇÃO DO CROMO NAS INDÚSTRIASNo processo de fabricação de couros são produzidos resíduos que são removidos na forma de sólidos, particulados, líquidos ou gases. Neste trabalho, designaremos os resíduos líquidos como efluentes líquidos.
Os vários segmentos da indústria do couro apresentam diferentes efluentes: indústrias que produzem o couro até o curtimento geram resíduos bem diferentes daquelas que realizam as etapas que vão do recurtimento ao acabamento. As alterações sofridas pelos efluentes dependem do tipo de tecnologia e dos mecanismos de operação e tratamento implementados nas instalações industriais.
Em geral os efluentes produzidos são complexos e de difícil tratamento. Os que derivam das etapas de lavagem, remolho e caleiro perfazem 31% do total dos efluentes. Aqueles que provêm do curtimento de cromo compõem 11% do total de efluentes. Os 58% restantes provêm das demais etapas do processo. Os efluentes gerados nas etapas
até a finalização do couro wet-blue têm a seguinte caracterização habitual: demanda
bioquímica de oxigênio (DBO5;20): 1 600 mg/L; demanda química de oxigênio (DQO):
4 600 mg/L; sulfitos: 64 mg/L; cromo total: 76 mg/L (BAJZA; VRCEK, 2001).
O Quadro 4 apresenta a média dos parâmetros de um efluente líquido bruto, homogeneizado, após peneiramento, proveniente de uma indústria que realiza curtimento com cromo, não recicla banhos residuais e procede à oxidação de sulfetos.
Quadro 4. Caracterização de efluentes brutos em sistema sem reciclagem de cromo.
Parâmetros Valores médios
pH
Sólidos sedimentáveis DQO
DBO5;20
Cromo total Sulfetos
8,6 90,0 ml/L 7 250 mg de O2/L
2 350 mg de O2/L
O Quadro 5 apresenta a média dos parâmetros de um efluente bruto, homogeneizado, após peneiramento, proveniente de uma indústria que realiza curtimento com cromo e recicla os banhos de caleiro e curtimento.
Quadro 5. Caracterização de efluentes brutos em sistema com reciclagem de cromo.
Parâmetros Valores médios
pH
Sólidos sedimentáveis DQO
DBO5;20
Cromo total Sulfetos
7,5 21,0 ml/L 4 000 mg de O2/L
1 800 mg de O2/L
15 mg/L 10 mg/L Fonte: Claas e Maia (1994).
Em sua maioria, os couros são curtidos em banho com cromo por 4 a 24 h e os sais de cromo III são tratados preliminarmente com álcalis e precipitados, realizando-se o reciclo do efluente.
A remoção completa do cromo III ou sua retirada até que se alcancem níveis permitidos pela legislação ambiental exigem investimentos em equipamento e em controle operacional e de manutenção, tornando dispendioso o tratamento desses resíduos e elevando o custo da produção. Devido às normas reguladoras ambientais nacionais, o tratamento dos efluentes vem sendo melhorado, buscando-se métodos mais eficazes de remoção de seus constituintes.
Apesar do elevado poder poluidor dos efluentes de curtumes, constata-se que uma parcela significativa dos efluentes líquidos gerados nesse ramo industrial pode ser
reduzida através de um melhor controle do processo industrial (TRINDADE et al.,
2003). A minimização da carga poluidora dessa atividade pode ser obtida pela redução dos insumos, combate às perdas que ocorrem nos processos e reutilização dos efluentes.
outros, os efluentes de todos os banhos são reunidos e encaminhados diretamente ao tratamento.
2.6.1. Tratamento primário físico-químico dos efluentes líquidos
O tratamento primário constitui a base de todo processo depurador dos efluentes líquidos gerados no processo industrial de um curtume. Independentemente da realização de reciclagem, o efluente bruto chega ao tanque de homogeneização para ser tratado (JOST, 1989, CLAAS; MAIA, 1994).
O tratamento primário proporciona uma redução na toxicidade que caracteriza o efluente bruto homogeneizado, permitindo um tratamento biológico posterior mais favorável.
Fluxograma 1. Tratamento primário de efluentes de curtumes.
Banho de Outros Banho curtimento banhos caleiro
N S N Oxidação S
Lodo Líquido sobrenadante
Reciclagem
Gradeamento
Tratamento em
caixa de gordura
Separação em peneira Decantação Coagulação floculação Reciclagem Oxidação catalítica Gradeamento Separação em peneira Reciclagem Equalização Curtume Desidra- tação Espessa- mento Condicio- namento Disposição final Tratamento secundário Saída do efluente tratado
S: resposta positiva N: resposta negativa