UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS
DEPARTAMENTO DE BIOQUÍMICA E BIOLOGIA MOLECULAR
CAMILA BEZERRA NOBRE
CARACTERIZAÇÃO FÍSICO-QUÍMICA E EFEITO SOBRE BACTÉRIAS ORAIS DE UMA LECTINA DE SEMENTES DE Andira surinamensis (Bondt)
Splitg. ex Amshoff
CAMILA BEZERRA NOBRE
CARACTERIZAÇÃO FÍSICO-QUÍMICA E EFEITO SOBRE BACTÉRIAS ORAIS DE UMA LECTINA DE SEMENTES DE Andira surinamensis (Bondt)
Splitg. ex Amshoff
Dissertação de Mestrado submetida à Coordenação do Curso de Pós Graduação em Bioquímica da Universidade Federal do Ceará como requisito parcial para obtenção do grau de Mestre em Bioquímica.
Área de concentração: Bioquímica Vegetal
Orientador: Prof. Dr. Benildo Sousa Cavada
Co-orientador (a): Profa. Dra. Kyria Santiago do Nascimento
CAMILA BEZERRA NOBRE
CARACTERIZAÇÃO FÍSICO-QUÍMICA E EFEITO SOBRE BACTÉRIAS ORAIS DE UMA LECTINA DE SEMENTES DE Andira surinamensis (Bondt)
Splitg. ex Amshoff
Dissertação submetida à coordenação do Programa de Pós-Graduação em Bioquímica da Universidade Federal do Ceará como requisito parcial para obtenção do grau de Mestre em Bioquímica.
Aprovado em ___/___/___
BANCA EXAMINADORA
______________________________________________________________________ Prof. Dr Benildo Sousa Cavada (Orientador)
Departamento de Bioquímica e Biologia Molecular Universidade Federal do Ceará
______________________________________________________________________ Profa. Dra. Kyria Santiago do Nascimento (Co-orientadora)
Departamento de Bioquímica e Biologia Molecular Universidade Federal do Ceará
______________________________________________________________________ Profa. Dra. Beatriz Tupinambá Freitas (Examinadora)
A Deus, A meus pais, por todo apoio, amor e dedicação.
AGRADECIMENTOS
A Deus, pelo dom da vida e por ter me concedido saúde, paz, determinação e coragem para que eu prosseguisse firme na realização desse trabalho.
Ao meu orientador, Prof. Dr. Benildo Sousa Cavada, por ter me recebido no seu laboratório, antes mesmo que eu fosse mestranda, por ter acreditado no meu trabalho e por todo apoio e incentivo nesses anos que estive no BioMol-Lab.
À minha orientadora, Profa. Dra. Kyria Santiago do Nascimento, pela co-orientação no desenvolvimento desse trabalho e pelos valiosos conhecimentos transmitidos durante o mestrado. Também não posso deixar de agradecer por toda dedicação, amizade e carinho desde que cheguei no laboratório.
Ao Prof. Dr. Celso Shiniti Nagano, pelos conhecimentos transmitidos e por ter disponibilizado a estrutura do seu laboratório para execução de parte desse trabalho.
Ao Prof. Dr. Bruno Anderson Matias da Rocha, pelos ensinamentos e por todo carinho e amizade desde a época da graduação.
À Profa. Dra. Beatriz Tupinambá Freitas, por ter me iniciado nesse vasto mundo da pesquisa e por todo carinho e atenção que sempre teve comigo.
Ao Prof. Dr. Rodrigo Maranguape, pela atenção e presteza que sempre me dispensou.
A todos que compõe o Laboratório Integrado de Biomoléculas (LIBS) da UFC-Campus de Sobral, especialmente ao Prof. Dr. Edson Holanda Teixeira, pela disponibilidade na utilização da estrutura do laboratório e aos amigos Victor, Rafaela e Érica por todo auxílio, carinho, amizade e atenção quando estive em Sobral.
Aos Professores do Departamento de Bioquímica e Biologia Molecular-UFC, por todos os ensinamentos transmitidos durante o curso.
A Capes pelo auxílio finaceiro.
À Mayara Torquato, por ter sido peça fundamental para realização desse trabalho, sempre tão presente e dedicada em enfrentar os desafios ao meu lado e pela sincera amizade que conseguimos construir.
Aos meus dois grandes amigos-irmãos e colegas de trabalho, Helton e Júnior, por todos esses anos de amizade, por todo amor, incentivo, aprendizado e por todas as situações, boas e ruins, que compartilhamos no decorrer desses anos.
Aos grandes amigos que conquistei nesses anos de BioMol-Lab, Sâmia, Aninha, Joana, Maria Júlia, Rafael Simões, Bruno Lopes, Rômulo, Mayron, Alysson, Ito, Tales, por terem se tornado pessoas tão especiais durante todo esse tempo e que quero conservar na minha vida para sempre. Obrigada por tudo!
À Raquel, meu agradecimento mais que especial, pelos valiosos ensinamentos, pela contribuição diferencial nessa etapa final e pela amizade e carinho que firmamos durante essa jornada!
A todos os amigos que se fizeram presentes nessa etapa da minha vida, com muito amor, paciência, carinho, incentivo, compreensão, proporcionando-me maravilhosos momentos de descontração.
A todos os meus amigos da turma de Mestrado 2010.1 do Departamento de Bioquímica e Biologia Molecular-UFC.
Palavras jamais irão descrever tudo que eu tenho a agradecer a toda minha imensa família e em especial à minha mãe Marigel, ao meu pai Nobre e ao meu irmão João Paulo... mas, quero que vocês saibam que sem o amor, apoio, dedicação, força e oração de vocês, desde quando vim morar em Fortaleza, nada disso seria possível!
“Enquanto estiver vivo, sinta-se vivo. Se sentir saudades do que fazia, volte a fazê-lo. Não viva de fotografias amareladas... Continue, quando todos esperam que desistas... Não deixe que enferruje o ferro que existe em você. Faça com que em vez de pena, tenham respeito por você. Quando não conseguir correr atrás dos anos, trote. Quando não conseguir trotar, caminhe. Quando não conseguir caminhar, use uma bengala. Mas nunca se detenha.”
RESUMO
As sementes de Andira surinamensis (Bondt) Splitg. ex Amshoff, uma espécie pertencente à
família Leguminosae, subfamília Papilionoideae, tribo Dalbergieae, possuem uma lectina glicose/manose específica, que aglutina eritrócitos de coelhos nativos ou tratados com enzimas proteolíticas. A lectina de sementes de Andira surinamensis foi purificada através de
cromatografia de afinidade em matriz de Sepharose-Manose seguida por cromatografia de troca iônica em matriz de DEAE-Sephacel. Esse procedimento resultou na lectina purificada, nomeada de ASL. O processo de purificação da ASL foi monitorado pela atividade hemaglutinate específica e SDS-PAGE, onde se observou que essa lectina é composta por seis bandas protéicas, uma de maior peso molecular aparente de aproximadamente 20 kDa e outras cinco bandas de menor peso molecular aparente entre 15 e 12 kDa. A massa molecular intacta da lectina purificada foi determinada através da técnica de espectrometria de massa com Ionização por Eletrospray (ESI). A análise do espectro de massa intacta mostrou a presença de dois íons majoritários de massa molecular de 12.220+ 2 e 13.258 + 2 Da. ASL também teve sua estrutura primária parcialmente sequenciada através de espectrometria de massa sequencial. Essa lectina é uma glicoproteína e demonstra elevada estabilidade, sendo capaz de manter sua atividade hemaglutinante em uma ampla faixa de pH e após exposição a temperaturas de até 80 ºC por 1hora. Após diálise contra o agente quelante EDTA, ASL teve sua atividade hemaglutinante diminuída, porém recuperou sua atividade após a adição de metais, mostrando-se dependente de cátions metálicos divalentes. Foi avaliado também o efeito da ASL no crescimento planctônico bacteriano e na formação de biofilmes e observou-se que ela interferiu no crescimento planctônico de duas diferentes cepas bacterianas gram-positivas (Streptococcus mitis e Streptococcus salivarius) e na formação de biofilme por
Staphylococcus aureus e Streptococcus salivarius.
ABSTRACT
Andira surinamensis (Bondt) Splitg. ex Amshoff seeds, a species belonging to the
Leguminosae family, Papilionoideae subfamily, Dalbergieae tribe, have a glucose/mannose specific lectin rabbit erythrocytes that agglutinate native or treated with proteolytic enzymes. The lectin from Andira surinamensis seeds was purified by affinity chromatography on
Mannose-Sepharose matrix followed by ion exchange chromatography on DEAE-Sephacel matrix. This procedure resulted in a purified lectin, named ASL. ASL purification process was monitored by specific hemagglutinating activity and SDS-PAGE, where it was observed that this lectin is composed of six protein bands, a higher molecular weight of approximately 20 kDa and five other bands of lower apparent molecular weight between 15 and 12 kDa.The intact molecular mass of the purified lectin was determined by mass spectrometry with
electrospray ionization (ESI).The analysis of the intact mass spectrum showed the presence
of two majority ions of molecular mass 12.220+ 2 and 13.258 + 2 Da. ASL also had its
primary structure partially sequenced by mass spectrometry sequence.This lectin is a
glycoprotein and shows high stability, being able to maintain their hemagglutinating activity in a wide pH range and after exposure to temperatures up to 80 °C for 1 hour. After dialysis against the chelating agent EDTA, ASL had its hemagglutinating activity decreased, but recovered its activity after the addition of metals, being dependent on divalent metal cations. We also evaluate the effect of ASL on planktonic bacterial growth and biofilm formation and found that it interfered with the growth of two different planktonic gram-positive bacterial
strains (Streptococcus mitis and Streptococcus salivarius) and biofilm formation by
Stafilococcus aureus e Streptococcus salivarius.
LISTA DE ILUSTRAÇÕES
Figura 1 - Biossíntese de glicoconjugados e reconhecimento na superfície
celular... 21
Figura 2 - Representação esquemática de merolectinas, hololectinas, quimerolectinas, e superlectinas ... 26
Figura 3 - Classificação das lectinas vegetais... 26
Figura 4 - Interações lectina-carboidrato na superfície celular... 27
Figura 5 - Modificações pós-traducionais durante a biossíntese da Concanavalina A(ConA)... 30
Figura 6 - Relação filogenética proposta para as tribos da subfamília Papilionoideae... 36
Figura 7 - Visão geral da estrutura dimérica de PELa em complexo com trimanose... 36
Figura 8 - Visão geral da estrutura dimérica de PELa em complexo com o heptassacarídeo simétrico... 37
Figura 9 - Estrutura geral da lectina de P. angolensis... 37
Figura 10 - Andira surinamensis (Bondt) Splitg. ex Amshoff... 39
Figura 11 - Componentes básicos de um espectrômetro de massa... 40
Figura 12 - Representação esquemática da natureza temporal proposta para o acréscimo de bactérias orais humanas na superfície do dente... 45
Figura 13 – Desenvolvimento de um biofilme... 47
Figura 14- SDS-PAGE... 67
Gráfico 1 - Cromatografia de Afinidade em matriz de Sepharose-Manose... 65
Gráfico 2 - Cromatografia de Troca Iônica em matriz de DEAE-Sephacel... 65
Gráfico 3 - Estabilidade térmica da lectina de Andira surinamensis... 68
Gráfico 4 - Estabilidade da lectina de Andira surinamensis a uma ampla faixa de pH... 68
Gráfico 5- Efeito do EDTA sobre a atividade hemaglutinante da ASL... 69
Gráfico 6- Espectro de massa deconvoluído mostrando a massa isotópica média das cadeias da ASL...
Gráfico 7 - Avaliação do potencial da lectina de sementes de Andira surinamensis (ASL) sobre o crescimento planctônico de Streptococcus mitis ATCC 903... 73
Gráfico 8 - Avaliação do potencial da lectina de sementes de Andira
surinamensis (ASL) sobre o crescimento planctônico de Streptococcus salivarius ATCC Salivarius... 73
Gráfico 9 - Avaliação do potencial antibiofilme da lectina de sementes de
Andira surinamensis (ASL) sobre o desenvolvimento do biofilme
de Stafilococcus aureus ATCC 25923... 74
Gráfico10 - Avaliação do potencial antibiofilme da lectina de sementes de
Andira surinamensis (ASL) sobre o desenvolvimento do biofilme
LISTA DE TABELAS
Tabela 1 - Exemplos de atividades biológicas descritas para lectinas... 28
Tabela 2 - Lectinas da tribo Dalbergieae, especificidade por açúcar e atividades biológicas... 35
Tabela 3 - Atividade hemaglutinante da ASL... 63
Tabela 4 - Inibição da atividade hemaglutinante da ASL por carboidratos... 64 Tabela 5 - Tabela de purificação da ASL ... 66
Tabela 6- Efeito do EDTA sobre a atividade hemaglutinante da ASL.... 69
LISTA DE SIGLAS
AaL: lectina de Araucaria angustifolia
AAL: lectina de Aleuria aurantia
Abu: ácido α-amino butírico
ACA: aglutinina de Amaranthus caudatus
A.H.E.: atividade hemaglutinante específica AMA: aglutinina de Arum maculatum
ASL: lectina de Andira surinamensis
ATCC: Coleção de Cultura Tipo Americana BmoLL: lectina de Bauhinia monandra
BSA: albumina sérica bovina
CGL: lectina de Canavalia gladiata
CID: Decomposição Induzida por Colisão CMI: Concentração Mínima Inibitória ConA: lectina de Canavalia ensiformis
ConBol: lectina de Canavalia boliviana
ConBr: lectina de Canavalia brasiliensis
ConM: lectina de Canavalia maritima
CRD: Domínio de Reconhecimento a Carboidratos CT: Concentração total
C-terminal: carboxi terminal Da: Dalton
DDA: Análise Direta de Dados DEAE: dietilaminoetano
DNA: ácido desoxirribonucléico
EDTA: Ácido Etilenodiaminotetracético
ELISA: Ensaio de Imunoabsorção Enzima-Ligada
EPSs: Substância Extracelular Polimérica ou Exopolissacarídeos ECorL: lectina de Erythrina corallodendron
ESI: Ionização por Eletrospray Fru: frutose
Glu: glicose
GNA: aglutininade Galanthus nivalis
kDa: Quilodalton Man: manose
MALDI: Ionização por Dessorção a Laser Assistida por Matriz MBL: lectina humana ligante a manose
MLP: lectina de Manihot esculenta
MPTs: Modificações protéicas pós-traducionais mRNA: ácido ribonucléico mensageiro
MS: Espectrometria de Massa
MS/MS: Espectrometria de Massa Sequencial m/z: relação massa/carga
N-terminal: amino terminal OD: densidade ótica
PA: pureza analítica
PAL: lectina de Pterocarpus angolensis
PAL: lectina de Pisum arvensis
PDB: Protein Data Bank
PELa: lectina recombinate de Platypodium elegans
pH: potencial hidrogeniônico
PPL-1: lectina de Parkia platycephala 1
PPL-2: lectina de Parkia platycephala 2
RE: retículo endoplasmático
RIP: proteínas inativadoras de ribossomos RPM: rotações por minuto
SBA: aglutinina de sementes de soja (Glycine max)
SDS: dodecil sulfato de sódio
SDS-PAGE: Eletroforese em gel de poliacrilamida em presença de dodecil sulfato de sódio ToF: Tempo de vôo
TSB: caldo tríptico de soja
TxLCI: lectina do bulbo de tulipa
VML: lectina de Vatairea macrocarpa
SUMÁRIO
1 INTRODUÇÃO... 19
1.1 Glicobiologia... 20
1.2 Fatos históricos e definições... 22
1.3 Classificação de lectinas vegetais... 24
1.4 Ubiquidade na natureza... 27
1.5 Ocorrência nos vegetais... 29
1.6 Lectinas de leguminosas... 29
1.7 Lectinas de Papilionoideae... 33
1.8 Andira surinamensis (Bondt) Splitg. ex Amshoff... 38
1.9 Espectrometria de massa: generalidades... 39
1.10 Biofilmes: generalidades... 44
2 OBJETIVOS... 50
2.1 Objetivo Geral... 51
2.2 Objetivos Específicos... 51
3 MATERIAIS E MÉTODOS... 52
3.1 Purificação da Lectina de Sementes de A. surinamensis... 53
3.1.1 Preparo da Farinha... 53
3.1.2 Extração de proteínas das sementes... 53
3.1.3 Preparo da solução protéica... 53
3.1.4 Atividade hemaglutinante... 53
3.1.5 Cálculo da Atividade Hemaglutinante Específica... 54
3.1.6 Especificidade por Carboidratos... 54
3.1.7 Cromatografia de Afinidade em Matriz de Sepharose-Manose... 55
3.1.8 Cromatografia de Troca Iônica em Matriz de DEAE-Sephacel... 55
3.2 Caracterização da Lectina de Sementes de A. surinamensis... 56
3.2.1 Eletroforese em gel de poliacrilamida na presença de SDS... 56
3.2.2 Determinação da massa molecular intacta por espectrometria de massa.. 57
3.2.3 Digestão in gel e sequenciamento dos peptídeos por espectrometria de massa... 57
3.2.5 Efeito do agente quelante (EDTA) sobre a atividade hemaglutinante da
ASL... 58
3.2.6 Efeito do pH sobre a atividade hemaglutinante da ASL... 59
3.2.7 Dosagem de carboidratos totais... 59
3.3 Avaliação do efeito da ASL sobre o crescimento bacteriano e formação de biofilmes... 59
3.3.1 Microorganismos... 59
3.3.2 Atividade da ASL sobre o crescimento bacteriano... 60
3.3.3 Efeito da ASL sobre a formação de biofilmes... 60
3.3.4 Análise estatística... 61
4 RESULTADOS E DISCUSSÃO... 62
4.1 Purificação e caracterização pela especificidade a carboidratos da lectina de sementes de Andira surinamensis... 63
4.2 Caracterização físico-química da lectina de sementes de A. surinamensis... 66
4.3 Determinação da massa molecular e sequenciamento por espectrometria de massa... 70
4.4 Avaliação do efeito da ASL sobre o crescimento bacteriano e formação de biofilmes... 72
5 CONCLUSÃO... 77
1.1 GLICOBIOLOGIA
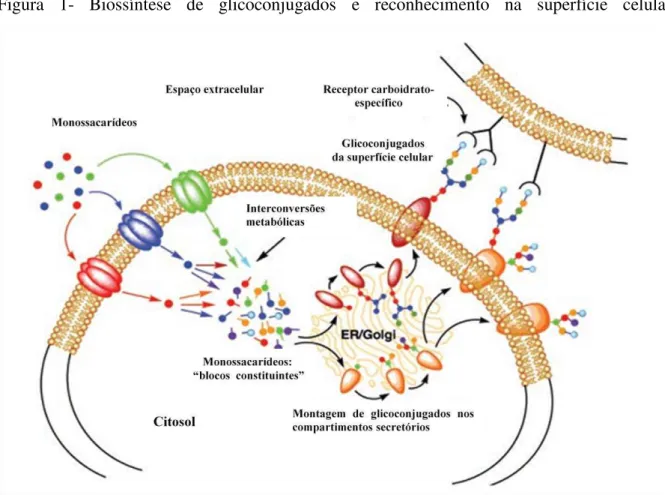
Na primeira metade do século XX, a química, bioquímica e biologia de carboidratos foram assuntos de grande interesse. No entanto, durante a fase inicial da revolução da biologia molecular moderna, estudos com glicanos foram preteridos em favor das outras principais classes de bio ou macromoléculas. Isso se deve em grande parte à complexidade estrutural inerente, a dificuldade em determinar sua sequência e o fato de que sua biossíntese não pode ser diretamente predita a partir de um molde de DNA. O desenvolvimento de uma variedade de novas tecnologias para explorar as estruturas dessas cadeias de açúcar abriu uma nova fronteira da biologia molecular que tem sido chamada de glicobiologia (Figura 1) (VARKI et al., 1999).
A glicobiologia compreende o estudo da estrutura, biossíntese e biologia de sacarídeos (cadeias de açúcar ou glicanos) que estão amplamente distribuídos na natureza. É um dos campos de mais rápido crescimento nas ciências biomédicas, com relevância para a pesquisa básica, biomedicina e biotecnologia (HALTIWANGER; FEIZI, 2011).
Oligossacarídeos e glicoconjugados (glicoproteínas e glicolipídios) têm intrigado pesquisadores por décadas no seu envolvimento como mediadores de eventos celulares complexos. A respeito da diversidade estrutural, eles têm a capacidade de ultrapassar proteínas e ácidos nucléicos. Sua variedade estrutural permite que eles codifiquem informações para reconhecimento molecular específico, servindo como determinantes para o enovelamento e estabilidade de proteínas, comunicação, diferenciação e proliferação celular, entre outros eventos de importância fisiológica. O arranjo estrutural de glicanos na superfície celular representa um fator determinante na identificação de células tumorais. As alterações nos padrões de glicosilação são o resultado de atividades alteradas de glicosiltransferases e glicosidases (GHAZARIAN, IDONI, OPPENHEIMER, 2011).
A habilidade de ligação de carboidratos a outras macromoléculas tais como proteínas, possibilita que as informações armazenadas nas moléculas de açúcar sejam decodificadas e traduzidas em eventos biológicos de interesse. Várias classes de proteínas apresentam essa capacidade de ligação, entre elas, as lectinas.
O termo lectina é derivado da palavra em latim legereque significa “escolher” ou
“selecionar” e abrange todas as aglutininas carboidrato específicas de origem não-imune que têm especificidade sanguínea (SHARON; LIS, 2004).
oligossacarídeos nas células, mas também a glicanos livres, incluindo monossacrídeos. (GHAZARIAN, IDONI, OPPENHEIMER, 2011).
A habilidade das lectinas de se ligarem a carboidratos está restrita a um pequeno número de aminoácidos na estrutura da proteína que compõem uma região denominada domínio de reconhecimento a carboidratos (CRD) (SHARON; LIS, 2004). Esse domínio lectínico reconhece resíduos de carboidratos em terminais não-redutores de glicoproteínas e glicolipídios encontrados nas membranas celulares. Essa região também pode discriminar entre isômeros anoméricos de um mesmo açúcar; a lectina de Canavalia ensiformis (ConA)
liga-se especificamente aos α-anômeros de glicose e manose, mas não aos seus isômeros (MODY, JOSHI, CHANEY, 1995).
Figura 1- Biossíntese de glicoconjugados e reconhecimento na superfície celular.
Fonte: Adaptado de BERTOZZI; KIESSLING, 2001. Monossacarídeos fornecidos exogenamente são absorvidos
pelas células e convertidos em “blocos construtores” (tipicamente açúcares nucleosídeos) dentro da célula.
1.2 FATOS HISTÓRICOS E DEFINIÇÕES
No final do século XIX surgiram as primeiras evidências que apontavam a existência na natureza de proteínas com habilidade de aglutinar eritrócitos. Tais proteínas foram referidas como hemaglutininas ou fitohemaglutininas, por terem sido encontradas inicialmente em extratos de plantas (SHARON; LIS, 2004).
Peter Hermann Stillmark em sua tese de doutorado em 1888 foi o responsável pela primeira descrição de lectinas vegetais. Em seu trabalho, Stillmark isolou a partir de extratos de sementes de mamona (Ricinus communis), uma toxina denominada de “ricina” que
apresentou capacidade de aglutinar eritrócitos. Esse estudo foi um marco para a bioquímica vegetal porque a ricina foi a primeira proteína de planta a ter uma atividade biológica estabelecida. Após a descoberta da ricina, outras substâncias tóxicas similares foram identificadas em sementes de Croton tiglium (crotina), Abrus precatorius (abrina) e na casca
de Robinia pseudoacacia (robinia) (VAN DAMME et al., 1998).
Posteriormente, Paul Ehrlich, do Instituto Real de Terapia Experimental (Frankfurt) empregou a ricina e a abrina como modelos de antígenos para estudos imunológicos. A partir desses estudos, Ehrlich conseguiu estabelecer em 1890 vários princípios fundamentais de imunologia, demonstrando que a imunidade às toxinas é transferida de mãe para filho pelo sangue durante a gravidez e pelo leite após o nascimento (SHARON; LIS, 2004).
O termo hemaglutinina foi usado pela primeira vez por Elfstrand em 1898 para designar todas as proteínas vegetais que causam aglutinação das células. Esse termo foi inspirado na similaridade entre a atividade hemaglutinante macroscopicamente visível causada pelas proteínas vegetais e aquela de aglutininas do soro humano e animal, descrita por Landois em 1875 (VAN DAMME et al., 1998).
A ideia de que toxicidade é uma propriedade intrínseca de lectinas foi abandonada no início do século seguinte por Landsteiner e Raubitscheck em 1907, quando eles relataram pela primeira vez a presença de lectinas não tóxicas em sementes de Phaseolus vulgaris
(feijão), Pisum sativum (ervilha), Lens culinaris (lentilha) e Vicia sativa (vicia). Após o
No início do século XX, James B. Sumner, da Universidade de Cornell (Ithaca, Nova Iorque), isolou das sementes de Canavalia ensiformis uma proteína denominada de
concanavalina A (ConA), obtendo assim a primeira lectina purificada da história. Entretanto, apenas em 1936, Sumner e Howell relataram que a ConA aglutina células tais como eritrócitos e leveduras e também precipita glicogênio a partir de solução. Eles mostraram que a hemaglutinação pela ConA foi inibida por sacarose, demonstrando pela primeira vez a afinidade de lectinas por açúcares. Esses dois pesquisadores ainda sugeriram que a hemaglutinação induzida por essa proteína é consequência de uma reação com carboidratos da superfície dos eritrócitos (SHARON; LIS, 2004).
O fato das lectinas exibirem uma clara preferência por eritrócitos de algum grupo sanguíneo em particular do sistema ABO constituiu-se o primeiro marco histórico no estudo dessas moléculas, registrado na primeira metade do século XX. Essa preferência foi relatada por Renkonen em 1948 e por Boyd e Reguera em 1949 (VAN DAMME et al., 1998). Eles
encontraram que extratos brutos de Phaseolus limensis e Vicia cracca, aglutinavam eritrócitos
do grupo sanguíneo A, mas não dos grupos B ou O, enquanto que o de Lotus tetragonolobus,
aglutinava especificamente eritrócitos do grupo O. Essa descoberta da especificidade a um grupo sanguíneo levou à introdução do novo termo “lectina” (do latim legere, que significa
selecionar ou escolher), por Boyd e Shapleigh em 1954 (SHARON; LIS, 2004).
A ideia de que lectinas exibem distintas especificidades por eritrócitos de grupos sanguíneos diferentes do sistema ABO foi corroborada pelo trabalho de Olavi Mäkelä, um estudante de doutorado de Renkonen, em 1957. Ele analisou extratos de sementes de diferentes espécies da família Leguminosae e verificou que as hemaglutininas exibiram diferentes especificidades para os grupos sanguíneos; algumas delas aglutinando eritrócitos dos grupos A, B ou O, e outras para ambos os grupos A e B. Esses achados contribuíram para as investigações iniciais das bases estruturais da especificidade dos antígenos associada aos grupos sanguíneos do sistema ABO, levando Morgan e Watkins, do Instituto Lister (Londres) em 1950 a encontrar que a aglutinação de eritrócitos do grupo A pela lectina de Phaseolus
limensis era melhor inibida por α-N-acetil-D-galactosamina, enquanto que a aglutinação de
eritrócitos do grupo O induzida pela lectina de Lotus tetragonolobus foi inibida
preferencialmente por α-L-fucose. Eles concluíram que α-N-acetil-D-galactosamina e α-L
-fucose são os açúcares que conferem especificidade determinante aos grupos sanguíneos A e O, respectivamente (SHARON; LIS, 2004).
As descobertas na década de 60 de que as lectinas das sementes de Phaseolus
lectina do gérmen de trigo (WGA) aglutina preferencialmente células malignas reforçaram a importância da interação entre lectinas e os carboidratos encontrados nas superfícies celulares para a execução de diferentes papéis biológicos (SHARON; LIS, 2004).
A habilidade peculiar de se ligar e reconhecer de forma específica carboidratos na superfície das células coloca as lectinas como um grupo de proteínas que podem ser distinguidas das demais por um critério funcional bem definido.
Com base nesse critério, Peumans & Van Damme (1995) definiram lectinas como sendo proteínas de origem não-imune com no mínimo um domínio não catalítico que se ligam reversivelmente a mono ou oligossacarídeos específicos.
1.3. CLASSIFICAÇÃO DE LECTINAS VEGETAIS
As lectinas vegetais são consideradas um grupo heterogêneo de proteínas por serem diferentes entre si no que diz respeito às propriedades bioquímicas e físico-químicas, relação evolucionária, estrutura molecular, especificidade e atividades biológicas (VAN DAMME et al., 1998), o que torna laboriosa a tarefa de classificá-las considerando todos os
aspectos que as descrevem simultaneamente.
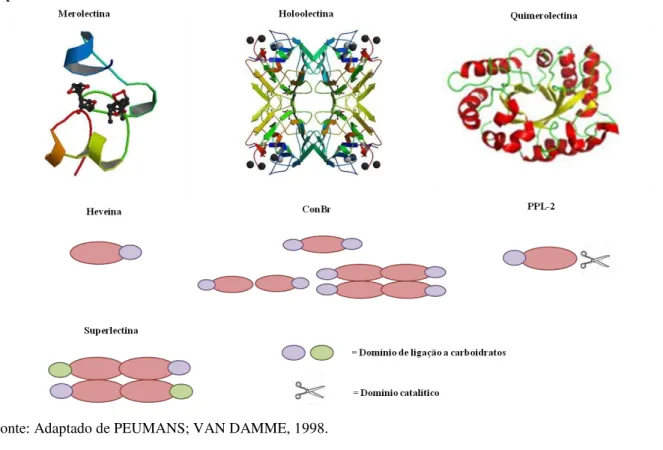
Van Damme e colaboradores(1998) subdividiram as lectinas vegetais em quatro classes principais tendo por base a estrutura do(s) sítio(s) de ligação a carboidratos, sendo assim classificadas: merolectinas, hololectinas, quimerolectinas e superlectinas (Figura 2).
As merolectinas são proteínas que consistem exclusivamente de único domínio de ligação a carboidrato. Devido ao seu caráter monovalente, as merolectinas são incapazes de precipitar glicoconjugados ou aglutinar células. A heveína, uma proteína do látex da seringueira (Hevea brasiliensis), que se liga à quitina, é uma típica merolectina (VAN
PARIJS et al., 1991).
As hololectinas também são compostas exclusivamente de domínios que se ligam a carboidratos, mas com dois ou mais sítios ligantes que são idênticos ou parecidos. Devido às hololectinas serem di ou multivalentes elas podem aglutinar células e/ou precipitar glicoconjugados. As hololectinas comportam-se como verdadeiras aglutininas e compreendem a maioria das lectinas de plantas, sendo a classe de lectinas melhor estudada. São exemplos típicos de hololectinas aquelas encontradas em sementes de plantas pertencentes aos gêneros
Canavalia e Dioclea (família Leguminoseae, sub-família Papilionoideae, tribo Phaseoleae).
catalítica bem definida, e que age independentemente dos domínios de carboidratos ligantes. Dependendo do número de sítios de ligação a carboidratos, as quimerolectinas comportam-se como merolectinas ou hololectinas. São exemplos de quimerolectinas as proteínas inativadoras de ribossomos (RIP tipo 2), como a ricina (toxina da mamona, Ricinus
communis) e a abrina (toxina de Abrus precatorius), que possuem dois domínios de ligação
para carboidratos comportando-se como hololectinas e um domínio para a inativação do ribossomo (PEUMANS et al., 1998). Outro exemplo é a PPL-2, uma lectina quitina-ligante
isolada de sementes de Parkia platycephala que possui, além do sítio ligante a carboidrato,
um sítio catalítico com atividade endoquitinásica (CAVADA et al., 2006).
As superlectinas consistem de, no mínimo, dois domínios de ligação para carboidratos. Diferente das hololectinas os domínios de ligação para carboidratos das superlectinas reconhecem açúcares estrutural e funcionalmente diferentes. Como exemplo, a lectina do bulbo de tulipa (TxLCI) que é formada por dois domínios de ligação a carboidrato, que reconhecem manose e N-acetil-galactosamina, respectivamente (VAN DAMME et al.,
1996).
Figura 2- Representação esquemática de merolectinas (Heveína; PDB: 1Q9B), hololectinas (ConBr; PDB: 3JU9), quimerolectinas (PPL-2; PDB: 2GSJ) e superlectinas, que não possuem representantes com estrutura tridimensional determinada
Fonte: Adaptado de PEUMANS; VAN DAMME, 1998.
Figura 3- Classificação das lectinas vegetais
Fonte: PDB. (A) Lectinas de leguminosas, Canavalia brasiliensis (ConBr; PDB: 3JU9); (B) Lectina ligante a
quitina composta por domínios heveínicos, Heveína (PDB: 1Q9B) ; (C) Lectinas de monocotiledôneas ligantes manose, Galanthus nivalis aglutinina (GNA; PDB: 1MSA); (D) RIP’s do tipo II, Ricina; (PDB: βAAI); (E)
Lectinas relacionadas à jacalina, Parkia platycephala (PPL-1; PDB: 1ZGR ); (F) Lectinas da família das
1.4. UBIQUIDADE NA NATUREZA
Lectinas estão presentes nos vários grupos de organismos vivos, sendo encontradas em vírus (GERMAIN et al., 2011), bactérias (KOUKI et al., 2011), algas
(NAGANO et al., 2005), fungos (KHAN; KHAN, 2011), plantas (COLARES et al., 2011) e
animais (MOURA et al., 2006). A ocorrência de lectinas em diferentes organismos reflete
uma ampliação das possibilidades de estudos de isolamento e caracterização dessas moléculas, do seu mecanismo de interação com carboidratos e do seu papel biológico intra e intercelular.
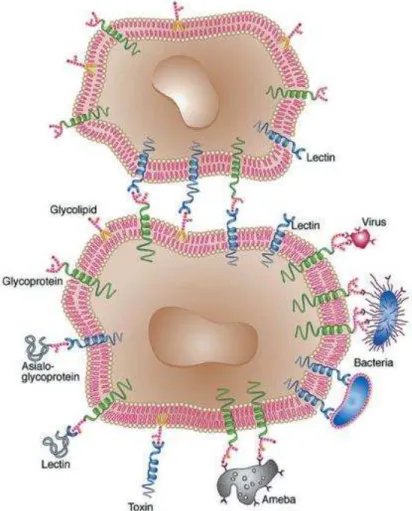
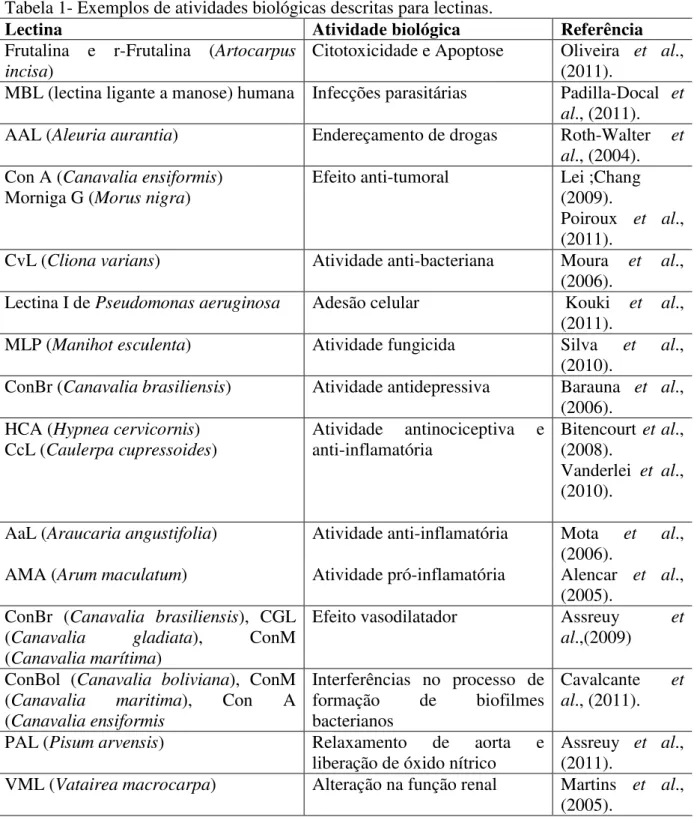
Essas proteínas apresentam-se como ferramentas indispensáveis para a pesquisa nos mais diversos segmentos científicos (agricultura, medicina, biotecnologia, dentre outros), devido à diversidade de eventos biológicos que são desencadeados em função da interação proteína/carboidrato (Figura 4). Alguns desses eventos encontram-se listados na Tabela 1.
Figura 4- Interações lectina-carboidrato na superfície celular.
carboidratos de glicoproteínas ou glicolipídios da superfície celular servem como sítios de ligação a moléculas biologicamente ativas, como as próprias lectinas.
Tabela 1- Exemplos de atividades biológicas descritas para lectinas.
Lectina Atividade biológica Referência
Frutalina e r-Frutalina (Artocarpus incisa)
Citotoxicidade e Apoptose Oliveira et al.,
(2011).
MBL (lectina ligante a manose) humana Infecções parasitárias Padilla-Docal et al., (2011).
AAL (Aleuria aurantia) Endereçamento de drogas Roth-Walter et
al., (2004).
Con A (Canavalia ensiformis)
Morniga G (Morus nigra)
Efeito anti-tumoral Lei ;Chang
(2009).
Poiroux et al.,
(2011).
CvL (Cliona varians) Atividade anti-bacteriana Moura et al.,
(2006).
Lectina I de Pseudomonas aeruginosa Adesão celular Kouki et al.,
(2011).
MLP (Manihot esculenta) Atividade fungicida Silva et al.,
(2010).
ConBr (Canavalia brasiliensis) Atividade antidepressiva Barauna et al.,
(2006). HCA (Hypneacervicornis)
CcL (Caulerpa cupressoides)
Atividade antinociceptiva e anti-inflamatória
Bitencourt et al.,
(2008).
Vanderlei et al.,
(2010).
AaL (Araucaria angustifolia) Atividade anti-inflamatória Mota et al.,
(2006).
AMA (Arum maculatum) Atividade pró-inflamatória Alencar et al.,
(2005). ConBr (Canavalia brasiliensis), CGL
(Canavalia gladiata), ConM
(Canavalia marítima)
Efeito vasodilatador Assreuy et
al.,(2009)
ConBol (Canavalia boliviana), ConM
(Canavalia maritima), Con A
(Canavalia ensiformis
Interferências no processo de formação de biofilmes bacterianos
Cavalcante et al., (2011).
PAL (Pisum arvensis) Relaxamento de aorta e
liberação de óxido nítrico
Assreuy et al.,
(2011).
VML (Vatairea macrocarpa) Alteração na função renal Martins et al.,
1.5. OCORRÊNCIA NOS VEGETAIS
As lectinas estão amplamente distribuídas no reino vegetal, sendo encontradas desde os organismos mais simples, como algas (NAGANO et al., 2005), musgos (PEUMANS
et al., 2007) e pteridófitas (TATENO et al., 2003), até aqueles mais complexos, como
angiospermas (DINANT, et al., 2003) e gimnospermas (SANTI-GADELHA et al., 2006).
Um crescente número de lectinas vegetais vêm sendo isoladas e caracterizadas sob diversos aspectos (físico-químicos, biológicos, estruturais), sendo que as famílias Leguminosae, Gramineae, Algae, Euphorbiaceae detêm a maior quantidade de estudos para essas moléculas. Contudo, dentre as famílias anteriormente citadas, a família Leguminosae é a que apresenta o maior número de lectinas isoladas e destas destacam-se principalmente as de sementes (LORIS et al., 1998; PRAKASHKUMAR, PUSHPANGADAN, VIJAYA
KUMA,1998; SHARON, 1993). Lectinas também estão presentes em outros tecidos
vegetativos, tais como em folhas (RATANAPO, NGAMJUNYAPORN,
CHULAVATNATOL, 2001), túberculos (SUSEELAN et al., 2002), frutos (SAMPIETRO et
al., 2001) e raízes de algumas Convolvulaceae (PEUMANS et al., 1997; VAN DAMME et al., 1997).
Muitas funções têm sido propostas para as lectinas vegetais, tais como proteção contra patógenos e insetos, transporte e armazenamento de carboidratos, reconhecimento celular (dentro da célula, entre células ou entre organismos), proteínas de reserva ou reguladores de crescimento (PUSZTAI, 1991). Alguns experimentos indicam que as lectinas vegetais são proteínas de defesa contra animais herbívoros e possuem função na simbiose entre as bactérias fixadoras de nitrogênio (Rhizobium spp.) e as raízes de leguminosas
(CAVADA et al., 2001).
1.6. LECTINAS DE LEGUMINOSAS
Lectinas de leguminosas constituem uma ampla família de proteínas intimamente relacionadas, encontradas exclusivamente em representantes da família Leguminosae (Fabaceae), sendo a família de lectinas vegetais mais bem estudada (SHARON; LIS, 1990).
solúveis, embora algumas espécies possam apresentar concentrações acima de 50%, ou abaixo de 0,1% do total de proteínas solúveis presentes nas sementes (SHARON & LIS, 1990; VAN DAMME, et al., 1998).
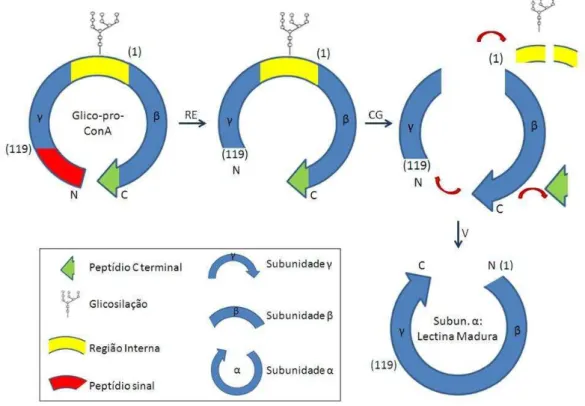
Quanto à sua biossíntese, essas proteínas são sintetizadas no retículo endoplasmático rugoso na forma de pré-pro-lectinas, sendo compostas por um peptídeo sinal (20 a 30 resíduos de aminoácidos) na região N-terminal, duas cadeias peptídicas ( e ), uma cadeia intermediária que será glicosilada no retículo endoplasmático (RE) e um peptídeo sinal na região C-terminal. Após a clivagem do peptídeo sinal na região N-terminal, a pré-pro-proteína passa por um novo processamento proteolítico no complexo de Golgi, onde uma endopeptidase é responsável pela remoção do peptídeo sinal na região C-terminal e da cadeia intermediária, tornando-se deglicosilada e funcionalmente ativa. As cadeias e são então religadas em uma posição invertida em relação ao precursor, formando a cadeia α (Figura 5) (CARRINGTON, AUFFRET, HANKE, 1985).
Figura 5- Modificações pós-traducionais durante a biossíntese da Concanavalina A (ConA).
Fonte: Adaptado de CARRINGTON, 1985. Sumário dos eventos de processamento convertendo a pro-concanavalina A glicosilada (pré-pro-conA) em lectina madura. Extremidades amino e carboxi terminal da lectina madura estão indicados por N e C, respectivamente, e o número em parênteses refere-se a resíduos da concanavalina A madura. Durante o processamento na planta, a pro-proteína glicosilada inativa é deglicosilada resultando no surgimento da atividade de ligação a carboidrato. A ação de uma endopeptidase que cliva o nonapeptídio carboxiterminal e o espaçador da deglicosilação está mostrado em verde e amarelo, respectivamente. Resíduos 118 e 119 são ligados enzimaticamente. Splicing então resulta em uma transposição
Outro tipo de processamento conhecido é o que ocorre com as lectinas de duas cadeias da tribo Vicieae. Neste caso uma sequência de seis resíduos é clivada da pró-lectina, resultando numa proteína contendo uma pequena cadeia α C-terminal e uma longa cadeia N -terminal (HIGGINS et al., 1983).
A lectina de sementes de Vatairea macrocarpa, espécie representante da tribo
Dalbergieae, sofre processamento pós-traducional seguindo uma rota proposta por Calvete e colaboradores (1998). A cadeia alfa sofre uma clivagem pelo rompimento da ponte entre asparagina-114 e lisina-115. Essa clivagem é diretamente dependente da deglicosilação do resíduo de asparagina-111. A partir dessa clivagem são gerados os fragmentos gama (N-terminal deglicosilado) e beta (C-(N-terminal glicosilado). O fragmento beta pode sofrer ainda uma deglicosilação no resíduo asparagina-183 seguido de processamento N- e C-terminal, gerando isoformas. Esses fragmentos são reunidos por ligações não covalentes fazendo com que ela tenha estrutura tridimensional praticamente idêntica àquela da cadeia alfa (não processada) (CALVETE et al., 1998).
Do ponto de vista estrutural, as lectinas de leguminosas são geralmente compostas de duas ou quatro subunidades, iguais ou diferentes, com massa molecular em torno de 25 a 30 kDa, compostas geralmente de uma cadeia polipeptídica simples com cerca de 250 aminoácidos, cuja união é estabelecida por forças não covalentes como ligações de hidrogênio, interações hidrofóbicas e eletrostáticas, que formam dímeros canônicos e estabilizam o tetrâmero pela união destes dímeros. Cada uma destas subunidades apresenta um único sítio de ligação a carboidratos com a mesma especificidade, além de um ou mais sítios de ligação a íons, podendo ainda apresentar um ou dois oligossacarídeos N-ligados. Entretanto, algumas lectinas possuem subunidades formadas por duas cadeias polipeptídicas, entre elas as lectinas da tribo Vicieae, gêneros Pisum, Vicia, Lathyrus e Lens. Estas lectinas
são dímeros formados por duas subunidades iguais e cada subunidade é constituída de uma cadeia α (5 a 7 kDa) e uma (15 a 19 kDa) mantidas por ligações não-covalentes (SHARON; LIS, 1989).
Outras lectinas de diferentes partes vegetais existem como uma complexa mistura de isoformas, como por exemplo, as lectinas de Robinia pseudoacacia (VAN DAMME et
al., 1995), do gênero Erythrina (BONNEIL et al., 2004), de Acacia constricta
(GUZMAN-PARTIDA et al., 2004) e de Amaranthus leucocarpus (HERNANDEZ et al.,
Lectinas de leguminosas são consideradas um modelo de estudo das bases moleculares das interações proteína-carboidrato (LORIS et al., 1998). Elas requerem cátions
divalentes em sítios ligantes a metal. Cada subunidade possui um íon Ca2+ e Mn2+, que são essenciais para a atividade de ligação a carboidrato da lectina. Os aminoácidos envolvidos na ligação desses íons são altamente conservados (VAN DAMME et al., 1998).
Os monômeros de diferentes lectinas de leguminosas são bastante semelhantes e sua estrutura pode ser descrita como um -sanduíche constituído por uma folha plana de seis fitas (a folha anterior) e por uma folha curva de sete fitas (a folha frontal). Uma terceira pequena folha- , formada por cinco fitas, faz a ligação das duas outras (BANERJEE et al.,
1996; HAMELRYCK et al., 1998).
O sítio de ligação a carboidratos está localizado no lado côncavo do -sanduíche, formado pela folha- frontal curva, ao lado dos sítios de ligação a metais. Esse sítio de reconhecimento a carboidratos é formado por diversos loops com diferentes graus de
variabilidade (SHARMA; SUROLIA, 1997). As conformações desses loops são determinadas
pela presença na estrutura de íons de metais de transição, no caso o Ca2+ e o Mn2+, cuja ausência resulta em instabilidade local e na perda da capacidade de ligar-se a carboidratos (LORIS et al., 2004).
Estudos recentes têm demonstrado que além dos domínios de ligação a carboidratos, esse grupo de proteínas pode apresentar sítios específicos que reconhecem metabólitos secundários, fitohormônios e aminoácidos não-protéicos, sendo que esses podem estar diretamente relacionados a mecanismos de defesa da planta contra a ação de patógenos, no processo de germinação da semente, dentre outros (DELATORRE et al., 2007).
Através da caracterização estrutural, por experimentos de cristalografia de raios X, Delatorre e colaboradores (2007) comprovou que uma lectina isolada de sementes de
Canavalia gladiataapresenta um sítio ligante para o aminoácido não protéico ácido α-amino
butírico (Abu). Esse sítio está presente na interface dos contatos monoméricos de cada dímero canônico dessa lectina e a presença do Abu nesse local aumentou os contatos intermoleculares e estabilizou fortemente os dímeros canônicos. Abu provavelmente desempenha um papel na proteção dessa leguminosa contra patógenos.
Algumas lectinas de leguminosas, como as lectinas extraídas de espécies da subtribo Diocleinae, exibem uma oligomerização dependente de pH, onde a proporção entre proteínas no estado dimérico e no estado tetramérico pode ser alterada de acordo com o pH do meio (CALVETE et al., 1999; NAGANO et al., 2008). A alteração desse equilíbrio
dessas lectinas, pelo fato dessas proteínas serem capazes de se ligar aos receptores glicoconjugados da superfície das membranas com uma maior afinidade quando na forma tetramérica (DELATORRE et al., 2006).
1.7. LECTINAS DE PAPILIONOIDEAE
A família das leguminosas está subdividida em três subfamílias: Papilionoideae, Caesalpinoideae, Mimosoideae. A subfamília Papilionoideae é a que detém o maior número de espécies a partir das quais lectinas já foram isoladas e estudadas. Muitos dos estudos com letinas de leguminosas envolvem membros da subfamília Papilionoideae, enquanto que investigações com lectinas das outras subfamílias, Caesalpinioideae e Mimosoideae, são escassos (MANN et al., 2001).
A subfamília Papilionoideae é formada por 483 gêneros e 13.800 espécies divididas em 28 tribos (Figura 6). No Brasil são 88 gêneros e 180 espécies nativas (BARROSO et al. 1991; LEWIS et al., 2005). Inúmeras lectinas dessa subfamília foram
isoladas e caracterizadas, sendo verificadas também algumas atividades biológicas para vários exemplares, tais como: atividade antidepressiva, ConBr (Canavalia brasiliensis); efeito
anti-tumoral, Con A (Canavalia ensiformis); atividade antinociceptiva, ConBol (Canavalia
boliviana); relaxamento de aorta e liberação de óxido nítrico, PAL (Pisum arvensis).
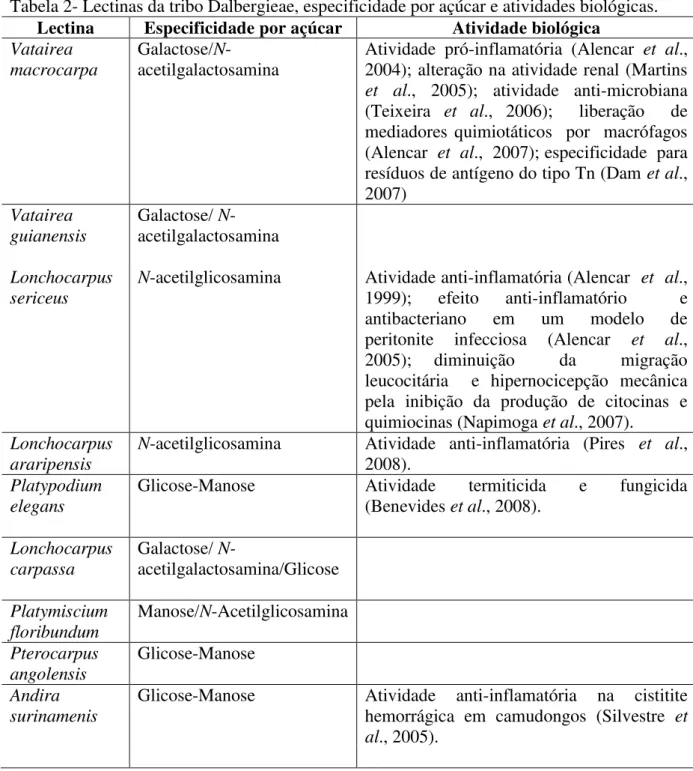
A tribo Dalbergieae, pertencente a subfamilia Papilionoideae, família Leguminosae, compreende 48 gêneros e cerca de 1.200 espécies. Apesar do grande número de espécies descritas, até o momento foram isoladas apenas 11 lectinas de diferentes espécies que compõe essa tribo. A Tabela 2 mostra a quais espécies pertencem, seus açúcares-ligantes específicos e apresenta algumas atividades biológicas que já foram evidenciadas para essas lectinas.
Até o momento, apenas duas lectinas de espécies pertencentes à subtribo Dalbergieae tiveram as estuturas tridimensionais determinadas: PAL (lectina de Pterocarpus
angolensis) e PELa (lectina recombinate de Platypodium elegans).
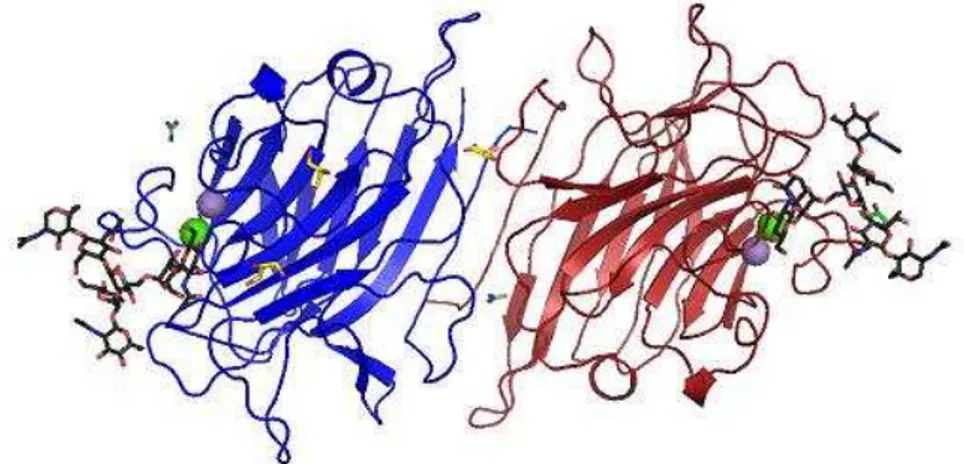
A PELa possui uma organização dimérica canônica típica de lectinas de leguminosas. Uma análise da especificidade por Glycan array evidenciou uma preferência
dimérica canônica típica de lectinas de leguminosas. O trimanose faz uma ponte entre os sítios de ligação a carboidrato de dímeros vizinhos, resultando na formação de cadeias infinitas no cristal. O heptassacarídeo liga-se com o braço 1-6 no sítio primário de ligação e com contatos extensivos adicionais em ambos os braços. O GlcNAc do braço 1-3 está ligado em uma conformação restrita que pode justificar a alta afinidade que é observada em chips para oligossacarídeos com braço 1-3 curto que não apresentam esse monossacarídeos (BENEVIDES, 2011).
A lectina de Pterocarpus angolensis (PAL), glicose/manose específica, foi
cristalizada em complexo com três diferentes açúcares: glicose, sacarose e turanose (Glc(α1– 3)Fru). A estrutura tridimensional de PAL mostra que ela está arranjada sob a forma de um dímero canônico, o que também é observado para as outras lectinas de leguminosas glicose-manose específicas tais como, ConA e outras representantes do gênero Dioclea e também
para lectinas da tribo Vicieae (Figura 9) (LORIS et al., 2003). A lectina contém um loop
clássico de ligação à manose, mas seu loop de ligação a metal assemelha-se à de lectinas com
especificiade não-relacionada, como Ulex europaeus e Maackia amurensis. Como
consequência, as interações com manose no sítio de ligação primário são conservadas, mas detalhes da extensão desse sítio de ligação a carboidratos diferem daqueles vistos em complexos carboidratos equivalentes de Concanavalina A. Essas observações explicam as diferenças em seus respectivos perfis de especificidade fina para oligomanoses (LORIS et al.,
2004). Ainda em busca de esclarecimentos sobre a estrutura de PAL, Garcia-Pino e colaboradores (2006) analisaram os efeitos da desmetalização na estabilidade conformacional, estrutura e propriedades de ligação a açúcar dessa lectina através de técnicas calorimétricas, espectroscópicas e cristalográficas. A remoção dos metais levou a uma forma mais flexível da proteína com estabilidade conformacional significativamente menor. As estruturas cristalinas sem metal mostraram rearranjos estruturais significativos, embora algumas características estruturais que permitem a ligação de açúcar sejam mantidas. Estes resultados juntos com dados termodinâmicos e espectroscópicos contribuem para o melhor entendimento das interações lectina-carboidrato.
Tabela 2- Lectinas da tribo Dalbergieae, especificidade por açúcar e atividades biológicas. Lectina Especificidade por açúcar Atividade biológica
Vatairea macrocarpa
Galactose/N
-acetilgalactosamina
Atividade pró-inflamatória (Alencar et al.,
2004); alteração na atividade renal (Martins
et al., 2005); atividade anti-microbiana
(Teixeira et al., 2006); liberação de
mediadores quimiotáticos por macrófagos (Alencar et al., 2007); especificidade para
resíduos de antígeno do tipo Tn (Dam et al.,
2007)
Vatairea guianensis
Galactose/ N
-acetilgalactosamina
Lonchocarpus sericeus
N-acetilglicosamina Atividade anti-inflamatória (Alencar et al.,
1999); efeito anti-inflamatório e antibacteriano em um modelo de peritonite infecciosa (Alencar et al.,
2005); diminuição da migração leucocitária e hipernocicepção mecânica pela inibição da produção de citocinas e quimiocinas (Napimoga et al., 2007).
Lonchocarpus araripensis
N-acetilglicosamina Atividade anti-inflamatória (Pires et al.,
2008).
Platypodium elegans
Glicose-Manose Atividade termiticida e fungicida
(Benevides et al., 2008).
Lonchocarpus carpassa
Galactose/
N-acetilgalactosamina/Glicose
Platymiscium floribundum
Manose/N-Acetilglicosamina
Pterocarpus angolensis
Glicose-Manose
Andira surinamenis
Figura 6- Relação filogenética proposta para as tribos da subfamília Papilionoideae.
Fonte: Adaptado de CALVETE et al., 1998. As tribos que possuem lectinas compostas por duas cadeias
resultantes do processamento pós-traducional estão sublinhadas e as que possuem processamento por permutação circular estão com um asterisco.
Figura 7- Visão geral da estrutura dimérica de PELa em complexo com trimanose, formada pelos monômeros A em vermelho e monômero B em azul. Presença dos metais Ca+2 e Mn+2 (esferas verde e roxa, respectivamente), do ligante trimanose (αMan1-γ(αMan1-6)Man (preto), de duas moléculas de glicerol (amarelo) e de dois íons sulfato (verde) .
Figura 8- Visão geral da estrutura dimérica de PELa em complexo com o heptassacarídeo simétrico, formada pelos monômeros A em vermelho e monômero B em azul. Presença dos metais Ca+2 e Mn+2 (esferas verde e roxa, respectivamente), do ligante heptassacarídeo (preto), de quatro moléculas de glicerol (amarelo) e de duas de uréia (verde).
Fonte: Adaptado de BENEVIDES, 2011.
Figura 9- Estrutura geral da lectina de P. angolensis. Representação esquemática do dímero
de PAL em duas orientações ortogonais. Um monômero colorido de laranja e o outro de amarelo. Os íons de manganês são mostrados como esferas azuis e íons de cálcio como esferas verdes. As moléculas de ligantes Me-α-D-glicopiranosídeo também estão representadas.
1.8. Andira surinamensis (Bondt) Splitg. ex Amshoff
O gênero Andira, tribo Dalbergieae, família Leguminosae, compreende 29
espécies, sendo que desse total, 27 ocorrem no Brasil. A distribuição geográfica indica ocorrência em todo território brasileiro e na região Nordeste há registros para o estado do Ceará (MATTOS, 1979; PENNINGTON, 2003).
As espécies deste gênero encontram-se entre as raras leguminosas dispersadas por vertebrados. A maioria das espécies possuem frutos menores que 6,0 cm, esverdeados ou amarelados, com cheiro adocicado e mesocarpo fibroso, os quais são dispersados por morcegos (o nome Andira é derivado do tupi e significa morcego) da família Phyllostomidae. Algumas espécies que ocorrem em beira de rios podem ser dispersadas pela água (PENNINGTON; LIMA, 1995).
Andira surinamensis (Bondt) Splitg. ex Amshoff é uma espécie não endêmica do
Brasil e ocorre nos domínios fitogeográficos da Caatinga, Cerrado e Amazônia. Essa espécie ocorre sob a forma de árvores, arbustos ou raramente subarbustos, atingindo de 4 a 42 metros de altura. Sua casca geralmente apresenta exsudado vermelho quando cortada. A madeira pode ser usada em construções navais, obras expostas, esteios, postes, carpintaria, carroçaria ou tanoaria (FERREIRA, HOPKINS, SECCO, 2004).
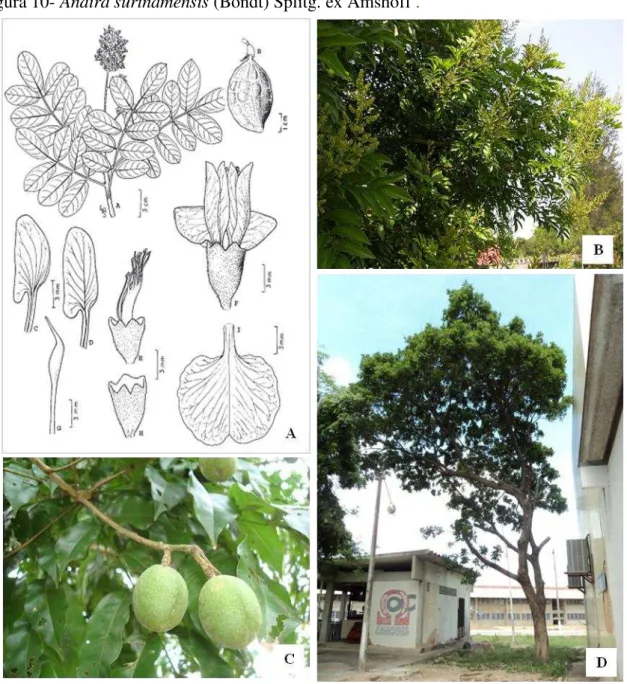
Figura 10- Andira surinamensis (Bondt) Splitg. ex Amshoff .
Fonte: (A) Adaptado de FERREIRA, HOPKINS, SECCO, 2004; (B) e (C) Adaptado de Google Imagens, 2011;
(D) NOBRE, 2012. (A) Representação esquemática da exsicata, (B) Copa da árvore, (C) Exemplar encontrado no Campus do Pici e (D) Frutos.
1.9. ESPECTROMETRIA DE MASSA: GENERALIDADES
Em linhas gerais, a espectrometria de massa (MS) é uma técnica capaz de determinar a relação entre massa e carga (m/z) de espécies ionizadas em fase gasosa
acordo com sua relação massa-carga (m/z); um detector, que recebe os íons que foram
separados pelo analisador, transformando a corrente de íons em sinais elétricos que são processados, armazenados na memória de um computador e mostrados em uma tela (Figura 11).
Figura 11- Componentes básicos de um espectrômetro de massa.
Fonte: PUC-RIO.
Os dois métodos de ionização de amostras para análise proteômica por MS mais utilizados são: a ionização por eletrospray (Elelectrospray ionization, ESI) e a dessorção a
laser assistida por matriz (Matrix Assisted Laser Desorption Ionization, MALDI)
(HOFFMAN; STROOTBART, 2007).
A ionização por eletrospray é um processo de transferência de íons pré-existentes em solução para a fase gasosa, envolvendo a formação de um “spray” eletrostático, a partir do qual são geradas pequenas gotas carregadas e destas são liberados os íons. Tipicamente, esta solução é bombeada através de um capilar (d.i. 50 a 100 µm) com uma vazão inferior a 10 µL/min. No caso de fluxos menores que 1 µL/min, o processo é chamado de “nanoelectrospray” (MORAES; LAGO, 2003).
Quando um potencial positivo, por exemplo, é aplicado na solução, os íons positivos tendem a se afastar para uma região menos positiva, isto é, em direção ao contra-eletrodo. Assim, a gota sendo formada na ponta do capilar estará enriquecida em íons positivos. Este tipo de separação de carga é chamado de processo eletroforético. Conforme a densidade de carga aumenta na gota, o campo elétrico formado entre o capilar e o contra eletrodo aumenta provocando a deformação da gota. A gota ganha a forma de um cone que é denominado de cone de Taylor (MORAES; LAGO, 2003).
Esta gota na forma de cone permanece “presa” ao capilar até o momento em que a densidade de carga na superfície da gota e o aumento da repulsão entre os íons vençam a tensão superficial do líquido, ocorrendo então a liberação de pequenas gotas (através de explosões coulômbicas) com alta densidade de carga. A frequência deste processo depende da magnitude do campo elétrico, da tensão superficial do solvente e da condutividade da solução (MORAES; LAGO, 2003).
A ionização por MALDI tornou-se uma ampla e poderosa fonte para a produção de íons na fase gasosa a partir de uma ampla gama de compostos de grande porte, não-voláteis e termicamente lábeis, como proteínas e oligonucleotídeos (HOFFMAN; STROOTBART, 2007).
A fonte de íons MALDI baseia-se na absorção intensa da radiação laser por uma matriz, que é misturada em solução com quantidades muito pequenas da biomolécula de interesse (o analito). A mistura matriz-analito é depositada sobre o porta amostra e secada, produzindo uma amostra sólida (FERNANDÉZ-LIMA, 2005).
Dois mecanismos são possíveis para a criação de íons no sistema matriz-analito (BAER, CHEUK-YIU, POWIS, 1997): i) ablação explosiva em clusters a partir de uma energia limiar (BEAVIS; CHAIT, 1991; BÖKELMANN, SPENGLER, KAUFMANN, 1995) e ii) expansão gasosa em jato, no qual as moléculas do analito estão dispersas dentro da matriz (KARAS, GLÜCKMANN, SCHÄFER, 2000; ZHIGUILEI et al., 1997).
Assim como há uma grande variedade de fontes de ionização, uma variedade de analisadores de massa têm sido desenvolvida. Todos os analisadores de massa usam elétrica estática ou dinâmica e seus campos magnéticos podem ser usados sozinhos ou combinados, dando origem a equipamentos classificados como híbridos, os quais fazem uso das vantagens inerentes a cada analisador. A maioria das diferenças básicas entre os vários tipos comuns de analisador de massa encontram-se na maneira pela qual esses campos são usados para conseguir a separação (HOFFMAN; STROOTBART, 2007). Quadrupolos, ion-traps
(tridimensionais e lineares), Time-of-Flight (ToF), Fourier-transform ion cyclotron resonance
(FT-ICR), orbitrap são exemplos de analisadores de massa. Tais equipamentos permitem que
experimentos em sequência (tandem) sejam realizados, isto é, sendo possível detectar um
determinado íon e posteriormente submetê-lo a uma etapa de fragmentação. Uma vez separados, esses íons são detectados por eletro multiplicadores que constituem os detectores mais largamente usados (CANTU et al., 2008).
Os programas mais comumente empregados para a identificação de proteínas em bancos de dados a partir de dados de MS são o Sequest e o Mascot. Ambos os programas correlacionam espectros de massa de fragmentação (não interpretados) de peptídeos com sequências de aminoácidos de proteínas registradas em bancos de dados (CHAMRAD et al.,
2004; ELIAS et al., 2005). Além disso, esses softwares também têm a capacidade de usar
sequências de nucleotídeos para fazer tal correlação. Para tal, eles primeiramente simulam as sequências primárias potenciais das proteínas correspondentes àquelas sequências de nucleotídeos encontradas nos bancos de genes, utilizando-se do código genético universal. Posteriormente, simulam a fragmentação destas sequências primárias. De forma geral, estes programas têm como objetivo encontrar a sequência de aminoácidos, em um determinado banco de dados, que melhor descreve os íons fragmentos encontrados em um espectro. As sequencias “candidatas” são procuradas nos bancos de dados de acordo com a massa do peptídeo intacto e com o espectro de fragmentação obtido para cada peptídeo (CANTU et al.,
2008).
Contudo, a interpretação manual de espectros de fragmentação (sequenciamento
existem situações nas quais o genoma de uma determinada espécie ainda não está completamente sequenciado ou disponível e, neste cenário, é necessário derivar a sequência primária de aminoácidos de um determinado peptídeo baseado única e exclusivamente nos dados obtidos por espectrometria de massa, isto é, sem recorrer a banco de dados (sequenciamento De novo) (STEEN; MANN, 2004).
O potencial de aplicação da MS em estudos biológicos tem sido bastante estendido, em razão dos impressionantes avanços observados nos últimos anos nas áreas de genômica, de transcriptômica, de metabolômica, de proteômica, de lipidômica e de outras plataformas “omics”, e do desenvolvimento extraordinário dos equipamentos (FENG et al.,
2008; HOFFMANN; STROOBANT, 2007). A MS é atualmente a técnica de escolha para identificação de proteínas e para estudo de modificações protéicas pós-traducionais (MPTs) em diferentes condições fisiológicas. Além disso, a MS vem sendo utilizada no monitoramento e na caracterização de diversos processos industriais, tais como processos fermentativos (ROYCE, 1993) e até mesmo análise de microrganismos intactos (CLAYDON
et al.,1996; FENSELAU; DEMIREV, 2001).
A utilização da MS no estudo de lectinas vegetais permite a caracterização dessas moléculas através da determinação da massa molecular intacta, identificação do estado oligomérico, localização e caracterização de pontes de sulfeto e modificações pós-traducionais, identificação de proteínas provenientes de uma eletroforese bidimensional. Além da rapidez e relativa simplicidade de análise, outra vantagem dessa técnica é a necessidade de pequenas quantidades de amostras para realização dos estudos (SIMÕES, 2011).
Algumas lectinas de leguminosas já tiveram suas sequências primárias parcialmente determinadas por MS, entre elas Erythrina velutina (SIMÕES, 2011),
Luetzelburgia auriculata (SIMÕES, 2011), Canavalia bonariensis (CALVETE, et al., 1999), Dioclea virgata (CALVETE, et al., 1999), Dioclea guianensis (CALVETE, et al., 1999), Dioclea violacea (CALVETE, et al., 1999), Dioclea rostrata (CALVETE, et al., 1999), Canavalia grandiflora (SIMÕES, 2011), Platymiscium floribundum (PEREIRA JÚNIOR,
2011).
A lectina de sementes de Vatairea macrocarpa (VML) teve a sua massa
molecular e de suas cadeias determinadas por MS, além da caracterização dos glicanos N-ligados (CALVETE et al., 1998). Através desses resultados foi sugerido um mecanismo de
1.10. BIOFILMES: GENERALIDADES
A diversidade de mecanismos de adaptação, sejam eles metabólicos ou fenotípicos, permite que os organismos procarióticos habitem tanto os ambientes adequados às formas de vida superiores, quanto ambientes inóspitos à maioria das formas de vida. Essas características adaptativas também possibilitaram às bactérias o desenvolvimento de uma sábia estratégia ecológica de sobrevivência que facilita sua adaptação às alterações ambientais: a vida em comunidade. Para os microbiologistas, a maioria das bactérias encontra-se na natureza vivendo em comunidades, de maior ou menor estruturação, e raramente elas ocorrem como células individuais, crescendo de maneira planctônica (livres, em suspensão). Sendo assim, esses organismos apresentam-se em seus habitats naturais em comunidades de diferentes graus de complexidade, associadas a superfícies diversas, geralmente compondo um biofilme.
Biofilmes são comunidades microbianas complexas estabelecidas em uma ampla variedade de superfícies que são geralmente associadas a uma matriz extracelular composta por vários tipos de biopolímeros (ABEE et al., 2010). Essas comunidades dinâmicas podem
se espalhar através de superfícies, incorporar partículas e outros microorganismos do meio circundante e continuamente liberar novas células planctônicas (STEPHENS, 2002). Eles estão presentes no meio aquático (RIVERA, et al., 2010), em equipamentos de diferentes
segmentos industriais (DAT et al., 2012), dispositivos médicos, como válvulas cardíacas
artificiais, marcapassos e articulações sintéticas (STEPHENS, 2002), lentes de contato (ONURDAĞ et al., 2010). Entre os biofilmes de maior interesse médico destacam-se aqueles
que são responsáveis pela colonização da cavidade oral e da superfície dos dentes, levando à ocorrência da cárie dental (OKUDA et al., 2010).
Superfícies dentárias expostas ao ambiente oral são quase instantaneamente cobertas por uma película proteinácea, que é conhecida como a película do esmalte adquirida. Essa película de proteína é formada pela adsorção seletiva de proteínas salivares, peptídeos e outras moléculas orgânicas (OLIVEIRA et al., 2007). O processo inicial de adesão bacteriana
Figura 12- Representação esquemática da natureza temporal proposta para o acréscimo de bactérias orais humanas na superfície do dente.
Fonte: Adaptado de Rickard et al., 2003. As espécies representadas aqui são Streptococcus gordonii,
Streptococcus mitis, Streptococcus oralis, Streptococccus sanguinis, Haemophilus parainfluenzae, Propionibacterium acnes, Veillonella atypica, Actinomyces naeslundii, Fusobacterium nucleatum, Actinobacillus actinomycetemcomitans, Helicobacter pylori, Treponema spp. e Porphyromonas gingivalis. Os
conjuntos de símbolos complementares adesina-receptor (um exemplo é mostrado no alto) representa interações por coagregação específica diferente ou adesão à película adquirida. Coagregação entre P. gingivalis and S.
gordonii é mediada pelas proteínas adesinas expressas na superfície de ambos tipos de células. Símbolos
idênticos não se destinam a identificar moléculas idênticas, mas relacionadas funcionalmente. Os símbolos retangulares representam coagregações sensíveis, outros símbolos representam coagregações lactose-insensíveis.
Cáries dentais são causadas pela colonização e acúmulo de microorganismos orais e a aderência desses microorganismos é o primeiro passo para a colonização (GIBBONS, 1984; NAPIMOGA et al., 2005). Organismos orais se ligam aos componentes salivares da
película do esmalte adquirida e, através do crescimento e interação entre espécies, formam uma comunidade de biofilme. Por conseguinte, o reconhecimento bacteriano de receptores salivares na superfície do dente representa um passo inicial importante na patogênese da doença oral (PALMER et al., 2003).