Universidade de Trás-os-Montes e Alto Douro
Doença dos Corpos de Inclusão na coleção de
Répteis do Zoo da Maia
Dissertação de Mestrado em Medicina Veterinária
Francisca Manuela Vicente Oliveira
Orientador:
Professora Doutora Maria Isabel Ribeiro Dias
Coorientador: Doutor Nuno Alvura
Universidade de Trás-os-Montes e Alto Douro
Doença dos corpos de inclusão na coleção de
Répteis do Zoo da Maia
Dissertação de Mestrado em Medicina Veterinária
Francisca Manuela Vicente Oliveira
Orientador:
Professora Doutora Maria Isabel Ribeiro Dias
Coorientador: Doutor Nuno Alvura
“Man is an animal that diddles, and there is no animal that diddles but man.” Edgar Allan Poe
AGRADECIMENTOS
À Professora Doutora Isabel Dias, minha orientadora, pelo otimismo que me transmitiu, pela disponibilidade em todos os momentos e pela ajuda para ultrapassar todos os obstáculos que surgiram ao longo deste trabalho.
Ao Dr. Nuno Alvura pela prontidão em aceitar ser coorientador nesta dissertação, por me ter acolhido no Zoo da Maia durante o meu estágio e pela enriquecedora transmissão de conhecimentos.
À Professora Doutora Maria dos Anjos Pires, à Professora Doutora Fernanda Seixas, à Professora Doutora Isabel Pires e à Professora Doutora Adelina Gama do Laboratório de Histologia e Anatomia Patológica da UTAD por me disponibilizarem todo o material e resultados necessários à elaboração deste trabalho.
Ao Dr. Roberto Sargo, à Dr. Joana Valente, à Dr. Filipa Loureiro e ao Dr. Juan Torre, do Hospital Veterinário da UTAD, e ao Luís Sousa pela calorosa receção no meu estágio, pelos conhecimentos, fascínio e paixão transmitidos, na área de clínica de animais exóticos e selvagens.
Ao Zoo da Maia pela oportunidade de estágio, em especial à Cláudia, à Andreia Silva e à Andreia Rocha e aos meus companheiros de estágio Anocky, Ana Lima e Leonel pelo carinho e companheirismo.
À Filipa, à Rita e à Sandra pela amizade, pela diversão, pela companhia e pelas longas tardes de estudo no caos da Serrana.
Aos meus amigos de longa data pela amizade de sempre, à Joana,ao Valter, à Sara, ao Norberto e ao Farinha.
A todos aqueles que de alguma forma em especial marcaram a minha estadia em Vila Real, ao longo do curso.
Um obrigada especial ao Hugo pelo carinho, amizade, pela força, pelo apoio incondicional, por acreditar sempre em mim.
Aos meus Pais por tudo o que são na minha vida, por tudo o que me dão, por tudo o que fazem por mim, sem eles nada disto seria possível.
RESUMO
O presente estudo reporta um rastreio da Doença dos Corpos de Inclusão na coleção de répteis do Zoo da Maia, doença conhecida por ocorrer em animais das famílias Boidae e
Pythonidae, tanto em coleções privadas como de jardins zoológicos em todo o mundo.
Foram colhidas amostras de sangue de 43 animais, das quais foram realizados esfregaços sanguíneos para pesquisa de corpos de inclusão intracitoplasmáticos em eritrócitos e linfócitos. Apenas 10 Boa constrictor apresentaram inclusões nas células sanguíneas. Desses 10 animais, 9 foram eutanasiados e o último foi sujeito a biopsia ecoguiada.
Histologicamente, todos os 10 animais apresentaram inclusões eosinofílicas intracitoplasmáticas, de redondas a ovais, nos hepatócitos. Esses corpos de inclusão foram encontrados distribuídos em outros orgãos (rim, pâncreas, intestino e pulmão), com frequência variada. Infelizmente, para este estudo, não foram colhidas amostras de Sistema Nervoso Central para exame histopatologico.
Uma vez que não foram detetados sinais clínicos, exceto caquexia em um dos animais, os resultados sugerem que a doença poderá ter evolução subclínica tornando estes animais portadores assintomáticos.
Mesmo havendo evidências do caráter contagioso da doença, o modo de transmissão permanece uma incógnita, embora se acredite que possa ocorrer por contacto direto. Pensa-se que o ácaro Ophionyssus natricis possa atuar como vetor e é também possível que o agente etiológico seja transmitido da progenitora para as crias.
Palavras-chave: Doença dos corpos de inclusão, inclusões intracitoplasmáticas, Boa
ABSTRACT
The following study reports a survey for Inclusion Body Disease (IBD) on reptile collection from Zoo da Maia, a disease known to occur in snakes of both the Boidae and
Pythonidae families in private and zoological snake collections all over the world.
Whole blood samples were collected from 43 snakes and stained blood smears were performed on all samples to detect the presence of intracytoplasmic inclusion bodies in erythrocytes and lymphocytes. Only 10 Boa constrictor had inclusions on blood cells. 9 animals were euthanized and an ultra-sound guided biopsy was performed on the last one.
Histologically, all those 10 snakes had intracytoplasmic round to oval, single to multiple eosinophilic inclusion bodies in hepatocytes. Those inclusions were distributed among other organs (kidney, pancreas, intestine and lung) with varying frequency. Unfortunately, samples of the central nervous system were not available for histopathology in this case.
Once no clinical signs were detected, the results suggest that snakes may have a subclinical infection remaining as asymptomatic carriers.
There is evidence that IBD is contagious but the mode of transmission remains unknown, although it is believed that direct contact is involved. The bloodsucking snake mite
Ophionyssus natricis is thought to act as a vector and it is also possible the causative agent
is passed through vertical transmission from mother to young.
Keywords: IBD, intracytoplasmic inclusion bodies, Boa constrictor, Python spp.,blood smear, ultrasound guided biopsy.
ÍNDICE GERAL
AGRADECIMENTOS ... i RESUMO ...ii ABSTRACT...iii ÍNDICE DE FIGURAS...vi ÍNDICE DE TABELAS...vi ÍNDICE DE GRÁFICOS...viLISTA DE ABREVIATURAS, SIGLAS, SÍMBOLOS OU ACRÓNIMOS...vii
1. INTRODUÇÃO... 1 2. EPIDEMIOLOGIA... 1 2.1. Transmissão ... 2 3. ETIOLOGIA... 2 3.1. Retrovírus... 3 3.2. Arenavírus... 3 3.2.1.Taxonomia ... 3 3.2.2.Estrutura... 5 3.2.3.Ciclo de vida ... 5 3.2.4.Hospedeiros e patogenia... 6
3.2.5.Arenavírus e a Doença dos Corpos de Inclusão ... 11
4. APRESENTAÇÃO CLÍNICA... 12
5. DIAGNÓSTICO ... 13
5.1. Antemortem ... 13
5.1.1. Esfregaço sanguíneo ... 14
5.1.2. Hematologia e bioquímica sérica ... 16
5.2. Post-mortem ... 16
5.2.1 Microscopia ótica ... 16
5.2.2. Microscopia Eletrónica... 17
5.3. Outras técnicas de diagnóstico... 18
5.3.1. Imunohistoquímica ... 18
5.3.2. PCR ... 19
6.1.Paramixovirus ... 20 7. TRATAMENTO ... 21 7.1. Fluidoterapia ... 21 8. PROFILAXIA... 22 8.1. Quarentena ... 22 8.2. Controlo de ectoparasitas... 23 8.2. Rastreio ... 23 8.3. Gestão da coleção... 23 8.3.1. Necrópsia... 24 9. OBJETIVOS ... 25 10. MATERIAL E MÉTODOS ... 26 10.1. Animais... 26
10.2. Colheita e processamento das amostras ... 26
10.3. Metodologia ... 26
10.3.1. Sedação e anestesia ... 27
10.3.2. Preparação e avaliação dos esfregaços sanguíneos... 27
10.3.3. Biopsia ecoguiada ... 27 10.3.4. Eutanásia... 28 10.3.5. Necropsia... 28 10.3.6. Histopatologia ... 28 10.3.5. Análise estatística ... 28 11. RESULTADOS ... 29 11.1. Caracterização da amostra ... 29 12.2. Esfregaços sanguíneos ... 31 12.3. Necropsia... 32 12.4. Histopatologia... 33 13. DISCUSSÃO... 36 14. CONCLUSÃO ... 39 15. REFERÊNCIAS BIBLIOGRÁFICAS... 40 16. ANEXOS... 45
ÍNDICE DE FIGURAS
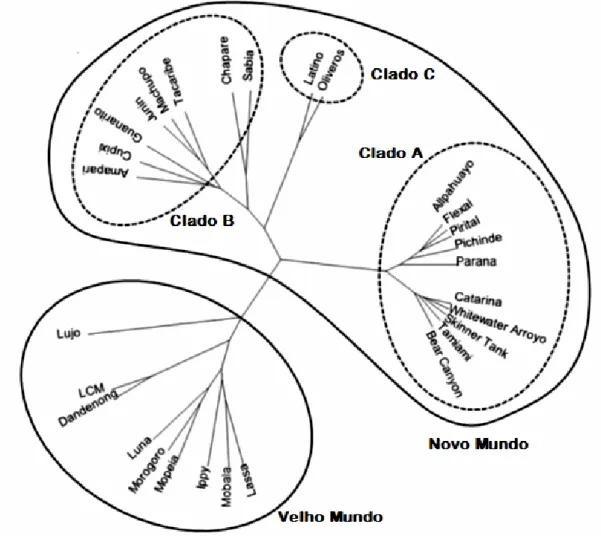
Figura 1. Árvore filogenética dos arenavírus ... 4
Figura 2. Evolução dos arenavírus. Estrutura genómica e proteínas codificadas por filovírus, arenavírus e arenavírus associado a doença dos corpos de inclusão ... 12
Figura 3. Boa constrictor com IBD... 13
Figura 4. Tonsila esofágica de Boa constrictor com IBD ... 14
Figura 5. Esfregaço sanguíneo de Boa constrictor com IBD... 15
Figura 6. Imagens histopatológicas de Boa constrictor com IBD. ... 17
Figura 7. Imagens de microscopia eletrónica. Boa constrictor com IBD ... 18
Figura 8. Eletroforese em gel ... 19
Figura 9. Esfregaços sanguíneos de Boa constrictor. ... 32
Figura 10. Alterações macroscópicas. Boa constrictor. ... 32
Figura 11. Imagens histopatológicas de Boa constrictor... 33
ÍNDICE DE TABELAS
Tabela 1. Lista de todos os arenavírus isolados com respetiva distribuição geográfica, hospedeiros e doenças em humanos associadas ... 8Tabela 2. Deteção de corpos de inclusão intracitoplasmáticos em Boa constrictor ...15
Tabela 3. Distribuição dos animais da população por intervalo de pesos. (Frequência absoluta) ...30
Tabela 4. Resultado da pesquisa de corpos de inclusão nos esfregaços sanguíneos. ...31
Tabela 5. Deteção de inclusões em cada um dos animais, nos vários tecidos colhidos para exame histopatológico...34
ÍNDICE DE GRÁFICOS
Gráfico 1. Proporção das espécies na população...29Gráfico 2. Proporção dos grupos estários na população. ...30
Gráfico 3. Distribuição dos animais da população por intervalo de pesos. (Frequência relativa) ...31
Gráfico 4. Proporção de amostras com presença de inclusões em cada orgão, relativamente ao total de amostras colhidas. ...34
LISTA DE ABREVIATURAS, SIGLAS, SÍMBOLOS OU ACRÓNIMOS
µm Micrómetro
% Percentagem
α –DG α -distroglicano
AST Aspartato Aminotransferase
CASV Virus California Academy of Sciences et al. et alli
g Grama
GGV Virus Golden Gate
GPC Precursor de glicoproteína (glycoprotein precursor) GTOV Vírus Guanarito
H-E Hematoxilina- Eosina
IBD Doença dos Corpos de Inclusão (Inclusion Body Disease)
IBDP Proteína da Doença dos Corpos de Inclusão (Inclusion Body Disease
Proteína)
ICTV Comité Internacional de Taxonomia de Vírus (International Committee on
Taxonomy of Viruses)
JUNV Vírus Junín
Kda Dalton (Unidade de Massa atómica)
Kg Quilograma
L Segmento maior
LASV Vírus Lassa
LCMV Vírus da coriomeningite linfocítica LUJV Vírus Lujo
MACV Vírus Machupo
Ml Mililitro
NP Proteína da nucleocápside (nucleocapsid protein)
NW Novo Mundo (New World)
OPMV Paramixovírus Ofídico (ophidian paramyxovirus) OW Velho Mundo (Old World)
RdRp RNA- polimerase RNA dependente (RNA-dependent RNA polymerase) RNA Acido Ribonucleico
RT-PCR PCR de Transcrição Reversa (Reverse transcription polymerase chain reaction)
S Segmento menor
SABV Vírus Sabia
SSP Péptido Sinal
TACV Vírus Tacaribe
TfR1 Recetor Humano Transferrina 1 UHV Vírus University of Helsinki
UTAD Universidade de Trás-os-Montes e Alto Douro VHF Febre Hemorrágica Viral
vRNP Ribonucleoproteína Viral Z Proteína ligadora de Zinco
1. INTRODUÇÃO
A Doença dos Corpos de Inclusão (IBD) foi identificada pela primeira vez nos Estados Unidos da América, em 1970, onde ainda hoje afeta várias coleções zoológicas e privadas (Schumacher et al., 1994).
É uma doença progressiva e fatal que afeta Ofídios, principalmente membros das famílias Boidae e Pythonidae (Chang e Jacobson, 2010; Hetzel et al., 2013). O stress resultante do maneio, a mistura de espécies de diferentes localizações geográficas e a consequente exposição a novos agentes patogénicos são causas que tornam estes animais mais suscetíveis à doença (Schumacher, 2006).
Mesmo não havendo números apurados, assume-se que alguns milhões destes animais são considerados animais de companhia e utilizados em programas de reprodução. Sendo esta doença a mais importante de boídios em cativeiro há uma preocupação crescente em todo o mundo relativamente à sua transmissão a populações selvagens (Chang e Jacobson, 2010).
A doença caracteriza-se pela presença de corpos de inclusão nas células sanguíneas (linha vermelha e linha branca), bem como nas células do sistema nervoso central, fígado, pâncreas e rim, visíveis à microscopia ótica (Chang e Jacobson, 2010; Hetzel et al., 2013).
A etiologia ainda é controversa, suspeitando-se que seja viral (retrovírus ou arenavírus), e tanto a patogenia como a epidemiologia são ainda pouco conhecidas, o que faz da doença um verdadeiro desafio nas coleções de répteis (Turchetti et al., 2013).
2. EPIDEMIOLOGIA
Inicialmente a doença foi identificada em animais da espécie Piton Burmesa (Python
molurus bivittatus). Mais tarde, na Austrália, foi feito o diagnóstico em Piton Carpete (Morelia spilota variegata) e Piton Diamante (M. spilota spilota) (Carlisle-Nowak et al., 1998), assim
como em Jiboias (Boa constrictor) nas Ilhas Canárias (Oros et al., 1998) e Bélgica (Vanncraeynest et al., 2006).
No início dos anos 90, foram relatados mais casos em Jiboias do que em Pitons (Chang e Jacobson, 2010).
Em 2001 foi diagnosticada uma doença semelhante à doença dos corpos de inclusão numa Serpente-Rei (Lampropeltis getula) que co-habitava com uma Boa constrictor
(Jacobson et al., 2001) e numa coleção de Víboras de Palma Verde (Bothriechis marchi) de um jardim zoológico (Raymond et al., 2001). No entanto, nenhum destes casos suspeitos foi confirmado como sendo positivo (Chang e Jacobson, 2010).
Atualmente sabe-se que a doença afeta outras espécies tais como Anaconda-verde (Eunectes murinus), Anaconda-amarela (Eunectes notaeus), Boa Arcoíris (Epicrates
cenchria), Boa do Haiti (Epicrates striatus), Boa de Madagáscar (Acrantophis madagascariensis), Piton Indiana (P. molurus molurus), Piton reticulada (P. reticulatus) e
Piton real (P. regius) (Chang e Jacobson, 2010; Hetzel, et al., 2013).
Mais recentemente foi registado o primeiro caso da doença dos corpos de inclusão numa Corallus hortulanus, sendo simultaneamente o primeiro caso da doença no Brasil (Turchetti et al., 2013).
Apesar de estar descrita apenas em animais adultos, todos os indivíduos, independentemente da idade, devem ser considerados suscetíveis.
2.1. Transmissão
Apesar de haver evidência de que a Doença dos Corpos de Inclusão é contagiosa, o modo de transmissão ainda é desconhecido. O ácaro de répteis Ophionyssus natricis é um problema comum em coleções de répteis afetadas pela doença e pensa-se que possa agir como vetor, no entanto, de momento não existem resultados experimentais que apoiem esta hipótese (Schumacher, 1996).
A presença de corpos de inclusão nas células testiculares sugere que a doença tenha transmissão venérea, sendo ainda transmitida à descendência. Pensa-se que possa ser também transmitida pela saliva, fezes e urina (Wright, 2013).
3. ETIOLOGIA
A etiologia permanece objeto de dúvida e estudo. Tanto Schumacher et al. (1994) como, mais recentemente, Hetzel et al. (2013) sugerem que o agente etiológico seja infecioso. Segundo o estudo de transmissão da doença realizado por Schumacher et al. (1994) ,Pitons Burmesas e Jiboias jovens inoculadas com sobrenadante de cultura de células hepáticas de uma Jiboia infetada, desenvolveram sinais clínicos e lesões microscópicas compatíveis com a doença. Já Hetzel et al. (2006) sugere mesmo que o agente etiológico seja um vírus, prião ou bactéria, devido ao sucesso da transmissão in vitro
em culturas de células não infetadas inoculadas com sobrenadante de culturas de células infetadas.
Vários retrovírus foram investigados e alguns caracterizados, sem que no entanto se tenha provado o papel dos mesmos na patogenia da doença (Schumacher et al.,1994; Wozniak et al., 2000; Jacobson et al., 2001; Huder et al., 2002; Bodewes et al., 2013).
Mais recentemente foram identificados vírus do tipo arenavírus em cobras com a doença dos corpos de inclusão, embora seja ainda necessário realizar estudos utilizando o vírus purificado para estabelecer uma relação causal com a doença (Stenglein et al., 2012; Bodewes et al., 2013; Hetzel et al., 2013).
3.1. Retrovírus
O Retrovírus isolado por Jacobson et al. (2001) em Boa constrictor com Doença dos Corpos de Inclusão era semelhante a um Retrovírus tipo C. Foi medida a atividade da transcriptase reversa em culturas de células infetadas e os elevados níveis de atividade registados poderiam ser a confirmação da presença de um Retrovírus. No entanto, as células infetadas com este Retrovírus não apresentavam as inclusões características da doença.
No estudo de Huder et al. (2002) foi isolado e sequenciado um Retrovírus endógeno de uma Python curtus e de uma Piton Burmesa (Python Molurus Bivittatus), esta última pertencente a uma coleção particular na qual foram registados sinais clínicos compatíveis com a doença dos corpos de inclusão. Outros boídios foram testados para o mesmo vírus, quer estivessem infetados ou não, sendo o resultado negativo. Por este motivo, este estudo sugere que não existe relação entre o Retrovírus em causa e a doença.
3.2. Arenavírus
3.2.1.Taxonomia
O Comité Internacional em Taxonomia de Vírus (ICTV) estabeleceu a família
Arenaviridae (Fig.1) com base em parâmetros morfológicos, físico-químicos e serológicos
(Pfau, 1974; Salvato et al., 2012).
Esta família inclui 25 espécies de vírus cujos hospedeiros são roedores, à exceção do vírus Tacaribe que afeta morcegos. Pelo menos 10 destes vírus podem ocasionalmente infetar seres humanos causando zoonoses (Weissenbacher et al., 1982; Salvato et al., 2012).
Estes vírus estão divididos em dois serogrupos: Velho Mundo (OW) e Novo Mundo (NW), também conhecidos como complexo LASV-LCMV e complexo Tacaribe, respetivamente. O serogrupo do Velho Mundo inclui o vírus da coriomeningite linfocítica (LCMV) e os arenavírus Africanos que infetam roedores da família Muridae, subfamília
Murinae. Os vírus do Novo Mundo incluem arenavírus da América do Sul e do Norte,
infetando roedores da família Muridae, subfamília Sigmodontinae (Gonzalez e Duplantier, 1999).
Juntamente com os critérios que dividem a família Arenaviridae nos grupos NW e OW, a demarcação das espécies é determinada segundo os seguintes critérios: diferenças significativas na reatividade e neutralização cruzadas antigénicas; o fato de participar, ou não, como agente etiológico de doença em humanos; distribuição geográfica; espécies dos hospedeiros; e diferenças significativas nas sequências proteicas comparativamente com outros vírus do mesmo género (Zapata e Salvato, 2013).
3.2.2.Estrutura
O envelope dos Arenavírus envolve partículas contendo genomas bi-segmentados de RNA de cadeia simples, codificando quatro proteínas virais. O segmento menor, de denominação S (~3.4kb), codifica o precursor de glicoproteína (GPC) e a proteína da nucleocápside (NP) que se apresentam como os imunogénios mais importantes do vírus. As sequências do GPC e da NP são separadas por uma região intergénica não codificante (IGR) (Auperin et al., 1984). O GPC é processado num péptido sinal (SSP) e nas porções GP1 e GP2, mediando estas últimas a aglomeração vírica, entrada, descapsidação e determinação do tropismo celular. A NP apresenta múltiplas funções: encapsida os segmentos de genoma viral, interage com a proteína L para formar o núcleo ribonucleico para a replicação e transcrição do RNA, associa-se com a proteína Z para aglomeração lírica, desempenha um papel importante na supressão da resposta inata do sistema imunitário do hospedeiro, possui exonucleases e atividade na ligação dos nucleótidos (Pinschewer et al., 2003; Eichler et al., 2004; Martinez-Sobrido et al.,2006; Casabona et al., 2009; Martinez-Sobrido et al., 2009; Qi et al., 2010; Shtanko et al., 2010; Hastie et al.,2011).
O segmento Maior (L) (~7.2kb), codifica a proteína ligadora de zinco (Z) que, por sua vez, funciona como matriz proteica, interage com a proteína L e com a NP e outras proteínas do hospedeiro, desempenha um papel na transcrição e replicação do vírus, promove a apoptose celular e é essencial para a gemulação viral (Salvato et al., 1992; Borden et al.,1998; Campbell Dwyer et al.,2000; Kentsis et al., 2001; Eichler et al., 2004; Lukashevich e Salvato, 2006; Shtanko et al., 2010). O segmento L também codifica a proteína L que é uma RNA- polimerase RNA dependente (RdRp). As proteínas L e NP são os fatores víricos mínimos necessários para a replicação e transcrição (Lee et al., 2000; Lopez et al., 2001; Pinschewer et al., 2003).
A biologia molecular do Arenavírus tem sido focada na caracterização do papel de cada um dos domínios das suas proteínas virais (in vitro) utilizando plataformas de genética reversa. Contudo, visto que mutações pontuais podem afetar a função de várias proteínas num complexo, tem-se seguido também a abordagem de isolar vírus com diferentes propriedades biológicas (in vivo), determinando-se então quais as mutações que mais contribuem para as funções (in vivo) relacionadas com o fenótipo do vírus. Novas estruturas moleculares e cristalinas vieram elucidar o papel de cada componente, facilitando assim a produção de melhores vacinas e compostos antivirais (Zapata e Salvato, 2013).
3.2.3.Ciclo de vida
De acordo com o amplo leque de hospedeiros e de tropismo celular, a proteína de superfície α-distroglicano (α-DG) foi identificada como o principal recetor para o vírus LCMV,
LASV e para outros arenavírus (Cao et al., 1998), enquanto que o recetor humano transferrina 1 (TfR1) foi identificado como o principal recetor usado pelos vírus do clado B do serogrupo NW (Radoshitzky et al., 2007).
Após a ligação ao recetor, o viriões são introduzidos na célula pelas vias endocíticas clatrina-independente ou clatrina-dependente para os arenavírus dos grupos OW e NW, respetivamente (Kunz et al.,2002; Kunz et al., 2003).
Seguidamente a ribonucleoproteína viral (vRNP) é libertada no citoplasma da célula infetada e, associada à RNA-polimerase celular, inicia a replicação e transcrição do RNA viral. A libertação dos viriões daí resultantes para o exterior da célula infetada envolve a associação da vRNP e do complexo glicoproteíco da superfície celular com a proteína Z (Urata e Yasuda, 2012).
3.2.4.Hospedeiros e patogenia
Vários arenavírus são confirmadamente a causa de febre hemorrágica (VHF) em animais e humanos, incluindo o vírus da coriomeningite linfocítica (LCMV), Lujo (LUJV), Lassa (LASV), Guanarito (GTOV), Junín (JUNV), Machupo (MACV), Sabia (SABV) e Chapare. A febre hemorrágica produz uma grande variedade de sintomas nos indivíduos infetados, dependendo do vírus que a causa embora ocorram algumas semelhanças entre a doença provocada pelos vários agentes etiológicos. O quadro clínico é normalmente caracterizado por febre, indisposição, dor corporal, exantema petequial, desidratação e hemorragias internas e externas. Em estados avançados a doença pode conduzir à morte (Vela, 2012).
Na natureza, os roedores são os principais reservatórios para a maioria dos arenavírus, incluindo todos aqueles que causam doença (Jay et al., 2005). Os morcegos (Artibeus spp.) são, presumivelmente, os reservatórios do vírus Tacaribe (TACV) (Price, 1978) no entanto este vírus ainda não está associado a nenhuma doença em humanos. A transmissão da doença para humanos pode ocorrer por contacto direto com roedores ou excrementos infetados (Vela, 2012).
Em humanos, o LCMV causa meningoencefalite asséptica aguda do Sistema Nervoso Central (Buchmeier et al., 2007). Este vírus está distribuído por todo o mundo e, sendo o seu reservatório o rato doméstico (Mus musculus) também com distribuição mundial, é importante já que muitas pessoas estão expostas a estes animais infetados (Childs e Peters, 1993). A maioria das infeções em humanos resulta em doença febril moderada que começa com dores de cabeça, febre, indisposição e mialgia (Buchmeier et
culminar em meningite ou encefalite. A mortalidade associada a este vírus é inferior a 1% (Vela, 2012).
O vírus LASV é o agente etiológico da doença denominada febre Lassa e o seu principal reservatório é o Rato de Benin (Mastomys natalensis), oriundo de África. Os sinais clínicos incluem dores peitorais, distúrbios gastrointestinais e faringite. Estados mais graves da doença ocorrem em menos de 10% dos casos e podem conduzir a edema facial, hipotensão, vasoconstrição, prostração e choque. A mortalidade em indivíduos hospitalizados está estimada em 15-20% (Buchmeier et al., 2007).
Os restantes vírus do serogrupo NW, o JUNV,MACV,GTOV e SABV têm como hospedeiros os roedores Calomys musculinus, Calomys callosus, Zygodontomys
brevicauda, respetivamente. A infeção provocada por estes vírus conduz a doença com
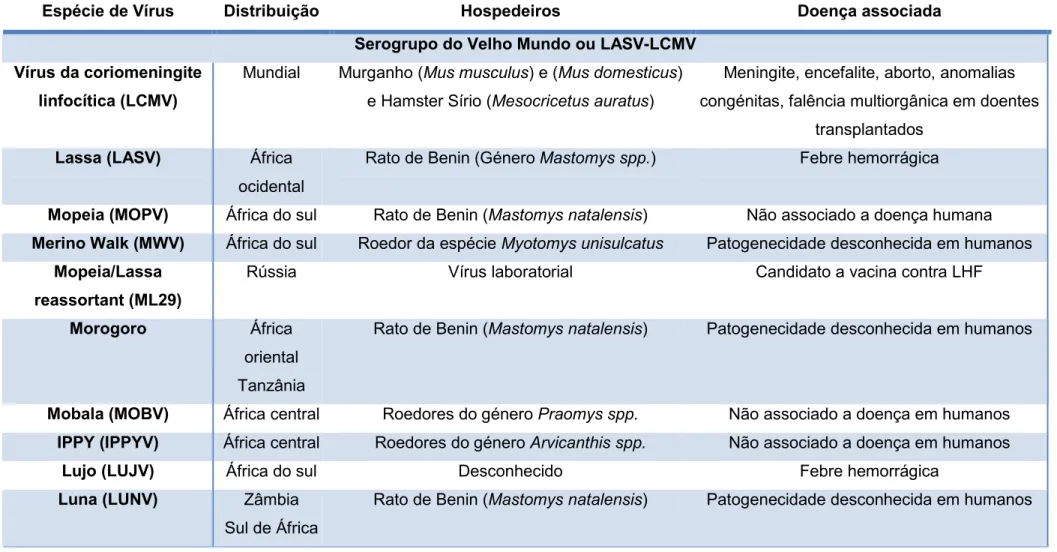
Tabela 1. Lista de todos os arenavírus isolados com respetiva distribuição geográfica, hospedeiros e doenças em humanos associadas (adaptado de Zapata e Salvato, 2013).
Espécie de Vírus Distribuição Hospedeiros Doença associada
Serogrupo do Velho Mundo ou LASV-LCMV Vírus da coriomeningite
linfocítica (LCMV)
Mundial Murganho (Mus musculus) e (Mus domesticus) e Hamster Sírio (Mesocricetus auratus)
Meningite, encefalite, aborto, anomalias congénitas, falência multiorgânica em doentes
transplantados
Lassa (LASV) África
ocidental
Rato de Benin (Género Mastomys spp.) Febre hemorrágica
Mopeia (MOPV) África do sul Rato de Benin (Mastomys natalensis) Não associado a doença humana
Merino Walk (MWV) África do sul Roedor da espécie Myotomys unisulcatus Patogenecidade desconhecida em humanos
Mopeia/Lassa reassortant (ML29)
Rússia Vírus laboratorial Candidato a vacina contra LHF
Morogoro África
oriental Tanzânia
Rato de Benin (Mastomys natalensis) Patogenecidade desconhecida em humanos
Mobala (MOBV) África central Roedores do género Praomys spp. Não associado a doença em humanos
IPPY (IPPYV) África central Roedores do género Arvicanthis spp. Não associado a doença em humanos
Lujo (LUJV) África do sul Desconhecido Febre hemorrágica
Luna (LUNV) Zâmbia
Sul de África
Serogrupo do Novo Mundo ou Tacaribe (Grupo: Sul americano)
Pichindé (PICV) Colômbia Roedor da espécie Nephelomys albigularis Não associado a doença em humanos
Paraná (PARV) Paraguai Roedores da espécie Oryzomys buccinatus e
Oryzomys angouya
Não associado a doença em humanos
Flexal (FLEV) Brasil Roedores das espécies Nephelomys
albigularis, Oryzomys buccinatus e Oryzomys angouya
Doença febril
Pirital (PIRV) Venezuela Rato do algodão Sigmodon alstoni Não associado a doença em humanos
G ru p o A Allpaahuayo (ALLV)
peru Roedores das espécies Oecomys bicolor e
Oecomys paricola
Patogenecidade desconhecida em humanos
Tacaribe (TCRV) Mar das
Caraíbas; Trinidad
Morcego da fruta (Artibeus spp.) Associado a infeções laboratoriais não fatais
Junín (JUNV) Argentina Roedores das espécies Calomys musculinus,
Akodon azarae e Bolomys obscurus
Febre hemorrágica
Candid#1 Argentina Porquinho-da-índia (Cavia porcellus) e
murganho (Mus musculus),seguidos de seleção clonal em células pulmonares fetais
de macaco Rhesus (Macaca mulatta)
Vacina contra a febre hemorrágica argentina
Machupo (MACV) Bolívia Roedor da espécie Calomys callosus Febre hemorrágica
Amapari (AMAV) Brasil Roedores das espécies Oryzomys goeldi e
Neacomys guianae
Não associado a doença em humanos
G
ru
p
o
B
Guanarito (GTOV)
Venezuela Rato da cana Zygodontomys brevicauda Febre hemorrágica
Sabiá (SABV) Brasil Desconhecido
Febre hemorrágica
Chapare (CHPV) Bolivia Desconhecido Febre hemorrágica
Latino (LATV) Bolivia, Brasil Roedor da espécie Calomys callosus Não associado a doença em humanos
Oliveros (OLVV) Argentina Roedor da espécie Bolomys obscurus Não associado a doença em humanos
G ru p o C Pampa virus (PAMV)
Argentina Roedores do género Bolomys spp. Não associado a doença em humanos
Grupo: América do Norte
Catarina (CTNV) Texas Roedor da espécie Neotoma micropus Patogenecidade desconhecida em humanos
Skinner tank vírus (SKTV)
Arizona Roedor da espécie Neotoma mexicana Patogenecidade desconhecida em humanos
Big brunshy tank (BBtv)
Arizona Roedor da espécie Neotoma albigula Patogenecidade desconhecida em humanos
Tonto creek (TTCV)
Arizona Roedor da espécie Neotoma albigula Patogenecidade desconhecida em humanos
Bear canyon (BCNV)
Califórnia Peromyscus californicus , Neotoma macrotis Patogenecidade desconhecida em humanos
Tamiami (TAMV) Florida Sigmodon hispidus Não associado a doença em humanos
G ru p o A Whitewater Arroyo (WWAV)
3.2.5.Arenavírus e a Doença dos Corpos de Inclusão
O Arenavírus surge agora como agente etiológico mais provável para a doença dos corpos de inclusão. A pesquisa de Stenglein et al. (2012) revelou a presença de um número substancial de sequências proteicas, semelhantes àquelas dos arenavírus, em todas as amostras colhidas de animais com diagnóstico confirmado de doença dos corpos de inclusão. Já no estudo de Hetzel et al. (2013) foi isolado e purificado um novo arenavírus, designado University of Helsinki vírus (UHV), de culturas de células provenientes de boídios com a doença.
Até agora pensava-se que a evolução dos arenavírus acompanhava a evolução dos seus hospedeiros. Surge a hipótese de que estes novos arenavírus foram introduzidos nas cobras por ingestão de presas infetadas, como sendo roedores, morcegos. No entanto, estes novos vírus são muito diferentes entre si e também muito diferentes daqueles cujos hospedeiros são roedores. Posto isto, é possível que surja num futuro próximo um terceiro serogrupo na família Arenaviridae que inclua os novos arenavírus associados à doença dos corpos de inclusão (Hetzel et al., 2013).
É possível que a transmissão inicial tenha ocorrido cedo na evolução destes animais, conduzindo a uma coevolução do vírus e do hospedeiro. Esta teoria pode ser suportada pelo facto de que os vírus isolados de espécies de cobras diferentes eram também diferentes entre si (CASV isolado numa Corallus hortulanus e os GGV, CVV e UHV de uma Boa
constrictor). Atualmente a prevalência da doença em populações selvagens, bem como a
origem do vírus permanece desconhecida (Hetzel et al., 2013).
Análises recentes sugerem que os arenavírus podem atravessar a barreira entre espécies e que a sua diversificação se deveu mais à proximidade geográfica entre os hospedeiros do que ao parentesco entre eles (Irwin et al., 2012).
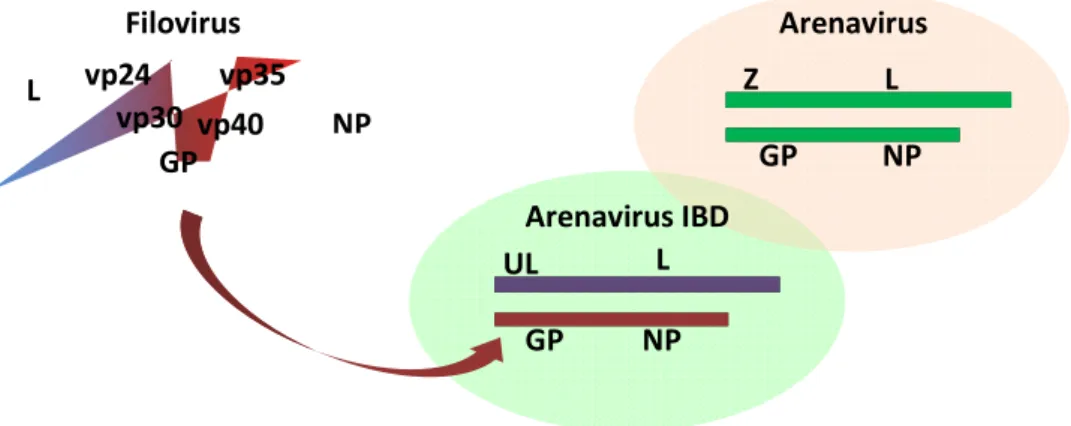
Estruturalmente, o UHV apresenta diferenças na região GP1 que mostra pouca homologia com a mesma região dos arenavírus clássicos (Charrel et al., 2011). Por outro lado, a região GP2 dos arenavírus contem um domínio envolvido por uma membrana e o domínio homólogo é encontrado em filovírus e retrovírus. Baseado nesta homologia, o estudo sugere que ocorreu recombinação entre filovírus e arenavírus (Stenglein et al., 2012). Esta hipotética recombinação conduz a um arenavírus que apresenta os genes L e NP de um arenavírus clássico, o gene GP de um filovírus e o gene Z semelhante a uma ligase ubiquitina celular (UL) (Fig. 2) (Zapata e Salvato, 2013).
Figura 2. Evolução dos arenavírus. Estrutura genómica e proteínas codificadas por filovírus,
arenavírus e arenavírus associado a doença dos corpos de inclusão (adaptado de Zapata e Salvato, 2013).
4. APRESENTAÇÃO CLÍNICA
A doença é clinicamente caracterizada por alterações neurológicas e digestivas. De entre os sinais clínicos neurológicos podem surgir anisocoria, opistotonus, tremores da cabeça, torcicolo, desiquilíbrio, paralisia flácida e incapacidade de retornar à posição natural aquando em decúbito dorsal (Fig. 3) (Schumacher et al., 1994). A regurgitação, anorexia e caquexia apresentam-se como os sinais clínicos digestivos mais comuns (Schumacher, 2006; Chang e Jacobson, 2010; Hetzel et al., 2013).
Consequentemente à infeção de células sanguíneas da linha vermelha e branca, bem como de células mielopoiéticas, ocorre imunossupressão (Wozniak et al., 2000; Chang e Jacobson, 2010). Assim, a maioria dos animais morre por infeções secundárias bacterianas (salmonelose), fúngicas (aspergillose) e protozoárias (amaebiose) que conduzem ao aparecimento de encefalite, pneumonia, hepatite, enterite, osteomielite e processos neoplásicos, nomeadamente linfomas (Schilliger et al., 2011).
As Boa constrictor apresentam sinais clínicos variáveis, tanto neurológicos como digestivos, podendo mesmo tornar-se portadoras assintomáticas. Por sua vez, as Pitons apresentam sintomatologia neurológica grave e geralmente fatal em poucas semanas (Schumacher, 2006; Vanncraeynest et al., 2006; Chang e Jacobson, 2010; Stenglein et al., 2012; Hetzel et al., 2013). NP vp35 vp40 GP vp30 vp24 L Filovirus UL L GP NP Z L GP NP Arenavirus Arenavirus IBD
Figura 3. Boa constrictor com IBD. A) Postura anormal correspondente a infeção do CNS. B)
Incapacidade de voltar a uma posição fisiológica quando colocada em decúbito dorsal (adaptado de Chang e Jacobson, 2010).
5. DIAGNÓSTICO
Perante a suspeita de doença dos corpos de inclusão o diagnóstico poderá ser feito tanto antemortem como post-mortem. Este consiste principalmente na avaliação histológica, com coloração Hematoxilina-Eosina (H-E), de esfregaços sanguíneos e de amostras de biopsia e de necropsia de órgãos como o fígado, rim, pâncreas, tonsilas esofágicas e o sistema nervoso central (Schumacher, 2006; Chang e Jacobson, 2010; Hetzel et al., 2013).
Os corpos de inclusão característicos da doença podem ser difíceis de distinguir de outros grânulos celulares ou de outro material proteináceo depositado no citoplasma da célula afetada (Chang e Jacobson, 2010).
Em alguns casos, as inclusões podem ser pouco numerosas nos tecidos colhidos por biópsia ou aquelas em estadios iniciais podem passar despercebidas no exame histopatológico, daí que seja importante o desenvolvimento de um diagnostico molecular válido, sensível e específico (Chang, 2013).
5.1. Antemortem
O diagnóstico antemortem passa pela avaliação histológica de esfregaços sanguíneos e amostras de biopsias, particularmente das tonsilas esofágicas (Fig. 4) e fígado. A análise hematológica e a bioquímica sérica podem contribuir com informação adicional mas não são a chave para um diagnóstico definitivo (Schumacher et al., 1994; Chang e Jacobson, 2010).
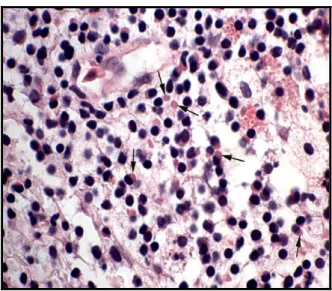
Figura 4. Tonsila esofágica de Boa constrictor com IBD. Coloração H-E. Numerosas inclusões
eosinofílicas intracitoplasmáticas (setas) em células linfoides (adaptado de Chang e Jacobson, 2010).
5.1.1. Esfregaço sanguíneo
O esfregaço sanguíneo tem algum valor diagnóstico uma vez que os corpos de inclusão podem surgir em células da linha vermelha e da linha branca (Fig. 5). Segundo (Hetzel et al., 2013), as células com corpos de inclusão não evidenciam quaisquer outras alterações nem sinais de apoptose ou necrose.
Esta técnica permite detetar infeções moderadas a graves. É necessária alguma experiência para analisar os esfregaços uma vez que os corpos de inclusão podem ser confundidos com outros materiais depositados nas células, conduzindo a falsos positivos. Por outro lado, não sabendo com que frequência as inclusões são encontradas nas células do sangue periférico, é de salientar que a sua ausência não é um resultado negativo, ou seja, não exclui a possibilidade de infeção (Tabela 2) (Knotek et al., 2007).
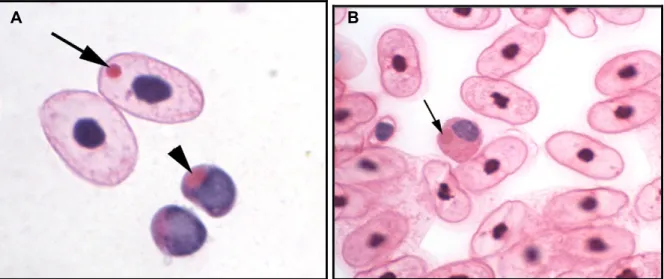
Figura 5. Esfregaço sanguíneo de Boa constrictor com IBD. Coloração H-E. A) Eritrócito (seta) e
linfócito (ponta de seta) contendo inclusões eosinofílicas. B) Inclusão eosinofílica (seta) num heterófilo (adaptado de Chang e Jacobson, 2010).
Tabela 2. Deteção de corpos de inclusão intracitoplasmáticos em Boa constrictor (adaptado de
Knotek et al., 2007).
Inclusões
Animal Eritrócitos/leucócitos Amostra de tecido Boa
constrictor 1
Ausência de corpos de inclusão Inclusões intracitoplasmáticas no fígado, rim, pâncreas e estômago Boa
constrictor 2
Ausência de corpos de inclusão Ausência de corpos de inclusão
Boa constrictor 3
Ausência de corpos de inclusão Inclusões intracitoplasmáticas no fígado, rim, pâncreas e estômago Boa
constrictor 4
Ausência de corpos de inclusão Inclusões intracitoplasmáticas no fígado, rim, pâncreas e estômago Boa
constrictor 5
Ausência de corpos de inclusão Inclusões intracitoplasmáticas no epitélio gástrico, pâncreas e fígado Boa
constrictor 6
Ausência de corpos de inclusão Inclusões intracitoplasmáticas no fígado e uretra
Boa constrictor 7
Ausência de corpos de inclusão Inclusões intracitoplasmáticas no fígado, rim, pâncreas, epitélio
gástrico e pulmões
5.1.1.1. Colheita de sangue
Em cobras, a colheita de sangue pode ser realizada na veia coccígea ventral, na veia palatina ou por cardiocentese. Esta última é apenas recomendada para animais com peso superior a 300g e para o executar corretamente é necessário saber a exata localização do coração. O batimento cardíaco pode ser visualizado externamente, na superfície ventral, aproximadamente no primeiro quarto do comprimento corporal, cranialmente ao movimento pulmonar (Jenkins, 1996; Redrobe e MacDonald, 1999).
Relativamente aos esfregaços sanguíneos, aqueles realizados com sangue fresco apresentam resultados mais fidedignos uma vez que os anticoagulantes, especialmente o EDTA, podem alterar a morfologia celular e a coloração (Jenkins, 1996).
5.1.2. Hematologia e bioquímica sérica
Os animais infetados, numa fase aguda da doença, apresentam alteração dos valores hematológicos e bioquímicos, incluindo leucocitose, linfocitose, redução das proteínas totais e globulinas, bem como aumento dos valores da enzima AST (aspartato
aminotransferase) quando comparados com os valores de animais cronicamente infetados
(Schumacher et al., 1994).
5.2. Post-mortem
O diagnóstico post-mortem é baseado em alterações macroscópicas e histopatológicas. As alterações macroscópicas incluem caquexia, fibrose pancreática, atrofia e fibrose esplénica, lesões nodulares no estômago e esófago, degenerescência hepática, estomatite ulcerativa e pneumonia (Jacobson et al.,1980; Schumacher et al., 1994; Vanncraeynest et al., 2006; Chang e Jacobson, 2010). Quando presente, a encefalite é, normalmente, mais severa em pitons do que em Boa constritor (Chang e Jacobson, 2010).
5.2.1 Microscopia ótica
A deteção de inclusões intracitoplasmáticas eosinofílicas por histopatologia, em preparações coradas com H-E, é considerada o diagnóstico definitivo (Schumacher et al., 1994; Chang e Jacobson, 2010). De acordo com Raymond et al. (2001) os corpos de inclusão são redondos a ovalados com 1-5 µm de diâmetro e Hetzel et al. (2013) relata a existência de corpos de inclusão com diâmetro de 5 a 25 µm.
Em pitons, os corpos de inclusão são mais comuns nos neurónios do Sistema nervoso Central. Por sua vez, as Boa constritor apresentam corpos de inclusão nos
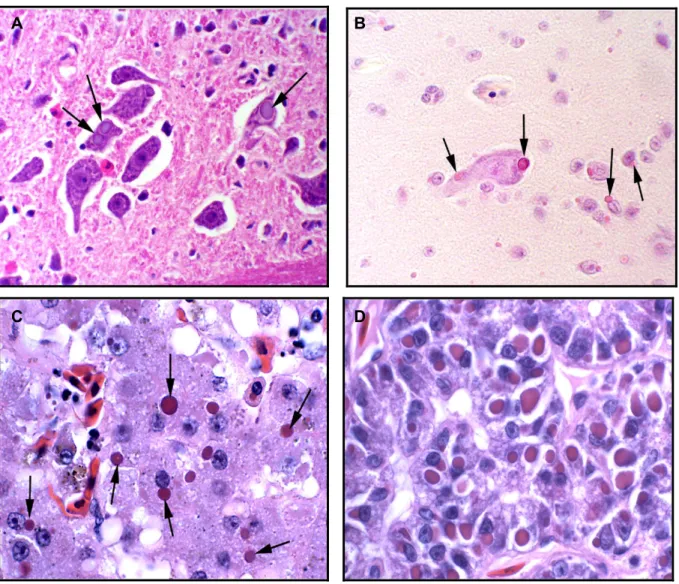
neurónios e células gliais do sistema nervoso central, associados ou não a alguma reação inflamatória, nas células epiteliais do sistema gastrointestinal e respiratório, nos hepatócitos, nas células pancreáticas acinares e nas células epiteliais do túbulos renais (Fig. 6) (Chang e Jacobson, 2010).
Figura 6. Imagens histopatológicas de Boa constrictor com IBD. Coloração H-E. A) Inclusões
intracitoplasmáticas em neurónios cerebrais. B) Inclusões intracitoplasmáticas (setas) em neurónios e células gliais do cérebro. C) Inclusões intracitoplasmáticas (setas) em hepatócitos. D) Células acinares do pâncreas contendo inclusões intracitoplasmáticas (adaptado de Chang e Jacobson, 2010).
5.2.2. Microscopia Eletrónica
Ultraestruturalmente, os corpos de inclusão são visíveis como agregados intracitoplasmáticos de material granular eletrodenso, próximos da membrana nuclear e,
A B
normalmente, sem uma membrana delimitante (Wozniak et al., 2000; Raymond et al., 2001; Vanncraeynest et al., 2006; Hetzel et al., 2013).
Estas inclusões iniciam-se como agrupamentos de pequenas subunidades de derivados poli-ribossómicos (Fig. 7A) (Jacobson e Samueslon, 2007) que aumentam de tamanho à medida que se vão depositando subunidades adicionais na sua periferia. Algumas inclusões apresentam um perfil concêntrico podendo observar-se as subunidades na sua superfície (Fig. 7B) (Chang e Jacobson, 2010).
Figura 7. Imagens de microscopia eletrónica. Boa constrictor com IBD. Coloração com acetato de
uranila e citrato de chumbo. A) Enterócito no intestino delgado, rodeado por subunidades proteicas, no estádio inicial de formação das inclusões. B) Subunidades proteicas depositadas na superfície de um enterócito (adaptado de Chang e Jacobson, 2010).
5.3. Outras técnicas de diagnóstico
5.3.1. Imunohistoquímica
O diagnóstico por Imunohistoquímica é um método recomendado, sensível e especifico quer para doenças infeciosas como para as não infeciosas. Esta técnica consiste na reação de um anticorpo a um antigénio específico, permitindo localizar esse mesmo antigénio nos tecidos afetados e aumentar a precisão de diagnóstico (Ramos-Vara, 2008).
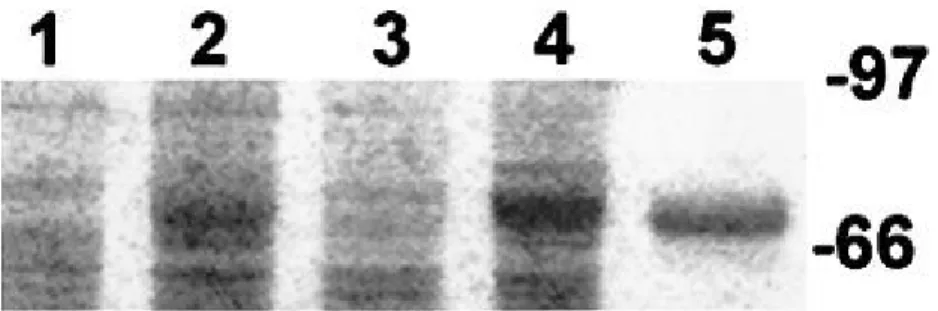
Foi identificada uma proteína constituinte dos corpos de inclusão em Boa constrictor, com peso molecular de 68Kda e denominada como “proteína da doença dos corpos de inclusão” (IBDP) (Fig. 8). Um anticorpo monoclonal produzido desenvolveu reação contra a IBDP em amostras de tecido previamente congelado. No entanto, o mesmo anticorpo não
demonstrou resposta aos corpos de inclusão em amostras conservadas em parafina (Wozniak et al., 2000).
Recentemente, foram produzidos anticorpos policlonais contra a nucleoproteína de um vírus tipo arenavírus que reconheceram os corpos de inclusão em tecidos de animais infetados mas a sensibilidade e especificidade destes anticorpos pode variar e por este motivo não são ainda considerados um diagnóstico clínico válido (Stenglein et al., 2012; Hetzel et al., 2013).
Um anticorpo capaz de reconhecer a proteína dos corpos de inclusão pode servir como uma importante ferramenta para o diagnóstico e para o desenvolvimento de outros testes de diagnostico imunológico para a doença dos corpos de inclusão (Chang, 2013).
Figura 8. Eletroforese em gel. Coloração com Azul brilhante de Coomassie R-250.As faixas 1 e 3
correspondem a fígado e rim de Boa constritor não infetada, respetivamente. As faixas 2 e 4 correspondem a fígado e rim de Boa constritor com IBD, respetivamente. A banda indicativa da proteína 68kD está presente em ambos os tecidos infetados e ausente nos tecidos livres de infeção. A proteína 68kD purificada está representada na faixa 5 (adaptado de Wosniak et al., 2000).
5.3.2. PCR
O PCR por transcrição reversa (RT-PCR) usando RNA purificado surge, segundo Stenglein et al. (2012), como a melhor combinação para um diagnóstico específico, sensível e de fácil recolha de amostras já que o RNA viral é tão abundante no sangue como nos tecidos infetados. No mesmo estudo todas as amostras de animais infetados apresentavam proteínas de arenavírus, como demonstrado pela Imunohistoquímica, e quase todos os animais tiveram um resultado positivo no RT-PCR utilizando um set de primers criados com base nas sequências dos vírus UHV, GGV (vírus Golden Gate) e CASV (vírus Califórnia
Academy of Sciences); estes dois últimos isolados em Boa constrictor e Corallus hortulanus,
respetivamente.
Por sua vez, o estudo de Hetzel et al. (2013) indica que uma das Boa constrictor com diagnóstico positivo para a doença dos corpos de inclusão em esfregaço sanguíneo, histopatologia e Imunohistoquímica e isolamento do vírus em cultura de células, apresentou
resultado negativo em RT-PCR, o que sugere que este método de diagnóstico precisará de ser aperfeiçoado.
6. DIAGNÓSTICOS DIFERENCIAIS
O diagnóstico diferencial mais importante para a doença é o Paramixovirus, uma infeção caracterizada por sinais neurológicos e respiratórios (Vanncraeynest et al., 2006). No entanto, enquanto que na doença dos corpos de inclusão não há normalmente uma resposta tecidular ou celular associada às numerosas inclusões, na infeção por Paramixovirus os animais apresentam pneumonia hemorrágica a necrótica associada a corpos de inclusão eosinofílicos intranucleares ou citoplasmáticos ocasionais (Turchetti et
al., 2013).
6.1.Paramixovirus
Algumas das doenças víricas mais devastadoras em animais e humanos são causadas por vírus da família Paramyxoviridae (Ahne, 1999; Murphy, 1999). O Paramixovirus ofídico (OPMV) foi inicialmente isolado em serpentes Bothrops moojeni (Jacobson, 1997) e, desde a sua descoberta, já foi isolado em todos as grandes famílias de cobras incluindo Elapídeos, Boídios, Colubrídeos e Viperídeos (Clark, 1979; Cranfield, 1996).
Os sinais clínicos associados com a infeção por Paramixovirus são variáveis, normalmente pouco específicos e muitas vezes subtis, incluindo anorexia, regurgitação, dispneia, estridores, pneumonia, emaciação, perda de massa muscular, diarreia mucoide, fezes com mau odor, sobrecrescimento de protozoários intestinais, tremores e stargazing (Sand et al., 2004). As infeções secundárias bacterianas são comuns e podem conduzir a descarga nasal, formação de material caseoso na cavidade oral e respiração forçada ( Aiello e Moses, 2011).
A suspeita de infeção surge sempre que as alterações respiratórias não são responsivas a tratamento de suporte, antibioterapia e nebulizações, no entanto, o OPMV é de difícil diagnóstico, quer antemortem quer post-mortem (Aiello e Moses, 2011). As alterações histológicas mais comuns são pneumonia proliferativa, formação de células sinciciais e desmielinização dos axónios e, no entanto, não são encontradas em todos os animais infetados. Apesar destas lesões serem sugestivas de infeção, o diagnóstico é feito maioritariamente pelo isolamento do vírus em cultura de tecidos (pulmão), demonstração do
vírus por microscopia eletrónica e títulos crescentes do anticorpo específico em animais infetados (por hemoglutinação) (Jacobson, 1992; Sand et al., 2004).
O estado dos animais infetados pode ser melhorado com tratamento de suporte, administração de antibióticos e regras de higiene. Apesar disto, não existe um tratamento específico e a vacina em desenvolvimento ainda não se mostra efetiva (Aiello e Moses, 2011).
7. TRATAMENTO
Ainda não existem vacinas ou tratamento efetivos para a doença, daí que o seu controlo deve ser baseado na prevenção (Vanncraeynest et al., 2006). No entanto, a existência de algumas vacinas para outros arenavírus (Maiztegui, 1998; Fisher-Hoch, 2004; Buchmeier et al., 2007; Ambrosio, 2011) e a utilização eficaz de ribavirina na diminuição da gravidade da febre hemorrágica em humanos (McCormick JB, 1986; Buchmeier et al., 2007; Emonet, 2011) trazem uma nova esperança para a criação de vacinas contra o arenavírus responsável pela Doença dos Corpos de Inclusão (Stenglein et al., 2012).
A condição geral dos animais afetados pode ser melhorada com alimentação forçada e fluidoterapia (Chang e Jacobson, 2010). Todos eles deverão usufruir de um correto intervalo de temperatura nas instalações, daí que seja importante conhecer as necessidades específicas de cada espécie (Rowland, 2011).
7.1. Fluidoterapia
A taxa de rehidratação de um réptil é de 20 a 30 ml/kg/dia e pode ser administrada por diversas vias: oral, subcutânea, intramuscular, intracelómica e intravenosa. Subcutaneamente é possível administrar pequenos volumes já que grandes volumes poderão ser dolorosos. A via intramuscular também permite a injeção de pequenos volumes e tem como local de eleição a musculatura obliqua adjacente à coluna vertebral; a injeção deve ocorrer por baixo de uma escama e apontada cranialmente, após assépsia do local. Para administração de grandes volumes e rápida absorção, é utilizada a via intracelómica. O local de administração deve ser no quarto caudal do corpo, na junção das escamas ventrais e laterais, no lado esquerdo. Esta via acarreta risco de trauma iatrogénico de alguns órgãos e infusão nos sacos aéreos. A veia jugular pode ser cateterizada para administração por via intravenosa. Em cobras de maiores dimensões pode ser utilizada a veia coccígea ventral, a veia palatina direita é também acessível mas frágil podendo não ser possível repetir a
administração. Em situações de emergência, pode recorrer-se a administração intracardíaca (Rowland, 2011).
8. PROFILAXIA
Na ausência de tratamento para a doença dos corpos de inclusão é importante apostar numa boa profilaxia e num bom programa de medicina preventiva para diminuir o risco de introdução da doença numa coleção e de transmissão em programas de reprodução, começando por procurar a ajuda de um veterinário especializado em medicina de répteis e por conhecer a história pregressa dos novos animais introduzidos na coleção. Com a crescente facilidade de compra e venda destes animais, sem qualquer tipo de controlo, aumenta a probabilidade de aquisição de animais provenientes de coleções infetadas não diagnosticadas. Deste modo, é recomendado que os novos animais sejam adquiridos de criadores reconhecidos que possuam programas de medicina preventiva (Chang e Jacobson, 2010).
8.1. Quarentena
No que diz respeito à diminuição do risco de doenças infeciosas é essencial fazer a quarentena de novos animais antes da sua introdução na coleção. A quarentena deve ter a duração mínima de 90 dias, devendo alguns animais permanecer mais tempo nestas condições. Raramente é realizada uma verdadeira quarentena, na qual todos os animais deveriam entrar e sair no mesmo dia, 90 dias depois, e permanecer alojados totalmente separados da coleção em que vão ser introduzidos. Após este período de tempo, apenas os animais livres de piolhos e ácaros, com apetite e boa condição corporal devem ser introduzidos na coleção existente (Chang e Jacobson, 2010).
O ideal será a existência de duas áreas de quarentena separadas, uma para os novos animais que entram na coleção e a segunda para o isolamento dos animais já pertencentes à coleção que manifestaram a doença (Stahl, 2001). Estas áreas devem ser visitadas apenas ao final do dia para assim evitar nova passagem pelas instalações da restante coleção (Mader, 1996).
No maneio dos animais em quarentena devem ser utilizadas luvas descartáveis e todos os instrumentos utilizados devem permanecer separados daqueles usados na restante coleção e, preferencialmente, esterilizados. As jaulas de quarentena devem ser fáceis de limpar, ainda assim respeitando as necessidades ambientais de cada espécie (temperatura,
luz, humidade, etc.). Igualmente, o substrato deverá ser fácil de mudar e permitir a avaliação das fezes, podendo ser utilizado jornal para o efeito (Pasmans et al., 2008).
8.2. Controlo de ectoparasitas
As carraças, ácaros e piolhos são ectoparasitas muito comuns tanto m populações de répteis selvagens como em coleções particulares. O ácaro Ophionyssus natricis é o ectoparasita mais comum nos répteis mantidos em cativeiro, afetando maioritariamente cobras. É possível que as presas vivas (roedores) utilizadas na alimentação possam introduzir o ácaro na coleção, daí que as presas rejeitadas pelos animais em quarentena nunca devem ser oferecidas a outros animais. Os ectoparasitas podem ser detetados usando o teste da fita-cola (Pasmans et al., 2008).
A desinfeção dos terrários contra os ectoparasitas pode ser efetuada por uso de fipronil (Pasmans et al., 2008). Em cobras e lagartos, o fipronil pode ser substituído por ivermectina, diluída de 1 mL em 1 L de água (Kahn, 2005).
8.2. Rastreio
Dependendo da disponibilidade financeira do detentor dos animais, para além da quarentena, pode ser feito o despiste da doença recorrendo à colheita de sangue e avaliação dos esfregaços sanguíneos, procurando corpos de inclusão nas células sanguíneas. Apesar de mais dispendiosa e menos prática do que a avaliação do esfregaço sanguíneo, a biópsia de linfonodos, rim e fígado também possui grande valor diagnóstico antemortem (Chang e Jacobson, 2010).
8.3. Gestão da coleção
Normalmente, um animal diagnosticado com doença dos corpos de inclusão não é um caso isolado sendo quase certa a existência de outros animais infetados dentro da mesma coleção. Assim, nos casos extremos em que vários animais são diagnosticados e em que muitos são suscetíveis por partilharem o mesmo espaço, o extermínio total da coleção apresenta-se como uma opção viável. Uma segunda opção passa por remover da coleção apenas os animais que apresentem sinais clínicos de doença dos corpos de inclusão, colocá-los num espaço distinto ou submetê-los a avaliação microscópica ou mesmo necropsia (Chang e Jacobson, 2010).
Se possível, deve evitar-se a mistura de diferentes espécies na mesma instalação. Isto prende-se com o facto de que, por exemplo, as Boa constrictor são vistas como
reservatórios da doença podendo transmiti-la a espécies mais suscetíveis como as pitons (Schumacher et al., 1994).
Uma das questões que se levanta relativamente a esta doença é a possibilidade de transmissão vertical, ainda por falta de informação e de meios de diagnóstico apropriados, sensíveis e específicos. Ainda assim, como medida de prevenção, a descendência de animais infetados não deve permanecer na coleção (Chang e Jacobson, 2010).
A limpeza das jaulas deve ser realizada para remoção de todo o material orgânico, seguida da desinfeção com soluções apropriadas, como hipoclorito de sódio (0.15%), que deverá permanecer em contacto com o material um mínimo de 15 minutos. As jaulas devem permanecer vazias durante, pelo menos, duas semanas antes da introdução de novos animais (Stahl, 2001).
8.3.1. Necrópsia
A necrópsia é um método de monitorização eficaz e económico uma vez que permite recolher informação importante sobre doenças infeciosas, metabólicas e mau maneio (Stahl, 2001).
Os animais em quarentena ou qualquer réptil da restante coleção que, eventualmente, morra devem ser submetidos a uma necrópsia completa, assim como uma avaliação histopatológica de todos os tecidos incluindo o cérebro. A recolha de amostras e consequente pesquisa de infeções víricas, bacterianas, parasitárias e fúngicas também deve ocorrer neste exame post-mortem (Jacobson, 1999).
9. OBJETIVOS
Este estudo pretendeu determinar a presença da Doença dos Corpos de Inclusão na colecção de répteis do Zoo da Maia, entre dezembro de 2013 e abril de 2014, sendo motivado pelo histórico de sinais clinicos compativeis com a doença em alguns dos animais no passado. Assim, teve como principais objectivos:
• A realização de uma revisão bibliográfica atualizada, visando desta forma aumentar e aprofundar o conhecimento acerca da Doença dos Corpos de Inclusão;
• Avaliar esfregaços sanguineos para identificação de corpos de inclusão em eritrócitos e leucócitos;
• Averiguar a validade do exame de esfregaços sanguíneos como meio de diagnóstico inicial.
10. MATERIAL E MÉTODOS
10.1. Animais
Foram, inicialmente, integrados neste estudo 43 ofídios de várias espécies, de diferentes idades e pesos,incluindo machos e fêmeas. Todos eles nascidos e criados em cativeiro. Os animais foram avaliados independentemente de apresentarem ou não sinais clinicos compatíveis com a doença dos corpos de inclusao, uma vez que já existia historial clinico em outros animais da coleção, num período anterior ao período do estudo, incluindo anorexia, vómito, diarreia, sinais neurológicos e morte.
Após uma primeira avaliação de esfregaços sanguíneos, apenas prosseguiram para a fase seguinte do estudo 10 animais, num dos quais foi realizada biopsia ecoguiada tendo sido os restantes 9 sujeitos a eutanásia e necropsia.
10.2. Colheita e processamento das amostras
As amostras de sangue para realização dos esfregaços sanguíneos foram colhidas por punção intracardíaca em 26 animais, por punção da veia palatina em 8 animais e da veia coccígea ventral em 9 animais; nestes últimos a um terço do comprimento da cauda, caudalmente à cloaca.
As amostras colhidas por biopsia ecoguiada, foram conservadas em formol a 10% até serem reenchaminhadas para avaliação histopatologica no Laboratório de Histologia e Anatomia Patológica da UTAD.
Os cadáveres dos animais submetidos a necropsia foram mantidos em refrigeração e enviados, no próprio dia da eutanásia, para o Laboratório de Histologia e Anatomia Patológica da UTAD.
10.3. Metodologia
Para a pesquisa de corpos de inclusão nos eritrócitos e leucócitos recorreu-se a avaliação de esfregaços sanguíneos. Posteriormente, procedeu-se à eutanásia, necropsia e avaliação histopatologica dos animais cujo esfregaço sanguíneo apresentou corpos de inclusão; excetuando um, do qual apenas se enviou para laboratório amostras de fígado,rim e pulmão, obtidas por biopsia ecoguiada.
A preparação e avaliação dos esfragaços, a eutanásia e a biopsia ecoguiada foram realizadas nas instalações do Zoo da Maia. Por sua vez, tanto as necropsias como a conservação e avaliação histopatologica das amostras foram executadas no Laboratório de Histologia e Anatomia Patológica da UTAD, seguindo os protocolos vigentes no mesmo. 10.3.1. Sedação e anestesia
A sedação de todos os animais para colheita de sangue foi assegurada pela utilização de Cloridrato de Tiletamina e Cloridrato de Zolazepam (Zoletil®100), na dose de 4 mg/Kg, administração IM (músculos epaxiais).
Para a indução anestésica na realização da biopsia ecoguiada recorreu-se a Alfaxalona, na dose de 10 mg/kg e administração IM.
10.3.2. Preparação e avaliação dos esfregaços sanguíneos
Para pesquisa e identificação de inclusões eosinófilas intracitoplasmáticas em leucóticos e eritrócitos foram elaborados 43 esfregaços sanguíneos, correspondentes a cada animal em amostra. A elaboração do esfregaço consistiu em:
• Recolha de sangue por punção intracardíaca, da veia palatina ou da veia coccígea ventral;
• Colocação de uma gota de sangue na extremidade da lâmina de observação microcópica;
• Extensão do sangue em esfregaço ao longo da lâmina e secagem durante 30 minutos;
• Fixação e coloração com Hemacolor® da Merck,de acordo com as instruções do fabricante (Anexo 1), seguida de lavagem com água corrente e secagem ao ar.
Após a elaboração dos esfregaços procedeu-se à observação dos mesmos: • Primeira avaliação da lâmina (ampliação 100x);
• Obervação dos elementos sanguíneos na objetiva de imersão (ampliação 1000x); • Recolha de imagens fotográficas em casos positivos;
• Repetição da observação nos casos com resultados duvidosos.
10.3.3. Biopsia ecoguiada
A biopsia foi efetuada em apenas um dos animais cujos esfregaços sanguíneos apresentavam inclusões eosinofílicas intracitoplasmáticas compatíveis com a doença dos corpos de inclusão. Foram colhidas amostras de rim, fígado e pulmão que, posteriormente
foram conversadas em formol a 10% e enviadas para o Laboratório de Histologia e Anatomia Patológica da UTAD.
10.3.4. Eutanásia
A eutanásia dos 9 animais, entre 10 com resultado positivo no esfregaço sanguíneo, foi efetuada com administração intracardíaca de pentobarbital sódico (Eutasil® 200 mg/ml) na dose de 86 mg/kg.
10.3.5. Necropsia
Os cadavéres foram enviados em refrigeração, no próprio dia da eutanásia, para o Laboratório de Histologia e Anatomia Patológica da UTAD, onde foram sujeitos a necropsia completa para averiguar a existência de alterações macroscópicas e para recolha de amostras de rim, intestino, fígado, pâncreas e pulmão para exame histopatologico.
10.3.6. Histopatologia
Tanto os tecidos colhidos durante a necropsia como os tecidos colhidos por biopsia foram sujeitos a exame histopatologico no Laboratório de Histologia e Anatomia Patológica da UTAD. Os tecidos de alguns dos cadáveres foram congelados antes de fixados.
Para a fixaçao do material foi usado formol a 10% tamponado, sendo de seguida submerso em parafina. Foram obtidas secçoes de 2-3 µm e posteriormente coradas com Hematoxilina e Eosina (H-E).
10.3.5. Análise estatística
Os dados recolhidos foram tratados com recurso ao programa de software Microsoft Excel® 2010 da Windows.
11. RESULTADOS
11.1. Caracterização da amostra
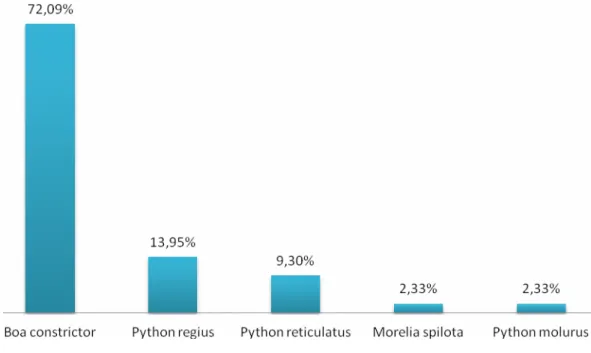
De entre os 43 animais avaliados, a espécie mais frequente foi a Boa constrictor com 72,09% (31 animais), seguida da Python regius com 13,95% (6 animais) e da Python
reticulatus com 9,30% (4 animais). As espécies Morelia spilota (1 animal) e Python molurus
(1 animal) estiveram representadas ambas a 2,33%, como demonstra o gráfico 1. Nesta população, 16 dos animais (37%) eram juvenis e 27 eram adultos (63%) (Gráfico 2).
Como anteriormente referido, os animais foram avaliados independentemente de apresentarem ou não sinais clínicos compatíveis com a doença. Assim sendo, entre os 43 animais, apenas uma Boa constrictor apresentava anorexia e caquexia marcada.
Gráfico 2. Proporção dos grupos etários na população.
A média de pesos obtida foi de 3,32 kg, com peso mínimo de 0,085 kg e máximo de 15,6 kg. Por forma a melhor elucidar a distribuição dos pesos na população amostrada,foram constituídos 7 intervalos de valores. Esta informação está representada na tabela 3 e gráfico 3.
Tabela 3. Distribuição dos animais da população por intervalo de pesos. (Frequência absoluta)
Intervalo de peso (kg) Número de animais
0,08-1,64 19 1,64-3,19 8 3,19-4,74 5 4,74-6,29 4 7,84-9,39 1 9,39-10,95 5 14,05-15,60 1
Gráfico 3. Distribuição dos animais da população por intervalo de pesos. (Frequência relativa)
12.2. Esfregaços sanguíneos
Foram encontradas inclusoes intracitoplasmáticas eosionofilícas compatíveis com os corpos de inclusão da doença em estudo, em apenas 10 dos 43 animais (23%) da população inicial. Todos estes 10 animais eram da espécie Boa constrictor, 9 dos quais adultos e o último um juvenil (Tabela 4). As inclusões em questão eram visíveis em maior abundância em eritrocitos do que em leucócitos, mas pouco abundantes por campo (Fig.9).
Tabela 4. Resultado da pesquisa de corpos de inclusão nos esfregaços sanguíneos.
Positivos Espécie Adulto Juvenil Negativos Boa constrictor 9 1 21 Python regius 0 0 6 Python reticulatus 0 0 4 Morelia spilota 0 0 1 Python molurus 0 0 1