En particulier, nous décrivons le mécanisme de transport du Pvd à travers la membrane externe via le RTBD FpvA. Le sixième chapitre traite de l'étude du devenir de la pyoverdine ferrique dans le périplasme après son transport par la RTBD FpvA.
Les sources de fer pour les bactéries à Gram-négatif
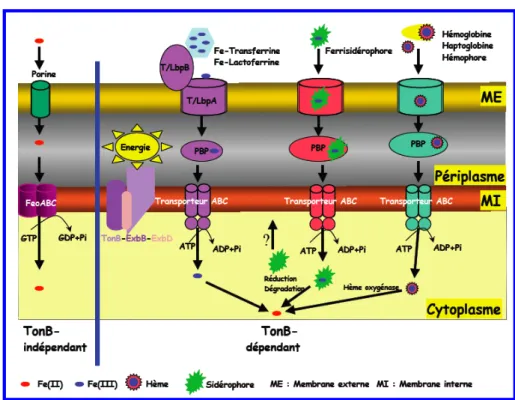
Les voies de transport de fer impliquant les sidérophores et les récepteurs TonB-dépendants
Les sources de fer pour les bactéries à Gram- négatif
Le fer
Les sources de fer lors d’une infection
Acquisition du fer chez les bactéries à Gram-négatif
- Le fer sur terre
- Le fer et les micro-organismes
- Biodisponibilité du fer
- Le fer et pouvoir pathogène
- Homéostasie du fer
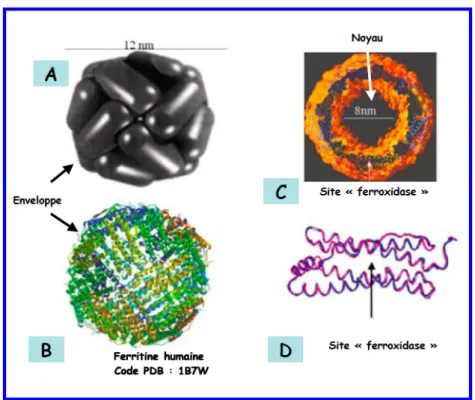
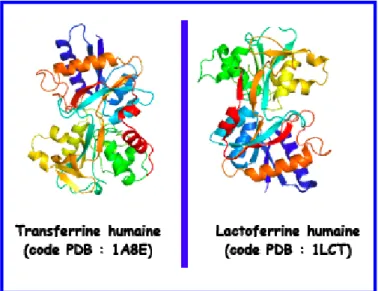
- Les protéines de régulation de la concentration du fer 1. La transferrine et la lactoferrine
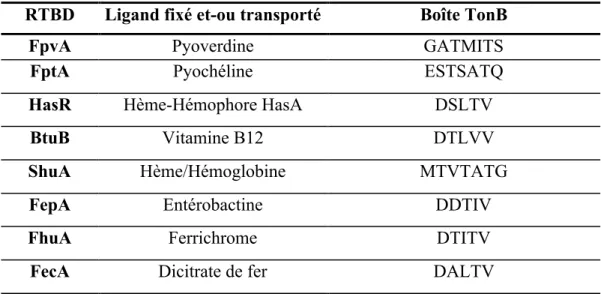
- Le dicitrate de fer
- Acquisition du fer ferreux libre par le système FeoABC
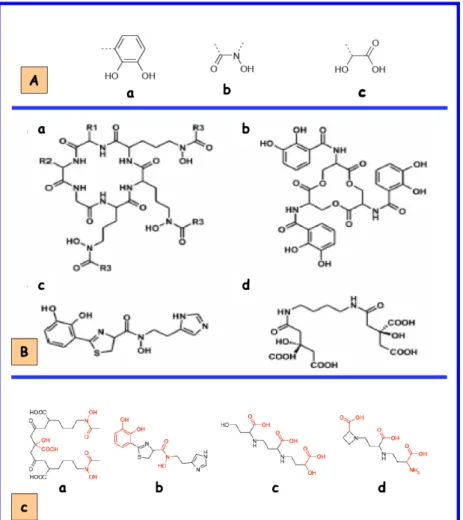
- Acquisition du fer par les sidérophores 1. Définition
- Fonctions
- Acquisition du fer par les hémophores 1. Définition
- Les systèmes à hémophores a) Le système HxuA
À l’exception de certaines souches de Lactobacilles (Imbert & Blondeau, 1998) et des agents de la maladie de Lyme : Borrelia burgdorferi (Posey & Gherardini, 2000) et de la syphilis : Treponema pallidum (Posey et al., 1999), tous les autres micro-organismes ont besoin de fer pour multiplier. Dans le milieu extracellulaire, HxuA pourrait reconnaître le complexe hème-hémopexine, extraire l'hème et le délivrer au récepteur membranaire externe HxuC (Morton et al., 2007).
Les voies de transport de fer impliquant les sidérophores et les récepteurs TonB-dépendants
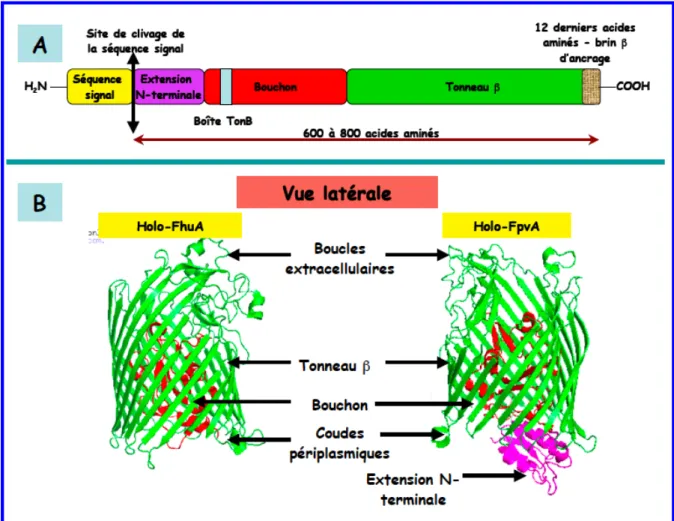
Les récepteurs TonB-dépendants (RTBDs) 1. Abondance
Cette dernière est liée de manière covalente à la lipoprotéine majeure de Braun de la membrane externe. La membrane externe est très asymétrique, elle est composée de phospholipides du côté périplasmique et principalement de lipopolysaccharides (ou lipooligosaccharides : cas des Neisseriae) du côté extracellulaire.
Les récepteurs TonB-dépendants (RTBDs)
1. Abondance
- Rôles biologiques
- Structures primaire et tridimensionnelle
- Classification
- Interaction ferri-sidérophore-RTBD
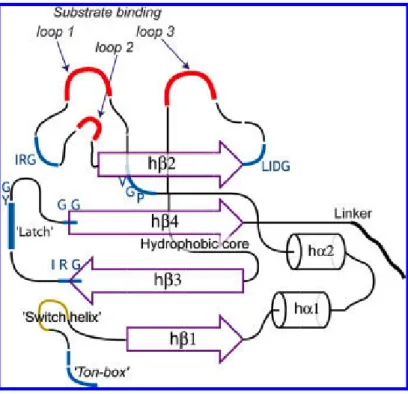
- Site de liaison et formation du complexe ferri-sidérophore-RTBD
- Changements de conformation du RTBD a) Changements de conformation au niveau des boucles
Dans la structure FptA-ferri-pyochelin, la boucle L8 recouvre également le site de liaison (Cobessi et al., 2005a). A droite, avec le dicitrate-Fe, le site de liaison est invisible après avoir été recouvert par les boucles L7 et L8 (Ferguson et al., 2002).
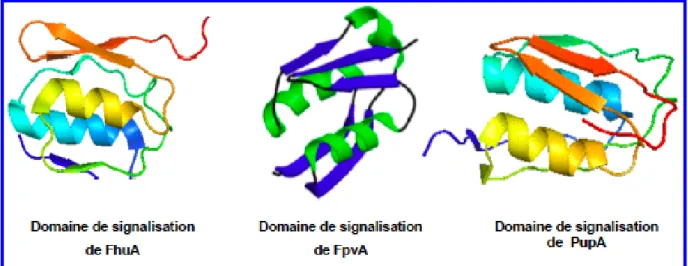
Changements de conformation au niveau du domaine de signalisation
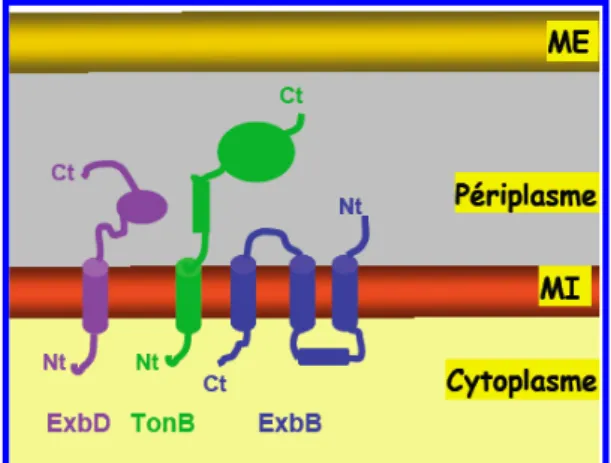
- Le complexe TonB-ExbB-ExbD (système Ton)
- La protéine TonB d’E. coli a) Topologie
- Stoechiométrie du complexe TonB-ExbB-ExbD
- Interaction TonB-RTBD
- Transduction d’énergie par le complexe TonB-ExbB-ExbD
- Transport à travers la membrane externe
Le domaine C-terminal de la protéine ExbD pourrait participer à la formation du complexe TonB-ExbB-ExbD (Braun et al., 1996). En effet, la réinsertion du segment transmembranaire de la protéine TonB dans la membrane interne est une étape thermodynamiquement défavorable.
L’adsorption par des résidus des boucles extracellulaires du ferri-sidérophore à la surface du RTBD est suivie de sa liaison au site de liaison spécifique avec une affinité de
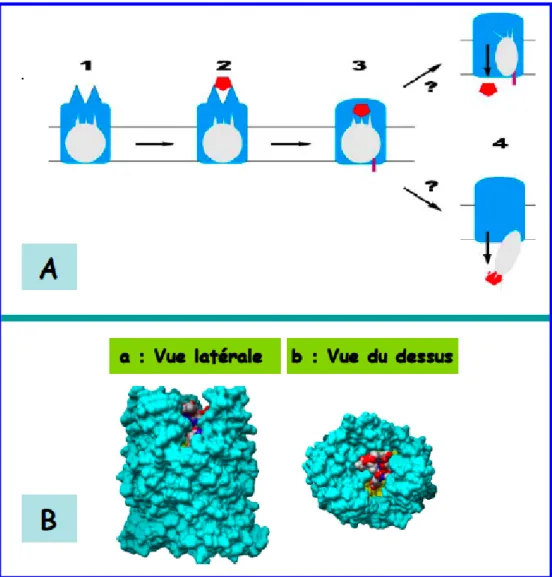
Le transport des sidérophores ferriques à travers la membrane externe implique la présence ou la formation d'un canal, sachant qu'aucun pore ou canal n'est observé dans les structures des RTBD. Un mécanisme général de transport via les RTBD est proposé. Il se compose de 4 étapes, basées sur les connaissances actuelles et résumées dans la figure 19A.
Étape 3- Les boucles extracellulaires subissent des changements de conformation importants et se referment sur le ferri-sidérophore pour le piéger dans son site de liaison et
Étape 4- Après l’interaction physique entre la boîte TonB du RTBD et la partie C- terminale de la protéine TonB, le ferri-sidérophore translate à travers le RTBD
- Transport à travers la membrane interne
- Dissociation des complexes ferri-sidérophores
- Régulation génétique de l’acquisition du fer 1. Régulation par la protéine Fur
- Régulation par les facteurs ECF
Au niveau de la membrane interne, BtuC et BtuD s'assemblent pour former un hétéro-tétramère fonctionnel (BtuC2D2) (Figure 21) (Locher et al., 2002). La protéine Fur possède un site structural par monomère pour le zinc, essentiel à l'activité protéique (Jacquamet et al., 1998).
Acquisition de l’hème chez les bactéries à Gram-négatif
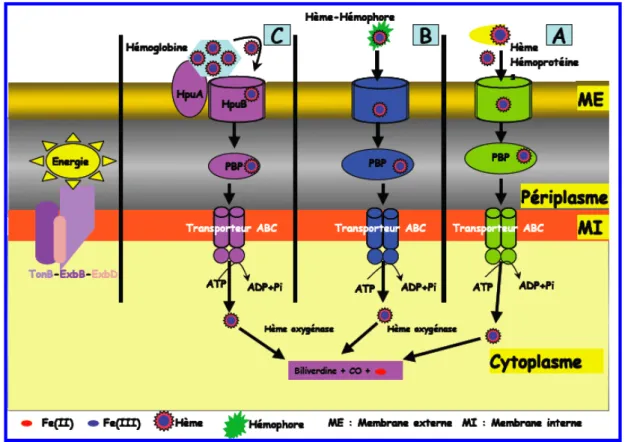
Systèmes d’acquisition de l’hème
Le deuxième système d'acquisition de l'hème implique des hémophores, du RTBD, une protéine périplasmique et un transporteur ABC (Figure 24B). L'hémophore sécrété a pour fonction de chélater l'hème libre ou de l'extraire des hémoprotéines et de le livrer aux RTBD. Les bactéries peuvent utiliser directement l’hème libre ou lié aux hémoprotéines comme source de fer (A).
Ils peuvent également synthétiser et sécréter dans le milieu extracellulaire de petites molécules peptidiques, les hémophores (B), qui vont chélater l'hème libre ou l'extraire des hémoprotéines et le délivrer aux RTBD. Dans le cas de Neisseria meningitidis, le transport de l'hème depuis l'hémoglobine est effectué par un système en deux parties contenant une RTBD et une lipoprotéine de la membrane externe (C). Dans tous les cas, l'hémophore et les protéines hèmes de leur hème sont déchargées au niveau de la membrane externe, seul l'hème est transporté via les RTBD.
Acquisition directe de l’hème
- Transport de l’hème à travers la membrane externe
- Interaction RTBD-hème
- Devenir de l’hème
Et une protéine cytoplasmique (ShuS) qui peut séquestrer l'hème et protéger la cellule des effets toxiques de l'hème libre (Wilks, 2001). Contrairement aux récepteurs sidérophores, les récepteurs hème ont une identité de séquence élevée (90 % dans certains cas) (Stojiljkovic & Perkins-Balding, 2002). Après avoir traversé la membrane externe via la RTBD, l’hème est internalisé dans le périplasme.
La translocation de l'hème par le transporteur ABC à travers la membrane interne s'accompagne d'une hydrolyse de l'ATP (Burkhard & Wilks, 2008). Initialement identifiée chez les mammifères, l'hème oxygénase protège les cellules contre les effets toxiques de l'hème libre (Wilks, 2002). En revanche, il a été démontré que l'expression du récepteur de l'hème HgbA chez Haemophilus ducreyi est régulée par les niveaux d'hème (Elkins et al., 1995).
Acquisition du fer par la voie pyoverdine chez P. aeruginosa
- Transport à travers la membrane externe 1. Structure de FpvA
- Caractéristiques génétiques
- Facteurs de virulence
- Sidérophores et virulence
- Les sidérophores utilisés par P. aeruginosa
- Pvd de P. aeruginosa PAO1 a) Structure
- Transport à la membrane externe via FpvA
- Structure de FpvA
- Site de liaison de la ferri-pyoverdine
- Changements de conformation induits par la liaison de la ferri-pyoverdine
- La protéine TonB
- Translocation à travers la membrane externe
- Devenir du complexe ferri-pyoverdine 1. Dissociation dans le périplasme
- Transport à travers la membrane interne
- Régulation de l’acquisition du fer par la voie Pvd
Ils sont ensuite acquis et activement transportés dans le périplasme bactérien via la RTBD (Takase et al., 2000b). En fonction du métal chélaté, les propriétés spectrales et de fluorescence du Pvd sont modulées (Braud et al., 2009). La combinaison d'approches génomiques (identification des gènes impliqués dans la synthèse du Pvd et attribution de fonctions aux protéines correspondant à chaque gène) et biochimiques (test des hypothèses soulevées par les approches génomiques) ont permis de comprendre les différentes étapes impliquées dans la biosynthèse et maturation du Pvd (Visca et al., 2007).
La biosynthèse du Pvd commence dans le cytoplasme avec l'assemblage d'un précurseur non fluorescent par les NRPS : la ferribactine (Merriman et al., 1995). L'exportation du précurseur non fluorescent du Pvd (ferribactine) à travers la membrane interne vers le périplasme est assurée par le transporteur ABC PvdE (McMorran et al., 1996). En présence de ces complexes, une augmentation de la production de Pvd a été observée (Braud et al., sous presse).
Résultats & discussion
Études structurales des récepteurs TonB- dépendants de bactéries à Gram-négatif
Mise en place d’un protocole pour l’étude structurale des RTBDs
- Contexte et objectifs
- Surexpression
- Solubilisation et purification
- Rendement des cultures bactériennes
- Choix du détergent
- Cristallisation
- Collecte des données de diffraction
- Conclusion et perspectives
Toute étude structurale d'une protéine par cristallographie commence généralement par le clonage, la surproduction et la purification de la protéine d'intérêt. Ainsi, l’insertion de l’étiquette poly-His à l’extrémité N-terminale des RTBD semble empêcher leur ciblage vers la membrane externe par accumulation au niveau de la membrane interne. Ceci s'explique par la surface limitée de la membrane externe pour l'intégration des récepteurs dans celle-ci.
Lors de la cristallisation des protéines membranaires, les détergents ne facilitent pas les tentatives de cristallogenèse. La faible hauteur de la solution dans la goutte entraîne ainsi deux inconvénients. Malgré des efforts importants ces dernières années, la résolution de la structure des protéines membranaires reste un défi.
Structure de ShuA, récepteur de l’hème/hémoglobine de Shigella dysenteriae
- Contexte et objectifs
- Surexpression et purification
- Cristallogenèse
- Collecte des données de diffraction
- Traitement des données de diffraction et phasage
- Analyse de la structure
- Fixation et transport de l’hème
- Conclusion et perspectives
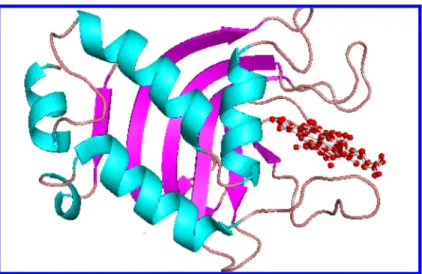
Other bacteria such as Serratia marcescens secrete hemophores, which bind to heme and are recognized by their respective outer membrane TBDT to deliver heme to the cell.9 The first crystal structure of a hemophore TBDT, HasR, was recently solved.10. The heme binding signal may involve a hydrogen bond network that goes from His86 to the TonB box. At the extracellular face, Figure 2. The plug and the barrel are colored pink and green, respectively.
His86 is located on top of the plug domain and is solvent exposed. This signal transduction pathway could lead to a conformational change of the TonB-box to interact with TonB. Characterization of the outer membrane receptor ShuA from the heme uptake system of Shigella dysenteriae.
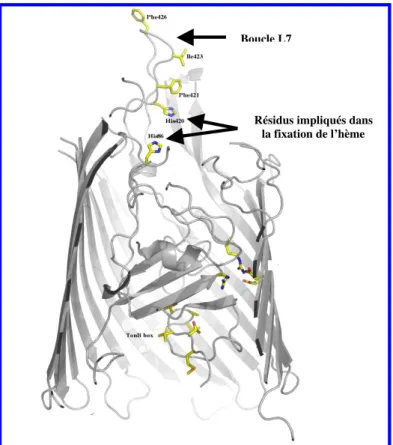
Caractérisation fonctionnelle des protéines impliquées dans le transport de la ferri-
Caractérisation fonctionnelle des protéines de l’opéron fpvCDEF
Caractérisation fonctionnelle du transporteur ABC FpvGHJK
Le transport de la ferri-pyoverdine par FpvA nécessite de l'énergie fournie par la force motrice des protons à travers la membrane interne. L'incorporation de fer à travers la membrane externe via RTBD FpvA a été surveillée à l'aide de ferri-pyoverdine, dont le fer est radioactif (55Fe). Les étapes suivant la liaison de la ferri-pyoverdine au récepteur FpvA ont été visiblement abolies chez le mutant « fpvC ».
Il a déjà été démontré en laboratoire que la dissociation de la pyoverdine ferrique se produit dans le périplasme et implique une réduction de Fe3+ en Fe2+ (Greenwald et al., 2007). Ces résultats suggèrent également un lien entre le transport à travers la membrane externe, via FpvA, et l'étape de dissociation du fer de la pyoverdine ferrique dans le périplasme. Ces protéines seront impliquées dans la dissociation périplasmique de la pyoverdine ferrique par réduction de Fe3+ en Fe2+.
In the presence of oxygen, iron(II) is rapidly oxidized to iron(III), which is precipitated as a polymeric oxyhydroxide. Bacteria were incubated in the presence of PVDI-55Fe and the radioactivity incorporated into the cells was monitored. We then assessed the effect of pH on the dissociation of PVDI-Fe in the presence of DTT and ferrozine.
Consistent with previous findings (24), an increase in fluorescence was observed upon addition of PVDI-Fe to PAO6382, corresponding to the dissociation of PVDI-Fe (formation of fluorescent apo PVDI) in the bacterial periplasm. PVDI-Fe dissociation kinetics were monitored in PAO6382 (red bars), PAO6662 (green bars) and PAOpvdFfpvA (blue bars) cells in the absence of DTT. As a control, the experiment was repeated in the absence of PVDI-Fe and DTT.

PAO6598 PAO1
Ces résultats confortent l'implication de la protéine FpvG dans l'acquisition du fer par le Pvd. L’état actuel des connaissances concernant la voie Pvd nous amène à émettre l’hypothèse que la protéine FpvG pourrait prendre le contrôle du fer après dissociation périplasmique de la pyoverdine ferrique. La protéine FpvG pourrait également être impliquée dans la dissociation de la ferripiovardine en jouant le même rôle que celle de la ferrozine in vitro.
L'implication de FpvG et FpvK dans ce type de mécanisme de dissociation de la ferri-pyoverdine n'a pas encore été déterminée. Après dissociation de la ferri-pyoverdine, le Pvd est recyclé vers le milieu extracellulaire par une pompe à efflux (Imperi et al., 2009) (Yeterian et al., sous presse)). Dans le périplasme, les protéines du cluster FpvCDEF seraient impliquées dans la dissociation de la ferri-pyoverdine par réduction de Fe3+ en Fe2+.
FptX, a member of the Major Facilitator Superfamily (MFS) was shown to be required for pyochelin-mediated iron uptake (8). Binding of the periplasmic binding protein FecB to transmembrane proteins FecCD in the ferric citrate transport system of Escherichia coli. Crystal structure of the pyoverdin outer membrane receptor FpvA from Pseudomonas aeruginosa at 3.6 A resolution.
The role of carboxy-terminal phenylalanine in the biogenesis of the outer membrane protein PhoE of Escherichia coli K-12. Characterization of a periplasmic heme-binding protein secreted from the heme uptake system of Shigella dysenteriae. Nuclear magnetic resonance solution structure of the periplasmic signaling domain of the TonB-dependent outer membrane transporter FecA from Escherichia coli.