Je tiens également à remercier mon directeur de thèse, Hervé Desvaux, d'avoir accepté d'encadrer la thèse et d'avoir toujours pris le temps de m'écouter et de me conseiller tant sur les aspects scientifiques que professionnels. Yann, je ne pense pas que tu regrettes de m'avoir accompagné dans cette aventure, mais je t'en suis reconnaissant.
Introduction
Généralités sur le CO 2
- Aspects environnementaux
- Les hydrocarbures et le CO 2 anthropologique
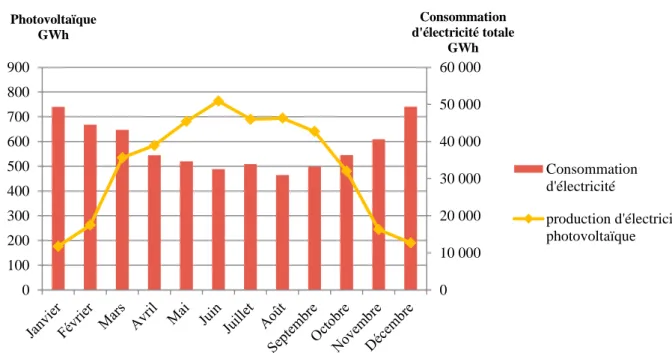
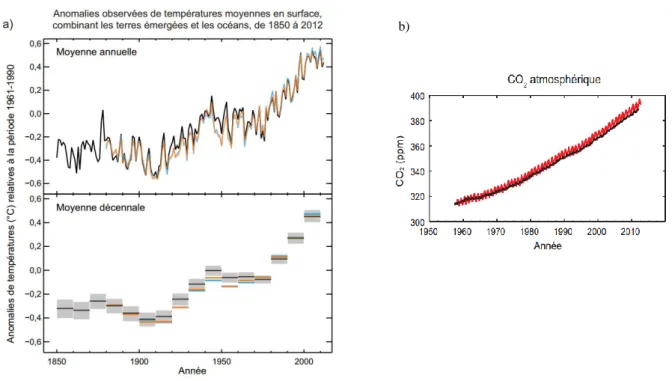
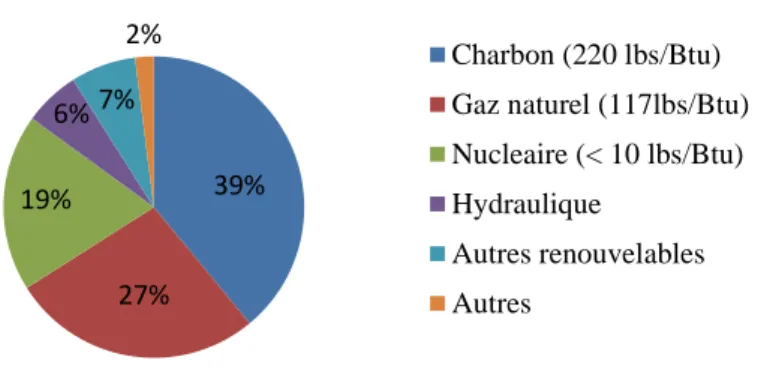
Aujourd’hui mise en avant pour son impact sur le climat, elle est pourtant cruciale pour l’équilibre de la biosphère. Aujourd’hui, 95 % de la consommation mondiale d’énergie destinée aux transports provient de ressources fossiles.
- Vers une alternative aux ressources fossiles dans le secteur de l’énergie
- Le CO 2 : une source de carbone pour la synthèse de produits chimiques
Le tableau ci-dessous regroupe les différents modes de stockage de l'électricité et de la chaleur ainsi que leurs caractéristiques. Le stockage d’énergie à bord constitue donc un enjeu pour réussir à se débarrasser des hydrocarbures, notamment dans le secteur des transports.
- Les contraintes liées à l’utilisation du CO 2
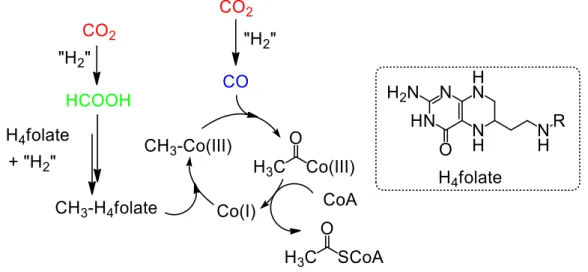
- La fixation du CO 2 dans la voie de Wood-Ljungdhal
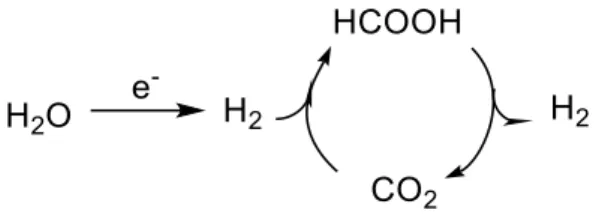
- Inter-conversion entre CO 2 , CO et HCOOH
- L’acide formique : un relai pour réduire le CO 2
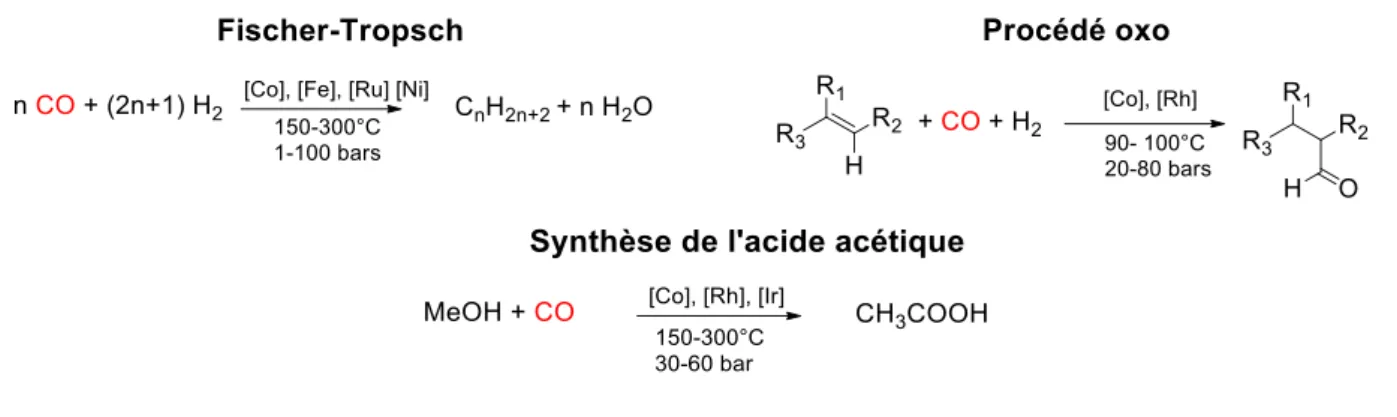
- Le CO : une plateforme pour la synthèse de liaisons C–C à partir du CO 2
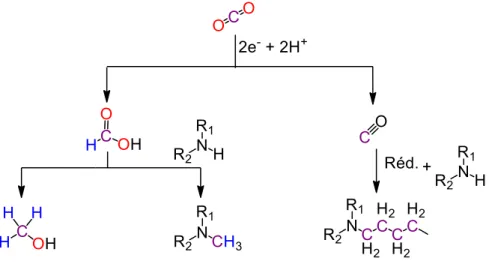
L'acide formique ne peut être un relais efficace pour la synthèse indirecte de produits chimiques à partir du CO2 que s'il est obtenu de manière efficace et renouvelable à partir de ce dernier. Il peut donc être considéré comme une bonne plateforme pour la synthèse indirecte de produits chimiques à partir du CO2.
Présentation des travaux développés au cours de la thèse
Inspirés par la nature et la voie Wood-Ljungdhal pour la synthèse de l'acétate, nous avons souhaité lors de cette thèse développer des réactions à partir de molécules facilement et directement accessibles depuis le CO2 afin de nous affranchir des limitations liées à ce dernier. Nous avons développé plusieurs réactions catalytiques utilisant l'acide formique et le monoxyde de carbone, qui sont les principaux dérivés du CO2.
- Électro-réduction et photo-réduction du CO 2
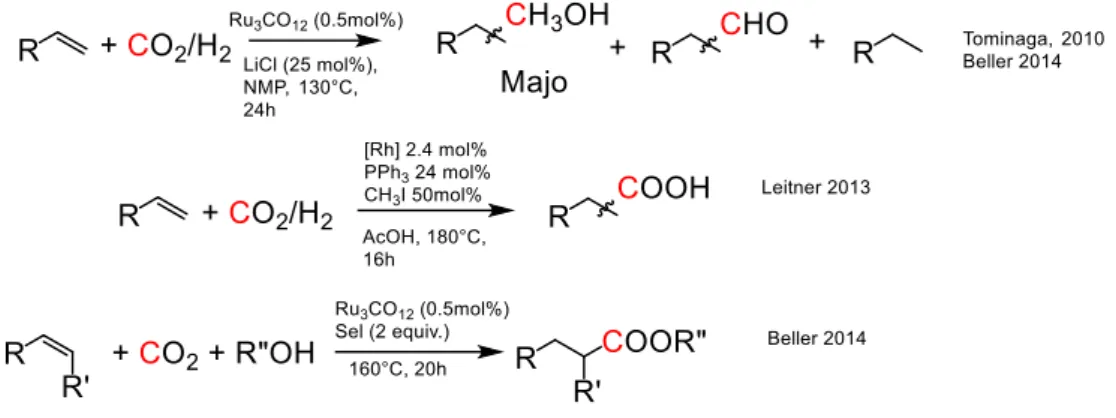
- L’hydrogénation du CO 2
- Hydroboration et hydrosilylation du CO 2
- Notre démarche
- Etat de l’art sur la disproportionation de l’acide formique
- Choix du catalyseur
- Premiers essais
- Optimisation de la réaction de disproportionation
- Etudes mécanistiques
- Nouveaux catalyseurs pour la disproportionation de l’acide formique
- Conclusions et perspectives sur la disproportionation de l’acide formique
- État de l’art sur la réduction photochimique du CO 2 en acide formique
- Étude de la formation du méthanol à partir du CO 2 via l’acide formique
- Conclusions et perspectives sur la réduction indirecte du CO 2 en méthanol via l’acide
Figure II–12 : Evolution en RMN 1H de la réaction brute de dismutation de l'acide formique avant (en rouge) et après 17 heures à 80 °C (en bleu). Ce complexe est probablement également formé par décarbonylation du méthanol et catalyse la déshydrogénation mais pas la dismutation de l'acide formique. Cependant, on sait aussi que la dismutation de l’acide formique entre en compétition avec sa déshydrogénation en produisant du H2 et du CO2.
Ainsi, les complexes 5 et 6 sont bien impliqués dans la formation du méthanol, mais également dans la déshydrogénation de l'acide formique en méthanol. Figure II–19 : Mécanisme proposé pour la réaction de dismutation de l'acide formique avec le complexe 1. Le fer a également attiré notre attention en tant que candidat potentiel pour la dismutation de l'acide formique.
C'est aujourd'hui le complexe de nickel le plus actif pour la déshydrogénation de l'acide formique. Parallèlement à l'optimisation de la réaction de photoréduction, nous avons essayé d'appliquer les différentes conditions de réduction à la dismutation de l'acide formique avec 1 (Tableau II-11).
Conclusion et perspectives
Méthylation des amines avec l’acide formique comme seule source de carbone et de
- Utilisation des méthylamines
- Etat de l’art sur la synthèse des méthylamines à partir du CO 2
- Notre approche
- Synthèse de méthylamines à partir de l’acide formique
- Premiers tests catalytiques de méthylation des amines avec HCOOH
- Optimisation de la réaction
- Criblage des substrats pour la méthylation des amines
- Etudes mécanistiques
- Conclusion et perspectives
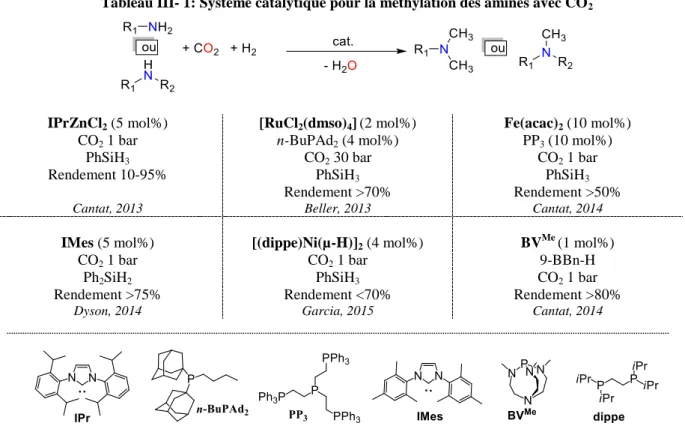
L’acide formique étant un relais de liaison C-H efficace (voir chapitre 2), nous avons voulu tenter de réaliser une méthylation des amines à partir de l’acide formique. Nous avons donc choisi d'utiliser ce complexe pour développer la réaction de méthylation des amines à partir de l'acide formique. Pour explorer le potentiel de la réaction, nous avons testé la méthylation d'amines avec de l'acide formique sur plusieurs substrats.
Quant à la dismutation de l'acide formique, plusieurs mécanismes peuvent être proposés pour la méthylation des amines à partir de HCOOH (Figure III-7). Au début de la réaction, l'acide formique est consommé, à la fois par déshydrogénation (production de H2) mais aussi par formylation de l'amine. Depuis le début de ces travaux, le groupe de Beller s'intéresse également à la méthylation et à l'alkylation des amines avec l'acide formique.
Le monoxyde de carbone pour la synthèse renouvelable d’alkylamines
Etat de l’art sur l’homologation des amines
- La synthèse des alkylamines : notre démarche
- Etat de l’art sur la carbonylation et la réduction
Figure IV–5 : État de l’art pour la carbonylation des amines tertiaires et des sels d’ammonium quaternaire. Par exemple, des catalyseurs tels que le fer pentacarbonyle ou l'acétylacétonate de ruthénium, qui sont efficaces pour l'élimination des alcools, peuvent également être efficaces dans la carbonylation des amines. Idéalement, l'homologation des amines se ferait avec du gaz de synthèse (CO + H2), de l'hydrogène issu de la biomasse ou de l'électrolyse de l'eau.
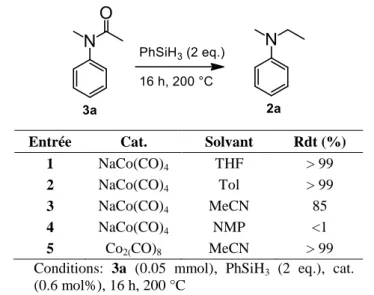
Pour ces raisons, nous avons d’abord étudié la réaction d’homologation des amines en utilisant un hydrosilane comme agent réducteur. Cette dernière apparaît donc comme le meilleur candidat pour procéder à l'homologation des aminés en présence de CO et d'hydrosilanes. Bien que le Co2(CO)8 soit connu pour être efficace à la fois pour la carbonylation des amines et la réduction des amides en amines, plusieurs défis sont à prévoir lors de l'approbation des amines.
Homologation des amines catalysée au cobalt
- Homologation ―one pot-two steps‖
- Réaction en une seule étape contrôlée
- Formation de chaînes longues par homologation
- Conclusions et perspectives
Figure IV–10 : Chromatogramme GC/MS de la réaction d’homologation de la N,N-diméthylaniline en deux étapes 2a. Il est rincé à l'hydrogène 3 fois avant d'être porté à la pression de réaction et chauffé pendant 16 heures. L'activité accrue du Co2(CO)8 en présence de phénylsilane ne provient donc pas de la formation d'une espèce R3SiCo(CO)4.
Figure IV–12 : Suivi RMN 1H de la réaction entre PhSiH3 et MeI en présence de Co2(CO). La faisabilité de l'enregistrement des amines dans un seul pot et en particulier de l'enregistrement de la N-éthylaniline dans la N-propylaniline (tableau IV-7, entrée 10) indique qu'il est possible d'atteindre un degré d'approbation plus élevé. Par ailleurs, la réactivité de l'indoline lors de la réaction d'homologation suggère qu'il est possible de transférer la chaîne formée vers un atome de carbone.
Homologation des amines catalysée par le fer
- Etat de l’art sur l’homologation des alcools catalysée par le fer
- Homologation
Le mécanisme proposé pour l’homologation du méthanol catalysé par le fer consiste en la création d’une espèce hautement nucléophile [HFe(CO)4]- par activation de l’hydrogène (équation 6). Dans nos conditions, la présence d'amines tertiaires peut permettre la carbonylation et/ou l'homologation des amines. La première réaction d’homologation d’amine avec Fe(CO)5 a été réalisée dans des conditions similaires à celles impliquant Co2(CO)8.
Un promoteur (MeI) a également été ajouté à la place du Me3N utilisé pour l'homologation de l'alcool car il semble plus facile de former le complexe alkyl-fer à partir de celui-ci. Comme pour l'homologation catalysée au cobalt, la réaction est très propre, nous n'avons observé que le produit de départ et 25% de l'amine 2a homologuée (Entrée 4). Ces premiers résultats d’enregistrement sont prometteurs, nous avons donc commencé à étudier simultanément l’enregistrement en one-pot et la carbonylation des amines.
Conclusion et perspective
Ce travail fait l'objet de la thèse de Tawfiq Nasr-Allah qui porte principalement sur l'optimisation de la carbonylation des amines avec des catalyseurs à base de fer. Nous espérons donc mieux comprendre ce catalyseur et développer une réaction de carbonylation des amines alternative à celle décrite avec le palladium ou le cobalt. L'homologation des amines nécessite encore beaucoup de développement, mais nous espérons que les études mécanistiques que nous entreprendrons (suivi IR, voltammétrie cyclique, suivi RMN) sur les intermédiaires catalytiques permettront de mieux comprendre la réaction et de l'optimiser en plus détail... qui sont par exemple des déchets industriels) ou par l'hydrogène.
Cela peut être réalisé dans un seul pot en utilisant des catalyseurs insensibles à la pression du CO ou en deux étapes. Ru(acac)3 semble un bon candidat en deux étapes car il est à la fois capable de catalyser l'homologation des alcools, et, en présence d'un ligand triphos, après une étape intermédiaire de purge de l'atmosphère du CO, de réduction des amides. L'imine obtenue par condensation de l'amine sur l'aldéhyde est beaucoup plus facilement réductible que l'amide et de nombreux autres catalyseurs peuvent donc être envisagés (Figure IV-24).213.
Conclusions et Perspectives
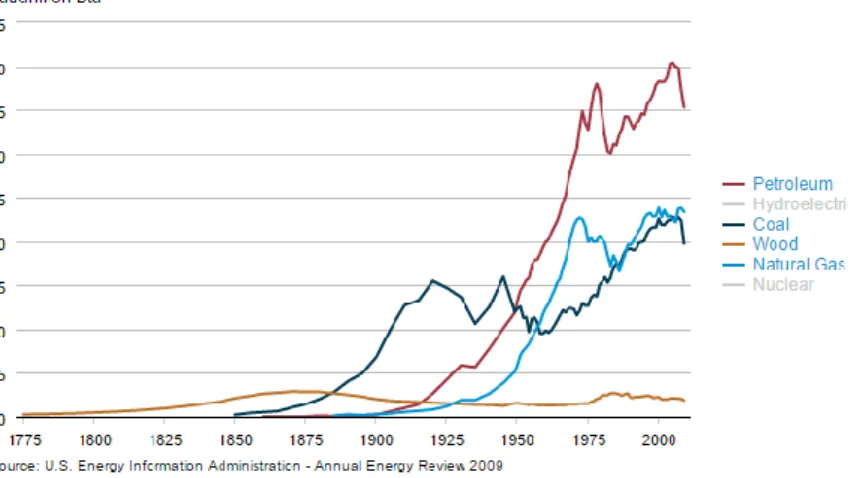
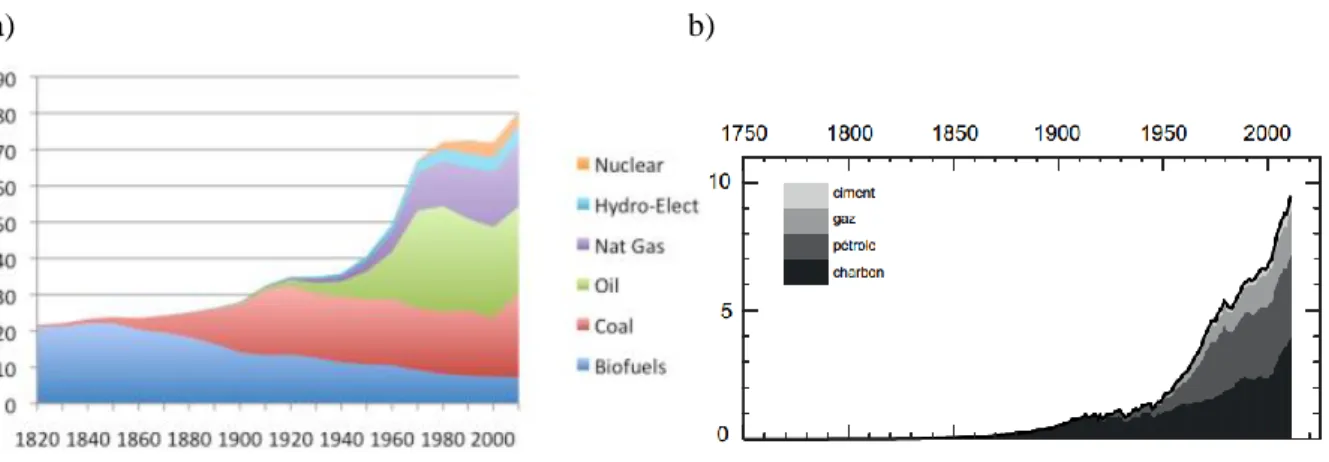
Etat des lieux des ressources énergétiques
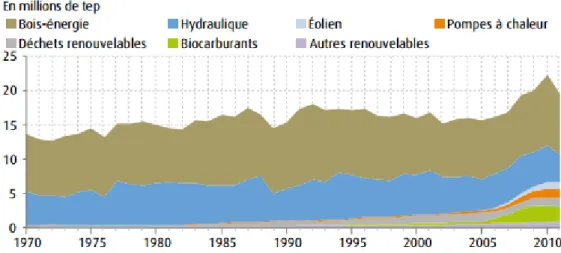
Dans la fabrication de produits chimiques, c’est le carbone contenu dans la molécule qui est utilisé. En 2011, les énergies renouvelables représentaient en France 14 % de la production totale d'électricité, alors qu'en 2004, elles en représentaient 10 %.
Le défi des énergies renouvelables intermittentes
Associés aux recherches visant à accroître l’efficacité de l’électrolyse de l’eau et des piles à combustible, des efforts doivent être faits pour trouver les moyens de stocker et de transporter l’hydrogène pour en faire véritablement un vecteur énergétique à bord. Aujourd'hui, ces efforts se portent particulièrement sur la sorption sur solides (hydrures métalliques) ou sur le stockage sous forme d'acide formique formé à partir de CO2 et d'hydrogène.
Stocker l’énergie dans le CO 2
La réduction du CO2 s'accompagne donc souvent de faibles rendements faradiques, ce qui pose problème pour l'industrialisation des procédés nécessitant une réduction du CO2. 17. Nous avons donc examiné la chimie de ces molécules pour déterminer si elles pouvaient également servir de plate-forme pour une utilisation efficace du CO2 comme élément de base moléculaire dans la synthèse de produits chimiques.
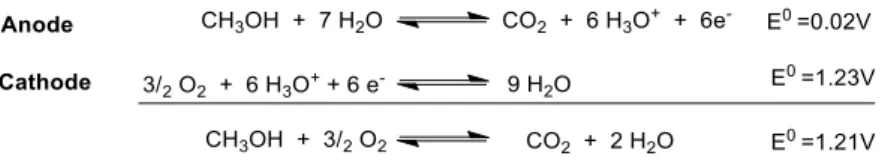
Ainsi, depuis les premiers travaux d'Inoue sur l'hydrogénation du CO2 en formiate, de nombreux efforts ont été déployés pour obtenir des TON dépassant le million.41. En effet, l’hydrogénation du CO2 produit non seulement de l’acide formique, mais aussi du formaldéhyde, du méthanol et du méthane.
Avantages de l’acide formique
Synthèse durable de CO à partir de CO 2
Électro-réduction du CO2 : Le CO peut également être obtenu à partir du CO2 par électro-réduction. Le principal problème de l'électroréduction du CO2 est la sélectivité des produits obtenus et la nécessité d'apporter des protons.
Avantages du monoxyde de carbone
En revanche, beaucoup de ces catalyseurs sont actifs pour la déshydrogénation de l'acide formique avec ou sans l'aide d'une base. Cette étude démontre clairement les difficultés inhérentes à la dismutation de l'acide formique, notamment dues à la compétition avec la déshydrogénation. Les sous-produits de la réaction sont l'hydrogène et le CO2 formés par déshydrogénation de l'acide formique et le méthanol (<5 %) formé par dismutation de l'acide formique.
La formation de méthanol (5 %) et de CO2 et H2 (45 % ; rendement par rapport à HCOOH) provenant respectivement de la dismutation et de la déshydrogénation de l'acide formique est la principale cause de limitation du rendement faradique (Figure III-5). Les connaissances que nous avons pu tirer de la réaction de dismutation de l'acide formique dans le méthanol nous ont permis d'utiliser l'acide formique comme seule source de carbone et de protons pour la synthèse de la méthylamine. De plus, nous avons développé une nouvelle réaction pour la méthylation des amines à partir de l'acide formique.
Figure V– 6 : Transfert de chaîne alkyle lors de l'homologation pour former des indolines substituées. Nous avons donc développé plusieurs réactions catalytiques utilisant l’acide formique et le monoxyde de carbone, qui sont les principaux dérivés du CO2.