Sa disponibilité et sa gentillesse m'ont fait réaliser à chaque instant quelle chance j'avais de pouvoir travailler dans des conditions de travail optimales. J'ai pu démontrer que la protéine de fusion BRD4-NUT était suffisante pour induire la tumorigenèse, grâce à un mécanisme de séquestration de la protéine histone acétyltransférase (HAT) CBP/p300.
Structure, dynamique et plasticité de la chromatine
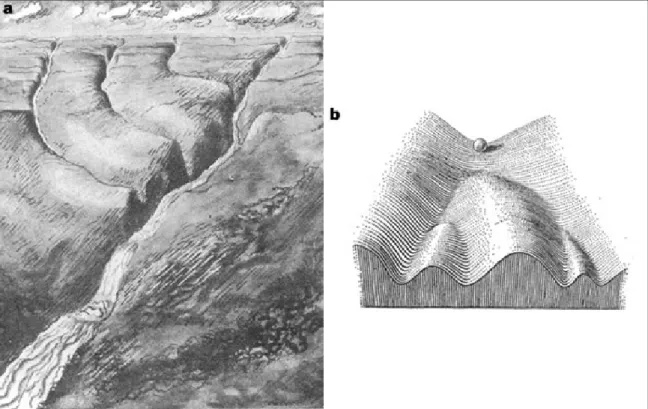
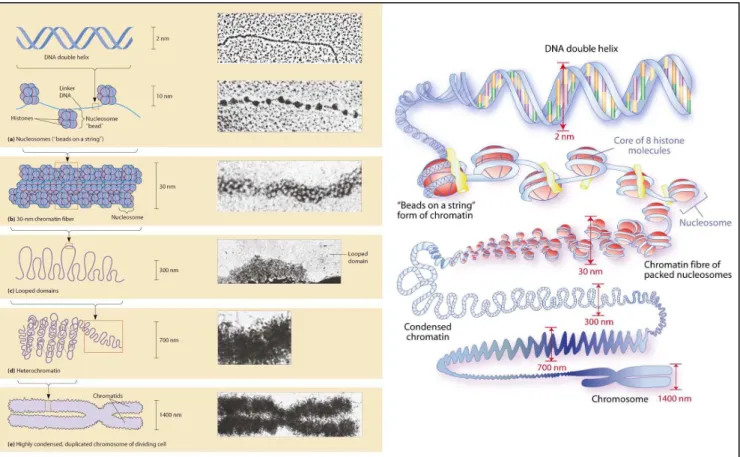
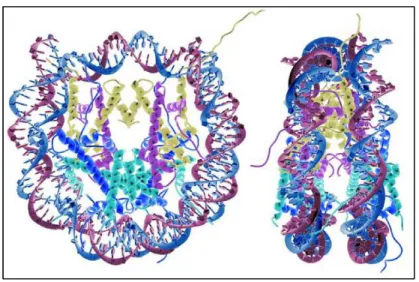
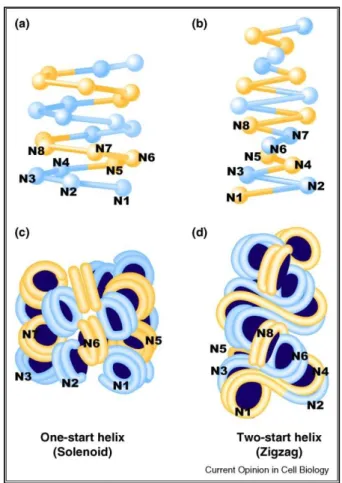
Quelle est la structure de la chromatine et comment peut-elle être modifiée pour apporter des informations supplémentaires à celle de l’ADN ? Cette plasticité de la chromatine, et la régulation de l’expression des gènes qui en résulte, est directement liée à l’épigénome, vecteur de l’information épigénétique.
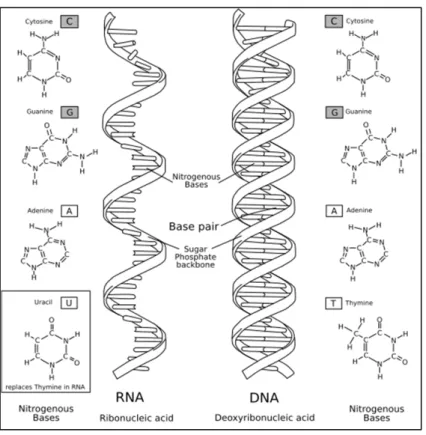
L’information épigénétique et ses acteurs
La méthylation de l'ADN est également utilisée comme moyen de contrôler la fidélité de la réplication. La méthylation de l’ADN est également un point clé dans la régulation de l’expression des gènes.
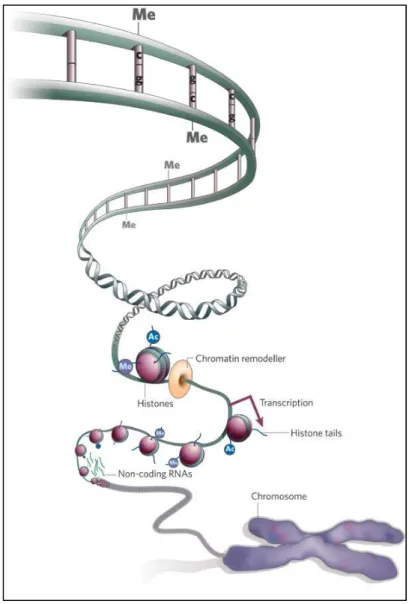
Epigénétique et pathologies humaines
En effet, les données suggèrent une méthylation accrue de l'ADN ribosomal dans le foie et les lignées germinales de rat (Oakes et al, 2003). Contrairement à cette diminution globale de la méthylation de l’ADN, l’hyperméthylation des îlots CpG participe également à la tumorigenèse. De plus, de nombreuses mutations dans les domaines PHD de la famille ING sont détectées dans les types de cancer (Chi et al, 2010).
En effet, dans les cellules souches embryonnaires (ES), les gènes importants sur le plan du développement sont réprimés de manière réversible par la création de i. Les changements globaux dans l’épigénome d’un cancer entraînent la dérégulation de centaines de gènes au cours de la tumorigenèse.
Conséquences de la protéine fusion BRD4-NUT dans les cancers
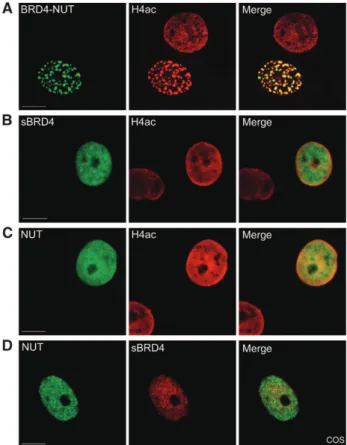
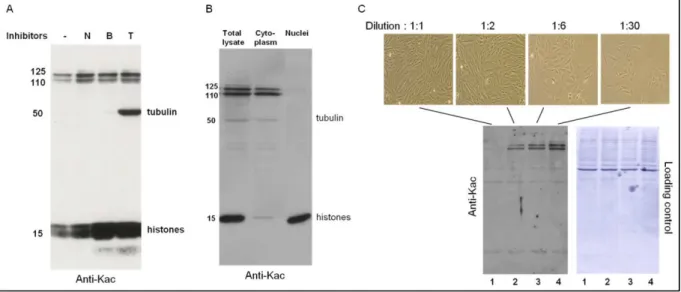
Consistent with this observation, no accumulation of H3K4me3 was observed in the BRD4-NUT foci (Supplementary Figure S2C, H3K4me3 panel). Endogenous p300 was observed to be associated only with NUT or BRD4-NUT (Figure 2B, lanes 2 and 4). This change was also perfectly localized with p300 foci co-localized with the BRD4–NUT foci (Figure 2F).
As predicted, fewer but larger BRD4-NUT foci are observed in the Myc-p300-expressing cells. Indeed, the overexpression of the p300-interacting domain of NUT, F1c, leads to the relocation of p300 and the spreading of the BRD4-NUT foci.
Caractérisation de la protéine BRD3
Brd3 est exprimée au cours de la spermatogenèse
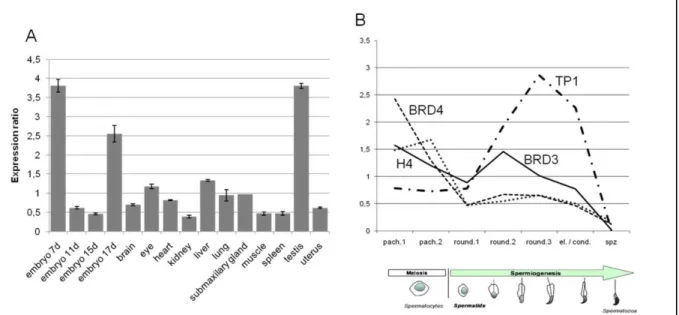
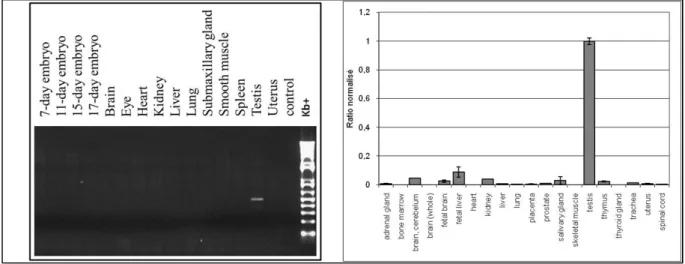
Bien que BRD3 ne soit pas exclusivement exprimé dans les testicules comme BRDT, son expression suggère un rôle important lors de l'embryogenèse et lors de la maturation des cellules germinales mâles. Il est également possible qu’il existe différentes isoformes de la protéine BRD3, dont l’une pourrait être spécifique aux testicules. En effet, BRD3 est bien exprimé au cours de la spermatogenèse et son expression est maintenue aux stades avancés de la spermiogenèse.
Le gène BRD3 est ainsi exprimé après la méiose au niveau des spermatides rondes (Fig1.B), étape à partir de laquelle survient généralement une répression transcriptionnelle globale. Les gènes présentant une expression postméiotique sont soupçonnés de participer aux étapes de maturation des spermatides, lors du remodelage drastique de la chromatine et de la formation des flagelles.
Production et validation d’un anticorps anti-BRD3
Nous avons fractionné les cellules germinales des testicules de souris en utilisant la technique de sédimentation par gradient BSA. Après avoir vérifié la pureté des enrichissements des différents types cellulaires par observation au microscope, nous avons réalisé une extraction d'ARN puis une transcription inverse. Les ADN complémentaires ainsi obtenus ont permis de réaliser une PCR quantitative en temps réel et nous avons pu observer un profil d'expression atypique du gène BRD3.
BRD3 ne semble donc pas être exprimé lors du remodelage de la chromatine qui a lieu après l'élongation des spermatides, mais il pourrait participer à l'établissement d'un profil d'expression spécifique nécessaire au bon déroulement de la spermatogenèse. Ainsi, grâce à son double bromodomaine, BRD3 pourrait recruter certains facteurs et moduler la répression globale des gènes, tout en activant celle des gènes spécifiquement nécessaires à la maturation des spermatides en spermatozoïdes.
Spécificité d’association de BRD3 à la chromatine
Ainsi, grâce à son double bromodomaine, BRD3 pourrait recruter certains facteurs et moduler la répression globale des gènes tout en activant ceux des gènes spécifiquement nécessaires à la maturation des spermatoïdes chez les spermatozoïdes. suggèrent spécifiquement un rôle majeur de la protéine dans la régulation des informations épigénétiques associées à H4K16ac. Ces résultats préliminaires permettent donc de comprendre l'importance d'une meilleure caractérisation de la protéine BRD3. Le manque de données actuel peut être rapidement comblé sur la base des connaissances établies pour les autres membres de la famille BET.
L'anticorps ne reconnaît pas les autres membres de la famille BET, BRD2, BRD4 et BRDt, exprimés de manière ectopique dans la lignée cellulaire COS. Tests de co-précipitation de la protéine BRD3 avec divers peptides biotinylés couplés à la bille.
Conséquences de l’expression illégitime de NUT au sein de lignées cellulaires
- Détection d’un doublet de protéines acétylées dans une lignée transformée de cellules musculaires
- Purification et identification du doublet acétylé
- Confirmation de l’identification de la protéine NUT
- La localisation cytoplasmique de NUT est contrôlée par son acétylation, qui dépend elle-même de
- La protéine NUT possède un grand nombre de lysines acétylables
- La protéine NUT régule le cycle cellulaire des cellules A7R5
- NUT confère un avantage prolifératif dans différentes lignées humaines
Nous avons également utilisé un anticorps récemment commercialisé spécifique de la protéine NUT pour compléter l’identification du doublet. Pour tester la régulation de la localisation de NUT par son acétylation, nous avons transfecté des cellules COS avec la version humaine de la protéine NUT marquée par HA. À l’inverse, l’inhibiteur spécifique de l’exportation nucléaire par CRM1, la leptomycine B, bloque la totalité de la protéine NUT dans le noyau.
Nous avons observé une variation du signal d'acétylation du NUT en fonction de la prolifération et de la confluence cellulaire. Nous avons cherché à mieux caractériser la fenêtre temporelle ciblée par l'inhibition de la protéine NUT.
Rôle physiologique de NUT au cours de la spermatogenèse
NUT est une protéine spécifique des cellules germinales
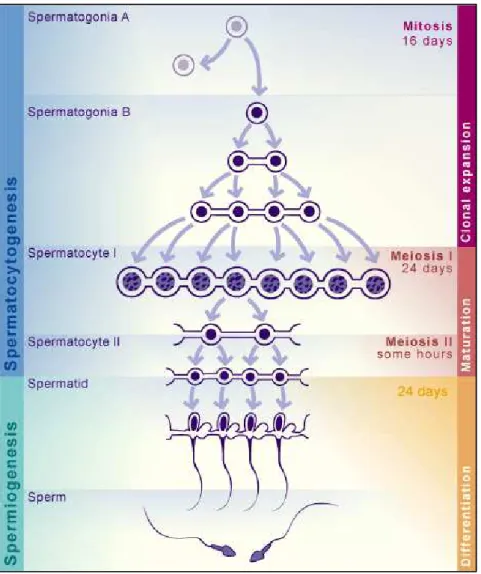
NUT est exprimée au cours de stades tardifs de la spermatogenèse
Pour ce faire, nous avons à nouveau utilisé la technique Q-PCR sur des extraits de populations cellulaires spécifiques des différents stades de la spermiogenèse. En raison de la taille et de la densité différentes entre ces cellules, il est effectivement possible d’éliminer différentes populations cellulaires par sédimentation. L'expression des histones H4 et BRD4, réprimées après la méiose, et l'expression de la protéine de transition TP1, activée à des stades tardifs, confirment la bonne pureté de l'enrichissement des populations cellulaires par sédimentation.
Ensuite, nous avons confirmé le profil d'expression de la protéine NUT lors de la spermatogenèse chez le rat par analyse in situ. Ce profil d'expression post-méiotique du gène NUT suggère un rôle spécifique de la protéine dans les derniers stades de la spermatogenèse.
NUT, acteur de la vague d’acétylation de la spermatogenèse ?
Prises ensemble, ces données suggèrent fortement que NUT et CBP/p300 forment un complexe au sein des cellules germinales. Ces deux protéines, qui, lorsqu'elles sont anormalement exprimées dans des tumeurs porteuses de la translocation BRD4-NUT, sont capables d'hyperacétyler en synergie la chromatine, pourraient être responsables de la vague d'acétylation de la spermatogenèse. Nous avons ensuite voulu savoir si la marque d'acétylation spécifique du CBP/p300, H3K56ac, pouvait être observée lors de la vague d'acétylation.
Par conséquent, nous avons effectué une immunofluorescence sur des cellules germinales provenant de tubules de souris, puis avons détecté la marque d'acétylation à l'aide d'un anticorps anti-H3K56ac. Ainsi, il est intéressant de penser que cette hyperacétylation du génome au niveau des spermatides rondes allongées peut être le résultat d'une HAT ubiquitaire, peu spécifique, dont l'activité va volontairement augmenter lors de la co-expression d'une protéine spécifique. des cellules comme NUT.
NUT et ses partenaires
La protéine STIM1 est exclusivement cytoplasmique et nous avons montré que NUT semble capable de faire la navette entre le noyau et le cytoplasme, où sa fonction peut changer. STIM1 est un capteur du niveau de Ca2+ dans la cellule (Zhang et al, 2005c), et NUT peut donc participer à la régulation des fonctions dépendantes du calcium des cellules germinales. En effet, le calcium est essentiel à la spermatogenèse, car un blocage des canaux calciques provoque l'infertilité, et la réaction acrosomale, la capacitation, la motilité du flagelle sont régulées par le calcium cytoplasmique.
La protéine NF1, principalement cytoplasmique, a été impliquée dans de nombreuses pathologies, notamment le cancer, en raison de sa fonction de régulation des voies dépendantes de Ras telles que la signalisation mTOR (Johannessen et al, 2005).
Génération d’une souris délétée pour NUT
Les gènes NUT et NOLA semblent être transcrits uniquement sur la base de l'analyse des données transcriptomiques et, par conséquent, l'invalidation de NUT et NOLA au cours de la spermatogenèse ne devrait pas avoir de conséquences inhérentes à NOLA. En effet, la protéine NOLA fait partie de la famille des snoRNP (petites ribonucléoprotéines nucléolaires) H/ACA qui participent à la formation de l'ARN ribosomal. Il est possible que le changement dans la vague d’acétylation soit l’un des phénotypes facilement observables qui nous renseignent sur la fonction de la protéine NUT.
Les connaissances et les outils du laboratoire permettront une analyse rapide des phénotypes attendus lors de la spermatogenèse. Analyse par immunoprécipitation anti-NUT à partir d'extrait de testicule, couplée à la détection directe d'anticorps de protéines en interaction ou par expression ectopique et co-immunoprécipitation de NUT et de la protéine H1t marquée. p.
Remodelage épigénétique au cours de la spermatogenèse
Plusieurs protéines de la famille BET peuvent protéger les histones acétylées du remodelage de la chromatine. Il est donc probable que NUT joue un rôle lors de la maturation des spermatozoïdes. Enfin, la caractérisation des partenaires de la protéine NUT permettra de mieux comprendre ses fonctions.
La protéine NF1 n’est pas caractérisée au cours de la spermatogenèse et est plutôt exprimée de manière omniprésente. Cependant, les conséquences d’une interaction entre NUT et NF1 au cours de la spermatogenèse restent floues.
Cancer et facteurs CT
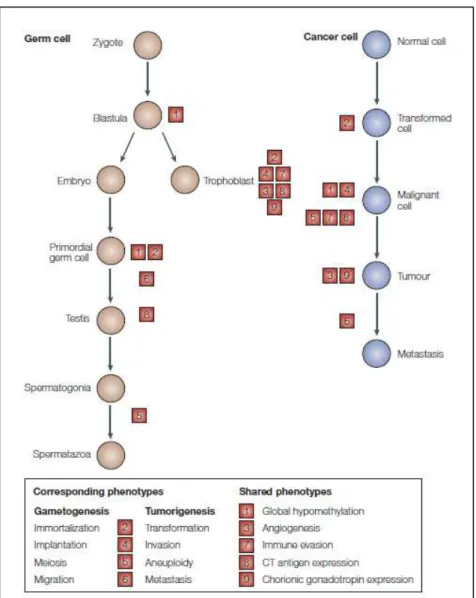
Toutes ces interactions et possibles fonctions physiologiques de la protéine NUT pourraient fortement perturber les différentes voies de signalisation cellulaire lors de l’expression illégitime de NUT dans les cellules somatiques. Il a été clairement établi qu'une expression illégitime de la famille MAGEA peut convertir les cellules somatiques dans une configuration favorisant leur transformation maligne. Nous n’observons pas non plus de variations au niveau cellulaire dans la marque spécifique CBP/p300 H3K56ac.
La protéine MDM2 est responsable de la dégradation de p53 et la liaison de NUT au domaine CH3 de CBP/p300 pourrait favoriser l'inactivation de p53. Les différents partenaires NUT que nous avons identifiés en plus du CBP/p300 pourraient également voir leur fonction physiologique dans les cellules somatiques altérée par l'expression illégitime de la protéine testiculaire.
Altérations épigénétiques et cancers NMC
Conclusion