Le premier, marqué "Stil de grain", provient de la pharmacie de l'ancien hôpital dédié à Sainte-Marthe. Dans une deuxième partie, une étude a été réalisée sur la composition chimique du gouda et des différents types de kraft dans le but de mieux comprendre ces colorants.
Étude bibliographique
- Historique
- Caractères botaniques
- Composition chimique
- Les ultrasons : généralités et principes
- Propriétés et utilisations
- Dans le domaine de la couleur
- Dans le domaine pharmacologique, agroalimentaire et sanitaire
- Activités mutagène et cancérigène de la garance
De plus, l'alizarine et la pseudopurpurine constituent de véritables marqueurs de croissance (Dixon et Hoyte, 1963 ; Norton, 1998). Enfin, les anthraquinones de la garance ont des propriétés antibactériennes et antifongiques (Rath et al., 1995).

Résultats et discussion
Étude des colorants de la garance
- Les anthraquinones de la garance
- Structures chimiques et propriétés spectroscopiques
- Comparaison de diverses espèces de garance ; cas de la garancine
Le chromatogramme de l'échantillon de garantie (Figure 1.15c) montre la seule présence des composés aglycones : lucidine (F), alizarine (G), purpurine (I) et rubiadine (J). La finalité de la production garantie permet donc de concentrer la coloration de l'extrait, c'est-à-dire d'augmenter la proportion de composés aglycones (de couleur rouge), comme l'alizarine et la purpurine, au détriment des précurseurs glycosylés (de couleur jaune). ).

Extraction des colorants par ultrasons
- Optimisation des conditions d’extraction
- Études préliminaires
- Résultats du plan d’expérience
- Conditions optimales
- Composition chimique
- Comparaison entre l’extraction par ultrasons et les méthodes
- Étude cytohistologique
La température est également un paramètre important pour faire ressortir les couleurs les plus folles. Le premier concerne l'optimisation d'un procédé utilisant les ultrasons pour l'extraction de colorants anthraquinoniques de la garance (Cuoco et al., 2009a).

Application à des échantillons provenant du Palais du Roure
- Analyse chromatographique
- Analyse colorimétrique
Conclusion
- Les espèces du genre Rhamnus
- L’espèce Reseda luteola
- Les flavonoïdes
- Les anthraquinones
Ces conditions d'extraction qui provoquent la dégradation des colorants, de nouvelles conditions ont été mises en place et utilisées dans la suite de l'étude pour l'analyse de la composition chimique : 25 min à 18°Cet dans un mélange méthanol-eau. (8:2), v/v). Ainsi, un protocole simple, rapide, efficace et non dénaturant a été mis en place pour l’extraction des colorants fous. La seconde compare la méthode d'extraction par ultrasons aux méthodes traditionnelles (chauffage à reflux et agitation magnétique) en termes de rendement en colorant, de composition chimique et d'impact des processus sur la racine (Cuoco et al., 2009 b ).
Ces composés ne sont spécifiques ni au genre Rhamnus ni à la famille botanique des Rhamnaceae. De même, la position 4' du flavonol peut également être occupée par des composés formant du rhamninose tels que la rhamnocitrine 4'-O-rhamninoside (catharticine) et le kaempférol 4'-O-rhamninoside. Structures d'émodinanthrone et de divers bianthrones présentes dans le genre Rhamnus (Mai et al., 2001).

Propriétés et utilisations
- Dans le domaine de la couleur
- Dans le domaine pharmacologique
Les fruits de l'argousier étaient principalement utilisés pour fabriquer des fruits jaunes à partir de fruits verts. Les fruits mûrs n'étaient utilisés que pour préparer des légumes appelés légumes blisters (Cardon et du Chatenet, 1990 ; Pérégo, 2005). Il était principalement préparé à partir des fruits de l’épine commune (Rhamnus frangula), mais d’autres espèces d’épine commune pouvaient également être utilisées à cet effet.
Blasgreen n’a cependant pas toujours été apprécié en raison de son instabilité dans le temps. Les fruits de divers chardons possèdent également des propriétés pharmacologiques et leur application remonte à l’Antiquité. Enfin, un échantillon nommé « Stil de graan » provenant d'un apothicaire du XVIIIe siècle a été analysé afin de déterminer les espèces botaniques précédemment utilisées.
Étude des colorants de Rhamnus
- Identification des flavonols
- Les aglycones
- Les glycosides
- Identification des anthraquinones
- Mise en place des conditions d’extraction par SPE
- Caractérisation de molécules
- Analyse des extraits de Rhamnus
- Comparaison chimique de trois espèces de Rhamnus
- Comparaison chimique de divers Rhamnus matures
- Application à un échantillon d’une pharmacie du XVIII ème siècle
Des analyses SPE/HPLC/UV-Visible ont été réalisées sur les trois espèces de Rhamnus présentes dans notre région (Rh. saxatilis, Rh. catharticus et Rh. alaternus) et sur des espèces de différentes provenances. Les données RMN 1H et 13C (tableau 2.5) du composé La déprotection observée sur le spectre RMN 1H des deux protons aromatiques 5 et 7 de +0,29 et 0,44 ppm respectivement par rapport à l'émodine, ainsi que la présence de spots de corrélation entre les protons aromatiques 5, 7 et le proton anomérique sur le NOESY Les spectres RMN permettent de confirmer que le fragment sucre est lié au fragment émodine au niveau de la fonction hydroxyle en position 6.
Les données RMN 1H (Tableau 2.7) du composé V sont très proches de celles du composé VII au niveau de l'émodine et du fragment rhamnoside. La composition chimique des fruits non mûrs de trois espèces de Rhamnus (Rh. . saxatilis, Rh. catharticus et Rh. alaternus), précédemment utilisées dans le procédé de production du jaune d'Avignon, a été étudiée et comparée par HPLC/UV-Visible en 350 nm. (Figure 2.25). Le composé 6-O-(2',3'-diacétyl)-rhamnopyranoside émodine (VII) est présent dans la plupart des espèces, à l'exception de quelques échantillons de Rh.
Enfin, les composés 6-O-(3',4'-diacétyl)-arabinopyranoside de l'émodine (VI) et 6-O-(2',3',4'-triacétyl)-arabinopyranoside de l'émodine (X) sont I identifié uniquement dans Rh. Chez la plupart des espèces, l'émodine est le composant le plus abondant, à l'exception des espèces Rh.

Étude des colorants de Reseda luteola
- Etude par électrophorèse capillaire
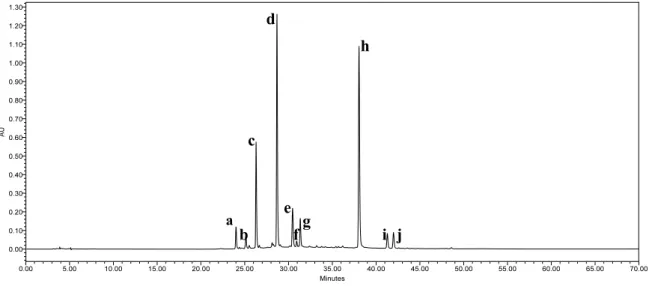
Les principaux composés (c, d, e, h, j) présents dans le gaud ont été identifiés en phase inverse. Après extraction des colorants Gaude dans un mélange méthanol-eau (1:1, v/v), le surnageant a été injecté en électrophorèse. Par rapport à l'HPLC, on observe un gain important de temps d'analyse (les composés sont élués en 14 minutes contre 45 minutes en chromatographie) tout en conservant une bonne séparation.
Ce phénomène est dû au fait que l'éluant utilisé en électrophorèse est un tampon borate (pH 9,2), alors que l'éluant en HPLC a un pH acide. Cette étude a permis la mise en œuvre d’une technique analytique rapide, efficace et alternative à la chromatographie liquide. En effet, l'impossibilité de comprendre l'ordre d'élution des différents analytes et la profonde modification de leur spectre UV-visible par rapport à HPLC/UV-visible ne nous a pas permis d'identifier les pics de l'électrophérogramme.
Conclusion
Une étude chromatographique a été réalisée précédemment (Fujii, 2008) et la mise en place des conditions d'analyse de ces composés par électrophorèse capillaire a été développée. Par rapport à l'HPLC, on observe un gain significatif en termes de durée tout en conservant une bonne séparation. En revanche, une perte de sensibilité de l'électrophorèse vis-à-vis de ces colorants a été observée.
Étude de fibres textiles anciennes
Extraction des colorants à partir d’une laque et d’un textile
Ces conditions drastiques entraînent la dégradation de la fibre ainsi que des colorants présents. En effet, une décarboxylation de la munjistine et de la pseudopurpurine pour donner respectivement de la xanthopurpurine et de la purpurine a été observée lors d'une « forte » décomplexation de colorants rouges provenant d'un lac (Wouters, 1985 ; Schweppe, 1993). Enfin, Sanyova et Reisse (2006) ont proposé un protocole d'extraction de couleurs plus garantes obtenues à partir de peintures anciennes en utilisant le mélange HF-DMF-AcOEt (8:1:1, v:v:v). ).
De plus, l'utilisation des ultrasons [prototype SOLEX 180 (voir Part Exp pour la solubilité de la laque (ou de la fibre) dans le tampon acétique) permet une augmentation du rendement d'extraction ainsi qu'une réduction du temps et de la température de réaction. Après analyse de la laque extraite par le tampon acétique (Figure 3.2a), les composés glycosylés ont été identifiés comme la rhamnétine 3-O-rhamninoside (7), la quercitrine et la 3-O-rhamnazine rhamninoside (9). La présence d'alizarine permet de confirmer que l'espèce utilisée dans la fabrication de cette laque est le teinturier (R. tinctorum).

Identification des colorants de textiles anciens
- Le Palais du Roure
- Indienne N°7
- Indienne N°102
- Le Museon Arlaten
- Les indiennes
- Les droulets et les jupons
De même, l'indigotine et l'indirubine ont été identifiées dans les fibres bleues, concluant à l'utilisation d'Isatis spp. La présence d'alizarine et de purpurine dans les fibres rouges et noires et d'alizarine elle-même dans les fibres brunes indiquent qu'elles ont été imprimées avec un type de Rubia tinctorum (mordant colorant) en utilisant différents graveurs. L'alizarine a été mise en évidence dans les fibres rouges, indiquant l'utilisation de Rubia tinctorum (colorant colère).
Les fibres rouges, noires et brunes contiennent de l'alizarine et correspondent donc à l'espèce Rubia tinctorum (garance des teinturiers). De la présence d'alizarine dans les fibres rouges et roses, nous pouvons conclure qu'elles sont empreintes de l'espèce Rubia tinctorum (garance des teinturiers). La présence d'indigotine et d'indirubine dans la fibre bleue et d'alizarine dans les fibres rouges permet de conclure que l'utilisation respective d'un indigoïde et de Rubia tinctorum (garance) est significative.

Essais de teinture en collaboration avec la société
La société Les Olivades
- Historique
- L'impression sur tissu
L'impression est automatisée à l'aide d'une table (Figure 3.16) dont le système est proche des anciennes techniques d'impression manuelle. Grâce à un chariot automatique, le cadre est déplacé, positionné avec précision, et en balayant la raclette, la peinture est appliquée sur le tissu à travers les zones non peintes du cadre. Une technique alternative peut être utilisée où, contrairement à la table, les cadres ne se déplacent pas sur les marchandises mais sont fixes.
C'est le tissu qui se déplie sur le tapis et se déplace pas à pas sous les cadres. Pour ce faire, le tissu est placé dans une enceinte fermée remplie de vapeur où il restera entre 10 et 40 minutes selon les teintures, les fibres et les procédés utilisés. Le tissu imprimé peut désormais être lavé, séché, puis découpé en petits rouleaux où il sera vérifié visuellement s'il répond aux critères de qualité Les Olivades®.

Essais de teinture
- Généralités
- Étude de la garance
- Étude des colorants jaunes
- Extraction des colorants à partir de fibres textiles
- Essais de coloration
Ces flavonols aglycones sont présents dans les fruits, mais ont également été identifiés dans les feuilles des espèces Rh. Chromatogrammes expansifs des flavonols à 350 nm (a) et des anthraquinones à 450 nm de l'échantillon pharmaceutique. Après analyse, l'alizarine a été identifiée en couleur bordeaux et l'alizarine a été identifiée ainsi que la purpurine en couleur rouge.
De plus, on peut noter la présence du 4'-O-rhamninoside du kaempférol et de la quercitrine, ce qui permet d'assumer l'utilisation du Rh. Ces fruits étaient en réalité utilisés lors de la production d’un vert, appelé vessie verte. Les racines de la garance des teinturiers (Rubia tinctorum L.) proviennent de la société Okhra (Roussillon, France).
Un tamis a été utilisé pour étudier l'influence de l'extraction par ultrasons en fonction de la granulométrie des racines. Une étude chromatographique préliminaire a été réalisée pour optimiser les conditions analytiques par HPLC/UV-Visible (voir Part Exp., 1.2.1). Après centrifugation, une partie du surnageant (! 100 µL) a été analysée par HPLC/UV-Visible pour l'identification du fragment flavonoïde (voir Part Exp., 3.1.3.).
Pour les couleurs rouge et bleu, le gradient d'élution est celui utilisé pour l'analyse du mudder et décrit dans le tableau E.3 (voir Partie Exp., 2.1.3.).








