35S : promoteur constitutif fort du virus de la mosaïque du chou-fleur. ARN 35S aa : acides aminés. VP16 : Facteur de transcription de l'herpèsvirus avec un domaine activateur constitutif pour la transcription VRN1/2 : VERNALIZATION1, VERNALIZATION2.
Qu’est ce qui déclenche la transition florale ?
Néanmoins, le mutant soc1 fleurit tardivement, indépendamment de la photopériode (Borner et al., 2000 ; Lee et al., 2000). Cependant, chez les mutants autonomes en cascade, l'expression de LFY est réduite et est donc probablement due à une action de FLC (Nilsson et al., 1998).
Morphogenèse florale
Comme le mutant simple cal, le mutant simple complet ne présente cependant aucun phénotype lié à l'identité du méristème floral (Gu et al., 1998). L'identité des organes floraux est génétiquement déterminée par l'expression combinée des gènes d'identité des organes floraux.
Présentation
Le rôle de LFY, à la fois comme intégrateur floral (décrit dans la section I.3.b. « les intégrateurs floraux : LFY, FT et SOC1) et comme gène FMI, en fait un acteur important du développement floral. L'expression de LFY, détectée pour la première fois dans les jeunes feuilles au cours du développement végétatif, augmente progressivement jusqu'à atteindre un seuil suffisant lors de la transition florale.
Rôle dans l’identité méristématique florale
Dans un système hétérologue (chez la levure), la protéine LFY n'est pas suffisante pour activer l'expression de AP1 (Parcy et al., 1998). 31 possède son propre régulateur, ce qui nécessiterait une action avec des co-régulateurs pour réguler l'expression de ses gènes cibles (Parcy et al., 1998). d) Répression des gènes d'identité des méristèmes d'inflorescence.
Rôle de FMI tardif dans la morphogenèse florale a) Mise en évidence
De plus, l'expression d'OVNI est détectée à partir du stade floral 2, lorsque l'identité des pétales et des étamines est déterminée (Laufs et al., 2003). LFY et WUS activent directement et en synergie l'expression de l'AG ( Lohmann et al., 2001 ).
Un rôle clé généralisable aux Angiospermes
Par exemple, contrairement au LFY, le RFL (riz LFY) est capable d'activer de manière ectopique l'expression de AP1 et AG dans les tissus végétatifs ( Chujo et al., 2003 ). Alternativement, la surexpression du PTLF (peuplier LFY) ne conduit pas à une floraison précoce chez le peuplier (Rottmann et al., 2000).
LFY, un facteur de transcription original
- Généralités sur les facteurs de transcription
- Points sur les connaissances biochimiques relatives à LFY
- Facteurs de transcription d’intérêt
- Théories sur l’apparition des fleurs
43 par l'étude in planta de l'effet des délétions au niveau de ces sites sur le profil d'expression d'AG (Busch et al., 1999). Les protéines de la boîte MADS du modèle ABCE seraient des acteurs clés dans l'origine de l'apparition de la fleur.
Objectifs de mon travail de thèse
- Matériel bactérien
- Levure
- Matériel végétal
- Solutions d’usage courant
- Biologie moléculaire a) BiFC
- Expression et purification des protéines recombinantes
Le vecteur pCH61 est obtenu en insérant le produit de digestion NcoI/XhoI de pCH60 dans NcoI/XhoI de pETtrx1a. Le vecteur pCH31 a été obtenu en insérant le produit de digestion NcoI/XhoI de pCH31bis dans NcoI/XhoI de pETM-11.
Etude biochimique des protéines a) Gel d’acrylamide
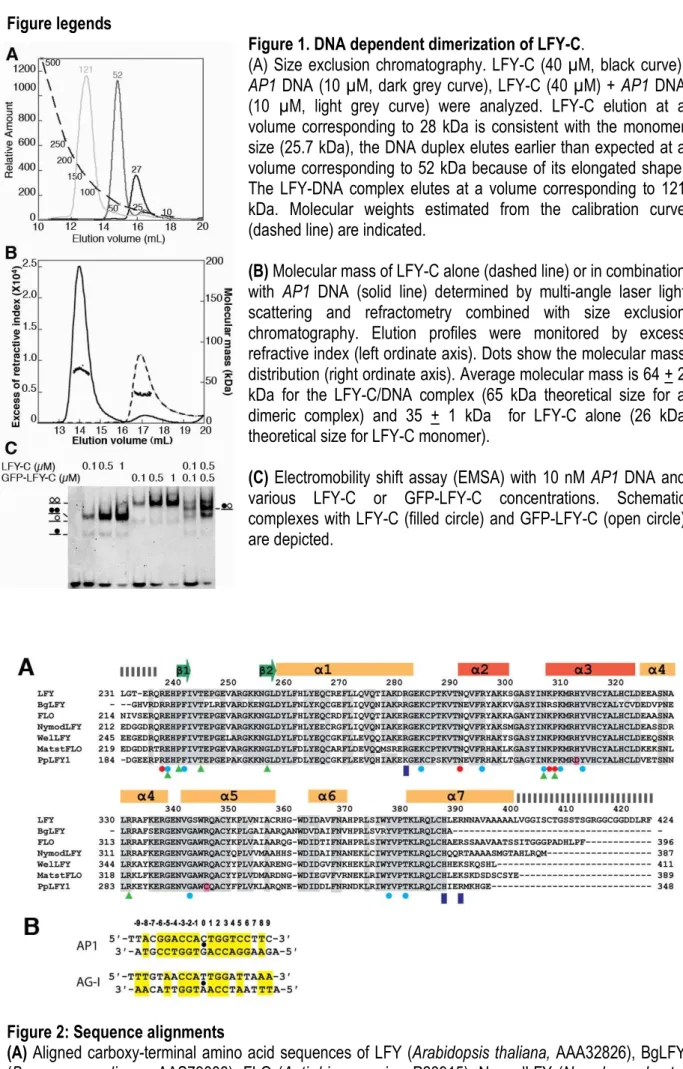
Les fractions obtenues sont analysées par électrophorèse sur gel SDS-page pour identifier la protéine d'intérêt et évaluer le rendement de purification. La masse moléculaire des différents complexes (MW, Molecular Weight) est alors égale à : MW=10[ax+b] où x correspond à la distance de migration normalisée pour la bande d'intérêt (fig. A).
Cristallogenèse a) LFY-C/ADN
65 (Tableau 2) ont été testés dans les 48 conditions du kit Natrix (Hampton Research) à raison de 1µL de mélange protéine/ADN + 1µL de tampon Natrix par spot. Des tests de cristallogenèse pour la protéine LFY-C seule ont été effectués à des concentrations de 2,5 mg/mL et 5 mg/mL de protéine et dans 48 conditions des kits Crystal Screen et Crystal Screen Lite (recherche Hampton).
Caractérisation de LFY chez la levure a) Milieux de culture
5 µl de culture saturée sont inoculés dans 3 ml de milieu sélectif SM 2% galactose, puis le tout est incubé sous agitation continue pendant une nuit à 30°C jusqu'à une DO600 de 0,2 à 0,6. Les levures sont ensuite centrifugées à 3000 g pendant 5 minutes et remises en suspension dans 0,40 ml de tampon Z froid (décrit dans la section précédente).
Caractérisation de LFY chez les plantes a) Stérilisation des graines
Enfin, le culot est séché sous vide rapide puis dissous dans 50 µL de TE 1X. g) Génotypage des plantes lfy-12. Le GADNA des plantes à tester est amplifié par PCR à partir des oligonucléotides oLFY1 (5'AAGCAGCCGTCTGCGGTGTCAGCAGCTGTT) et oLFY2 (5'CTGTCAATTTCCCAGCAAGACAC).
Introduction: pourquoi étudier le domaine C-terminal ?
Production du domaine C-terminal de LFY: sélection du vecteur d’expression optimal Dans le but de cristalliser le domaine conservé C-terminal, j’ai construit différents vecteurs
Le premier test d'expression a été réalisé avec le système TNT (In Vitro Transcription Translation RTS Rapid Transcription System, Roche) en utilisant le vecteur pIVEX2.4d. Après une deuxième étape de purification par chromatographie d'exclusion de taille (SEC ; colonne GE Healthcare Superdex) permettant d'isoler la fraction de protéines agrégées, les protéines finales dérivées de pCH26 et pCH28 apparaissent pures et abondantes et résistent au clivage par TEV (Tobacco Etch Virus) protéase de leur étiquette 6his et supportent une concentration pouvant atteindre plus de 15 mg/mL pour un rendement de purification final d'environ 3% (soit environ 1,5 mg/L de culture de départ ; Fig. 19D et E).
Fonctionnalité et caractérisation quantitative de la liaison de LFY-C à l’ADN
Sachant qu'une seule construction de référence nous suffisait pour étudier les propriétés du domaine C-terminal et que pCH28 permet de produire une protéine avec 7 aa en plus de pCH26 à l'extrémité N-terminale, nous avons choisi ce vecteur pCH28. . Il fallait donc se mettre d’accord sur une méthode de dosage unique pour avoir une référence commune.
L’anisotropie de fluorescence (AF)
L’expérience de retard sur gel (EMSA)
La résonance plasmonique de surface (SPR)
Après avoir confirmé que notre protéine produite était effectivement fonctionnelle, nous avons déterminé avec précision le domaine minimal de liaison à l'ADN LFY décrit par Maizel et ses collègues (2005). Par conséquent, nos résultats sont cohérents avec ceux de Maizel et ses collègues qui limitent l'extrémité N-terminale du domaine minimal de liaison à l'ADN du LFY à l'extrémité du domaine C-terminal conservé (résidu 230).
Détermination de la nature des deux complexes de LFY-C/ADN
Nous l'avons adapté pour l'étude de la masse moléculaire d'un complexe protéine/ADN par l'EMSA. Notez cependant que l’analyse de la protéine seule suggère une masse moléculaire de LFY-C de 35 ± 1 kDa, un résultat qui ne correspond ni au monomère (25,7 kDa), ni au dimère (51,4 kDa).
Mise en évidence d’une coopérativité de liaison de LFY-C à l’ADN a) Définition de la coopérativité
La coopérativité est évaluée dans l'EMSA à partir de l'étendue croissante de LFY-C à une concentration fixe d'AP1 (Figure 28B). Ainsi, l’indice de coopérativité du LFY-C est estimé à 91, ce qui reflète une très forte coopérativité.
Etude de la coordination d’ion(s) métallique(s) a) Les indices à l’origine de cette hypothèse
Nous avons donc voulu examiner si tel était le cas pour le domaine C-terminal de LFY. Pour cela, nous avons utilisé deux techniques indépendantes pour mesurer les ions métalliques traces présents dans la préparation LFY en solution.
Discussion
Comment expliquer les effets de la phénanthroline et de l'EDTA sur la liaison du LFY-C à l'ADN. L'analyse du LFY-C à l'aide d'une approche biochimique classique a amélioré notre compréhension de son mode de liaison à l'ADN.
Protocole de cristallogenèse
La première étape critique dans la réalisation d’une étude cristallographique est la production de la protéine d’intérêt à haute concentration. Pour la grande majorité des gouttelettes produites après la formation des précipités, nous avons poursuivi la cristallogenèse à 4°C, cette fois manuellement, en utilisant un écran commercial de 48 conditions tirées des principales conditions de cristallogenèse de complexes protéine/ADN connus. (Kit Natrix, Hampton. ).
Cristallographie
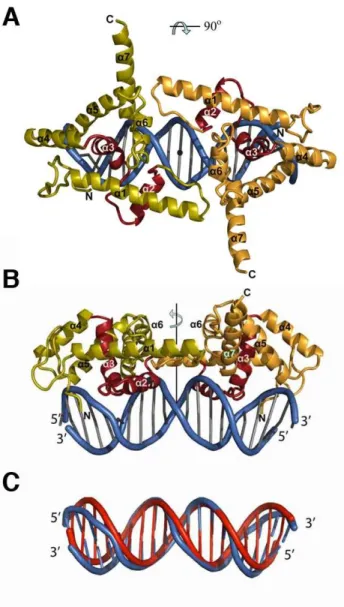
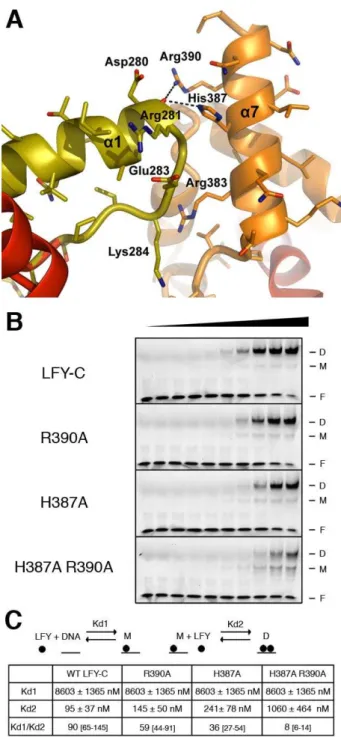
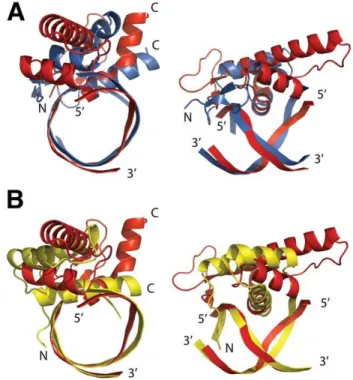
La structure de l'ADN présente une courbure de 20° qui permettrait de rapprocher le petit sillon du grand sillon (Fig.34C). La structure du complexe LFY-C avec l'ADN révèle également des interactions importantes entre les deux monomères : l'Asp280 de la boucle entre les hélices α1 et α2 est contactée au niveau de son squelette carboné par His387 et l'Arg390 de l'hélice α7 (Fig.38 ) ).
Validation et approfondissement des données structurales par approche biochimique a) Validation des points de contact LFY-C/AP1
Nous avons vu que la coopérativité pouvait résulter soit d'une modification de la conformation de l'ADN, soit d'une interaction monomère-monomère. La structure suggère donc que le mécanisme moléculaire à l’origine de la coopérativité pourrait être la dimérisation du LFY-C. 3. Validation et élaboration des données structurales par approche biochimique a) Validation des points de contact LFY-C/AP1.
Pour confirmer cette hypothèse, nous avons étudié l'effet de la mutation de ces résidus sur le comportement de liaison du LFY-C. La mutation D280K ne semble pas modifier le comportement de liaison à l'ADN de LFY-C, car la coopérativité et l'affinité de liaison de LFY à l'ADN sont comparables à celles de la protéine de type sauvage (figure 41A).
Discussion
Comme nous l’avons mentionné dans la discussion du premier chapitre, cela pourrait être une implication de l’ADN. Dans le contexte d’une cellule, les excès de protéines et d’ADN favorisent la formation de complexes non spécifiques.
Introduction
Etude in vitro du comportement de liaison à l’ADN de LFY FL a) Une protéine difficile à produire
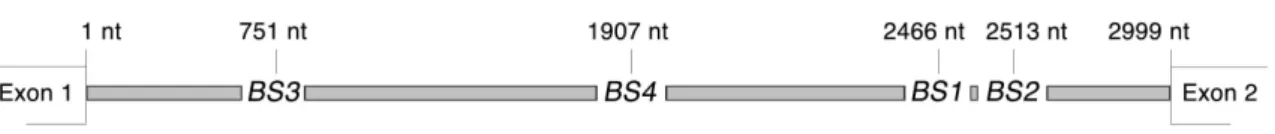
6-Démonstration de sites putatifs de liaison au LFY dans le promoteur AP1. À partir de la séquence consensus de liaison à l’ADN de LFY CCANTG, nous avons identifié deux séquences putatives supplémentaires de liaison à LFY pour le promoteur AP1.
Etude de l’homodimérisation de LFY FL in planta
Par conséquent, la co-expression entraîne une réponse synergique de LFY et de lfy-VP16, résultat cohérent avec une éventuelle dimérisation dépendante de l'ADN de LFY/lfy-VP16. b) Mise en évidence de l'implication des résidus His387 et Arg390 dans la capacité de LFY FL à activer l'AG par simple hybridation (travaux de E. Thévenon). Par conséquent, toutes ces caractéristiques indiquent que les plantes lfy-5-VP16/lfy-5-VP16, lfy-12/lfy-12 présentent un phénotype mutant lfy.
Discussion
L'analyse du promoteur AP1 a révélé deux séquences putatives de liaison au LFY à cette région d'ADN en plus de la séquence AP1bs1 connue. 129 donc sur la relation existante entre l'affinité de liaison à l'ADN et la capacité du LFY à activer ses gènes cibles in planta.
Les données structurales sur le repliement de la protéine LFY
La structure tridimensionnelle de l'une d'elles, la région C-terminale, révèle une organisation globulaire et des points de contact qui assurent la dimérisation de la protéine et sa liaison à l'ADN. Les structures protéiques homéodomaines telles que Engrailed montrent un changement de conformation dans le bras qui entre en contact avec le petit sillon en présence d'ADN (Clarke et al., 1994).
La coopérativité de liaison de LFY-C à l’ADN a-t-elle une réalité biologique?
L'effet de la double mutation H387A/R390A sur la capacité de LFY FL à activer l'expression de ses gènes cibles in vivo a été étudié dans un deuxième temps. 137 Il serait intéressant de savoir si les gènes cibles du LFY possèdent systématiquement plusieurs sites de liaison.
Caractérisation moléculaire de l’interaction LFY-C/ADN
A partir de ces résultats, il suffira d'examiner les régions cis-régulatrices des gènes cibles du LFY pour identifier les sites de liaison potentiels et évaluer leur validité en utilisant une approche biochimique classique. William et al., 2004) avec la présence d'un site de liaison dans leurs séquences régulatrices devrait permettre de savoir s'il existe des gènes cibles directs sans site de liaison pour le dimère (deux demi-sites situés l'un à côté de l'autre), suggérant que les LFY peuvent également réguler les gènes sous forme monomère ou hétérodimère.
Comment LFY agit-il avec ses corégulateurs ?
En revanche, la mutation d’un seul des deux sites de liaison du LFY n’a qu’un effet modéré. 143 Pour ma part, j'ai tenté d'étudier la liaison du LFY et du WUS à l'AG en utilisant une approche biochimique.
Comment LFY a-t-il évolué ?
Cette observation n’implique cependant pas que les propriétés de liaison à l’ADN du LFY sont restées inchangées depuis l’émergence du LFY. 151 variantes de l'angiosperme LFY histidine converties en aspartate dans les mousses (H312D, correspondant à H394D dans leur article).
Quelle relation existe-il entre LFY et l’apparition des plantes à fleurs ?
2001) Function and evolution of the plant MADS-box gene family. 2004) Regulation of flower development in Arabidopsis by SCF complexes. 2007) Comparative analysis of the SBP box gene families in P. 2005) Flower and fruit development in Arabidopsis thaliana.
Structural basis for LEAFY floral switch function and similarity with helix-turn-helix proteins
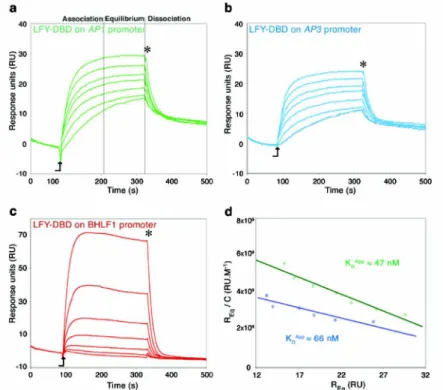
To refine the LFY/AG-I complex the AP1 DNA sequence in the LFY/AP1 complex was replaced with the AG-I sequence. Interactions of LFY with target and non-target promoters. a-c) SPR curves for the interactions of the LFY DNA binding domain (LFY-DBD) with the regulatory regions of the LFY target genes AP1 (a) and AP3 (b) and the non-target gene BHLF1 from Epstein-Barr virus ( c).