Je leur suis infiniment reconnaissant pour leur disponibilité et leur patience et pour m'avoir suivi, conseillé et guidé durant ces trois années. Je remercie Josiane Eche, Pascale Jegou et René Brennetot pour leur accueil et leur coopération aux travaux menés sur le cuivre.
Contexte
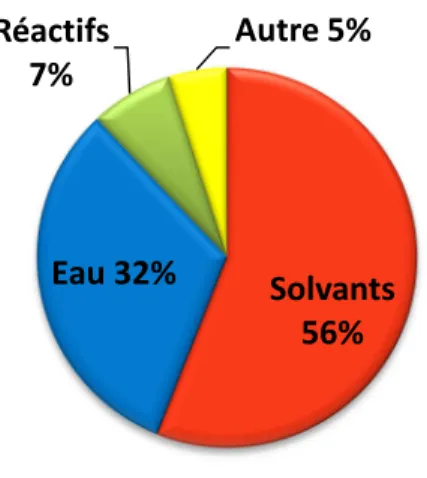
Les produits, processus et systèmes doivent être conçus pour atteindre la plus grande efficacité en termes de quantités de matériaux, d'énergie, d'espace et de temps. Les produits, processus et systèmes doivent être conçus pour permettre leur rétablissement vers leur cycle de vie normal.
Les métriques de la chimie verte
L'excès de capacité doit être considéré comme un défaut de conception lors de la conception d'un processus (le concept de « taille unique » doit être rejeté). 13 met particulièrement en évidence l'influence de l'économie atomique globale (GAE), des rendements (ε), des excès de réactifs (b) et de la quantité de matières auxiliaires (s), qui permettent d'identifier les faiblesses d'un procédé.
![Tableau 1 Les facteurs E des industries chimiques (extrait de la réf.[9]).](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465467.70661/14.892.97.800.795.992/tableau-1-facteurs-industries-chimiques-extrait-réf-9.webp)
Solvants alternatifs éco-compatibles
- Pourquoi en a-t-on besoin ?
- Le polyéthylène glycol
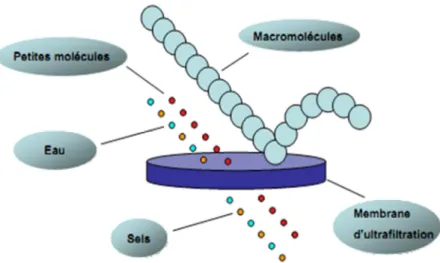
- L’eau
- L’éthanol
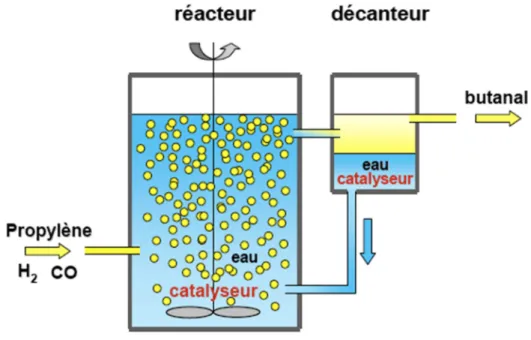
Par exemple, sur la base des travaux de l'équipe de Lubineau [27, 28], L'Oréal a développé la synthèse d'un composé anti-âge dans l'eau [29-31]. Le procédé d'hydroformylation développé par Ruhrchemie/Rhône-Poulenc est un autre exemple d'utilisation de la chimie de l'eau à l'échelle industrielle.

Les flavonoïdes
Structure chimique et classification
Ils sont souvent liés aux flavonoïdes en position 3, moins souvent en position 7 et rarement en positions 4', 3' et 5. Parmi les monosaccharides (15 espèces), le D-glucose et le L-rhamnose sont les plus abondants, suivis du L. - arabinose, D-xylose et acide D-glucuronique.
Biosynthèse
Extraction et disponibilité des flavonoïdes
Pour illustrer la quantité de flavonoïdes que les plantes peuvent contenir, la figure 8 et la figure 9 montrent respectivement la composition en flavonoïdes de l'oignon rouge et de l'olive noire. L'extraction d'environ 1 gramme d'un mélange de flavonoïdes nécessite donc le traitement d'une quantité de matière végétale fraîche de l'ordre du kilogramme et implique l'utilisation d'une quantité importante de solvant, d'autant plus si l'on cherche à isoler un composé particulier.
Flavonoïdes et lutte contre le stress oxydant
Les espèces réactives de l’oxygène
Schéma 10 : Neutralisation de l'anion superoxyde par la superoxyde dismutase et du peroxyde d'hydrogène par la catalase. Ces dernières sont présentes en grande quantité dans les plantes, et leur apport alimentaire varie de 50 à 800 mg/jour.
Les flavonoïdes contre les ERO
- Les flavonoïdes dans la protection des plantes contre les UV
- Les flavonoïdes, inhibiteurs d’enzymes
- Les flavonoïdes, piégeurs d’ions métalliques
- Neutralisation directe et indirecte d’ERO
- Oxydation des flavonols
Elle a notamment étudié l’oxydation de la quercétine et de la quercétine 3-O-rutinoside par le DPPH en milieu protique [56]. L'équipe de Dangles a également tenté d'étudier l'oxydation de la quercétine par le DPPH dans un environnement aprotique.
![Figure 10 Structure 3D du flavonol quercétine (1) et de la flavone lutéoline (2) après optimisation avec GAMESS (extrait de la réf.[53])](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465467.70661/41.892.108.786.101.519/figure-structure-flavonol-quercétine-flavone-lutéoline-optimisation-gamess.webp)
Exemples de synthèses de glycosylflavonoïdes
Synthèse de O-glycosylflavonols
Synthèse de C-glycosylflavones
Ainsi, l'isoorientine a été obtenue à partir de 2',4',6'-trihydroxyacétophénone en 10 étapes avec un rendement total de 14 %. La C-glycosylation directe par D-glucose de la 2',4',6'-trihydroxyacétophénone en solution aqueuse a permis d'obtenir le C-glycoside avec un rendement de 40 % et une stéréosélectivité élevée sans utiliser de groupes protecteurs [ 62 ].
Objectifs du travail
L'azoture de C-glucoside sera obtenu par substitution nucléophile du bromure de C-glucoside par de l'azoture de sodium avec une économie atomique de 72 %. Enfin, la condensation de Knoevenagel permettra d'accéder au C-glycoside à partir du D-glucose avec une économie atomique de 60 %.
Synthèse du motif sucre
Réaction de C-glycosylation
Une β-élimination de l'eau, suivie d'une addition intramoléculaire de type Michael 1,4 conduit à la formation du dérivé C-glycosylé. La rétroaldolisation de Claisen avec élimination de l'acétate conduit à la formation d'un mélange cinétique d'α- et β-pyranose et de dérivés du furanose (dans lequel le composé α-furanose prédomine) qui, lors d'un chauffage prolongé, donne exclusivement le composé thermodynamique β-D-C-pyranose. 1.
Etude de la réaction de bromation
La diminution du temps de réaction n'a pas amélioré le rendement de la réaction, même si le rapport 2:2' est plus favorable (entrée 2). De plus, l'ajout d'eau permet l'hydrolyse de l'éventuel acétal issu de l'éventuelle réaction entre la fonction cétone du C-glucoside et l'éthanol. Enfin, de l'acide bromique se forme lors de la réaction, l'ajout d'une solution de Na2CO3 neutralise le milieu.
De plus, les réactions de bromation effectuées avec le tribromure de pyridinium supporté sur un polymère sont faciles à suivre visuellement car sa couleur passe du rouge au jaune au fur et à mesure de la consommation du brome. Comme avec cette méthode il n'est pas nécessaire d'utiliser ni de L-proline ni de bisulfite de sodium, la purification de la matière première par chromatographie s'effectue plus facilement.

Synthèse du motif flavonoïde
Synthèse de la 2’-hydroxy-4’-propargyloxyacétophénone
Compte tenu des conditions réactionnelles basiques, un diméthyl PEG éther a été choisi afin de protéger les deux fonctions hydroxyles. Ce composé présente en RMN 1H les signaux de deux fonctions propargyles ainsi que des déplacements chimiques différents pour les signaux de ses protons aromatiques par rapport à ceux de la 3 et de la 2',4'-dihydroxyacétophénone. Cependant, il a été constaté qu’un extrait liquide-liquide H2O-Et2O nécessitait une plus petite quantité d’éther diéthylique pour extraire tout le produit, réduisant ainsi l’intensité massique et le facteur E de la synthèse.
D'autre part, nous avons pu calculer l'intensité de masse spécifique et le facteur E de la réaction (MIr et Er) (Équation 10, Équation 11) ainsi que le RME à partir des données expérimentales des publications. Il serait donc intéressant de le réviser pour améliorer le MI et le facteur E mais aussi pour supprimer l'éther diéthylique qui présente des problèmes de sécurité.
Réaction d’aldolisation
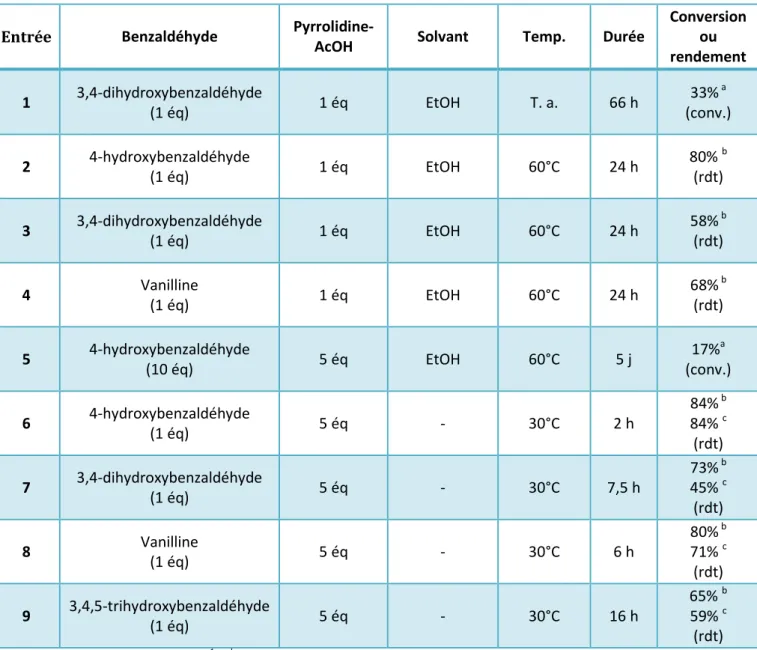
En plus de la formation de chalcone 4a et de flavanone 4'a, la formation d'un nouveau produit a été observée. Les proportions de chalcone-flavanone dans les mélanges obtenus sont identiques et en faveur de la chalcone (chalcone-flavanone 2:1). Ainsi, le RME de la synthèse des composés 4a-4'a est élevé car le taux de conversion et l'efficacité de recristallisation sont bons.
A l'inverse, le RME de la synthèse des composés 4b-4'b souffre d'un taux de conversion plus faible, mais surtout du faible rendement de recristallisation. Ce type de composé est généralement obtenu par catalyse acide ou basique de la réaction aldolique entre un benzaldéhyde et une flavanone.
Réaction d’Algar-Flynn-Oyamada
Étant donné que l'équilibre chalcone-flavanone dépend du pH et se déplace vers la chalcone dans des conditions basiques, les conditions de réaction devraient permettre à l'équilibre de se déplacer vers la chalcone pour permettre la réaction AFO. Afin de comprendre la formation de l'acide benzoïque, le flavonol 6a pur a été soumis à des conditions de réaction AFO. La synthèse des composés 6a et 6c a été évaluée à l'aide de mesures de chimie verte (Tableau 11).
Ceci est dû à la décomposition des produits 6a et 6c en acides, réduisant ainsi le rendement et le RME de la réaction. 81 en fait la même réaction AFO a été tentée, mais cette fois sur la matière première pour la réaction d'aldolisation.
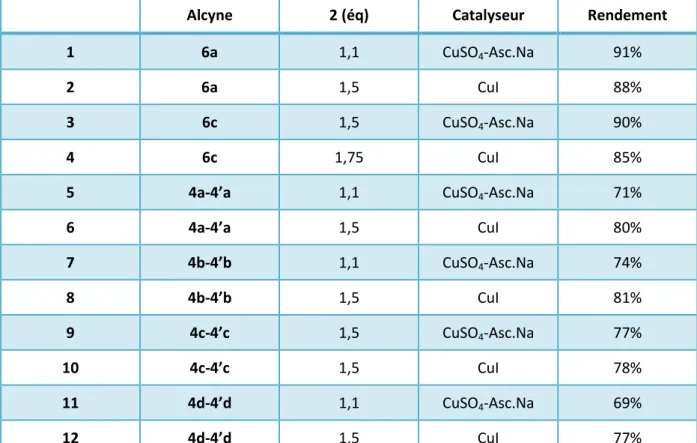
Réaction de CuAAC
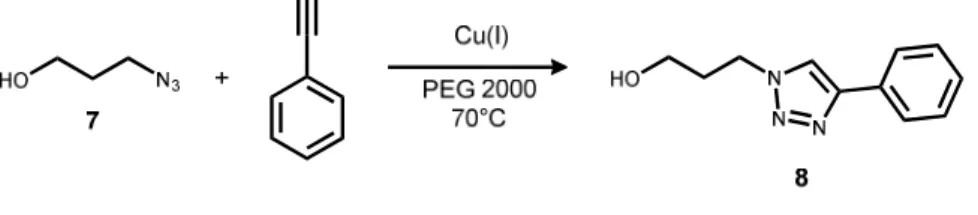
Etude préliminaire de la réaction de CuAAC
Quel que soit le catalyseur, la concentration en cuivre dans le PEG est environ 10 fois supérieure à celle dans le composé 8. La masse de résidu de cuivre dans le PEG obtenu correspond à environ 70 % de la masse initiale de cuivre dans le catalyseur. Il est intéressant de noter que la concentration en cuivre dans le PEG (entrée 5) lors de l'utilisation du CuT comme catalyseur n'est que deux fois moins élevée par rapport aux concentrations mesurées en PEG lors du premier cycle pour les autres catalyseurs (CuI et CuNP).
85 éliminé avant chaque précipitation, le cuivre restant dans le PEG représente uniquement les espèces de cuivre dissoutes de la surface du CuT. La masse de cuivre restant dans le PEG est alors assez faible et ne représente pas plus de 1% de la masse de CuT utilisée.
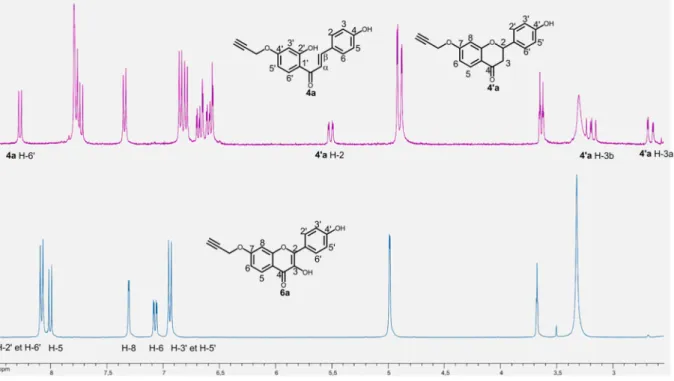
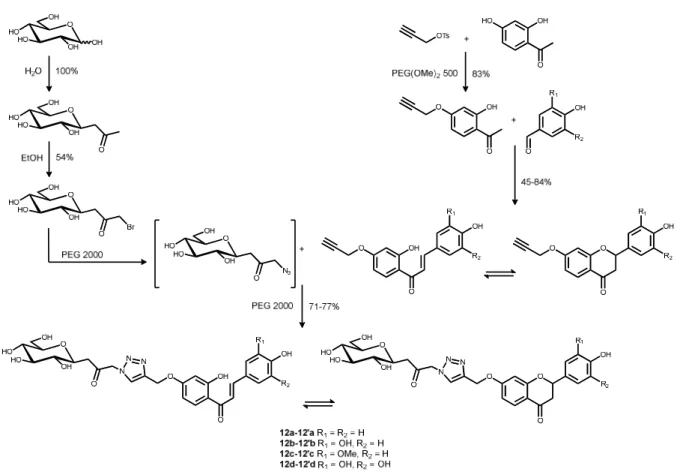
Synthèse des glycosylflavonoïdes
En effet, alors que les glycosylflavonols précipitent sous forme de poudre, les mélanges glycosylchalcone-glycosylflavanone précipitent généralement sous forme d'agrégats collants, ce qui devrait induire des pertes lors de la purification. Cependant, les fonctions iminodiacétate de la résine QuadrapureTM IDA ne sont pas adaptées à ces conditions de pH. La réalisation en un seul pot de la substitution nucléophile et de la réaction CuAAC est réalisée avec une bonne économie atomique.
Afin de réduire le facteur E global du processus, la synthèse de glycosylflavonoïdes a été tentée en utilisant le C-glycoside 2 bromé, brut issu de la réaction de bromation, comme source. Malheureusement, l'utilisation du brut issu de la réaction de bromation ne permet pas une conversion complète des flavonoïdes propargylés.
Evaluation de l’éco-compatibilité du procédé
A partir de la 2',4'-dihydroxyacétophénone, ils sont obtenus en quatre étapes avec de bons rendements de 34 et 41 %. A partir de la 2',4'-dihydroxyacétophénone, ils sont obtenus en trois étapes avec des rendements allant de 28 à 50 %. En prenant en compte les excipients utilisés lors de la synthèse, il est possible de déterminer l'intensité massique et le facteur E.
Si ces quantités sont importantes, cela est dû en grande partie à la purification de la réaction de bromation, qui nécessite une chromatographie. Ainsi, si la synthèse du glycosylflavonol 11a nécessitait encore une chromatographie lors de l'étape d'aldolisation, ainsi qu'une extraction liquide-liquide lors de la réaction AFO, une intensité massique de 2361 et un facteur E de 2360 seraient obtenus.
Evaluation de l’hydrosolubilité des glycosylflavonoïdes
The condensation of ketones with cyanoacetic acid esters and the mechanism of the Knoevenagel reaction, Journal of the American Chemical Society. An improved synthesis of the paradols (alkyl-4-hydroxy-3-methoxyphenethyl ketones) and an assessment of their pungency, Journal of the Chemical Society, Perkin Transactions. Main, The kinetics and mechanism of the cyclization of some 2'-hydroxychalcones to flavanones in basic aqueous solution, Journal of the Chemical Society, Perkin Transactions.
Nudelman, Mechanism of cyclization of substituted 2'-hydroxychalcones to flavanones, Journal of the Chemical Society, Perkin Transactions. Mielczarek, Practical and theoretical aspects of flavanone-chalcone isomerization, Journal of the Chemical Society, Perkin Transactions. Kinetics and Mechanism of the Base-Catalyzed Isomerization of 3-Arylideneflavanones, Journal of the Chemical Society, Perkin Transactions.
Oyamada, A new general method for the synthesis of flavonol derivatives, Bulletin of the Chemical Society of Japan.
![Figure 8 Représentation de la catalyse « sur l’eau » (extrait de la réf. [23]).](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465467.70661/24.892.251.638.308.455/figure-8-représentation-catalyse-eau-extrait-réf-23.webp)
![Figure 11 Spectre d’absorption du DPPH et du DPPH-H (extrait de la réf. [55]).](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465467.70661/41.892.265.626.784.1052/figure-11-spectre-absorption-dpph-dpph-extrait-réf.webp)