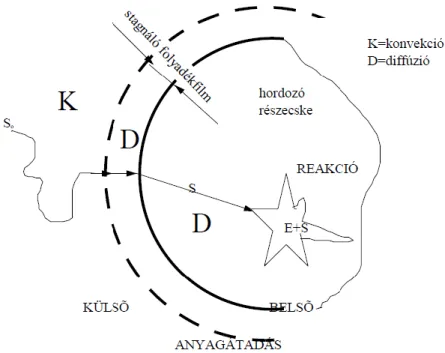
Bevezetés
Vizsgáltuk a por vezetőképességének és szelektivitásának hőmérsékletfüggését folyamatos, átfolyós műveletben, végül, szintén folyamatos üzemben, enantiomertiszta (R)- és (S)-alkoholokat és (R)-acetátokat is előállítottunk preparatív méretben. A dinamikus kinetikai rezolváláshoz szilárd hordozóhoz kapcsolt proteázzal, amidálószerként benzilaminnal és racemizálószerként 1,8-diazabicikloundec-7énnel először külön kerestük a kinetikus rezolválás és a racemizációs részlépések hőmérsékleti optimumát, majd az allépések kombinálásával a folyamatos kinetikus áramlást valósítottuk meg. Az Irodalmi áttekintés fejezetben egyebek mellett összefoglalom az enzimkatalízissel, a kinetikai és dinamikus kinetikai felbontással és néhány folyamatos működési rendszerrel kapcsolatos legfontosabb ismereteket.
Irodalmi áttekintés
- Enzimek, mint biokatalizátorok
- Az enzimek működésének alapjai
- Enzimkinetika
- Az enzimkatalizált, enantiomer szelektív folyamatok jellemzése
- Az enzimek csoportosítása
- Hidrolázok
- Lipázok és proteázok
- A szerin hidrolázok működése
- Enzimrögzítés
- Rögzített enzimes rendszerek kinetikája
- Kinetikus rezolválások hidrolázokkal
- Alkoholok kinetikus rezolválása
- Aminok kinetikus rezolválása
- Aminosavak kinetikus rezolválása
- Dinamikus kinetikus rezolválás
- Szakaszos és folyamatos üzemű biokatalizált rezolválások
- Aminok előállítási lehetőségei
Minden enzimreakció reverzibilis, az enzim nem befolyásolja a reakció egyensúlyi állapotát, csak felgyorsítja az oda vezető utat. Végül a sztereospecifitás azt jelenti, hogy egy királis centrumot tartalmazó szubsztrát esetén az enzim csak az egyik antipódot képes átalakítani 13. Ezeknek a rendszereknek a nagy előnye, hogy homogének, és nem igényelnek más előállítást, mint az enzim izolálását.
Kovalens kötés: kovalens kötések létrehozása a hordozó funkciós csoportjai és az enzim nem esszenciális aminosav oldalláncai között. De emellett figyelembe kell venni a felhasznált oldószer és a kinetikus rezolváló reagens minőségét, a racemizáló katalizátor és az enzim közötti lehetséges kölcsönhatásokat, valamint az alkalmazott hőmérsékletet és nyomást is.
Eredmények és értékelésük
Ketonok reduktív aminálása szakaszos és folytonos, átfolyásos üzemben ,
- Célkitűzések
- Aminok előállítási lehetőségei oxim intermedieren keresztül
- Katalizátorok tesztelése az acetofenon (1g) egylépéses reduktív aminálási
- Az egylépéses aminálás módszerének kiterjesztése
- Alifás és cikloalifás ketonok (1a-d) 10%-os Pd/C katalizálta reduktív
A jó irány a Zn mennyiségének növelése és a hidroxil-amin-hidroklorid mennyiségének csökkentése volt, hiszen 3 ekvivalens Zn és 1 ekvivalens hidroxilamin-hidroklorid (29%) felhasználásával, ha nem is jelentősen megnőtt az (1-fenil-etil)-amin (2g) termelése. További kísérletek után megállapították, hogy hidroxil-amin-hidroklorid alkalmazása teljesen felesleges, mivel a reakció enélkül megy végbe. Ennek a felismerésnek további előnye, hogy a hidroxil-amin-hidroklorid nagyon mérgező MAO-gátló és feltehetően rákkeltő, emellett nagyon káros a környezetre, különösen a vízi élővilágra, így a hidroxil-amin-hidroklorid elhagyása jelentősen zöldebbé teszi a vizsgált reakciót.
Összesen öt különböző katalizátort teszteltek acetofenon (1g) 6 vagy 10 ekvivalens ammónium-formiát aminálására, amelyek a cinkporon kívül a következők voltak: Cu és Mg por, 10% Pd/C és Raney-Ni. A 2-acetil-tiofénből (1j) a 10%-os Pd/C-katalizált amin képződés a kiindulási anyagon kívül semmi mást nem tartalmazott, még 16 órás keverés után sem. Ezzel szemben 10% Pd/C használatakor 16 órás szobahőmérsékleten végzett keverés után melléktermékek képződése nélkül, jellemzően 50% feletti termeléssel kaptam a kívánt amint.
Alifás és cikloalifás ketonok (1a-d) 10%-os Pd/C katalizált reduktív aminálásának megvalósítása folyamatos áramlású reaktorban Folyamatos áramlású reaktor megvalósítása. A kapott reakcióelegyet 0,2 ml/perc áramlási sebességgel 40 °C-ra termosztált, 10%-os Pd/C katalizátorral töltött oszlopon engedjük át. A ciklohexil-amin (2b) előállítását illetően az irodalomból ismertnél nagyobb konverziót lehetett elérni, szakaszos reakció során is 10%-os Pd/C katalizátorral.101.
Annak bizonyítására, hogy a katalizátor nem veszíti el aktivitását, a fenti reakciósorozatot kétszer hajtottuk végre ugyanazon oszlopon, amely 10% Pd/C katalizátorral volt megtöltve, és nem figyeltünk meg szignifikáns eltérést a gyártási adatokban.

Racém aminok kinetikus rezolválása folytonos, átfolyásos rendszerben 118
- Célkitűzések
- Racém aminok enzimkatalizált kinetikus rezolválása szakaszos üzemben
- A produktivitás és a szelektivitás hőmérsékletfüggése racém aminok (rac-2a,
- Racém aminok (rac-2a, c, e, g) preparatív léptékű enzimkatalizált kinetikus
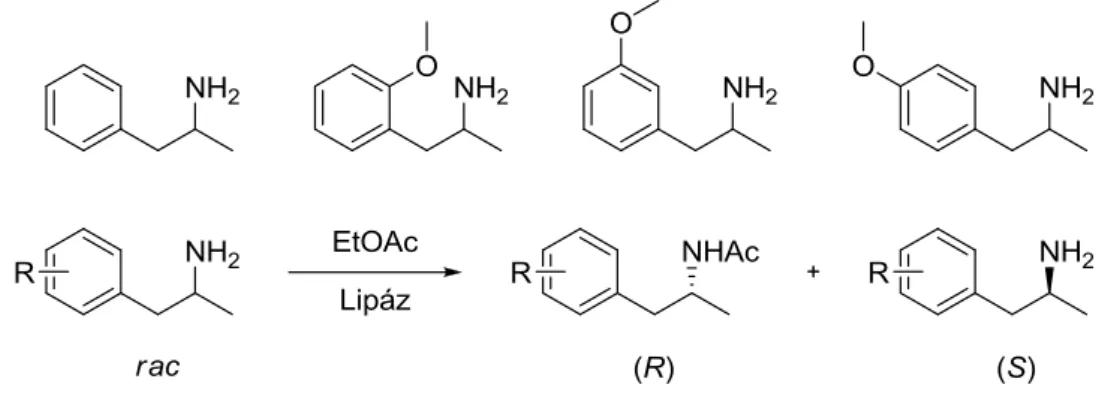
Az enantiomer szelektív N-acilezések referenciaanyagaként először hagyományos, nem szelektív módszerekkel állítottak elő racém acetamidokat (rac-3a, c, e, g). A heptán-2-amin (2a) esetében azt találtuk, hogy a kutatócsoport által készített BUTE 3 (T-2) és SSF9 enzimkészítmények katalizálják az N-acilezést, de a reakció nagyon lassú, a konverzió 24 óra elteltével sem haladta meg az 5%-ot, az enantiomer tisztaság pedig csak 75-85 között volt. A CaLB T2-150 enzimmel, amely jól működött az előző két szubsztrát molekulával (2a, 2c) (20% konverzió 2a és 40% konverzió 2c 24 óra elteltével) sokkal lassabb reakciót figyelhettünk meg, és az enantiomer tisztaság nem érte el a 88,5%-ot.
A vizsgált racém aminok (rac-2a, c, e, g) enzimkatalizált N-acilezése során először egy optimális oldószert, majd egy acilezőszert próbáltunk találni, amellyel a termelékenység és/vagy az enantiomer tisztaság növelhető. A termelékenység és a szelektivitás hőmérsékletfüggése racém aminok (rac-2a, c, e, g) enzimkatalizált kinetikus rezolválása során folyamatos, áramlási rendszerben enzimkatalizált kinetikus rezolválás során folyamatos, áramlási rendszerben. Az enantiomer tisztaság (ee) mindkét enzim esetében általában 96 és 98 között változik, a 20 és 60 °C közötti adszorptív CaLB esetében 0,5-0,8 százalékponttal magasabb, mint a kovalens CaLB-é.
Az alacsonyabb enantiomer tisztaság miatt az enantiomerszelektivitási értékek a legtöbb esetben mindkét enzim esetében 100 alatt maradtak. Az adszorpciósan immobilizált CaLB enzim esetében 0 és 70 °C között a termelékenység szinte teljesen lineárisan nőtt a hőmérséklettel, de 40 °C felett az enantiomer tisztaság és az enantiomer szelektivitás csökkenni kezdett, és 70 °C-on az ee értéke az első. A konformációslag leginkább rugalmas, adszorpciós fix CaLB használatakor az enantiomer tisztaság és enantiomerszelektivitás 50 °C körül mutatott maximumot (ee(R)-3g: 99,6%, E: ~1000 50 °C-on).
Ugyanakkor az enantiomertisztaság és az enantiomerszelektivitás hőmérsékletfüggése 50 °C körüli maximumot mutatott, akárcsak a CaLB N435 esetében (ee(R)-3g: 99,7% és E: 840).

Indolvázat tartalmazó szekunder alkoholok kinetikus rezolválása folytonos,
- Célkitűzések
- Szekunder alkoholok (rac-5a-c) enzimkatalizált kinetikus rezolválása
- Szekunder alkoholok (rac-5a-c) enzimkatalizált kinetikus rezolválása
- Enantiomertiszta szekunder alkoholok ((S)-5a-c) és acetátok ((R)-6a-c)
A CaLB N435 és Lipobond PS enzimekkel végzett kinetikus felbontások során pedig majdnem elérte az 50%-ot. A csoporteredmények alapján a rac-5a kinetikai felbontására folyamatos üzemben az Amano AK, CaLA Dv250P, CaLB N435, Lipobond PS, Lipozyme MmL és Lipozyme TLIM enzimeket, valamint a CaLB N435, Lipobond PS, Lipozyme second, Lipozyme TL, IM enzimeket használtuk. . A Lipozyme TLIM enzim használatával 0 és 40°C között értük el a legnagyobb termelékenységet, míg a legalacsonyabb aktivitást az Amano AK esetében tapasztaltuk.
Bár a CaLB N435 20°C alatt nem mutatott szignifikáns aktivitást, termelékenysége 30°C-tól drasztikusan emelkedni kezdett, 50°C felett pedig a legaktívabb enzimkészítmény volt, kiváló szelektivitással (ee és 70°C-on). Batch módban az aktívabb CaLB N435 és Lipobond PS enzimekkel 0 és 70°C között, a Lipozyme TLIM és Lipozyme MmL enzimekkel 0 és 60°C között végeztünk méréseket. A kötegelt feldolgozás során a méréseket az aktívabb CaLB N435 és Lipozyme TLIM enzimekkel 0 és 70°C között, a kevésbé aktív Lipobond PS és Lipozyme MmL enzimekkel 0 és 60°C között végeztük.
A szakaszos üzemmódban végzett méréseknek megfelelően a Lipozyme TLIM használatával a teljes vizsgált hőmérsékleti tartományban (0-70°C) a legmagasabb termelékenységet értük el, miközben kiváló szelektivitást tapasztaltunk (E »200 és monotonan növekvő ee értékek 10-ről 70°C-ra: 10°C-on 99,6%, 10°C-on ›99,9%). Ellentétben az előző két szubsztráttal (rac-5a, b), ahol a CaLB N435 volt a legaktívabb enzim magasabb hőmérsékleten, a rac-5c folyamatos kinetikai felbontásában a legnagyobb termelékenységet a teljes vizsgált hőmérsékleti tartományban a Lipozyme TLIM enzim használatakor figyelték meg. Mivel a CaLB N435 60°C-on mindhárom esetben magas termelékenységet mutatott (rfolyás >100 µmol/(g×h)), enantiomerszelektivitást (E »200) és enantiomer tisztaságot (ee »99,9%), ezért ezt az enzimkészítményt választottuk preparatív méretű kísérleteinkhez.
A három szubsztrát (rac-5a-c) folyamatos és recirkulációs, átfolyásos üzemben történő mérése után ismét megmértük a biokatalizátorral töltött oszlopok aktivitását és szelektivitását 30 és 60°C között a rac-5a kinetikai felbontásán folyamatos üzemben, ill.

Racém N-Boc védett fenilalanin tioetilészter dinamikus kinetikus rezolválása
- Célkitűzések
- Az N-Boc-védett fenilalanin tioetilészter (rac-9) szakaszos üzemű kinetikus
- A racém N-Boc-védett fenilalanin tioetilészter (rac-9) enzimkatalizált
- Az (R)-tioetilészter ((R)-9) báziskatalizált racemizációja folytonos, átfolyásos
- A racém N-Boc-védett fenilalanin tioetilészter (rac-9) dinamikus kinetikus
N-Boc-védett fenilalanin-tioetil-észter (rac-9) kinetikai rezolválásának megvalósítása szakaszos módban felületmódosított szilikagélen rögzített proteázzal Rezolválás megvalósítása felületmódosított szilikagélen rögzített proteázzal A vizsgálatokhoz használt kiindulási anyagot (rac-9) két lépésben állítottuk elő. A vizsgált körülmények között a legaktívabb és legszelektívebb enzim az Alc-Dv250-Et (Etilcsoporttal módosított szilikagél felületen adszorbeált Alcalase) volt, mellyel több mint 41%-os konverziót értünk el 98%-os enantiomertisztasággal és magas enantiomerszelektivitással (E ›200). Racém N-Boc-védett fenilalanin-tioetil-észter (rac-9) enzimkatalizált kinetikus rezolválása folyamatos, átfolyó rendszerben, folyamatos, átfolyó rendszerben.
Méréseinket folyamatosan 0 és 100 °C között terveztük végezni, de az intermittáló oldószerként használt terc-butanol szobahőmérsékleten szilárd halmazállapotú és 83 °C felett forr. Mivel nem találtunk szignifikáns különbséget a termelékenységben vagy a szelektivitásban, ezért folyamatos kísérleteinkhez terc-amil-alkoholt használtunk. A folyamatos működési teszteket négy enzimpreparátummal (Alc-Dv250-Et, Alc-Dv250-DiMe, Alc-Dv250-MePhe és Alc-Dv250-Dodec) végeztük, amelyek szakaszos üzemben teljesítenek a legjobban.
Ez a növekedés jellemzően 2,0-2,8-szoros volt, de az Alc-Dv250-MePhe használatakor az rflow érték több mint 4,5-szerese lett az rbatch értéknek. Mivel a legjobb eredményeket az Alc-Dv250-Et és Alc-Dv250-MePhe készítményekkel kaptuk, ezeket az enzimeket használtuk további vizsgálatainkhoz. Mivel az Alc-Dv250-Et enzim alkalmazásakor valamivel magasabb átlagértékeket tapasztaltunk (rflow: 414 µmol/(g×h), ee: 99,5%), mint az Alc-Dv250-MePhe-nél (rflow: 403 µmol/(g×h), ee), ezért a folyamatos dinamikus felbontás előbbi ki- racnetikus előkészítését választottuk.
Racém N-Boc védett fenilalanin-tioetil-észter (rac-9) dinamikus kinetikai felbontása folyamatos áramlási rendszerben.

Kísérleti rész
- Felhasznált anyagok
- Analitikai módszerek, eszközök, készülékek
- Ketonok (1a–j) reduktív aminálása
- Aminok (2e, 2g–i) előállítása ketonból (1e, 2g–i) oxim intermedieren keresztül
- Különböző fémkatalizátorok tesztelése az acetofenon (1g) egylépéses reduktív
- Ketonok (1a–j) reduktív aminálása egylépéses reakcióban Zn és 10%-os Pd/C
- Ketonok (1a–d) 10%-os Pd/C katalizálta reduktív aminálása folytonos,
- Racém aminok (rac-2a, c, e, g) enzimkatalizált kinetikus rezolválása
- Racém aminok (rac-2a, c, e, g) kémiai N-acilezése
- Racém aminok (rac-2a, c, e, g) kinetikus rezolválása N-acilezéssel szakaszos
- Az oldószer és az acilezőszer hatásának vizsgálata az enzimkatalizált N-
- Racém aminok (rac-2a, c, e, g) kinetikus rezolválása N-acilezéssel folytonos,
- Racém aminok (rac-2a, c, e, g) preparatív léptékű kinetikus rezolválása N-
- Szekunder alkoholok (rac-5a–c) enzimkatalizált kinetikus rezolválása
- Szekunder alkoholok (rac-5a–c) előállítása ciklohexén-oxid gyűrűnyitási
- Szekunder alkoholok (rac-5a–c) kémiai O-acilezése
- Szekunder alkoholok (rac-5a–c) kinetikus rezolválása O-acilezéssel szakaszos
- Szekunder alkoholok (rac-5a–c) kinetikus rezolválása O-acilezéssel folytonos,
- Szekunder alkoholok (rac-5a–c) preparatív léptékű kinetikus rezolválása
- Enantiomertiszta acetátok ((R,R)-6a–c) Zemplén-féle dezacilezése
- Racém N-Boc-védett fenilalanin tioetilészter (rac-9) enzimkatalizált dinamikus
- Racém fenilalanin (rac-7) Boc-anhidrides védése
- Racém N-Boc-védett fenilalanin tioetilészter (rac-9) előállítása
- Racém N-Boc fenilalanin benzilamid (rac-10) előállítása
- Proteáz enzim adszorpciós rögzítése felületmódosított szilikagélekre
- Racém N-Boc-védett fenilalanin tioetilészter (rac-9) kinetikus rezolválása
- Racém N-Boc-védett fenilalanin tioetilészter (rac-9) kinetikus rezolválása
- Az Alc-Dv250-Et és az Alc-Dv250-MePhe enzimkészítmények működési
- Az (R)-N-Boc-védett fenilalanin tioetilészter ((R)-9) racemizációjának
- A racém N-Boc-védett fenilalanin tioetilészter (rac-9) dinamikus kinetikus
- Az elméleti, a technikai és a kinetikus szelektivitási és aktivitási limit
Az egyesített szerves fázisokat 15 ml telített NaCl-oldattal mostuk, Na2S04 felett szárítottuk, majd bepárlás után a kívánt amint (2e, 2g–i) kaptuk. A szerves fázist Na2S04 fölött szárítottuk, végül az oldószert rotációs vákuumbepárlóval eltávolítottuk, így a megfelelő racemát-acetamidot kaptuk (rac-3a,c,e,g). Racém aminok (rac-2a, c, e, g) kinetikus rezolválása N-acilezéssel szakaszos műveletben A pontos reakciókörülményeket a referencia publikációk tartalmazzák.118,127 A pontos reakciókörülményeket a referencia publikációk tartalmazzák.118,127.
Az oldószer és az acilezőszer hatásának vizsgálata az enzimkatalizált N-acilezések során szakaszos feldolgozás során szakaszos feldolgozás során. Másodlagos alkoholok (rac-5a–c) előállítása ciklohexén-oxid gyűrűnyitási reakciójával A reakció pontos körülményeit, valamint a termékek fizikai és kémiai tulajdonságait a referencia tartalmazza. 146. Racém N-Boc-védett fenilalanin-tioetil-észter (rac-9) kinetikai rezolválása kötésamidálással benzil-aminnal.
Racém N-Boc-védett fenilalanin-tioetil-észter (rac-9) kinetikai rezolválása benzil-aminnal történő amidálással folyamatos áramlású rendszerben benzil-aminnal történő amidálással folyamatos áramlású rendszerben. Racém N-Boc-Phe-SEt (rac-9, 5 mg/ml) és benzil-amint (1,2 ekv.) terc-amil-alkoholban oldva áramoltattuk át a megfelelő szilárd biokatalizátorral töltött oszlopon 0,2 ml/perc áramlási sebességgel 0-100 °C hőmérséklet-tartományban, 10 °C-os lépésekben. Ezen a rendszeren 0,2 ml/perc áramlási sebességgel terc-amil-alkoholban oldott racém N-Boc-Phe-SEt (rac-9, 5 mg/ml), benzilamint (1,2 ekv.) és 1,8-diazabiciklocén-7-ént (DBU, 3 ekv.) tartalmazó oldatot engedtünk át.
Elméleti, technikai és kinetikai szelektivitás és aktivitási határok számítása a rac-9 dinamikus kinetikai felbontása során.
Összefoglalás
Dolgozatom harmadik részében indolvázat tartalmazó szekunder alkoholok (rac-5a-c) lipáz-katalizált kinetikus rezolválását valósítottuk meg folyamatos, átfolyó rendszerben O-acilezéssel. Először a kinetikus rezolválást vinil-acetáttal, hexán:terc-butil-metil-éter 2:1 arányú elegyében, szakaszosan hajtjuk végre. A legjobb hat (rac-5a) és négy (rac-5b, c) enzimpreparátummal folyamatos kinetikai felbontást is megvalósítottunk, melynek során a termelékenység és a szelektivitás hőmérsékletfüggését vizsgáltuk.
Azt találtuk, hogy a hőmérséklettől és a vizsgált szubsztráttól függően a CaLB N435 és a Lipozyme TLIM általában a két legtermékenyebb és legszelektívebb enzim. 50°C-ig általában a Lipozyme TLIM volt a legaktívabb enzim, míg 50°C felett a CaLB N435 magasabb termelékenységet mutatott kiváló szelektivitási értékekkel. Az optimalizált paraméterek mellett enantiomertiszta alkoholokat ((R)- és (S)-5a-c) és (R)-acetátokat ((R)-6a-c) állítottunk elő preparatív méretben CaLB N435 enzimmel folyamatos, átfolyós vagy recirkulációs üzemmódban.
Végül munkám utolsó részében egy racém aminosav származék (rac-9) proteáz-katalizált dinamikus kinetikus rezolválását valósítottuk meg folyamatos áramlású rendszerben. Először megfelelő enzimkészítményeket kellett előállítani, amelyeket N-Boc-védett fenilalanin-tioetil-észter (rac-9) benzil-aminnal történő amidálási reakciójában teszteltem szakaszos és folyamatos üzemben. Megállapítottuk, hogy a szelektivitás és a termelékenység a vizsgált hőmérsékleti tartományban maximumot mutat, ez a maximum 50-60°C körül van.
Az enantiomertiszta (R)-tioetil-észter ((R)-9) racemizálása során azt a hőmérsékletet kerestük, amelynél az enantiomertisztaság csökkenése maximális, míg a jelenlévő (S)-benzilamid ((S)-10) ee értéke nem változik.
Tézisek
Közlemények
Irodalomjegyzék