PROGRAMA DE POS GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS
DISSERTAÇÃO DE MESTRADO
AVALIAÇÃO DO EFEITO DE PARTICULADOS SÓLIDOS NA
EFICIÊNCIA DE UM INIBIDOR DE CORROSÃO
RECOMENDADO PARA MEIOS SALINOS COM CO
2Michele Portela Távora
Orientador: Prof. Dr. Uílame Umbelino Gomes
Co-orientador: Prof. Dr. Djalma Ribeiro da Silva
MICHELE PORTELA TÁVORA
AVALIAÇÃO DO EFEITO DE PARTICULADOS SÓLIDOS NA
EFICIÊNCIA DE UM INIBIDOR DE CORROSÃO
RECOMENDADO PARA MEIOS SALINOS COM CO
2Michele Portela Távora
NATAL/RN 2007
Dissertação apresentada como requisito parcial à obtenção do título de Mestre em Ciência e Engenharia de Materiais pelo Programa de Pós-Graduação em Ciência e Engenharia de Materiais da Universidade Federal do Rio Grande do Norte.
AGRADECIMENTOS
Este trabalho foi resultado não só do meu esforço, mas também do apoio de algumas pessoas e instituições, que devem ser relembradas com carinho. Assim, apresento os meus sinceros agradecimentos:
Em primeiro lugar a DEUS, que foi o primeiro responsável pela elaboração deste trabalho, através da vida que me deu.
Ao Prof. Dr. Uílame Umbelino Gomes pela orientação dada no decorrer deste trabalho e pelas enriquecedoras observações feitas na ocasião da qualificação;
Ao Prof. Dr. Djalma Ribeiro da Silva, pela orientação fornecida durante o desenvolvimento deste trabalho e também pela dedicação e oportunidades geradas nos últimos 4 anos de convivência;
Ao Prof. Dr. Hélio Scatena Júnior pela participação e pelas enriquecedoras observações feitas na ocasião da qualificação;
Ao Eng. Pedro Altoé Ferreira, do CENPES, por possibilitar a realização deste trabalho, através do financiamento e apoio incondicional em todas as etapas do trabalho;
Aos colegas do CENPES, Eva, Rosane e Marcelo, pelo coleguismo, compreensão e troca de experiências em momentos tão importantes, Álvaro e Jussara, pelas discussões que possibilitaram o enriquecimento deste trabalho, Fabrício, pelo empenho na realização deste projeto e pelas inúmeras contribuições a este trabalho, além das palavras de apoio fornecidas;
Aos amigos da UN-RNCE, Décio, David, Ossian e Andréa, pelo apoio e cooperação desde o início deste trabalho, pela compreensão nos momentos que necessitei me dedicar exclusivamente ao mestrado;
Ao Prof. Dr. Jailson pelo empréstimo de equipamentos e pelas discussões no decorrer deste trabalho;
Aos amigos Jardel e Andréa, por todos os momentos de cooperação, apoio e paciência, por sempre ter acreditado que a finalização deste projeto era possível e pela palavra amiga que sempre me ajudou a ter forças para seguir em frente;
A todos os integrantes do Laboratório de Corrosão, Adriana, Aécia, Allison, Daniela, Dannyele, Eduardo, Emily, Fernanda, Juliana, Rina, Shirley, Tarcila, Verushka e Williane, que tiveram contato comigo durante o desenvolvimento deste trabalho, principalmente pelo apoio, pela opinião e pelo incentivo;
A Thiago e Philipp, que acompanharam bem de perto a luta que foi finalizar este projeto, pelas horas dispensadas aos preparativos e execução dos ensaios, pelas discussões enriquecedoras e pelo empenho e dedicação que possibilitaram a realização deste trabalho;
A Severino, pela disponibilidade a qualquer momento do dia, pela companhia sempre alegre que tornou os dias menos cansativo e mais produtivo;
Ao Núcleo de Estudos em Petróleo e Gás Natural pela infra-estrutura concedida para a realização da pesquisa;
A Gerson, pela confecção dos cupons, eletrodos, célula e outras coisas importantes para o andamento deste trabalho, assim como pelo apoio e compreensão;
Aos meus pais, Eloilton Amoras da Silveira Távora e Francisca Portela Távora, pela dedicação durante todos os anos da minha vida e pelo apoio dado neste momento e em outros também difíceis, pela compreensão em relação a minha ausência durante muitos momentos;
Aos meus irmãos e minha sobrinha pelo carinho;
Ao meu namorado Túlio pelo companheirismo e compreensão durante os finais de semana e as noites em que a minha dedicação foi exclusiva a este trabalho e também pelas palavras de consolo ditas na hora certa;
SUMÁRIO
LISTA DE FIGURAS... viii
LISTA DE TABELAS... xiii
RESUMO... xiv
ABSTRACT... xv
1 INTRODUÇÃO... 16
2 REVISÃO DE LITERATURA... 19
2.1 Corrosão pelo CO2... 20
2.1.1 Fatores que interferem na corrosão pelo CO2... 21
2.1.2 Mecanismo... 33
2.1.3 A taxa de corrosão pelo CO2... 36
2.1.4 Produtos de corrosão pelo CO2... 37
2.2 Inibidores de corrosão... 43
2.3 Técnicas de monitoramento da corrosão... 51
2.3.1 Técnicas eletroquímicas... 52
2.3.2 Técnica gravimétrica – Perda de massa... 62
2.4 Influência dos sólidos na velocidade de corrosão... 65
3 MATERIAIS E MÉTODOS... 68
4 RESULTADOS E DISCUSSÃO... 81
4.1 Caracterização dos cupons de perda de massa e eletrodos... 82
4.2 Caracterização dos particulados sólidos... 83
4.3 Eficiência do inibidor CT 703... 89
4.4 Velocidade de formação do filme do inibidor CT 703... 91
4.5 Efeito dos sólidos... 96
4.6 Eficiência do inibidor CT 703 com sólidos ... 98
4.7 Velocidade de formação do filme do inibidor CT 703 com sólidos... 99
5 CONCLUSÕES E SUGESTÕES... 106
REFERÊNCIAS... 108
LISTA DE FIGURAS
Figura 2.1 - Variação do pH in situ com H2S e CO2 (adaptado ALTOÉ, 1998;
PREDICT, 2002)... 22 Figura 2.2 - Taxa de corrosão do aço em função do pH (adaptado ALTOÉ,
1998; PREDICT, 2002)... 22 Figura 2.3 - Diagrama de Pourbaix para o sistema Fe-H2O-CO2 a 51 ºC, com
valores diferentes de atividade iônica, mostrando a região do FeCO3
(adaptado MISHRA et al. 1993)... 24
Figura 2.4 - Taxa de corrosão em função da temperatura e da Pco2
(adaptado ALTOÉ, 1998; PREDICT, 2002)... 26 Figura 2.5 - Efeito da concentração de oxigênio em função da temperatura
na corrosão (adaptado ALTOÉ, 1998; PREDICT, 2002)... 28 Figura 2.6 - Distribuição das espécies em função do pH para o caso pCO2 =
2 bar (adaptado ALTOÉ, 1998)... 35 Figura 2.7 - Monograma da corrosão pelo CO2 (ALTOÉ, 1998; PREDICT,
2002)... 37 Figura 2.8 - Diferentes morfologias observadas para camadas de corrosão
protetoras e não protetoras (adaptado KERMANI e MORSHED, 2003)... 42 Figura 2.9 - Representação esquemática da dupla camada de Helmholtz
(adaptado VILORIA e VERA, 1994)... 46 Figura 2.10 - Circuito equivalente de um sistema com dois eletrodos (METAL
SAMPLES, 2005)... 55 Figura 2.11 - Princípio do sistema comercial PAIR* (METAL SAMPLES,
2005)... 56 Figura 2.12 - Tipos de sonda RPL utilizadas no campo. Tipo Flush
(embutido:) (a) e (c) e tipo Projecting (pino): (b) e (d) Adaptada do
catalogo da CorroCean ASA, 1999... 57 Figura 2.13 - Decaimento da taxa de corrosão em relação ao tempo... 58 Figura 2.14 - Exemplo de sondas de galvânica empregadas em campo: Tipo
Figura 3.1 - Geometria e dimensões dos corpos de prova utilizados nos ensaios de perda de massa e como eletrodos da sonda LPR. Adaptado do catálogo da METAL SAMPLES, 2005... 69 Figura 3.2 - Corpos de prova em aço carbono após fabricação e
condicionamento para os ensaios de corrosão. À esquerda antes e à
direita depois do jateamento... 70 Figura 3.3 - Geometria e dimensões dos eletrodos da sonda galvânica.
Adaptado do catálogo da Metal Samples, 2005... 70 Figura 3.4 - Eletrodos galvânicos após fabricação e condicionamento para
os ensaios eletroquímicos. À esquerda o eletrodo de aço carbono e à
direita o de latão... 70 Figura 3.5 - Experimento montado na capela... 73 Figura 3.6 - Detalhes das sondas e eletrodos dentro da célula... 73 Figura 3.7 - (a) Sistema de vedação/travamento da tampa e (b) Detalhe do
sistema de vedação... 74 Figura 4.1 - Microestrutura típica dos corpos de prova de aço carbono
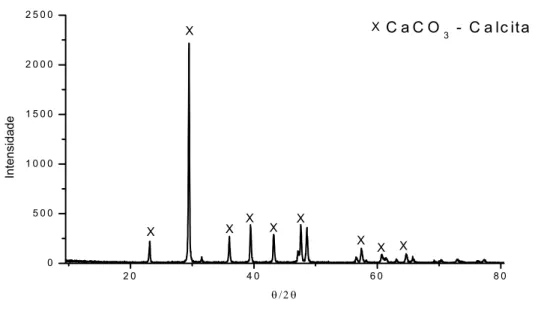
ensaiados. Estrutura ferrítico-perlítica. Ampliação 500x. Ataque Nital 2%.. 82 Figura 4.2 - Difratograma do carbonato de cálcio (CaCO3) evidenciando a
presença de uma única fase de calcita... 84 Figura 4.3 - Difratograma do óxido de ferro (Fe3O4) evidenciando a presença
de uma única fase de magnetita... 84 Figura 4.4 - Difratograma da areia evidenciando a presença exclusiva de
quartzo (SiO2)... 85
Figura 4.5 - Difratograma do sulfeto de ferro, evidenciando a presença de
duas fases, a troilita (FeS) e a greigita (Fe3S4)... 85
Figura 4.6 - Distribuição granulométrica da calcita (CaCO3). Diâmetro médio
= 4,13 Pm... 86 Figura 4.7 - Distribuição granulométrica da magnetita (Fe3O4). Diâmetro
Médio = 6,75 Pm... 86 Figura 4.8 - Distribuição granulométrica do quartzo (SiO2). Diâmetro Médio =
190,77Pm... 87 Figura 4.9 - Distribuição granulométrica do sulfeto de ferro. Diâmetro Médio
Figura 4.10 - Sobreposição das curvas de distribuição granulométrica do
CaCO3, Fe3O4, FeS/Fe3S4 e SiO2... 88
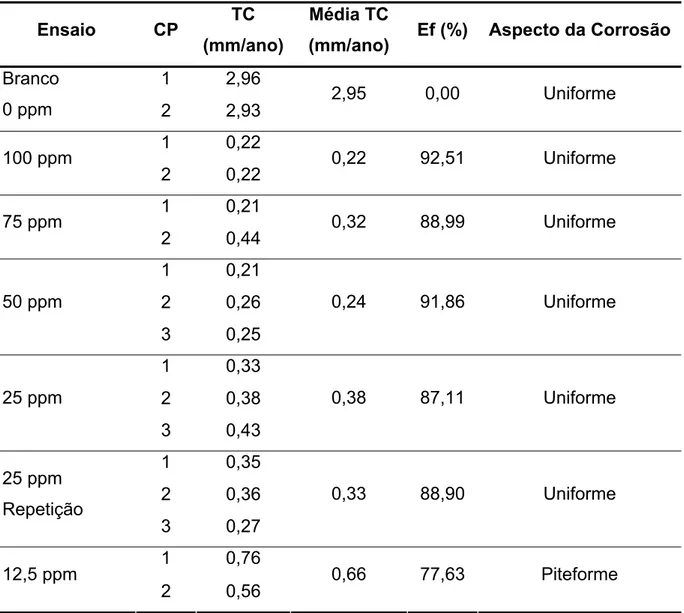
Figura 4.11 - Eficiência do inibidor CT 703... 90
Figura 4.12 - Taxa de corrosão x tempo do branco... 91
Figura 4.13 - Taxa de corrosão x tempo do CT 703 100 ppm... 92
Figura 4.14 - Taxa de corrosão x tempo do CT 703 75 ppm... 92
Figura 4.15 - Taxa de corrosão x tempo do CT 703 50 ppm... 93
Figura 4.16 - Taxa de corrosão x tempo do CT 703 25 ppm... 93
Figura 4.17 - Taxa de corrosão x tempo do CT 703 25 ppm repetição... 94
Figura 4.18 - Taxa de corrosão x tempo do CT 703 12,5 ppm... 94
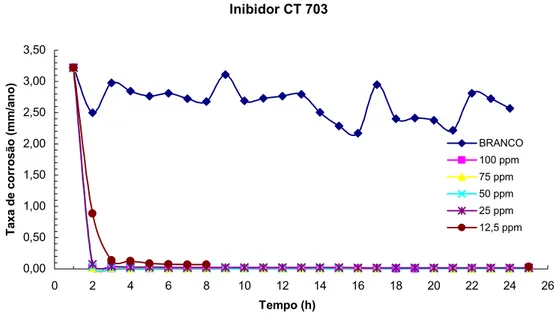
Figura 4.19 - Gráfico da taxa de Corrosão por RPL para o ensaio com todas as concentrações do inibidor CT 703... 95
Figura 4.20 - Gráfico da taxa de Corrosão por RPL para os ensaios branco com todos os sólidos... 97
Figura 4.21 - pH x tempo branco calcita... 98
Figura 4.21 - Taxa de corrosão x tempo do CT 703 50 ppm com quartzo... 100
Figura 4.22 - Taxa de corrosão x tempo do CT 703 50 ppm com magnetita.... 100
Figura 4.23 - Taxa de corrosão x tempo do CT 703 50 ppm com calcita... 101
Figura 4.24 - Taxa de corrosão x tempo do CT 703 50 ppm com sulfeto de ferro... 101
Figura 4.25 - Gráfico da taxa de corrosão por RPL com inibidor CT 703 com os sólidos estudados... 102
Figura 4.26 - Relação inibidor e quartzo... 103
Figura 4.27 - Relação inibidor e magnetita... 103
Figura 4.28 - Relação inibidor e calcita... 104
Figura 4.29 - Relação inibidor e sulfeto de ferro... 104
Figura A.1 - Taxa de corrosão x tempo do branco... 114
Figura A.2 - O2 x tempo do branco... 114
Figura A.3 - pH x tempo do branco... 114
Figura A.4 - Temperatura x tempo do branco... 114
Figura A.5 - Taxa de corrosão x tempo CT 703 100 ppm... 115
Figura A.6 - O2 x tempo CT 703 100 ppm... 115
Figura A.8 - Temperatura x tempo CT 703 100 ppm... 115
Figura A.9 - Taxa de corrosão x tempo CT 703 75 ppm... 116
Figura A.10 - O2 x tempo CT 703 75 ppm... 116
Figura A.11 - pH x tempo CT 703 75 ppm... 116
Figura A.12 - Temperatura x tempo CT 703 75 ppm... 116
Figura A.13 - Taxa de corrosão x tempo CT 703 50 ppm... 117
Figura A.14 - O2 x tempo CT 703 50 ppm... 117
Figura A.15 - pH x tempo CT 703 50 ppm... 117
Figura A.16 - Temperatura x tempo CT 703 50 ppm... 117
Figura A.17 - Taxa de corrosão x tempo CT 703 25 ppm... 118
Figura A.18 - O2 x tempo CT 703 25 ppm... 118
Figura A.19 - pH x tempo CT 703 25 ppm... 118
Figura A.20 - Temperatura x tempo CT 703 25 ppm... 118
Figura A.21 - Taxa de corrosão x tempo CT 703 25 ppm repetição... 119
Figura A.22 - O2 x tempo CT 703 25 ppm repetição... 119
Figura A.23 - pH x tempo CT 703 25 ppm repetição... 119
Figura A.24 - Temperatura x tempo CT 703 25 ppm repetição... 119
Figura A.25 - Taxa de corrosão x tempo CT 703 12,5 ppm... 120
Figura A.26 - O2 x tempo CT 703 12,5 ppm... 120
Figura A.27 - pH x tempo CT 703 12,5 ppm... 120
Figura A.28 - Temperatura x tempo CT 703 12,5 ppm... 120
Figura A.29 - Taxa de corrosão x tempo branco quartzo... 121
Figura A.30 - O2 x tempo branco quartzo... 121
Figura A.31 - pH x tempo branco quartzo... 121
Figura A.32 - Temperatura x tempo branco quartzo... 121
Figura A.33 - Taxa de corrosão x tempo branco magnetita... 122
Figura A.34 - O2 x tempo branco magnetita... 122
Figura A.35 - pH x tempo branco magnetita... 122
Figura A.36 - Temperatura x tempo branco magnetita... 122
Figura A.37 - Taxa de corrosão x tempo branco calcita... 123
Figura A.38 - O2 x tempo branco calcita... 123
Figura A.39 - pH x tempo branco calcita... 123
Figura A.41 - Taxa de corrosão x tempo branco sulfeto de ferro... 124
Figura A.42 - O2 x tempo branco sulfeto de ferro... 124
Figura A.43 - pH x tempo branco sulfeto de ferro... 124
Figura A.44 - Temperatura x tempo branco sulfeto de ferro... 124
Figura A.45 - Taxa de corrosão x tempo CT 703 50 ppm com quartzo (1000 ppm)... 125
Figura A.46 - O2 x tempo CT 703 50 ppm com quartzo (1000 ppm)... 125
Figura A.47 - pH x tempo CT 703 50 ppm com quartzo (1000 ppm)... 125
Figura A.48 - Temperatura x tempo CT 703 50 ppm com quartzo (1000 ppm) 125 Figura A.49 - Taxa de corrosão x tempo CT 703 50 ppm com magnetita (1000 ppm)... 126
Figura A.50 - O2 x tempo CT 703 50 ppm com magnetita (1000 ppm)... 126
Figura A.51 - pH x tempo CT 703 50 ppm com magnetita (1000 ppm)... 126
Figura A.52 - Temperatura x tempo CT 703 50 ppm com magnetita (1000 ppm)... 126
Figura A.53 - Taxa de corrosão x tempo CT 703 50 ppm com calcita (1000 ppm)... 127
Figura A.54 - O2 x tempo CT 703 50 ppm com calcita (1000 ppm)... 127
Figura A.55 - pH x tempo CT 703 50 ppm com calcita (1000 ppm)... 127
Figura A.56 - Temperatura x tempo CT 703 50 ppm com calcita (1000 ppm).. 127
Figura A.57 - Taxa de corrosão x tempo CT 703 50 ppm com sulfeto de ferro (1000ppm)... 128
Figura A.58 - O2 x tempo CT 703 50 ppm com sulfeto de ferro (1000 ppm)... 128
Figura A.59 - pH x tempo CT 703 50 ppm com sulfeto de ferro (1000 ppm).... 128
LISTA DE TABELAS
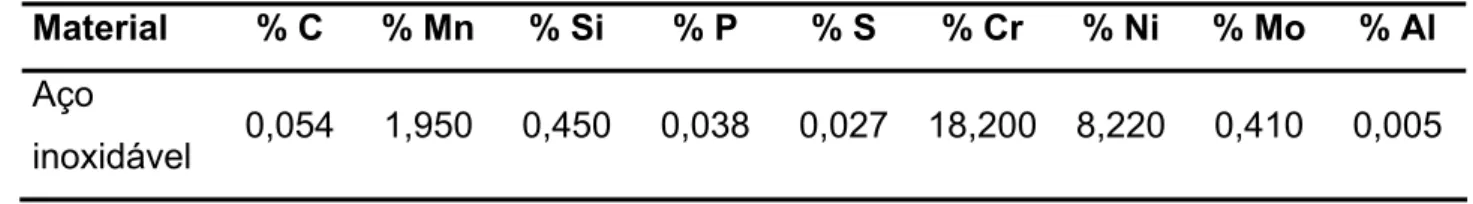
Tabela 4.1 - Composição química do aço carbono utilizado nos ensaios... 82 Tabela 4.2 - Composição química do aço inoxidável utilizado nos ensaios… 83 Tabela 4.3 - Fluorescência de raios-X dos particulados sólidos analisados... 83 Tabela 4.4 - Difração de raios-X dos particulados sólidos analisados... 83 Tabela 4.5 - Distribuição granulométrica dos particulados sólidos analisados. 88 Tabela 4.6 - Dados de perda de massa e eficiência do inibidor CT 703... 89 Tabela 4.7 - Dados de perda de massa dos brancos com sólidos... 96 Tabela 4.8 - Dados de perda de massa e eficiência do inibidor CT 703 com
RESUMO
O principal problema ligado à atividade de exploração de petróleo é a água que se produz nos campos produtores. O agravamento deste problema se deve aos avanços obtidos nos processos de extração de petróleo, bem como às operações secundárias que objetivam a recuperação de petróleo. Os principais contaminantes presentes nesta água que contribuem para o desenvolvimento de processos corrosivos são: gases (que se encontram dissolvidos na água, tais como O2, CO2e
H2S), sólidos em suspensão e sais dissolvidos. Dentre os gases destaca-se o CO2
que provoca desgaste significativo nas tubulações (de aço carbono) de indústrias de petróleo e gás natural. O uso de inibidores de corrosão é uma prática comum no combate aos processos corrosivos. Neste contexto, os contaminantes do tipo particulados sólidos são pouco avaliados. Desta forma, neste trabalho, o efeito do inibidor de uso comercial CORRTREAT 703 em particulados sólidos comumente encontrados em oleodutos. Utilizou-se um meio salino contendo 10.000 ppm de cloreto desaerado com CO2 até obtenção de um meio isento de oxigênio. Para
tanto, os sólidos escolhidos foram: quartzo, magnetita, carbonato de cálcio e sulfeto de ferro. A eficiência de inibição do CORRTREAT 703 na corrosão provocada por estes sólidos, foi medida com o uso de técnicas eletroquímicas (resistência de polarização linear e par galvânico) e gravimétricas. Durante todo o trabalho experimental, foram monitorados os seguintes parâmetros: pH, oxigênio dissolvido, temperatura, taxa de corrosão instantânea e corrente galvânica. De acordo com os resultados obtidos comprovou-se que o carbonato de cálcio e o sulfeto de ferro estão envolvidos em um processo corrosivo mais lento em função do aumento do pH do meio. No entanto, o quartzo e a magnetita em virtude da sua dureza aceleram a corrosão pela quebra da camada passiva por erosão. Por outro lado, o inibidor avaliado foi eficaz (91 %) em uma concentração de 50 ppm no processo avaliado.
Palavras-chave: particulados sólidos, inibidor de corrosão, corrosão pelo CO2,
ABSTRACT
The main problem on the exploration activity on petroleum industry is the formation water resulted on the fields producing. The aggravating of this problem is correlated with the advancing technologies used on the petroleum extractions and on its secondary approach objecting the reobtainment of this oil. Among the main contaminants of the water formation are corrosives gases such as: O2, CO2and H2S,
some solids in suspension and dissolved salts. Concerning to those gases the CO2 is
the one that produce significant damage for carbon steel on corrosion process of the petroleum and gas industries. Corrosion inhibitors for carbon steel in formation water is one of the most used agents in control of those damages. In this context, the poor investigations of carbon steel corrosion proceeding from solids in suspension is an opened field for studies. On this work the inhibitor effect of the commercial CORRTREAT 703 was evaluated on some specific solids in suspension at saline medium containing 10.000 ppm of de-aerated chloride using CO2 until non oxygen
atmosphere been present. For that, quartz, calcium carbonate, magnetite and iron sulphide were subjected to this investigation as the selected solids. The effect of this inhibitor on corrosion process correlated with those specific solids, was measured using electrochemical (resistance of linear polarization and galvanic pair) and gravimetrical techniques. During all the experimental work important parameters were monitored such as: pH, dissolved oxygen, temperature, instantaneous corrosion rate and galvanic current. According to the obtained results it was proved that the suspension solids calcium carbonate and iron sulphide decrease the corrosion process in higher pH medium. Meanwhile the quartz and magnetite been hardness increase corrosion by broking of the passive layer for erosion. In the other hand, the tested inhibitor in concentration of 50 ppm, showed to be effective (91%) in this corrosion process.
Keywords: solid particle, corrosion inhibitor, CO2 corrosion, electrochemical
INTRODUÇÃO
1 INTRODUÇÃO
As atividades de exploração e produção de petróleo e gás natural estão sempre associadas à presença da água produzida. Enquanto a produção do óleo diminui com o tempo, a produção de água cresce ao longo da vida produtiva do reservatório decorrente dos processos naturais ou provenientes dos métodos de recuperação secundária. Em campos maduros, a quantidade de água produzida pode atingir teores acima de 90 %. Alguns campos de produção do RN estão operando a mais de 30 anos e a recuperação com injeção de água e vapor é uma técnica para continuar produzindo.
A água muitas vezes tem salinidade elevada, aumentando assim a condutividade do meio e promovendo um processo corrosivo acelerado nas estruturas em aço carbono. Os gases dissolvidos (CO2, H2S e O2) na água
promovem mudanças nas características da mesma como abaixamento do pH e leva a um agravamento no processo corrosivo.
Entre os gases dissolvidos, o CO2 é o mais comum, promovendo a corrosão
que é um problema comum na indústria do petróleo e gás natural, onde a maior parte das instalações é de aço carbono. O estudo deste tipo de corrosão visa diminuir os custos associados aos reparos ou substituição de equipamentos danificados pela corrosão, mas principalmente controlar os custos diretos decorrentes da perda do volume de petróleo produzido. Em poços de petróleo, a presença de CO2 nos fluidos produzidos provém da formação produtora ou do uso
de técnicas especiais de recuperação terciária de óleo baseada na injeção de gás carbônico nos reservatórios (MORAES e SHADLEY, 2001).
A corrosão no transporte de óleo está sempre associada à presença de água, gases dissolvidos, composição do óleo, nível de água produzida e por parâmetros operacionais tais como: velocidade de fluxo, regime de escoamento, pressão e temperatura. Os ensaios são normalmente feitos levando-se em consideração somente a fase aquosa, que é a maior responsável pelas altas taxas.
Neste contexto os inibidores de corrosão entram como alternativa para controlar as taxas de corrosão, mantendo-as em níveis aceitáveis.
aplicação, da forma mais rápida e econômica possível. O teste de seleção deve ser simples, confiável e representativo. Na maioria das vezes, os inibidores são selecionados mediante testes que levam em consideração somente o tipo de aço e a composição da água produzida, não sendo considerado os sólidos presentes.
O objetivo deste trabalho é avaliar o efeito de particulados sólidos na eficiência de inibidores de corrosão para meios salinos com CO2 utilizando técnicas
eletroquímicas e gravimétricas.
O presente trabalho está dividido da seguinte forma:
Capítulo 1: Introdução
Neste capítulo são descritos sucintamente a justificativa e o objetivo do trabalho e a forma como a dissertação está dividida.
Capítulo 2: Revisão de Literatura
Aqui será abordada toda a teoria que embasa este trabalho, como o mecanismo, fatores interferentes e produtos da corrosão pelo CO2, inibidores de
corrosão e as técnicas de monitoramento da corrosão.
Capítulo 3: Materiais e Métodos
Este capítulo relata e descreve os materiais utilizados para o desenvolvimento deste trabalho, além dos métodos (eletroquímicos e não-eletroquímicos) de avaliação da corrosão.
Capítulo 4: Resultados e Discussão
Todas as etapas do desenvolvimento deste trabalho encontram-se neste capítulo, com os seus respectivos resultados e discussões.
Capítulo 5: Conclusões e Sugestões
Encontram-se resumido neste capítulo os principais resultados desta dissertação e as sugestões para trabalhos futuros.
Referências
2 REVISÃO DE LITERATURA
2.1 Corrosão pelo CO2
A corrosão por CO2 é freqüentemente encontrada na indústria de petróleo e
gás natural e ocorre em todos os estágios de produção, desde a prospecção até às instalações de processamento (ALTOÉ, 1998; LINTER e BURSTEIN, 1999; FILHO e ORAZEM, 2001; ABAYARATHANA e NARAGHI, 2001; ABAYARATHANA e NARAGHI, 2001; FERREIRA, 2003). A perda de produção e os custos de reparo ocasionados pela corrosão do aço em contato com gases úmidos e linhas com múltiplas fases tornam indispensável à adoção de técnicas adequadas de monitoramento da corrosão (MISHRA et al., 1997; ALTOÉ, 1998; MORA-MENDOZA
e TURGOOSE, 2002; SILVA et al., 2006)
Os métodos de prevenção incluem a substituição das tubulações de aço por ligas resistentes à corrosão e o uso de inibidores e revestimentos não metálicos (MISHRAet al., 1997).
O CO2 se dissolve na água formando ácido carbônico (H2CO3), o qual é
agressivo ao aço. A formação do produto de corrosão sobre a superfície sofre influência da composição do aço, do fluxo e das condições do meio, como pH, temperatura, pressão, composição do eletrólito, existência de inibidores, dentre outros (MORA-MENDOZA e TURGOOSE, 2002).
Sabe-se que a camada de produto de corrosão tem papel fundamental no mecanismo, na cinética e no tipo de corrosão por CO2. Quando existe uma camada
protetora, a transferência de massa para a superfície metálica se torna o fator de controle da taxa de corrosão, antes da evolução catódica do hidrogênio (KINSELLA, TAN e BAILEY, 1998).
A formação irregular da camada de corrosão e a sua destruição localizada são os principais fatores que contribuem para a corrosão localizada por CO2.
Camadas de corrosão protetoras são capazes de diminuir a taxa de corrosão inicial em até 3 vezes, levando a taxa nula de corrosão com o passar do tempo (KINSELLA, TAN e BAILEY, 1998).
A corrosão por CO2 pode ser ocasionada tanto pelas condições do meio,
2.1.1 Fatores que interferem na corrosão pelo CO2
2.1.1.1 pH
O pH da solução tem um papel importante na corrosão do aço porque influencia tanto as reações eletroquímicas que levam à dissolução do ferro quanto à precipitação das camadas protetoras que governam os fenômenos de transporte associados com estas reações. Sob certas condições, os constituintes da solução na fase aquosa tamponam o pH, o que pode levar à precipitação da camada de corrosão e a uma possível diminuição na taxa de corrosão (KERMANI e MORSHED, 2003).
Como um exemplo, pelo incremento do pH de 4,0 para 5,0, a solubilidade do Fe2+ é reduzida 5 vezes. Já para um acréscimo do pH de 5,0 para 6,0, a redução da solubilidade do Fe2+ é de cerca de 100 vezes. Uma baixa solubilidade pode corresponder a uma maior supersaturação, a qual acelera o processo de precipitação do filme de FeCO3. Para valores de pH > 5,0, a probabilidade de
formação do filme é aumentada e pode contribuir para as menores taxas de corrosão observadas (KERMANI e MORSHED, 2003). Além disso, valores elevados de pH resultam na diminuição da taxa de corrosão porque diminuem a quantidade de íons H+ disponíveis e diminuem a taxa de reação de redução de H (NESIC e LUNDE, 1994).
Para corrosão uniforme, a taxa de corrosão aumenta com a adição de CO2,
porque a solução tem seu pH reduzido em virtude da formação do ácido carbônico. Este efeito é mais acentuado para valores menores que 3,8 (MISHRA et al., 1997).
O pH é um dos parâmetros mais críticos na determinação da corrosividade. Para ambientes que contêm CO2 e H2S dissolvidos, o pH deve ser calculado com
Figura 2.1 - Variação do pH in situ com H2S e CO2 (adaptado ALTOÉ, 1998; PREDICT, 2002)
De acordo com o pH, a taxa de corrosão será afetada, conforme pode ser observado na Figura 2.2 (ALTOÉ, 1998).
Figura 2.2 - Taxa de corrosão do aço em função do pH para algumas velocidades de fluxo (adaptado ALTOÉ, 1998; PREDICT, 2002)
Verifica-se ainda na Figura 2.2 que a velocidade de fluxo é um parâmetro bastante significativo na corrosividade do fluido. Algumas águas de formação
Taxa de
Corr
osão (mm/a
no)
apresentam altos valores de pH devido à ação tampão do bicarbonato e acetato. Estes efeitos devem ser considerados no cálculo do pH.
OGUNDELE e WHITE (apud MORA-MENDOZA e TURGOOSE, 2002), determinaram que para o aço, imerso em soluções aquosas com CO2 na
temperatura ambiente, as camadas de FeCO3 se formam para pH > 4,95. MORAES
(2000) também relatou que filmes protetores só são observados para valores de pH acima de 5,0. AL-SAYED (apud MORA-MENDOZA e TURGOOSE, 2002) mostrou que o FeCO3 é o principal produto formado na superfície metálica para soluções
saturadas com CO2, com pH 6,5 e temperatura ambiente. Para pequenos períodos
de imersão, o filme na superfície não se encontra uniforme e apresenta falha na compactação. Porém, com o passar do tempo, a compactação é melhorada e após 8 dias são formados cubos cristalinos de FeCO3.
VIDEM e DUGSTAD (apud KERMANI e MORSHED, 2003), reportaram que uma boa proteção pode ser obtida em pH 6,0 pelos filmes de FeCO3, mesmo em
temperatura ambiente. Eles demonstraram que um aumento no pH também resulta na formação de um filme como conseqüência da redução da solubilidade do Fe2+. Da mesma forma, MORAES (apud KERMANI e MORSHED, 2003) afirmou que as camadas protetoras podem ser observadas somente em pH > 5,0 – camadas muito protetoras estão presentes somente em altas temperaturas (93 ºC) e altos valores de pH (> 5,5).
Na ausência de agentes complexantes (como o HCO3-), a solubilidade do
FeCO3 é pequena para pH 8,0 (VIDEM E KOREN, 1993).
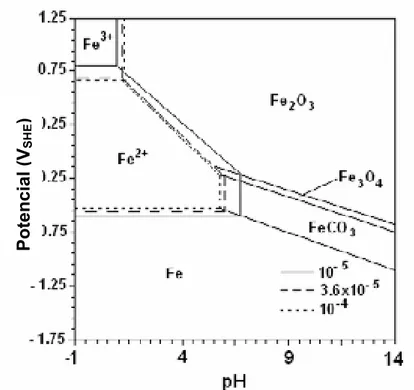
MISHRA et al. (1993) construíram um Diagrama de Pourbaix para o sistema
Fe-H2O-CO2 a 51 ºC, onde se verifica que a formação do carbonato de ferro é
Figura 2.3 - Diagrama de Pourbaix para o sistema Fe-H2O-CO2 a 51 ºC, com valores diferentes de atividade iônica, mostrando a região do FeCO3 (adaptado MISHRA et al. 1993)
2.1.1.2 Temperatura
A temperatura de operação afeta fortemente a natureza, as características e a morfologia do filme, o qual tem influência no processo de corrosão por CO2. Em
temperaturas acima de 80 ºC, a solubilidade do FeCO3 na solução é diminuída e a
supersaturação leva à precipitação deste composto (KERMANI e MORSHED, 2003), formando um filme aderente e compacto (MISHRA et al., 2003). Em baixas temperaturas (< 70 ºC), a taxa de corrosão aumenta progressivamente até temperaturas intermediárias, entre 70°C e 90 ºC. Porém, nos lugares onde ocorre a quebra na formação de FeCO3, o processo corrosivo acontece de forma
incontrolável, o que pode acarretar severo ataque localizado. O aumento na taxa de corrosão em baixas temperaturas é devido a um aumento na taxa de transferência de massa como um resultado do efeito de fluxo e da baixa taxa de formação de FeCO3. Conseqüentemente, depois da formação de uma camada protetora, o
processo de difusão se torna o processo limitante na corrosão (KERMANI e MORSHED, 2003).
Em altíssimas temperaturas (> 250 ºC), a formação da magnetita (Fe3O4)
torna o filme mais estável (MISHRA et al., 1997).
Potencial
(VSHE
A supersaturação do Fe2+ pode ser 5 a 10 vezes maior do que os valores
termodinâmicos calculados para a solubilidade (MORA-MENDOZA e TURGOOSE, 2002).
IKEDA (apud ALTOÉ, 1998) correlaciona a temperatura com os produtos de corrosão pelo CO2:
x Para temperaturas abaixo de 60 °C a corrosão pelo CO2 não forma
produtos de corrosão protetores, expondo assim a superfície do material a uma corrosão contínua e normalmente mais uniforme;
x Para temperaturas entre 60 °C e 120 °C, a corrosão pelo CO2
aumenta gradativamente com o aumento de temperatura. Nesta faixa de temperatura a taxa de corrosão uniforme pode às vezes ser menos severa, dependendo da formação do filme do produto de corrosão. Entretanto, o mecanismo de corrosão preocupante passa a ser a corrosão Iocalizada, devido à formação imperfeita do filme criando pites, o que pode levar a falhas em tempos menores de operação. Nesta faixa de temperatura, a corrosão torna-se bastante influenciada pela velocidade, ocorrendo também problemas de corrosão-erosão;
x Para temperatura entre 120 °C e 150 °C, é conhecido que a taxa de corrosão é baixa devido à formação de um filme pelo produto de corrosão bastante fino, uniforme e aderente, o que lhe confere um caráter protetor. A formação desse filme ocorre devido à forte dissolução do ferro e a uma nucleação muito acelerada do FeCO3, tornando-o bastante uniforme e protetor.
DUGSTAD (apud MORA-MENDOZA e TURGOOSE, 2002) demonstrou que a morfologia dos filmes é função da temperatura. Abaixo de 40 ºC, os filmes apresentam estrutura com poros abertos e são formados principalmente por Fe3C,
com pouco FeCO3 e elementos de liga contidos no aço. O carbeto de ferro é a
primeira parte do aço original, no estado não oxidado, que se acumula na superfície como produto de corrosão do ferro. A taxa de corrosão tende a diminuir nos primeiros dias de exposição, porém aumenta novamente para tempos mais prolongados, devido ao aumento da reação catódica induzida pela presença de carbeto de ferro.
A temperatura de 49 ºC, os filmes de corrosão formados não são efetivos na redução da taxa de corrosão (MORAES et al., 2000). Em 60 ºC, o filme apresenta
poros contendo principalmente Fe3C na parte interna e mais FeCO3 acumulado na
significativamente. A 80 ºC, um filme de FeCO3 denso e protetor é formado próximo
à superfície metálica, diminuindo a taxa de corrosão rapidamente (MORA-MENDOZA e TURGOOSE 2002).
A maioria dos trabalhos concorda que a taxa de corrosão atinge um máximo na faixa de temperatura entre 60°C a 80 °C, conforme apresentado na Figura 2.4 (ALTOÉ, 1998). A pressão parcial de CO2 (pCO2) também exerce forte influência na
corrosividade do meio.
Figura 2.4 - Taxa de corrosão em função da temperatura e da pCO2 (adaptado ALTOÉ, 1998; PREDICT, 2002)
2.1.1.3 Pressão parcial de CO2 (pCO2)
A pressão parcial de CO2 tem sido usada nos cálculos de pH e nas medidas
das taxas de corrosão (KERMANI e MORSHED, 2003), uma vez que influi na quantidade de CO2 dissolvido (MISHRA et al., 1997).
Temperatura (°C)
Taxa de
Corr
osão (mm/a
Maiores pressões parciais de CO2 aumentam a taxa de corrosão, pois
causam redução no pH e aumentam a taxa de reação de redução do ácido carbônico (NESIC e LUNDE, 1994).
A inserção de CO2 no sistema acelera a reação catódica, pela ação do
H2CO3 não dissociado. Em uma dada pressão parcial de CO2, a concentração de
H2CO3 não é afetada pela variação da concentração do íon HCO3- (VIDEM e
KOREN, 1993).
2.1.1.3 O2 dissolvido
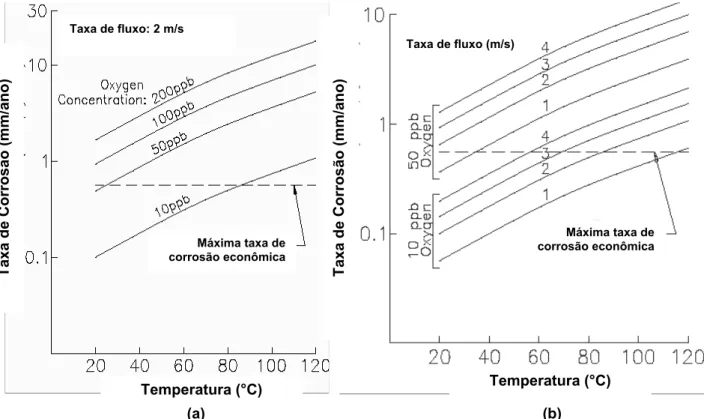
O oxigênio não está presente no fluido de produção transportado em oleodutos e gasodutos a não ser que tenha ocorrido uma contaminação. Esta contaminação pode ocorrer quando o campo tem sistema de injeção de água, cujo oxigênio pode não ter sido removido adequadamente; em oleodutos, onde os suspiros de tanques de campos de baixa produção não são selados com gás natural; em gasodutos, por falha em selagens de compressores; em oleodutos, por problemas em gaxetas, etc (ALTOÉ, 1998).
Quando esta contaminação ocorre, o resultado pode ser desastroso. A Figura 2.5 (a) e (b) mostram como a taxa de corrosão pelo CO2 aumenta em função
(a) (b)
Figura 2.5 - Efeito da concentração de oxigênio em função da temperatura na corrosão (adaptado ALTOÉ, 1998; PREDICT, 2002)
A contaminação por O2 é uma das maiores dificuldades no estudo da
corrosão por CO2 em laboratório. Na prática, traços de O2 podem entrar no sistema
na injeção de inibidores ou em outras operações. Adição súbita de O2 (10 ppb a
1500 ppb) resulta em um acréscimo moderado da taxa de corrosão devido a uma reação catódica alternativa (MISHRA et al., 1997).
2.1.1.4 H2S dissolvido
Ignorando os problemas de corrosão associados à presença de enxofre, baixos níveis de H2S podem afetar a corrosão por CO2, agindo como promotor da
dissolução anódica através da adsorção de sulfeto e afetando o pH. Porém pode também diminuir a corrosão pela formação de um filme protetor, para razões de H2S/CO2 superiores a 1/5.000 (KERMANI e MORSHED, 2003).
Em condições similares, as instalações de petróleo e gás podem sofrer menores taxas de corrosão na presença de enxofre se comparadas com sistemas completamente isentos deste composto. Isto é atribuído ao fato de que o ácido criado pela dissolução do H S é cerca de três vezes mais fraco do que o ácido
Taxa de
Corr
osão (mm/a
no)
Taxa de
Corr
osão (mm/a
no)
Temperatura (°C) Temperatura (°C)
Taxa de fluxo: 2 m/s
Taxa de fluxo (m/s)
Máxima taxa de corrosão econômica
carbônico, porém o H2S é três vezes mais solúvel do que o CO2. Como resultado, o
efeito destes dois gases em baixos valores de pH, e, potencialmente, em taxas de corrosão crescentes, são fundamentalmente os mesmos (KERMANI e MORSHED, 2003).
KERMANI e MORSHED (2003) mostraram os resultados contraditórios dos estudos de Videm e Mishra, em relação ao H2S. Enquanto o primeiro diz que
quantidades muito pequenas de H2S em águas que contenham CO2 aumentam a
taxa de corrosão, o outro argumenta que pequenas quantidades de H2S inibem o
efeito da corrosão de CO2 em aços. Este fato é atribuído à formação de um filme de
sulfeto de ferro que aparentemente é mais protetor que o FeCO3.
ALTOÉ (1998) diz que em níveis de H2S muito baixo (pressão parcial menor
que 0,01 psia), o CO2 é a espécie corrosiva predominante e, em temperaturas acima
de 60 °C, a corrosão e qualquer passivação que ocorram são função da formação dos produtos da corrosão do CO2 (ex. FeCO3). A presença de H2S, portanto, não
tem significância nesta condição. Já em sistemas dominados pelo CO2 a presença
de pequenas quantidades de H2S pode levar à formação de um depósito de sulfeto
de ferro chamado mackinawita, em temperaturas abaixo de 120 °C. Isto ocorrerá quando a razão entre a pressão parcial do CO2 e a pressão parcial do H2S
(pCO2/pH2S) for maior que 200. Esta é a opinião de muitos pesquisadores, embora
este valor não seja uma verdade absoluta. Este depósito de mackinawita é um depósito fino, que reduz a taxa de corrosão e sua estabilidade é ainda desconhecida.
A maioria das literaturas indica que a taxa de corrosão por CO2 é reduzida
na presença de H2S em temperatura ambiente. Porém, o H2S pode formar uma
camada não protetora e catalisar a dissolução anódica do aço sem proteção. Os aços podem sofrer algum tipo de corrosão localizada na presença de H2S
(KERMANI e MORSHED, 2003).
MISHRA (1997) relata que a adição de uma pequena quantidade de H2S
(1,65 Pa) em uma solução de H2CO3 sob a pressão de 1 atm (0,1 MPa) pode reduzir
a taxa de corrosão uniforme de 0,33 para 0,082 mm/ano. Este comportamento é causado pela formação do sulfeto de ferro (FeS ou FeS2, dependendo da pressão
2.1.1.5 Velocidade de fluxo
A velocidade é provavelmente um dos parâmetros mais significativos na determinação da corrosividade. A velocidade do fluido afeta tanto a composição quanto à extensão dos filmes dos produtos de corrosão. Apesar de existirem algumas diretrizes em relação à velocidade, não existem valores definidos que sejam realidades absolutas. A criticidade em relação à velocidade irá variar de acordo com o duto (ALTOÉ, 1998).
ALTOÉ (1998) cita algumas diretrizes quanto à influência da velocidade na corrosão e na proteção com inibidores:
x A taxa de corrosão aumenta levemente na faixa de 3 a 10 m/s em sistemas multifásicos protegidos com inibidores de corrosão;
x A taxa de corrosão aumenta fortemente para velocidades > 10 m/s, em sistemas multifásicos, mesmo na presença de inibidores de corrosão. O controle da corrosão para velocidades > 10 m/s com inibidores, em geral não é recomendado;
x Normalmente, para velocidades maiores que 4 m/s em sistemas não inibidos, a taxa de corrosão aumenta significativamente devido à remoção mecânica dos filmes de produto de corrosão;
x A proteção com o uso de inibidores é preferencialmente recomendada quando a velocidade do fluxo é maior que 3 m/s e menor que 10 m/s, ou quando a quantidade de água é grande.
MISHRA et al. (1997) diz que a taxa de corrosão é controlada parcialmente
por difusão em velocidades < 0,32 m/s, onde o processo difusivo é a etapa determinante. DENPO e OGAWA (apud MISHRA et al, 1997) verificaram que, para
eletrodo de disco rotatório, a taxa de corrosão em meio com CO2 é controlada
parcialmente pela difusão para velocidades de até 1,0 m/s.
NESIC e LUNDE (1994) verificaram que o fluxo pode causar erosão nos filmes de carbeto de ferro onde a formação de filmes protetores é dificultada.
Altas taxas de fluxo normalmente aumentam as taxas de corrosão pelo aumento das taxas de transporte das espécies reagentes da superfície metálica e pela prevenção ou destruição das camadas protetoras. Sob algumas condições, altas taxas de fluxo podem diminuir as taxas de corrosão pela remoção dos filmes de Fe3C. Quando o aço corrói, geralmente são formados filmes com Fe3C, o qual não é
metal. O carbeto de ferro pode ser visto como o esqueleto do metal que permanece após a remoção do metal pelo processo corrosivo. Estes filmes são muito porosos e não fornecem proteção ao substrato metálico. Em experimentos realizados a 20 ºC, filmes com estas características são constituídos predominantemente por Fe3C
(NESIC e LUNDE, 1994).
O efeito do fluxo mais relevante ocorre a baixas temperaturas (20 ºC), onde existe uma dificuldade na formação de FeCO3 e a possibilidade de se chegar a uma
supersaturação de Fe2+. Após as exposições, a superfície metálica fica coberta de
carbeto de ferro, o qual demonstra ser muito susceptível à erosão pelo fluxo. Isto é um efeito mecânico que afeta o processo eletroquímico, sem estar relacionado à transferência de massa (NESIC e LUNDE, 1994).
2.1.1.6 Solução de teste
A água produzida tipicamente contém íons, como o cloreto, em solução. A concentração de cloreto na água pode variar consideravelmente, de zero até milhares de ppm na água de formação. Normalmente, este valor varia de 10.000 ppm a 130.000 ppm. Dependendo da temperatura, este teor de cloreto pode se tornar preocupante, principalmente para valores de temperatura maiores que 60 °C. Os íons cloretos podem ser incorporados ao produto de corrosão, podendo leva-lo à desestabilização e conseqüentemente ao aumento da corrosão. Dependendo da temperatura este efeito é acelerado (ALTOÉ, 1998).
Já o bicarbonato tem uma ação oposta à do cloreto. Dependendo do seu valor, este pode agir sobre o pH, elevando o seu valor e conseqüentemente reduzindo a taxa de corrosão (ALTOÉ, 1998).
Em solução de H2CO3 livre de O2, o cloreto pode levar à redução da
corrosão uniforme pela reação com o CO2 ou pela inibição na superfície. O aumento
da concentração de cloretos ou outros sais diminuem a solubilidade do CO2 em uma
constante pressão parcial deste gás, diminuindo a taxa inicial de corrosão. Não é possível observar o efeito a baixas concentrações de cloretos (< 1.000 ppm), entretanto, os testes de laboratório têm resultado em taxas maiores do que as encontradas no campo, uma vez que utilizam soluções de sais puros, como o NaCl, sem alguns componentes encontrados em campo, como Ca2+, HCO3-, Mg2+, etc. A
concentrações encontradas nas situações reais. Este comportamento ocorre pela construção de filmes protetores, principalmente de FeCO3 enriquecidos com cálcio
(MISHRA et al., 1997).
A adição de petróleo e derivados pode ter efeitos significativos na corrosão do aço. O petróleo não é corrosivo, promovendo uma barreira entre a superfície metálica e a água e protegendo o metal enquanto estiver na sua superfície (MISHRA et al., 1997).
Porém, tem sido determinado que os óleos crus modificam a morfologia, a composição e a compactação dos produtos de corrosão para diferentes razões óleo/água. O hidrocarboneto desestabiliza a formação do filme de FeCO3 passivo,
acelerando a corrosão localizada (KERMANI e MORSHED, 2003).
Partículas sólidas, como areia, levam à corrosão do aço através de dois mecanismos: erosão dos filmes de corrosão protetores, e despolarização do processo de corrosão controlado anodicamente e/ou catodicamente pela danificação da superfície metálica (MISHRA et al., 1997).
A supersaturação é essencial na formação e na estabilidade da camada de corrosão protetora. Em meio sem enxofre, um sal insolúvel pode ser importante na redução da taxa de corrosão. A supersaturação dos íons leva à precipitação de uma camada/filme de corrosão que reduz a taxa de corrosão através de alguns efeitos (KERMANI e MORSHED, 2003):
x Provisão de uma barreira de difusão (comprimento de difusão estendido entre o substrato metálico e o meio corrosivo);
x Formação de uma camada protetora de baixa porosidade (diminuindo as superfícies expostas comparadas com a superfície do aço e, portanto, menos áreas para serem corroídas);
x Criação de gradientes de concentração das principais espécies químicas (Fe2+; HCO3-).
A taxa de precipitação e as características protetoras da camada dependem fortemente da supersaturação no seio da solução. Assim, variações no nível de supersaturação podem afetar a severidade da corrosão. Para sistemas de carbonato de ferro, isto pode ser representado como uma reação similar a
3 2 3 3)
(HCO FeCO H CO
Fe l . Enquanto que a solubilidade do carbonato de ferro
supersaturação é alcançado com o aumento da temperatura, para baixas concentrações de Fe2+, facilitando a formação de FeCO
3 (KERMANI e MORSHED,
2003).
Quando o limite de solubilidade do FeCO3 é alcançado ou excedido, ele se
precipita na superfície do metal, formando um filme protetor. Como a precipitação não ocorre instantaneamente quando a saturação termodinâmica é alcançada, é possível se trabalhar com sistemas supersaturados. O grau de supersaturação é função da razão metal/água, da temperatura e do pH (NESIC e LUNDE, 1994).
VIDEM e DUGSTAD (apud KERMANI e MORSHED, 2003) concluíram que uma mudança de 30 ppm de Fe2+ pode afetar a taxa de corrosão da mesma forma
que uma mudança na concentração de CO2 em 1.000 ppm (2 bar) a 90 ºC.
2.1.1.7 Tratamento térmico do aço
A microestrutura do aço e do aço baixa liga são conhecidas por sofrer influência na sua resistência à corrosão em ambiente ácido, e em particular em ambiente com CO2. Além disso, é conhecido que o aço e o aço doce são mais
resistentes quando temperados ou duplamente temperados para formar a microestrutura martensítica, atingindo dureza da ordem de 22 HRC (Rockwell Hardness). A espessura da camada primária de FeCO3 é mais uniforme com
grandes cristais na amostra normalizada que a formada no material temperado. Este comportamento resulta da fase perlítica no aço normalizado, que é bem distribuída na matriz metálica e ajuda a ancorar os cristais de FeCO3 da superfície quando a
ferrita é corroída, deixando a perlita na forma de plaquetas (MISHRA et al., 1997).
2.1.2 Mecanismo
Apesar da corrosividade pelo CO2 ser tema de muitos estudos nos últimos
30 anos, o completo conhecimento do seu mecanismo e previsão da sua corrosividade não são completamente dominados. Existem várias proposições diferentes sobre reações eletroquímicas em relação à corrosão pelo CO2. Em alguns
LOTZ (apud ALTOÉ, 1998) dizem que, de forma generalizada, as reações que acarretam a corrosão pelo CO2 podem ser representadas pelas seguintes equações:
dissolvido gas H O CO
CO2 2 o 2 (2.1)
3 2 2
2 H O H CO
CO dissolvido o (ácido carbônico) (2.2)
) (
3 3
2CO H HCO bicarbonato
H o (2.3)
) (
2 3 2
3 H CO carbonato
HCO o (2.4)
Entretanto, na temperatura ambiente, somente cerca de uma em cem mil moléculas é dissociada na Equação 2.3 (ALTOÉ, 1998).
Embora seja um ácido fraco, o acido carbônico é altamente corrosivo porque a parte catódica da reação de corrosão não necessita do H+, como acontece normalmente na corrosão ácida, pois envolve a redução direta do ácido carbônico na forma não dissociada:
o
3
3
2CO e H HCO
H (2.5)
Seguido por:
2
2H oH (2.6)
A reação anódica, que é a dissolução do ferro, é a seguinte:
oFe e
Fe 2 2 (2.7)
A reação global é a seguinte:
2 3 3
2CO FeCO H H
A solubilidade do FeCO3 (carbonato de ferro) é baixa e diminui com a
temperatura (ALTOÉ, 1998).
O FeCO3 pode formar um filme protetor em algumas condições, porém a
quantificação dessa proteção é um dos assuntos mais difíceis no estudo da corrosão pelo CO2. Alguns pesquisadores encontraram, para certas condições de temperatura
e velocidade, a presença de óxido de ferro (Fe3O4) como produto de corrosão pelo
CO2 junto com o carbonato de ferro e cementita, porém, como a quantidade de
FeCO3 e de cementita é pequena, fica difícil uma avaliação mais consistente
(ALTOÉ, 1998).
Na realidade existem diferentes modelos propostos na literatura. Apesar de WAARD (apud ALTOÉ, 1998) afirmar que a reação é controlada por transferência de carga, a difusão do H2CO3 do meio para a superfície do duto e o seu consumo
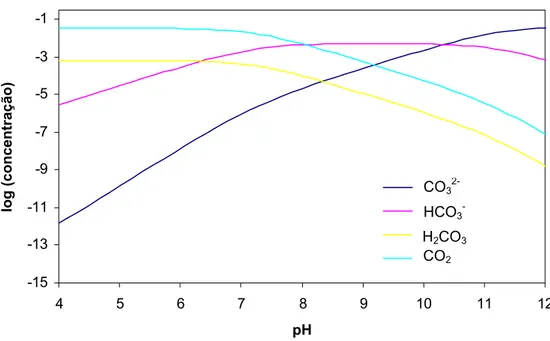
também devem ser considerados. O gráfico a seguir, Figura 2.6, mostra como as espécies presentes variam em função do pH em uma temperatura fixa de 25 °C.
-15 -13 -11 -9 -7 -5 -3 -1
4 5 6 7 8 9 10 11 12
pH
log (concentração)
CO3-2 HCO3-H2CO3 CO2
Figura 2.6 - Distribuição das espécies em função do pH para o caso pCO2 = 2 bar (adaptado ALTOÉ, 1998)
DAWSON (apud ALTOÉ, 1998) diz que para pH menor que 4,0 a redução do hidrogênio é ainda a equação catódica dominante junto com a concentração dos íons H+, onde:
CO3
2-HCO3
-CO2
2
2
2H e oH (2.9)
Já para pH intermediário, isto é, entre 4,0 e 6,0, além da reação de redução do hidrogênio, uma nova reação catódica torna-se importante: a redução direta do ácido carbônico.
o
3
3
2CO e H HCO
H (2.10)
2.1.3 A taxa de corrosão pelo CO2
Apesar de existirem vários trabalhos diferentes, a maioria dos pesquisadores usa sempre como referência o trabalho de WAARD e MILLIANS (1975 apud ALTOÉ, 1998) para estimar a corrosão pelo CO2. Com base neste
trabalho, outros estudos foram desenvolvidos para aprimorar a previsão da corrosão pelo CO2, visto que o resultado calculado na maioria das vezes é superior ao
verificado na prática, sendo assumidos os seus resultados como o pior caso.
A reação de corrosão do aço pelo ácido carbônico é controlada, em parte, pela transferência de carga. Esse processo é representado pelo diagrama a seguir, onde é assumido como premissa que a reação da corrosão pelo CO2 não é
completamente controlada catodicamente e que a reação anódica depende do pH e da pCO2, o que reduz a dependência em relação à pressão parcial de CO2 (ALTOÉ,
1998).
Figura 2.7 - Monograma da corrosão pelo CO2 (ALTOÉ, 1998; PREDICT, 2002)
Os resultados obtidos pelo diagrama devem ser corrigidos, pois outros fatores contribuem para atenuar a corrosão. WAARD e LOTZ (apud ALTOÉ, 1998) propuseram modificações, com a determinação de fatores que consideram vários outros efeitos no valor obtido do diagrama. Entre esses fatores está o da velocidade, segundo o qual a taxa de corrosão não seria apenas influenciada pela transferência de carga, ou seja, as reações de cinética (eletroquímicas), mas também pela taxa de transporte de massa das espécies que estão reagindo.
2.1.4 Produtos de corrosão pelo CO2
A corrosão por CO2 em aços carbono e de baixa liga é fortemente
taxa de corrosão e a sua natureza (corrosão generalizada ou localizada). A cinética de precipitação do filme de FeCO3 é afetada pelas concentrações do ferro e de
carbonato e sua subseqüente formação e crescimento são extremamente sensíveis à temperatura. Não é a espessura do filme e sim a estrutura e a sua morfologia que conferem baixa corrosão e proteção. É interessante notar que uma camada de corrosão contendo os mesmos componentes sólidos pode ser extremamente protetora, pouco protetora, ou até mesmo corrosiva (KERMANI e MORSHED, 2003).
Em geral, as características de proteção do filme de corrosão dependem tanto das características do aço (microestrutura, tratamento térmico, elementos de liga) quanto das condições do meio (pH da solução, temperatura, composição da solução, fluxo, etc.) (KERMANI e MORSHED, 2003).
KERMANI e MORSHED (2003) mostraram, baseados em extensivas observações feitas por muitos pesquisadores, que os filmes de corrosão formados entre 5 ºC e 150 ºC em água com CO2 podem ser divididos genericamente em
quatro classes principais:
x Transparentes;
x De carbeto de ferro (Fe3C);
x De carbonato de ferro (FeCO3);
x De carbonato de ferro com carbeto de ferro (FeCO3 + Fe3C).
2.1.4.1 Filmes transparentes
Estes filmes possuem menos que 1 µm de espessura e são somente observados à temperatura ambiente, porém a sua formação é mais rápida em temperaturas inferiores. Esta classe de filme não é termodinamicamente o produto sólido mais estável e pode ser formada em águas com CO2 com uma concentração
entre ferro e oxigênio em toda a espessura do filme. A questão atual é saber se esta razão corresponde ao Fe2+ ou Fe3+ (KERMANI e MORSHED, 2003).
Os filmes transparentes têm sido ignorados por muitos pesquisadores e um estudo sistemático é necessário para confirmar ou invalidar sua formação e seu efeito na formação de FeCO3(KERMANI e MORSHED, 2003).
2.1.4.2 Carbeto de ferro – Cementita (Fe3C)
A dissolução anódica do aço leva à formação de íons de ferro dissolvidos. Este processo deixa para trás um filme de Fe3C não corroído (cementita) que se
acumula na superfície. Este filme pode ser frágil, poroso e susceptível às condições de fluxo, ou pode ser uma rede resistente. Fluxos elevados em meios aquosos com CO2 não tamponados levam à formação de um filme de corrosão constituído
principalmente por Fe3C, mais constituintes de alguns elementos de liga
provenientes do substrato. A redução do fluxo pode aumentar a quantidade de Fe3C,
mas isto também leva à presença de FeCO3 no filme (KERMANI e MORSHED,
2003).
O filme de Fe3C afeta o processo de corrosão e aumenta a taxa de corrosão
de 3 a 10 vezes pela quantidade de vazios existentes na camada. Sua atuação ocorre da seguinte forma (KERMANI e MORSHED, 2003):
x Par galvânico: o Fe3C tem um sobrepotencial menor para as reações
catódicas do que o ferro, o contato galvânico entre os dois pode acelerar a dissolução do ferro pela aceleração da reação catódica na presença de muito menos que 1 ppm de Fe2+ na água;
x Acidificação local: as reações catódicas podem acontecer preferencialmente nos pontos de Fe3C, separando fisicamente as reações de
corrosão anódica e catódica. Isto leva a mudança na composição da fase aquosa nas regiões catódicas tornando-as mais alcalinas e as regiões anódicas mais ácidas podendo causar acidificação interna localizada e promover corrosão na superfície do metal;
x Enriquecimento de Fe2+: os íons de ferro dissolvidos levam a um grande
enriquecimento de Fe2+ na superfície do meta aumentando a supersaturação local
x Ancoramento do filme: em certas condições o filme de corrosão consiste na combinação de Fe3C e FeCO3. Nestes filmes, o Fe3C age como uma estrutura,
ancorando o FeCO3 precipitado na superfície do filme. Com isto há uma melhora na
resistência mecânica em altas taxas de fluxo. Nestas situações, a corrosão localizada é diminuída.
Apesar da alta concentração de íons de ferro, a acidificação local na superfície deve levar a condições não favoráveis para a precipitação de FeCO3.
Forma-se então uma camada de corrosão com contato e ligação fracos na superfície metálica ou com regiões não preenchidas entre a superfície metálica e o filme de corrosão. Fornece pequena proteção, portanto as taxas de corrosão podem ser altas. Uma taxa de corrosão local tende a aumentar a diferença de pH entre as regiões anódicas e catódicas adjacentes, o que favorece o desenvolvimento de filmes não protetores (KERMANI e MORSHED, 2003).
Em geral, um acúmulo de Fe3C previne a difusão dos íons de ferro da
superfície, promovendo a formação do filme de FeCO3, o qual oferece maior grau de
proteção. Invariavelmente, a microestrutura governa a distribuição do carbeto, afetando a estabilidade do filme (KERMANI e MORSHED, 2003).
2.1.4.3 Carbonato de ferro – Siderita (FeCO3)
O FeCO3, ou siderita, é o mais importante filme que pode crescer no aço em
meios sem H2S. A formação do filme é fortemente dependente da termodinâmica e
da cinética de precipitação do FeCO3. A supersaturação é o principal fator para o
crescimento do filme de FeCO3 e para a determinação de sua morfologia. Uma
supersaturação de FeCO3 é necessária para formar um filme protetor,
particularmente em baixas temperaturas. A princípio, o processo de precipitação possui duas etapas: a nucleação e o crescimento. A morfologia do filme dependerá da etapa que for determinante. Uma vez formado o filme, ele irá permanecer protetor mesmo em supersaturações menores. A formação do filme protetor é acelerada por medidas que restringem o transporte dos produtos de reação da superfície (KERMANI e MORSHED, 2003).
A aderência e a espessura da camada de FeCO3 dependem da
densamente e mais espessos do que os filmes formados em aços temperados (KERMANI e MORSHED, 2003).
O FeCO3 reduz a taxa de corrosão pela redução e selamento da porosidade
do filme. Isto restringe os fluxos de difusão das espécies envolvidas nas reações eletroquímicas. O aumento da temperatura pode melhorar a proteção da camada de FeCO3, assim como a sua adesão e dureza – quanto maior a temperatura, maior é a
proteção. A máxima taxa de corrosão observada para o aço em ambientes sem enxofre foi entre 60°C e 70 ºC e a partir daí ela começa a diminuir devido ao crescimento de filmes de FeCO3 protetores. A menor temperatura necessária para
se obter os filmes de FeCO3, reduzindo a taxa de corrosão significativamente é 50
ºC, e a proteção é aumentada proporcionalmente com o pH (KERMANI e MORSHED, 2003).
Tem sido argumentado que os filmes protetores formados em altas temperaturas e pressões fornecem melhor proteção do que os formados em condições contrárias. O nível de proteção aumenta com o tempo de exposição, o qual depende do processo (KERMANI e MORSHED, 2003).
2.1.4.4 Carbonato de ferro (FeCO3) + carbeto de ferro (Fe3C)
Este tipo de filme é o mais comumente encontrado em superfícies de aços e de baixa liga em meios com CO2. Durante a corrosão por CO2 de aço, a fase Fe3C é
catódica (resistente à corrosão), podendo ser entrelaçada com o filme de FeCO3. A
estrutura do filme, portanto, depende de onde e quando a precipitação de FeCO3
ocorre. De um lado, se isto ocorre diretamente e o carbonato integra-se com a fase carbeto, então é formado um filme estável e protetor que suporta altos fluxos. Do outro lado, a formação inicial de uma camada de cementita na superfície seguida de um selamento parcial do FeCO3, perto do limite externo da cementita, pode acarretar
um filme não protetor. Contrastando, se a fase cementita efetivamente selar a camada de siderita formada em contato com a superfície metálica, um selamento incompleto ou uma redissolução parcial de FeCO3 não é prejudicial e o filme de
corrosão permanece protetor (KERMANI e MORSHED, 2003).
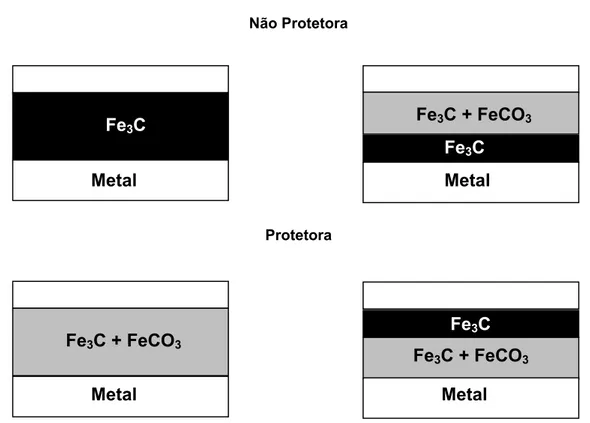
CROLET et al. (1996, apud KERMANI e MORSHED, 2003) categorizou as
dissolução/precipitação e do deslocamento do pH e é suportado pelas observações das morfologias reais de camadas de corrosão protetoras e não protetoras.
Não Protetora
Protetora
Figura 2.8 - Diferentes morfologias observadas para camadas de corrosão protetoras e não protetoras (adaptado KERMANI e MORSHED, 2003)
A estrutura do filme misto é um importante fator para a formação e quebra dos filmes protetores de carbonato. Ela é influenciada pela quantidade de carbono e o tamanho e distribuição dos carbetos, que é dependente da microestrutura do aço. Os aços ferríticos/perlíticos têm uma estrutura de carbetos, a qual fornece um bom suporte para a construção de filmes protetores de carbonatos (KERMANI e MORSHED, 2003).
Experimentos com aço padrão, após diferentes tratamentos térmicos, mostraram que tanto a taxa de corrosão quanto à habilidade de formação de filmes protetores decrescem com o aumento da temperatura aplicada, indicando que a estrutura do carbeto do aço é importante na formação de filmes protetores (KERMANI e MORSHED, 2003).
ALTOÉ (1998) já cita os trabalhos de IKEDA, VERAS e CROLET, que discutem a presença de um outro produto de corrosão pelo CO2, o Fe3O4
(magnetita). Segundo Veras, o produto de corrosão observado em baixa velocidade foi principalmente o FeCO , enquanto em alta velocidade um filme fino bem aderente
Fe3C
Metal Metal
Metal Metal Fe3C
Fe3C Fe3C + FeCO3
Fe3C + FeCO3
e com uma relativa alta concentração de Fe3C e Fe3O4 foi encontrado. Estes fatos
sugerem que a velocidade afeta a cinética de dissolução do ferro (corrosão) e a nucleação do FeCO3, produzindo um filme mais protetor e mais resistente à erosão,
provavelmente devido ao favorecimento da ancoragem de partículas de Fe3C
(cementita) não corroídas. Já na visão de CROLET, os produtos de corrosão são constituídos principalmente pelo FeCO3 insolúvel e constituintes não dissolvíveis,
como Fe3C, mais alguns outros elementos como óxidos, que são tão pequenos que
não podem ser positivamente identificados. Para CROLET, o FeCO3 e o Fe3C não
são nem compactos e nem impermeáveis, o que faz concluir que a proteção pode estar associada a mecanismos de transporte através do depósito. Portanto, o fenômeno de corrosão envolve não somente as duas reações eletroquímicas, mas também dois outros processos, o transporte dos reagentes para o catodo e também a remoção dos produtos do anodo (fenômenos de difusão). Logo, a formação do depósito de corrosão sobre uma superfície nua do aço é o resultado dos seguintes fatores (ALTOÉ, 1998):
x A espessura da camada de difusão, que é governada pela hidrodinâmica; x O fluxo de difusão das espécies, que é governado pela taxa de corrosão
inicial;
x O potencial de corrosividade; x A solubilidade dos íons ferrosos.
Portanto, no início não há formação de depósitos, só a dissolução do ferro gerando os íons ferrosos. Como o depósito não se forma imediatamente, a corrosão do ferro (ferrita) leva à exposição da cementita (que não é dissolvível), que provavelmente limita este processo de difusão devido à força mecânica da cementita na rede (estrutura do aço).
Na realidade, normalmente já existem na sua superfície do duto, depósitos (ferrugem, corrosão, etc.) que podem alterar significativamente esta situação, alterando a taxa de corrosão em até duas ordens de grandeza.
2.2 Inibidores de corrosão
da corrosão deve ser baseada em avaliações particulares do sistema a inibir, para os quais devem ser considerados os parâmetros de operação, as características do sistema corrosivo, a compatibilidade do inibidor e a possibilidade de aplicação do mesmo (VILORIA e VERA, 1994).
VILORIA e VERA (1994) definem inibidor de corrosão como uma substância que retarda ou diminui uma reação química e que ao ser adicionado em pequenas quantidades em um determinado ambiente reduz a ação nociva que o meio exerce sobre o metal.
Segundo VILORIA e VERA (1994), a ciência da inibição esta baseada no conhecimento do sistema:
Metal/Eletrólito/Inibidor
Neste sentido é necessário analisar cada um dos elementos envolvidos no processo de inibição.
2.2.1 Reações químicas do processo de corrosão e natureza do meio corrosivo
Durante as reações espontâneas da corrosão do ferro em soluções ácidas na ausência de agentes despolarizantes, a dissolução anódica do ferro pode ser expressa como mostrado na Equação 2.11.
oFe e
Fe 2 2 (2.11)
Que é acompanhada simultaneamente pela redução do H2 segundo a
Equação 2.12.
2
2 2
2H e o H oH (2.12)
A taxa de corrosão do processo está controlada pela reação particular do eletrodo que corresponde à etapa mais lenta da reação.
Em soluções ácidas inibidas, a taxa de corrosão pode ser controlada através das reações anódicas ou catódicas, dependendo da natureza do inibidor e a composição da solução corrosiva. Independentemente do controle anódico ou catódico, a velocidade limite é um processo de transferência de carga, a qual consiste fundamentalmente na descarga do próton na interface metal/solução, sendo esta etapa o passo limitante da reação da corrosão (VILORIA e VERA, 1994).
A reação catódica depende do pH, da natureza e concentração dos ânions ácidos. Para pH entre 4,0 e 12,0 a corrosão evolui sob controle catódico, mas a reação predominante é a difusão do oxigênio e sua subseqüente redução na interface metal/solução. A corrosão dos metais em soluções próximas a neutralidade conduz à formação de produtos de baixa solubilidade, tais como óxidos, hidróxidos ou sais. O processo catódico é a redução do oxigênio. Nesta situação a ação do inibidor é exercida sobre a superfície de óxido que recobre o metal mantendo ou incrementando as características protetoras da camada ou película (VILORIA e VERA, 1994).
2.2.2 Cinética das reações de corrosão e sua inibição. Dupla camada elétrica
O processo de corrosão do metal e a adsorção de espécies químicas (inibidores, ânions, etc) sobre a superfície deste, estão intimamente ligados com o comportamento da dupla camada elétrica (VILORIA e VERA, 1994).
Figura 2.9 - Representação esquemática da dupla camada de Helmholtz (adaptado VILORIA e VERA, 1994)
Na Figura 2.9 se encontra o modelo da dupla camada, onde os círculos fechados representam o excesso de íons presumivelmente solvatados, os círculos pontilhados representam uma deficiência de um determinado íon, círculos pequenos representam defeito ou excesso de íons não solvatados e os sinais negativos ou positivos no metal representam excesso ou defeitos de elétrons no metal. Também demonstra o potencial da dupla camada para duas situações dadas (VILORIA e VERA, 1994):
A primeira delas relacionada com o potencial da corrosão igual ao potencial da carga nula. Nesta situação o potencial do metal é nulo em ausência de compostos que ativem a superfície. O segundo ilustra o metal polarizado negativamente.
adsorção de moléculas orgânicas na interface solução/metal ocorre através da equação 2.13.
sol ads
ads
sol nH O Org H O
Org 2 o 2 (2.13)
onde n depende da relação entre os volumes das moléculas, das substâncias orgânicas e das moléculas de água.
As n moléculas de água são removidas da superfície do metal por cada molécula de inibidor adsorvida, adota-se n como independente do grau de cobertura ou carga do eletrodo. Se a interação entre a superfície do metal e o inibidor é mais forte que a interação metal/água, então ocorrerá a adsorção do inibidor (VILORIA e VERA, 1994).
2.2.3 Classificação dos inibidores de corrosão
A inibição constitui uma medida preventiva contra o ataque por corrosão de materiais metálicos, consiste no uso de substâncias que são introduzidas em pequenas concentrações em um meio agressivo e são capazes de diminuir a corrosão do metal exposto ao ambiente (VILORIA e VERA, 1994).
Existem vários métodos para a classificação dos inibidores. Esses métodos baseiam-se nas suas características estruturais ou na sua forma de ação.
TRABANELLI (apud VILORIA e VERA, 1994) classifica os inibidores de acordo com sua natureza química, modo de ação e aplicação.
2.2.3.1 Classificação quanto à natureza química
2.2.3.1.1 Natureza química: Baseada na presença de elementos inorgânicos ou de cadeias de hidrocarbonetos
x Inorgânicos: cromatos, nitritos, fosfatos, silicatos, boratos;