PROGRAMA DE PÓS-GRADUAÇÃO EM BIOQUÍMICA
JANICE DA SILVA CORTEZ
Utilização da Berberina na Identificação dos Mastócitos do Molusco
Anomalocardia brasiliana
JANICE DA SILVA CORTEZ
Utilização da Berberina na Identificação dos Mastócitos do Molusco
Anomalocardia brasiliana
Dissertação de mestrado apresentada ao Departamento de Bioquímica do Centro de Biociências da Universidade Federal do Rio Grande do Norte como requisito parcial para a obtenção do título de mestre em Bioquímica Orientador: Prof. Dr. Elizeu Antunes dos Santos
Cortez, Janice da Silva.
Utilização da Berberina na identificação dos mastócitos do Molusco Anomalocardia brasiliana / Janice da Silva Cortez. - Natal, RN, 2005.
59 f.
Orientador : Elizeu Antunes dos Santos.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte.Centro de Biociências. Departamento de Bioquímica.
1. Molusco (Anomalocardia brasiliana) – Tese. 2. Anomalocardia brasiliana – Mastócitos – Tese. 3. Berberina – Tese. 4. Heparina – Tese. I. Santos, Elizeu Antunes dos. II. Título.
Dedico,
Aos
Meus Pais
, responsáveis por tudo o que sou até hoje, através
do seu amor, incentivo e confiança durante todos os momentos de
AGRADECIMENTOS
x A Deus, Senhor absoluto da minha vida e fonte de estímulo e forças em todos os momentos;
x A Ronaldo que com seu amor, carinho e compreensão esteve sempre ao meu lado me apoiando;
x Aos meus irmãos que em muitos momentos tiveram que suportar minhas descargas de estresse;
x Ao Departamento de Bioquímica, onde realizei meu mestrado, contribuindo para o meu crescimento profissional e pessoal;
x Aos Professores da banca de pré-qualificação, Fernanda wanderley e Hugo Rocha, que tanto contribuiram para a melhoria da elaboração desta
dissertação com suas idéias e conhecimentos;
x Aos professores da banca de qualificação dessa dissertação Fernanda Wanderley e João Felipe.
x À professora Selma Jerônimo, coordenadora do Mestrado em Bioquímica pelo apoio para a finalização desse trabalho.
x Às professoras Fernanda Wanderley e Suely Chavante pelo bom convívio laboratorial e pela amizade construída;
x Aos demais professores do Departamento de Bioquímica: André Negreiros, Dilma, Jacira Maria, José Fernandes, Luciana Duarte, Luiz Abreu, Roberto
Dimenstein;
hoje posso considerá-lo um amigo;
x A todos os maravilhosos colegas do mestrado, da minha turma, Anny, Celton, Carlos, Flávio, Glória, Luana, Magda, Raniere, Renata, pelos momentos que
trocamos conhecimentos e idéias;
x Aos queridos companheiros de bancada: Vanessa, Fernanda Haydine, Cíntia Andrade, Karla Cristiane, Adriana, Louise, Anna Catarina, Beth, que em
tantos momentos compartilhamos a tristeza, mas nunca faltou a esperança e
a certeza de que dias melhores viriam;
x À amiga Giulianna Viana, que com sua paciência e dedicação tanto me ajudou no meu desenvolvimento laboratorial;
x A Dácio Michel pela amizade e pelas suas dicas durante o desenvolvimento deste trabalho;
x A Rodolfo Daniel que foi o meu braço direito e contribuiu de forma ímpar para a finalização deste trabalho;
x A minha amiga Luciana Silva pelas horas de diálogo e brincadeiras vividas; x A Leonardo pela ajuda prestada nas fotos da fluorescência
x Aos funcionários do Departamento de Bioquímica da UFRN, em especial a Eliene que sempre dava um “jeitinho”, além disso tornou-se uma amiga.
x À Professora Magnólia Florêncio do Departamento de Microbiologia e Imunologia da UFRN, pelo grande e fundamental auxílio prestado na
x Ao professor Luís Reginaldo Menezes da Rocha e ao Departamento de Patologia da UFRN, pela imensa ajuda na confecção das lâminas
histológicas.
x À Professora Teresinha Guimarães, minha “mãe científica” que tanto me incentivou a dar o primeiro passo e me acompanhou em todos os momentos;
x À Financiadora de Estudos e Projetos (FINEP), ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e à Coordenação de
Aperfeiçoamento de Pessoal do Nível Superior (CAPES) pelas bolsas e
demais recursos financeiros concedidos, para a elaboração dessa
dissertação.
FIGURA 1 - MICROFOTOGRAFIA ELETRÔNICA DE TRANSMISSÃO DE
MASTÓCITO DE TECIDO CONJUNTIVO DE RATO ...13
FIGURA 2 - ESTRUTURA DA BERBERINA...20
FIGURA 3 - ESTRUTURA QUÍMICA ELEMENTAR DA MOLÉCULA DE
HEPARINA...22
FIGURA 4 - REPRESENTAÇÃO ESQUEMÁTICA DO PROTEOGLICANO DE HEPARINA...22
FIGURA 5 - FOTO DO MOLUSCO Anomalocardia brasiliana...27
FIGURA 6 - REPRESENTAÇÃO ESQUEMÁTICA DOS TECIDOS DE
Anomalocardia brasiliana...27
FIGURA 7 - FLUXOGRAMA DE EXTRAÇÃO DE GLICOSAMINOGLICANO DE ÓRGÃOS DO MARISCO Anomalocardia brasiliana...33
FIGURA 8 - ELETROFORESE EM GEL DE AGAROSE NO TAMPÃO PDA ...36
FIGURA 9 - ELETROFORESE EM GEL DE AGAROSE NO SISTEMA BA/PDA 37
FIGURA 10 - MICROGRAFIAS DO MANTO DE Anomalocardia brasiliana...41
FIGURA 11 - MICROGRAFIAS DO CTENÍDEO DE Anomalocardia brasiliana...42
FIGURA 12 - MICROGRAFIAS DE MANTOS DE A. brasiliana TRATADOS COM DESGRANULANTES ...45
LISTA DE ABREVIATURAS
AA-PAS: Azul de Alcian – Ácido Periódico de Schiff. AM: Azul de Metileno.
CS: Condroitim Sulfato. Da: Daltons.
DS: Dermatam Sulfato.
EDA: Etilenodiamino Acetato.
EDTA: Ácido Etilenodiamino Tetra-acético. Fc: Fração cristalizável de imunoglobulina.
FcHRI: Receptor de alta afinidade para fração cristalizável de imunoglobulina E ou
H
.
GAG: Glicosaminoglicanos. Gli: Glicina.
HE: Hematoxilina-Eosina. Hep: Heparina.
HS: Heparam Sulfato.
P.A.S: Ácido Periódico de Schiff. PDA: 1,3 Diaminopropano Acetato. PM: Peso Molecular.
p/p: relação peso-peso. RPM: Rotações Por Minuto.
SCF: Fator estimulador de colônias Steam Cell. Ser: Serina.
TCA: Ácido tricloroacético.
A berberina é um alcalóide usado como fluorcromo na identificação de
heparina e DNA. Enerbäck, em 1974, descreveu a técnica até hoje empregada deste
fluorcromo no estudo dos grânulos ricos em heparina dos mastócitos de vertebrados.
Santos et al., em trabalhos anteriores, utilizando abordagens bioquímica e
histológica, descreveram a presença de mastócitos no marisco Anomalocardia
brasiliana. Baseado nestes estudos, testamos a técnica de fluorescência com
berberina para a caracterização adicional dessas células. Destarte, mantos e
ctenídeos dos espécimes foram submetidos a técnicas rotineiras de fixação e
inclusão em parafina. Os cortes histológicos foram desparafinados, hidratados e
incubados com cloridrato de berberina (0,02%) em ácido cítrico (1%) por 20 minutos,
sendo o excesso retirado com ácido cítrico (pH 4) por 5 minutos. A visualização das
seções foi feita por microscopia de fluorescência com emissão no espectro
ultravioleta. Pudemos evidenciar células com conteúdo citoplasmático fluorescente
amarelo-brilhante, correspondentes àquelas descritas anteriormente como
mastócitos, localizadas nos epitélios dos órgãos. Algumas espécimes, logo após a
dissecação foram submetidas a tratamento com desgranulantes e depois
processadas como citado acima. O uso da fluorescência tornou mais fácil a
delimitação do conteúdo granular destas células em relação ao núcleo (que emite
fluorescência esverdeada). Sendo assim, a técnica apresentada mostrou ser
ABSTRACT
Berberine is an alkaloid used as a fluorochrome in the identification of
heparin and DNA. Enerback, 1974, described the technique used until today to study
granules rich in heparin of vertebrate mast cells. Santos et al., 2003, studied mast
cells of the mollusk Anomalocardia brasiliana using biochemical and histological
analysis. This work used the fluorescent dye berberine technique to improve
characterization of these cells. Mollusk organs (ctenidium and mantle) were
processed with routine histological techniques. Tissue sections were treated with
berberine 0,02% in redistilled water acidified to pH 4, by the addition of citric acid for
20 minutes. The visualization was made through fluorescence microscopy with
ultraviolet region emission. The mast cell fluorescence had a strong yellow color,
where cell nuclei appeared more greenish. This result was very similar to the ones
reported before. Mast cells are location at the epithelium surface is the same in both
organs, mantle and ctenidium. The fluorescence was easily observed in the granules.
Therefore, this technique showed to be good and sensitive to study mast cell of
1. INTRODUÇÃO ...12
1.1. MASTÓCITOS ...12
1.1.1. DESGRANULAÇÃO E SECRETAGOGOS...15
1.1.2. ORIGEM E MATURAÇÃO ...17
1.2. USO DE FLUORESCÊNCIA NA DETECÇÃO DE MASTÓCITOS...19
1.3. HEPARINA...20
1.3.1. ESTRUTURA ...20
1.4. HEPARINA EM INVERTEBRADOS:...23
1.4.1. DISTRIBUIÇÃO E LOCALIZAÇÃO DA HEPARINA EM DIFERENTES TECIDOS DOS MOLUSCOS E OUTROS INVERTEBRADOS...24
2. OBJETIVOS: ...26
3. MATERIAL E MÉTODOS:...27
3.1. MATERIAL BIOLÓGICO ...27
3.2. MATERIAIS E REAGENTES: ...28
3.2.1. PADRÕES DE GLICOSAMINOGLICANOS SULFATADOS...28
3.2.2. ENZIMAS...28
3.2.3. OUTROS MATERIAIS E REAGENTES...29
3.3. APARELHOS: ...29
3.4. METODOLOGIA ...30
3.4.1. PREPARO DAS ESPÉCIES UTILIZADAS ...30
3.4.2. ENSAIO DE DESGRANULAÇÃO COM O COMPOSTO 48/80 (P-METÓXI-N-METILFENETILAMINA) E POLIMIXINA B...30
3.4.3. FIXAÇÃO E PROCESSAMENTO DOS TECIDOS ...31
3.4.5. EXTRAÇÃO DE GLICOSAMINOGLICANOS...32
3.4.6. ELETROFORESE EM GEL DE AGAROSE...34
4. RESULTADOS E DISCUSSÃO ...36
4.1. IDENTIFICAÇÃO DE HEPARINA NOS ÓRGÃOS DO MOLUSCO
Anomalocardia brasiliana...36
4.1.1. ANÁLISE ELETROFORÉTICA: ...36
4.1.2. ANÁLISE HISTOLÓGICA ...38
4.1.3. ANÁLISE DE FLUORESCÊNCIA DOS ÓRGÃOS SUBMETIDOS A DESGRANULAÇÃO...43
5. CONCLUSÕES ...47
1. INTRODUÇÃO
1.1. MASTÓCITOS
Descritos pela primeira vez por Ehrlich, em 1878, como um tipo celular
especial, os mastócitos (Figura 1) foram originalmente denominados “Mastzellen”
(células bem-nutridas) devido sua principal característica: a presença de abundantes
grânulos citoplasmáticos que se julgava serem acúmulo de nutrientes, que poderiam
ter um papel na guarnição do tecido conjuntivo, onde essas células são encontradas.
No entanto tal conceito foi revisto por Jorpes, Holmgren e Wilander em 1937 quando
demonstraram que os grânulos de mastócitos continham alto teor de heparina
estocada no seu interior (JORPES, HOLMGREN; WILANDER,1937). Essa
descoberta levou ainda à sugestão do termo heparinócito para essas células
(HÄRMA; SUOMALAINEN, 1951). Tais grânulos foram visualizados graças à sua
propriedade metacromática sobre alguns corantes básicos derivados da tionina, tais
como: azure A, azul de metileno e azul de toluidina (JAQUES, 1961).
Os mastócitos são encontrados em diferentes espécies de animais, desde
pequenos vertebrados até o homem (YONG, 1997; GOMES; DIETRICH, 1982;
NADER et al., 1980, 1982). Trabalhos recentes têm evidenciado a presença de
mastócitos e heparina em alguns invertebrados.(SANTOS,1997 e 2003;
CAVALCANTEet al.,2000;MEDEIROSet al.,2000).
Um aspecto importante que desperta o interesse dos pesquisadores é a
heterogeneidade mastocitária tanto na sua morfologia, quanto na sua fisiologia
celular e até mesmo na sua resposta à ação de secretagogos. Pouco se sabe sobre
essa heterogeneidade em animais invertebrados mas, no homem e nos roedores os
INTRODUÇÃO - 13
suas características morfológicas, bioquímicas, histoquímicas, funcionais e
imunofenotípicas. Assim sendo, em rato os mastócitos foram classificados como
mastócitos de mucosa (MM), presentes principalmente na lâmina própria do intestino
e mastócitos de tecido conjuntivo (MC), os quais são amplamente distribuídos no
tecido conjuntivo, principalmente na pele e na cavidade peritoneal (METCALFE,
BARAM; MEKORI 1997; KITAMURA et al., 1989; ENERBÄCK, 1986.). Os
mastócitos estão localizados no tecido conjuntivo bem próximo a vasos sangüíneos,
nervos e a regiões susceptíveis a entrada de antígenos no organismo, como a pele e
mucosas (METCALFE, BARAM; MEKORI 1997; YONG, 1997; NADER; DIETRICH,
1989).
2µm
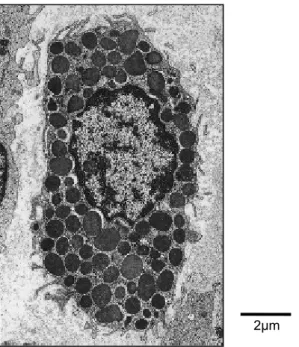
FIGURA 1 - MICROFOTOGRAFIA ELETRÔNICA DE TRANSMISSÃO DE MASTÓCITO DE TECIDO CONJUNTIVO DE RATO
A estrutura central cercada pelos grânulos correspondem ao núcleo. Num maior aumento é possível reconhecer algumas mitocôndrias entre os grânulos.
Fonte: BURKITT et al.,1994
Os MM são células menores, têm morfologia mais intensamente variável e
contêm menor quantidade de grânulos, de formas e tamanhos variáveis, quando
Enerbäck, em 1986, definiu em mastócitos murinos algumas condições
ideais de fixação e coloração para distinguir MM de MC. As diferenças na coloração
refletem principalmente a presença de heparina nos grânulos de MC, evidenciada
também pela formação de complexo fluorescente com sulfato de berberina. Esse
complexo não ocorre em MM, cujos grânulos contêm proteoglicanos ricos em
condroitim sulfato. (ENERBÄCK, 1989)
TABELA 1 CARACTERÍSTICAS DISTINTIVAS DAS LINHAGENS DE MASTÓCITOS MURINOS
PARÂMETROS MASTÓCITO DE
CONJUNTIVO (MC) MASTÓCITO DEMUCOSA (MM)
DIÂMETRO MÉDIO 19,6Pm 9,7Pm (forma variável)
GRÂNULOS Numerosos e de
tamanho uniforme
Poucos e de diversos tamanhos
GAG PREDOMINANTE Heparina Condroitim sulfatob
PROTEASE
MARCADORA Tipo I(análoga à quimotripsina)
Tipo II
(análoga à tripsina)
HISTAMINA 15-35 pg/célula < 2 pg/célula
SEROTONINA Alto conteúdo
(0,2-1,5 pg/célula) Baixo conteúdo (aumentado em infecção por nematódeo) RESPOSTA AO COMPOSTO 48/80a
Secretória Proliferativa (não secretória)
TIMO-DEPENDÊNCIA Não Sim
MEIA-VIDA > 6 meses < 40 dias
Tabela adaptada de Mota, 1985 e Enerbäck, (1989) a Poliamina secretagoga
b Condroitim extrassulfatado (CSE e CSD)
Além de glicosaminoglicanos, outras substâncias como proteases e aminas
vasoativas de baixo peso molecular estão presentes nos grânulos mastocitários. A
INTRODUÇÃO - 15
mastócitos de mamíferos e aves (TAKAYA, 1969), mas está ausente nos anfíbios e
répteis (CHIU; LAGUNOFF, 1971; LIMLOMWONGSE, THITHAPANDHA; SOBHON
1973). Santos, em 1997 demonstrou a presença de grânulos contendo histamina no
molusco Anomalocardia brasiliana e sua íntima correlação nos diversos tecidos com
o teor de heparina. A serotonina (5-hidroxi-triptamina) é encontrada nos mastócitos
de rato e camundongo (BENDITT et al., 1955, 1963; PADAWER, 1966; RITZÉN,
1966), já a dopamina é descrita em mastócitos de bovinos (FALCK et al., 1964;
COUPLAND; HEATH, 1966), de rato e camundongo (ENERBACK; HAGGENDAL,
1970) e de hamster (ADAMS-RAY et al., 1964; FALCK et al., 1964). Os grânulos
apresentam ainda muitas outras substâncias como proteases neutras e alcalinas,
outras enzimas não proteolíticas que atuam em processos inflamatórios e
anafiláticos e fatores com elevado potencial quimiotático (SIRAGANIAN, 1988) que
são liberados quando a célula é estimulada a desgranulação. A ativação celular
provoca também a síntese de substâncias como prostaglandinas e leucotrienos
(derivados do ácido araquidônico liberado de fosfolipídios de membrana), fator
ativador de plaquetas (SCHWARTZ; AUSTEN, 1984), citocinas (como as
interleucinas IL- 3, 4, 5,e 6) e o fator estimulador de colônias de granulócitos
(STEVENS; AUSTEN, 1989), os quais são responsáveis conjuntamente pelos
fenômenos de hipersensibilidade imediata e retardada, injúria e permeabilidade
vascular, imunorregulação e potencialidade para toxicidade de eosinófilos e
macrófagos.
1.1.1.DESGRANULAÇÃO E SECRETAGOGOS
Os mastócitos possuem na superfície de sua membrana citoplasmática,
imunoglobulina E (FcHRI), sendo esta uma das características imunofenotípicas
relacionadas com o papel dessas células no organismo. Os mastócitos, quando
devidamente ativados, liberam mediadores químicos que possuem amplo e
significativo papel biológico, como o crescimento e a diferenciação celular, produção
e liberação de citocinas, dependentes ou não do FcHRI. Sua ativação ocorre através
da ligação da porção Fc das IgEs ao receptor FcHRI e/ou quando antígenos
multivalentes se ligam as IgEs promovendo a agregação dos receptores na
superfície da célula. Alguns compostos induzem desgranulação por processo
semelhante (METZGER, 1992) provocando uma série de reações que culminam
com a liberação do conteúdo dos grânulos para o meio extracelular.
Os compostos geralmente descritos como desgranulantes ou secretagogos
de mastócitos normalmente são substâncias químicas básicas ou catiônicas.
Quimicamente os desgranulantes são amidas, amidinas, compostos terciários e
quaternários de amônio, compostos de piridíneo (como são vários corantes
alimentícios e têxteis), piperidinas e certos alcalóides. Os mais conhecidos são:
tubocuranina, succinilcolina, sais de morfina, certos tipos de radiocontrastes, alguns
expansores plasmáticos, bradicinina, substância P, mastoparam, e polimixina B.
Todas essas substâncias conseguem ativar a resposta secretória de mastócitos e
até de basófilos promovendo uma elevação do teor do íon cálcio intracelular,
algumas atuando como ionóforas, transportando cálcio para a célula e outros como
por exemplo o mastoparam desviando cálcio dos receptores da superfície celular e
estimulando diretamente as proteínas reguladoras ligadas ao nucleotídeo guanina
(proteínas G). Fatores físicos, como excesso de calor e de frio, também levam a
INTRODUÇÃO - 17
EDTA e cromoglicato de sódio normalmente bloqueiam a ação desgranulante do
composto 48/80 e de polimixina B (GOODMAN; GILMAN, 1996).
O composto 48/80, secretagogo polibásico de mastócitos (uma mistura de
polímeros de diversos pesos moleculares, derivados fenetilamina substituídos no
qual o mais ativo é o hexâmero), também causa a ativação de mastócitos
independente de FcHRI através de uma estimulação direta das proteínas G via
fosfolipase D por meio da inserção de seus anéis aromáticos na membrana
citoplasmática. Possui o potencial de desencadear a mobilização das reservas de
cálcio intracelular e que culminam com eventos de desgranulação mastocitária dose
dependente (BLOOM; HAEGERMARK, 1965; JOHNSON; MORAN, 1969;
SIRAGANIAN, 1988; MOUSLI et al., 1990a; 1990b). A polimixina B possui ação
secretagoga muito semelhante ao composto 48/80 e atividade mais potente.
1.1.2.ORIGEM E MATURAÇÃO
Devido à ampla participação dos mastócitos em diversos processos
orgânicos, diferentes aspectos de sua biologia têm sido estudados, entre eles a sua
origem e maturação. A origem dos mastócitos começou a ser elucidada por Kitamura
e colaboradores, a partir de 1978, quando os resultados de suas pesquisas
demonstraram que os mastócitos se diferenciam de precursores encontrados na
medula óssea, originados de células-mãe hematopoiéticas pluripotentes. Estes
pesquisadores demonstraram também a influência imprescindível de fatores do
microambiente na caracterização fenotípica definitiva dessas células e as diversas
possibilidades de transdiferenciação que a célula apresenta se colocada em
microambientes diferentes. A partir dos estudos de Kitamura foi demonstrado que a
interleucinas 3 e 4, dá origem a células que se assemelham fenotipicamente a
mastócitos de mucosa (GALLI, DVORAK; DVORAK 1984). Rotten et al. em 1991
demonstraram que mastócitos humanos se originam de células-fonte pluripotentes
CD34+ e que em condições apropriadas, in vitro, adquirem a ultraestrutura granular
típica de mastócitos característicos de cada região corpórea.
Estudos realizados com roedores demonstraram que o precursor de
mastócito origina-se na medula óssea, passa para o sangue circulante
(ZUCKER-FRANKLIN et al., 1981; SONODA, OHNO; KITAMURA 1982) e depois para os
tecidos, onde, sob influência de fatores do microambiente, diferencia-se e
amadurece (NAKANO et al., 1985). Porém, não se pode esquecer que os
experimentos foram feitos em roedores, e não podem ser generalizados para outros
grupos, devido à grande diversidade de aspectos apresentados pelos mastócitos
(GALLI, 1990).
Galli et al.,1999, sugerem que os precursores de mastócitos migram através
da corrente sangüínea para os sítios periféricos do organismo onde sofrem
maturação. Diferentemente dos mastócitos, a maioria das progênies de outras
células hematopoiéticas sofre maturação ainda na medula óssea (GALLI; LANTZ
1999; METCALFE, BARAM; MEKORI 1997; ROTTEM et al., 1992, 1994; KITAMURA
et al., 1989). Os precursores dos mastócitos não são devidamente reconhecidos na
circulação sangüínea por não apresentarem características de mastócitos maduros,
como as granulações metacromáticas. As células precursoras de mastócitos ao
chegarem aos tecidos sofrem a ação de fatores de crescimento, como interleucinas
(IL-3 IL-4, IL-9, IL-10) e Stem Cell Factor que vão promover a sua diferenciação em
INTRODUÇÃO - 19
A maturação dos mastócitos é regulada por uma complexa gama de fatores,
sendo que a IL-3 é a principal envolvida neste processo de diferenciação e
maturação (VALENT, SILLABER; BETTELHEIM 1991). O SCF, além de promover a
proliferação e maturação dos mastócitos imaturos, pode regular sua atividade
secretora e manter sua sobrevivência impedindo a apoptose (GALLI et al., 1995). No
entanto, usando somente o SCF não é possível promover o desenvolvimento total
dos mastócitos (ISHIZAKA et al., 1993; TSAI et al., 1991), mas quando este é
associado a IL-3, IL-4 ou IL-10, apresenta uma grande capacidade de
desenvolvimento e maturação destas células (RENNICK et al., 1995).
1.2. USO DE FLUORESCÊNCIA NA DETECÇÃO DE MASTÓCITOS
O emprego da fluorescência para o estudo dos mastócitos teve início há
cerca de vinte anos atrás (BERLIN; ENERBÄCK, 1984). Apesar de alguns novos
fluorcromos estarem sendo empregados com certas vantagens operacionais
(SIRAGANIAN, 1988), como as carbocianinas, aril-oxazóis e um complexo com
rutênio (Rubipy), os compostos mais utilizados freqüentemente são o acridine
orange e a berberina (STOCKERT, 2000).
A berberina é um alcalóide derivado da planta Hydrastis canadensis (apesar
de poder ser encontrado em outras plantas). Esta substância é usada há séculos
pela medicina chinesa como antidiarréico, havendo estudos visando o seu emprego
pela medicina ocidental. Apresenta uma estrutura aromática planar com um N
quaternário (JUNG et al, 1999) (Figura 2 ), responsável pela complexação com GAG
sulfatados (STOCKERT,2000).
Como fluorcromo para tecidos animais, a berberina tem sido usada
amarela-esverdeada) e os grânulos de heparina dos mastócitos (ao qual confere coloração
amarelo brilhante) (ENERBÄCK, 1989). Outra utilização da berberina é na
quantificação de células com a utilização de citofluorometria. Apesar de amplamente
difundido, ainda não foi descrito o uso desse fluorcromo no estudo de inverterados.
FIGURA 2 - ESTRUTURA DA BERBERINA
1.3. HEPARINA
1.3.1. ESTRUTURA
O termo heparina (hepathos = fígado) foi criado por Howell e Holt em 1918,
para denominar um composto, provavelmente um fosfolipídeo, com atividade
anticoagulante extraído por solução etérea de fígado de cão por McLean em 1916. O
mesmo termo foi empregado ainda por Howell, em 1922, para descrever outro
composto com maior atividade anticoagulante obtido também, de tecido hepático de
cão, porém por extração aquosa e precipitação por acetona (JAQUES, 1961).
Até 1928, pouco se conhecia sobre a estrutura da heparina, até que o
estudo químico desenvolvido por Howell em 1928, mostrou que se constituía de um
carboidrato, mais especificamente um glicosaminoglicano (GAG), como constatado
por Jorpes em 1935. Muitos pesquisadores têm trabalhado, com base nos avanços
INTRODUÇÃO - 21
vez mais purificadas, para o estabelecimento de conceitos básicos estruturais e
biológicos da heparina, mas atualmente ainda reserva-se alguns questionamentos
com relação a sua atividade biológica.
A heparina, por ser um glicosaminoglicano típico, apresenta uma cadeia
polissacarídica linear formada por unidades dissacarídicas repetitivas compostas por
um ácido urônico, que pode ser D-glucurônico ou L-idurônico, unido através de uma
ligação glicosídica a uma D-glucosamina (LINDAHL; AXELSSON, 1971). O ácido
L-idurônico geralmente é sulfatado em C-2 (WONFROM, WANG, HONDA, 1969); e a
maioria dos resíduos de glucosamina são N-sulfatados e O-sulfatados em C-2 e C-6
(DANISHEFSKY et al., 1969) (Figura 3). Esse alto grau de sulfatação faz da
heparina o glicosaminoglicano mais ácido e, conseqüentemente, o polieletrólito
natural mais fortemente carregado. Tal característica química contribui para a
relativa facilidade de se localizar a heparina nos tecidos animais empregando-se
corantes acidófilos em valores reduzidos de pH.
Os glicosaminoglicanos se encontram ligados a uma cadeia protéica,
formando os proteoglicanos. Os proteoglicanos de heparina são exclusivamente
encontrados em grânulos mastocitários, constituídos por uma proteína pequena
(14-17kDa), que apresenta um domínio com 24 seqüências justapostas de serina-glicina,
na qual estão ligadas aproximadamente 12 cadeias de glicosaminoglicano
(AVRAHAM et al., 1989; BOURDON, SHIGA; RUOSLAHTI, 1987). A peculiaridade
dessa cadeia protéica originou o nome serglicim dado a essa classe de
proteoglicanos típica de grânulos celulares. A Figura 4 apresenta um desenho
esquemático do proteoglicano de heparina e características de sua cadeia protéica.
O alto número de cadeias de heparina por comprimento de proteína produz
outro biopolímero conhecido (WIGHT, HEINEGARD; HASCALL, 1991). Esse fato foi
associado à outra característica desses proteoglicanos: sua resistência à ação de
proteases (YURT et al., 1977) muito embora a falta de aminoácidos aromáticos e
básicos no domínio de ligação dos glicosaminoglicanos, também possa justificar
essa resistência (STEVENS, 1986).
AIdo GlcN AIdo GlcN AGlc GlcN
O O
OH O OH
O O COO-OH OH O O OH OH OH O -OSO3 -OSO3 -3 HNSO -3 HNSO -3 HNSO -3 SO CH2 -3 SO 2 CH -3 SO 2 CH COO-O O COO-O O O n
FIGURA 3 - ESTRUTURA QUÍMICA ELEMENTAR DA MOLÉCULA DE HEPARINA
AIdo, ácido idurônico; AGlc, ácido glucurônico; GlcN, glicosamina.
A
138 90
27 179
COOH H2N
(Ser-Gli)24
B
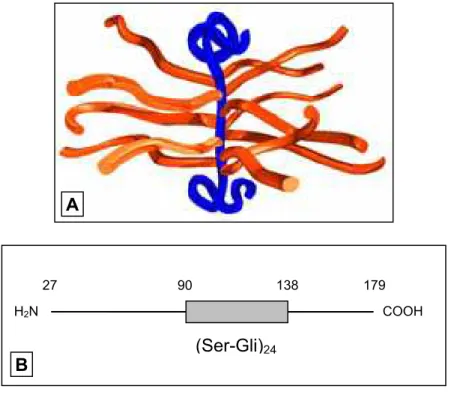
FIGURA 4 - REPRESENTAÇÃO ESQUEMÁTICA DO PROTEOGLICANO DE HEPARINA
A - Modelo espacial
Em azul - cadeia protéica central. Em laranja - cadeias de heparina.
B - Estrutura da cadeia protéica (sem o peptídeo-sinal) (Ser-Gli)24 - domínio de inserção das cadeias de heparina.
Os comprimentos dos segmentos são proporcionais ao número de aminoácidos em cada um.
INTRODUÇÃO - 23
1.4. HEPARINA EM INVERTEBRADOS:
Em 1951, Thomas fez o primeiro relato sobre um fator anticoagulante tipo
heparina em invertebrados, desde então foram realizadas pesquisas em várias
espécies, como Spisula solidissima (CHARLES; SCOTT,1933), Arctica islandica
(FROMMHAGEN et al,1953) Cyprina islandica e Venus mercenária (CIFONELLI;
MATHEUS,1972). Tais trabalhos mostraram que esses compostos possuíam alta
atividade anticoagulante, e eram metacromáticos na presença do azul de toluidina.
Com a realização de novos estudos, cada vez mais era considerada a
semelhança desses GAG extraídos dos moluscos com a heparina de mamífero. Em
1985, Dietrich et al afirmaram categoricamente a presença de heparina nos extratos
do molusco Anomalocardia brasiliana, caracterizando o composto através de
análises químicas, propriedades físico-químicas, atividades farmacológicas e
susceptibilidade às enzimas heparinase e heparitinase II de Flavobacterium
heparinum. Comparativamente, a heparina do molusco se apresentou bastante
semelhante às de mamífero (pulmão e intestino bovino). Em 1989, dando
prosseguimento ao trabalho, foram analisadas a heparina de mais duas espécies, a
Donax striatus e Tivela mactroides, incluindo em suas análises a espectroscopia de
ressonância magnética nuclear. Esses estudos indicaram novamente, que a
heparina de invertebrados é virtualmente indistinguível da heparina presente em
tecido de vertebrados, além disso sugeriram que a heparina mantém seu aspecto
estrutural ao longo da filogenia animal (DIETRICH et al.,1989). Em 1995, a mesma
equipe fez um estudo comparativo do mecanismo de ação anticoagulante da
heparina entre mamíferos e moluscos. Constataram que a heparina de molusco tem
Entretanto apresenta uma atividade inibitória sobre a trombina quatro vezes maior do
que sobre o cofator II da heparina (PAIVA ,1995).
1.4.1. DISTRIBUIÇÃO E LOCALIZAÇÃO DA HEPARINA EM
DIFERENTES TECIDOS DOS MOLUSCOS E OUTROS
INVERTEBRADOS
Em 1993, Hoving e Linker, empregando marcação radioativa com 35S,
estudaram tecidos do marisco de água doce Anodonta californiensis, e encontraram
como principais glicosaminoglicanos a heparina e um tipo não usual de heparam
sulfato. Os estudos auto-radiográficos dos tecidos revelaram que os GAGs estavam
presentes, principalmente, dentro de células distribuídas perifericamente no manto e
no ctenídeo (brânquia). Os mesmos pesquisadores, em 1998, pesquisando os GAGs
de duas outras espécies de molusco, Aplysia californica (lesma do mar) e Helix
aspersa (caracol), e da sanguessuga Nephelopsis obscura, demonstraram que a
heparina ocorria como o GAG presente em maior quantidade. (HOVING;
LINKER,1998)
SANTOS, 1997, caracterizou, por eletroforese e degradação enzimática, os
glicosaminoglicanos de manto, ctenídeo, palpo labial, massa visceral, pé e secreção
palial do molusco Anomalocardia brasiliana, mostrando que, com exceção dos dois
últimos, a heparina era o principal GAG encontrado. Além disso, a atividade
anticoagulante e o teor de histamina total desses extratos apresentaram uma boa
correlação com o conteúdo de heparina. A análise histológica do intestino, ctenídeo,
palpo e manto evidenciou a presença de células contendo grânulos metacromáticos
com azul de toluidina, distribuídas no epitélio. Metodologia enzimática e química in
situ permitiu, ainda, corroborar a presença de heparina em cortes histológicos do
INTRODUÇÃO - 25
A localização da heparina no bivalve Mercenaria mercenaria, foi
determinada histologicamente com o uso dos corantes azure e alcian blue por Ulrich
e Boon em 2000. Foi visto que a heparina localizava-se em células de palpo labial,
ctenídeo, intestino e sifão, e estavam restritas a áreas próximas da superfície
epitelial, onde grânulos foram observados em todos os tipos de células, exceto
intestino.
Os dados até aqui citados demonstram que o estudo da heparina de
invertebrados têm sido bastante desenvolvido no filo mollusca, entretanto, a
ocorrência de heparina e heparinóides também foi relatada em espécies de outros
filos de invertebrados, como no camarão Penaeus brasiliensis (DIETRICH et al,
1999). Cavalcante et al., 2000 descreveram a ocorrência de heparina numa
monocamada de células que envolvem o oócito da ascídia Styela plicata. Tais
células apresentavam granulações fortemente metacromáticas ao corante azul de
(1,9-)dimetil-metileno e foram sensíveis ao efeito desgranulante do composto 48/80.
A presença de heparina nessas células foi confirmada por marcação
imunofluorescente utilizando o anticorpo monoclonal anti-heparina ST-1.
Devido à grande difusão de relatos sobre a ocorrência de heparina em
invertebrados, Medeiros et al., 2000 desenvolveram um extenso trabalho de
investigação dos GAGS de filos de invertebrados para os quais haviam pouca ou
nenhuma informação. Foram isolados os glicosaminoglicanos sulfatados de 23
2. OBJETIVOS:
Este trabalho vem no seguimento de um conjunto de estudos realizados por
Santos et al. que visa determinar a localização tissular da heparina em diversos
invertebrados e especular, a função da heparina no animal estudado. Deste modo
visamos:
x Testar o uso da berberina na identificação e determinação da distribuição tissular de mastócitos de molusco
MATERIAL E MÉTODOS - 27
3. MATERIAL E MÉTODOS:
3.1. MATERIAL BIOLÓGICO
O molusco utilizado tem considerável importância comercial, é relativamente bem aproveitado na culinária de populações ribeirinhas e são conhecidos popularmente por: “buzo”, “marisco branco”, “berbigão”, e outros. No Brasil é encontrado no litoral da região Norte ao sul da costa brasileira até a costa uruguaia, é encontrado ainda na Índia (BOFFI, 1979; RIOS, 1970,1975). (Figuras 5 e 6).
FILO: Mollusca
CLASSE: Pelecypoda (Bivalvia) ORDEM: Eulamellibranchia SUB-ORDEM: Heterodonta FAMÍLIA: Veneridae
GÊNERO:Anomalocardia
ESPÉCIE:Anomalocardia brasiliana
Manto (revestindo a face interna das valvas)
ctenídeo
Pé
Massa visceral
FIGURA 5 - FOTO DO MOLUSCO Anomalocardia brasiliana
FIGURA 6 - REPRESENTAÇÃO ESQUEMÁTICA DOS TECIDOS DE
Anomalocardia brasiliana
3.2. MATERIAIS E REAGENTES:
3.2.1.PADRÕES DE GLICOSAMINOGLICANOS SULFATADOS
Condroitim 4-sulfato (extraído de cartilagem de baleia), condroitim 6-sulfato
(de cartilagem de tubarão, P.M. 60.000 Da) e dermatam sulfato (de pele de porco)
foram adquiridos da Seikagaku Kogyo Co. (Tóquio, Japão).
Heparam sulfato (de pâncreas bovino, P.M. 25.000 Da) foi preparado com
amina quaternária, segundo Cifonelli e Dorfman em 1962, na Opocrin Laboratories
(Modena, Itália). Heparam sulfatos C (9.300Da) e D (4.500Da) foram preparados
como descrito por Dietrich e Nader em 1974 e correspondem a heparina de baixo
peso molecular (5.000 Da) extraído de pulmão bovino.
Heparina de pulmão bovino foi generosamente cedido pela Upjonh Co
(Kalamazoo, MI, EUA) e pela Opocrin Laboratories (Modena, Itália) e heparina de
mucosa intestinal de bovinos pela Laob Laboratories (Barueri, SP, Brasil).
3.2.2.ENZIMAS
Maxatase (protease alcalina P 126) foi adquirida da Biocon do Brasil
industrial Ltda. (Rio de Janeiro, RJ, Brasil).
Superase (coquetel de enzimas proteolíticas preparadas a partir de uma
MATERIAL E MÉTODOS - 29
3.2.3.OUTROS MATERIAIS E REAGENTES
Entellan£, eosina, xilol, formaldeído, ácido sulfúrico, ácido clorídrico da
Merck (Darmstadt, Alemanha).
Azul de Toluidina, Azul de Alcian, Hematoxilina, Eosina, Vermelho de cresol,
e Sulfato de Berberina Sigma Chemical Co. (St. Louis, Mo, EUA).
Ácido tricloroacético (TCA), ácido clorídrico, ácido acético, acetona, cloreto
de sódio, parafina da Reagen Quimibrás Indústrias Químicas S.A, benzina.
Composto 48/80 (p-metóxi-N-metilfenetilamina) (Sigma-Aldrich, Berlim,
Alemanha).
Polimixina B na forma do sal Sulfato de polimixina B gentilmente cedido pelo
laboratório de imunopatologia da Universidade de São Paulo (USP) (Ribeirão Preto).
Agarose (Standart-Low-Mr) da BioRad Laboratories (Richmond, CA, EUA)
Todos os demais reagentes e materiais empregados foram da melhor
qualidade disponível, observando-se sempre elevado grau de pureza.
3.3.
APARELHOS:
Além dos aparelhos usuais de laboratório foram utilizados:
- Medidor de pH Orion Research, modelo 701 A/ digital Lonalyzer
(Cambridge, MA, EUA).
-Banhos e estufas de temperatura constante da Fanem Ltda (São Paulo,
SP, Brasil).
-Câmara para eletroforese em gel de agarose, modelo desenvolvido por
Jaqueset al., em 1968. Técnica Permatron Ltda (São Paulo, SP, Brasil).
-Microscópio óptico Nikon Eclipse E200 e Microscópio de fluorescência
Olympus BX 41.
-Fontes de corrente contínua regulável desenvolvida pelo Dr. H. Rzeppa,
Técnica Permatron Ltda (São Paulo, SP, Brasil).
-Incubadora de temperatura controlável com agitador, modelo G-25, New
Brunswick Scientific Co. Inc (New Brunswick, NJ, EUA).
3.4. METODOLOGIA
3.4.1. PREPARO DAS ESPÉCIES UTILIZADAS
Os mariscos empregados no estudo, foram coletados na foz do Rio
Ceará-Mirim (próximo à praia de Barra do Rio, em Extemoz-RN) durante a maré baixa (0,0-
0,7). Os animais recém-coletados foram levados vivos ao laboratório em baldes
contendo água do mar e lá mantidos vivos por até quatro dias, em um aquário com
água do mar, com oxigenação contínua, à temperatura ambiente.
3.4.2. ENSAIO DE DESGRANULAÇÃO COM O COMPOSTO 48/80
(P-METÓXI-N-METILFENETILAMINA) E POLIMIXINA B
Mantos e ctenídeos de 3 ou 4 espécimes do molusco foram dissecados de
cada lado do animal ainda vivo e mergulhados simetricamente em frascos separados
contendo água do mar filtrada e solução desgranulante (composto 48/80 a
100Pg/mL ou polimixina B a 50 Pg/mL) em água do mar filtrada sob leve agitação. Após esse tempo os tecidos foram lavados duas vezes com água do mar filtrada em
MATERIAL E MÉTODOS - 31
amostras foram chamadas de manto 48/80 e ctenídeo 48/80 ou manto polimixina e
ctenídeo polimixina, conforme o composto desgranulante usado, e manto mar e
ctenídeo mar, os respectivos controles negativos. O restante do corpo do animal não
foi usado no teste de desgranulação devido à complexidade no manejo e avaliação
do mesmo.
3.4.3. FIXAÇÃO E PROCESSAMENTO DOS TECIDOS
Os tecidos (os que sofreram desgranulação e os controles positivos) foram
submetidos a fixação com álcool etílico/ácido acético numa proporção de 3/1 durante
60 min. Após esse período, a solução fixadora foi descartada e o seu excesso
retirado através de simples evaporação. O tecido foi, então, transferido para uma
solução fixadora de formol (formaldeído) neutro a 10% em água destilada associada
a carbonato de cálcio.
Seguindo a fixação, as amostras foram submetidas às técnicas rotineiras de
histologia: desidratação, inclusão em parafina e corte das peças em micrótomo
comum, para a obtenção de seções histológicas com espessura variando entre 3 e 6
micrômetros. Uma vez montadas em lâminas, foram desparafinadas, desidratadas e
coradas.
3.4.4. TÉCNICA DE COLORAÇÃO
O fluorcromo utilizado foi uma solução de cloridrato de berberina a 0,02%
diluído em água deionizada (miliQ) e acidificada a pH 4 por adição de pequena
quantidade de solução de ácido cítrico a 1% em água deionizada. Os cortes
foram lavados por cerca de 5 minutos em solução de ácido cítrico pH 4 e levados ao
microscópio de fluorescência com emissão no espectro ultravioleta.
Paralelamente, algumas seções de tecido foram submetidas às colorações
habituais de azul de metileno, hematoxilina-eosina e azul de alcian-P.A.S. e
analisadas em microscópio óptico comum para comparação entre os métodos.
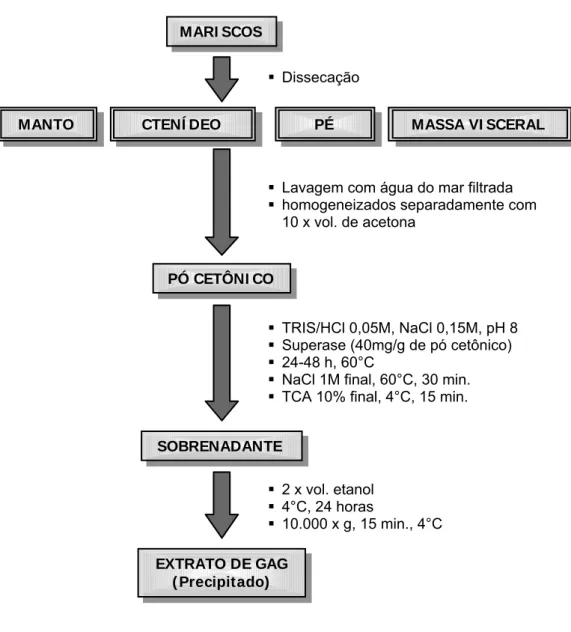
3.4.5.EXTRAÇÃO DE GLICOSAMINOGLICANOS
Cerca de 60 espécimes do molusco Anomalocardia brasiliana tiveram seus
órgãos (manto, ctenídeo, pé e massa visceral) dissecados, picados, colocados em
acetona (equivalente a 10 vezes o volume da massa tecidual) e deixados à
temperatura ambiente por 1 ou 2 dias com trocas diárias (caso necessário) do
sobrenadante de acetona. Os pós cetônicos de todas as amostras foram pesados e
submetidos à proteólise. Para isso, cada grama de pó cetônico foi incubado com 40
mg de superase dissolvidos em 10 ml de tampão Tris-HCl 0,05 M, pH 8,0, com NaCl
0,15 M por 24 a 48 horas a 60°C. Depois, o caldo proteolisado teve sua
concentração de NaCl corrigida para 1,0 M final e permaneceu ainda por 30 minutos
a 60°C. Em seguida foi resfriado e adicionado ácido tricloroacético para uma
concentração final de 10%. Após permanecer por 15 minutos a 4°C, a mistura foi
centrifugada. Os glicosaminoglicanos foram, então, precipitados do sobrenadante
pela adição de 2 volumes de etanol a 4°C por 24 horas. O precipitado formado
(extrato de glicosaminoglicanos) foi seco e pesado em balança de precisão e
preparadas soluções nas concentrações de 100 mg/mL e 50 mg/mL em água
MATERIAL E MÉTODOS - 33
MARI SCOS
PÓ CETÔNI CO
SOBRENADANTE
Lavagem com água do mar filtrada
homogeneizados separadamente com 10 x vol. de acetona
CTENÍ DEO PÉ
MANTO
Dissecação
MASSA VI SCERAL
TRIS/HCl 0,05M, NaCl 0,15M, pH 8
Superase (40mg/g de pó cetônico)
24-48 h, 60°C
NaCl 1M final, 60°C, 30 min.
TCA 10% final, 4°C, 15 min.
2 x vol. etanol
4°C, 24 horas
10.000 x g, 15 min., 4°C
EXTRATO DE GAG ( Precipitado)
3.4.6.ELETROFORESE EM GEL DE AGAROSE
A identificação da heparina foi realizada através do método de eletroforese
em gel de agarose, desenvolvida por Jaques et al., em 1968 e posteriormente
modificado por Dietrich e Dietrich em 1976.
Cinco microlitros das amostras na concentração de 10 mg/mL (extrato bruto)
foram aplicadas em lâmina de gel de agarose 0,6% de 7,5 x 5,0 cm ou 12 x 7,5 cm
com espessura de 0,2 cm, no tampão 1,3-diaminopropano acetato (PDA) 0,05 M, pH
9,0. A eletroforese foi efetuada a 5 V/cm durante 1 hora em câmara refrigerada a
4°C (DIETRICH; DIETRICH,1976; DIETRICH, McDUFFIE; SAMPAIO,1977). Nesse
sistema de tampão a diamina interage com os glicosaminoglicanos em diferentes
graus, resultando na seguinte ordem decrescente de mobilidade eletroforética:
Condroitim 4- e 6- sulfatos (CS) dermatam sulfato (DS) e heparam sulfato (HS)
juntamente a heparina (Hep). No tampão acetato de Bário (Ba) 0,04 M, pH 5,8 – 4
V/cm durante 10 minutos – e 1,3-diaminopropano acetato (PDA) 0,05 M, pH 9,0 – 5
V/cm durante 90 minutos (BIANCHINI et al., 1980). Esse sistema consiste na
submissão do gel às condições de eletroforese no tampão acetato de bário e,
seguida da transferência para outra câmara preparada com tampão PDA,
permanecendo em repouso a 4°C por 15 min. Daí segue as condições de sistema
PDA. Neste sistema a heparina, exclusivamente é fracionada em três componentes
com migrações distintas e inversamente relacionadas com o peso molecular.
Utilizou-se como indicador de migração o vermelho de cresol. Os
glicosaminoglicanos foram fixados no gel com Cetavlon 0,1% durante pelo menos 2
horas. Em seguida o gel foi seco sob ação de uma corrente de ar quente e
posteriormente imerso para coloração em solução com azul de toluidina 0,1% em
MATERIAL E MÉTODOS - 35
removida com solução descorante (ácido acético 1% e etanol a 50%) e o gel seco à
4. RESULTADOS E DISCUSSÃO
4.1. IDENTIFICAÇÃO DE HEPARINA NOS ÓRGÃOS DO MOLUSCO
Anomalocardia brasiliana
4.1.1.ANÁLISE ELETROFORÉTICA:
Após a dissecação foram isolados do molusco os seguintes órgãos: pé (P),
manto (M), ctenídeo (Ct) e massa visceral (V). Tais órgãos tiveram os seus
glicosaminoglicanos extraídos por precipitação alcoólica após delipidação e
proteólise (ver métodos). Os extratos de GAGS foram analisados por eletroforese
em gel de agarose, a fim de caracterizar as suas composições.
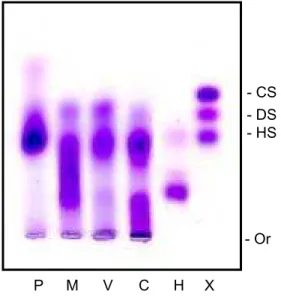
Como pode ser visto pela eletroforese em tampão de PDA (Fig. 8) todos os
extratos apresentam compostos metacromáticos cuja a maior parte deles tem
migração semelhante a heparina padrão.
- HS - DS - CS
- Or
P M V C H X
FIGURA 8 - ELETROFORESE EM GEL DE AGAROSE NO TAMPÃO PDA
RESULTADOS E DISCUSSÃO - 37
O sistema de eletroforese em Ba/PDA permite fracionar exclusivamente a
heparina em 2 ou 3 componentes distintos, consistindo numa técnica de análise
mais acurada capaz de distinguir heparam sulfato de heparina. Assim, observa-se
que nos extratos e manto, ctenídeo e, em menor grau, massa visceral, ocorre o
fracionamento típico da heparina. Por outro lado, o extrato do pé não se comporta
como contendo heparina.
Esses resultados reproduzem os dados dos estudos anteriores de que a
heparina é o principal glicosaminoglicano encontrado nessa espécie (DIETRICH et
al., 1985) e que a mesma se acha distribuída em vários órgãos do molusco
Anomalocardia brasiliana, sendo mais abundante no manto, ctenídeo e palpo labial
(SANTOSet al., 2003; NADER et al., 2004).
- CS
- HS - DS
- Or
P M V C H X
FIGURA 9 - ELETROFORESE EM GEL DE AGAROSE NO SISTEMA BA/PDA
4.1.2.ANÁLISE HISTOLÓGICA
De acordo com dados prévios, a heparina vista é presente exclusivamente
em mastócitos, e aparecem em altas concentrações na composição do manto e
ctenídeo (SANTOS et al.,2003). Considerando ainda a facilidade de dissecação e
isolamento do manto e do ctenídeo e baseado em pesquisas anteriores sobre
microscopia óptica desses mastócitos (SANTOS et al., 2003; SOUZA, 2004), estes
órgãos foram escolhidos para um estudo histológico dos mastócitos utilizando o
fluorcromo berberina.
Após dissecação os órgãos foram isolados, fixados e processados através
de técnicas rotineiras de histologia para montagem da lâmina, sendo depois
submetido à técnica de fluorescência com sulfato de berberina a 0,02% pH 4.
Paralelamente foram utilizadas as colorações Hematoxilina-eosina (HE), Azul de
Alcian-Ácido Periódico de Shiff (PAS-AA) e Azul de Metileno (AM).
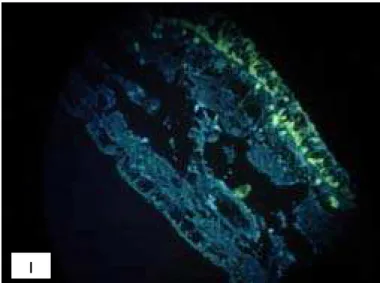
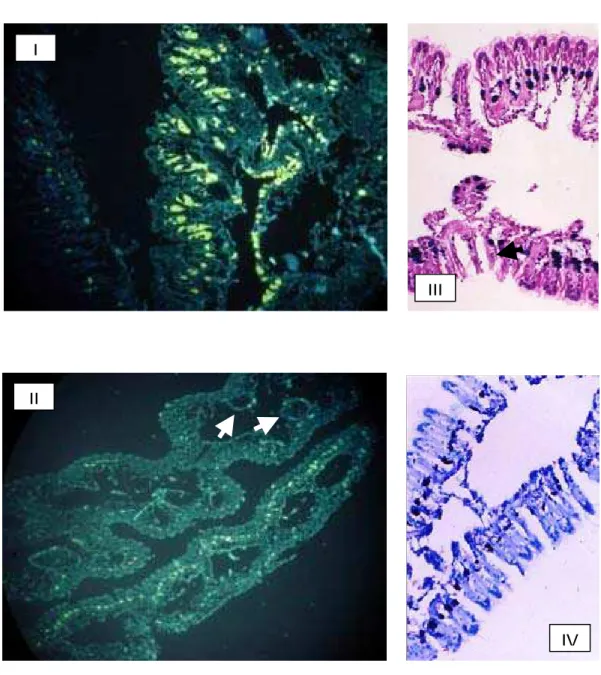
Na figura 10 (I e II) podemos observar a micrografia de fluorescência do
manto apresentando fluorescência em praticamente toda faixa do epitélio da face
interna do manto (a que fica voltada para a cavidade palial, em contato com a água
do mar). O manto se mostra como uma extensa e delgada lâmina tecidual contendo
um epitélio de revestimento cilíndrico simples com formações ciliares, numa
organização tecidual com nítidas simulações de estratificação.
Fazendo uma comparação com as colorações PAS-AA e AM, verificamos
que a fluorescência corresponde à localização dos mastócitos que se coram em azul
pelo PAS-AA (Figura 10 ).
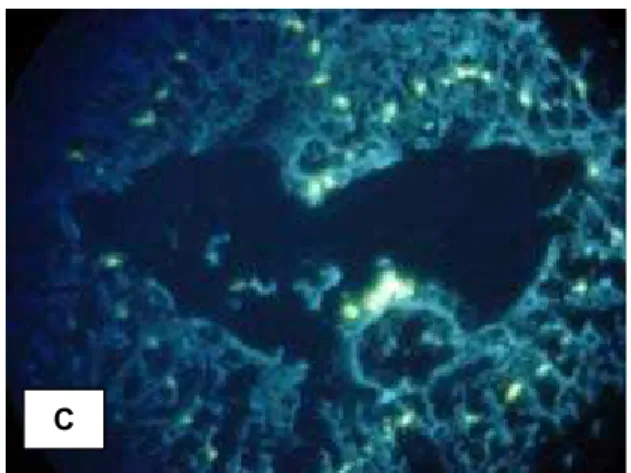
Com relação ao ctenídeo, podemos observar a fluorescência na porção
basal dos filamentos e em torno dos tubos aqüíferos (Figura 11 I e II). Os mastócitos
RESULTADOS E DISCUSSÃO - 39
manto. Quando comparadas as seções tratadas com berberina com as colorações
por HE, PAS-AA e AM, notamos a distribuição dos mastócitos nos mesmos locais e
da mesma forma (Figura 11 III e IV).
A metodologia proposta neste trabalho proporcionou uma vizualização
adequada do conteúdo dos grânulos citoplasmáticos dos tecidos estudados. A
berberina conferiu uma coloração amarela brilhante ao conteúdo granular de várias
células, estando todas elas localizadas em epitélios que ficam em contato com o
meio externo. A berberina é também utilizada para a identificação de DNA, onde sua
coloração fluorescente é amarelo-esverdeada (JUNG et al.,1999), não sendo
possível confundir as granulações com o núcleo das células.
Conforme já descrito para vertebrados, a fluorescência pela berberina se
mostrou eficiente na identificação de mastócitos (e de heparina) no molusco
Anomalocardia brasiliana. O uso da berberina pode representar uma técnica
sensível e valiosa na pesquisa futura de mastócitos de outros invertebrados, cujo
teor de heparina nos tecidos é menor, mas que, uma vez localizada
intracelularmente, concentrada em grânulos, pode ser visualizada pela fluorescência
da berberina.
Há uma grande semelhança na distribuição de heparina (dos mastócitos)
em moluscos e em vertebrados, em ambos a heparina se concentra em tecidos /
órgãos que estão em contato com o meio ambiente ou que funcionam como barreira
interna contra agentes infecciosas, sugerindo seu envolvimento com mecanismos
alternativos de defesa nos organismos (GOMES; DIETRICH, 1982; NADER et al.,
1988).
Em Anomalocardia brasiliana os mastócitos do manto localizam-se
(SANTOS et al., 2003), esta última é responsável pelo crescimento da valva do
animal, sugerindo o papel dos grânulos (com alto teor de heparina) como uma matriz
química na captação e deposição de cálcio marinho, para formação e crescimento
RESULTADOS E DISCUSSÃO - 41
I III
II IV
I
III
II
IV
FIGURA 11 - MICROGRAFIAS DO CTENÍDEO DE Anomalocardia brasiliana I e II – Berberina; III – HE e IV – AT
RESULTADOS E DISCUSSÃO - 43
4.1.3.ANÁLISE DE FLUORESCÊNCIA DOS ÓRGÃOS SUBMETIDOS
A DESGRANULAÇÃO
Considerando estudos recentes realizados com agentes secretagogos sobre
os mastócitos de molusco (SOUZA, 2003), buscamos avaliar o potencial uso da
berberina como um meio para atestar a eficiência do efeito desgranulante.
Posteriormente à dissecação, os órgãos (mantidos vivos em água do mar)
sofreram tratamento com os desgranulantes composto 48/80 e polimixina B e, em
seguida, foram submetidos às técnicas rotineiras de histologia e à técnica de
fluorescência com berberina. Também foram feitas lâminas para controle dos órgãos
sem a utilização dos compostos desgranulates.
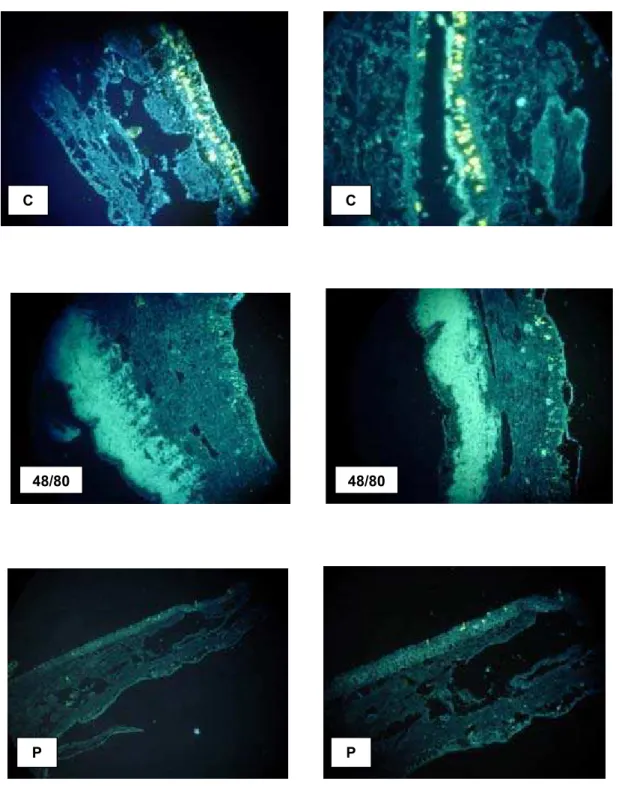
A análise do manto submetido ao composto 48/80 e tratado com berberina
(fig. 12) mostra uma redução no material granular, ou seja, no conteúdo amarelo
brilhante deixando as células com aspecto vacuolado. No ctenídeo (fig 13) ocorre
fato semelhante, sendo que os cortes histológicos usados para tratamento com a
berberina mostram regiões com mastócitos mais espaçados entre si do que aqueles
feitos com as colorações ópticas de referência (Fig 11 ). Com relação à polimixina B,
constatamos da mesma forma que há uma redução nos grânulos tanto no manto
como no ctenídeo quando comparados com o controle (Fig.12 e 13)
A ação do composto 48/80 e da polimixina B sobre os mastócitos de
Anomalocardia brasiliana foi evidente nas colorações de referência, sendo ainda
mais bem visualizado quando usamos a microscopia de fluorescência pela
berberina. A vantagem da microscopia de fluorescência sobre a óptica foi mais
evidente no estudo do ctenídeo, visto que a localização dos seus mastócitos na base
A maior ocorrência de zonas vacuoladas nos mastócitos em comparação
com os resultados obtidos com composto 48/80 sugere que, da mesma forma que
em mastócitos de vertebrados, a intensidade de desgranulação dos mastócitos do
marisco Anomalocardia brasiliana é maior diante do uso do antibiótico sulfato de
polimixina B.
Semelhante ao que ocorre em mastócitos de vertebrados, nota-se um efeito
de desgranulação mais intenso com polimixina B do que o apresentado com o
composto 48/80 no mesmo tecido.
Através dessa técnica pudemos confirmar dados anteriormente
apresentados pelo nosso grupo, que mostrou que os mastócitos do molusco
estudado são susceptíveis às substâncias desgranulantes normalmente empregadas
para o estudo de mastócitos de vertebrados. Esta observação representa um
avanço, ficando evidente a existência de um mecanismo de exocitose, em termos de
sinalização intracelular, capaz de promover a extrusão do conteúdo granular à
semelhança do que ocorre com os seus correspondentes nos mamíferos. O estímulo
que iniciaria a cadeia de sinalização continua incerto. Embora seja óbvio que a
ligação a receptores de imunoglobulinas não esteja presente nesse animal, a
ativação direta por agentes agressores do meio seria uma teoria aceitável, dada a
importância já conhecida dos mastócitos no processo de defesa dos mamíferos.
Nesse caso, pode-se especular que, à semelhança do ocorrido com o sistema
nervoso durante a evolução das espécies, as células do sistema imune primitivo
foram internalizadas do decorrer dos anos para transformar-se no que hoje
RESULTADOS E DISCUSSÃO - 45
C C
48/80 48/80
P P
FIGURA 12 - MICROGRAFIAS DE MANTOS DE A. brasiliana TRATADOS COM DESGRANULANTES
C C
48/80 48/80
P P
FIGURA 13 - MICROGRAFIAS DE CTENÍDEOS DE A. brasiliana TRATADOS COM DESGRANULANTES
CONCLUSÕES - 47
5. CONCLUSÕES
Abaixo, seguem em síntese os pontos mais relevantes:
1 – O fixador utilizado, bem como os passos envolvidos na preparação das
lâminas histológicas, permitiram uma preservação adequada da estrutura tecidual e
do conteúdo granular das células observadas.
2 – O uso da berberina permitiu a visualização adequada dos mastócitos
nos tecidos com um nível de “background” e interferência de fluorescência aceitável.
3 – O molusco estudado apresenta células epiteliais ricas em grânulos que
contêm heparina, sendo então denominados de mastócitos. Essa característica,
evidenciada pela fluorescência amarelo brilhante da berberina, a torna semelhante
ao mastócito de conjuntivo descrito no modelo murino.
4 – Houve uma boa correlação entre os resultados obtidos com
fluorescência e os diversos corantes de referência, sendo que a berberina permitiu
uma melhor delimitação do conteúdo granular nas células e, conseqüentemente, seu
melhor posicionamento em relação ao núcleo.
5 – O uso da berberina permitiu observar que os mastócitos de
Anomalocardia brasiliana, assim como os de vertebrados, são susceptíveis às ações
REFERÊNCIAS
ADAMS-RAY, J.; DAHLSTROM, A.; FUXE, K.; HILLARP, N. A. Mast cells and monoamines. Experientia, v.20, p.80-82, 1964.
AVRAHAM, S.; STEVENS, R.L., NICODEMUS, C.F.; GARTNER, M.C.; AUSTEN, K.F.; WEIS, J.H. - Molecular cloning of cDNA that encodes the peptide core of a mouse mast cell secretory granule proteoglycan and comparing with the analogous rat and human cDNA. Proc. Natl. Acad. Sci. USA 86: 3763,1989.
BENDITT, E. P.; HOLCENBERG, J.; LAGUNOFF, D. The role of serotonin (5-hydroxytryptamine) in mast cells. Ann NY Acad. Sci., v.103, p.179, 1963.
BENDITT, E. P.; WONG, R. L.; ARASE, M.; ROEPER, E. 5-Hydroxytryptamine in mast cells. Proc. Soc. Exp. Biol. Med., v.90, p.303-304, 1955.
BERLIN, G.; ENERBÄCK, L. – Mast Cell Secretion.). Int. Archs Allergy appl. Immun. 73, 256-262, 1984
BLOOM, G. D.; HAEGERMARK, O. -A study on morphological changes and histamine release induced by 48/80 in rat peritoneal mast cell. Exp. Cell. Res., v.40, p.637-654, 1965.
BOFFI, A.V. - Moluscos brasileiros de interesse médico e econômico. FAPESP - Editora HUCITEC, 1979, São Paulo, SP. 182p.
BOURDON, M.A.; SHIGA, M.; RUOSLAHTI, E. -Gene expression of the chondroitin sulfate proteoglycan core protein PG19. Mol. Cell. Biol. 7: 33-40, 1987.
BURKITT,H.G.; YOUNG,B.; HEATH,J.W. – Wheater HIstologia functional.3ed. Rio de Janeiro, Guanabara Koogan 409p.,1994.
CAVALCANTE, M.CM. ALLODI, S., VALENTE, A.P., STRAUS, A.H., TAKAHASHI, H.K., MOURÃO, P.A.S., PAVÃO, M.S.G.- Occurrence of heparin in the invertebrate Styela plicata (tunicata) is restricted to cell layers facing the outside environment. An ancient role in defense? J. Biol.Chem. 275,:36189-36196, 2000.
CHARLES, A.F.; SCOTT, D.A. - Studies on heparin. I. The preparation of heparin. J. Biol. Chem. 102, 425, 1933.
CHARLES, A.F.; SCOTT, D.A. - Studies on heparin. IV. Observations on the chemistry of heparin. Biochem. J. 30, 1927, 1936.
CHIU, H.; LAGUNOFF, D. Histochemical comparison of frog and rat mast cells. J. Histochem.Cytochem, v.19, p.369-375, 1971.
REFERÊNCIAS - 49
COUPLAND, R. E.; HEATH, I. D. Chromaffin cells, mast cells and melanin. II. The chromaffin cells of the liver capsule and gut in ungulates. J. Endocrinol. v.22, p.71-76, 1966.
DANISHEFSKY, I.; STAINER, H.; BELLA, Jr. A.; FRIEDLANDER, A. - Investigations on the chemistry of heparin. VI. Position of the sulfate ester groups. J. Biol. Chem.
244, 1741, 1969.
DIETRICH,C.P; DIETRICH,S.M.C, -Electrophoretic behaviour of acidic mucopolysaccharides in diamine buffers. Anal. Biochem. 70, 645. 1976.
DIETRICH, C.P.; McDUFFIE, N.M.; SAMPAIO, L.O. - Identification of acidic mucopolysaccharides by agarose gel electrophoresis. J. Chromatogr. 130: 299-304, 1977.
DIETRICH, C.P.; NADER, H.B.; PAIVA, J.F.; SANTOS, E.A.; HOLME, K.R.; PERLIN, A.S. - Heparin in mollusks: chemical, enzymatic degradation and 13C and 1H n.m.r. spectroscopical evidence for the maintenance of the structure through evolution. Int. J. Biol. Macromol. 11, 361,1989.
DIETRICH, C.P.; PAIVA, J. F.; MORAES, C. T.; TAKAHASHI, H. K.; PORCIONATTO, M. A.; NADER, H. B. -Isolation and characterization of a heparin with high anticoagulant activity from Anomalocardia brasiliana. Biochim. Biophys.
Acta843: 1-7,1985.
DIETRICH,C.P.; PAIVA, J.F.; CASTRO, R.A.B.; CHAVANTE, S.F.; JESKE, W.; FAREED, J.; GORIN, P.A.J.; MENDES, A.; NADER, H.B. – Structural features and anticoagulant actives of a novel natural low molecular weight heparin from the Penaeus brasiliensis. Biochim. Biophys.Acta 1428: 273-283,1999.
EHRLICH, P. - Beiträge zur theorie und praxis der histologischen färbung. Tese -
University of Leipzig, 1878.
ENERBACK, L. -Mast cell heterogeneity: the evolution of the concept of a specific mucosal mast cell. In BEFUS, A.D.; BIENENSTOCK, J. DENBURG, J.A. Mast Cell Differentiation and Heterogeneity, New York, Raven Press. p.1-26, 1986.
ENERBACK, L.; HAGGENDAL, J. -Uptake and storage of catecholamines in mucosal mast cells of the rat. J. Histochem. Cytochem. v.18, p.803-811, 1970. ENERBÄCK, L. -The mast cells system. In: LANE, D.A.; LINDAHL, U. -Heparin. Chemical and biological properties, clinical applications. London, Edward Arnold, p.97-113 1989.
FALCK, B.; NYSTEDT, T.; ROSENGREN, E.; STENFLO, J. -Dopamine (dihydroxyphenethyl amine) and mast cells in ruminants. Acta Pharmacol. Toxicol.
v.21, p.5-158, 1964.
GALLI, S.J. -Biology of Disease. New insights into ”the ride of mast cells”. Microenviromental regulation of mast cell development and phenotypic hetereogenety.Lab. Invest, v.65, p. 5-33,1990.
GALLI, S. J.; DVORAK, A. M.; DVORAK. H. F. -Basophils and mast cells: Morphologic insights into their biology, secretory patterns, and function. In: ISHIZAKA, K. Mast cell activation and mediator release. Prog. Allergy, 34, Karger, Basel p.1-141. 1984.
GALLI, S.J.; LANTZ, C.S. -Allergy In: Fundamental Immunology. Edited by William E. Paul. Lippincott-Raven Publishers, Philadelphia, PA, 4a ed., p.1127, 1999. GALLI, S. J.; TSAI, M.; WERSHIL, B. K.; TAM S. Y.; COSTA, J. J. Regulation of mouse and human mast cell development survival and function by stem cell factor, the ligand for the c-kit receptor. Int. Arch. Allergy Immunol. V 107, p.51-53, 1995. GOODMAN,; GILMAN.; As bases farmacológicas da terapêutica 9a ed , Mcgraw-Hill interamericanas editores, p.406, 1996.
GOMES, P.B.; DIETRICH, C.P. - Distribution of heparin and other sulfated glycosaminoglycans in vertebrates. Comp. Biochem. Physiol. 73B: 85, 1982
HÄRMA, R.; SUOMALAINEN, P. - Heparinocytes and hibernation in the headge-hog.
Acta physiol. scand. 24: 90-100,1951.
HOVING, P.; LINKER, A. -Glycosaminoglycans in Anodonta californiensis, a freshwater mussel. Biol. Bull. 185: 263-276, 1993.
HOWELL, W.H. - Heparin, an anticoagulant. Am. J. Physiol. 63, 434,1922.
HOWELL, W.H.; HOLT, E. - Two new factors in blood coagulation: heparin and pro-antithrombin.Am. J. Physiol. 47, 328, 1918.
HOWELL, W.H. -The purification of hepatin and its chemical and physilogical reactions.Bull. Johns Hopkins Hosp. 42, 199, 1928.
ISHIZAKA, K. Mast cell activation and mediator release. Prog. Allergy, 34, Karger, Basel p.1-141. 1984.
ISHIZAKA, T.; MITSUI, H.; YANAGIDA, M.; MIURA, T.; DVORAK, A. M. Development ofhuman mast cells from their progenitors. Curr. Opin. Immunol. V.5, n.6, p.937-943, 1993.
JAQUES, L.B. - Heparin and the mast cell. Can. J. Biochem. Physiol. 39: 643-651, 1961.
JOHNSON, A.R.; MORAN, N.C. Selective release of histamine from rat mast cell by compound 48/80 and antigen. J. Physiol., p.453-459, 1969.
REFERÊNCIAS - 51
JORPES, J.E. - The chemistry of heparin. Biochem. J. 29, 1817, 1935.
JUNG,D.W.; YOO,G.S; CHOI,J.K. Detection of DNA in agarose gels using berberine and mordant yellow 3R. Analytical Biochemistry. 272, 254-256, 1999
KATZ, H.R.; AUSTEN, K.F.; CATERSON, B.; STEVENS, R.L. - Secretory granules of heparin-containing rat serosal mast cells also possess highly sulfated chondroitin sulfate proteoglycans. J. Biol. Chem. 261: 13393-13396, 1986.
KITAMURA, Y.; NAGOSHI, J.; ONOUE, H.; KURIU, A. -Regulatory mechanisms of mast cell differentiation. Hum Cell. v.2, n.4, p.363-368, 1989.
KITAMURA, Y.; GO, S.; HATANAKA, S. -Decreased production of mast cells in W/Wv mice and their increase by bone marrow transplantation. Blood, v.52, p.447-452, 1978.
LANE, D.A.; LINDAHL, U. -Heparin. Chemical and biological properties, clinical applications. London, Edward Arnold, p.97-113 1989.
LIMLOMWONGSE, L.; THITHAPANDHA, A.; SOBHON, P. The role of endogenous histamine on gastric acid secretion. Proc. Soc. Exp. Bio. Med., v.142, p.167-176, 1973.
LINDAHL, U.; AXELSSON, O. - Identification of iduronic acid as the major sulfated uronic acid of heparin. J. Biol. Chem. 246: 74, 1971.
McLEAN, J. -The thromboplastic action of cephalin. Amer. J. Physiol. 41: 250, 1916. MEDEIROS, G.F.; MENDES, A.; CASTRO, R.A.B.; BAÚ, E.C.; NADER, H.B; DIETRICH, C.P. – Distribution of sulfated glycosaminoglycans in the animal kingdom: widespread occurrence of heparin-like compounds in invertebrates. Biochim. Biophys. Acta 25039: 1-8, 2000.
MEDEIROS, G.F.; MENDES, A.; CASTRO, R.A.B.; BAÚ, E.C.; NADER, H.B; DIETRICH, C.P. –Distribution of sulfated glycosaminoglycans in the animal kingdom: widespread occurrence of heparin-like compounds in invertebrates. Biochim. Biophys. Acta 25039: 1-8, 2000.
METCALFE, D.D.; BARAM, D.; MEKORI, Y.A. Mast Cells. -Physiological Reviews,
v.77, n.4, p.1033-1078, 1997.
METCALFE, D.D.; MEKORI, Y.A. Activated T lymphocytes induce degranulation and cytokine production by human mast cells following cell-to-cell contact. J. Leukoc. Biol., v.63, p.337-341, 1998.
METZGER, H. The receptor with high affinity for IgE. Immunol. Rev., v.125, p.37-48, 1992.
MOUSLI, M.C.; BRONNER, J.; BOCKAERT, J.; ROUOT, B.; LANDRY, Y. Interaction of substance P, compound 48/80 and mastoparan with D-subunit C-terminal of G-protein.Immunol. Lett. v.25, p.355-358,1990b.
MOUSLI,M.C.; BRONNER, C.; LANDRY, Y.; BOCKAERT, J.; ROUOT, B. Direct activation of GTP- binding regulatory proteins (g-proteins) by substance P and compound 48/80. FEBS Lett. v.259, p.260-262, 1990a.
NADER, H.B.; TAKAHASHI, H.K.; STRAUS, A.H.; DIETRICH, C.P. - Selective distribution of heparin in mammals. Conspicuous presence of heparin in lymphoid tissues.Biochim. Biophys. Acta 627: 40, 1980.
NADER, H.B.; STRAUS, A.H.; TAKAHASHI, H.K.; DIETRICH, C.P. -Selective appearance of heparin in mammalian tissue during development. Biochim. Biophys. Acta 714: 292, 1982.
NADER, H.B.; DIETRICH, C.P. - Natural occurrence and possible biological role of heparin. In: LANE, D.A.; LINDAHL, U. (Eds.) -Heparin: Chemical and biological properties, clinical applications. Edward Arnold Publishers, London, p. 81-86, 1989.
NADER,H.B.; LOPES,C.C.; ROCHA,H.A.O.;SANTOS,E.A.; DIETRICH,C.P. Heparins
And Heparinoids:Occurence, structure and Mechanism of Antithrombotic and Hemorrhagic activities. Current pharmaceutical desing.P 951-966,2004.
NAKANO, T; SONODA, T.; HAYASHI, C.; YAMATODANI, A.; KANAYAMA, Y.; YAMAMURA, T; ASAI, H.; YONEZAWA, T.; KITAMURA, Y.; GALLI, S.J. Fate of bone marrow-derived cultured mast cells after intracutaneous, intraperitoneal, and intravenous transfer into genetically mast cell-deficient W/WV mice. Evidence that cultured mast cells can give rise to both connective tissue type and mucosal mast cells. J. Exp. Med., v.162, p.1025-1043, 1985.
PADAWER, J. -Some studies on the fluorescence of mast cells after paraformaldehyde treatment. Z. Zellforsch, v. 75, p. 178-200, 1966.
PAIVA, J.F.; SANTOS, E.A.; JESKE, W.; FAREED, J.; NADER, H.B.; DIETRICH, C.P. -A comparative study on the mechanism of the anticoagulant action of mollusc and mammalian heparins. Comp. Biochem. Physiol. 111A: 495-499, 1995.
RENNICK, D.; HUNTE, B.; HOLLAND, G.; THOMPSON-SNIPES, L. -Cofactors are essential for stem cell factor-dependent growth and maturation of mast cell progenitors: comparative effects of interleukin-3 (IL-3), IL-4, IL-10, and fibroblasts.
Blood, v.85, n.1, p.57-65, 1995.
RILEY, J. F. -Histamine in tissue mast cells. J. Physiol., v.177, p.72P, 1952.
RIOS, E.C, -Brazilian Marine Mollusks iconography: Rio Grande, Museu oceanográfico, 331p. 91pl.1975.