VALÉRIA FERNANDES DE SOUZA
Administração repetida de baixas doses de reserpina:
um possível modelo para o estudo de déficits
cognitivos e motores associados à Doença de
Parkinson
Tese apresentada à Universidade Federal do Rio Grande do Norte, para obtenção de título de doutor no curso de pós-graduação em Psicobiologia.
II VALÉRIA FERNANDES DE SOUZA
Administração repetida de baixas doses de reserpina: um
possível modelo para o estudo de déficits cognitivos e
motores associados à Doença de Parkinson
Tese apresentada à
Universidade Federal do Rio Grande do Norte, para obtenção de título de doutor no curso de pós-graduação em Psicobiologia.
ORIENTADORA: Profa. Dra. Regina Helena da Silva
III Título: Administração repetida de baixas doses de reserpina: um possível modelo para o estudo de déficits cognitivos e motores associados à Doença de Parkinson
Autor: Valéria Fernandes de Souza
Data da defesa: 15/ 09/ 2011 Banca Examinadora:
___________________________________ Prof. Vanessa Costhek Abílio
Universidade Federal de São Paulo, UNIFESP ___________________________________ Prof. Ângela Maria Ribeiro
Universidade Federal de Minas Gerais, UFMG ___________________________________ Prof. Elaine Cristina Gavioli
Universidade Federal do Rio Grande do Norte, UFRN ___________________________________
Prof John Fontenele Araujo
Universidade Federal do Rio Grande do Norte, RN ___________________________________
Prof. Regina Helena da Silva
IV “O homem não teceu a teia da vida, ele é dela apena um fio. O que ele fizer estará
fazendo para si mesmo. O que ele fizer para si mesmo estará fazendo para a Teia.”
V AGRADECIMENTOS
À Universidade Federal do Rio Grande do Norte pela oportunidade concedida. A minha orientadora, Profa. Regina Helena da Silva, por acreditar e tornar possível a realização desse sonho e por sua amizade.
Aos meus colegas do Laboratório de Estudo de Memória (LEME), pela contribuição nos experimentos e amizade. Em especial, ao Ronaldo, Thieza, Anderson, Alicia e Geison pela colaboração nos experimentos e nas análises dos vídeos.
A colaboração da Profa. Angela Maria Ribeiro (Laboratório de Neurociências e Comportamento, LaNeC/UFMG) na coleta de meus dados, incentivo nas horas difíceis e por sua amizade.
A minha família, em especial minha mãe, pelo seu apoio e amor incondicional que sempre me incentivaram na busca da realização de meus sonhos. Meu pai, que sempre cultivou na minha criação a busca pela curiosidade e estudos, obrigada. Ao meu irmão. A Tula que sempre manteve sua fidelidade e amizade. Aos meus parentes (Tias, Tios, Primos e Primas) pelo reconhecimento do meu esforço, pelo carinho e apoio. Muito obrigada!!!
Aos meus amigos do LaNeC pela troca constante de conhecimento e alegria em trabalhar dentro de um laboratório.
Aos meus amigos e amigas Potiguares que tornaram minha estada em Natal agradável.
VI Gostaria muito de agradecer aos animais que deram suas vidas em prol do meu trabalho de doutoramento e para a melhoria da ciência brasileira.
A todos os momentos difíceis que enfrentei para chegar a conclusão deste trabalho pois eles me ensinaram a buscar soluções, ter força e determinação que servirão como características essenciais para exercer minha profissão. Além disso, a todos os momentos maravilhosos que me deram motivação, alegria e a certeza que tudo passa.
VII SUMÁRIO
Página
1. Introdução... 13
1.1. Apresentação... 14
1.2. Introdução Geral... 14
1.2.1. Doença de Parkinson... 14
1.2.2. Transtornos motores na Doença de Parkinson... 17
1.2.3. Déficits cognitivos na Doença de Parkinson... 22
1.2.4. Sistemas de neurotransmissão na Doença de Parkinson... 24
1.2.5. Estudo da doença de Parkinson em modelos animais... 27
1.2.6. Estresse oxidativo e doença de Parkinson... 35
1.3. Justificativa... 39
1.4. Objetivogeral... 41
1.4.1. Objetivos específicos... 41
2. Experimentos... 42
2.1. Experimento I... 43
2.2. Experimento II... 72
3. Discussão geral e conclusões... 104
4. Referências... 113
VIII Resumo
A doença de Parkinson (DP) é um dos transtornos cerebrais neurodegenerativos mais comuns e se caracteriza primariamente por uma progressiva degeneração dos neurônios dopaminérgicos nigroestriatais. Os sintomas principais dessa doença são aqueles de origem motora (bradicinesia, rigidez, tremor em repouso), porém alterações na cognição, no humor e no sistema sensorial também podem ser observadas.
Modelos animais que tentam mimetizar características clínicas da DP vêm sendo utilizados para compreender as alterações comportamentais e mecanismos neuronais subjacentes ao distúrbio neurofisiológicos dessa doença Contudo, a maioria dos modelos promove um comprometimento motor intenso e imediato, compatível com estágios avançados da doença, invalidando estes estudos quanto à avaliação da natureza progressiva da manifestação sintomatológica (motora ou cognitiva) da DP.
A administração de reserpina (um depletor de monoaminas) em roedores tem sido considerada um modelo animal para o estudo da DP. Recentemente verificamos que a reserpina (em doses menores que as usualmente empregadas para produzir os sintomas motores) promove um déficit de memória em uma tarefa de discriminação aversiva, sem alterar a atividade motora. A partir desse estudo sugeriu-se que a administração desse fármaco em doses baixas pode ser útil para o estudo dos déficits de memória encontrados na DP. Corroborando esse dado, em outro estudo, a administração aguda subcutânea de reserpina, em doses que não afetam a função motora, levou a alterações em memória que envolve contexto emocional enquanto as sem conotação emocional não foram afetadas.
X Abstract
Parkinson's disease (PD) is one of the most common neurodegenerative brain disorders and is characterized primarily by a progressive degeneration of dopaminergic neurons nigroestriatais. The main symptoms of this disease are motor alterations (bradykinesia, rigidity, tremor at rest), which can be highly disabling in advanced stages of the condition. However, there are symptomatic manifestations other than motor impairment, such as changes in cognition, mood and sensory systems.
Animal models that attempt to mimic clinical features of PD have been used to understand the behavioral and neural mechanisms underlying neurophysiological disturbance of this disease. However, most models promote an intense and immediate motor impairment, consistent with advanced stages of the disease, invalidating these studies for the evaluation of its progressive nature.
The administration of reserpine (a monoamine depletor) in rodents has been considered an animal model for studying PD. Recently we found that reserpine (in doses lower than those usually employed to produce the motor symptoms) promotes a memory deficit in an aversive discrimination task, without changing the motor activity. It was suggested that the administration of this drug in low doses can be useful for the study of memory deficits found in PD. Corroborating this data, in another study, acute subcutaneous administration of reserpine, while preserving motor function, led to changes in emotional context-related (but not neutral) memory tasks.
XII Lista de abreviações
ALDH2: adeído desidrogenase mitocondrial
DOPAC: ácido 3-4-dihidroxifenilacetico
DOPAL: 3-4-dihidroxifenilacetaldeido
DP: Doença de Parkinson
DSM-IV: ―Diagnostic and Statistic Manual of Mental Disorders of the American
Psychiatry Association IV‖ 4HNE: 4-hidroxi-2-nonenal
GSH: glutationa O2-: superóxido
OH-: radical hidroxila
6-OHDA: 6-hidroxidopamina MAO-B: Monoamina oxidase B
MAO: monoamina oxidase MDA: malondialdeído
NMDA: N-metil-D-aspartato
NE: norepinefrina NO-:oxido nítrico
MPP+: 1-metil-4-fenil-piridina
MPTP: 1-metil-4-fenil-1,2,3,6-tetrahidropiridina ROS: “oxygen reactive species”
SN: Sistema nervoso
14 1.1. Apresentação
Esta tese foi organizada em formato de artigos científicos. Dessa forma, apresentamos uma introdução geral e, em seguida, os experimentos I e II, estes expostos como manuscritos para submissão. Finalizamos com uma discussão geral e conclusão, onde os resultados obtidos nos experimentos realizados foram unificados.
1.2. Introdução Geral
1.2.1. Doença de Parkinson
A Doença de Parkinson (DP) foi descrita pela primeira vez por James Parkinson em 1817 (2002). Atualmente, é um dos transtornos cerebrais neurodegenerativos mais comuns, atingindo em torno de 1% da população com 65 anos ou mais (Bennett et al. 1996, Mayeux 2003).
15 Huang et al. 2007, Schmitt-Eliassen et al. 2007). Além disso, por ser uma doença de evolução progressiva, dependendo do estágio da doença pode ser observado disfunção autonômica, alterações de personalidade, distúrbios do sono, dificuldade na fala e disfunção sexual (Mayeux 2003, Klochgether 2004).
Classicamente, a maioria dos pesquisadores tem utilizado a idade de 40 anos para classificar os pacientes quanto às manifestações clínicas da DP (Quinn et al. 1987). Quinn et al. (1987) propuseram que casos da DP que se iniciassem entre a idade de 21-40 anos deveriam ser denominados de portadores da ―DP de início precoce‖. Além disso, resultados de estudos com portadores da ―DP de início precoce‖ indicaram uma relação com fatores genéticos relacionados ao risco de desenvolvimento da doença, especialmente se houver um histórico familiar positivo (Quinn et al. 1987, Schrag & Schott 2006). A maioria destes pacientes também apresenta idiopatia de corpos de Lewys (Schrag & Schott 2006). Os pacientes que manifestam os sintomas da DP com 70 anos ou mais são classificados como de inícios tardio (Jankovic et al. 1990).
16 relacionados a déficits cognitivos, depressão, apatia, alucinações podem ser inclusos no subtipo tremor não dominante, associado a psicopatologias que também acompanham distúrbios motores como hipocinesia (movimentos lentos ou ausentes), rigidez, instabilidade postural e distúrbios da marcha. Essas características fisiopatológicas subjacentes aos subtipos indicam possíveis implicações neuropatológicas diferenciadas (Reijnders et al. 2009).
Estudos que enfocam deficits motores e cognitvos na DP apresentam resultados consideravelmente variados (Aarsland et al. (2004, 2007), Borek et al. 2006, Reijnders et al. 2009). Alterações cognitivas que se manifestam antes das disfunções motoras em pacientes com DP são descritos na literatura (Fenelon 1997, Shults 2003). Por outro lado, é comum encontrar a associação de um declínio funcional e rápido das funções motoras com a presença de prejuízos cognitivo que caracteriza um quadro demencial em indivíduos com DP (Aarsland et al. (2004, 2007)). Geralmente, o início do desenvolvimento do quadro demencial pode oscilar do diagnóstico até 10 anos ou mais após detectada a doença. Existem vários fatores preditores do declínio cognitivo, dentre eles podemos destacar os sintomas motores graves, a presença de alucinações, a presença de corpos de Lewys e os distúrbios na fala (Aarsland et al. 2004, Burn et al. 2006). Apesar da heterogeneidade dos pacientes com DP, é encontratado um consenso na literatura quanto à influência dos déficits cognitivos na qualidade de vida destes pacientes (Aarsland et al. (2004, 2007), Borek et al. 2006).
17 como 6-hidroxidopamina (6-OHDA) e 1-metil-4-fenil-1,2,3,6-tetrahidropiridina (MPTP) (Calne 2007, Mayeux 2003). Adicionalmente, estudos sobre as taxas de mortalidade e prevalência da DP mostram que a incidência é maior nos homens do que nas mulheres. As razões para o aumento do risco de homens desenvolverem DP não são conhecidas (Wooten et al. 2004).
1.2.2. Transtornos motores na Doença de Parkinson
Os primeiros sintomas manifestados durante o desenvolvimento da DP podem ser tremor de repouso unilateral no braço ou na perna. Contudo, sintomas como a bradicinesia (lentificação e escassez de movimentos), incapacidade de realizar movimentos (acinesia), membros rígidos, andar e postura inclinados, podem também estar presentes em fases iniciais da doença (Mayeux 2003). Outra dificuldade motora frequentemente relatada por pacientes com DP é a incapacidade de realizar movimentos suaves e coordenados com as mãos, que dificulta o desempenho na escrita e o desenvolvimento de movimentos precisos (Van Gemmert et al. 2001).
18 apresentar uma função intelectual preservada (Hallett & Khoshbin 1980, Klockgether 2004). A presença de bradicinesia nas extremidades superiores manifesta-se como micrografia e, com o processo degenerativo, as pessoas afetadas desenvolvem dificuldade na execução de movimentos finos, como o de abotoar roupas (Klockgether 2004).
O tremor parkinsoniano normalmente manifesta-se durante o repouso e afeta principalmente os membros superiores, podendo também afetar as pernas e, com menos frequência a cabeça. Nos casos típicos de DP, o tremor de repouso possui uma frequência de 4-7 Hz. Este sintoma não é necessariamente incapacitante, mas muitos pacientes sofrem porque o tremor os estigmatiza como portadores da DP (Klockgether 2004).
A rigidez muscular é definida como um aumento da resistência da movimentação passiva em consequência da rigidez da articulação, que se manifesta em toda a amplitude do movimento (Xia et al. 2009). Em pacientes nos quais a rigidez é acompanhada pelo tremor de repouso, um tipo muito característico de resistência pode ser observado e tem sido denominado como rigidez de roda denteada. Relatos subjetivos dos pacientes com rigidez a descrevem como sensações de rigidez e diminuição da capacidade de relaxar os músculos dos membros (Klockgether 2004).
19 O diagnóstico de DP utilizado na clínica geralmente inclui a presença de bradicinesia e pelo menos uma das três características primárias que são: (1) rigidez muscular dos membros; (2) tremor postural ou residual; (3) instabilidade postural ou transtorno postural. Apesar de por vezes presentes, características como demência ou disfunções autonômicas não contemplam os sintomas utilizados para o diagnóstico (Mayeux 2003). Assim sendo, os sintomas motores têm sido ressaltados como os mais importantes transtornos associados com a DP (Klockgether 2004).
Geralmente, os sintomas motores da DP são atribuídos à perda progressiva dos neurônios dopaminérgicos da substância negra, que leva ao comprometimento dos tratos extrapiramidais que controlam movimentos corporais complexos (Grossman 1999, Korczyn 2001, Nieoullon 2002). Entretanto, os mecanismos subjacentes da depleção de dopamina relacionados aos distúrbios motores não estão completamente esclarecidos e continuam sob investigação. Alguns estudos que correlacionam disfunções motoras, dopamina e DP têm sugerido que estes fatores envolvem alterações do funcionamento dos circuitos cortico-estriatais (Antonini et al. 1997, Costa et al. (2004, 2006)).
20 Resultados de estudos post mortem em pacientes com DP suregem que características parkinsonianas diferentes podem ter alterações diferenciadas nos circuitos neuronais. Estes estudos mostram que pacientes com parkinsonismo do tipo acinético-rígido possuem perdas mais significativas de células da porção ventrolateral da substância negra e do locus coeruleus em comparação à pacientes com parkinsonismo com tremor predominante (Paulus & Jellinger 1991, Jellinger 1999).
21 relacionados a danos nas vias dentato-rubro-olivar e a disfunções dopaminérgicas nigro-estriatais.
Um estudo utilizando tomografia por emissão de pósitrons (TEP) com marcadores fluoroso F18, fluorodopa (FDOPA) e raclopride (RACLO) utilizados para estudar o metabolismo da glicose estriatal e de DOPA, e marcação de receptor D2
de dopamina mostraram em seus resultados sintomas motores e atrofia de múltiplos sistemas dopaminérgicos. Este achado indica que a degeneração de sistemas dopaminérgicos pré e pós-sinápticos estriatais é responsável pelas alterações motoras em humanos (Antonini et al. 1997).
Outras evidências do envolvimento do sistema dopaminérgico com as alterações motoras estão no efeito de medicamentos utilizados no tratamento de tais sintomas, os quais aumentam a função dopaminérgica. Estudos têm demonstrado que medicamentos pró-dopaminérgicos (exemplo: L-DOPA, selegelina, entre outros) melhoram a rigidez de pacientes com DP (Benecke et al. 1987, Xia et al. 2009).
22 1.2.3. Déficits cognitivos na Doença de Parkinson
Como escrito no item anterior evidências surgerem que os sintomas motores são devido à perda progressiva dos neurônios dopaminérgicos da substância negra que promovem depleção dos níveis de dopamina estriatal (Johnston et al. 1999, Lindner et al. 1999, Ridley et al. 2006). Contudo, os distúrbios motores podem estar acompanhados também por prejuízos intelectuais que afetam significativamente a qualidade de vida de uma pessoa acometida (Korczyn 2001, Nieoullon 2002, Scherfler et al. 2004, Zgaljardic et al. 2004). Em alguns casos, esses prejuízos cognitivos se manifestam antes das alterações motoras, e sugere-se que estejam envolvidos com circuitos neuronais diferentes (Fenelon 1997, Shults 2003). Além disso, as alterações cognitivas têm sido correlacionadas a disfunções nas projeções das vias dopaminérgicas envolvidas em funções de áreas fronto-corticais, tais como planejamento de ações e a memória operacional (Pillon et al. (1997, 1997a) , Cools et al. 2002).
23 (Perry et al. 2004, Albouy et al. 2008, Ferreira et al. 2008). Finalmente, deve-se ressaltar que embora as disfunções executivas sejam as mais bem estudadas em pacientes com DP, o DSM-IV (―Diagnostic and Statistic Manual of Mental Disorders
of the American Psychiatry Association IV‖) coloca déficits de memória como característica básica da demência associada à DP.
O declínio cognitivo mais acelerado na DP tem sido relacionado a alguns fatores preditivos como idade avançada, ocorrência de alucinações, presença de sintomas motores graves (Aarsland et al. 2004).
24 1.2.4. Sistemas de neurotransmissão na Doença de Parkinson
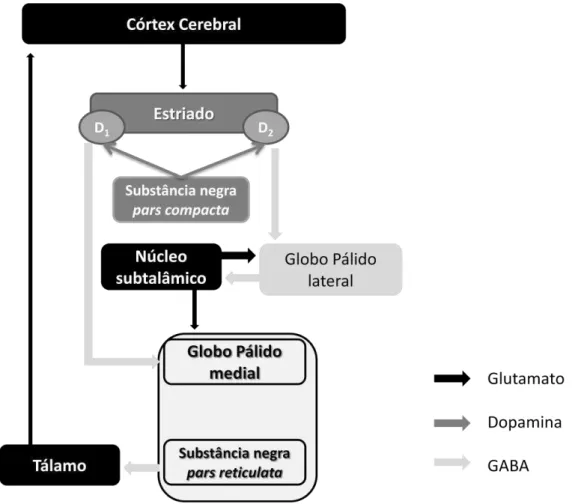
A execução correta dos movimentos depende do circuito dos núcleos da base que processam sinais que chegam do córtex. Assim sendo, alguns pesquisadores desenvolveram um modelo de funcionamento dos núcleos da base a fim de compreender melhor os mecanismos envolvidos na execução dos movimentos na condição normal e em transtornos como a DP (DeLong & Wichmann 2007, Blandini et al. 2000). De acordo com o modelo do circuito dos núcleos da base, a entrada do sinal do circuito seria na substância negra pars compacta que projeta vias dopaminérgicas para o estriado. Os neurônios estriatais expressam receptores dopaminérgicos do tipo D1 e D2 , os quais são distintos funcionalmente. O subgrupo
de neurônios estriatais que expressa receptores D1 projeta vias GABAérgica para a
substância negra pars reticulata e para globo pálido medial, denominada via direta. O subgrupo de neurônios estriatais que expressa receptores D2 projeta vias
Gabaérgicas para o globo pálido lateral, denominada via indireta, que envia projeções GABAérgicas para o núcleo subtalâmico. O núcleo subtalâmico, por sua vez, envia eferências glutamatérgicas para o globo pálido medial e globo pálido lateral. A substância negra pars reticulata e o globo pálido medial formam um núcleo que envia projeções Gabaérgicas (inibitórias) que atingem o tálamo motor que projeções glutamatérgicas para o córtex motor, fechando o circuito (Blandini et al. 2000) (Ver figura 1).
25 dopamina estriatal levaria ao aumento da atividade dos núcleos de saída dos núcleos da base. Dessa forma, este aumento da atividade dos núcleos de saída resultaria no aumento do controle inibitório sobre o tálamo motor e subseqüente redução das saídas glutamatérgicas para o córtex motor (Blandini et al. 2000, Ossowska et al. 2002) (Ver figura 1).
Figura 1: Representação esquemática da organização funcional do circuito dos Núcloes da base de acordo com o modelo clássico das vias diretas e indiretas (Adaptada de Blandini et al. 2000).
26 características neurológicas e psiquiátricas do quadro clínico da DP (Ulas et al. 1994). Os resultados ressaltam uma possível relação de alterações das vias glutamatérgicas que fazem parte do circuito dos núcleos da base com os complexos sintomas parkinsonianos (Lange et al. 1997, Ulas et al. 1994).
Outra possível relação do glutamato com a DP está na hipótese de esse transmissor desencadear um processo gradual de eliminação de células resultante da ativação de programas de apoptose. Uma via seria através da excitotoxidade por estimulação excessiva do receptor NMDA pelo glutamato, que causaria morte celular. Outra via seria através da capacidade do glutamato em induzir a formação de espécies reativas de oxigênio (oxygen reactive species, ROS) que resultariam em danos nas células neuronais (Tan et a. 1998, Blandini et al. 2000).
27 1.2.5. Estudo da doença de Parkinson em modelos animais
Modelos animais vêm sendo utilizados para estudar as alterações causadas pela DP. Alguns modelos tentam mimetizar características clínicas da DP em roedores, a fim de compreender melhor os mecanismos subjacentes ao distúrbio neurofisiológicos dessa doença. Contudo, há muitas controvérsias quanto aos modelos que expressariam a natureza progressiva da DP e dos estágios ―pré-clinico‖ e ―clínico‖.
Nas últimas décadas, alguns modelos famacológicos foram criados e os mais estudados utilizam toxinas tais como 6-hidroxidopamina (6-OHDA) e 1-metil-4-fenil-1,2,3,6-tetrahidropiridina (MPTP). Estas duas substâncias promovem lesões específicas de células do sistema nervoso (SN), promovendo um comprometimento motor intenso e imediato, sem estabelecer um processo gradativo neurodegenerativo (Meredith et al. 2008).
A neurotoxina, 6-OHDA, tem uma estrutura similar à dopamina e à norepinefrina (NE), o que proporciona uma alta afinidade pelos transportadores de catecolaminas das membranas. Dessa forma, essa toxina é transportada para dentro do neurônio, onde promove reações de oxidação e produção de paraquinona e peróxido hidrogênio, ambos com alta toxicidade. A 6-OHDA não atravessa a barreira hematoencefálica, por isso deve ser administrada diretamente no tecido nervoso, onde causa lesões específicas nos neurônios liberadores de dopamina e norepinefrina (Meredith et al. 2008).
28 administrada unilateralmente, que induz o aparecimento de um comportamento esteriotipado de rotação contralateral a lesão (Marin et al. 2007, Blandini et al. 2008), e o hemisfério contralateral é utilizado como controle. As injeções bilaterais da 6-OHDA são evitadas devido à alta taxa de mortalidade dos animais submetidos a este procedimento (Ferro et al. 2005, Blandini et al. 2008), pelo menos nas doses usuais. Outro aspecto interessante é que os efeitos funcionais induzidos pela lesão por 6-OHDA não dependem apenas do total de doses injetadas, mas também do local ou sub-região em que a toxina provoca morte celular.
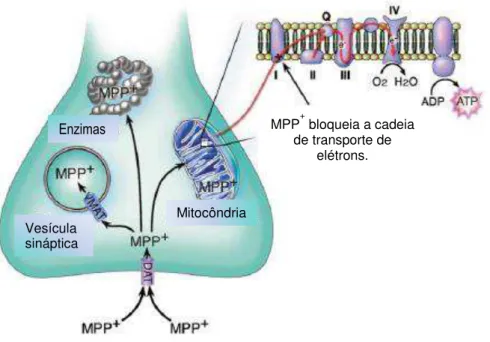
29 permanecer no citosol celular interagindo com as enzimas (Ver figura 2) (Dauer et al. 2003).
Recentemente, alguns estudos têm proposto modelos crônicos com o MPTP em roedores, através da infusão crônica intra-cerebral. Contudo, os estudos crônicos com MPTP têm encontrado algumas limitações, como uma alta mortalidade dos animais, pelo nível de toxidade da substância, e uma alta variabilidade dos sinais que caracterizam a DP. Apesar dessas limitações esse modelo tem evidenciado algumas vantagens, como a presença de alterações mitocondriais e a possibilidade de avaliar processos neuroprotetores em estágios do desenvolvimento dos sinais da DP (Sonsalla et al. 2008, Meredith et al. 2008 a).
Figura 2: Representação esquemática das vias intracelulares do MPP+ dentro das
células dopaminérgicas (Adaptada de Dauer et al. 2003). Mitocôndria
Vesícula sináptica
Enzimas MPP
+
bloqueia a cadeia de transporte de
30 Estudos em animais que expressam 5% do transportados vesicular de monoaminas 2 (VMAT 2) tem sido proposto como um novo modelo para o estudo da DP (Taylor et al. 2009). Os animais deficientes de VMAT 2 apresentam aumento do estresse oxidativo, perda progressiva dos terminais de dopamina assim como acumulação de -sinucleína (Caudle et al. 2007). Além disso, disfunções
monoaminérgicas também são encontradas, os níveis de dopamina, de norepinefrina e de serotonina são severamente diminuídos (Caudle et al. 2007, Taylor et al. 2009). Alterações no sono, gastrointestinais, sintomas de ansiedade e depressão foram observados em resultados de estudos com camundongos deficientes de VMAT 2 (Taylor et al. 2009).
31 única de reserpina não promover uma degeneração neuronal progressiva. Por outro lado, a reserpina pode promover um aumento no estresse oxidativo celular, possivelmente pelo aumento da metabolização da dopamina acumulada no citoplasma pela enzima monoaminoxidase (Abílio et al. 2002). Dessa forma, a administração repetida de doses reduzidas dessa substância poderia ser um melhor modelo para estudar uma doença neurodegenerativa progressiva.
A maioria dos modelos farmacológicos desenvolvidos utiliza avaliações comportamentais que são realizadas para observação de sinais motores e cognitivos semelhantes às características clínicas da DP. As avaliações dos sinais motores são estudadas através de: avaliações da passada (Kirik et al.1998, Chang et al. 1999), parâmetros motores no campo aberto (distância percorrida, frequência em levantar as patas dianteiras, latência em iniciar o movimento, tempo de imobilidade, velocidade) (Peixoto et al. 2005, Perry et al. 2005, Reksidler et al. 2008), tempo no comportamento de catalepsia (Namba et al. 1981, Perry et al. 2005), distância percorrida e velocidade em labirintos (Carvalho et al. 2006), entre outros. As avaliações dos sinais cognitivos são realizadas através de: tarefas do labirinto aquático de Morris (Da Cunha et al. 2002, Bellissimo et al. 2004, Perry et al. 2004), teste do medo condicionado ao contexto (Fernandes et al. 2008), teste da esquiva discriminativa em labirinto em cruz elevado (Carvalho et al. 2006), entre outros.
32 no estriado superior a 80% induz reduções significativas da capacidade dos ratos em ajustar os passos enquanto que redução dopaminérgica estriatal inferior a 80% não provoca déficits detectáveis (Chang et al. 1999).
Ratos com lesão na substância negra, induzida pela MPTP, 24 horas após a administração aguda mostram redução no número de quadrantes percorridos e na freqüência em levantar as patas dianteiras, parâmetros avaliados no campo aberto. Contudo, este efeito não persiste ao longo do tempo, indicando um possível mecanismo de compensação do circuito neuronal (Perry et al. 2005). Outro trabalho com administração repetida de MPTP demonstrou que as perdas de neurônios dopaminérgicos na substância negra compacta foram significativas somente após a primeira aplicação. Porém, as alterações motoras (diminuição distância percorrida e velocidade no campo aberto e aumento do tempo no comportamento de catalepsia) permaneceram estáveis durante o tratamento com três aplicações. Uma provável explicação para a alteração motora não regredir está na consequente diminuição dopaminérgica nas vias estriatais, reafirmada pela diminuição expressiva da enzima tirosina hidroxilase, da primeira aplicação ao último dia de análises (Reksidler et al. 2008).
33 Bellissimo et al. 2004, Perry et al. 2004). Contudo, os estudos de Bellissimo et al. (2004) e Da Cunha et al. (2002) também demonstraram a possibilidade da participação do comprometimento motor, a negligência sensorial e/ou prejuízo da representação espacial contralateral neste prejuízo da tarefa do labirinto aquático. Os resultados destes estudos ainda revelaram que os ratos com lesão pelo MPTP apresentaram perda acentuada de células dopaminérgicas da substância negra (parte compacta), assim como uma significativa depleção da dopamina no estriado (Da Cunha et al. ( 2001, 2002), Bellissimo et al. 2004).
34 mimetizar não somente os aspectos motores, mas também outros sintomas presentes no desenvolvimento da patologia referida.
Carvalho et al. (2006) demonstraram que os efeitos da reserpina induzem um prejuízo no desempenho da memória na esquiva discriminativa em labirinto em cruz elevado, uma tarefa que associa uma estimulação aversiva com um determinado local do labirinto. É importante ressaltar que nesse estudo (Carvalho et al. 2006), foram utilizadas doses de reserpina menores que as usuais (0,1 a 0,5 mg/kg) e que o comprometimento cognitivo foi observado mesmo em doses que não afetaram a função motora. O fato de doses pequenas de reserpina induzirem déficits cognitivos, sem alterarem a atividade motora está de acordo com a observação de que déficits cognitivos podem preceder os sinais motores tanto em pacientes com DP (Cooper et al. 1991, Owen et al. 1992) quanto em modelos animais (Schneider & Pope-Coleman 1995, Carvalho et al. 2006). De fato, evidências sugerem que pequenas perturbações na transmissão dopaminérgica levariam a déficits cognitivos, enquanto que um alto nível de alteração nessa neurotransmissão levaria a déficits motores, os quais poderiam até sobrepor prejuízos cognitivos pré-existentes (Schneider & Pope-Coleman 1995, Pillon et al. 1997, Owen et al. 1998).
35 depleção moderada de monoaminas pode preferencialmente induzir déficits em tarefas que envolvem contextos emocionais (Fernandes et al. 2008). Tomados em conjunto, os estudos até o momento realizados sugerem que o efeito amnésico da reserpina em ratos pode ser uma abordagem comportamental para o estudo dos sintomas cognitivos da DP podendo estar correlacionados com disfunções nas projeções dopaminérgicas envolvidas no controle de funções de áreas fronto-corticais e nigroestriatais. Tais estudos prévios, entretanto, foram realizados com a administração sistêmica (subcutânea) aguda de reserpina, de modo que seria interessante verificar os efeitos da reserpina em um tratamento prolongado, o que poderia mimetizar com mais fidedignidade as etapas relacionadas com déficits cognitivos que surgiriam ao longo do processo neurodegenerativo progressivo da DP.
1.2.6. Estresse oxidativo e doença de Parkinson
O oxigênio (O2) é uma molécula essencial para a vida dos seres vivos,
contudo, é capaz de produzir espécies altamente reativas (radicais livres) denominado ―espécies reativas de oxigênio‖ (reactive oxygen species – ROS), que ocorrem durante a fosforilação oxidativa mitocondrial. Exemplos de radicais livres derivados de reações com o O2 são o superóxido (O2-), o radical hidroxila (OH-) e o
36 Quando o equilíbrio é afetado, favorecendo a produção de ROS, ocorre o estresse oxidativo, o que resulta no acúmulo de moléculas oxidativas que alteram a atividade normal da célula (Bains & Shaw 1997, Tsang & Chung 2009). Todos os componentes celulares são vulneráveis à ação das ROS, mas a membrana é um dos mais atingidos em decorrência da peroxidação lipídica, que gera alterações estruturais e na permeabilidade iônica. Além disso, a peroxidação lipídica pode ser catalizada por íons ferro (Ferreira & Matsubara 1997, Rauhala et al. 1996). Os neurônios são particularmente susceptíveis ao estresse oxidativo, pois podem apresentar altas taxas de atividade metabólicas oxidativas e baixos níveis de enzimas antioxidantes, o que pode resultar na morte celular (Bains & Shaw 1997, Tsang & Chung 2009).
O desequilíbrio entre eventos oxidativos e as defesas antioxidantes pode gerar estresse oxidativo que por sua vez pode induzir a morte neuronal. Dessa forma, este desequilíbrio pode aumentar a produção de ROS e reduzir agentes antioxidantes, como as moléculas de glutationa (GSH) (Tsang & Chung 2009). Nesse sentido, um dos fatores propostos como mecanismo de perdas de células nigroestriatais na DP é o estresse oxidativo neuronal (Beal 2003). Contudo, o estresse oxidativo também é proposto como causa do processo de envelhecimento normal (Cadenas & Davies 2000, Beal 2002), assim como em doenças neurodegenerativas relacionadas ao envelhecimento, como a doença de Alzheimer entre outras (Beal (2000, 2002)).
37 alterações no complexo I da cadeia respiratória mitocondrial (Bains & Shaw 1997, Tsang & Chung 2009). Além disso, o metabolismo de dopamina é uma fonte de ROS nos neurônios nigroestriatais (Tsang & Chung 2009). O processo oxidativo da dopamina é catalizado pela ação da enzima monoamina-oxidase (MAO). A metabolização da dopamina produz quinonas e semi-quinonas que podem atuar como oxidantes, sustentando a hipótese da formação da ROS (Tsang & Chung 2009). Alguns pesquisadores acreditam que o aumento da reciclagem (―turnover‖) da dopamina está associado a eventos oxidativos na célula, através do aumento da produção de peróxido de hidrogênio. O peróxido de hidrogênio é formado durante a degradação da dopamina pela enzima monoamina oxidase (MAO) ou pela oxidação do anel catecol (Ver figura 3). Um produto desta reação é o H2O2 (Ver figura 3) que
pode interagir com metais de transição (por exemplo, o ferro) e formar radicais hidroxilas que causam danos em proteínas, lipídeos e no DNA celular. Essa reação pode ser bloqueada por antioxidantes como a glutationa (Rabinovic & Hastings 1998). Além do H2O2 também é produzido o 3,4-dihidroxifenilacetaldeido (DOPAL)
38 Figura 3: Formação de peróxido de hidrogênio durante a degradação da dopamina por uma reação de oxidação catalisada pela enzima monoamina oxidase. (Adaptado de Spina & Cohen 1989)
O MPTP, depois de ser convertido em MPP+ pela MAO B no cérebro, induz a formação de radicais livres, como o radical hidroxila (OH-). A elevação do nível do radical hidroxila leva a peroxidação lipídica que, como já foi explicado, pode levar à morte celular. Assim sendo, alguns trabalhos têm relacionado o modelo do MPTP como um método interessante de estudar a hipótese do estresse oxidativo e os possíveis mecanismos patofisiológicos da DP (Obata 2002).
Alguns autores sugerem que as lesões dopaminérgicas nigroestriatais induzidas pela 6-OHDA ocorrem pela geração de peróxido de hidrogênio e radicais hidroxilas (Heikkila & Cohen 1971, Riobó et al. 2002).
A reserpina parece exercer um efeito sobre estes eventos oxidativos citados acima. Resultados de estudos demonstraram que a reserpina induz uma queda dos níveis de glutationa do estriado (Abílio et al. 2003, Teixeira et al. 2008), aumento da peroxidação lipídica e da atividade de catalase do estriado (Abílio et al. 2002, Nade et al. 2009) e de glutationa oxidada no estriado e no córtex pré-frontal (Spina & Cohen 1989).
Dessa forma, podemos concluir que existem evidências dos danos do estresse oxidativo em cérebro de pacientes com DP (Beal 2002), e em modelos farmacológicos da doença, tais como o MPTP (Obata, 2002), a 6-OHDA (Riobó et al. 2002) e a reserpina (Bilska et al. 2007, Spina & Cohen 1989). Contudo, a relação
Dopamin a O 2 H2 O
H2O2 NH
39 entre o estresse oxidativo e fatores relacionados à degeneração progressiva, alterações motoras e cognitivas não estão esclarecidos.
Em face do exposto nesta introdução, propomos o estudo da administração repetida de baixas doses de reserpina como um modelo de DP que possa abranger as características comportamentais e bioquímicas citadas acima, em semelhança aos sintomas observados em humanos afetados por esta patologia.
1.3. Justificativa
A maioria dos modelos utilizados para estudar os déficits cognitivos e motores da DP é baseada em efeitos de administrações agudas de substâncias como 6-OHDA e MPTP. Contudo, esses dois modelos acarretaram em perdas específicas e imediatas de células do sistema nervoso (SN) além de um acentuado número de mortes de animais, não apresentando um processo neurodegenerativo progressivo (Ferro et al. 2005, Meredith et al. 2008).
40 animais, a administração aguda subcutânea de reserpina (em doses que não afetam a função motora) levou a alterações de memória que envolve contexto emocional enquanto as sem conotação emocional não foram afetadas. Outro fator importante a ser considerado é que além da dopamina, há evidências da participação de outros sistemas de neurotransmissão, como o GABA e o glutamato na gênese dos sintomas parkinsonianos, tanto em modelos animais quanto em humanos (Bezard et al, 1997; Bianchi et al, 2003; Bonsi et al, 2007; DeLong e Wichmann, 2007). Existe ainda o fator da alteração de mecanismos de neuroproteção a eventos oxidativos induzidos pela reserpina (Bilska et al. 2007, Spina & Cohen 1989), os quais corroboram os danos do estresse oxidativo em cérebro de pacientes com DP (Beal 2002), e em modelos farmacológicos como o MPTP (Obata 2002) e a 6-OHDA (Riobó et al. 2002). Contudo, a relação entre o estresse oxidativo, o envolvimento de sistemas de neurotransmissão não dopaminérgicos, fatores relacionados à degeneração progressiva e alterações motoras e cognitivas na DP ainda não está completamente esclarecida.
41 1.4. Objetivo geral
No presente trabalho, propomos desenvolver um possível modelo farmacológico em ratos que mimetize uma neurodegeneração progressiva semelhante às encontradas em pacientes com DP, através da administração repetida de baixas doses de reserpina.
1.4.1. Objetivos específicos
Avaliamos os efeitos da administração repetida de reserpina (em doses que causariam pouco ou nenhum comprometimento motor agudamente) sobre:
1. O desempenho de ratos em modelos comportamentais de memória ao longo do tratamento;
2. A atividade motora ao longo do tratamento;
3. Os níveis de GABA e glutamato em regiões cerebrais possivelmente relacionadas com o surgimento de déficits cognitivos ou sintomas motores ao final do tratamento;
43 2.1. Experimento I: Artigo científico que será submetido ao periódico Psychology & Neuroscience
BEHAVIORAL AND NEUROCHEMICAL EFFECTS OF
REPEATED ADMINISTRATION OF LOW DOSES OF
RESERPINE: A PROGRESSIVE MODEL FOR THE STUDY OF
PARKINSON’S DISEASE?
Valéria S. Fernandes1, Anderson H.F.F. Leão1, Angela Maria Ribeiro2, Alessandra M. Ribeiro1, Regina H. Silva1,*
1Memory Studies Laboratory, Physiology Department, Federal University of Rio Grande do Norte, Natal, Brazil
2Departamento de Bioquímica e Imunologia, Laboratório de Neurociência
44 Abstract
Parkinson's Disease (PD) has been studied in models that attempt to mimic the neurophysiologic and behavioral changes found in the development of this disease. However, in general, these protocols induce an immediate severe motor impairment, similar to advanced stages of PD. The administration of reserpine (a monoamine depletor) in rodents has been considered a model for studying PD. In this study, repeated treatment with 0.1 and 0.2 mg/kg (but not 0.05 mg/kg) reserpine have induced progressive motor alterations in rats when compared with the vehicle-treated group, as shown by the evaluation of the catalepsy behavior across the treatment. Additionaly, animals repeatedly treated with 0.1 mg/kg reserpine showed concomitant memory impairment when tested in the plus-maze discriminative avoidance task. At the end of the treatment (5 days after the 15th injection) striatal
GABA and gluatamate levels were determined. While no changes were observed for the GABAergic system, a decrease in glutamate striatal concentration was found in 0.1 and 0.2 mg/kg reserpine-treated animals. Thus, repeated treatment with low doses of reserpine appears to be promising as a model of PD, since it induces progressive motor alterations. By the end of the treatment, these motor symptoms were accompanied by cognitive and neurochemical changes. However, more studies are needed to verify if the memory deficits and neurochemical alterations would present a progressive profile as well.
Keywords:
45 1. Introduction
Parkinson's disease (PD) is a progressive neurodegenerative disease in which the ability to perform voluntary movements is gradually lost. The clinical condition of PD includes rigidity, tremor and bradykinesia (slowness of movement) (Klockgether, 2004). However, cognitive changes can also be observed in patients with PD (Aarsland et al., 2004; Mahieux et al., 1998; Verbaan et al., 2007).
Animal models have been used to study the changes caused by PD. Some studies try to mimic the clinical features of PD in rodents in order to better understand the neurophysiological mechanisms underlying the disorder (Meredith et al. 2008). However, the the effectiveness of models regarding the progressive nature of the "preclinical" and "clinical" stages of PD is controversial (Deumens et al., 2002). Indeed, in recent decades some pharmacological animal models of PD have been developed, with the most studied toxins being 6-hydroxydopamine (6-OHDA) and 1-methyl 4-phenyl 1,2,3,6-tetrahydropyridine (MPTP) (Meredith et al., 2008; Schober, 2004). These two models have shown specific loss of cells related to PD in the central nervous system (CNS), although not presenting a neurodegenerative process, instating already an advanced stage of the disease upon administration (Meredith et al., 2008).
46 Recently, lower doses of reserpine have also been found to promote a memory deficit in an aversive discrimination task without any effects on motor activity, suggesting that the administration of this drug in low doses can be useful to study memory deficits found in PD (Carvalho et al., 2006). Similar results were found in a different aversively motivated behavioral model, the contextual fear conditioning (Fernandes et al., 2008). In summary, the data from the literature suggest that acute reserpine is able to induce motor and cognitive alterations similar to those found in PD patients, although in different dose ranges.
47 Considering the importance of an animal model that simulates the progressive nature of the disease, we evaluated the effects of a repeated treatment with low sub-effective doses of reserpine on motor and cognitive behaviors. In addition, we also addressed possible changes in GABAergic and glutamatergic systems as a consequence of this treatment.
2. Methods
2.1. Subjects
Five-month old male Wistar rats (n= 29) were used. All animals were
maintained in groups of four or five per cage, under a 12 h light 12 h dark cycle and
at a constant temperature of 25 1 C, with food and water available ad libitum. The
rats were handled according to Brazilian law procedures for the use of animals in scientific research (Law Number 11.794) and all procedures were approved by the local research ethics committee (final opinion number 149/2008). All efforts were made to minimize animal pain, suffering or discomfort, and to minimize the number of rats used.
2.2. Drug treatment, general procedures and experimental design
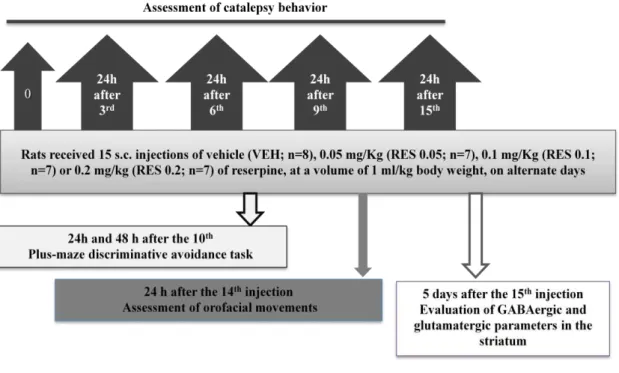
48 acetic acid and water as in the reserpine solution. These solutions were injected subcutaneously (s.c.).
Rats received 15 s.c. injections of vehicle (VEH; n=8), 0.05 mg/Kg (RES 0.05; n=7), 0.1 mg/Kg (RES 0.1; n=7) or 0.2 mg/kg (RES 0.2; n=7) of reserpine, at a volume of 1 ml/kg body weight, on alternate days. During treatment rats went through the following procedures: (1) assessment of catalepsy behavior 24h after the 3rd, 6th, 9th, 12th and 15th injections; (2) plus-maze discriminative avoidance task 24h and 48 h
after the 10th injection; (3) assessment of orofacial movements 24 h after the 14th injection; (4) Contextual fear conditioning 48 and 72 h after the 15th injection; (5)
evaluation of GABAergic and glutamatergic parameters in the striatum 5 days after the 15th injection (Figure 1).
Figure 1: Experimental design
49 behavior and orofacial movements were performed by direct observation (by researchers blind to the treatment). All other behavioral sessions were recorded by a camera placed above the apparatus and the behavioral parameters were registered by an animal video-tracking software (Any maze Stoelting, USA).
All apparatus were washed with a water–alcohol (5%) solution before
behavioral testing to eliminate possible bias due to odors left by previous subjects.
2.3. Apparatus
2.3.1. Catalepsy Test:
The catalepsy was assessed placing the animal‘s front paws on a horizontal bar positioned at 9 cm above the bench surface. The duration of catalepsy, which was defined as an immobile posture, keeping the two front paws on the bar, was measured within a maximum of 180 s.
2.3.2. Plus-maze discriminative avoidance task:
50 applied through a speaker placed over the aversive enclosed arm. In the test session, held 24h later, the rats were again placed in the apparatus for 10 min, without receiving the aversive stimulation, with the lamp and the speaker still present over the aversive arm, but turned off. Distance traveled in the apparatus (used for motor activity evaluation) and time spent in each arm (aversive, non-aversive and open arms) were registered. Percent time in aversive arm (time spent in aversive enclosed arm/time spent in both enclosed arms) and percent time spent in open arms (time spent in open arms/time spent in both open and enclosed arms) considering the whole duration of behavioral sessions were used to evaluate memory and anxiety, respectively (Silva et al., 2000). Percent time spent in the aversive enclosed arm assessed minute by minute across the training and test sessions were used to evaluate learning and extinction of the task, respectively (Ribeiro et al., 2010).
2.3.3. Orofacial movements assessment:
51 2.4. Biochemical analysis: Evaluation of GABA and glutamate levels:
After the animals were sacrificed by decapitation, the brains were quickly removed from the cranial cavity, weighed and dissected according to the stereotactic coordinates provided by Paxinos & Watson (Paxinos & Watson 1997). The sample of striatum was then stored at -80 ° C to achieve the biochemical assays.
Samples of striatum were weighed and homogenized in 15 volumes of methanol: water (85:15 v / v) in automatic homogenizing. Then the homogenate was centrifuged at 4 ° C for 15 minutes at 7800x g (Sorvall RC-5B). The supernatant obtained after centrifugation was collected and kept on ice until subjected to derivatization.
Due to the absence of electroactive or fluorescent characteristics inherent in the amino acid glutamate and GABA, several works have used the technique of pre-column derivatization for the chromatographic separation and identification of these compounds. One of the most widely used derivatising agents is o-phthalaldehyde (OPA), which reacts with primary amines in the presence of thiol and generates electroactive and fluorescent derivatives (Freitas et al. 2009). The derivatization reaction was made by mixing 100 mL of sample, 20 mL of methanolic OPA (5 mg / mL) prepared daily, 75 mL of borate buffer (pH 9.9) and 5 mL of 3-mercaptopropiônico acid (MPA). The resulting solution was stirred and injected into the chromatographic system after 1 minute at room temperature.
52 LC-10. The wavelengths of excitation and emission used were 337 nm and 454 nm, respectively. A reversed phase chromatographic column C18 (150 mm x 4.6 mm ID) and a guard column (E. Merck RT 250-4, ER Darmsdt, Germany) were used in the analysis. The isocratic mobile phase consisted of a 0.05 M solution of sodium acetate, tetrahydrofuran and methanol (50:1:49 v / v), pH 4.0. The mean elution of GABA and glutamate is 8.0 to 3.0 minutes, respectively, the concentrations in µg / g of tissue were calculated using peak areas and their standard curves which was provided by an integrator (R7Ae Shimadzu C-plus) coupled to the chromatographic system (Freitas et al., 2009).
2.5. Statistics
All data were tested for homogeneity of variances (Levene's test) and normality (Kolmogorov-Smirnov test) and parametric tests were performed for all data. Data on the percentage of time spent in the aversive arm (measured every minute, in training and test sessions) and catalepsy behavior across the treatment (24h after the 3rd, 6th, 9th, 12th and 15th injections) were analyzed by analysis of variance (ANOVA) with repeated measures. For catalepsy behavior analysis, between-subject comparisons were held in each timepoint with one-way ANOVA with sequential Bonferroni‘s post hoc. Other data were analyzed by one-way ANOVA
53 3. Results
3.1- Effects of repeated administration of low doses of reserpine on the catalepsy behavior:
Catelpsy behavior results are shown in figure 2. ANOVA with repeated measures revealed time (quantity of injections) [F(5, 125)=22.36; p=0.000],
treatment (reserpine (0.05, 0.1 or 0.2 mg/Kg) or vehicle) [F(3, 25)=16.92; p=0.000]
54 Fig. 2: Effects of repeated administration of low doses of reserpine (RES- 0.05, 0.1 or 0.2 mg/Kg) or vehicle (VEH) on catalepsy behavior before the beginning (basal) and 24h hours after the 3rd, 6th, 9th, 12th and 15th injections. Data are expressed as mean±S.E.M. (s). ANOVA with repeated measures revealed time, treatment and time x treatment interaction effects. *p<0.05 compared to VEH and RES 0.05 group (ANOVA and Bonferroni‘s test).
3.2- Effects of repeated administration of low doses of reserpine on plus-maze discriminative avoidance task
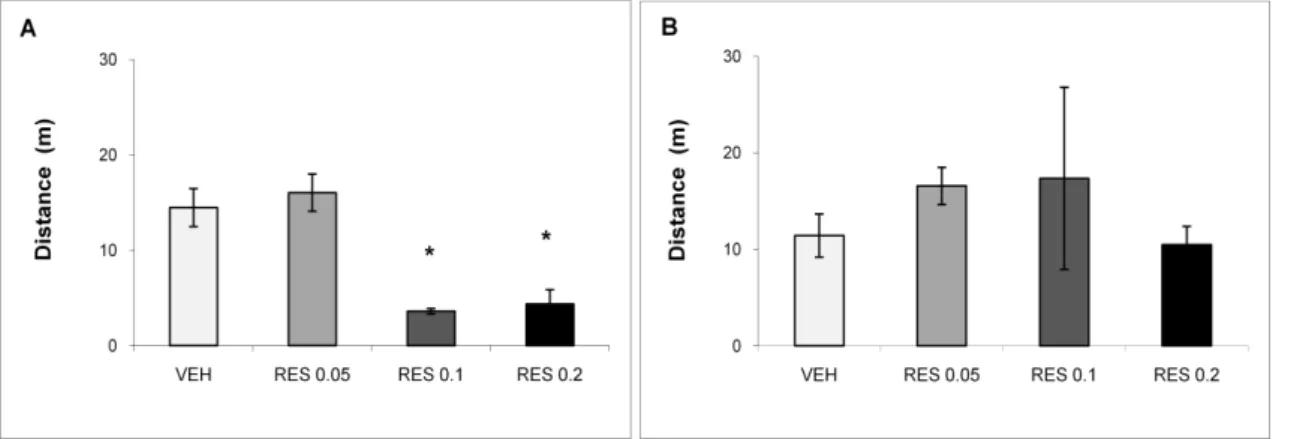
In the training session, we observed a significant effect of treatment in the distance traveled in the apparatus (Figure 3 A; ANOVA, F (3, 25) = 15.98, p = 0.000). The post hoc analysis (Duncan‘s test) revealed that RES 0.1 and 0.2 groups showed decreased motor activity when compared to groups VEH and RES 0.05 in the training session (24 h after administration of the 10th injection). In the test session, 48
0 20 40 60 80 100
0 3rd 6th 9th 12th 15th
C
atal
ep
sy
du
rat
ion
(
s)
55 h after administration of the 10th injection, there was no significant difference between groups in the distance traveled (Fig. 3 B; ANOVA, F (3, 25) = 0.51, p = 0.681).
Fig. 3: Effects of repeated administration of low doses of reserpine (RES - 0.05, 0.1 or 0.2 mg/Kg) or vehicle (VEH) on the plus-maze discriminative avoidance apparatus during training (A) and test (B) sessions performed 24 and 48 h after the 10th injection, respectively. * p <0.05 compared with vehicle and RES 0.05 group (ANOVA and Duncan‘s test)
56 Fig. 4: Effects of repeated administration of low doses of reserpine (RES - 0.05, 0.1 or 0.2 mg/Kg) or vehicle (VEH) on percent time in the open arms (%TO) of the plus-maze discriminative avoidance apparatus during training (A) and test (B) sessions, performed 24 and 48 h after the 10th injection, respectively. * p <0.05 compared with all other groups (ANOVA and Duncan‘s test)
Regarding the percent time in the aversive arm, we found no significant effects when the whole training session duration was considered for analysis (Figure 5 A, ANOVA, F (3, 25) = 1.99, p = 0. 142). When the same analysis was applied to the test session, we found a significant effect of treatment for percentage of time in the aversive arm. The post hoc analysis (Duncan test) showed that RES 0.1 group showed increased aversive arm exploration when compared with groups VEH and RES 0.05 (Figure 5 B, ANOVA, F (3, 25) = 3.25, p = 0. 039).
59 (C) and test (D) sessions, performed 24 and 48 h after the 10th injection, respectively. ANOVA with repeated measures revealed time (minutes) effect, in training session, and time x treatment interaction effects, in training and test sessions (C and D)* p <0.05 compared with vehicle and RES 0.05 group (ANOVA and Duncan‘s test)
3.3- Effects of repeated administration of low doses of reserpine on orofacial movements
61 Figure 6: Effects of repeated administration of low doses of reserpine (RES - 0.05, 0.1 or 0.2 mg/Kg) or vehicle (VEH) on orofacial movements 24 h after the 14th
subcutaneous injection. Data are expressed as the mean±S.E.M. of the number of vacuous chewing movements (A), the duration of facial twitching (B) and the number of tongue protrusions (C). * p <0.05 compared with vehicle group and RES 0.05 group, # p <0.05 compared with RES 0.1 group (ANOVA and Duncan‘s test).
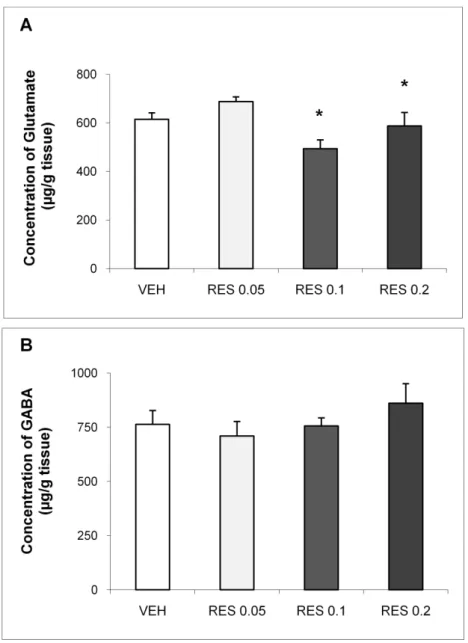
3.4- Effects of repeated administration of low doses of reserpine on GABA and glutamate striatal levels
62
63 4. Discussion
This study evaluated the effect of repeated treatment with low doses of reserpine on motor and cognitive parameters. The results revealed that repeated treatment with 0.05 mg/kg of reserpine did not change the performance of cognitive and motor tasks or in the concentrations of glutamate and GABA in the striatum. On the other hand, the results obtained by repeated treatment with higher doses of reserpine (RES 0.1 and 0.2 mg / kg) showed changes in the performance of animals on contextual fear conditioning and plus-maze discriminative avoidance behavior. More importantly, repeated treatment with 0.1 and 0.2 mg/kg of reserpine showed a progressive onset of motor alterations, as shown by increased on catalepsy behavior from the 9th injection onwards (Fig. 2), decreased distance traveled in the discriminative avoidance apparatus 24 h after the 10th injection (Fig. 3A) and
increase in orofacial movements 24 h after the 14th injection (Fig 6 A, B and C). We also found a significant decrease of striatal glutamate in levels in both groups RES 0.1 and 0.2 five days after the 15th injection (Fig. 7A).
64 repeated administration of 0.1 and 0.2 mg/kg reserpine showed both kinds of alterations (increased catalepsy behavior - Fig. 2; decreased distance traveled in the plus-maze discriminative avoidance apparatus- Fig. 3A). Previous studies have demonstrated these effects of reserpine on catalepsy behavior and locomotor activity. However, in these studies, one or two injections of considerably higher doses (1.0 or 5.0 mg / kg) were administred (Shiozaki et al., 1999; Dutra et al., 2002) to produce catalepsy and hipolocomotion. Therefore, the results found in the present work suggest that the alterations observed during treatment could indicate progressive features of those signs.
65 evidence that orofacial movements alterations co-exist with other kinds of motor changes, including parkinsonism (Harten et al., 1997). On the other hand, a study of specific dopamine lesions in the ventrolateral striatum in rats showed oral motor disorders in the absence of locomotor deficits (Jicha et al., 1991). Thus, different changes in the dopaminergic system can cause various motor signs showing that it is unclear which is the neurochemical mechanism underlying the simultaneous onset of orofacial dyskinesia and other motor alterations.
Besides evaluating memory, we used the plus maze discriminative avoidance task (performed after the 10th injection) to assess learning, memory, anxiety and
motor behavior, since it has been shown that these evaluations can be performed concomitantly, and by different parameters, in this paradigm (Silva et al., 2002; Silva et al., 2000). In the training session, we observed that RES 0.1 and 0.2 groups showed a decrease in distance traveled in the maze (Fig. 3A). The possibility that this motor impairment could have interfered with the acquisition of the task should be considered, since the animals have to enter the aversive arm during training to learn the assossiation with the aversive stimuli. However, the RES 0.1 animals did explored the aversive enclosed arm in the first three minutes of the session, gradually avoing this arm across the training, indicating they have learned the task (as shown by the evaluation of behavior minute by minute throughout the training session in Fig 5C). On the other hand, the animals from RES 0.2 group almost did not enter the aversive arm during the training session. Thus, these results suggest that the RES 0.2 group had an impairment in the acquisition of the task due to the motor deficit.
66 with 0.2 mg/kg reserpine presented increased percent time in the open arms (Fig 4B). This result would usually indicate changes in anxiety-like behavior. However, the severe motor impairment presented by this group at this point of the treatment could be the reason of this increase. Indeed, the observation of individual data of this parameter (data not shown) revealed that most animals minimally advanced from the central platform to one of the open arms and remained there. The other alteration induced by reserpine treatment was the increase in percent time in the aversive enclosed arm, specifically at 0.1 mg/kg (Fig. 5C). In this respect, we found that these animals showed motor deficits during the acquisition of the task, which could jeopardize an interpretation related to the cognitive aspect of animal behavior in the test session. However, as mentioned before, the animals in this group did learn the task, so the increased aversive arm exploration in the test session is probably reflects a retrieval deficit. Nevertheless, it would be interesting to verify if reserpine would induce cognitive impairments earlier during treatment, when the motor impairment would be absent or mild.
67 Parkinson's disease (McNeill et al., 1988; Ingham et al., 1998; Dunah et al., 2000). On the other hand, no alterations were found in GABA striatal levels after treatment, corroborating reports that show absence of alterations in the striatal GABAergic system in humans with PD (Gerlach et al., 1996).
In summary, we observed motor alterations during repeated treatment with 0.1 and 0.2 mg/kg reserpine consistent with a progressive development of motor impairment. The RES 0.1 group showed a concomitant cognitive impairment, although the possible progressive nature of this alteration remains to be investigated. Finally, motor changes (observed in tests of catalepsy) were accompanied by a decreased level of glutamate (but not GABA) in the striatum, which is consistent with neurochemical changes previously shown in animal models and in patients with PD (see above). Thus, although further investigation is undoubtedly necessary, repeated treatment with low doses of reserpine appears to be a promising animal model to study the progressive motor changes of PD.
5. Acknowledgments
68 6. References
Aarsland, D., Andersen K., Larsen, J.P., Perry, R., Wentzel-Larsen, T., Lolk, A. & Kragh-Sorensen, P. (2004). The Rate of Cognitive Decline in Parkinson Disease. Arch Neurol, 61, 1906-1911.
Abílio, V.C., Araujo, C.C.S., Bergamo, M., Calvente, P.R.V. & D‘Almeida, V. de A.R.R. (2003). Vitamin E attenuates reserpine-induced oral dyskinesia and striatal gssg/gsh ratio enhancement in rats. Prog Neuro- Psychopharmacol Biol Psychiat, 27,109–14.
Abílio, V.C., Silva, R.H., Carvalho, R.C., Grassl, C., Calzavara, M.B. & Registro, S. (2004). Important role of striatal catalase in aging- and reserpine-induced oral dyskinesia. Neuropharmacology, 47, 263–72.
Alves, C.S.D, Andreatini, R., da Cunha, C., Tufik, S. & Vital, M.A.B.F. (2000). Phosphatidylserine reserves reserpine-induced amnesia. European Journal of Pharmacology, 404, 161-167.
Andreassen, O.A. & Jorgensen, H.A. (2000). Neurotoxicity associated with neuroleptic-induced oral dyskinesias in rats Implications for tardive dyskinesia? Progress in Neurobiology, 61, 525-541.
Beal, M.F. (2003). Mitochondria, Oxidative damage, and Inflammation in Parkinson's disease. Ann. N. Y. Acad. Sci., 991, 120-131.
Bezard, E., Boraud, T., Bioulac, B. & Gross, C.E. (1997). Compensatory effectsof glutamatergic inputs to the substantia nigra pars compacta in experimental parkinsonism. Neuroscience, 81, 399–404.
Bianchi, L., Galeffi, F., Bolam, J.P. & Corte, D.L. (2003). The effect of 6-hydroxydopamine lesions on the relase of amino acids in the direct and indirect pathways of the basal ganglia: a dual microdialysis probe analysis. European Journal of Neuroscience, 18, 856-868.
Blandini, F., Nappi, G., Tassorelli, C. & Martignoni, E. (2000). Functional changes of the basal ganglia circuitry in Parkinson's disease. Progress in Neurobiology, 62, 63-88.
Bonsi, P., Cuomo, D., Picconi, B., Sciamanna, G., Tscherter, A., Tolu, M., Bernardi, G., Calabresi, P. & Pisani, A. (2007). Striatal metabotropic glutamate receptors as a target for pharmacotherapy in Parkinson‘s disease. Amino Acids, 32, 189– 195.
Capitelli, C., Sereniki, A., Lima, M.M.S., Reksidler, A.B., Tufik, S. & Vital, M.A.B.F. (2008). Melatonin attenuates tyrosine hydroxylase loss and hypolocomotion in MPTP-lesioned rats. European Journal of Pharmacology, 594, 101–108.
Carvalho, R.C., Patti, C.C., Takatsu-Coleman, A.L., Kameda, S.R., Souza, C.F., Garcez-do-Carmo, L. & Abílio, V.C. (2006). Effects of reserpina on the pluz-maze discriminative avoidance task: Dissociation between memory and motor impairments. Brain Research, 1122, 176-183.
Colpaert, F.C. (1987). Pharmacological characteristics of tremor, rigidity and hypokinesia induced by reserpine in rat. Neuropharmacology, 26, 1431-1440.
Corona, J.C., Gimenez-Cassina, A., Lim, F. & Díaz-Nido, J. (2010). Hexokinase II Gene Transfer Protects against Neurodegeneration in the Rotenone and MPTP
Mouse Models of Parkinson‘s Disease. Journal of Neuroscience Research, 88,