www.jped.com.br
ARTIGO
ORIGINAL
Evaluation
of
the
Western
blotting
method
for
the
diagnosis
of
congenital
toxoplasmosis
夽
,
夽夽
Jaqueline
Dario
Capobiango
a,∗,
Thaís
Cabral
Monica
b,
Fernanda
Pinto
Ferreira
c,
Regina
Mitsuka-Breganó
d,
Italmar
Teodorico
Navarro
d,
João
Luis
Garcia
de
Edna
Maria
Vissoci
Reiche
eaUniversidadeEstadualdeLondrina(UEL),CentrodeCiênciasdaSaúde,DepartamentodePediatriaeCirurgiaPediátrica,
Londrina,PR,Brasil
bUniversidadeEstadualdeLondrina(UEL),CentrodeCiênciasAgrárias,ProgramadePós-graduac¸ãoemCiênciaAnimal,
Londrina,PR,Brasil
cUniversidadeEstadualdeLondrina(UEL),DepartamentodeMedicinaVeterináriaPreventiva,LaboratóriodeZoonoses
eSaúdePública,Londrina,PR,Brasil
dUniversidadeEstadualdeLondrina(UEL),CentrodeCiênciasAgrárias,DepartamentodeMedicinaVeterináriaPreventiva,
Londrina,PR,Brasil
eUniversidadeEstadualdeLondrina(UEL),DepartamentodePatologia,AnálisesClínicaseToxicológicas,Londrina,PR,Brasil
Recebidoem13deoutubrode2015;aceitoem16defevereirode2016
KEYWORDS Congenital Toxoplasmosis; WesternBlotting; Diagnosis; Serology
Abstract
Objective: ToevaluatetheWesternblottingmethodforthedetectionofIgGanti-Toxoplasma gondii(T.gondii)(IgG-WB)intheserumofchildrenwithsuspectedcongenitaltoxoplasmosis.
Methods: Weaccompanied 47 mothers with acquiredtoxoplasmosis inpregnancy and their children,betweenJuneof2011andJuneof2014.TheIgG-WBwasdoneinhouseandthetest wasconsideredpositive ifthechildhadantibodiesthatrecognizedatleastonebandonIgG blotsdifferentfromthemother’sorwithgreaterintensitythanthecorrespondingmaternal band,duringthefirstthreemonthsoflife.
Results: 15children(15.1%)metthecriteriaforcongenitaltoxoplasmosisand32(32.3%)had the diagnosis excluded. The symptomswere observed in12 (80.0%)children and themost frequentwerecerebralcalcificationin9(60.0%),chorioretinitisin8(53.3%),andhydrocephalus in4(26.6%).IgMantibodiesanti-T.gondiidetectedbychemiluminescence(CL)werefoundin 6(40.0%)childrenandthepolymerasechainreaction(PCR)fordetectionofT.gondiiDNAwas positivein5of7performed(71.4%).ThesensitivityofIgG-WBwasof60.0%[95%confidence interval(CI)32.3---83.7%]andspecificity43.7%(95%CI26.7---62.3%).ThesensitivityofIgG-WB
DOIserefereaoartigo:
http://dx.doi.org/10.1016/j.jped.2016.02.014
夽 Comocitaresteartigo:CapobiangoJD,MonicaTC,FerreiraFP,Mitsuka-BreganóR,NavarroIT,GarciaJL,etal.EvaluationoftheWestern
blottingmethodforthediagnosisofcongenitaltoxoplasmosis.JPediatr(RioJ).2016;92:616---23.
夽夽EstudofeitonaUniversidadeEstadualdeLondrina,Londrina,PR,Brasil.
∗Autorparacorrespondência.
E-mail:jaquedc@uel.br(J.D.Capobiango).
increasedto 76.0and89.1% when associated to theresearchofIgM anti-T. gondiior PCR, respectively.
Conclusions: TheIgG-WBshowedgreatersensitivitythanthedetectionofIgManti-T.gondii; therefore,itcanbeusedforthediagnosisofcongenitaltoxoplasmosisinassociationwithother congenitalinfectionmarkers.
©2016PublishedbyElsevierEditoraLtda.onbehalfofSociedadeBrasileiradePediatria.Thisis anopenaccessarticleundertheCCBY-NC-NDlicense(http://creativecommons.org/licenses/ by-nc-nd/4.0/).
PALAVRAS-CHAVE Toxoplasmose Congênita; Westernblotting; Diagnóstico; Sorologia
Avaliac¸ãodométodoWesternBlottingparadiagnósticodetoxoplasmosecongênita
Resumo
Objetivo: Avaliar o método Western Blotting para detecc¸ão de IgG anti-Toxoplasma gondii
(T.gondii)(IgG-WB)nosorodecrianc¸ascomsuspeitadetoxoplasmosecongênita.
Métodos: Acompanhamos47mãescomtoxoplasmoseadquiridanagravidezeseusfilhos,entre junho de2011ejunho de2014. OIgG-WBfoi feitointernamente eoteste foiconsiderado positivo quando acrianc¸a apresentava anticorpos quereconheciam pelomenos uma banda nasmanchasdeIgGdiferentedasbandasdamãeoucommaiorintensidadedoqueabanda maternacorrespondente,duranteosprimeiros3mesesdevida.
Resultados: Atenderam aos critérios para diagnóstico de toxoplasmose congênita 15 crianc¸as(15,1%)e32(32,3%)tiveramodiagnósticoexcluído.Ossintomasforamobservadosem 12crianc¸as(80%)eosmaisfrequentesforamcalcificac¸ãocerebralemnove(60%),coriorretinite emoito(53,3%)ehidrocefaliaemquatro(26,6%).OsanticorposIgManti-T.gondiidetectados porquimiluminescência(QL)foramencontradosemseiscrianc¸as(40%)eareac¸ãoemcadeia dapolimerase(RCP)paradetecc¸ãodoDNAdeT.gondiifoipositivaemcincodesetereac¸ões (71,4%).AsensibilidadedoIgG-WBfoide60%[intervalodeconfianc¸a(IC)de95%,32,3a83,7%] eaespecificidadefoide43,7%(ICde95%,26,7a62,3%).AsensibilidadedoIgG-WBaumentou para76e89,1%quandorelacionadaàpesquisadeIgManti-T.gondiiouàRCP,respectivamente.
Conclusões: OIgG-WBmostroumaiorsensibilidadedoqueadetecc¸ãodeIgManti-T.gondii; portanto, podeserusadoparaodiagnóstico detoxoplasmosecongênitaemassociac¸ãocom outrosmarcadoresdeinfecc¸ãocongênita.
©2016PublicadoporElsevierEditoraLtda.emnomedeSociedadeBrasileiradePediatria.Este ´
eumartigoOpenAccesssobumalicenc¸aCCBY-NC-ND(http://creativecommons.org/licenses/ by-nc-nd/4.0/).
Introduc
¸ão
Amaioriadascrianc¸ascomtoxoplasmosecongênita(TC)não demonstrasinaisousintomasnonascimento.Aindaassim, háumriscodedesenvolversequelastardias,principalmente comprometimentooculareneurológico.1
Todas as crianc¸as cujas mães tiveram toxoplasmose aguda no curso da gravidez são consideradas suspeitas; portanto, devemser submetidasa umainvestigac¸ão soro-lógicacomdetecc¸ão deanticorposanti-Toxoplasmagondii
(T.gondii).1,2
Contudo, um diagnóstico sorológico que confirme a infecc¸ão por T. gondii por meio da detecc¸ão de anticor-pos específicos IgMe/ou IgA contrao parasitanão ocorre emtodososrecém-nascidos.1,3---5Portanto,osanticorposIgG contra o T. gondii em amostras de soro em série devem seranalisadose acrianc¸adevecontinuarsob acompanha-mentoambulatorial,quepodelevarmesesatéadefinic¸ão dodiagnóstico.1,6
Emumfetoinfectado,osanticorposIgGeIgMproduzidos contraos determinantesantigênicos deT. gondii poderão diferirdosanticorposIgGeIgManti-T.gondiidetectadosno soromaterno,oquesugereumaneossíntesedeanticorpos específicos. Assim, crianc¸as com TC com não reatividade em testes convencionais para detecc¸ão de IgM foram
diagnosticadas nos primeiros meses de vida por meio do métodoWesternBlot(WB).7---9
Existe a necessidade de um diagnóstico precoce e rápidocomummétododebaixacomplexidadequepermita que os laboratórios de referência em toxoplasmose dife-renciem os resultados duvidosos obtidos com os métodos sorológicos convencionais de rotina, como imunofluo-rescência indireta (IFI), ensaio imunossorvente ligado a enzima (Elisa) e imunoensaio de micropartículas com quimiluminescência(QL).
O objetivo desteestudo foi avaliar o métodoWB para detecc¸ãodeanticorposIgGanti-T.gondii(IgG-WB)nosoro dacrianc¸a e de sua mãe com toxoplasmose adquirida na gravidezparaajudarnodiagnósticoprecocedeTC.
Métodos
Indivíduos
o cuidado pré-natal. As amostras de sangue dos pares crianc¸a/mãeforamcoletadassimultaneamentedurante os primeiros3mesesdevidadacrianc¸aearmazenadasa---20◦C paraoWB.Ogrupodecontroleconsistiaemcrianc¸ascujas mãesmostraram suspeita detoxoplasmose agudadurante agravidez, masnãoatendiam aoscritérios para TC.2,10,11 Nesseperíodo,47crianc¸asesuasmãesforammonitoradas. Dessas, 15 (15,1%) crianc¸as foram diagnosticadas com TC eem 32(32,3%)essediagnósticofoi excluído.As grávidas receberamespiramicinaousulfadiazinamaispirimetamina e ácido folínico atéo nascimento dacrianc¸a. As crianc¸as comsuspeitadeinfecc¸ãoreceberamsulfadiazinamais piri-metaminaeácidofolínicoatéadefinic¸ãododiagnóstico.
Critériosdediagnósticoemcrianc¸as
ConsideramosaTCquandoacrianc¸aapresentouelevac¸ãode títulosespecíficosdeIgGanti-T.gondiiemamostras sequen-ciaisnosprimeirosmesesdesuavidae/ouapersistênciade títulosdeIgGanti-T.gondiiapós12mesesdevidae/ou reati-vidadeparaIgManti-T.gondiie/oucoriorretinitee/oulesão dosistemanervosocentral(SNC)comreatividadeparaIgG e/oupositividadeparaoDNAdeT.gondiicomreac¸ãoem cadeiadapolimerase(RCP).2,10,11
Testesorológicoparadetecc¸ãodeIgMeIgG
anti-T.gondii
Os testes sorológicos durante o cuidado pré-natal e em amostrasdecrianc¸as foramfeitos pormétodos laboratori-aisderotinaconvencionais.OsanticorposIgGanti-T.gondii foramdeterminadosporimunofluorescênciaindireta(IFI)12 (Immunoblot, Biolab-Mérieux, Rio de Janeiro, RJ, Brasil), comT. gondiiobtidos do fluidoascéticode ratos infecta-dos,equimioluminescência(QL)(Architect,SistemaAbbott, Wiesbaden, Alemanha) com antígenos recombinantes de
T.gondiip30(SAG1)ep35(GRA8).OsanticorposIgManti-T. gondii tambémforam detectados com QL (Architect, Sis-tema Abbott,Wiesbaden, Alemanha) com antígeno p30 e lisadototaldeT.gondii.
AntígenosdeT.gondii
Cinco ratas albinas entre 45 e 60 dias e entre 25 e 40g foram usadas na obtenc¸ão de taquizoítos da cepaRH de T.gondii. Osanimaisforam inoculadospelavia intraperi-toneal com umasuspensão de taquizoítos vivos (105/mL) em uma soluc¸ão salina estéril. O exsudato foi obtido 48horasapósainoculac¸ãopormeiodalavagemdacavidade peritonealcom3mLdesoluc¸ãosalinaestéril.Asamostras passaramporumaagulha27Gpararuptura dascélulasdo hospedeiro.Então,foram centrifugadase osedimento foi padronizadoa109taquizoítos/mLpormeiodacontagemem umacâmaradeNeubauer.13
MétodoIgG-Westernblotting
AsproteínasdeT.gondiiaseremusadasnoIgG-WBforam quantificadascom o método deLowry et al.14 e o gelde poliacrilamida12%foiusadonaseparac¸ãoeletroforéticade
proteínas com a transferência subsequente das proteínas paraumamembranadenitrocelulose (iBlot® Gel Transfer System,Califórnia,EUA).Opapeldenitrocelulosefoi man-chadocomPonceaue,apóslavagemcomáguadestilada,as tirasdenitroceluloseforamcortadasebloqueadascomleite desnatado a 5% mais Tween® salina tamponada com Tris (TBS)(Sigma-Aldrich,MO,EUA).Posteriormente,lavamosas tirascomTBSeleitedesnatadoa5%e,então,adicionamos o soro do paciente diluído em Tween TBS (Sigma-Aldrich, MO,EUA) e leite desnatadoa 5%, lavamose adicionamos conjugadoIgGanti-humano(Invitrogen,LifeTechnologies, CA,EUA)diluídoemTweenTBSeleitedesnatadoa5%.Após lavagensadicionais, adicionamos o substratocromogênico diaminobenzidina (DAB) a 0,2% (Acrös Organics, Thermo Fisher Scientific, Geel, Bélgica) e peróxidode hidrogênio (100L).Quandoasbandasforamvisualizadas,areac¸ãofoi
interrompidacomáguadestilada.Asamostrasdecontrole positivoenegativodeanti-T.gondiiforamincluídasemcada teste.
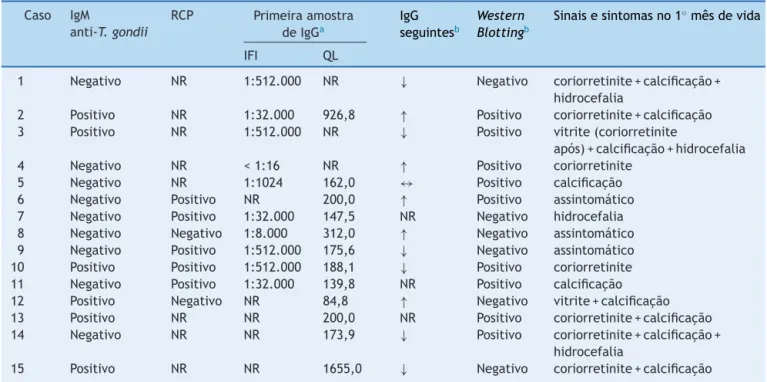
O teste foi considerado positivo no caso de a crianc¸a terproduzidoanticorposquereconheceramnomínimouma banda deproteínas diferentedamãeoucommaior inten-sidadedoqueabanda maternacorrespondente(fig.1),o que caracterizou a neossíntese de anticorpos IgG anti-T. gondii.15---18 Paracontrolar asubjetividadedaleitura, dois observadores independentes leram os padrões do IgG-WB àscegase semoconhecimentodos resultadossorológicos anterioresdostestesconvencionais;houveconcordânciaem 100%dosresultados.
A especificidade do método IgG-WB foi determinada com 26amostrasséricas obtidasdeindivíduos soronegati-vosparatoxoplasmose(anticorposIgGeIgManti-T.gondii
nãoreativoscom QL)ecomsororreatividade aanticorpos comrelac¸ãoaoutrospatógenos,comoTreponemapallidum
(n=5), Trypanosoma cruzi (n=5), Leishmania spp (n=2),
Paracoccidioides brasilienses (n=5) ou sororreatividade a marcadoressorológicosdedoenc¸asautoimunes,como anti-corposantinucleares(n=5)eanticorposanti-DNAdecadeia dupla(n=4).
Usodareac¸ãoemcadeiadapolimerasepara
detecc¸ãodoDNAdeT.gondii
O DNA foi extraído de células sanguíneas periféricas de crianc¸as, coletado com o etilenodiaminotetracético (EDTA)como anticoagulante,atétrêsmesesapós o nasci-mento, comokitEasyPrepDNAMiniI(EasyGen,Favorgen Biotech, Áustria). A amplificac¸ão do DNA de T. gondii foi feita com o método descrito por Homan et al.19 Os Primers Tox4 (CGCTGCAGGGAGGAAGACGAAAGTTG) e Tox5 (CGCTGCAGACACAGTGCATCTGGATT) foram usados para amplificac¸ão deum fragmento de529 paresde base (pb) (GenBankn◦ AFI46527)doDNAdeT.gondii.ARCPfoifeita emumvolumefinalde22,5L,com2,5LdeDNAextraído
da amostra; 1L de 1mM para cada primer, 100mM de
desoxirribonucleotídeosfosfatados(dNTP)(Invitrogen,Life Technologies,CA,EUA),60mMdeTris-HCl(pH9),15mMde (NH4)2SO4,2mMdeMgCl2e0,25LdeTaqDNApolimerase
(Invitrogen, Life Technologies, CAa, EUA), também finali-zadacom7,75Ldeágua MilliQ.Aamplificac¸ãofoifeita
55
kDa kDa
94
77
67
58
37 30
23
20
13
6 72
64
58
kDa kDa
68
50
45
40
27
16
14
M C M C M C CP CN
B
A
C
D
46 44
39 31
25 22
16
11
160 154 130 121
104 101 94 78 77 76 67 64 58 50 46 44 40 37 33 31 30 25 23
20 13
10 6
Figura1 Reconhecimentopadrão deproteínasde cepasRHdeToxoplasmagondiiporanticorpos IgG comométodo Western Blotting(IgG-WB) em amostrasdesorodemães comtoxoplasmoseadquiridaduranteagravidezeseusfilhos comsuspeitade toxoplasmosecongênita.A,IgG-WesternBlottingpositivoparatoxoplasmosecongênita.Bandasiguaisreconhecidasporanticorpos IgGcomintensidademaisfortenaamostradacrianc¸aemcomparac¸ãocomaamostramaterna.B,IgG-WesternBlottingpositivopara toxoplasmosecongênita.BandasdiferentesreconhecidasporIgGdaamostradacrianc¸aemcomparac¸ãocomaamostramaterna. C, IgG-Western Blottingnegativopara toxoplasmose congênita. Bandasiguais reconhecidasporanticorpos IgG de amostrasda crianc¸aedamãe.M,mãe;C,crianc¸a;CP,controlepositivo;CN,controlenegativo.
CA, EUA),com a seguintecondic¸ão deciclo: 7 minutos a 94◦Cpara desnaturac¸ão no1◦ ciclo, seguido de 33 ciclos de 1 minuto a 94◦C paradesnaturac¸ão, 1 minuto a 55◦C paraemparelhamentoe1minutoa72◦Cparaextensão;o ciclo35foiseguidoporumaextensãofinalde10minutosa 72◦C.UmaamostradecadaprodutodaRCPfoisubmetida à eletroforese em gel de agarose a 2%. O DNA de cepas RH de taquizoítos (107/mL) foi extraído para ser usado como controlepositivo.A águafoiconsiderada ocontrole negativo.Amostrasdoscontrolespositivosenegativospara T.gondiiforamincluídasemcadateste.
Análiseestatística
FoifeitanoGraphPadPrism5(GraphPadSoftware,Inc.,San Diego,EUA).Asvariáveiscategóricasforamexpressasemum númeroabsoluto(n)eumpercentual(%)eanalisadaspelo teste qui-quadrado ouexato de Fisher. Foram calculados parâmetrosdesensibilidade,especificidade,valorpreditivo positivo(VPP)e valor preditivonegativo (VPN)com inter-valodeconfianc¸a(IC)de95%.Osvaloresdep<0,05foram consideradosestatisticamentesignificativos.
OestudofoiaprovadopeloComitêdeÉticaemPesquisa comSeres Humanos. Todasasmães participaram volunta-riamente e assinaram o Termo de Consentimento Livre e Esclarecido.
Resultados
Das15crianc¸ascomTC,12(80%)eramsintomáticase aten-diamaoscritérios clínicosparadefinic¸ão dadoenc¸a(nove com calcificac¸ão cerebral, oito com coriorretinite e qua-trocomhidrocefalia),seis(40%)apresentaramreatividadea IgManti-T.gondii,cinco(33,3%)apresentaramelevac¸ãonos níveisdeIgGanti-T.gondiinosprimeirosmesesde vidae umadelas(6,7%)mostroupersistênciadetítulosdeIgG anti--T.gondiiemamostrassequenciais.Cincodassetecrianc¸as (71,4%)submetidas àPCR para detectarDNAde T.gondii apresentaramresultadospositivos(tabela1).
Entreas15crianc¸ascomTC,otesteIgG-WBfoipositivo em nove (60%) e entre as32 crianc¸as sem TCo testefoi positivoem18(56,3%),oqueresultouemumasensibilidade de60% (ICde95%, 32,3a83,7%),especificidadede43,7% (ICde95%,26,4a62,3%),VPPde33,3%(ICde95%,16,5a 54,0%)eVPNde70%(ICde95%,45,7a88,1%)(p=0,05875). Entre as crianc¸as com TC, duas apresentaram IgG-WB negativoe IgManti-T.gondiipositivo;cincoapresentaram IgG-WBpositivoeIgManti-T.gondiinegativo;quatro apre-sentaramambosostestespositivosequatroapresentaram ambosostestesnegativos.
Tabela1 Característicasclínicaselaboratoriaisde15crianc¸ascomtoxoplasmosecongênitadejunhode2011ajunhode2014 Caso IgM
anti-T.gondii
RCP Primeiraamostra deIgGa
IgG seguintesb
Western Blottingb
Sinaisesintomasno1◦mêsdevida
IFI QL
1 Negativo NR 1:512.000 NR ↓ Negativo coriorretinite+calcificac¸ão+ hidrocefalia
2 Positivo NR 1:32.000 926,8 ↑ Positivo coriorretinite+calcificac¸ão 3 Positivo NR 1:512.000 NR ↓ Positivo vitrite(coriorretinite
após)+calcificac¸ão+hidrocefalia 4 Negativo NR <1:16 NR ↑ Positivo coriorretinite
5 Negativo NR 1:1024 162,0 ↔ Positivo calcificac¸ão 6 Negativo Positivo NR 200,0 ↑ Positivo assintomático 7 Negativo Positivo 1:32.000 147,5 NR Negativo hidrocefalia 8 Negativo Negativo 1:8.000 312,0 ↑ Negativo assintomático 9 Negativo Positivo 1:512.000 175,6 ↓ Negativo assintomático 10 Positivo Positivo 1:512.000 188,1 ↓ Positivo coriorretinite 11 Negativo Positivo 1:32.000 139,8 NR Positivo calcificac¸ão 12 Positivo Negativo NR 84,8 ↑ Negativo vitrite+calcificac¸ão 13 Positivo NR NR 200,0 NR Positivo coriorretinite+calcificac¸ão 14 Negativo NR NR 173,9 ↓ Positivo coriorretinite+calcificac¸ão+
hidrocefalia
15 Positivo NR NR 1655,0 ↓ Negativo coriorretinite+calcificac¸ão
IFI,Imunofluorescênciaindiretaparadetecc¸ãodeIgGanti-T.gondii;NR,nãorealizada;QL,imunoensaioquimioluminescentede micro-partículasparadetecc¸ãodeIgGanti-T.gondii,expressoemUI/mL;RCP,reac¸ãoemcadeiadapolimeraseparadetecc¸ãodoDNAde
Toxoplasmagondii;↑,aumentonosníveisdeanticorposIgGanti-T.gondiiemamostrasdesoroemsérie;↔,persistênciadeníveis deIgGanti-T.gondiiemamostrasdesoroduranteoacompanhamento;↓,reduc¸ãodeanticorpos.
aAmostracoletadano1◦mêsdevida.
b Amostracoletadanosprimeiros3mesesdevida,comtodasascrianc¸asemtratamento.
seteapresentaram bandasdiferentesdaquelas observadas nosoromaternoeduasapresentarambandasdemaior inten-sidadedoqueaquelasapresentadaspelasamostrasdesuas mães.Asbandasdominantesreconhecidaspelosanticorpos IgG em amostras de crianc¸as com TC e em crianc¸as não infectadassãoapresentadasnafigura2.
Quantoàs26amostrasdepacientescomoutrasdoenc¸as, duas não apresentaram reatividade e 24 apresentaram
P 94 0 10 20 30 40
P 78 P 58
Sem toxoplasmose congênita Com toxoplasmose congênita
P 44
Bandas antígenos (kDa)
Frequência, %
P 31 P 30 P 13
Figura 2 Distribuic¸ão das proteínas de Toxoplasma gondii
mais frequentesreconhecidas por anticorpos IgG nosoro de crianc¸ascomtoxoplasmosecongênitaecrianc¸assemadoenc¸a, deacordocomseupesomolecular(kDa)(p>0,05paratodasas proteínasreconhecidas).
reatividade de anticorpos IgG, que reconheceram proteí-nascomPMentre17e118kDa.As proteínasreconhecidas commaisfrequênciaforamp22(11/40,7%),p34(9/33,3%), p38 (8/29,6%), p94 (6/22,2%), p56 (5/18,5%) e p30 (5/18,5%).
A análise dos resultados de IgM anti-T gondii com QL apresentousensibilidadede40%(ICde95%,16,3a67,6%), especificidadede100%(ICde95%,89,1a100%),VPPde100% (ICde95%,54,1a100%)eVPNde78,1%(ICde95%,62,4a 89,4%)(p=0,0005).Noquedizrespeitoàdetecc¸ãodoDNA doparasitacomRCP,asensibilidadefoide71,4%(ICde95%, 29a96,3%),especificidadede100%(ICde95%,69,2a100%), VPPde100%(ICde95%,47,8a100%)eVPNde83,3%(ICde 95%,51,6a98%)(p=0,0034).
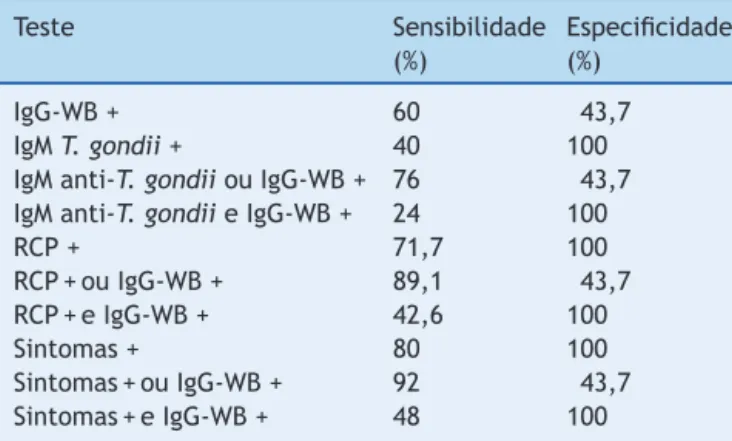
A sensibilidade e a especificidade do IgG-WB, quando relacionadasaoutrosmarcadoresdeTC,comoapresenc¸a deIgManti-Tgondii,RCPpositivaesintomasclínicos,são apresentadasnatabela2.
OIgG-WBfoipositivoemseisdosnovepacientes(66,7%) com lesões oculares e em três dos seis pacientes (50%) comTCsemlesõesoculares(p=0,6224),comsensibilidade de66,7%(ICde95%,29,9 a92,5%),especificidadede50% (ICde95%,11,8a88,2%),VPPde66,7%(ICde95%,29,9a 92,5%)eVPNde50%(ICde95%,11,8a88,2%).
Discussão
Tabela 2 Sensibilidadeeespecificidadedométodo Wes-ternBlottingparadetecc¸ãodeIgGanti-Toxoplasmagondii
(IgG-WB), IgM anti-Toxoplasma gondii, reac¸ão em cadeia da polimerase (RCP) ao Toxoplasma gondii e presenc¸a de sintomas clínicos compatíveis coma toxoplasmose congê-nita,avaliadosemsérieeparalelamente,deacordocoma presenc¸aouausênciadetoxoplasmosecongênita
Teste Sensibilidade (%)
Especificidade (%)
IgG-WB+ 60 43,7
IgMT.gondii+ 40 100
IgManti-T.gondiiouIgG-WB+ 76 43,7 IgManti-T.gondiieIgG-WB+ 24 100
RCP+ 71,7 100
RCP+ouIgG-WB+ 89,1 43,7 RCP+eIgG-WB+ 42,6 100 Sintomas+ 80 100 Sintomas+ouIgG-WB+ 92 43,7 Sintomas+eIgG-WB+ 48 100
IgG-WB, Western Blotting para diagnóstico de infecc¸ão con-gênita com detecc¸ão de anticorposIgG; IgManti-Toxoplasma gondiidetectadoporquimiluminescência;Sintomas, presenc¸a desintomase/ousinaisclínicoscompatíveiscomtoxoplasmose congênita;+testepositivo
convencionais varia amplamente, de 48,3% a 75%.3---5 A ausênciadeIgManti-T.gondiipodeserjustificadapelofato de a infecc¸ão fetal ter ocorrido no inícioda gravidez ou como resultado de o tratamento materno para toxoplas-mosetersidofeitoduranteosdoisprimeirostrimestresde gravidez,oqueteriacausadoobloqueiodarespostaimune ouseuatraso.20Ademais,oatrasoouaausênciaderesposta imune detectável pormétodos padrão(dosagem deIgGe IgMouWB)podeestarrelacionadoadiferenc¸asnaresposta imune individual.Outra desvantagem dessemarcador é o atrasonacoletadeamostras,compositividadereduzidade IgM depoisdos primeiros30 dias devida.21 Assim,muitas vezes é necessário monitorar os resultados sorológicos com a identificac¸ão de títulos estáveis ou crescentes de IgG anti-T. gondii, que atrasam o diagnóstico e causam incertezaà família.16 Nesse contexto, o IgG-WBpode ser usado para comparar os padrões de anticorpos com o
T.gondiiemamostrasdesorodas mãesedeseusfilhose paradeterminarseosanticorpossãotransmitidos passiva-mente ou sintetizados pelo feto ou neonatoem casos de TC.15
Outros autores observaram umamaior contribuic¸ão do IgG-WB parao diagnóstico de TCnos primeiros meses de vida.22,23 Além disso, a associac¸ão do IgG-WB com outros métodossorológicospodeaumentaraprobabilidadedo diag-nóstico. Em uma coorte de crianc¸as, a sensibilidade do IgG-WBerade82,4%eaumentoupara85,7%quandoo IgG--WBeraassociadoà presenc¸adosanticorposIgMe/ouIgA anti-T. gondii com o Elisa.16 Outro estudo mostrou que a combinac¸ãodostestesdeimunocapturadeIgAeIgM,a aná-lisedospadrõesdoWBparaIgGeIgMeacombinac¸ãodas duastécnicaspermitiramadetecc¸ãode94%,94%e100%dos casos,respectivamente.24
OsresultadosdoIgG-WBobtidosnopresenteestudoestão próximosdaquelesencontradosporoutrosautores,que rela-taramumasensibilidadede73,5%.18Essesmesmosautores relataramqueacombinac¸ãodeIgG-WBeIgM-WBaumentou asensibilidadepara86,5%.18
Asensibilidademaisbaixaobtidanesteestudopodeser explicada,emparte,devidoaofatodetodosospacientes comsuspeitadeTCterem sidotratadoscomsulfadiazina, pirimetaminaeácidofolínicoduranteainvestigac¸ão,oque poderiainibiraneossíntesedeanticorpos.20
Outra estratégia para melhorar a sensibilidade desse métodopropostoéarepetic¸ãodoIgG-WBduranteos primei-ros3mesesdevida.8Emumestudocomcoletadeamostras nonascimento,asensibilidadedoanticorpoIgManti-T. gon-diipormétodos convencionais(reac¸ão deaglutinac¸ãopor imunoabsorc¸ão[Isaga]eElisa)foide52%epelométodoWB (comIgGeIgM),de67%.Aocombinarambososmétodos,a sensibilidadeaumentoupara78%nonascimentoe85%nos primeiros3mesesdevida,comdetecc¸ãode94%doscasos deTC.17
Nesteestudo,analisamosalgumasamostrassequenciais doIgG-WB.Entreascrianc¸asinfectadascomresultadofalso negativo na primeira amostrasegundo o método IgG-WB, duasdeseis(33,3%)reconheceramproteínasdiferentesem comparac¸ão comaamostramaternanasegundacoleta,o quecaracterizouaneossíntesedeIgGanti-T.gondiie justi-ficaanecessidadedarepetic¸ãodoIgG-WBemamostrasem série.
Em uma análise anterior, o momento da coleta da amostramaternainfluenciouoresultado dotesteIgG-WB, poisasmãesquereceberamtratamentoparatoxoplasmose durante a gravidezpodem deixar dereagir aos antígenos de T. gondii no período posterior ao nascimento, com resultado falso negativo.16 Neste estudo, esse fenômeno foi observado em uma mãe de uma crianc¸a infectada. Contudo,a maiorparte dasmãesapresentouumaumento nonúmerodebandasreconhecidasnasamostrascoletadas imediatamenteapósainterrupc¸ãodotratamentonoparto. Em um estudo anterior, o PM de bandas antigênicas reconhecidas pela IgG de neonatos com TC variou entre 21e116kDa.18 Nesteestudo, semelhantementeaosdados encontrados por outros autores,15,16 os anticorpos encon-tradoscom alta frequênciaem crianc¸as infectadas foram aqueles relacionados às proteínas de PM maiores do que 30kDa. As diferenc¸as no PM de proteínas reconhecidas relatadasemestudosanteriorespodemserexplicadaspor diferentesexigênciasmetodológicas,comoapreparac¸ãodo antígenodeT.gondii,ascondic¸õesdaeletroforeseemgel deacrilamidaeasdiluic¸õesdesoro.20Outraexplicac¸ãoéa diversidadegenéticaentreascepasdeT.gondii,oquepode levaraoreconhecimentodediferentesproteínas,alémdo fatodealgunsindivíduosapresentaremIgGquereconhece váriasproteínas, aopassoque outrosapresentamIgGque reconheceumaúnicaproteína.25
demonstraroanticorpoIgGanti-T.gondii,quereconheceu as proteínas p22 e p46, ausentes no soro materno. Após 12 mesesde vida, essa crianc¸aque apresentou cicatrizes coriorretinianas continuou não reativa a anticorpos IgG anti-T.gondii avaliadosporQL eIFI; contudo,apresentou resultadopositivonoIgG-WB.
ATCcomnãoreatividadeparaIgGe IgManti-T.gondii
poderá ser resultante do tratamento de toxoplasmose na mãee noneonato.20 Otratamento dacrianc¸aduranteum anoapósonascimentotambémpoderácausaranticorponão reativo.Contudo,namaioriadessescasos,háadetecc¸ãode IgGanti-T. gondiilogo após a interrupc¸ão dotratamento, denominadaefeitorebote.1,7,20
No presenteestudo, o Paciente1 mostrou não reativi-dade;masapresentouanticorposanti-T.gondiidetectáveis após a interrupc¸ão do tratamento. Semelhantemente ao Paciente4, ospacientes6,8e 9tambémmostraramuma queda nos anticorpos até a nãoreatividade e assim per-maneceram após a interrupc¸ão do tratamento. Existe a possibilidade de que esses pacientes deixem de reconhe-cerasproteínasp30ep35presentesnotestedeQL,oque justificaa nãoreatividadenesse testecoma evoluc¸ão da infecc¸ão.
Portanto,em vez deavaliarsomente a persistênciade IgGanti-T.gondiipormeiodeQL,sugerimosousodo IgG--WBnomonitoramentosorológico,poisacrianc¸ainfectada podeproduzir anticorposcontraoutrasproteínas do para-sitae, assim, continuar positivaapós 12 meses deidade. Nesse caso, a ausência de IgG anti-T. gondii na QL não poderá excluir a TC, o que também justificaria a menor especificidadedoIgG-WB encontradadurante este estudo emcomparac¸ãocomestudosanteriores.16---18,22,23Contudo, maisestudosdevem serfeitosantesdouso doIgG-WBno monitoramentosorológico.
Deacordocomumestudofeitonapopulac¸ãobrasileira, pacientescomIgMreativa pelométodoWB(IgM-WB) mos-trarammaiorriscodelesãomacularativadoquepacientes comIgM-WBnegativo.18Contudo,nenhumadiferenc¸a signi-ficativafoiencontradaentreapositividadedoIgG-WBea presenc¸adelesãomacular,comonesteestudo.Nãoé elu-cidado se há proteínas específicas de cepas de T. gondii
relacionadasalesõesoculareseseelaspoderiamexplicara maiorfrequênciadelesõesocularesemcrianc¸asbrasileiras comTCdoqueemcrianc¸asdeoutrospaíses.26 Aprincipal limitac¸ãodesteestudofoiaausênciadeavaliac¸ãodas amos-trascomoIgM-WB,oquepoderiamelhorarasensibilidade dediagnósticodoteste.
O procedimento técnico do IgG-WB é de baixa com-plexidadee de custo disponível, o que o torna viável na rotina laboratorial. A desvantagem do método interno é sualentidão,quepoderiaserreduzidacomapadronizac¸ão de um conjunto de reagentes de fabricac¸ão nacional. Asemiautomac¸ão do método com o uso de umprograma para leitura da intensidade da banda visualizada por meiodoWB facilitariaaleitura e a reprodutibilidadedos resultados.20
Os resultados reforc¸am a utilidade do método IgG-WB paraavaliac¸ãosorológicadepacientescomTC,commaior sensibilidadedoque a detecc¸ão deIgM anti-T. gondiipor métodosconvencionais.Portanto,oIgG-WBpodeserusado paraobterodiagnósticoprecocedeTCemcombinac¸ãocom outrosmarcadoresdainfecc¸ãocongênitaporT.gondii.
Financiamento
ProgramadeApoioàExtensãoUniversitáriadoMinistérioda Educac¸ãodoBrasil(Proext---MEC/SESu)eConselhoNacional deDesenvolvimentoCientíficoeTecnológico(CNPq).
Conflitos
de
interesse
Osautoresdeclaramnãohaverconflitosdeinteresse.
Agradecimentos
Atodosospacienteseparentesquecontribuíramparaeste trabalho, ao Programa de Pós-Graduac¸ão em Ciências da SaúdedaUniversidadeEstadualdeLondrina(UEL)eao Pro-gramadePós-Graduac¸ãoemCiênciaAnimaldaUEL.
Referências
1.RemingtonJS,McLeodR,WilsonCB,DesmontsG. Toxoplasmo-sis.Em:RemingtonJS,KleinJO,WilsonCB,NizetV,Maldonado YA,editores.Infectiousdiseaseofthefetusandnewborninfant. 7ed.Philadelphia:ElsevierSaunders;2011.p.918---1041.
1.RemingtonJS,McLeodR,WilsonCB,DesmontsG. Toxoplasmo-sis.In:RemingtonJS,KleinJO,WilsonCB,NizetV,Maldonado YA,editors.Infectiousdiseaseofthefetusandnewborninfant. 7ed.Philadelphia:ElsevierSaunders;2011.p.918---1041.
2.AmericanAcademyofPediatrics.Reportofcommitteeon infec-tiousdiseases. Toxoplasmagondii infections(Toxoplasmosis). 28a
ed.Illinois:ElkGroveVillage;2009.p.667---72.
3.LebechM,AndersenO,ChristensenNC,HertelJ,NielsenHE, Peitersen B, et al. Feasibility of neonatal screening for toxoplasma infection in the absence of prenatal treat-ment.DanishCongenitalToxoplasmosis StudyGroup.Lancet. 1999;353:1834---7.
4.LagoEG,NetoEC,MelamedJ,RucksAP,PresottoC,CoelhoJC, et al. Congenital toxoplasmosis: late pregnancy infections detectedbyneonatalscreeningandmaternalserologicaltesting atdelivery.PaediatrPerinatEpidemiol.2007;21:525---31.
5.Capobiango JD, Mitsuka-Breganó R, Navarro IT, Rezende NetoCP,CasellaAM,Lopes-MoriFM,etal.Congenital toxoplas-mosisinareferencecenterofParaná,SouthernBrazil.BrazJ InfectDis.2014;18:364---71.
6.RodriguesIM,CastroAM,GomesMB,AmaralWN,AvelinoMM. Congenitaltoxoplasmosis:evaluationofserologicalmethodsfor detection of anti-Toxoplasma gondii IgMand IgA antibodies. MemInstOswaldoCruz.2009;104:434---40.
7.PinonJM,DumonH,ChemlaC,FranckJ,PetersenE,LebechM, etal.Strategyfordiagnosisofcongenitaltoxoplasmosis: evalua-tionofmethodscomparingmothersandnewbornsandstandard methodsforpostnataldetectionofimmunoglobulinG,MandA antibodies.JClinMicrobiol.2001;39:2267---71.
8.Tissot-Dupont D, Fricker HH, Pinchart MP, Bost-Bru C, ThomasPA,PellouxH.UsefulnessofWesternBlotinserological follow-upofnewbornssuspectedofcongenitaltoxoplasmosis. EurJClinMicrobiolInfectDis.2003;22:122---5.
9.RemingtonJS,ThulliezP,MontoyaJG.Recentdevelopmentsfor diagnosisoftoxoplasmosis.JClinMicrobiol.2004;42:941---5.
10.Brasil. Ministério da Saúde. Secretaria de Atenc¸ãoà Saúde. DepartamentodeAc¸õesProgramáticasEstratégicas.Atenc¸ãoà saúdedorecém-nascido:guiaparaosprofissionaisde saúde: intervenc¸ões comuns, icterícia e infecc¸ões. 2a
ed. Brasília: MinistériodaSaúde;2013.p.109---22.
Toxoplasma infection in immunocompetentpregnant women andtheircongenitallyinfectedoffspring.EurJClinMicrobiol InfectDis.1996;15:799---805.
12.CamargoME.Improvedtechnique ofindirect immunofluores-cenceforserologicaldiagnosisoftoxoplasmosis.RevInstMed Trop.1964;6:117---8.
13.LundénA.Immuneresponsesinsheepafterimmunizationwith Toxoplasmagondiiantigensincorporatedintoiscoms.Vet Para-sitol.1995;56:23---5.
14.Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the Folin phenol reagent. J Biol Chem. 1951;193:265---75.
15.Chumpitazi BF, Boussaid A, Pelloux H, Racinet C, Bost M, FleuretAG.Diagnosisofcongenitaltoxoplasmosisby immuno-blottingandrelationshipwithothermethods.JClinMicrobiol. 1995;33:1479---85.
16.GrossU,Lüder CG,HendgenV,HeegC,SauerI,WeidnerA, etal.ComparativeimmunoglobulinGantibodyprofilesbetween motherandchild(CGMCTest)forearlydiagnosisofcongenital toxoplasmosis.JClinMicrobiol.2000;38:3619---22.
17.RillingV,DietzK,KrczalD,KnotekF,EndersG.Evaluationof acommercial IgG/IgM westernblotassay forearly postnatal diagnosisofcongenitaltoxoplasmosis.EurJClinMicrobiolInfect Dis.2003;22:174---80.
18.Machado AS, Andrade GM, Januário JN, Fernandes MD, CarneiroAC,CarneiroM,etal.IgGandIgMwesternblotassay for diagnosisof congenitaltoxoplasmosis.Mem Inst Oswaldo Cruz.2010;105:757---61.
19.HomanWL,VercammenM, DeBraekeleer J,Verschueren H. Identification of a 200- to 300-fold repetitive 529bp DNA
fragmentinToxoplasmagondii,anditsusefordiagnosticand quantitativePCR.IntJParasitol.2000;30:69---75.
20.SensiniA.Toxoplasmagondiiinfectioninpregnancy: opportu-nitiesandpitfallsofserologicaldiagnosis.ClinMicrobiolInfect. 2006;12:504---12.
21.LagoEG,OliveiraAP,BenderAL.Presenceanddurationof anti--ToxoplasmagondiiimmunoglobulinMininfantswithcongenital toxoplasmosis.JPediatr(RioJ).2014;90:363---9.
22.MagiB,MiglioriniL.Westernblottingforthediagnosisof con-genitaltoxoplasmosis.NewMicrobiol.2011;34:93---5.
23.L’OllivierC,WallonM,FaucherB,PiarrouxR,PeyronF,FranckJ. Comparison ofmotherand childantibodies thattarget high--molecular-massToxoplasmagondiiantigensbyimmunoblotting improvesneonataldiagnosisofcongenitaltoxoplasmosis.Clin VaccineImmunol.2012;19:1326---8.
24.GamgneuxFR,CommereV,SchaeferCT,CametJD.Performance ofaWesternBlotassaytocomparemotherandnewborn anti--Toxoplasmagondiiantibodiesfortheearlyneonataldiagnosis of congenital toxoplasmosis.Eur JClin Microbiol Infect Dis. 1999;18:648---54.
25.SunX,LuH,JiaB,ChangZ,PengS,YinJ,etal.A compara-tivestudyofToxoplasmagondiiseroprevalenceinthreehealthy Chinese populations detected using native and recombinant antigens.ParasitVectors.2013;6:241---7.