UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE PROGRAMA DE PÓS-GRADUAÇÃO EM PSICOBIOLOGIA
YWLLIANE DA SILVA RODRIGUES MEURER
Participação do circuito dopaminérgico nas
alterações do comportamento de medo inato de
camundongos infectados pelo
Toxoplasma gondii
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE PROGRAMA DE PÓS-GRADUAÇÃO EM PSICOBIOLOGIA
YWLLIANE DA SILVA RODRIGUES MEURER
Participação do circuito dopaminérgico nas alterações do
comportamento de medo inato de camundongos
infectados pelo
Toxoplasma gondii
Dissertação apresentada ao programa de
pós-graduação em Psicobiologia da Universidade
Federal do Rio Grande do Norte como requisito
parcial para obtenção do título de Mestre em
Psicobiologia.
Orientador: Prof. Dr. Antonio Pereira Junior
Natal - RN
Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial do Centro de Biociências
Meurer, Ywlliane da Silva Rodrigues.
Participação do circuito dopaminérgico nas alterações do comportamento de medo inato de camundongos infectados pelo Toxoplasma gondii / Ywlliane da Silva Rodrigues Meurer. - Natal, RN, 2012.
58 f.: il.
Orientador: Prof. Dr. Antônio Pereira Júnior
Dissertação (Mestrado) - Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Psicobiologia.
1. Toxoplasma gondii. – Dissertação. 2. Dopamina. – Dissertação. 3. Medo inato. – Dissertação. I. Pereira Júnior, Antônio. II. Universidade Federal do Rio Grande do Norte. III. Título.
Autora: Ywlliane da Silva Rodrigues Meurer
Instituição: Universidade Federal do Rio Grande do Norte – UFRN Pós-graduação em Psicobiologia (Psicologia Fisiológica)
26 de Abril de 2012, Natal –RN.
Banca Examinadora:
________________________________________
Prof. Dr. Antonio Pereira Junior Instituto do Cérebro (UFRN)
________________________________________
Prof.ª Dr.ª Alessandra Mussi Ribeiro
Departamento de Fisiologia/Centro de Biociências (UFRN)
________________________________________
Dr. Marco Aurélio de Moura Freire Instituto de Neurociências de Natal –
RESUMO
O protozoário Toxoplasma gondii transforma a aversão inata de ratos à
urina de gato em atração. Essa mudança pode aumentar a probabilidade de
transmissão do parasito para o seu hospedeiro definitivo, os felinos, onde pode se
reproduzir sexualmente. Os circuitos neurais envolvidos no medo inato, ansiedade
ou medo aprendido se sobrepõem consideravelmente, aumentando a possibilidade
de que o T. gondii possa interferir com todos de maneira não-específica. Neste
estudo, foi avaliada a imunorreatividade para tirosina hidroxilase (TH) em áreas
dopaminérgicas relacionadas com o medo inato em camundongos suiços machos
infectados. A infecção latente pelo parasita inverteu a aversão aos odores de felinos.
Esta modificação pode estar relacionada com a presença dos cistos na amígdala,
pois a infecção não diminui medo aprendido, a ansiedade, o olfato, ou a
aprendizagem não-aversiva. No entanto, o mecanismo neuroquímico relacionado a
estas alterações no medo inato durante a infecção permanece pouco estudado. Os
animais foram infectados com bradizoítos (25 cistos) da cepa ME-49 de T. gondii. Os
cérebros foram removidos após 60 dias, seccionados e processados para revelar a
reatividade da enzima TH. Os cistos foram contados nas áreas associadas ao
circuito dopaminérgico, bem como em regiões relacionadas ao medo inato. A
contagem por área e a análise densitométrica mostrou baixa relação entre a
presença de cistos e a reatividade para TH regiões de interesse nos animais
infectados, quando comparados aos controles não-infectados.
ABSTRACT
The protozoan parasite Toxoplasma gondii transforms the innate aversion of
rats for cat urine into a fatal attraction, that increases the likelihood of the parasite
completing its life cycle in the cat’s intestine. The neural circuits implicated in innate
fear, anxiety, and learned fear all overlap considerably, raising the possibility, that T.
gondii may disrupt all of these nonspecifically. In this study, we evaluated
immunoreactivity for tyrosine hydroxylase (TH) in areas associated with innate fear of
infected male swiss mice. The latent Toxoplasma infection converted the aversion of
mice to feline odors into attraction. This loss of fear is remarkably specific, as
demonstrated by Vyas et al (2007), because infection did not diminish learned fear,
anxiety-like behavior, olfaction, or nonaversive learning. However, the neurochemical
mechanism related to alterations in innate fear due to T. gondii infection remains
poorly studied. 20 mice were inoculated with bradyzoites (25 cysts) from a
Toxoplasma gondii(Me-49 strain). The brains were removed after 60 days, sectioned
and processed for TH immunohistochemistry. The correlation between the amount of
cysts per area and the densitometric analysis of neurotransmitter reactivity was low in
the areas implicated in innate fear of infected animals, when comparated with
non-infected controls.
Figura 1: Ciclo de vida do parasita Toxoplasma gondii ... 12 Figura 2: Esquema de síntese das catecolaminas ... 18 Figura 3: Representação dos núcleos dopaminérgicos. ... 19 Figura 4: Cistos da cepa Me-49 obtidos de macerado de cérebro de
camundongos previamente infectados. (A) Cistos observados na objetiva de 4X. (B) Cisto observado na objetiva de 10X. (C) Cisto observado na objetiva de 40X. ... 26
Figura 5: Procedimento de inoculação do parasita realizado per gavage com agulha curva ponta de bola ... 26
Figura 6: Paradigma de medo inato. Adaptado de (VYAS, A. et al.; 2007) ... 27 Figura 7: Diagrama esquemático do procedimento histológico aplicado no
cérebro dos animais experimentais. (A) visão sagital das regiões analisadas, (B) sequencia coronal exeplificando como foram feitas as identificações das áreas nos cortes seriados e (C) esquema seriado de organização dos cortes nas lâminas. ... 29
Figura 8: Aparência de camundongos controle não infectados (A) e infectados (B) com o Toxoplasma gondii. Camundongos albinos Swiss com 2 meses de idade infectados pelo período de 60 dias. (C) efeito neurológico e físico em animais infectados segundo Hermes (2009)... 31
Figura 9: Frequência media de ocupação dos quadrantes com odores pelos animais (A) controle e (B) infectados (N=odor neutro; G=odor de gato; C=odor de cachorro; P=odor próprio) ... 34
Figura 10:Distância percorrida por segmento temporal do teste (A), distância total percorrida (B) e velocidade total alcançada pelos animais infectados e controle. (C=controle; I=infectado) (Média±erro padrão) ... 35
Figura 11:Tempo nas zonas (média±erro padrão) definidas no campo aberto (A) e número de entradas em cada zona definida (B) pelos animais infectados e não-infectados. (C=controle; I=infectado; P=odor próprio; N=odor neutro; C=odor de cachorro; G=odor de gato; Ce=centro do aparato) ... 38
Figura 14:Distribuição de cistos em áreas do cérebro dos animais infectados pelo T. gondii. (AmBSA= amígdala basolateral; ATV= área tegmentar ventral; SN= Substantia nigra; ZCPA= zona cinzenta periaquedutal; AF=área frontal; Hcp=hipocampo) (
*
=p<0,05; ZCPA vs AF) ... 40Figura 15:Análise densitométrica (média±erro padrão) e de contraste entre as marcações para a enzima tirosina hidroxilase nos núcleos dopaminérgicos substantia nigra e ATV em cérebros de animais controles e infectados. ... 42
SUMÁRIO
RESUMO
ABSTRACT
1. INTRODUÇÃO ... 10
1.1. Toxoplasma gondii E O COMPORTAMENTO ... 11
1.1.1. O PARASITO – T. gondii ... 11
1.2. ALTERAÇÕES COMPORTAMENTAIS CAUSADAS PELO T. gondii ... 12
1.3. REAÇÕES DE DEFESA ... 15
1.3.1. MEDO ... 16
1.3.1.1. MEDO INATO ... 16
1.4. DOPAMINA E MEDO... 17
2. OBJETIVO ... 24
3. MATERIAIS E MÉTODOS ... 25
3.1. ANIMAIS ... 25
3.2. MODELO EXPERIMENTAL ... 25
3.3. PARADIGMA DE MEDO INATO ... 27
3.4. SOROLOGIA ... 28
3.5. PROCESSAMENTO HISTOLÓGICO ... 28
3.6. ANÁLISE ESTATÍSTICA ... 30
4. RESULTADOS ... 31
4.1. APARÊNCIA FÍSICA DOS ANIMAIS INFECTADOS ... 31
4.2. CONFIRMAÇÃO DA INFECÇÃO NOS ANIMAIS EXPERIMENTAIS E AVALIAÇÃO DO PESO DOS ANIMAIS DURANTE O PROCEDIMENTO EXPERIMENTAL ... 32
4.3. ANÁLISE COMPORTAMENTAL DOS ANIMAIS SUBMETIDOS À EXPOSIÇÃO AO ODOR DE GATO ... 34
4.3.1. Atividade locomotora dos animais experimentais ... 35
4.3.2. Medo Inato ... 37
4.4. ANÁLISE HISTOLÓGICA DO CÉREBRO DE ANIMAIS SUBMETIDOS AO PARADIGMA DE ODOR ... 39
4.4.1. Número de cistos no cérebro dos animais infectados ... 39
5. DISCUSSÃO ... 44
6. CONCLUSÃO ... 51
1. INTRODUÇÃO
Os parasitas sobrevivem através da exploração de hospedeiros de uma
espécie diferente. Esta sobreviência é provavelmente uma das relações ecológicas
mais bem sucedidas do planeta, tendo em vista que para cada organismo existe um
parasita que pode infectá-lo. Hospedeiros e parasitas podem co-evoluir em uma
disputa perpétua envolvendo adaptações e contra-adaptações de modo a manter
suas adequações aos ambientes que compartilham. Este raciocínio segue a
hipótese evolucionária denominada de princípio da rainha vermelha, proposta por
van Valen (VAN VALEN, L.; 1973) e que pode ser resumida “... para um sistema
evolucionário, o desenvolvimento contínuo é necessário apenas para manter a sua
adequação relativa aos sistemas com os quais co-envolve”. No caso de seres
humanos, esse princípio pode ser ilustrado pelo fato de que apesar da imensa
alocação somática para o sistema imunológico no nosso organismo, as pessoas
ainda são bastante vulneráveis às doenças infecciosas.
Vários parasitas evoluíram ciclos de vida complexos, que envolvem múltiplos
hospedeiros e são transmitidos para o hospedeiro definitivo de maneira trófica.
Aparentemente, existem vantagens adaptativas na introdução de pelo menos um
hospedeiro intermediário para a transmissão do parasita até seu hospedeiro final
(CHOISY, M. et al.; 2003).
Alguns parasitas que são transmitidos de maneira trófica são capazes de
alterar o comportamento do hospedeiro intermediário para aumentar suas chances
de predação (THOMAS, F.; ADAMO, S. ; MOORE, J.; 2005). O fenômeno de
alteração fenotípica induzida em animais parasitados permite que o parasito passe
de um hospedeiro intermediário para o hospedeiro definitivo e desta forma possa
completar o seu ciclo de vida (CEZILLY, F. et al.; 2010). Existem vários exemplos de
manipulação parasitária de hospedeiros disponíveis na literatura, ocorrendo em
vários organismos, desde microorganismos até mamíferos (LEFEVRE, T. et al.;
2009). Por exemplo, formigas infectadas com o trematodo Dicrocoelium dendriticum
se deslocam para o topo da vegetação e assim aumentam suas chances de
Um outro exemplo é o aumento da atratividade de seres humanos infectados pelo
parasito Plasmodium falciparum, causador da malária, para o mosquito Anopheles
gambiae, hospedeiro definitivo do parasito e permitindo que o mesmo possa
completar o seu ciclo de vida (LACROIX, R. et al.; 2005).
As modificações fenotípicas induzidas por parasitos são bem variadas, tanto
em magnitude quanto em diversidade. Na maioria dos casos, são vários os traços
fenotípicos modificados pelo parasito no hospedeiro, em efeito transformando-os em
organismos profundamente modificados (THOMAS, F.; ADAMO, S. ; MOORE, J.;
2005; THOMAS, F.; POULIN, R. ; BRODEUR, J.; 2010).
1.1. Toxoplasma gondii e comportamento
1.1.1. O parasito T. gondii
T. gondii é um protozoário parasito intracelular obrigatório que tem a
capacidade de invadir e proliferar dentro de todo tipo celular nucleado em diferentes
hospedeiros. Este parasito tem um ciclo de vida complexo – heteroxeno – no qual há
a participação de dois hospedeiros para o seu desenvolvimento, um definitivo e
outro intermediário.
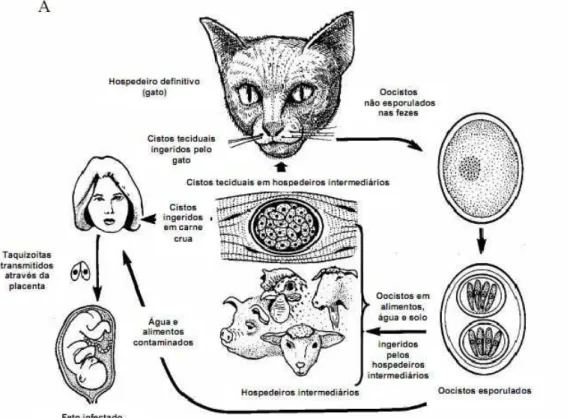
O ciclo definitivo ocorre no tecido enteroepitelial de felídeos, onde aparecem
diferentes estágios morfológicos, com fases de desenvolvimento sexuada e
assexuada, e liberação final de oocisto não-esporulado. No hospedeiro
intermediário, no entanto, são encontradas duas formas predominantes do
patógeno, a taquizoíta e a bradizoíta, que proliferam por endodiogenia dentro das
células e tecidos de vários vertebrados, como peixes, aves e mamíferos, incluindo
humanos (DUBEY, J. P.; LINDSAY, D. S. ; SPEER, C. A., 1998; ROBERTS, L. S.;
Figura 1: Ciclo de vida do protozoário T. gondii. (Adaptado de DUBEY; LINDSAY et al; 1998).
1.2. Alterações comportamentais causadas pelo Toxoplasma gondii
No caso do T. gondii, as alterações fenotípicas induzidas em hospedeiros
intermediários como os roedores incluem a modificação do comportamento inato de
aversão ao odor da urina de felinos em atração (BERDOY, M.; WEBSTER, J.P. ;
MACDONALD, D.W.; 2000; VYAS, A. et al.; 2007; WEBSTER, J.P.; 2007; KANNAN,
comportamental é especifica para a aversão inata aos feromônios do gato presentes
na urina, já que não ocorrem alterações em outros comportamentos, tal como medo
aprendido ou ansiedade (VYAS, A. et al.; 2007).
As indicações iniciais dos mecanismos responsáveis pelas mudanças
comportamentais induzidas pelo T. gondii sugerem a participação de vias
dopaminérgicas. Foi demonstrado, por exemplo, que a administração do
antipsicótico haloperidol e do ácido valpróico, um estabilizador do humor, poderiam
evitar o aparecimento dessas mudanças comportamentais (WEBSTER, J.P. et al.;
2006). Além disso, foi demonstrado que a administração de um bloqueador seletivo
de autoreceptores dopaminérgicos, a vanoxerina, (GBR- 12909) também causava
supressão dos comportamentos atípicos associados com a infecção crônica pelo
T.gondii em roedores (SKALLOVA, A. et al.; 2006) e que antipsicóticos e
estabilizadores de humor têm ação inibitória sobre a replicação de taquizoítas in vitro
(JONES-BRANDO, L.; TORREY, E.F. ; YOLKEN, R.; 2003).
Os cistos de T. gondii se localizam em regiões estratégicas para a
manipulação do comportamento no sistema nervoso central de mamíferos, como no
sistema límbico, (HOLLIMAN, R.E.; 1997) sistema olfatório, córtex pré-frontal,
hipotálamo, amígdala lateral e basolateral (VYAS, A. et al.; 2007). O sistema límbico
é uma região envolvida na mediação de vários comportamentos sociais, tal como
agressividade, reprodução e comportamentos parentais (KLEIN, S.L., 2003).
Recentemente foi demonstrado que ratos infectados cronicamente com T.gondii ao
serem expostos ao odor do gato apresentam aumento da atividade neural localizada
numa região da amígdala normalmente ativada quando ratos não infectados são
expostos a uma fêmea no estro (HOUSE, P.K.; VYAS, A. ; SAPOLSKY, R.; 2011).
Isto poderia explicar a atração fatal que roedores infectados apresentam pela urina
de gato (HOUSE, P.K.; VYAS, A. ; SAPOLSKY, R.; 2011).
Também foi demonstrado que o genoma do T. gondii possui dois genes,
TgAaaH1 e TgAaaH2 que codificam a enzima tirosina hidroxilase, a enzima
passo-limitante para síntese de dopamina (GASKELL, E.A. et al.; 2009). Além disso, foi
observado que a infecção de células dopaminérgicas com o T. gondii aumentou o
comportamental observada em hospedeiros intermediários do parasito
(PRANDOVSZKY, E. et al.; 2011).
Vários estudos epidemiológicos têm demonstrado uma correlação entre a
soroprevalência para o T. gondii e a esquizofrenia (FULLER TORREY, E.;
RAWLINGS, R. ; YOLKEN, R.H.; 2000; TORREY, E.F. ; YOLKEN, R.H.; 2003). Por
exemplo, análises de amostras de soro obtidas de mães pouco antes ou após o
parto revelaram uma proporção significantemente elevada de anticorpos IgM para T.
gondiioxoplasma em crianças que desenvolveram esquizofrenia durante a vida
subsequente (TORREY, E.F. ; YOLKEN, R.H.; 2003) e indivíduos no primeiro
episódio de esquizofrenia apresentaram níveis significativamente altos de anticorpos
das classes IgG, IgM e/ou IgA no soro e no fluido cerebroespinhal (YOLKEN, R.H. et
al.; 2001). Além disso, a meta-análise de estudos que testaram uma associação
entre títulos de anticorpos para T. gondii e primeiro episódio de esquizofrenia
revelaram que 18 dos 19 estudos demonstraram alta prevalência deste parasito
entre pacientes esquizofrênicos em comparação com controles (WEBSTER, J.P. et
al.; 2006).
Foi demonstrado que os cistos são encontrados quase exclusivamente no
interior de neurônios, não em células de glia, onde podem permanecer por toda a
vida do hospedeiro protegidos da ação do sistema imunológico através da formação
do chamado vacúolo parasitóforo (MELZER, T.C. et al.; 2010). Parasitas dentro de
neurônios podem diretamente causar morte celular ou atrofia de seus processos
celulares (VALLOCHI, A.L. et al.; 2005), além disso a geração de um processo
inflamatório pode contribuir, via produção de óxido nítrico ou espécies reativas de
oxigênio, o que pode afetar diretamente na gênese de novos neurônios.
É importante ressaltar que mecanismo de resposta imunológica contra o T.
gondii encistado pode desencadear a produção de citocinas proinflamatórias, INF-g
e indoleamina 2,3–dioxigenase, além de alterar os níveis, reciclagem e eficiência de
muito neuromoduladores, incluindo dopamina, glutamato e serotonina (STIBBS,
H.H.; 1985). Ainda, o próprio T. gondii pode diretamente influenciar os níveis de
neurotransmissores, talvez de forma mais sutil do que a proposta por STIBBS em
aumenta diretamente o metabolismo local (PRANDOVSZKY, E. et al.; 2011), pois
pode codificar as enzimas de síntese (GASKELL, E.A. et al.; 2009) e ainda liberar
dopamina (PRANDOVSZKY, E. et al.; 2011). A relação com a dopamina é apoiada
por diversos estudos que vem demonstrando alteração em comportamentos de
roedores, além do fato que agonistas e antagonistas dopaminérgicos perturbarem os
fenótipos comportamentais expressos pelo parasito (SKALLOVA, A. et al.; 2006;
GOODWIN, D.G.; STROBL, J.S. ; LINDSAY, D.S.; 2011).
1.3. REAÇÕES DE DEFESA
O estudo comparado do comportamento em várias espécies animais contribui
para o entendimento da evolução do comportamento humano. O estudo do medo e
da ansiedade, por exemplo, que tem um claro valor adaptativo em resposta a
situações de ameaça que podem comprometer a integridade física ou a
sobrevivência, pode se beneficiar enormemente da observação comportamental em
várias espécies diferentes de animais (BLANCHARD, R.J. et al.; 1998)
As fontes de perigo para um animal são muito variadas. Dentre elas, podemos
citar confrontos com predadores, competições com co-específicos por acesso a
alimentos ou oportunidades reprodutivas, condicionantes ambientais tais como
altura, iluminação, estímulos dolorosos e ambientes ou objetos desconhecidos.
Embora o comportamento de defesa e as ameaças variem para cada espécie, os
animais geralmente utilizam uma de quatro estratégias defensivas básicas: fuga,
congelamento, ataque defensivo e submissão (BLANCHARD, D.C. ; BLANCHARD,
R.J.; 1988; ADAMS, D.B.; 2006). A decisão por uma estratégia em particular leva em
conta vários fatores, como as características do ambiente (existência de uma rota de
fuga ou não), distância do estímulo ameaçador e experiência prévia com o estímulo
ou ambiente.
BLANCHARD & BLANCHARD, estudando as respostas defensivas
comportamentais de roedores (ratos e camundongos) em confronto com predadores
(BLANCHARD, D.C. ; BLANCHARD, R.J.; 1988; BLANCHARD, R.J. et al.; 1998),
potencial ou incerta, distal ou proximal. No primeiro grupo, as estratégias
observadas são comportamentos exploratórios cautelosos e hesitantes, usando
posturas e movimentos do corpo que possibilitam a aproximação e a investigação de
possíveis ameaças denominadas de comportamentos de avaliação de risco. O
segundo grupo entra em ação após a avaliação do risco e determina a estratégia de
lidar com a ameaça, que envolve fuga, se a ameaça é distal, ou luta/congelamento,
caso seja proximal.
1.3.1. MEDO
O medo e a ansiedade são estados emocionais de grande valor adaptativo,
experimentados de maneira subjetivos como não prazerosos e desconfortáveis,
acompanhados por um conjunto de alterações comportamentais e fisiológicas.
Lader (1981) atribui como causa principal da ansiedade a expectativa de um perigo
iminente e indefinido, porém sem que uma ameaça real seja identificada ou, quando
existente, considerada como desproporcional à resposta (LADER, M.H.; 1981). Em
modelos com roedores, o medo e ansiedade podem ser diferenciados através dos
estímulos e/ou situações que os desencadeiam, de forma que o medo ocorre diante
de situações claras e evidentes de ameaça e perigo, enquanto a ansiedade é
desencadeada por situações onde o perigo é apenas potencial, vago e incerto
(BLANCHARD, R.J. et al.; 1990)
1.3.1.1. MEDO
Os mamíferos apresentam um comportamento fortemente defensivo à
exposição ao odor natural do seu predador, em especial ao odor da pele ou pelo,
mas também da urina e fezes (APFELBACH, R. et al.; 2005). Esta resposta tem sido
cada vez mais utilizada como um modelo para estudo de ansiedade (BLANCHARD,
D.C.; GRIEBEL, G. ; BLANCHARD, R.J.; 2003; MCGREGOR, I.S. et al.; 2004;
STAPLES, L.G. et al.; 2005; SIVIY, S.M.; HARRISON, K.A. ; MCGREGOR, I.S.;
rígido (DIELENBERG, R.A. ; MCGREGOR, I.S.; 2001). Por exemplo, quando ratos
são reexpostos à coleira de um gato, mesmo sem qualquer odor, apresentam o
mesmo comportamento aversivo (BLANCHARD, D.C.; GRIEBEL, G. ; BLANCHARD,
R.J.; 2001; BLANCHARD, R.J. et al.; 2001; STAPLES, L.G. et al.; 2005). Alterações
plásticas pronunciadas e duradouras foram encontradas no hipocampo de animais
submetidos ao paradigma de odor de predador (FOX, R.J. ; SORENSON, C.A.;
1994; MESCHES, M.H. et al.; 1999).
Na literatura, tem sido relatado que a exposição de ratos ou camundongos
aos gatos, não somente aos seus odores, induzem respostas defensivas imediatas
(BLANCHARD, R.J. et al.; 1990), e também respostas de longa duração (semanas),
como um aumento de ansiedade revelado no paradigma experimental do labirinto
em cruz elevado (ADAMEC, R.E. ; SHALLOW, T.; 1993; COHEN, H.; BAR-HAIM, N.
; KOTLER, M.; 1996; ADAMEC, R.; 1997; COHEN, Y.; LACHENMEYER, J.R. ;
SPRINGER, C.; 2003; ADAMEC, R.; SHALLOW, T. ; BURTON, P.; 2005; ADAMEC,
R.E.; BLUNDELL, J. ; BURTON, P.; 2005).
É importante ressaltar que o modelo do medo inato baseado no odor do gato
tem uma desvantagem importante que é a sua reprodução por diversas vezes
complicada pela dificuldade na determinação da intensidade do odor (LI, C.I.;
MAGLINAO, T.L. ; TAKAHASHI, L.K.; 2004) e pelas peculiaridades relacionadas
com o odor, gênero, raça e dieta dos gatos utilizados (por exemplo, a quantidade de
carne consumida). Isso prejudica sobremaneira a comparação entre os estudos.
1.4. DOPAMINA E MEDO
A dopamina (DA), um neurotransmissor da família das catecolaminas, é
sintetizada pela ação da enzima tirosina hidroxilase, que converte o aminoácido
tirosina em L-DOPA o qual, por sua vez, é descarboxilado para formar a dopamina
Figura 2: Esquema de síntese das catecolaminas.
Os neurônios dopaminérgicos apresentam dois modos distintos de atividade:
tônica, que ocorre através do disparo espontâneo destes neurônios, e fásica,
representada pelo padrão explosivo de disparos em resposta a estímulos relevantes.
O término da ação da DA no encéfalo pode envolver sua recaptação e posterior
metabolismo através da enzima monoaminaoxidase (MAO), que converte a DA em
ácido dihidroxifenilacético (DOPAC), ou sua conversão em ácido homovanílico
(HVA), provavelmente no espaço extraneuronal, através da ação seqüencial da
catecol-Ometiltransferase e da MAO (CARLSSON, A. ; WALDECK, B.; 1958;
ELSWORTH, J.D. ; ROTH, R.H.; 1997).
A liberação de DA é modulada por receptores pré-sinápticos localizados no
denominados auto-receptores. A estimulação de auto-receptores da região
somatodendrítica diminui a taxa de disparos destes neurônios, enquanto a
estimulação de auto-receptores dos terminais nervosos inibe a síntese e a liberação
de DA. As vias dopaminérgicas ascendentes do sistema nervoso central de
mamíferos podem ser divididas em: mesoestriatal (ou nigroestriatal), que tem origem
predominante na substância negra do mesencéfalo e inerva o estriado dorsal, em
particular os núcleos caudado e putame; mesocortical, que surge
predominantemente na área tegmental ventral (ATV) e projeta-se sobretudo para o
córtex pré-frontal; e mesolímbica, que também tem origem predominante na ATV e
inerva estruturas do sistema límbico, incluindo núcleo accumbens, amígdala e
hipocampo (OADES, R.D. ; HALLIDAY, G.M.; 1987; GARDNER, E.L. ; ASHBY, C.R.,
JR.; 2000). (Figura 3)
Existe, contudo, um significativo grau de heterogeneidade quanto às origens
anatômicas e aos alvos de projeção dessas vias (MOORE, R.Y. ; BLOOM, F.E.;
1978; WISE, R.A.; 2009). O córtex cingulado, por exemplo, aparece como parte
integrante tanto da via mesolímbica quanto da via mesocortical (OADES, R.D. ;
HALLIDAY, G.M.; 1987; GARDNER, E.L. ; ASHBY, C.R., JR.; 2000). A via
dopaminérgica mesoestriatal tem sido classicamente associada com o controle da
movimentação voluntária (OZER, H.; EKINCI, A.C. ; STARR, M.S.; 1997; DAMIER,
P. et al.; 1999).
Figura 3: Diagrama esquemático das vias dopaminérgicas. Modificado de
Por outro lado, diferentes condições fisiológicas e patológicas como alerta,
estresse, adição a drogas, e distúrbios neuropsiquiátricos têm sido associadas a
alterações nas vias mesolímbica e mesocortical (FINLAY et al.; 1995; GOLDSTEIN;
DEUTCH, 1992; VOLKOW et al., 2002).
Vários neurotransmissores têm sido implicados no medo. Dentre eles
evidenciam-se as aminas biogênicas, como a noradrenalina e a serotonina,
aminoácidos como o GABA e a glicina, peptídeos como o fator de liberação da
corticotrofina, o ACTH e a colecistocinina, e esteroides como a corticosterona
(GRAEFF; BRANDÃO, 1999).
Muitos estudos têm sido realizados no intuito de relacionar circuitos
encefálicos específicos com o medo e a ansiedade. Estudos sobre a regulação
desses circuitos por neuromoduladores são úteis na medida em que podem ser de
relevância terapêutica para os distúrbios de ansiedade (BRANDÃO et al., 1994,
1999, 2003; MILLAN, 2003). A dopamina parece ser um dos neuromoduladores mais
ativos em mecanismos subjacentes a estados de medo e ansiedade (MILLAN,
2003).
A associação de alterações na transmissão dopaminérgica e situações
ameaçadoras têm sido demonstradas em numerosos trabalhos. Mecanismos
dopaminérgicos têm sido associados à produção e elaboração do estresse agudo e
crônico (FEENSTRA et al., 1995; FINLAY et al., 1995). Na realidade, alterações na
transmissão dopaminérgica sempre ocorrem em consequência da exposição de
animais a uma ampla variedade de estressores (GOLDSTEIN et al., 1996). Apesar
das inúmeras evidências de um envolvimento secundário da dopamina em estados
de medo pesquisas comportamentais visando esclarecer o envolvimento da
dopamina e de seus receptores nessa condição têm relatado efeitos ansiolíticos,
ansiogênicos ou ausência de efeitos com o uso de agonistas e antagonistas
dopaminérgicos em diferentes modelos animais de ansiedade (DAVIS et al., 1993;
GARCIA et al., 2005; GREBA; KOKKINIDIS, 2000; INOUE et al., 2000; OLIVEIRA et
al., 2006; REIS et al., 2004; RODGERS et al., 1994). Sugere-se que tais efeitos
mecanismo dopaminérgico no comportamento defensivo dependeria do tipo de
estímulo emocional eliciador da resposta.
As caracterizações de quais vias dopaminérgicas estão envolvidas no
comportamento de medo permanece, no entanto, pouco esclarecida. Além disso, o
envolvimento de mecanismos dopaminérgicos tanto em processo de medo inato ou
aprendido tem sido pouco relatado.
Um conjunto crescente de evidências converge atualmente para a ideia de
que a ativação das vias mesocortical e mesolímbica, originadas a partir de neurônios
dopaminérgicos na ATV, é particularmente sensível a estimulações ambientais
aversivas e pode ser importante para o desenvolvimento de respostas exageradas
de medo (DEUTCH et al., 1985; GREBA et al., 2001; GUARRACI; KAPP, 1999;
GUARRACI et al., 2000), que dependem diretamente da conexão entre áreas como
amígdala, hipocampo e córtex pré-frontal. A ativação de neurônios da ATV por
estímulos aversivos parece modular o medo e a ansiedade por meio de suas
projeções ascendentes.
A dopamina é encontrada na amígdala em concentrações apreciáveis
(INGLIS; MOGHADDAM, 1999; YOUNG; RESS, 1998). As projeções
dopaminérgicas para amígdala têm origem principalmente na ATV (OADES;
HALLIDAY, 1987), embora um estudo recente tenha demonstrado que a área
mesencefálica A9 de primatas, referente à substância negra parte compacta, projeta
seus axônios diretamente para o núcleo amigdalar basolateral, fornecendo fortes
evidências da participação deste núcleo, de forma maciça, na regulação dos estados
emocionais (CHO, Y.T. ; FUDGE, J.L.; 2010)
Déficits produzidos por extensas lesões na amígdala que envolvem as regiões
amigdaloides CeA (núcleo amigdaloide central), BLA (núcleo basolateral) e MeA
(núcleo amigdaloide medial) (BLANCHARD, D.C. ; BLANCHARD, R.J.; 1972)
responsáveis por induzir medo inato em relação ao predador pode ser ocasionado
por danos específicos na MeA, bem como possivelmente, por danos na BLA
O BLA é o principal sítio de recepção de sinais aversivos, enquanto o núcleo
central é a principal estação de saída para as respostas autonômicas, endócrinas e
somáticas associadas ao medo (DAVIS, 1992; FENDT; FANSELOW, 1999;
LEDOUX et al., 1988; LEDOUX, 2000).
Lesões no núcleo CeA atenuam a exibição de “freezing”, em testes
relacionados ao medo aprendido contextual, no período imediatamento pós-choque,
e em testes de retenção, demonstrando o papel crítico deste núcleo amigdaloide
(FANSELOW, M.S. et al; 1993, DAVIS et al; 1997, PHILLIPS & LEDOUX; 1992).
Com relação ao medo inato, estudos posteriores demonstram que as lesões de CeA,
as quais são capazes de afetar medo condicionado não têm efeitos significativos
sobre o medo inato ao odor gato (LI, C.I.; MAGLINAO, T.L. ; TAKAHASHI, L.K.;
2004). Este resultado é consistente com dado recente que mostra que a inativação
de CeA induzida por muscimol não teve efeitos sobre medo inato induzido por TMT
(2,3,5-trimetil-3-tiazoline), odor relacionado a predadores (FENDT et al.; 2003). Além
disso, estudos indicam que lesões no núcleo CeA da amigdala não afetam a
ocorrência de outras respostas emocionais inatas (SANANES; CAMPBELL; 1989,
WALKER; DAVIS; 1997).
Com relação ao núcleo amigdaloide medial (MeA), alguns estudos o apontam
como importante estrutura conectada a diversas regiões cerebrais envolvidas na
modulação do comportamento de medo inato. Suas projeções seguem até
estruturas como o septum lateral, o núcleo da stria terminalis, até hipotálamo
anterior e ventromedial e também substância cinzenta periarquedutal (CANTERAS,
N.S.; SIMERLY, R.B. ; SWANSON, L.W.; 1995). Estudos demonstram que lesões ou
estimulação elétrica de regiões inervadas por este núcleo amigdaloide afetam a
expressão do comportamento defensivo (ALBERT & CHEW, 1980; BANDLER,
DEPAULIS & VERGNES, 1985; CANTERAS, 2002; DE OCA, DECOLA, MAREN, E
FANSELOW, 1998; FERNÁNDEZ DE MOLINA & HUNSPERGER, 1962; SILVEIRA
& GRAEFF, 1992).
Além disso, lesões neste núcleo produzem efeitos importantes sobre o
freezing e componentes de contato do medo inato, pois ratos com este núcleo
expandida/avaliação exploratória, o que é consistente com a redução do medo.
Logo, conhecer a neurobiologia deste nucleo no comportamento de medo inato pode
ter relevância para compreender a base neural dos traços emocionais e da
fisiopatologia de transtornos psiquiátricos que incluem um componente
incondicionada, como fobias (BIEDERMAN et al, 2001;. SCHWARTZ, WRIGHT,
SHIN, KAGAN , & RAUCH, 2003).
Vários estudos atribuem à amígdala o papel de receber informações acerca
de sinais de perigo e avaliá-los quanto ao seu grau de ameaça para o organismo.
Desta forma, a amígdala parece atuar como uma espécie de interface
sensório-afetiva na reação de defesa, isto é, funcionaria como um filtro de sinais sensoriais
com conotação afetiva. Uma vez que a amígdala aparece como uma estrutura
essencial para a aquisição e a expressão do medo condicionado (FANSELOW;
LEDOUX, 1999; FENDT; FANSELOW, 1999; LEDOUX, 2000; MAREN; FANSELOW,
1996; MAREN, 2000) e recebe, através do BLA, projeções dopaminérgicas dos
neurônios da ATV (BRINLEY-REED; MCDONALD, 1999; KRETTEK; PRICE, 1978;
WALLACE et al., 1992), essas duas áreas tornam-se alvos interessantes para o
estudo do envolvimento de mecanismos dopaminérgicos no medo e na ansiedade.
Cabe ressaltar que a participação do circuito amigdaloide na organização da
resposta inata ainda permanece obscura, embora dados recentes apontem o seu
papel na modulação desta resposta. Alguns propoem um papel diferencial das
respostas geradas pelos núcleos amigdaloides basolateral e central em respostas de
medo inato (MOREIRA, C.M. et al.; 2007). No entanto, outros avaliam que as
estruturas amigdaloides respondem ao processo de medo inato de maneira similar
ao tipo de processamento do medo aprendido (ANTONIADIS, E.A. ; MCDONALD,
R.J.; 2001; CANTERAS, N.S.; RIBEIRO-BARBOSA, E.R. ; COMOLI, E.; 2001;
MULLER, M. ; FENDT, M.; 2006).
Neste contexto, muito ainda precisa ser avaliado sobre as interconexões entre
as estruturas cerebrais envolvidadas tanto no processamento de medo inato e
aprendido, uma vez que ambos expressam uma gama de respostas autonomicas,
hormonais e neuroquímicas, que influenciam comportamento, funções motoras e
2. OBJETIVO
Avaliar a participação do circuito dopaminérgico nas alterações do medo inato
de camundongos induzidas pela infecção crônica pelo parasito Toxoplasma gondii.
2.1. Objetivos específicos
Avaliar as alterações no comportamento de medo inato dos camundongos
infectados pelo T gondii após a exposição ao estímulo aversivo (urina de gato)
utilizando o teste do campo aberto.
Avaliar as alterações na distribuição da enzima tirosina hidroxilase no circuito
dopaminérgico e no circuito de medo inato do cérebro de camundongos infectados
3. MATERIAS E MÉTODOS
3.1. Animais
Foram utilizados 20 camundongos (Mus musculus) machos albinos da
linhagem Swiss (idade: 7-8 semanas; peso: 35-40g), oriundos do Biotério Central da
Universidade Federal do Ceará e mantidos na sala de criação de animais do
Laboratório de Biologia da Malária e Toxoplasmose, do Centro de Biociências da
Universidade Federal do Rio Grande do Norte (UFRN). Os animais foram mantidos
em ciclo claro-escuro de 12h:12h controlado por um temporizador, com inicio da fase
clara às 6h00, com água e ração ad libitum. Os animais foram divididos
aleatoriamente em dois grupos (n=10), controle e infectado, e mantidos em caixas
com grupos de cinco animais separadamente. O projeto foi aprovado no comitê de
ética para uso de animais (CEUA) da UFRN, com número de protocolo 007/2010.
3.2. Modelo experimental de infecção
A cepa do T. gondii utilizada foi a ME-49, tipo II, mantida in vivo, com
passagens a cada 8 semanas em camundongos albinos swiss (Mus musculus)
através da inoculação de 25 cistos obtidos a partir da maceração do cérebro de
camundongos previamente infectados diluídos em 1 mL de salina (Figura 4). O
período de infecção para todos os animais foi de 60 dias. Cada grupo foi
acompanhado e avaliado durante todo o período de experimentação, com
A B C
Figura 4: Cistos da cepa Me-49 obtidos de macerado de cérebro de camundongos
previamente infectados. (A) Cistos observados na objetiva 4X (setas). (B) Cisto observado
na objetiva de 10X. (C) Cisto observado na objetiva de 40X. (Arquivo pessoal)
(Escala:50µM)
Os 25 cistos foram inoculados em cada animal experimental por via oral (per
gavage) com agulha de aço boleada na ponta para evitar ferimentos no trato
digestivo superior dos animais (Figura 5).
Figura 5: Procedimento de inoculação do parasita realizado por gavage com agulha
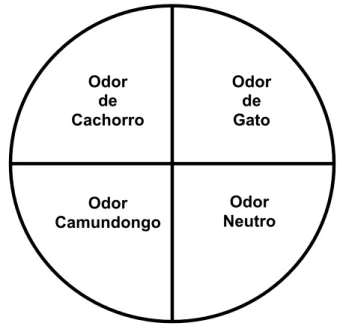
Odor de Cachorro
Odor de Gato
Odor Camundongo
Odor Neutro 3.3. Paradigma de medo inato
Após os 60 dias de infecção, os animais foram submetidos ao paradigma de
exposição ao odor de predador, (VYAS, A. et al.; 2007) com a exploração de uma
arena circular (raio = 75 cm) com fundo negro, dividida em quatro quadrantes, cada
um associado com um objeto cilindrico de PVC idêntico para cada quadrante. Todos
os objetos foram impregnados com um odor específico (urina de gato, urina de
cachorro, urina de camundongo, ou um objeto com odor de cada caixa original de
cada grupo de animais, denominado de odor neutro).
Os animais foram previamente habituados à sala de experimentação e ao
aparato durante 1 hora. Em seguida, o teste foi realizado e gravado por 20 min para
cada animal com uma câmera webcam 3.1MP acoplada a um computador com
software de análise comportamental ANY-MAZE (Stoelting, USA). Os parâmetros
analisados foram: distância total percorrida, distância por período do teste,
velocidade total desenvolvida pelo animal, latência, distância percorrida e número de
entradas nos diferentes quadrantes envolvidos, com ênfase no quadrante com odor
de seu predador.
3.4. Sorologia
Após análise no paradigma de medo, os animais foram anestesiados com
Tiopental sódico® (30mg/Kg) e 500µl de sangue venoso foi coletado por punção
cardíaca antes do procedimento de perfusão para análise sorológica da presença de
anticorpos anti-T. gondii. O perfil sorológico dos animais experimentais foi avaliado
através do teste de hemaglutinação indireta, utilizando um kit comercial da marca
Warma®, onde hemácias sensibilizadas com antígeno do parasito são utilizadas
para avaliar a adsorção de possíveis anticorpos anti-T. gondii presentes em fluidos
testes. A presença de anticorpos proporciona uma aglutinação entre
antígeno-anticorpo e forma um “botão” no fundo de uma placa em V. Quando antígeno-anticorpos estão
ausentes, não ocorre aglutinação e forma uma visualização contínua na placa.
3.5. Processamento histológico
Ao final do período de infecção e dos testes comportamentais, os dez animais
de cada grupo experimental foram anestesiados com uma dose de Tiopental
(30mg/kg) e perfundidos através do ventrículo esquerdo com 180-250ml de solução
salina 0,9% em tampão fosfato 0,1 M heparinizada (pH 7,4) seguida de 250ml de
uma solução de paraformaldeído a 4% em tampão fosfato 0,1 M (pH 7,4). Após a
perfusão, os cérebros foram removidos e mergulhados em tampão fosfato 0,1 M (pH
7,4 a 4ºC) por 24 horas. Depois de lavados com solução salina 0,9%, os cérebros
foram crioprotegidos por mais 24 horas em sacarose 30%, também a 4ºC. Ao fim
desse processo, foram congelados em meio de inclusão para criotomia Tissue-Tek®
(Sakura, Japão). Os cérebros foram mantidos em freezer -80ºC até serem
seccionados coronalmente na espessura de 60 µm com um criostato.
Para imunohistoquímica, os cérebros foram seccionados, de forma seriada,
com 5 séries, com 60µm de espessura no criostato em plano coronal. As fatias
7
A
B
C
Figura 7: Diagrama esquemático do procedimento histológico no cérebro dos
animais experimentais. (A) visão sagital das regiões analisadas, (B) sequência coronal
exemplificando como foram feitas as identificações das áreas nos cortes seriados e (C)
esquema seriado de organização dos cortes nas lâminas (SANTOS, J.R., 2010).
Antes do procedimento imunohistoquímico, as secções foram previamente
lavadas e tratadas com peróxido de hidrogênio para inativação das peroxidases
endógenas. Em seguida, as secções do tecido foram incubadas com anticorpo
primário anti-TH, proveniente de coelhos, diluídos em tampão fosfato 0,1M contendo
soro normal a 0,4% (1:10.000; Millipore®) por toda a noite na temperatura ambiente.
No dia seguinte, as lâminas foram lavadas 4X por 10 minutos cada, em tampão
fosfato 0,1M, para em seguida serem incubadas com anticorpo secundário
anti-coelho feito em cabra (1:1000, Vector Laboratories, USA) por 2h em temperatura
ambiente. Após várias lavagens com tampão fosfato 0.1M, o complexo anticorpo foi
localizado utilizando o sistema ABC (Vectastain ABC Elite kit cat # PK6101, Vector
Laboratories®, USA) seguido pela reação com 3,3’-diaminobenzidina. As amostras
foram então desidratadas em etanol e xileno, para então serem montadas utilizando
3.6. Análise dos dados
Neste trabalho foi utilizado o software ANY-MAZE para análise
comportamental do paradigma de medo inato. A análise histológica foi realizada em
parte em microscópio comum binocular acoplado a uma câmera CCD de baixa
resolução. Algumas magens também puderam ser capturadas utilizando um
microscópio Zeiss de alta resolução acoplado a uma câmera digital monocromática
com base motorizada. Os softwares ImageJ (http:\\www.nih.gov) e MatLab
(v.R2009b, HTTP:\\www.mathworks.com) foram utilizados para processamento das
imagens e análise densitométrica. Os dados obtidos foram analisados com a ajuda
do software GraphPad v.5.0, utilizando o teste t de Student e o teste post-hoc de
4. RESULTADOS
4.1. Aparência física dos animais infectados
Foi observada diminuição da função comportamental e neurológica nos
camundongos infectados, utilizando as observações propostas por (HERMES, G. et
al.; 2008). Padrões de salubridade como a aparência física dos animais foram
observados durante o período de infecção. No primeiro quarto de tempo de infecção
foram verificadas dificuldades no padrão postural, piloereção, ferimentos na cauda,
marcha alterada, bem como variação no peso corporal (Figura 8).
Outros estudos disponíveis na literatura também demonstram estas
caracteristicas durante as duas primeiras semanas pós-infecção (SKALLOVA, A. et
al.; 2006; HERMES, G. et al.; 2008). De acordo com alguns estudos (SKALLOVA, A. et al.; 2006; AFONSO, C.; PAIXAO, V.B. ; COSTA, R.M.; 2012), os animais
estudados apresentam melhora nestas condições à medida que progride o tempo de
infecção. Neste trabalho, após 60 dias de infecção, apenas um animal apresentava
Figura 8: Aparência de camundongos controle não infectados (A) e infectados (B)
com o Toxoplasma gondii. Camundongos albinos Swiss com 2 meses de idade infectados
pelo período de 60 dias. (C) Imagem retirada de HERMES et al (2009) mostrando a
aparência de animal controle (1), infectado com ferimento na cauda (2) e infectado com
distúrbio postural (3).
4.2. Confirmação da infecção e avaliação do peso dos animais experimentais
O peso dos animais também foi acompanhado durante o experimento. Os
animais foram pesados antes da inoculação, 30 dias após e no término do
experimento, com 60 dias de infecção. Foi observado que camundongos infectados
perderam peso ou diminuíram o ganho de peso ao longo do tempo de infecção
(2,32±0,21), enquanto os animais controle mantiveram o ganho de peso (3,56±0,23)
(Tabela 1). O efeito no peso nos animais infectados pode ter relação direta com o processo fisiológico da doença, visto que as duas primeiras semanas de infecção
são cruciais para o desempenho imunológico dos animais (SKALLOVA, A. et al.;
2006; AFONSO, C.; PAIXAO, V.B. ; COSTA, R.M.; 2012). Todos os animais
infectados apresentaram positividade no teste de hemaglutinação. Animais controle
foram negativos como esperado.
1 2 3
Tabela 1: Variação de peso (gramas) dos animais experimentais durante o processo
de infecção comparados com o valor de peso médio de cada grupo (números negativos
indicam peso do animal abaixo do peso médio do grupo).
Animal Variação no peso Status
sorológico Antes Após 30 dias Após 60 dias
I1 0,5 3,5 6,5 +
I2 -0,5 0,5 5 +
I3 1,5 2 5,6 +
I4 0,5 1,3 5,4 +
I5 -1,5 1 4,3 +
I6 -2 0 5,2 +
I7 0,5 2,5 5,5 +
I8 0 1 4,6 +
I9 2 4,1 6,8 +
I10 -1 1 3,9 +
C1 0 3,3 8,4 -
C2 1 2 7,1 -
C3 -2 3,7 7,9 -
C4 1,5 4,9 9 -
C5 0,5 3,4 7,6 -
C6 -1,5 1,7 6 -
C7 0 2,6 7,4 -
C8 -1 2,3 6,6 -
C9 2 3,9 7,8 -
C
P
G
N
C
P
G
N
A) B)
+
-
4.3. Análise comportamental dos animais submetidos à exposição ao odor de gato
Para analisar a aversão aos odores, os animais foram colocados na arena de
campo aberto que continha quatro quadrantes, dentro dos quais havia quatro objetos
com diferentes odores posicionados. A posição inicial dos animais experimentais foi
no quadrante de odor de camundongo. Foi permitida a exploração do animal durante
15 minutos. Após isso, foi constatado que animais controle apresentavam diminuição
no padrão exploratório e uma robusta aversão ao quadrante com odor de gato
(Figura 9). Estes animais, controle, apresentaram um deslocamento para regiões
vizinhas ao quadrante de odor próprio. Em contrapartida, animais infectados
apresentaram um aumento no padrão exploratório e uma preferência pelo quadrante
com odor de seu predador. Este aumento de preferência pode ter relação direta com
a modulação do estado de medo ou semelhante a ansiedade.
Figura 9: Frequência media de ocupação dos quadrantes com diferentes odores pelos
animais (A) controles e (B) infectados (N=odor neutro; G=odor de gato; C=odor de cachorro;
P=odor próprio). (MaP: Maior tempo de permanência no quandrante; MeP: Menor tempo de
4.3.1. Atividade locomotora dos animais experimentais
Em relação à distância percorrida no campo aberto circular a análise de
variância entre o grupo infectado (100,9±3,50; n=10) e controle (69,27±5,55; n=10)
revelou uma diferença significativa. A atividade locomotora foi diferente tanto em
relação a distância total percorrida quanto em número de linhas cruzados entre as
zonas. Esses resultados confirmam estudos anteriores (AFONSO, C.; PAIXAO, V.B.
; COSTA, R.M.; 2012). (Figura 10)
Vale destacar que a distância percorrida foi diferente entre etapas do teste,
tendo em vista que o animal infectado apresentou uma maior locomoção no primeiro
e terceiro segmento temporal, o que condiz com dados de outros autores (AFONSO,
C.; PAIXAO, V.B. ; COSTA, R.M.; 2012)
A respeito da velocidade desenvolvida pelos animais, foi possível observar
que os animais controle (0,079±0,01; n=10) apresentaram maior velocidade do que
os animais infectados (0,109±0,01; n=10) (p<0,05). Estes resultados permitem inferir
que os animais controle apresentavam um comportamento semelhante à ansiedade.
Em contrapartida, o aumento da mobilidade, comportamento exploratório, com
comprometimento muscular (pelo aumento da velocidade) demonstram especiais
circunstâncias que sinalizam uma diminuição da ansiedade em animais infectados e,
por conseguinte, um possível aumento na taxa de predação pela diminuição do
0-300 300-600 600-900 0 10 20 30 40 50 Infectado Tempo (minutos) D is tâ n c ia p e rc o rr id a ( m e tr o s )
A
B
C
C I 0 50 100 150 D is tâ n c ia p e rc o rr id a ( m ) C I 0.00 0.05 0.10 0.15 V e lo c id a d e ( m /s ) * *4.3.2. Medo Inato
Com relação ao número de entradas nos quadrantes do aparato experimental
foi possível notar que os dois grupos apresentaram respostas distintas. Os animais
infectados passaram mais tempo na zona de odor de gato (283,53±11,06; n=10,
p<0,01) do que animais não infectados (179,15±13.2; n=10). Em contrapartida, os
animais não infectados ficaram mais tempo na zona de odor próprio (282,56±32.2;
n=10, p<0,05) quando comparados aos infectados (192,56±27.6; n=10) (Figura 11). Este resultado corrobora estudos anteriores que demonstraram a preferência do
animal infectado pelo ambiente com o odor do seu predador natural (BERDOY, M.;
WEBSTER, J.P. ; MACDONALD, D.W.; 2000; VYAS, A. et al.; 2007; VYAS, A.; KIM,
S.K. ; SAPOLSKY, R.M.; 2007)
Animais infectados apresentaram também uma maior preferência ao ambiente
com odor de cachorro. Isso pode ser confirmado quando avaliamos esta preferência
por segmento temporal do teste, no qual em 2/3 do teste os animais manifestaram
maior preferência pelo odor de gato e em seguida aumentaram a frequência de
permanência também no ambiente com odor de cachorro.
O mesmo pode ser visto com relação aos animais controle, que passaram a
frequentar mais o ambiente de odor neutro. Talvez esta diferença, embora não
significativa, tenha relação direta com o fluxo de ar da sala, que fazia com que os
odores de gato e cachorro se misturassem em determinado momento do teste.
Como visto por outros autores, animais infectados aumentam suas visitas ao
centro do aparato, sinalizando possivelmente um comportamento típico de
ansiedade (VYAS, A. et al.; 2007; VYAS, A.; KIM, S.K. ; SAPOLSKY, R.M.; 2007;
C I C I C I C I C I 0 10 20 30 40 50
P
N
C
G
Ce
E
n
tr
a
d
a
s
n
a
s
z
o
n
a
s
C
I
C
I
C
I
C
I
C
I
0
100
200
300
400
P
N
C
G
Ce
T
e
m
p
o
n
a
s
z
o
n
a
s
(
s
)
* * *A
B
Figura 11: Tempo nas zonas (média±erro padrão) definidas no campo aberto (A) e
número de entradas em cada zona definida (B) pelos animais infectados e não-infectados.
(C=controle; I=infectado; P=odor próprio; N=odor neutro; C=odor de cachorro; G=odor de
4.4. Análise histológica do cérebro de animais submetidos ao odor
Secções foram co-marcados com técnica de Nissl e anti-TH para contagem
de cistos cerebrais nos tecido nervoso de animais infectados. Foram separados os
cortes seriados contendo as áreas de interesse. A co-marcação demonstrou que
todos os espécimes estavam em bom estado anatômico e a marcação
dopaminérgica havia sido específica nos seus núcleos correspondentes (Figura 12).
Figura 12: Representação dos cortes histológicos do cérebro de animais infectados
pelo T. gondii. (A) Bulbo olfatório e (B) Substantia nigra e ATV.
4.4.1. Número de cistos no cérebro dos animais infectados
Foi realizada análise da distribuição de cistos em regiões do cérebro dos
animais infectados. A análise da freqüência de distribuição dos cistos em
determinadas áreas do cérebro apontam para uma distribuição variável e aleatória
(Figura 13 e 14). Em regiões relacionadas ao comportamento de medo, referidas
como alvo de tropismo do parasito em trabalhos anteriores, os cistos foram poucos e
em proporções variáveis (AmBSA= 3,4±0.74; VTA=2,8±0.4; SN=2,4±1.34;
ZCPA=0,8±0.37; 3,4±0.51; 3,01±0.89). Diferente de outros estudos, não foi
observado um acúmulo preferencial de cistos em estruturas como a amígdala
(VYAS, A. et al.; 2007).
Figura 13: Representação de cistos encontrados em áreas do cérebro dos animais
infectados pelo T. gondii. Cistos=Setas e cabeças de seta.
Figura 14: Distribuição de cistos em áreas do cérebro dos animais infectados pelo T. gondii. (AmBSA= amígdala basolateral; ATV= área tegmentar ventral; SN= Substantia nigra; ZCPA= zona cinzenta periaquedutal; AF=área frontal; Hcp=hipocampo) (*=p<0,05; ZCPA vs
AF).
100 µM
AmBLA ATV SN ZCPA AF Hcp
0 2 4 6 8
N
ú
m
e
ro
d
e
c
is
to
s
d
o
T
.
g
o
n
d
ii
4.4.2. Densidade de marcação nas áreas relacionadas ao medo inato e circuito dopaminérgico
A reatividade para a tirosina hidroxilase apresentou distribuição homogênea
em toda a substantia nigra e área tegmental ventral. Não houve alteração
significativa na reatividade nessas regiões quando os animais infectados foram
comparados com o grupo controle, o que foi confirmado através da análise
densitométrica (Figura 15A). Os resultados nos dois principais núcleos dopaminérgicos foram (Substantia nigra: C=0,106±0.005; I=0,1035±0.0047; ATV:
Figura 15: Análise densitométrica (média±erro padrão) e de contraste entre as
marcações para a enzima tirosina hidroxilase nos núcleos dopaminérgicos substantia nigra e
ATV em cérebros de animais controles e infectados.
Nigra ATV Nigra ATV
1.5 2.0 2.5
3.0 C I
D e n s id a d e Ó p ti c a
A
B
Nigra ATV Nigra ATV
Figura 16: Imunomarcação para enzima tirosina hidroxilase em cérebros de animais
infectados. (Cistos contendo bradizoítos são mostrados pelas setas).
5. DISCUSSÃO
O parasitismo é a capacidade de um organismo utilizar os recursos de seu
hospedeiro para sobreviver. De acordo com a hipótese de manipulação
comportamental, um parasita pode ser capaz de alterar o comportamento de seu
hospedeiro em benefício próprio (POULIN, R.; 2010; THOMAS, F.; POULIN, R. ;
BRODEUR, J.; 2010). Esta capacidade de modular o comportamento do hospedeiro
sugere adaptações intrigantes desenvolvidas por alguns parasitas para facilitar sua
própria transmissão entre hospedeiros (THOMAS, F.; ADAMO, S. ; MOORE, J.;
2005). Em roedores, por exemplo, especula-se que a atração pela urina do gato em
animais infectados é um tipo de manipulação comportamental, que pode aumentar a
taxa de predação por gatos, possibilitando a reprodução sexual do parasito
(WEBSTER, J.P.; BRUNTON, C.F. ; MACDONALD, D.W.; 1994; BERDOY, M.;
WEBSTER, J.P. ; MACDONALD, D.W.; 1995; SKALLOVA, A. et al.; 2006; VYAS, A.
et al.; 2007; VYAS, A.; KIM, S.K. ; SAPOLSKY, R.M.; 2007). A presença dos cistos
parasitários na amígdala (VYAS, A.; KIM, S.K. ; SAPOLSKY, R.M.; 2007), e o
consequente aumento nos níveis de dopamina locais poderia explicar o bloqueio da
aversão à urina de felinos em ratos infectados pelo parasita (VYAS, A. et al.; 2007;
VYAS, A.; KIM, S.K. ; SAPOLSKY, R.M.; 2007).
Vários autores têm sugerido que cistos de T. gondii se localizam em regiões
estratégicas para a manipulação do comportamento no sistema nervoso central de
mamíferos, como no sistema límbico (HOLLIMAN, R.E.; 1997), sistema olfatório,
córtex pré-frontal, hipotálamo, amigdala lateral e basolateral (VYAS, A. et al.; 2007).
Sendo estas regiões envolvidas na mediação de vários comportamentos sociais, tais
como agressividade, reprodução e comportamentos parentais (KLEIN, S.L., 2003).
Recentemente, alguns autores (BERENREITEROVA, M. et al.; 2011) demonstraram
a distribuição maciça e aleatória de cistos no cérebro de animais infectados, sem
estar associada aos núcleos dopaminérgicos ou a algum tropismo como anunciado
anteriormente (WEBSTER, J.P.; 1994; VYAS, A. et al.; 2007; HOUSE, P.K.; VYAS,
A. ; SAPOLSKY, R.; 2011). É importante destacar que o estudo de
(BERENREITEROVA, M. et al.; 2011) foi feito somente através de marcação
demonstrada alterada em testes in vitro (GOODWIN, D.G.; STROBL, J.S. ;
LINDSAY, D.S.; 2011; PRANDOVSZKY, E. et al.; 2011) e in vivo (STIBBS, H.H.;
1985; SKALLOVA, A. et al.; 2006).
Neste contexto, tem sido demonstrado que a capacidade de um parasita
alterar o comportamento de seus hospedeiros depende de sua capacidade de
modular o sistema imunológico ou os sistemas de neurotransmissores do
hospedeiro, como o sistema dopaminérgico (STIBBS, H.H.; 1985; WEBSTER, J.P.;
1994; SKALLOVA, A. et al.; 2006; VYAS, A. et al.; 2007; VYAS, A.; KIM, S.K. ;
SAPOLSKY, R.M.; 2007; HERMES, G. et al.; 2008).
Durante o período de infecção utilizado neste estudo, demonstrou-se que a
cepa ME-49 produz os mesmo efeitos na aparência dos animais experimentais
descrito por outros autores (HRDA, S. et al.; 2000; SKALLOVA, A. et al.; 2006;
HERMES, G. et al.; 2008). Tal efeito, no entanto, é temporário (HRDA, S. et al.;
2000) e ocorre por um período entre oito e dez semanas após a inoculação.
Nossos resultados demonstram que durante o período de infecção os animais
apresentam ganho de peso corporal reduzido, possivelmente em decorrência do
processo infeccioso. Contudo a redução de ganho de peso passa a ser cada vez
menor ao se aproximar a oitava semana de infecção. Isso demonstra que, embora
não tenha sido realizada a sorologia para confirmação do estado imunológico neste
período, os animais poderiam estar em processo de soroconversão. Este resultado é
corroborado por outros estudos (SKALLOVA, A. et al.; 2006; AFONSO, C.; PAIXÃO,
V.B. ; COSTA, R.M.; 2012) que observaram durante as primeiras semanas de
infecção a redução de peso porém com recuperação nas semanas seguintes.
A presença do T. gondii no tecido cerebral é demonstrada rotineiramente
quando se realiza um estudo morfológico no cérebro de animais infectados. Estudos
recentes têm demonstrado por bioluminescência a presença do parasito no tecido
cerebral também sugerem um tropismo para regiões do córtex cerebral, no lobo
frontal, e nas regiões do gânglio basal, hipotálamo e cerebelo
(DELLACASA-LINDBERG, I.; HITZIGER, N. ; BARRAGAN, A.; 2007; VYAS, A. et al.; 2007; VYAS,
No contexto das hipóteses de manipulação comportamental discutidas
recentemente na literatura, é importante notar que o parasito nem sempre está
associado com estruturas do sistema dopaminérgico, nem com o sistema defensivo
do hipotálamo. Apesar da variabilidade interindividual ser significativa, algumas
caracteristicas gerais se sobressaem nesta distribuição tecidual. Primeiro, as áreas
cerebrais corticais quase sempre exibem alta densidade de cisto em comparação
com regiões subcorticais (BERENREITEROVA, M. et al.; 2011). Em segundo,
regiões como a amígdala ou áreas associativas temporais apresentam alta
densidade de cistos, como descrito por alguns autores (VYAS, A. et al.; 2007; VYAS,
A.; KIM, S.K. ; SAPOLSKY, R.M.; 2007)
Cabe ressaltar que a presença do T. gondii no cérebro dos animais pode
afetar o processamento da informação dentro em uma ampla variedade de sistemas
funcionais cerebrais, uma vez que modificações locais podem afetar regiões
distantes através de supressão ou estimulação de receptores de membrana e vias
intracelulares (GOODWIN, D.G.; STROBL, J.S. ; LINDSAY, D.S.; 2011).
Neste trabalho, cistos contendo T. gondii foram encontrados distribuídos em
várias regiões do cérebro dos animais infectados, sem apresentar o tropismo
sugerido por alguns autores (VYAS, A. et al.; 2007; BERENREITEROVA, M. et al.;
2011). A distribuição de cistos foi avaliada em regiões dopaminérgicos e em regiões
relacionadas ao medo, para correlação do modelo utilizado com as alterações
comportamentais demonstradas. Pode-se constatar uma distribuição aleatória de
cistos em cada região estudada de cada animal infectado, no entanto uma tendência
de presença nas regiões moduladoras de medo.
O fato de não demonstrarmos um tropismo dos cistos permite supor que a
presença dos cistos em regiões dopaminérgicas e não dopaminérgicas modulam de
maneira sutil os sistemas de neurotransmissão locais. Desta forma podem alterar
comportamentos regidos por áreas aferentes e eferentes deste sistema, o que pode
influenciar os animais para determinados fenótipos comportamentais já
demonstrados anteriormente como mudanças na análise de risco ou o medo inato
(BERDOY, M.; WEBSTER, J.P. ; MACDONALD, D.W.; 2000; VYAS, A. et al.; 2007;
SAPOLSKY, R.; 2011). Estes resultados sugerem que o acúmulo de cisto em
diferentes áreas de um circuito em particular pode conduzir a alterações
comportamentais semelhantes e, assim, o próprio parasita pode ter sofrido pressão
seletiva para manipular circuitos neuronais funcionais em detrimento a uma área
específica.
Neste estudo, animais infectados aumentaram sua locomoção exploratória
quando expostos ao odor específico de seu predador, apresentando maior distância
percorrida e maior velocidade de movimentos. A exploração do ambiente também
ocorreu de maneira diferente em relação ao grupo controle, quando avaliado o
número de entrada nas zonas e o cruzamento entre as linhas das zonas do aparato.
Os animais infectados apresentaram menor número de cruzamento de segmentos.
Além disso, os animais infectados apresentavam menor tigmotaxia, se expondo mais
ao centro, demonstrando um comportamento de menor ansiedade (VYAS, A. et al.;
2007; VYAS, A.; KIM, S.K. ; SAPOLSKY, R.M.; 2007). Os animais infectados
apresentaram respostas preferenciais a áreas inseguras (mais próximas ao odor do
predador), demonstrando um comportamento de medo inato reduzido e por
conseguinte expressando um maior comportamento de risco.
Animais infectados apresentaram também uma maior preferência ao ambiente
com odor de cão, possivelmente por mistura de odores no aparato. Isso pode ser
confirmado quando avaliamos esta preferência por segmento temporal do teste, no
qual em 2/3 do teste os animais manifestaram maior preferência pelo odor de gato e
em seguida aumentaram a frequência de permanência também no ambiente com
odor de cachorro.
Animais controle também passaram a frequentar mais outros ambientes,
como o de odor neutro após 2/3 do teste. Estes eventos podem ter sido ocasionados
pela direção do fluxo de ar da sala, que induzia a mistura de odores após certo
tempo de teste, e pelo tipo de aparato utilizado, o qual facilita a mistura de odores
em seu interior.
Os dados aqui apresentados sugerem que os animais cronicamente