CENTRO DE CIÊNCIAS EXATAS E DA TERRA
PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
TESE DE DOUTORADO
H
H
I
I
D
D
R
R
O
O
C
C
A
A
R
R
B
B
O
O
N
N
E
E
T
T
O
O
S
S
P
P
O
O
L
L
I
I
C
C
Í
Í
C
C
L
L
I
I
C
C
O
O
S
S
A
A
R
R
O
O
M
M
Á
Á
T
T
I
I
C
C
O
O
S
S
N
N
O
O
M
M
E
E
I
I
O
O
A
A
M
M
B
B
I
I
E
E
N
N
T
T
E
E
:
:
D
D
I
I
F
F
E
E
R
R
E
E
N
N
C
C
I
I
A
A
Ç
Ç
Ã
Ã
O
O
D
D
E
E
F
F
O
O
N
N
T
T
E
E
S
S
E
E
M
M
S
S
E
E
D
D
I
I
M
M
E
E
N
N
T
T
O
O
S
S
E
E
M
M
E
E
T
T
A
A
B
B
Ó
Ó
L
L
I
I
T
T
O
O
S
S
E
E
M
M
B
B
I
I
L
L
E
E
D
D
E
E
P
P
E
E
I
I
X
X
E
E
S
S
Maria de Fátima Guadalupe Meniconi
Orientador: Prof. Dr. Valter José Fernandes Jr.
HIDROCARBONETOS POLICÍCLICOS AROMÁTICOS NO
MEIO AMBIENTE: DIFERENCIAÇÃO DE FONTES EM
SEDIMENTOS E METABÓLITOS EM BILE DE PEIXES
B
BAANNCCAAEEXXAAMMIINNAADDOORRAA
Prof. Dr. Valter José Fernandes Junior – UFRN (Presidente)
Prof. Dr. Luiz Augusto dos Santos Madureira – UFSC
Prof. Dr. Arthur de Lemos Scofield – PUC-RJ
Prof. Dr. Marcus Antônio de Freitas Melo – UFRN
Prof. Dr. Dulce Maria de Araújo Melo – UFRN
Prof. Dr. Antônio Souza de Araújo – UFRN
Meniconi, Maria de Fátima Guadalupe.
Hidrocarbonetos policíclicos aromáticos no meio ambiente: diferenciação de fontes em sedimentos e metabólitos em bile de peixes / Maria de Fátima Guadalupe. – Natal, 2007.
213 f. : il.
Orientador: Valter José Fernandes Jr.
Tese (Doutorado) – Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação em Química.
ou melhor: Bordeaux – Rio ou na memória: Divinópolis – BH. Não importa. O que importa é o amor que atravessa tudo e está em tudo. Nós, eu e você; nossos filhos adorados; nossas famílias, apesar dos detalhes. Mas, no resumo e extrato,
o que importa somos nós.
Chegamos lá. Temos uma comunhão rara.”
pela presença constante em meu coração,
Agradeço, primeiramente, a meu orientador, Valter, pela oportunidade, confiança, e amizade. Sua garra, entusiasmo, discernimento e leveza são qualidades que trarei para meu cotidiano como referência.
Agradeço, também pelo carinho e estímulo, à pessoa maravilhosa que é Antônio Araújo. É um privilégio tê-lo por perto.
Sou grata a todos os colegas do Centro de Pesquisas da Petrobras (CENPES) e particularmente ao Grupo de Química Ambiental. Especialmente agradeço à Heloísa, Rui, Politano, Cristina Bentz, Rosana, Mauro, Leonardo, Denis, Eleine, Leandro, André, Sirayama, Sanseverino, Maurício, Teresinha, Mônica Aparecida, Flávia, Gilson, Paulo César e Lima, que colaboraram em diversas fases deste trabalho.
Ao pessoal da Reprografia do CENPES, agradeço pelo sempre excelente trabalho, camaradagem e bom humor.
Agradeço também aos colegas do SOP, que viabilizaram a difícil tarefa de envio de bile de peixe para a França.
Sou imensamente grata ao colega, amigo e extraordinário químico Scot, referência para todos nós. Sua alegria é contagiante. Suas discussões, uma aprendizagem constante.
coordenação do grupo, tornando possível minha dedicação ao trabalho de tese. Isto foi fundamental. Sou grata também por sua cuidadosa revisão do manuscrito e por suas discussões tão pertinentes e calorosas.
À minha amiga Irene, agradeço pelo incentivo nesta empreitada e sempre. Sou grata por seu suporte permanente, sua liderança e seus cuidados constantes. Sua bondade e desprendimento são exemplos para todos nós.
Agradeço a Petrobras por ter viabilizado meu programa de pós-graduação, em especial ao Gerente Pedro Penido Duarte Guimarães, concedendo os recursos necessários para a realização deste trabalho.
Agradeço as pessoas com as quais convivi no Laboratório de Físico-toxicoquímica de Sistemas Naturais da Universidade de Bordeaux e que contribuíram para este trabalho. Especialmente à Hélèn Budzinski e Marie le Dû, pela oportunidade e aprendizagem que tive com elas. Agradeço ainda a Sylvie Augagneur por me ajudar a sobreviver à burocracia francesa.
Ainda em Bordeaux, agradeço a convivência maravilhosa com Jean Claude, Annie e Marta ao longo de ricos três meses onde, longe da família e de casa, experimentei nova e duradoura amizade.
A minha irmã de direito, de sangue e de sonhos, Maria Neusa, minha referência sempre, sou grata pela força, admiração e amor incondicional.
Sumário
Pág.
Sumário i
Resumo iii
Abstract v
Lista de Figuras vii
Lista de Tabelas xii
CAPÍTULO 1 Introdução e Objetivos 1
1.1. Introdução 2
1.2. Objetivos 4
1.2.1.Objetivo Geral 4
1.2.2. Objetivos Específicos 4
CAPÍTULO 2 Aspectos Teóricos e Revisão da Litetratura 6
2.1. Introdução 7
2.2. Hidrocarbonetos Policíclicos Aromáticos 9
2.3. Comportamento dos HPA no Ambiente Marinho e seus Metabólitos 12
2.3.1. Propriedades físico-químicas dos HPA 12
2.3.2. Ciclos Geoquímico e Biológico dos HPA no Meio Ambiente 15 2.3.3. Biotransformação dos HPA (Metabólitos) e sua Toxicidade 24 2.3.4. Critérios de Qualidade Ambiental: Valores Orientadores de HPA 28
2.4. Principais Fontes de HPA no Ambiente Marinho 33
2.4.1. Fontes Antropogênicas 33
2.4.2. Fontes Naturais 44
2.5. Diferenciação de Fontes de HPA em Amostras Ambientais 47
2.5.1. Razões Diagnósticas de HPA 48
2.5.2. Análise de Componente Principal (ACP) 54
CAPÍTULO 3 Área de Estudo 55
3.1. Características Regionais da Baía de Guanabara e sua Poluição Antropogênica Crônica
56
3.2. Derrame de Óleo Combustível na Baía de Guanabara – Janeiro de 2000 62
CAPÍTULO 4 Materiais e Métodos 65
4.1. Diferenciação de Fontes de HPA em Sedimentos da Baía de Guanabara 66
4.1.1. Estratégia Amostral 67
4.1.2. Determinação dos HPA em Sedimentos 71
4.1.2.1. Extração da Amostra 72
4.1.2.2. Fracionamento do Extrato 73
4.1.2.3. Análise de HPA por CG-EM 73
4.1.3. Técnicas de Identificação de Fontes de HPA 75
4.1.3.1. Razões Diagnósticas 75
4.1.3.2. Análise de Componentes Principais (ACP) 77
4.2.1. Estratégia Amostral 79
4.2.2. Coleta de Bile de Peixe 82
4.2.3. Determinação dos Metabólitos Biliares de HPA 84
4.2.3.1. Preparo da Amostra 85
4.1.3.2. Análise de Metabólitos de HPA por CG-EM 86
CAPÍTULO 5 Resultados e Discussão 88
5.1. Quantificação e Distribuição dos HPA em sedimentos da Baía de Guanabara 89
5.2. Diferenciação de Fontes de HPA na Baía de Guanabara 98
5.2.1. Razões Diagnósticas 98
5.2.2. Análise de Componentes Principais (ACP) 113
5.3. Metabólitos de HPA em Bile de Peixes da Baía de Guanabara 118
5.3.1. Análise Descritiva dos Teores de Metabólitos de HPA 123
5.3.2. Avaliação Estatística dos Teores de Metabólitos de HPA 133
CAPÍTULO 6 Conclusões 141
CAPÍTULO 7 Recomendações 147
CAPÍTULO 8 Referências Bibliográficas 150
ANEXOS 171
Anexo A Lista de HPA analisados por CG-EM em sedimento da Baía de Guanabara
172
Anexo B Lista das coordenadas geográficas das estações de sedimento na Baía de Guanabara
173
Anexo C Lista de metabólitos de HPA analisados em bile de peixes 174
Anexo D Concentração de HPA em sedimentos da Baía de Guanabara, campanhas 2000 e 2003 e nos óleos estudados
175
Anexo E Análises paramétrica e não paramétrica dos teores de HPA em sedimentos da Baía de Guanabara entre as campanhas 2000 e 2003
180
Anexo F Distribuição de HPA em sedimentos da Baía de Guanabara para as
campanhas 2000 e 2003 - concentrações individuais 183
Anexo G Valores das razões diagnósticas de HPA para as amostras de
sedimentos da Baía de Guanabara coletadas nas campanhas 2000 e 2003 e para os óleos e derivados estudados
190
Anexo H Dados processados de HPA para análise de ACP das amostras de sedimentos da Baía de Guanabara das campanhas de 2000 e 2003
Resumo
predominantemente petrogênicos e sedimentos com características de combustão. Apenas uma minoria de amostras não apresentou com nitidez a natureza de sua contaminação. As razões que apresentaram maior capacidade em diferenciar as fontes de HPA foram Fluoranteno / (Fluoranteno + Pireno), (Fenantreno + Antraceno) / (Fenantreno + Antraceno + C1Fenantreno) e o índice
pirolítico, 6 ҏҏ(HPA parentais de 3-6 anéis) /6 (5 séries de HPA alquilados). Na avaliação temporal realizada neste estudo não foram verificadas variações significativas na natureza das fontes contaminantes predominantes na baía, revelando que os hidrocarbonetos presentes estão correlacionados principalmente com os aportes crônicos e não diretamente com eventos agudos como o derrame de óleo ocorrido em janeiro de 2000. Este estudo teve como segundo objetivo a avaliação preliminar do nível de exposição a que os organismos aquáticos da Baía de Guanabara estão submetidos, através da quantificação de 12 metabólitos individuais de HPA presentes em bile de peixe de quatro espécies demersais representativas de três famílias diferentes. Os metabólitos analisados foram 1-hidroxinaftaleno, 1-hidroxifenantreno, 9-hidroxifenantreno, 2-hidroxinaftaleno, 2-9-hidroxifenantreno, 1-hidroxipireno, 3-hidroxibifenila, 3-hidroxifenantreno, 1-hidroxicriseno, 9-hidroxifluoreno, 4-hidroxifenantreno, 3-hidroxibenzo(a)pireno. As concentrações encontradas nas espécies de peixes analisadas mostraram-se elevadas, na faixa de 13 a 177 Pg g
-1, porém similares às encontradas em algumas regiões de grande influência
antropogênica, tanto no Brasil quanto no exterior. Além dos metabólitos estabelecidos pela metodologia utilizada, foi possível quantificar três compostos, ainda não reportados na literatura, em concentrações relevantes. Estes metabólitos, relacionados a contribuição pirolítica de HPA aos organismos aquáticos da Baía de Guanabara, são isômeros de 1-hidroxipireno e de 3-hidroxibenzo(a)pireno.
Abstract
diagnostic ratios that have exhibited high ability to distinguish combustion- and petroleum-derived PAH inputs for Guanabara Bay sediments were Phenanthrene+Anthracene/ (Phenanthrene+Anthracene+C1Phenanthrene); Fluorantene/(Fluorantene+Pyrene); 6 (other 3-6 ring PAHs)/ 6 (5 alkylated PAH series). The PCA results prooved to be a useful tool for PAH source identification in the environment, corroborating the diagnostic indexes. In relation to the temporal evaluation carried out in this study, it was not verified significant changes on the class of predominant source of the samples. This result indicates that the hydrocarbons present in the Guanabara Bay sediments are mainly related to the long-term anthropogenic input and not directly related to acute events such as the oil spill of January 2000. This findings were similar to various international estuarine sites. Finally, this work had a complementary objective of evaluating the level of hydrocarbons exposure of the aquatic organisms of Guanabara Bay. It was a preliminary study in which a quantification of 12 individual biliar metabolites of PAH was performed in four demersal fish representing three different families. The analysed metabolites were hydroxynaphtalene, 2-hidroxinaphtalene, hydroxyphenanthrene, 9-hydroxyphenanthrene, 2- hydroxyphenanthrene, 1-hydroxypyrene, 3-hidroxibiphenil, 3- hydroxyphenanthrene, 1-hydroxychrysene, 9-hydroxyfluorene, 4- hydroxyphenanthrene, 3-hydroxybenz(a)pyrene. The metabolites concentrations were found to be high, ranging from 13 to 177 Pg g-1, however they were similar to worldwide regions under high anthropogenic input. Besides the metabolites established by the used protocol, it was possible to verified high concentrations of three other compounds not yet reported in the literature. They were related to pyrolytic PAH contribution to Guanabara Bay aquatic biota: 1-hydroxypyrine and 3-hydroxybenz(a)pyrine isomers.
Lista de Figuras
Capítulo 2 - Aspectos Teóricos e Revisão da Litetratura
Figura 2.1. Estruturas e nomenclatura dos HPA parentais prioritários da EPA
10
Figura 2.2. Estruturas e nomenclatura de HPA parentais e alquilados mais frequentemente investigados na literatura
11
Figura 2.3. Esquema de origem, transporte e transformação dos HPA no meio ambiente
16
Figura 2.4. Variação da distribuição dos HPA em amostra de sedimento de Prince William Sound, Alaska, após acidente do navio
Exxon Valdez face ao intemperismo
18
Figura 2.5. Evolução da razão C2 Criseno/C2 Fenantreno para amostras do óleo derramado do navio tanque Exxon Valdez no Alasca ao
19
Figura 2.6. Processo de transformação dos HPA em organismos aquáticos
22
Figura 2.7. Esquema da ativação metabólica de HPA através de oxidação por reação enzimática
25
Figura 2.8. Estruturas e nomenclaturas de metabólitos livres (A) e conjugados (B) de HPA
26
Figura 2.9. Processo de formação de petróleo e seu armazenamento 34
Figura 2.10. Perfis de distribuição de alguns HPA demonstrando as
diferenças entre fontes petrogênicas e pirolíticas em função da abundância relativa dos HPA parentais e seus respectivos alquilados
36
Figura 2.11. Estatística de derrames de óleo segundo ITOPF 38
Figura 2.12. Processos de alteração de um óleo após contato com o meio ambiente
43
Figura 2.13. Escala de tempo dos diversos processos de intemperismo de óleo no meio ambiente
43
Figura 2.14. Representação de uma exsudação de óleo na superfície do oceano
46
Figura 2.15. Exsudações na superfície do oceano (a) formas circulares (b) formas alongadas
46
Figura 2.16. Habilidade de discriminação de razões diagnóstica com base em isômeros parentais através de estabilidade termodinâmica
52
Capítulo 3 - Área de Estudo
Figura 3.2. Características socio-fisico-econômica da Baía de Guanabara 57
Figura 3.3. Evolução da mancha de óleo após acidente de janeiro/2000 na Baía de Guanabara
63
Capítulo 4 - Materiais e Métodos
Figura 4.1. Fluxograma do procedimento experimental e analítico do estudo de diferenciação de fontes de HPA em sedimentos da Baía de Guanabara
67
Figura 4.2. Posição geográfica das 21 estações de sedimento na Baía de
Guanabara analisadas em 2000 e 2003 68
Figura 4.3. Coleta de amostras de sedimento da baía de Guanabara com testemunhadores e dragas e sub-amostragem da camada
superior do sedimento
70
Figura 4.4 Lista dos 38 HPA analisados neste estudo: 16 prioritários EPA, os homólogos alquilados e outros
71
Figura 4.5. Fluxograma das etapas analíticas envolvidas na determinação de HPA em sedimentos da Baía de Guanabara
72
Figura 4.6. Cromatograma de massas dos HPA parentais de uma mistura
padrão 74
Figura 4.7. Fluxograma das etapas do estudo de metabólitos de HPA em bile de peixes da Baía de Guanabara
78
Figura 4.8. Imagens das espécies de peixes estudadas na Baía de Guanabara
80
Figura 4.9. Local geográfico das estações de coleta de peixes por arrasto na Baía de Guanabara para a análise de metabólitos biliares de PAH
81
Figura 4.10. Ilustração do procedimento de extração da visícula biliar de peixes da Baia de Guanabara
82
Figura 4.11 Fluxograma das etapas analíticas envolvidas na
determinação de metabólitos de HPA em bile de peixes
84
Figura 4.12. Cromatograma de massas dos metabólitos de HPA de uma mistura padrão após derivatização
87
Capítulo 5 - Resultados e Discussão
Figura 5.1. Predomínio de HPA alquilados em amostras de intermaré para a campanha de 2000 em relação à de 2003 na Baía de
Guanabara
94
Figura 5.2. Predomínio de HPA de quatro e cinco anéis para as amostras do infralitoral para as campanhas de 2000 e 2003 dentro da área de influência da mancha de óleo de janeiro de 2000
Figura 5.3. Predomínio de HPA de quatro e cinco anéis para as amostras do infralitoral para as campanhas de 2000 e 2003 fora da área de influência da mancha de óleo de janeiro de 2000
96
Figura 5.4. Distribuição dos HPA por número de anéis para os sedimentos da Baía de Guanabara – campanha 2000
97
Figura 5.5. Distribuição dos HPA por número de anéis para os sedimentos da Baía de Guanabara – campanha 2003
97
Figura 5.6. Diagrama cruzado de Fenantreno/Antraceno versus
Fluoranteno/Pireno para sedimentos da Baía de Guanabara das campanhas 2000 e 2003 e MF 380, óleo árabe (AL), óleo leve (Ar) e óleo diesel (DM)
100
Figura 5.7. Diagrama cruzado de Antraceno/Antraceno+Fenantreno versus
Fluoranteno /(Fluoranteno+Pireno) para os sedimentos da Baía de Guanabara das campanhas 2000 e 2003 e MF 380, óleo árabe (AL), óleo leve (Ar) e óleo diesel (DM)
101
Figura 5.8. Diagrama cruzado de Indeno (CD)Pireno/Indeno 1,2,3-(cd)Pireno+ Benzo(ghi)Perileno versus Fluoranteno/(fluoranteno + pireno) para os sedimentos da Baía de Guanabara das campanhas 2000 e 2003 e MF 380, óleo árabe (AL), óleo leve (Ar) e óleo diesel (DM)
102
Figura 5.9. Diagrama cruzado de Fluoranteno/(Fluoranteno+Pireno) versus Fenantreno+Antraceno/(Fenantreno+Antraceno+C1Fenantreno) para os sedimentos da Baía de Guanabara das campanhas de 2000 e 2003 e MF 380, Petróleo árabe (AL), óleo leve (Ar) e óleo diesel (DM).
103
Figura 5.10. Diagrama das razões [6(HPA parentais de 3-6 anéis)/6 (5 séries de HPA alquilados)]. versus Fenantreno/Antraceno para sedimentos da Baía de Guanabara das campanhas de 2000 e de 2003 e e MF 380, Petróleo árabe (AL), óleo leve (Ar) e óleo diesel (DM).
107
Figura 5.11. Diagrama das razões [6(HPA parentais de 3-6 anéis)/6 (5 séries de HPA alquilados)]. Versus
Fluoranteno/(Fluoranteno+Pireno) para sedimentos da Baía de Guanabara das campanhas de 2000 e de 2003 e e MF 380,
Petróleo árabe (AL), óleo leve (Ar) e óleo diesel (DM)
108
Figura 5.12. Abundância relativa de perileno para os sedimentos da Baía
de Guanabara das campanhas de 2000 e de 2003 109 Figura 5.13. Diagrama cruzado de C3BDT/C3Fe versus C2BDT/C2Fe para
os sedimentos da Baía de Guanabara das campanhas 2000 e 2003 e MF 380, Petróleo árabe (AL), óleo leve (Ar) e óleo diesel (DM)
110
Figura 5.14. Razão C2Criseno/C2Fenantreno para os sedimentos da Baía
de Guanabara das campanhas 2000 e 2003 111
Figura 5.15. Classificação das fontes de HPA para os sedimentos da Baía de Guanabara considerando as campanhas 2000 e 2003
Figura 5.16. Projeções de ACP de variáveis de HPA e amostras de sedimento de campanha de 2000 e MF 380, óleo leve (Ar), óleo árabe (AL) e óleo diesel (DM)
113
Figura 5.17. Projeções de ACP de variáveis de HPA e as amostras de sedimentos de campanha de 2003 e e MF 380, óleo leve (Ar), óleo árabe (AL) e óleo diesel (DM)
114
Figura 5.18. Cromatograma de massas dos metabólitos de HPA depois da derivatização para a amostra de bile da Cyclichthys spinosus
coletada no fundo da Baía de Guanabara, em março/2006
118
Figura 5.19. Somatório das concentrações (Pg g-1) de metabólitos de HPA
(6 12 OH-HPA) para a espécie Genidens genidens coletada no fundo da Baía de Guanabara em fevereiro, março e abril
119
Figura 5.20. Somatório das concentrações (Pg g-1) de metabólitos de HPA (6 12 OH-HPA) para a espécie Micropogonias furnieri coletada
no fundo e na entrada da Baía de Guanabara
120
Figura 5.21. Somatório das concentrações (Pg g-1) de metabólitos de HPA (6 12 OH-HPA) para a espécie Cyclichthys spinosus
amostrada no fundo e na entrada da Baía de Guanabara
120
Figura 5.22. Gráfico de barras descritivo das concentrações de metabólitos de HPA em bile de Genidens genidens na área interna da
Baía de Guanabara (Área 1) coletadas em fevereiro, março e abril de 2006
124
Figura 5.23. Gráfico de barras descritivo das concentrações de metabólitos de HPA para a espécie de peixe Micropogonias furnieri
coletada na área interna e entrada da Baía de Guanabara.
125
Figura 5.24. Gráfico de barras descritivo das concentrações de metabólitos de HPA para a espécie de peixe Cyclichthys spinosus
coletada na área interna e entrada da Baía de Guanabara
126
Figura 5.25. Gráfico de barras descritivo das concentrações de metabólitos de HPA para as espécies Cyclichthys spinosus, Genidens genidens e Micropogonias furnieri na área interna da Baía de
Guanabara
126
Figura 5.26. Gráfico de barras descritivo para as espécies Cyclichthys
spinosus e Micropogonias furnieri na entrada da Baía de
Guanabara
127
Figura 5.27. Cromatograma de massas para íon m/z 290 para uma amostra padrão (GBTEST05) e amostras de bile da espécie
Cyclichthys spinosus da Baía de Guanabara.
129
Figura 5.28. Estruturas de possíveis isômeros do 1-hidroxipireno (m/z 290).
Figura 5.29. Cromatograma de massas para íon m/z 290 para uma amostra padrão (linha preta) e amostras de bile das espécies
Micropogonis furnieri e Genidiens genidens. da Baía de
Guanabara (linhas coloridas)
130
Figura 5.30. Cromatograma de massas para íon m/z 340 para uma amostra padrão (linha preta) e amostras de bile de peixe da espécie
Cyclichthys spinosus da Baía de Guanabara (linhas coloridas)
131
Figura 5.31. Estruturas de possíveis isômeros do 3-hidroxibenzo(a)pireno (m/z 340)
131
Figura 5.32. Gráfico de barras descritivo para as espécies Cyclichthys
spinosus, Genidens genidens e Micropogonias Furnieri na
área interna da Baía de Guanabara, considerando os 12 metabólitos e 3 isômeros (m/z 290 A e B e m/z 340)
Lista de Tabelas
Capítulo 2 - Aspectos Teóricos e Revisão da Litetratura
Tabela 2.1. Propriedades físico-químicas dos HPA prioritários e distribuição de anéis segundo Mackay et al (1992).
14
Tabela 2.2. Classificação dos HPA de acordo com seu potencial Carcinogênico.
27
Tabela 2.3. Valores orientadores de concentrações de HPA em
sedimentos (marinhos e de água doce) e na coluna d’água (água doce e marinha) nos EUA (NOAA Squirts)
30
Tabela 2.4. Valores orientadores de concentrações de HPA em sedimentos (marinhos e de água doce), solo e na coluna d’água (água doce) no Canadá (Canadian Environmental Quality Guidelines)
31
Tabela 2.5. Padrões de qualidade para HPA das águas do Brasil (CONAMA 357, março de 2005, artigo 14)
32
Tabela 2.6. Valores orientadores de concentrações de HPA em água
subterrânea e solos da Cetesb 32
Tabela 2.7. Lista dos maiores acidentes com derrame de óleo nos últimos 30 anos
39
Tabela 2.8. Valores característicos das razões moleculares para
identificação de fontes de HPA 49
Tabela 2.9. Habilidade de discriminação de aportes petrogênicos e pirolíticos em relação às relativas estabilidades
termodinâmicas de alguns isômeros
52
Capítulo 4 - Materiais e Métodos
Tabela 4.1. Amostras de bile de peixe para análise de metabólitos de HPA 83
Tabela 4.2. Principais íons (m/z) característicos dos espectros de massas obtidos por CG-EM com e sem derivatização
87
Capítulo 5 - Resultados e Discussão
Tabela 5.1. Resumo dos resultados de HPA (ng g-1 peso seco) de
amostras de sedimento de Baía de Guanabara para a campanha 2000
90
Tabela 5.2. Resumo dos resultados de HPA (ng g-1 peso seco) de amostras de sedimento de Baía de Guanabara para a campanha 2003
Tabela 5.3. Comparação dos teores de HPA (ng g-1peso seco) deste estudo com dados de literatura para sedimentos de inúmeros locais costeiros no mundo
93
Tabela 5.4. Razões diagnósticas utilizadas para os sedimentos da Baía de Guanabara e suas faixas limítrofes de identificação de fontes
98
Tabela 5.5. Concentrações médias de 12 metabólitos biliares de HPA (Pg g-1 bile) de peixes da Baía de Guanabara
119
Tabela 5.6. Concentração de metabólitos totais em bile de peixes (ng g-1
de bile) em regiões costeiras nacionais e internacionais 122 Tabela 5.7. Tempos de retenção e íons de quantificação dos metabólitos
de HPA analisados nas condições descritas no protocolo
128
Tabela 5.8. Concentrações dos metabólitos biliares de HPA (Pg g-1 bile) de peixes da Baía de Guanabara considerando os 12 compostos e 3 isômeros
132
Tabela 5.9. Banco de dados de concentrações de metabólitos biliares de HPA de peixes da Baía de Guanabara (Pg g-1de bile)
134
Tabela 5.10. Ranks quanto ao fator Família 135
Tabela 5.11. Níveis descritivos amostrais (p-valor) para os metabólitos de HPA em relação ao Fator Família (Teste Kruskal-Wallis)
135
Tabela 5.12. Ranks quanto ao fator Tempo 136
Tabela 5.13. Níveis descritivos amostrais (p-valor) para os metabólitos de HPA em relação ao Fator Tempo (Teste Kruskal-Wallis)
136
Tabela 5.14. Ranks quanto ao fator Local 137
Tabela 5.15. Níveis descritivos amostrais (p-valor) para os metabólitos de HPA em relação ao Fator Local (Teste Kruskal-Wallis)
Lista de Abreviaturas
APA Área de Proteção Ambiental
APC Análise de componentes principais
BSTFA Bis(trimetilsilano)-trifluoracetamida
CG-EM Cromatografia gasosa acoplada à espectrometria de massas CLAP-F cromatografia líquida de alta performance com detector de fluorescência CONAMA Conselho Nacional de Meio Ambiente
EPA Environmental Protection Agency
Hf Calor de formação
HPA Hidrocarbonetos Policíclicos Aromáticos
ITOPF International Tanker Owners Pollution Federation
LDM Limite de detecção do método
m metro
MCNR Mistura complexa não resolvida
mg Miligrama (10-3 g)
Pg Micrograma (10-3 g)
PL Microlitro (10-3 L)
Pm Micrômetro (10-6m)
mm Milímetro (10-3m)
m/z Íon de quantificação – razão massa sobre carga
ng Nanograma (10-9 g)
NOAA National Oceanic and Atmospheric Administration
NOS Compostos contendo átomos de nitrogênio (N), oxigênio (O) e enxofre (S)
OH-HPA Metabólito de HPA
p-valor Níveis descritivos amostrais
Capítulo 1
1. Introdução e Objetivos
1.1. Introdução
Os hidrocarbonetos policíclicos aromáticos (HPA) são compostos ubíquos no meio ambiente e advêm principalmente do uso do petróleo como uma das mais importantes fontes de energia para a condução da vida contemporânea. Entretanto, é preciso ressaltar que existem vários mecanismos diferentes pelos quais os hidrocarbonetos podem ser introduzidos no meio ambiente.
Dentre as fontes antropogênicas de HPA pode-se citar os despejos domésticos e industriais, as drenagens pluviais urbanas, os efluentes da indústria petrolífera, os derrames acidentais de óleo e derivados, a combustão incompleta de óleo combustível automotivo e industrial e a queima intencional de madeira e plantações. As fontes naturais incluem as películas de plantas superiores, algas, plânctons e exsudações naturais de petróleo no oceano.
Portanto, principalmente em centros urbanos e industriais, a contaminação das amostras ambientais por estes agentes retratam, inevitavelmente, a coexistência de múltiplas fontes de hidrocarbonetos face às diversas formas de introdução de hidrocarbonetos no meio ambiente. Além disso, os hidrocarbonetos, quando presentes no meio ambiente, estão sujeitos a processos físicos, químicos e biológicos que alteram de sua composição química, tornando um grande desafio sua identificação.
casos de derrames acidentais, quanto nos programas de gestão ambiental de áreas afetadas direta ou indiretamente pela presença do contaminante.
Adicionalmente, os estudos ambientais de áreas contaminadas por hidrocarbonetos requerem, além da detecção dos níveis de hidrocarbonetos no meio ambiente (sedimento e água) e de suas fontes, avaliações integradas dos ecossistemas, fornecendo dados da biodisponibilidade dos contaminates aos organismos aquáticos. Estes estudos procuram estabelecer a conexão entre as concentrações dos hidrocarbonetos no meio ambiente e nos tecidos e fluídos dos organismos.
Uma das formas de avaliação da biodisponibilidade de contaminates se dá por meio de análise de metabólitos de hidrocarbonetos policíclicos aromáticos em fluídos biológicos de organismos aquáticos. Tal análise fornece subsídios para a avaliação do nível de exposição a que os organismos foram submetidos, subsidiando estudos integrados do ecossistema. Um dos indicadores utilizados é o nível de metabólitos de HPA em bile de peixe.
1.2. Objetivos
1.2.1. Objetivo Geral
Este trabalho teve como objetivo principal aplicar técnicas para identificação e diferenciação de fontes de hidrocarbonetos em amostras de sedimento da Baía de Guanabara, utilizando razões diagnósticas de HPA e análises estatísticas multivariadas. O segundo objetivo foi avaliar, de forma preliminar, os metabólitos de HPA em bile de peixes demersais coletados na Baía de Guanabara para verificar o nível de exposição destes organismos a hidrocarbonetos.
1.2.2. Objetivos Específicos
Os objetivos específicos do presente trabalho foram:
x Determinar as concentrações dos HPA parentais, seus isômeros e séries homólogas em amostras de sedimento da Baía de Guanabara;
x Comparar as concentrações de HPA em sedimentos da Baía de Guanabara com de outras áreas estuarinas no mundo e com valores de referência estabelecidos no Brasil e em outros países;
x Verificar a eficiência da aplicação das razões diagnósticas para diferenciação das fontes de hidrocarbonetos em um ambiente com elevada influência antropogênica, neste caso os sedimentos da BG;
x Avaliar o potencial da técnica de análise de componentes principais (ACP) como ferramenta para discriminação fontes de hidrocarbonetos em sedimentos da Baía de Guanabara;
x Verificar variabilidade temporal das fontes de hidrocarbonetos identificadas no ecossistema estudado;
x Determinar, preliminarmente, as concentrações de metabólitos biliares de HPA em alguns peixes demersais na Baía de Guanabara;
x Comparar os níveis de metabólitos das espécies de peixes estudadas a HPA em duas macro-regiões da Baía de Guanabara (entrada e fundo);
x Comparar as concentrações de metabólitos biliares de HPA em peixes da Baía de Guanabara com outras áreas do mundo;
Capítulo 2
2. Aspectos Teóricos e Revisão da Literatura
2.1. Introdução
Nos últimos anos, as companhias de petróleo têm vivenciado muitos desafios diante de redirecionamentos de seus negócios não somente para o aumento da prospecção e produção de petróleo em águas profundas, bem como para o alcance da excelência em gestão ambiental e segurança operacional, visando minimizar riscos ambientais e contribuir para o desenvolvimento sustentável e para responsabilidade social.
A maior empresa de energia do país, a Petrobras, é responsável por quase a totalidade da prospecção, produção, refino e transporte de petróleo em território nacional (www.petrobras.com.br). Dentro da gestão ambiental, vários procedimentos para ajuste ambiental entre a empresa e os órgãos ambientais têm sido realizados, visando a regularização completa do licenciamento de operação das unidades de negócio da Petrobras. Inserido no Plano de Contingência da Companhia, destaca-se o programa de contenção, caracterização e monitoramento de ecossistemas afetados por suas atividades.
Muitos estudos de caracterização e monitoramento de ecossistemas da área de influência direta e indireta de diversas unidades das companhias de petróleo no mundo têm sido desenvolvidos. Estes auxiliam na determinação do comportamento do óleo ou efluente no meio ambiente e subsidiam a avaliação dos ecossistemas.
podem ser introduzidos no meio ambiente, que não o derrame de óleo ou o efluente da indústria petrolífera, que são: despejos domésticos e industriais, queima natural ou intencional de madeira e plantações, drenagens pluviais urbanas, combustão incompleta de óleo combustível e processos naturais que incluem transformações diagenéticas de produtos naturais (ceras epicuticulares de plantas superiores, algas, plânctons) e exsudações naturais.
Portanto, a caracterização dos hidrocarbonetos associada à sua correlação a fontes conhecidas torna-se extremamente importante em amostras ambientais, independente da dificuldade inerente a esta tarefa. O desafio recai não apenas na complexidade das amostras, bem como nos efeitos de transformação sobre a composição dos óleos derramados ou do efluente descartado no meio ambiente. A identificação de uma fonte específica dos hidrocarbonetos é geralmente difícil, pois a caracterização pode ser obscurecida pelos hidrocarbonetos provenientes de outras fontes.
Por isto, torna-se imprescindível a utilização de ferramentas que possibilitem a determinação das fontes de hidrocarbonetos. Dentre elas destacam-se as razões diagnósticas dos hidrocarbonetos policíclicos aromáticos (HPA), também conhecidas como índices composicionais dos HPA (Wang et al., 1999; Yunker et al., 2002) e a análise de componentes principais de HPA (Yunker et al., 2000).
2.2. Hidrocarbonetos Policíclicos Aromáticos
Os hidrocarbonetos policíclicos aromáticos (HPA) são uma extensa série de compostos de ocorrência ubiquoa (Neff, 1979), isto é, estão presentes em todos os ambientes terrestres e marinhos, constituindo uma importante classe de compostos orgânicos extensamente investigados na literatura científica não apenas pela sua abundância, mas também face ao seu potencial efeito tóxico aos organismos dos ecossistemas naturais.
Os HPA são uma família de moléculas constituídas unicamente de carbono e hidrogênio, com estrutura aromática de 2 ou mais anéis condensados, cada anel com 5 ou 6 átomos de carbono (HPA parentais) e podem apresentar ramificações constituídas de cadeias hidrocarbônicas alifáticas, sendo denominados HPA alquilados.
Os HPA mais estudados na literatura recente são os compostos de 2 até 6 anéis aromáticos. Os compostos heterocíclicos contendo enxofre como os benzotiofenos, dibenzotiofenos e suas séries alquiladas têm sido também investigados face sua igualmente extensa ocorrência em amostras ambientais e similaridade química e funcional aos HPA. Por conveniência, estes compostos serão mencionados daqui para frente como simplesmente HPA.
A Figura 2.1 ilustra as fórmulas estruturais e a nomenclatura IUPAC
(International Union of Pure and Applied Chemistry) dos 16 HPA parentais
prioritários segundo a agência de proteção ambiental americana (USA-EPA:
Environmental Protection Agency) e a Figura 2.2 apresenta as estruturas e nomes
dos HPA mais frequentemente reportados na literatura, incluindo os 16 HPA prioritários, os compostos alquilados, a série dos dibenzotiofenos, o benzo(e)pireno e o perileno. Ainda na Figura 2.2 é apontada a região de “baía” do benzo(a)pireno como exemplo da região côncava dos HPA. Esta região viabiliza reações enzimáticas importantes de processos de biotransformação dos HPA, conferindo uma forte capacidade de ligação destes compostos com o DNA. Os HPA
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(1) Naftaleno; (2) Acenaftileno (3) Acenafteno (4) Fluoreno (5) Fenantreno (6) Antraceno (7) Fluoranteno (8) Pireno (9) Benzo (a) antraceno (10) Criseno (11) Benzo (b) fluoranteno (12) Benzo (k) fluoranteno (13) Benzo (a) pireno (14) Indeno (1,2,3-cd) pireno (15) Dibenzo (a,h) antraceno (16) Benzo (g.h.i) perileno
CH3
1- Metilnaftaleno Naftaleno
CH3
2-Metilnaftaleno Bifenil
C2H5
CH3 C H3 CH3 CH3 CH3 C H3 2-Etilnaftaleno
2,6-Dimetilnaftaleno 1,3-Dimetilnaftaleno 1,7-Dimetilnaftaleno
CH3 CH3 CH3 C H3 2,3-Dimetilnaftaleno Acenaftileno 1,5-Dimetilnaftaleno Acenafteno CH3 C H3 C H3 CH3 C H3 C
H3 CH3
CH3 C H3 CH3 CH3 CH3
1,6,7-Trimetilnaftaleno 1,4,6-Trimetilnaftaleno 2,3,6-Trimetilnaftaleno
2,3,5-Trimetilnaftaleno CH3 C H3 C H3 CH3 CH3 C H3
CH3 S
Fluoreno 1,4,5-Trimetilnaftaleno 1,2,3,4-Tetrametilnaftaleno Dibenzotiofeno
S CH3
S CH3
Fenantreno Antraceno 1-Metildibenzotiofeno 3-Metildibenzotiofeno
S CH3 CH3 CH3 CH3 4-Metildibenzotiofeno
9-Metilfenantreno 2-Metilfenantreno 1-Metilfenantreno
S CH3 CH3 2,3-Dimetildibenzotiofeno CH3 C H3 2,7-Dimetilfenantreno CH3 CH3
3,6-Dimetilfenantreno Fluoranteno Pireno
CH3
CH3
CH3
2,3,5-Trimetilfenantreno Benzo(a)antraceno
Criseno Benzo(b)fluoranteno
Benzo(k)fluoranteno Benzo(e)pireno Benzo(a)pireno
Perileno Indeno[1,2,3-c,d]pireno Dibenzo(a,h)antraceno Benzo(g,h,i)perileno
Figura 2.2. Estruturas e nomenclatura de HPA parentais e alquilados mais frequentemente investigados na literatura e região de “baía” do benzo(a)pireno (Fonte: adaptado de Silva, 2005).
2.3 Comportamento dos HPA no Ambiente Marinho e seus Metabólitos
2.3.1. Propriedades físico-químicas dos HPA
Algumas propriedades físico-químicas de alguns HPA estão apresentadas na Tabela 2.1. Estes compostos são inertes quimicamente e são encontrados na forma sólida na temperatura ambiente, apresentando pontos de ebulição (218 a 496ºC) e de fusão (80 a 262ºC) elevados. De um modo geral apresentam volatilidade relativamente baixa face à baixa pressão de vapor, exceto os compostos de menor massa molar (Mackey et al., 1992).
As propriedades físico-químicas dos HPA são importantes uma vez que vão determinar a sua distribuição e comportamento dentro dos diferentes compartimentos ambientais existentes: atmosfera, água, solo e sedimento e, por conseguinte, auxiliar nos estudos de avaliação do comportamento e intemperismo destes compostos no meio ambiente, isto é, da alteração dos mesmos como conseqüência da combinação dos processos de evaporação, dissolução, degradação biológica, foto-oxidação e sedimentação (Stout et al., 2002; Neff, 2002; Stout and Wang, 2007).
Como pode ser observado na Tabela 2.1, a solubilidade dos HPA na água é baixa (a solubilidade do naftaleno é 31 mg L-1) e diminui com o aumento de sua massa molar (até 4 ordens de magnitude entre os compostos de 2 a 6 anéis). Segundo McElroy e colaboradores (1989), a temperatura e a salinidade apresentam também alguma influência sobre a solubilidade destes compostos, porém em menor magnitude que a massa molar. Dados experimentais reportam aumento da solubilidade de duas a cinco vezes para uma faixa de variação de temperatura entre 5 a 30°C, dependendo do composto. Em relação à salinidade, a variação entre 0 a 36%opode reduzir a solubilidade dos HPA por um fator máximo de dois. Esta baixa
Tabela 2.1. Propriedades físico-químicas dos HPA prioritários e distribuição de anéis segundo Mackay et al (1992).
HPAs Nº de Anéis
MMa (g mol-1)
PFb (°C) (1) PEc (°C) (1)
Solubilidade em água d
(mg L-1) à 25°C (2)
Log Kow e (2)
Log Kocf (2)
Log Kdg (2)
Pressão de vapor h (Pa a 25°C)
(2)
Constante Henry i Atm.m3/mol 10-6
ar/água (2)
1 Naftaleno 2 128 80 218 31,8 3,4 3,0 1,7 10,5 483
2 Acenaftileno 3 152 92 265 16,1 4,1 - - - -
3 Acenafteno 3 154 96 279 3,7 3,9 3,7 - 0,36 145
4 Fluoreno 3 166 116 293 1,98 4,2 3,9 - 9x10-2 91
5 Fenantreno 3 178 101 340 1,2 4,6 4,2 2,7 1,8x10-2 39,3
6 Antraceno 3 178 216 340 1,29 4,57 4,4 2,7 7,5x10-4 49,7
7 Fluoranteno 4 202 111 - 0,26 5,2 4,9 3,7 1,2x10-3 11,6
8 Pireno 4 202 149 360 0,15 5,2 - 3,7 8,86x10-4 5
9 Benzo (a) antraceno 4 228 158 400 1,1x10-2 5,84 - 4,2 7,3x10-6 -
10 Criseno 4 228 255 - 3x10-3 5,84 - 4,2 5,7x10-7 -
11 Benzo (b) fluoranteno 5 252 167 - 1,5x10-3 6,6 5,2 5,0 - 12
12 Benzo (k) fluoranteno 5 252 217 480 7,6x10-4 6,8 5,9 4,9 6,0x10-7 0,7
13 Benzo (a) pireno 5 252 179 496 3,8x10-3 6,4 6,0 4,9 7,3x10-7 0,4
14 Indeno (1,2,3-cd) pireno 6 276 163 - 1,9x10-4 6,6 6,8 5,6 - 0,3
15 Dibenzo (a,h) antraceno 5 278 262 - 5,1x10-4 6,7 6,1 5,6 3,7x10-10 0,05
16 Benzo (g.h.i) perileno. 6 276 222 - 5,5x10-3 7,04 - 5,6 6,0x10-8 -
a MM: Massa Molar b PF: Ponto de fusão c PE: Ponto de ebulição d Solubilidade de uma substância em água é a concentração mássica desta substância na água
e
Kow: coeficiente de partição n-octanol/água definido como a razão entre as concentrações de equilíbrio da substância nas 2 fases constituídas de solventes que não se misturam f
Koc: coeficiente de partição carbono orgânico/água definido como a razão entre a quantidade adsorvida de um composto por unidade de massa de carbono orgânico do solo ou sedimento e a concentração deste mesmo composto em solução aquosa em equilíbrio
g
Kd: coeficiente de partição sedimento/água definido como a razão entre a concentração de um elemento adsorvido no sedimento e a concentração deste mesmo elemento em solução aquosa em equilíbrio
h Pressão de vapor: pressão de saturação de uma substância líquida ou sólida
i Contante de Henry traduz a propriedade de uma substância em se distribuir entre 2 fases de um sistema binário ar/água (25°C) (1) Louro, 1997
2.3.2 Ciclos Geoquímico e Biológico dos HPA no Meio Ambiente
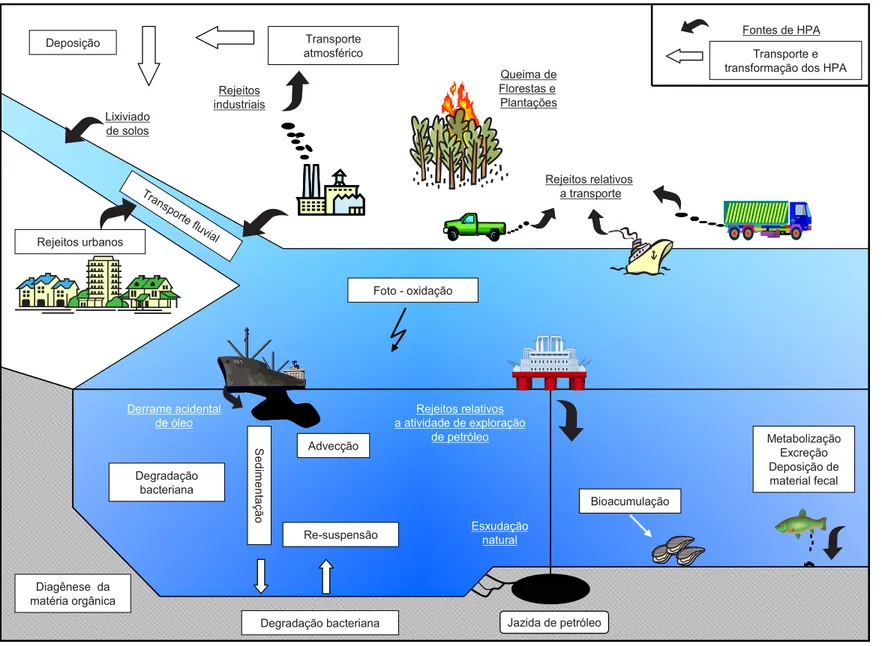
Conforme já mencionado, os HPA são compostos ubíquos no ambiente e esta característica pode ser explicada tanto pela multiplicidade de suas fontes quanto pela sua estabilidade e transporte a longas distâncias, (Neff, 1979, MacDonald et al, 2000a e b, Yunker, 2002). Eles podem estar presentes nos compartimentos água, sedimento e atmosfera. Na água, podem estar dissolvidos (associados à matéria orgânica dissolvida) ou adsorvidos às partículas ou colóides em suspensão. No sedimento, podem ser encontrados adsorvidos sobre as partículas ou dissolvidos na água intersticial. Na atmosfera, os HPA podem estar na forma gasosa ou adsorvidos sobre o material particulado atmosférico. Um esquema simplificado das diversas origens e dos processos de transporte e transformação dos HPA no meio ambiente encontra-se ilustrado na Figura 2.3.
O transporte dos HPA dentro do meio ambiente pode ocorrer de várias formas. O transporte atmosférico é importante, pois permite percorrer longas distâncias, podendo inclusive cruzar oceanos (Macdonald et al, 2000b , Simoneit, 2000). Do compartimento atmosférico, os HPA podem ser transferidos e depositados para os ambientes continental e marinho. A transferência destes compostos do ambiente continental para o marinho pode ocorrer, subsequentemente, através da erosão dos solos seguido do transporte fluvial.
Rejeitos relativos a transporte Queima de
Florestas e Plantações Transporte
atmosférico Deposição
Rejeitos industriais Lixiviado
de solos
Fontes de HPA Transporte e transformação dos HPA
Tran sporte
fluvial Rejeitos urbanos
Foto - oxidação
Derrame acidental de óleo
Re-suspensão Degradação
bacteriana
S
edi
m
ent
aç
ão
Degradação bacteriana Diagênese da
matéria orgânica
Jazida de petróleo
Bioacumulação Esxudação
natural
Metabolização Excreção Deposição de material fecal Advecção
Rejeitos relativos a atividade de exploração
de petróleo
Uma metodologia de predição de evaporação de óleo ou derivados de petróleo foi desenvolvida por Fingas (2001b), considerando perda mássica do óleo a 180°C na curva de destilação, a temperatura ambiente e o tempo de exposição. Alguns óleos seguem a equação logarítima (1) e outros seguem a equação de raiz quadrada (2).
Equação logarítima:
% evaporação = 0,165 (%D) + 0,045 (T – 15) ln(t) (1)
Equação de raiz quadrada:
% evaporação = [0,0254 (%D) + 0,01 (T – 15) ¥(tempo)] (2)
Onde %D é a percentagem mássica destilada do óleo a 180°C, T é a temperatura ambiente (°C) e t é o tempo (minutos).
Quando depositados nos sedimentos marinhos, os HPA podem também sofrer biodegradação por ação de bactérias hidrocarbonoclásticas e fungos (Cerniglia and Heitkamp, 1989, Juhasz et al, 1997, Cerniglia, 1992, Nadalig, 1998, Luo et al, 2005). Esta degradação biológica dos HPA, no entanto, depende de fatores tais como disponibilidade de nutrientes, existência de substratos alternativos, concentração dos HPA e concentração dos microorganismos (E & P FORUM, 1994). Depende também do número de anéis na estrutura: quanto menor o número de anéis, maior a taxa de degradação do composto. Portanto, com o acréscimo da massa molecular dos compostos a resistência à degradação aumenta (Stout et al, 2002, Page et al, 1995, Bence et al, 1996).
toxicidade ou no aumento da habilidade em usar os HPA como substratos (Cerniglia and Heitkamp, 1989).
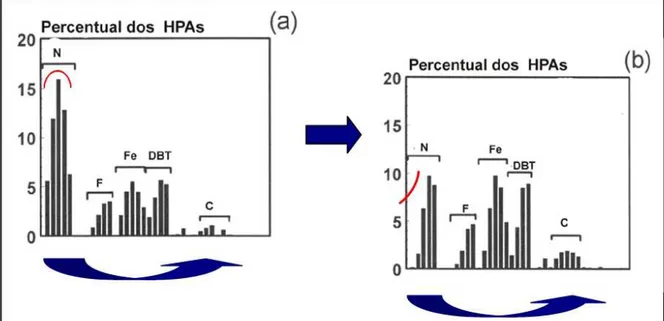
Amostras ambientais contendo HPA que sofreram intemperismo apresentam uma distribuição característica destes compostos, diferente daqueles contendo HPA sem alterações provocadas por evaporação, dissolução, degradação biológica ou foto-oxidação. Isto pode ser observado na Figura 2.4 de duas formas:
x a abundância relativa dos naftalenos diminui em relação aos fluorantenos, fenantrenos, dibenzotiofenos e crisenos, pois os primeiros são mais susceptíveis a degradação ;
x o padrão de distribuição dos isômeros dos naftalenos, fenantrenos e dibenzotiofenos se altera: passa de uma distribuição gaussiana, com concentração máxima nos isômeros alquilados com 2 e 3 carbonos (C2 e C3 HPA alquilados) para uma distribuição crescente com concentração máxima para o isômero de maior alquilação (HPA parental < C1 <C2 < C3 < C4). Isto ocorre porque os isômeros de maior alquilação são mais resistentes à degradação (Sauer and Uhler, 1994-1995; Stout et al, 2002, Page et al, 1995).
A avaliação desta alteração no padrão de distribuição dos HPA devido ao processo diferenciado de degradação entre os compostos é geralmente acompanhada através da razão entre C2 Criseno e C2 Fenantreno uma vez que o criseno é mais resistente a este processo que o fenantreno (Figura 2.5). Desta forma, com o tempo, a razão C2 Criseno/C2 Fenantreno aumenta. O mesmo pode ser observado para a razão C2 Criseno/C2 Dibenzotiofeno (Page et al, 1995, Wang et al., 1999, Stout et al, 2002, Bence et al., 2007). A razão entre os naftalenos alquilados (alquil N) e o total de HPA também pode ser utilizada para acompanhar a evolução do intemperismo, apresentando um comportamento inverso à razão C2 Criseno/C2 Fenantreno uma vez que os naftalenos alquilados são mais rapidamente degradados que as demais HPA.
Figura 2.5. Evolução da razão C2 Criseno/C2 Fenantreno para amostras do óleo derramado do navio tanque Exxon Valdez no Alasca ao longo do tempo (adaptado de Page et al., 1995). Abreviaturas no Anexo A.
A distribuição da granulometria do sedimento é também outro parâmetro que se deve levar em conta. Os sedimentos mais finos, com uma surperfície de adsorção mais elevada, tendem a apresentar maior afinidade com os HPA que os sedimentos com maior granulometria. Além disso, dentre os HPA, os compostos de maior massa molar são concentrados preferencialmente nos sedimentos finos. Com isso, existe uma tendência de maior concentração de HPA de massa molar mais elevada em sedimentos finos (Prahl and Carpenter, 1983; Raoux and Garrigues, 1993; Gobas and Zhang, 1994).
Ainda sobre as características do ambiente marinho que podem influenciar na distribuição dos HPA, vale ressaltar que o tempo de contato entre estes compostos e sedimentos envelhecidos abaixo da superfície fortalece as interações contaminante-matriz; e com isto constata-se uma diminuição da disponibilidade dos HPA ao longo da profundidade da coluna sedimentar (Harkey et al., 1995).
Ao longo de todo o ciclo geoquímico dos HPA no ambiente, estes compostos podem estar disponíveis aos organismos. A disponibilidade dos HPA dissolvidos na coluna d’água é maior que a dos HPA adsorvidos em sedimentos e partículas (Neff, 1984). Após absorção pelos organismos, os HPA podem se transferir e ser retidos nos órgãos ricos em lipídios, podendo ocorrer a bioacumulação. A absorção dos HPA presentes no sedimento por organismos aquáticos pode ocorrer através da via alimentar (caso dos organismos bentônicos) ou através da absorção pela pele (Bailey et al., 1973). Alguns organismos aquáticos podem também filtrar os sedimentos através das brânquias.
expostos aos HPA depositados nos sedimentos marinhos podem acumular estes compostos em seus tecidos e posteriormente transferi-los aos organismos da cadeia trófica imediatamente acima deles, porém esta transferência é interrompida pelos organismos marinhos vertebrados (peixes, mamíferos) e o processo de biomagnificação dos HPA nos níveis tróficos superiores da cadeia alimentar não ocorre. Os HPA são metabolizados por estes organismos, secretados na bile e, subsequentemente, excretados no trato alimentar (Buhler and Williams, 1989, Foureman, 1989, Broman et al., 1990, Varanasi and Stein, 1991, E & P Forum, 1994; ONU, 1999; Saxton, 1993; NOAA, 1989; Krahn et al., 1992, NOAA, 1993; UNEP, 1999).
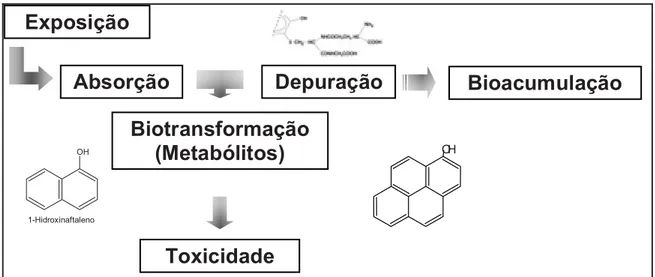
Portanto, a concentração/acumulação dos HPA nos tecidos dos organismos aquáticos é governada por um fenômeno complexo: resulta do equilíbrio entre a aquisição (uptake) dos HPA (que depende da biodisponibilidade do contaminante e do tipo de dieta do organismo) e sua depuração (que depende da capacidade de biotransformação do organismo em relação à cadeia trófica). A Figura 2.6 apresenta de forma simplificada este processo.
O uptake é governado primeiramente pela biodisponibilidade, que por sua
vez, está associado com sua solubilidade na água. Como os HPA são hidrofóbicos, tendem a adsorver em partículas e com isto sua solubilidade decresce (Neff, 1979). Além disso, como a solubilidade dos HPA decresce com o aumento da massa molar, a sua bioacumulação nos organismos é geralmente maior para os compostos de menor massa molar que apresentam maior solubilidade em água (Djomo et al., 1996).
Ouptake é governado também pelo tipo de dieta do organismo: a acumulação
dos HPA em organismos que se alimentam diretamente do sedimento ou vivem em contato íntimo com o sedimento, mais expostos aos contaminantes, é maior que em organismos que se alimentam de outros organismos, como os carnívoros, por exemplo, que estão menos expostos aos HPA (Baumard et al., 1998a).
biotransformação. À medida que se sobe na cadeia trófica, maior é a capacidade de biotransformação/ metabolização dos HPA e, portanto, menor acúmulo dos mesmos (Buhler and Williams, 1989, Foureman, 1989, Broman et al., 1990, E & P Forum, 1994). Ocorrem também diferentes taxas de biotransformação dos HPA, sendo as maiores taxas para compostos de massa molar mais elevada. Assim, subindo na cadeia trófica, a tendência é haver uma discriminação dos HPA de elevada massa molar, isto é, um acúmulo preferencial dos HPA de baixa massa molar (Broman et al., 1990).
OH
1-Hidroxinaftaleno
Exposição
Absorção
Depuração
Bioacumulação
Toxicidade
OH
Biotransformação
(Metabólitos)
Figura 2.6. Processo de transformação dos HPA em organismos aquáticos.
Em decorrência da elevada capacidade de metabolização apresentada pelos peixes, os teores de HPA em seus tecidos, quando expostos à estes compostos, são usualmente baixos (Krahn et al, 1986a; Varanasi et al, 1989; Varanasi and Stein, 1991; van der Oost et al, 2003). Portanto, torna-se mais adequada a determinação dos teores dos metabólitos dos HPA para uma avaliação do nível de exposição destes organismos.
resultantes da interação dos HPA com o organismo vivo (resposta biológica), medido dentro do organismo ou em seus fluidos biológicos; um sinal precoce de exposição de organismos à contaminação de HPA.
Dados da literatura corroboram a correlação entre a concentração de metabólitos na bile de peixes e a concentração de HPA no meio ambiente (Khran et al, 1992, Khran et al, 1993, Yu et al, 1995). Collier and Varanasi (1991) ressaltam, no entanto, que o nível de metabólitos na bile se apresenta como melhor indicador quando os organismos são expostos a concentrações elevadas de HPA, não se mostrando, em geral, sensível quando expostos a baixos níveis destes contaminantes.
2.3.3 Biotransformação dos HPA (Metabólitos) e sua Toxicidade
Os HPA, conforme já mencionado anteriormente, são moléculas de estruturas relativamente simples (plana e altamente conjugada) e inertes, porém são classificados como compostos químicos mutagênicos e carcinogênicos. Para exercer seus efeitos mutagênicos ou carcinogênicos, os HPA requerem, no entanto, sua ativação metabólica, que pode ocorrer através de metabolismos dentro de organismos vivos (Harvey, 1991; Miller, 1978, Miller and Miller, 1996; Golddstein and Faletto, 1993, Harris, 1991).
Os HPA, uma vez absorvidos pelos organismos vivos, passam por um processo de biotransformação (metabolização) que ocorre no fígado, hepatopâncreas, estômago ou glândula digestiva, dependendo de tratar-se de peixes, crustáceos ou moluscos (Singer and Lee, 1977, James, 1989; Livingstone, 1989, Deshpande et al, 2002).
Dentre os diversos mecanismos para a ativação metabólica dos HPA propostos na literatura (Xue and Warshawsky, 2005), três são mais estudados:
x oxidação dos HPA por reação enzimática em três etapas, catalisada pelo citocromo P450 na região de “baía” (côncava) dos HPA, gerando compostos eletrofílicos tais como os diol-epóxidos (epóxidos, dihidrodióis, fenóis) capazes de se ligarem com DNA e de se associarem a substratos hidrosolúveis endógenos como glutationa, glucuronida, aminoácidos (aceito como o mecanismo carcinogênico mais dominante);
x oxidação com remoção de um eletron S da molécula de HPA e formação do radical catiônico ;
Como pode ser observado na Figura 2.7, o processo enzimático de ativação metabólica dos HPA catalisado pelo citocromo P450 (mecanismo mais dominante) é realizado em 2 etapas: funcionalização e conjugação. Inicialmente os HPA transformam-se em compostos eletrolíticos tais como epóxidos, fenóis, dihidrodiols, quinonas, diols, triols e quatriols através da ação de enzimas mono-oxigenases citocromo P 450. Esta etapa é conhecida como fase de funcionalização, ou fase I (Buhler and Williams, 1989). Em seguida, na etapa de conjugação, ou fase II, os compostos formados na fase I se ligam com grupamentos hidrofílicos tais como o ácido glucorônico, sulfatos, glutationa, formando produtos conjugados hidrofílicos para favorecer a sua excreção (Foureman, 1989). Os principais conjugados formados por peixes são os glucoronídeos e glutationideos (George, 1994). A Figura 2.8 ilustra as estruturas e nomenclaturas dos principais metabólitos livres de HPA e alguns metabólitos conjugados formados através do processo de biotransformação dos HPA.
HPA
hidrofóbicos
Efeitos Tóxicos
Fase I
Metabólitos Eletrofílicos
Fase II
Metabólitos Conjugados hidrofílicos
Excreção
Funcionalização
Conjugação D
E S I N T O X I C A Ç Ã O
OH
OH OH HO
O
H OH
OH
OH
1-Hidroxinaftaleno 2-Hidroxinaftaleno 2-Hidroxibifenil 9-Hidroxifluoreno
9-Hidroxifenantreno 1-Hidroxipireno 1-Hidroxicriseno
1-Hidroxibenzo(a)pireno
Figura 2.8. Estruturas e nomenclaturas de metabólitos livres (A) e conjugados (B) de HPA.
Conjugação ao
ácido Glucorônico Conjugaçãoao Sulfato
Conjugação a
Glutationa
B
A
A toxicidade dos HPA está relacionada com a sua capacidade de produzir efeito deletério a um organismo e a mutagenicidade e a carcinogenicidade são as propriedades tóxicas mais estudadas nos HPA. Estão relacionadas com os compostos eletrofílicos formados na fase I da biotransformação dos HPA, que não são convertidos a conjugados hidrofílicos, podem se ligar com DNA, RNA ou proteínas e, subsequentemente, induzir mutações genéticas e tumores cancerígenos (Miller and Miller, 1996; Pahlman and Pelkonen, 1987; Varanasi et al., 1989; Harvey et al., 1991 e 1999; Nesnow et al., 2002; Neff, 2002).
Dentre os HPA, o Benzo(a)antraceno, o Benzo(a)pireno e Dibenzo(a,h)antraceno são considerados os mais tóxicos, classificados como “provavelmente cancerígenos” ao homem pela organização internacional IARC (International Agency for Research on Cancer) e pela US-EPA (Environmental
Protection Agency) (Tabela 2.2), seguidos pelo Benzo(b)fluoranteno,
Benzo(k)fluoranteno e Indeno(1,2,3-cd)pireno, classificados como “possivelmente cancerígenos” ao homem. Segundo o Programa Internacional de Segurança Química (IPCS) estes compostos, juntamente com o Benzo(j)fluoranteno e o Criseno, são classificados como cancerígenos à mamíferos.
Tabela 2.2. Classificação dos HPA de acordo com seu potencial carcinogênico.
Carcinogenicidade Composto
IARCa USA-EPAb
IPCSc IARCa:
Naftaleno 2B C (?) 1: Carcinogênico ao homem
Aceftileno D 2A: Provavelmente carcinogênico ao homem
Fenantreno 3 D - 2B: Possivelmente carcinogênico ao homem
Antraceno 3 D - 3: Não classificado
Fluoranteno 3 D (+) bUSA-EPA:
Pireno 3 D (?) A: Carcinogênico ao homem
Benzo(a)antraceno 2A B2 + B1 e B2: Provavelmente carcinogênico ao homem
Criseno 3 B2 + C: Possivelmente carcinogênico ao homem
Benzo(b)fluoranteno 2B B2 + D: Não classificado
Benzo(k)fluoranteno 2B B2 + E: Provavelmente não carcinogênico
Benzo(j)fluoranteno 2B + cIPCS:
Benzo(a)pireno 2A B2 + +: efeito positivo
Indeno(1,2,3-c,d)pireno 2B B2 + -: efeito negativo
Dibenzo(a,h)antraceno 2A B2 + ?: incerto
2.3.4. Critérios de Qualidade Ambiental: Valores Orientadores de HPA
Em função de seu potencial carcinogênico e mutagênico, as instituições governamentais em diversos países do mundo selecionaram, dentre vários compostos, alguns HPA como contaminantes prioritários a serem avaliados nos diversos compartimentos ecológicos (solo, sedimento, água e atmosfera) e estabeleceram valores orientadores e de referência para estes ambientes. As Tabelas 2.3 e 2.4 reportam as concentrações limites dos HPA nos corpos d’água e sedimentos nos EUA e no Canadá (http://response.restoration.noaa.gov/2006; http:// www.ec.gc.ca/CEQG-RCQE/english/default.cfm/2006).
Para sedimentos marinhos, alguns critérios de qualidade podem ser destacados: a NOAA estabelece a concentração total de HPA de 4022 ng g-1 como ERL – effects range-low, a partir da qual a toxicidade poderia ser observada em espécies sensíveis e a concentração total de HPA de 16770 ng g-1 como PEL –
probable effects level, acima da qual se espera que ocorram frequentemente efeitos
adversos. Segundo Long e colaboradores (1995), concentrações entre 4022 e 44792 ng g-1 representam uma faixa na qual efeitos adversos biológicos poderiam ocasionamente ocorrer em sedimentos marinhos e estuarinos. Kennicutt (1995) utilizou esta concentração de HPA de 4022 ng g-1 como limítrofe para ambientes contaminados no estudo conduzido em Casco Bay, Maine.
O Canadá estabelece, também para sedimentos marinhos, a concentração total de HPA de 7070,9 ng g-1 como PEL – probable effects level, acima da qual é provável que ocorram efeitos adversos na biota. Estabelece também o nível de HPA total de 766 ng g-1 como ISQG (interim sediment quality guideline), guia de qualidade de sedimento interino, valor usado quando dados são limitados, visando proteger todas as formas de vida marinha em todos os aspectos de seus ciclos de vida e por um tempo de exposição às substâncias químicas indefinido.
Dentro dos critérios de qualidade estabelecidos pela NOAA para a água
exceto para acenafteno e naftaleno, cujos valores são 970 e 2350 Pg L-1, respectivamente.
No Brasil, o Conselho Nacional do Meio Ambiente através da Resolução CONAMA nº 357, de 17 de março de 2005 (CONAMA, 2005), define as concentrações de alguns HPA em águas doces, salinas e salobras de acordo com sua classificação de padrões de qualidade da água, que varia conforme seus usos preponderantes (Tabela 2.5). Observa-se que em águas doces e salgadas onde existe o cultivo de organismos para consumo humano (classe I, tabela II para águas doces e classe 1, tabela V para águas salinas, respectivamente) os teores máximos dos HPA individuais são bastante restritivos: 0,018 Pg L-1.
Tabela 2.3. Valores orientadores de concentrações de HPA em sedimentos (marinhos e de água doce) e na coluna d’água (água doce e marinha) nos EUA (NOAA Squirts – http://response.restoration.noaa.gov/2006).
Sedimento de Água Doce
(ng g-1) Sedimento de Água Marinha (ng g-1)
Água Marinha (Pg L-1) Composto Nível limite
de efeito (TEL)1 Nível de efeito provável (PEL) Limite superior de efeitos (UET) Nível limite de efeito (TEL) Faixa de efeitos baixos (ERL) Limite aparente de efeitos (AET) Nível provável de efeitos (PEL) Critério de concentração máxima CMC
Acenafteno - - 290 6,71 16 130 88,9 970
Acenaftileno - - 160 5,87 44 71 127,87 300
Antraceno 10 - 260 46,85 85,3 280 245 300
Benzo(k)fluoranteno 27,2 - 13400 - - 1800 - 300
Benzo(a)pireno 32,4 782 700 88,81 430 1100 763,22 300
Benzo(b)fluoranteno - - - 1800 - 300
Benzo(ghi)perileno - - 300 - - 670 - 300
Benzo(a)antraceno 15,72 385 500 74,83 261 960 692,53 300
Criseno 26,83 862 800 107,77 384 950 845,98 300
Dibenzo(a,h)antraceno 10 - 100 6,22 63,4 230 134,61 300
Fluoranteno 31,46 - 1500 112,82 600 1300 1493,54 40
Fluoreno 10 2355 300 21,17 19 120 144,35 300
Indeno(1,2,3-c,d)pireno 17,32 - 330 - - 600 - 300
Metilnaftaleno - - - 20,21 70 64 201,28 300
Naftaleno 14,65 - 600 34,57 160 230 390,64 2350
Fenantreno 18,73 515 800 86,68 240 660 543,53 7,7
Pireno 44,27 875 1000 152,66 665 2400 1397,6 300
HPA Total 264,05 - 12000 1684,06 4022 - 16770,4 300
TEL: representa a concentração abaixo da qual efeitos adversos são esperados apenas raramente PEL: representa o nível acima do qual espera-se que efeitos adversos ocorram frequentemente
ERL: representa a concentração na qual a toxicidade pode começar a ser observada em espécies sensitivas
UET: representa a concentração acima da qual espera-se que sempre ocorra impacto biológico adverso no ambiente de água doce AET: representa a concentração acima da qual espera-se que sempre ocorra impacto biológico adverso no ambiente marinho
CMC: critério de concentração máxima, é o maior nível para uma exposição média de 1 hora e não deve exceder mais do que uma vez a cada três anos, e é um sinônimo para agudo.
Tabela 2.4. Valores orientadores de concentrações de HPA em sedimentos (marinhos e de água doce), solo e na coluna d’água (água doce) no Canadá (Canadian Environmental Quality Guidelines - www.ec.gc.ca/CEQG-RCQE/english/default.cfm/2006).
Sedimento de Água Doce (ng g-1)
Sedimento de Água Marinha (ng g-1)
Solo
(mg kg-1) Água doce (Pg L-1)
Composto
ISQG
Nível de efeito provável
(PEL) ISQG
Nível de efeito provável
(PEL) Agricultura Vida aquática
Acenafteno 6,71 88,9 6,71 88,9 - 5,8
Acenaftileno 5,87 128 5,87 128 -
-Antraceno 46,9 245 46,9 245 - 0,012
Benzo(a)antraceno 31,7 385 74,8 693 0,1 0,018
Benzo(a)pireno 31,9 782 88,8 763 0,1 0,015
Benzo(b)fluoranteno - - - - 0,1
-Benzo(k)fluoranteno - - - - 0,1
-Criseno 57,1 862 108 846 -
-Dibenzo(a,h)antraceno 6,22 135 6,22 135 0,1
-Fluoranteno 111 2355 113 1494 - 0,04
Fluoreno 21,2 144 21,2 144 - 3,0
Indeno(1,2,3-e,d)pireno 0,1
-2-Metilnaftaleno 20,2 201 20,2 201 -
-Naftaleno 34,6 391 34,6 391 0,1 1,1
Fenantreno 41,9 515 86,7 544 0,1 0,4
Pireno 53,0 875 153 1398 0,1 0,025
PEL: representa o nível acima do qual espera-se que efeitos adversos ocorram frequentemente