Universidade Federal de Minas Gerais Instituto de Ciências Exatas
Departamento de Química
FREDERICO HAYALA FERNANDES BARBOSA
Desenvolvimento de método de amostragem de agrotóxicos em águas utilizando nanotubos de carbono e determinação por cromatografia gasosa acoplada à espectrometria de massas.
UFMG / ICEx / DQ. 1113a D. 612a
FREDERICO HAYALA FERNANDES BARBOSA
Desenvolvimento de método de amostragem de agrotóxicos em águas utilizando nanotubos de carbono e determinação por cromatografia gasosa acoplada à espectrometria de massas.
Dissertação apresentada ao Departamento de Química do Instituto de Ciências Exatas da Universidade Federal de Minas Gerais, como requisito parcial para obtenção do grau de Mestre em Química - Química Analítica.
Barbosa, Frederico Hayala Fernandes
Desenvolvimento de método de amostragem de
agrotóxicos em águas utilizando nanotubos de carbono e determinação por cromatografia gasosa acoplada à espectrometria de massas [manuscrito] / Frederico Hayala Fernandes Barbosa. 2015.
[xi], 70 f. : il.
Orientador: Zenilda de Lourdes Cardeal. Coorientador: Helvecio Costa Menezes.
Dissertação (mestrado) – Universidade Federal de Minas Gerais – Departamento de Química.
Inclui bibliografia.
1. Química analítica - Teses 2. Produtos químicos agrícolas - Teses 3. Cromatografia de gás – Teses 4. Nanotubos de carbono - Teses 5. Água - Análise – Teses I. Cardeal, Zenilda de Lourdes, Orientadora II. Menezes, Helvecio Costa, Coorientador III. Título.
CDU 043 B238a
Não confunda jamais conhecimento com sabedoria. Um o ajuda a ganhar a vida, o outro a construir uma vida.
i AGRADECIMENTOS
Uma folha é pouco para colocar todas as pessoas que de alguma forma fizeram com que essa dissertação pudesse se tornar realidade. Agradeço:
Primeiramente a Deus pela sabedoria que me foi dada.
A minha mãe Fátima pelo apoio incondicional em todos os momentos da minha vida, me dando força para que todos os meus sonhos se tornem realidade.
Ao meu pai Airton que mesmo do céu, tem olhado por mim.
Aos meus irmãos Alessandro e Vinicius pela amizade e apoio de sempre.
A professora Dra. Zenilda de Lourdes Cardeal por acreditar no meu potencial e por todo o amplo conhecimento passado.
Ao professor Helvécio Costa Menezes pela paciência e pelos inúmeros e valiosos ensinamentos.
A todos colegas do Laboratório 171, pelo grande apoio em todos os momentos, em especial ao Vitor Antipoff pela grande parceria nesse projeto contribuindo para que ele se torne realidade.
Aos meus primos Cristiane e Lucas pela hospedagem, conselhos e paciência.
A todos meus familiares e amigos que me apoiaram e que contribuíram de forma direta ou indireta para que esse sonho seja realizado, em especial minha prima Lorrayne sempre orientando e ajudando profissionalmente; e aos amigos André Faria, Arthur Costa, Flávio Ribeiro, Gustavo Freitas, João Paulo Alves, Pedro Emilio e Vinicius Oliveira pelas longas conversas e experiências vividas.
A empresa Corplab e todos os funcionários que tiveram uma contribuição enorme com as amostras, e em especial ao Thiago Freitas pelo incentivo em concretizar esse trabalho.
ii RESUMO
O crescimento populacional mundial ocasiona uma grande demanda por alimentos, os quais devem ter boa qualidade e durabilidade. Os agrotóxicos são produtos importantes para o controle e prevenção de organismos nocivos, minimizando as perdas, aumentando a qualidade e quantidade dos produtos obtidos. No entanto, a maioria dos agrotóxicos são nocivos e podem causar problemas de contaminação ambiental e alimentar. O risco da exposição aos agrotóxicos requer o controle do uso destes compostos e torna necessário o desenvolvimento de métodos eficientes para sua identificação e quantificação.
Esse trabalho apresenta o desenvolvimento de um novo método de extração multiresíduo para análise de agrotóxicos em água com determinação por cromatografia gasosa acoplada à espectrometria de massas (GC/MS). O procedimento de extração proposto foi baseado na utilização de nanotubos de carbono híbridos e anfifílicos com propriedades magnéticas (mNTC). Os mNTC usados foram produzidos no Departamento de Química da UFMG. Eles possuem estruturas de paredes múltiplas (MWNTC) e são constituídos por uma fração hidrofóbica e uma fração hidrofílica (dopada com Nitrogênio). A constituição hibrida possibilita a total dispersão em água e ao mesmo tempo uma elevada eficiência para a sorção dos agrotóxicos. Além do mais, a propriedade magnética permite que os mNTC sejam facilmente retirados da solução. Portanto, uma pequena quantidade de mNTC é necessária para a extração, e após separação da solução por um imã estes mNTC são dessorvidos com micro quantidades de solventes.
Foram estudados 19 agrotóxicos que foram escolhidos através do inventário, dos compostos de uso extensivo no estado de Minas Gerais, em culturas de abacaxi, café, cana de açúcar, eucalipto, mamão, maracujá, melão, morango, uva e trigo. O estudo de validação do método mostrou que os parâmetros de méritos estão adequados para a quantificação de 16 agrotóxicos em água. O método apresentou boa linearidade na faixa de 0,5 a 4,0 mg L-1 com coeficientes de determinação entre 0,9040 e 0,9733. Os limites de detecção ficaram entre 0,51 e 2,29 µg L-1, e os limites de quantificação entre 1,19 a 5,35 µg L-1. A recuperação variou entre 79,9 e 111,6 %.
A aplicação do método foi feita através da análise de 48 amostras de água coletadas em diversas localidades do estado de Minas Gerais. Em 10 amostras foram determinados 6 agrotóxicos, cresoxim metílico, trifluralina, terbufós, dissulfotom, alacloro e buprofenzina.
iii ABSTRACT
Development of water in pesticide sampling method using carbon nanotubes and
determination by gas chromatography-mass spectrometry.
World population growth causes a great demand for food, which must have good quality and durability. The pesticides are important products for the control and prevention of harmful organisms, minimizing losses, increasing the quality and quantity of the products obtained. However, most pesticides are harmful and can cause environmental and food contamination problems. The risk of pesticides exposure requires controled use of these compounds and the development of efficient methods for their identification and quantification.
This work presents the development of a new multiresidue method for pesticides analysis in water by gas chromatography coupled to mass spectrometry (GC/MS). The proposed extraction procedure was based on the use of carbon nanotubes amphiphilics and hybrids with magnetic properties (mCNT). The mCNT used were produced in the Department of chemistry at UFMG. They have multiple-walled structures (MWNTC) and are composed of a hydrophobic and a hydrophilic fraction (doped with nitrogen). That hybrid constitution allows their total dispersion in water and at the same time a high efficiency for the sorption of pesticides. Besides, the magnetic property allows easy removal of the mCNT from the solution. Therefore, a small amount of mCNT is required for extraction, and after separation from the solution by a magnet these are mCNT desorbed with micro amounts of solvents.
The 19 pesticides studied were extensively used in Minas Gerais State in cultures of pineapple, coffee, sugarcane, eucalyptus, papaya, passion fruit, melon, strawberry, grape and wheat. The study of method validation showed appropriate merit parameters to the quantification of 16 pesticides in water. The method presented good linearity in the range of 0.5 to 4.0 mg L-1 coefficients of determination were in the range of 0.904 to 0.973. The detection limits were in the range of 0.51 to 2.29 µg L-1 and the quantification limits between 1.19 to 5.35 µg L-1.The recovery ranged from 79.9 to 111.6 %.
The method application was realised by analyzing 48 water samples collected at various locations in the State of Minas Gerais. 10 samples were contaminated with 6 pesticides, kresoxim methyl, trifluralin, terbufos, disulfoton, alachlor and buprofezin.
iv LISTA DE FIGURAS
Figura 1 – Estrutura molecular do alacloro ... 3
Figura 2 – Estrutura molecular do benalaxil. ... 4
Figura 3 – Estrutura molecular da buprofenzina. ... 4
Figura 4 – Estrutura molecular do cadusafós. ... 5
Figura 5 – Estrutura molecular do clorfenapir... 5
Figura 6 – Estrutura molecular do clorotalonil. ... 6
Figura 7 – Estrutura molecular do cresoxim metílico. ... 6
Figura 8 – Estrutura molecular do dissulfotom. ... 7
Figura 9 – Estrutura molecular do espiromesifeno. ... 7
Figura 10 – Estrutura molecular da fenamidona. ... 8
Figura 11 – Estrutura molecular da fenpropatrina. ... 8
Figura 12 – Estrutura molecular do fentoato. ... 9
Figura 13 – Estrutura molecular do metalaxil-M. ... 9
Figura 14 – Estrutura molecular da pendimetalina. ... 10
Figura 15 – Estrutura molecular da procimidona. ... 10
Figura 16 – Estrutura molecular do terbufós. ... 11
Figura 17 – Estrutura molecular da trifloxistrobina. ... 11
Figura 18 – Estrutura molecular da trifluralina. ... 12
Figura 19 – Estrutura molecular da zoxamida. ... 12
Figura 20 – Dinâmica dos agrotóxicos no meio ambiente. ... 13
Figura 21 – Representação esquemática: (A) Microextração em gota suspensa - SDME e (B) Microextração em fase líquida – LPME. ... 18
Figura 22 – Representação esquemática do método de DLLME. ... 20
Figura 23 – Técnicas de microextração SPME. ... 22
Figura 24 – Microseringa com fibra de sílica. ... 23
Figura 25 - Imagens da microscopia eletrônica de transmissão do NTC híbrido N-dopado.... 27
Figura 27 – Representação esquemática do nanotubo de carbono dopado com nitrogênio. .... 37
Figura 28 – Dispositivo para purificação dos nanotubos de carbono. ... 38
Figura 29 – Procedimento para adsorção dos nanotubos de carbono. ... 39
v Figura 31 – Mapa de Minas Gerais destacando as bacias hidrográficas com os pontos
coletados destacados. ... 42
Figura 32 - Cromatograma de massas dos compostos estudados ... 46
Figura 33 - Estudo de eficiência de adsorção com diferentes massas de mNTC. ... 47
Figura 34 – Estudo da temperatura de dessorção utilizando 2,0 mg de mNTC. ... 48
Figura 35 - Gráfico de barras para o estudo do método de dessorção com variação no tempo no ultrassom utilizando 2,00 mg de mNTC. ... 49
Figura 36 - Estudo comparativo método de dessorção por aquecimento em chapa elétrica (T 70 °C) e ultrassom (U 3 min). ... 50
Figura 37 – Imagem de satélite do ponto P01 coletado no Rio Doce no município de Belo Oriente/MG, georeferenciado com coordenadas 19°20'10.2"S 42°25'16.6"W, gerada pelo programa Google Earth. ... 66
Figura 38 – Imagem de satélite do ponto P02 coletado no Rio Cabo Verde no município de Alfenas/MG, georeferenciado com coordenadas 21°23'38.8"S 45°59'43.2"W, gerada pelo programa Google Earth. ... 66
Figura 39 – Imagem de satélite do ponto P03 coletado no Rio Sapucaí no município de Fama/MG, georeferenciado com coordenadas 21°24'03.9"S 45°49'57.5"W, gerada pelo programa Google Earth. ... 67
Figura 40 – Imagem de satélite do ponto P04 coletado no Rio Sapucaí no município de Pouso Alegre/MG, georeferenciado com coordenadas 22°12'44.2"S 45°52'03.6"W, gerada pelo programa Google Earth. ... 67
Figura 41 – Imagem de satélite do ponto P05 coletado no Rio Grande no município de Frutal/MG, georeferenciado com coordenadas 21°01'01.7"S 46°08'20.2"W, gerada pelo programa Google Earth. ... 68
Figura 42 – Imagem de satélite do ponto P06 coletado no Rio Claro no município de Carmo do Rio Claro/MG, georeferenciado com coordenadas 20°09'36.8"S 48°41'24.3"W, gerada pelo programa Google Earth... 68
Figura 43 – Imagem de satélite do ponto P07 coletado no Rio Araguari no município de Nova Ponte/MG, georeferenciado com coordenadas 19°15'56.8"S 47°38'31.3"W, gerada pelo programa Google Earth. ... 69
vii LISTA DE TABELAS
viii LISTA DE ABREVIATURAS E SIGLAS
AG-LPME Agarose gel liquid phase microextraction
ANVISA Agência Nacional de vigilância sanitária
C.V. Coeficiente de variação
CVD Deposição química de vapor (Chemical Vapor Deposition) DI-HS-SPME Direct immersion headspace-solid phase microextraction
DL50 Dose Letal 50
DLLME Dispersive liquid liquid microextraction
DPR Desvio padrão relativo
EI Impacto eletrônico (Eletronic Impact) EURACHEM Analytical Chemistry in Europe
FTIR Fourier transform infrared
GC Cromatografia gasosa (Gas chromatography) GC-FPD Gas chromatography Flame Photometric Detector
GC-MS Cromatografia gasosa acoplada com espectrometria de massas (Gas
chromatography mass spectrometry)
G-HF-LPME Graphene reinforced hollow fiber liquid phase microextraction
HF-LPME Hollow fiber-liquid phase microextraction
HPLC Cromatografia líquida de alta eficiência (High Performance Liquid
Chromatography)
HPLC-UV High Performance/Pressure Liquide Chromatography
HS-SDME Headspace single drop microextraction
IBAMA Instituto brasileiro do meio ambiente e dos recursos naturais renováveis
IGEC Instituto de geoinformação e tecnologia INMET Instituto nacional de meteorologia INMETRO Instituto nacional de metrologia
KW-LPME Knitting wool liquid phase microextraction
LANAGRO-MG Laboratório nacional agropecuário de Minas Gerais
LD Limite de detecção
ix
LQ Limite de quantificação
MF-LPME Microfunnel-supported liquid-phase microextraction
MS Espectrometria de Massas (Mass Spectrometry) MWCNTs Multi-walled Carbon nanotubes
NFC Nanofibra de carbono
NHMRC/NRMMC
Ministerial para gerenciamento de recursos naturais do governo australiano (National Health and Medical Research Council /Natural
Resource Management Ministerial Council)
NIST National Institute of Standards and Technology
NTC Nanotubos de carbono
NWS-SWCNTs Nanowires and single-walled carbon nanotubes
OMS Organização Mundial da Saúde
PVDF-LPME Porous polyvinylidene fluoride liquid phase microextraction
QuEChERS Quick, Easy, Cheap, Effective, Rugged, Safe
RSD Desvio padrão relativo (Relative standard deviation) SBSE Stir bar sorptive extraction
SDME Micro extração com única gota (Single-Drop Microextraction)
SEM Scanning electron microscopy
SFODME Microextraction solidification of floating organic drop
SPE Extração em fase sólida (Solid Phase Extraction)
SPME Micro extração em fase sólida (Solid Phase Micro Extraction) SWCNTs Single-walled Carbon nanotubes
TEM Microscopia de transmissão eletrônica (Transmission electronic
microscopy)
UDSA-DLLME Up-and-down-shaker-assisted dispersive liquid–liquid microextraction
UFMG Universidade Federal de Minas Gerais
USEPA Agência de proteção ambiental dos Estados Unidos (United States
Environmental Protection Agency)
UV Ultravioleta (Ultraviolet)
VLDS-SD-DLLME Vortex-assisted low density solvent based solvent demulsified
dispersive liquid–liquid microextraction
x SUMÁRIO
Agradecimentos ………..i
Resumo ………..ii
Abstract ……….iv
Lista de Figuras ...vi
Lista de Tabela ...ix
Lista de abreviaturas e siglas ...x
1 INTRODUÇÃO ... 1
1.1 Agrotóxicos ... 1
1.1.1 Classificação dos agrotóxicos ... 2
1.1.2 Agrotóxicos estudados ... 3
1.1.2.1 Alacloro ... 3
1.1.2.2 Benalaxil ... 4
1.1.2.3 Buprofenzina ... 4
1.1.2.4 Cadusafós ... 5
1.1.2.5 Clorfenapir ... 5
1.1.2.6 Clorotalonil ... 6
1.1.2.7 Cresoxim metílico ... 6
1.1.2.8 Dissulfotom ... 7
1.1.2.9 Espiromesifeno ... 7
1.1.2.10 Fenamidona ... 7
1.1.2.11 Fenpropatrina ... 8
1.1.2.12 Fentoato ... 8
1.1.2.13 Metalaxil-M ... 9
1.1.2.14 Pendimetalina ... 9
1.1.2.15 Procimidona ... 10
1.1.2.16 Terbufós ... 10
1.1.2.17 Trifloxistrobina ... 11
xi
1.1.2.19 Zoxamida ... 12
1.1.3 Dinâmica dos agrotóxicos no meio ambiente ... 12
1.1.4 Valores máximos permitidos (VMPs) de resíduos de agrotóxicos em água ... 15
1.2.1 Microextração em fase líquida (LPME) ... 18
1.2.2 Microextração em fase sólida (SPME) ... 21
1.3 Nano extração em fase sólida com o mNTC ... 24
2 OBJETIVOS ... 29
2.1 Objetivo geral ... 29
2.2 Objetivos específicos ... 29
3 PARTE EXPERIMENTAL ... 30
3.1 Instrumentação... 30
3.2 Reagentes e materiais ... 31
3.3 Análise por cromatografia gasosa acoplada a espectrometria de massas ... 32
3.4 Validação do método analítico ... 35
3.5 Nanotubos de carbono ... 36
3.5.1 Purificação e magnetismo ... 37
3.5.2 Extração dos agrotóxicos ... 38
3.5.2.1 Adsorção dos agrotóxicos ... 38
3.5.2.2 Dessorção dos agrotóxicos ... 39
3.6 Coleta das amostras reais ... 40
4 RESULTADOS E DISCUSSÃO ... 44
4.1 Testes de otimização de análise por GC/MS ... 44
4.2 Ensaios para otimização do método de extração ... 47
4.3 Estudo dos parâmetros de mérito do método GC/MS ... 50
4.4 Análises das amostras reais ... 54
5 CONCLUSÃO ... 56
6 REFERÊNCIAS BIBLIOGRÁFICAS ... 57
1 1 INTRODUÇÃO
Com o aumento da população mundial, há uma demanda crescente por alimentos, o que tem se tornado um problema global. Com isso a agricultura passou a criar novas técnicas e insumos para minimizar as perdas e aumentar a produção [1]. Os mais usados são os agrotóxicos, que são compostos com atividade biocida, sendo utilizados para remover insetos, fungos e ervas daninhas, que causam grandes danos as plantações [2].
No entanto a utilização indiscriminada de agrotóxicos pode gerar diversos danos ao homem e ao meio ambiente [3]. Por esse motivo a determinação desses compostos em alimentos, solos, ar, e águas tem despertado grande interesse [2].
A toxicidade desses compostos tem sido objeto de diversos estudos que demonstram os efeitos agudos e crônicos da exposição do homem aos agrotóxicos. Dentre os principais efeitos adversos à saúde pode-se citar efeitos sobre o sistema nervoso [4], disfunção cognitiva e psicomotora [5], depressão [6], doenças mentais e neurodegenerativas [7], afetando também as funções reprodutivas [8], e o crescimento [9].
1.1 Agrotóxicos
2 Tabela 1 - Vendas de produtos formulados divididos por classe no Brasil em 2013. Adaptado Relatório anual IBAMA 2013 [12].
Classe de Uso Quantidade (toneladas de
Ingrediente Ativo)
Percentual (%)
Herbicida 303573,23 61,23
Inseticida 56993,88 11,50
Fungicida 54030,27 10,90
Inseticida, Acaricida 31725,65 6,40
Adjuvante 19038,99 3,84
Outros* 30402,52 6,13
* Acaricida, espalhante, nematicida, regulador de crescimento, bactericida, cupinicida, protetor de sementes, formicida, feromônio e moluscicida.
1.1.1 Classificação dos agrotóxicos
Os agrotóxicos são classificados em função de alguns aspectos, como por exemplo, grau de toxicidade, estrutura química e modo de ação.
O grau de toxicidade determina o quanto os agrotóxicos são prejudiciais à vida e está relacionado com a dose letal 50 (DL50 - dose necessária de uma dada substância para eliminar 50% de uma população animal em teste).
No modo de ação do ingrediente ativo, os agrotóxicos são classificados de acordo com a forma com que agem nos organismos alvos ou à natureza da praga, e são classificados como inseticidas, fungicidas, herbicidas, raticidas, acaricidas, nematicidas, fumigantes, moluscicidas, etc. Os modos de ação podem ocorrer pela ingestão (agrotóxico ingerido pelo organismo alvo), contato (organismo alvo atingido diretamente pelo biocida) e sistêmico (agindo nas plantas ou contra insetos).
3 No Brasil, a agência nacional de vigilância sanitária (ANVISA) dividiu os agrotóxicos em 4 classes de acordo com sua toxicidade [14]. A classificação mostrada na tabela 2 foi baseada na DL50 em ratos.
Tabela 2 – Classificação dos agrotóxicos de acordo com a periculosidade aos seres humanos.
Classificação Classificação toxicológica
Classe I Extremamente tóxico
Classe II Altamente tóxico
Classe III Medianamente tóxico
Classe IV Pouco tóxico
1.1.2 Agrotóxicos estudados
1.1.2.1 Alacloro
O alacloro (2-cloro-2',6'-dietil-N-metoximetilacetanilida) cuja estrutura está sendo mostrada na Figura 1, é um herbicida e sua aplicação ocorre nos casos de plantas já infestadas. Por determinação da ANVISA, no Brasil seu uso é autorizado nas culturas de café, algodão, amendoim, girassol, cana-de-açúcar, milho, soja. O ingrediente ativo é considerado de Classe III [15].
4 1.1.2.2 Benalaxil
O benalaxil (metil-N-fenilacetil-N-2,6-xilil-DL-alaninato) cuja estrutura está sendo mostrada na Figura 2, é um fungicida e sua aplicação é foliar. Por determinação da ANVISA, no Brasil seu uso é autorizado nas culturas de batata, cebola, tomate e uva. O ingrediente ativo é considerado de Classe III [15].
Figura 2 – Estrutura molecular do benalaxil.
1.1.2.3 Buprofenzina
A buprofenzina (2-terc-butilimino-3-isopropil-5-fenil-1,3,5-tiadiazinan-4-ona) cuja
estrutura está sendo mostrada na Figura 3, é um inseticida e acaricida e sua aplicação é foliar.
Por determinação da ANVISA, no Brasil uso é autorizado nas culturas de abacate, abacaxi,
abóbora, abobrinha, algodão, anonáceas, begônia, berinjela, cacau, chuchu, citros, cupuaçu, feijão, guaraná, gérbera, jiló, kiwi, mamão, manga, maracujá, maxixe, melancia, melão, pepino, pimenta, pimentão, quiabo, romã, soja e tomate. O ingrediente ativo é considerado de Classe IV [15].
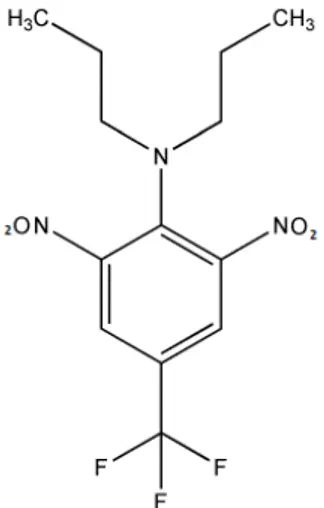
5 1.1.2.4 Cadusafós
O cadusafós (S,S-di-sec-butil O-etil fosforoditioato) cuja estrutura está sendo mostrada na Figura 4, é um inseticida e nematicida e sua aplicação é no solo. Por determinação da ANVISA, no Brasil seu uso é autorizado nas culturas de algodão, batata, café e cana-de-açúcar. O ingrediente ativo é considerado de Classe I [15].
Figura 4 – Estrutura molecular do cadusafós.
1.1.2.5 Clorfenapir
O clorfenapir
(4-bromo-2-(4-clorofenil)-1-etoximetil-5-(trifluorometil)pirrole-3-carbonitrilo) cuja estrutura está sendo mostrada na Figura 5, é um inseticida e acaricida e sua
aplicação é foliar. Por determinação da ANVISA, no Brasil tem seu uso autorizado nas culturas de acerola, algodão, alho, amora, batata, cebola, citros, couve, crisântemo, eucalipto, feijão, framboesa, maracujá, mamão, melancia, melão, milho, morango, pimentão, pitanga, repolho, rosa, soja e tomate. O ingrediente ativo é considerado de Classe II [15].
6 1.1.2.6 Clorotalonil
O clorotalonil (tetracloroisoftalonitrilo) cuja estrutura está sendo mostrada na Figura 6, é um fungicida e sua aplicação é foliar. Por determinação da ANVISA, no Brasil tem seu uso autorizado nas culturas de alface, amendoim, arroz, banana, batata, begônia, berinjela, café, cebola, cenoura, citros, cravo, crisântemo, dália, feijão, gladíolo, gramados, hortênsia, maçã, mamão, melão, melancia, miosótis, pepino, pimentão, repolho, rosa, seringueira, soja, tomate, trigo, tulipa, uva e violeta. O ingrediente ativo é considerado de Classe III [15].
Figura 6 – Estrutura molecular do clorotalonil.
1.1.2.7 Cresoxim metílico
O cresoxim metílico (metil (E) -2-metoxiimino [2- (o-toliloximetil) fenil] acetato de
etilo) cuja estrutura está sendo mostrada na Figura 7, é um fungicida e sua aplicação é foliar.
Por determinação da ANVISA, no Brasil tem seu uso autorizado nas culturas de acerola, algodão, alho, arroz, batata, berinjela, café, cebola, cevada, crisântemo, feijão, framboesa, jiló, kiwi, maçã, manga, maracujá, melancia, melão, morango, pepino, pimenta, pimentão, quiabo, rosa, soja, tomate, trigo e uva. O ingrediente ativo é considerado de Classe III [15].
7 1.1.2.8 Dissulfotom
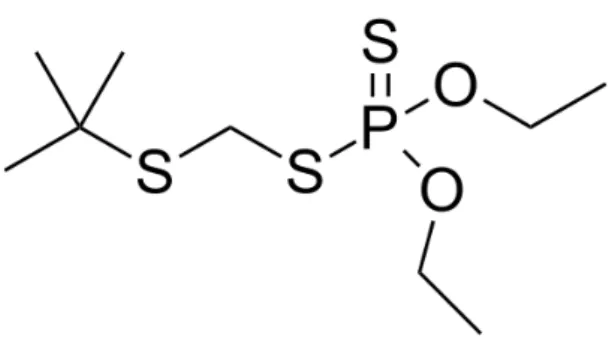
O dissulfotom (O, O-dietilo S-2-etiltioetilo fosforoditioato) cuja estrutura está sendo mostrada na Figura 8, é um Inseticida, acaricida e fungicida e sua aplicação é no solo e em sementes. Por determinação da ANVISA, no Brasil tem seu uso autorizado nas culturas de café e algodão. O ingrediente ativo é considerado de Classe I [15].
Figura 8 – Estrutura molecular do dissulfotom.
1.1.2.9 Espiromesifeno
O espiromesifeno (3-mesitil-2-oxo-1-oxa-espiro [4.4] non-3-en-4-ilo
3,3-dimetilbutanoato) cuja estrutura está sendo mostrada na Figura 9, é um inseticida e acaricida e
sua aplicação é foliar. Por determinação da ANVISA, no Brasil tem seu uso autorizado nas culturas de algodão, feijão, melão e tomate. O ingrediente ativo é considerado de Classe III [15].
Figura 9 – Estrutura molecular do espiromesifeno.
1.1.2.10 Fenamidona
8 determinação da ANVISA, no Brasil tem seu uso autorizado nas culturas de alface, batata, cebola, melancia, melão, rosa, tomate e uva. O ingrediente ativo é considerado de Classe III [15].
Figura 10 – Estrutura molecular da fenamidona.
1.1.2.11 Fenpropatrina
A fenpropatrina ((RS)-alfa-ciano-3-fenoxibenzil 2,2,3,3-tetrametil ciclopropanocarboxilato) cuja estrutura está sendo mostrada na Figura 11, é um Inseticida e acaricida e sua aplicação é foliar. Por determinação da ANVISA, no Brasil tem seu uso autorizado nas culturas de algodão, café, cebola, citros, crisântemo, feijão, gladíolo, maçã, mamão, milho, morango, repolho, rosa, soja e tomate. O ingrediente ativo é considerado de Classe II [15].
Figura 11 – Estrutura molecular da fenpropatrina.
1.1.2.12 Fentoato
9 Figura 12 – Estrutura molecular do fentoato.
1.1.2.13 Metalaxil-M
O metalaxil-M (metil-N-metoxiacetil-N-2,6-xilil-D-alaninato) cuja estrutura está sendo mostrada na Figura 13, é um fungicida e sua aplicação é foliar e sementes. Por determinação da ANVISA, no Brasil tem seu uso autorizado nas culturas de algodão, amendoim, arroz, canola, feijão, girassol, milho, pastagens, soja, sorgo batata, cana-de-açúcar, cebola, fumo, melancia, melão, pepino, repolho, rosa, tomate e uva. O ingrediente ativo é considerado de Classe II [15].
Figura 13 – Estrutura molecular do metalaxil-M.
1.1.2.14 Pendimetalina
10 Figura 14 – Estrutura molecular da pendimetalina.
1.1.2.15 Procimidona
A procimidona (N- (3,5-diclorofenil) -1,2-dimetilciclopropano-1,2-dicarboximida) cuja estrutura está sendo mostrada na Figura 15, é um fungicida e sua aplicação é no solo, semente e foliar. Por determinação da ANVISA, no Brasil tem seu uso autorizado nas culturas de alface, alho, algodão, batata, cebola, cenoura, feijão, gladíolo, maçã, melancia, melão, morango, pêssego, rosa, soja, tomate e uva. O ingrediente ativo é considerado de Classe IV [15].
Figura 15 – Estrutura molecular da procimidona.
1.1.2.16 Terbufós
11 Figura 16 – Estrutura molecular do terbufós.
1.1.2.17 Trifloxistrobina
A trifloxistrobina (metil (E) -metoxi-imino - {(E) -α- 1- (α, α, αtrifluoromtolil)
-etilidenoaminooxi -o-tolil} acetato) cuja estrutura está sendo mostrada na Figura 17, é um
fungicida e sua aplicação é foliar. Por determinação da ANVISA, no Brasil tem seu uso autorizado nas culturas de algodão, alho, amendoim, arroz, aveia, banana, batata, café, caqui, cana-de-açúcar, cebola, cenoura, cevada, citros, eucalipto, feijão, goiaba, maçã, mamão, manga, maracujá, melancia, melão, milho, soja, tomate e trigo. O ingrediente ativo é considerado de Classe II [15].
Figura 17 – Estrutura molecular da trifloxistrobina.
1.1.2.18 Trifluralina
12 culturas de algodão, alho, amendoim, arroz, berinjela, cana-de-açúcar, cebola, cenoura, citros, couve, couve-flor, eucalipto, feijão, feijão-vagem, girassol, gladíolo, mamona, mandioca, milho, pimentão, pinus, quiabo, repolho, seringueira, rosa, soja e tomate. O ingrediente ativo é considerado de Classe III [15].
Figura 18 – Estrutura molecular da trifluralina.
1.1.2.19 Zoxamida
A zoxamida ((R, S) -3,5-dicloro-N- (3-cloro-1-etil-1-metil-2-oxo-propil) -p-toluamida) cuja estrutura está sendo mostrada na Figura 19, é um fungicida e sua aplicação é foliar. Por determinação da ANVISA, no Brasil tem seu uso autorizado nas culturas de batata, rosa, tomate e uva. O ingrediente ativo é considerado de Classe II [15].
Figura 19 – Estrutura molecular da zoxamida.
1.1.3 Dinâmica dos agrotóxicos no meio ambiente
13 pelo uso em excesso, durante o transporte, no descarte de frascos e na lavagem dos equipamentos.
Os riscos ambientais ocasionados pelo uso de agrotóxicos dependem, principalmente, da sua dissipação ou degradação nas culturas, no solo e na água. A persistência dos resíduos tóxicos e sua migração para regiões distantes é determinada pelo seu comportamento ambiental, como lixiviação, volatização, carreamento superficial, adsorção e dessorção, e outros processos físico-químicos [16].
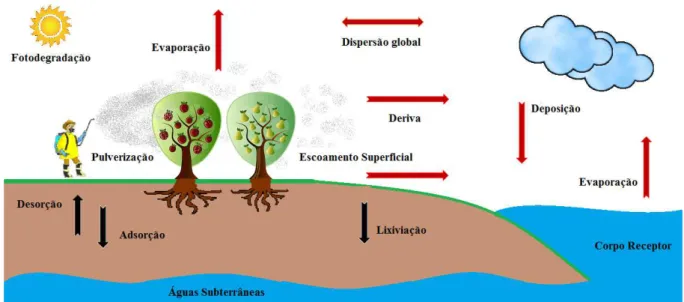
A Figura 20 mostra a dinâmica de dispersão dos agrotóxicos no meio ambiente, onde o agrotóxico que foi pulverizado é transportado pela água da chuva que escoa superficialmente pelo solo, chegando até o corpo receptor de água. Os picos de concentrações desses produtos nos corpos hídricos estão relacionados com aumentos bruscos na precipitação pluviométrica. A lixiviação é um processo que depende das propriedades do agrotóxico e do solo, onde a água da chuva com os resíduos penetra no solo, podendo atingir a água subterrânea. O transporte dos agrotóxicos pela atmosfera ocorre pelo material particulado carregado pelo vento através dos processos de deriva, dispersão global, evaporação e deposição. A evaporação pode ocorrer durante e após a aplicação, a partir das plantas, do solo, assim como na superfície do corpo receptor.
Figura 20 – Dinâmica dos agrotóxicos no meio ambiente.
14 No Brasil, a Portaria normativa nº 84 do IBAMA [18], classifica os agrotóxicos em 4 classes de acordo com sua periculosidade ambiental. A classificação baseia-se nos parâmetros persistência no ambiente, bioacumulação, probabilidade de ser teratogênico, cuidados no transporte, toxicidade a diversos organismos, potencial mutagênico, carcinogênico, sendo então divididos em classes conforme mostra a Tabela 3.
Tabela 3 – Classificação dos agrotóxicos de acordo com a periculosidade ambiental.
Classificação Periculosidade ambiental
Classe I Produto altamente perigoso
Classe II Produto muito perigoso
Classe III Produto perigoso
Classe IV Produto pouco perigoso
Para o estudo de sorção dos agrotóxicos pelo NTC, foi avaliado o coeficiente de partição óleo/água, chamado também de kow, que avalia a polaridade dos compostos. Compostos que apresentam kow acima de 350 já são considerados como apolares, portanto, apenas o Metalaxil-M é considerado polar, conforme pode-se observar na Tabela 4, que mostra também as classes dos agrotóxicos estudados assim como seu grupo químico.
15 Tabela 4 – Propriedades gerais dos agrotóxicos estudados.
Nomes Kow Classificação toxicológica Grupo químico
Alacloro 1230 III Cloroacetanilida
Benalaxil 3470 III Acilalaninato
Buprofenzina 85100 IV Tiadiazinona
Cadusafós 7080 I Organofosforado
Clorfenapir 67670 III Análogo de pirazol
Clorotalonil 794 III Isoftalonitrila
Cresoxim metílico 2510 III Estrobilurina
Dissulfotom 8910 I Organofosforado
Espiromesifeno 35500 III Cetoenol
Fenamidona 631 III Imidazolinona
Fenpropatrina 1100000 II Piretróide
Fentoato 4900 III Organofosforado
Metalaxil-M 51 II Acilalaninato
Pendimetalina 158000 III Dinitroanilina
Procimidona 2000 IV Dicarboximida
Terbufós 32400 I Organofosforado
Trifloxistrobina 31600 II Estrobilurina
Trifluralina 186000 III Dinitroanilina
Zoxamida 5750 II Benzamida
1.1.4 Valores máximos permitidos (VMPs) de resíduos de agrotóxicos em água
16 estabelece os limites, conforme publicado na Portaria 2914/2011 [22] e para corpos de águas a Resolução No 357, de 17 de março de 2005 [23]. Para águas de reuso, existe também a agência de proteção ambiental dos Estados Unidos (US-EPA) [24].
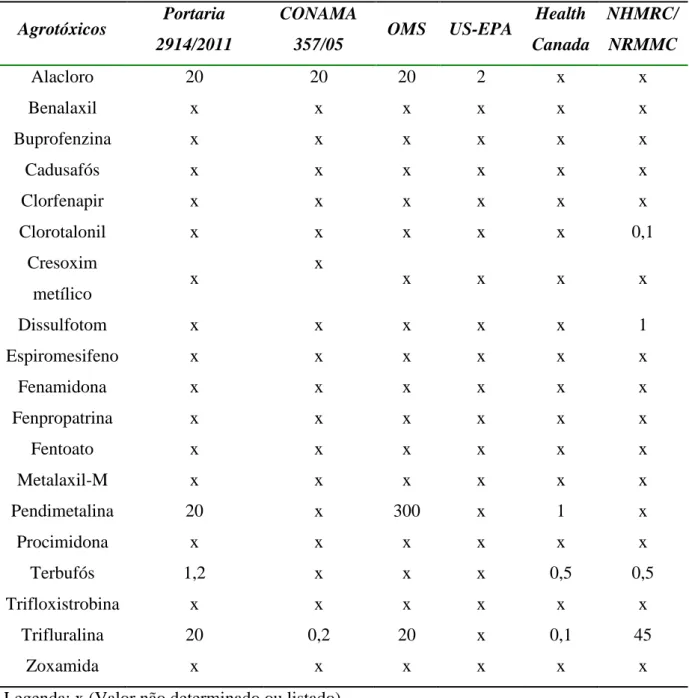
A Tabela 5 apresenta os valores máximos permitidos dos agrotóxicos estudados de acordo com esses órgãos governamentais reguladores.
Tabela 5 - Valores máximo permitido em μg L-1 para agrotóxicos em água de acordo com os principais órgãos regulamentadores.
Agrotóxicos Portaria
2914/2011
CONAMA
357/05 OMS US-EPA
Health
Canada
NHMRC/
NRMMC
Alacloro 20 20 20 2 x x
Benalaxil x x x x x x
Buprofenzina x x x x x x
Cadusafós x x x x x x
Clorfenapir x x x x x x
Clorotalonil x x x x x 0,1
Cresoxim
metílico x
x
x x x x
Dissulfotom x x x x x 1
Espiromesifeno x x x x x x
Fenamidona x x x x x x
Fenpropatrina x x x x x x
Fentoato x x x x x x
Metalaxil-M x x x x x x
Pendimetalina 20 x 300 x 1 x
Procimidona x x x x x x
Terbufós 1,2 x x x 0,5 0,5
Trifloxistrobina x x x x x x
Trifluralina 20 0,2 20 x 0,1 45
Zoxamida x x x x x x
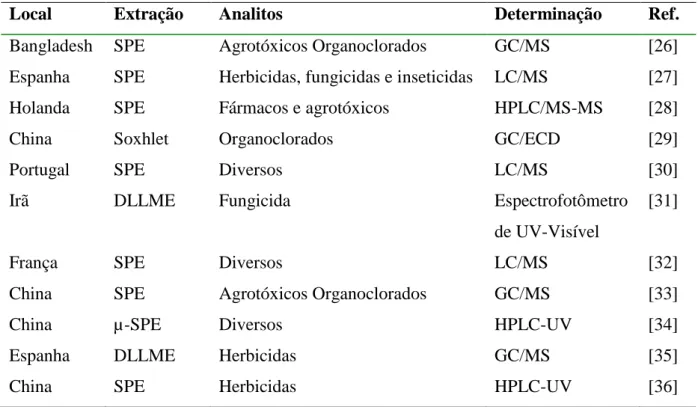
17 Nos sistemas fluviais, os agrotóxicos podem entrar como fontes difusas ou pontuais, ao longo de todo o curso da água [25]. A Tabela 6 mostra alguns estudos realizados entre os anos de 2013 e 2015 para determinação de agrotóxicos em águas. Foram estudados diferentes compostos usando métodos distintos.
Tabela 6 – Trabalhos entre os anos de 2013 e 2015 realizados em diversos países para identificação de agrotóxicos em águas.
Local Extração Analitos Determinação Ref.
Bangladesh SPE Agrotóxicos Organoclorados GC/MS [26]
Espanha SPE Herbicidas, fungicidas e inseticidas LC/MS [27]
Holanda SPE Fármacos e agrotóxicos HPLC/MS-MS [28]
China Soxhlet Organoclorados GC/ECD [29]
Portugal SPE Diversos LC/MS [30]
Irã DLLME Fungicida Espectrofotômetro
de UV-Visível
[31]
França SPE Diversos LC/MS [32]
China SPE Agrotóxicos Organoclorados GC/MS [33]
China µ-SPE Diversos HPLC-UV [34]
Espanha DLLME Herbicidas GC/MS [35]
China SPE Herbicidas HPLC-UV [36]
1.2 Técnicas de microextração
18 1.2.1 Microextração em fase líquida (LPME)
O método de microextração em fase líquida, LPME (Liquid phase microextraction), é barato, rápido e simples quando comparado com as outras técnicas de extração e também pode ser aplicado a uma grande quantidade de compostos [10].
Dentre os vários métodos de LPME, SDME (Single-Drop Microextraction), HF-LPME (hollow fiber-liquid phase microextraction) e DLLME (dispersive liquid liquid
microextraction) são as técnicas mais representativas para análise de agrotóxicos em águas
[39].
A LPME foi desenvolvida em 1996, por dois grupos de pesquisa quase que ao mesmo tempo, Liu e Dasgupta [40] e Jeannot e Cantwell [41] relataram um sistema gota-a-gota para extrair suas amostras e em seguida injetada num sistema de cromatografia em fase gasosa para a análise. O método possuía uma desvantagem já que a extração e a injeção devem ser realizadas separadamente e com aparelhos diferentes. Em 1997, para suprir esse problema, Jeannot e Cantwell [42] desenvolveram um método de microextração, onde é deixado 1 µ L do solvente na ponta da agulha da seringa e em seguida ela é imersa na solução aquosa contendo os analitos alvo sob agitação, a gota é então recolhida de volta após a extração e injetada no GC (gas chromatography) para análise posterior, o que integra a extração e injeção em um só sistema. Com isso houve o surgimento de algumas novas configurações LPME, como SDME e HF-LPME. A Figura 21 mostra a representação esquemática de SDME e LPME.
19 Yunli Wu e colaboradores [43] compararam dois métodos microextração líquida com gota única utilizando headspace HS-SDME (headspace single drop microextraction) e microextração líquida com fibra oca utilizando headspace HS-HF-LPME (headspace hollow
fiber liquid phase microextraction) com a determinação por HPLC-UV (High
Performance/Pressure Liquide Chromatography) de compostos fenólicos em amostras de
água, mel e toner. Os limites de detecção ficaram na faixa de 0,2 a 4,2 ng mL-1 e os desvios padrão relativos ficaram entre 3,1 e 9,8 %. Os dois modos têm desempenhos analíticos comparáveis, no entanto HS-SDME foi menos robusto porem mais simples do que o HS-HF-LPME, este último tem maior interface de extração o que permite que os compostos voláteis, alcancem o equilíbrio em um menor período.
O problema da SDME é o tempo de extração longo e taxas de agitação mais rápidos que normalmente resultam em dissolução e/ou deslocamento queda. Para resolver esse problema, em 1999, Pedersen-Bjergaard e colaboradores [44], introduziu um método denominado de microextração de fase líquida com fibra oca (HF-LPME), onde existe uma fibra porosa oca que protege o micro-extrato tornando o método mais robusto do que SDME. Wang e colaboradores [45] desenvolveram um método de pré-tratamento de amostras de água do mar para determinação de ésteres organofosforados, por microextração em fase líquida com fibra oca (HF-LPME) juntamente com a cromatografia gasosa acoplada a espectrometria de massa (GC-MS). Os resultados mostraram que esse método é rápido, preciso e possui uma alta sensibilidade com os limites de detecção (LD), variando de 2,6 a 120 ng L-1 para diferentes organofosforados, e os desvios padrão relativos variaram de 2,1 a 10,4 %.
20 Figura 22 – Representação esquemática do método de DLLME.
Chen e colaboradores [47] desenvolveram um estudo em amostras de rios e lagos da técnica chamada de UDSA-DLLME (up-and-down-shaker-assisted dispersive liquid–liquid microextraction) acoplado a um GC-MS para determinação de herbicidas na água. O limite de
detecção foi de 0,02 a 0,04 µg L-1, a linearidade do método foi de 0,2 a 200,0 µg L-1. As recuperações relativas de amostras em rios e lagos enriquecida com 2,0 µg L-1 de triazinas foram de 94,2 a 102,2 % e 98,5 a 104,1 %, respectivamente. Sendo assim a técnica proporcionou alta repetibilidade e recuperação dentro de um prazo curto de extração.
Em 2007, Khalili Zanjani e colaboradores [48] desenvolveram uma nova técnica de microextração em fase líquida com flutuação da gota orgânica por solidificação, SFODME (microextraction solidification of floating organic drop) onde um pequeno volume de solvente orgânico com um ponto de fusão próximo da temperatura ambiente é misturada com a solução aquosa da amostra. O método consiste em transferir o solvente orgânico, depois de fundido, para um frasco cônico, onde este é usado para a determinação dos analitos. SFODME, possui baixo custo, é sensível, eficaz na remoção de matrizes interferentes e reduz a quantidade de solvente.
Novos métodos de extração LPME tem sido desenvolvidos recentemente. Saleh e seus colaboradores [49] utilizaram o método chamado de MF-LPME (microfunnel-supported
liquid-phase microextraction), onde foi aplicado solvente orgânico de baixa densidade
21 mar foram de 1,0, 4,8 e 1,4 ng L-1 para Irgarol 1051, diuron e 3,4-dicloroanilina, respectivamente. A precisão da técnica foi avaliada em termos de reprodutibilidade que era menos do que 12,0 % (n = 5). O método oferece bom LD (em ng L-1 gama), bem como boa linearidade e reprodutibilidade aceitável para os analitos sendo eficiente, simples e sensível e podendo também ser utilizado pelas técnicas convencionais, tais como SPE, SPME e outros tipos de LLME.
Outros métodos têm sido desenvolvidos para a microextração em fase líquida, a Tabela 7 mostra alguns desses experimentos.
Tabela 7 – Métodos recentes para amostragem de agrotóxicos por LPME.
Técnica Descrição Analito Ref.
AG-LPME Utilização de Gel de agarose na microextração e analise em GC-MS
Hidrocarbonetos aromáticos [50]
VLDS–SD– DLLME
Utilização de Vortex com solvente desmulsificado de baixa densidade para a microextração e analise por HPLC
Agrotóxicos organofosforados
[51]
KW-LPME Utilização de lã na microextração e analise por LC-UV
2,4-dihidroxibenzofenona, benzofenona e 2-hidroxi-4-metoxibenzofenona
[52]
G-HF-LPME Utilização do fibra oca de grafeno na microextração e analise por HPLC
Herbicidas de fenil [53]
PVDF-LPME
Utilização de fibra oca de fluoreto de polivinilideno poroso na microextração e analise por UHPLC–MS/MS
Agrotóxicos (propoxur, carbofurano, atrazina, cianatrin, metolacloro, prometrina e tebuconazol)
[54]
1.2.2 Microextração em fase sólida (SPME)
22 amostra em qualquer local [56]. A SPME é uma técnica onde a pré-concentração e a extração dos analitos não utiliza solvente e tem alto poder de concentração. A técnica consiste na separação no equilíbrio e é desenvolvida em duas etapas, sendo a primeira a etapa a de adsorção (extração) já na segunda etapa ocorre a dessorção do material extraído para a análise cromatográfica. No método de SPME são consideradas basicamente três fases: a fibra extratora, a fase gasosa (headspace) e a matriz homogênea, sendo um processo baseado em equilíbrios simultâneos em sistemas multifásicos ocorrendo processos da termodinâmica e da transferência de massa. Atualmente existem diversas configurações de SPME e também com diversas aplicações como análise de alimentos, solo, água, produtos naturais e farmacêuticos, forense e analise clínica [57].
Os métodos de SPME são classificados em procedimentos estáticos e dinâmicos. Os processos estáticos são realizados para amostras sob agitação, e tem como principais métodos, fibra de SPME, Microextração com película fina, extração com disco rotativo de sorção, extração com barra magnética (SBSE) e SPME dispersiva, já os processos dinâmicos tem como exemplos as microextrações com capilar utilizando as configurações de agulha, tubo ou ponteira [56]. Algumas dessas técnicas encontram-se na Figura 23.
Figura 23 – Técnicas de microextração SPME. Adaptado [56].
23 tem-se uma fibra de sílica dentro da agulha da microseringa, conforme ilustrado na Figura 24. Quando em contato com a amostra a fibra é exposta pelo movimento do êmbolo, que permite a sua exposição durante a extração e a dessorção quando injetado no equipamento, onde a agulha protege a fibra no processo.
Figura 24 – Microseringa com fibra de sílica.
Merib e colaboradores [59] propuseram um método de extração simultânea de voláteis (trihalometanos) e semi-voláteis (agrotóxicos organoclorados) de amostras de água por imersão direta em headspace utilizando fibras para a microextração em fase sólida chamado de DI-HS-SPME (direct immersion headspace-solid phase microextraction) onde foram otimizados e comparados. Os modos de extração SPME foram comparados e o DI-HS-SPME produziu excelentes resultados para ambos os compostos voláteis e semi-voláteis onde o limite de quantificação variaram de 0,02 a 2,0 mg L-1 para agrotóxicos organoclorados e 0,30 a 0,77 mg L-1 para os trihalometanos. O uso do método DI-HS-SPME representa uma técnica de fácil utilização para a análise de rotina das amostras e foi mais eficaz do que o uso de modos tradicionais de SPME para a extração das duas classes de compostos estudados (trihalometanos e agrotóxicos organoclorados).
O método que utiliza cartuchos descartáveis para extração em fase sólida (SPE) teve seus primeiros trabalhos em 1978. O método diminui o uso de solventes quando comparado com os métodos de LPME já que consiste na adsorção de compostos da amostra por algum material com capacidade de capturar, por diferença de polaridade, os analitos [60].
24 extrair diferentes agrotóxicos presentes em baixas concentrações em amostras de água, como organofosforados, clorados, piretróides, triazinas e cloroacetamidas. A identificação e quantificação foi realizada por cromatografia gasosa acoplada a espectrometria de massa (GC-MS). Os limites de quantificação obtidos ficaram entre 0,2 e 3,5 ng L-1, para robustez as recuperações variaram de 63 a 104 % com RSD de 4 a 23 %, e com precisão aceitável. As áreas com práticas agrícolas intensivas, apresentaram os maiores níveis de agrotóxicos, onde os valores máximos de atrazina com 433,9 ng L-1, alfa-cipermetrina com 121,7 ng L-1 e endosulfan com 106,7 ng L-1.
Em 2003 Anastassiades e colaboradores [62] desenvolveram um método simples, rápido e de baixo custo chamado de QuEChERS (Quick, Easy, Cheap, Effective, Rugged,
Safe) para a determinação de agrotóxicos em frutas e legumes. O procedimento envolve a
extração em fase única de 10,0 g da amostra com 10,0 mL de acetonitrila, seguido pela partição líquido-líquido formada pela adição de 4,0 g de MgSO4 anidro e 1,0 g de NaCl. Mantzos e colaboradores [63] utilizaram o QuEChERS para a extração em fase sólida (SPE) para determinar quatro herbicidas (metazacloro, oxifluorfeno, quizalofope-p-etil, quinmeraque) e um inseticida (cipermetrina) em águas. A determinação foi realizada utilizando (GC-MS) e (HPLC-MS). O coeficiente de correlação foi superior a 0,992 para todos os agrotóxicos em todos os substratos e os valores médios de recuperação foram obtidos para todos os agrotóxicos em água (65,4 a 108,8 %), solo (70,0 a 110,0 %) e vegetal (66,1 a 118,6%). Esses métodos podem ser aplicados de forma eficiente para estudos de dissipação dos agrotóxicos no campo.
Com a necessidade de otimizar os processos de extração de compostos orgânicos como os agrotóxicos, novas ferramentas têm sido desenvolvidas. Atualmente, os nanotubos tem sido bastante estudados, com diversas aplicações.
1.3 Nano extração em fase sólida com o mNTC
25 Nanotubos de carbono são tubos em escala molecular de carbono grafite que pode ser considerada como uma folha de grafeno na forma de um cilindro. Sua designação logo evoluiu para nanotubos de carbono de paredes múltiplas chamado de MWCNTs (multi-walled
Carbon nanotubes), que reflete melhor sua estrutura. Com um controle da deposição de vapor
catalítica pode-se fazer uma única camada de estruturas tubulares com diâmetros tão pequenos quanto 1 nm. Estas estruturas foram então designadas de nanotubos de carbono de parede única ou SWCNTs (single-walled Carbon nanotubes) e foram sintetizados em a fase de gás, pela mesma via de produzir MWCNTs [65].
É possível sintetizar os nanotubos de carbono em grandes quantidades com um número preciso de camadas, os três principais métodos empregados são, arco-descarga, separação à laser e a deposição química de vapor.
O primeiro método utilizado para produção de nanotubos foi o de arco-descarga [64] [66]. Neste método, uma descarga eletrica é gerada no arco entre dois elétrodos de grafite, sob uma atmosfera inerte de hélio ou de árgonio. Obtem-se uma temperatura muito elevada, a qual permite a sublimação do carbono [67].
O metodo de separação a laser consiste em uma folha de grafite que é vaporizada por irradiação laser sob uma atmosfera inerte, resultando em uma fuligem contendo nanotubos que são arrefecidas para as paredes de um tubo de cobre. É possivel a fabricação dos nanotubos de carbono de paredes múltiplas ou de parede simples [68].
O composto produzido pelo processo de deposição química de vapor (Chemical Vapor Deposition – CVD) é anfifílico devido a nanoestrutura (NTC) e nanofibra (NFC) de carbono serem hidrofóbicas e os fragmentos de silicatos em camadas hidrofílicos. É também magnético devido aos núcleos do Ferro revestidos por carbono. Esse composto se dispersa muito bem na água, mantendo o NTC e NFC separados (evitando aglomeração). Esta área da superfície exposta de carbono é muito eficiente para a adsorção (sem limitação da difusão) das moléculas orgânicos apolares [69].
26 Existem três tipos de NTC adsorventes que são os nanotubos de carbono de paredes múltiplas (MWCNTs), de parede única (SWCNTs) e os funcionalizados (f-NTC). Esses materiais desempenham um papel importante na remoção e identificação de vários contaminantes orgânicos, gerando então grande interesse na utilização dos NTC em amostras de agrotóxicos em águas [71].
Ghasemi e colaboradores [72] sintetizaram um nanotubo de carbono (PbO2/MWNTC). Ele foi sintetizado pela formação hidrotermal de dióxido de chumbo em MWNTC funcionalizado onde ele é usado para construir o cartucho de fase sólida. A remoção de agrotóxicos a partir da água potável foi determinada por cromatografia gasosa-espectroscopia de massa de análise (GC/MS). Foram adsorvidos os 74 agrotóxicos contidos na água e a adsorção média variou de acordo com a polaridade e a concentração dos analitos e seus desvios padrão relativos ficaram entre 1,4 e 11 %.
Huo e colaboradores [73] desenvolveram um sensor eletroquímico constituído por nanofios de óxido de cobre e nanotubos de carbono de parede única (SWCNTs) para a detecção de agrotóxicos organofosforados. O NTC desenvolvido é altamente estável e possui grande afinidade com o malathion. O comportamento eletroquímico do sensor de NTC para a determinação de agrotóxicos foi avaliado através de voltametria cíclica, espectroscopia de impedância eletroquímica e voltametria de pulso diferencial. O sensor possui boa estabilidade, reprodutividade assim como boa seletividade quando comparados com íons inorgânicos e açúcares, o que mostra que os NWS-SWCNTs (nanowires and single-walled carbon
nanotubes) podem ser utilizados para a detecção sensível e seletiva de agrotóxicos
organofosforados.
Purceno e colaboradores [74] produziram um nanotubo anfifílico hibrido, contendo no mesmo nanotubo duas seções distintas, uma parte hidrofílica N-dopado conectada a um segmento não dopado hidrofóbico. Esses nanotubos foram sintetizados como o ferro como catalisador em uma reação com duas fases, utilizando etileno puro para o crescimento da seção não dopada do nanotubo e acetonitrila como fonte de carbono e nitrogênio para produzir no mesmo tubo uma seção hidrofílica polar. Esses nanotubos adsorveram duas classes de contaminantes perigosos, o hormônio etinilestradiol e 16 contaminantes policromáticos.
27 microscopia eletrônica de transmissão (transmission electronic microscopy – TEM), analise elementar, influência de nitrogênio na qualidade dos mNTC utilizando a espectroscopia de Raman e por fim a qualidade de carbono por análise térmica, onde os resultados obtidos mostraram a presença de nanotubos de carbono do tipo MWNTC com átomos de ferro encapsulados, justificando a capacidade magnética dos mNTC, conforme pode-se observar na Figura 25. A análise elementar mostrou a presença de 0,4 % m/m de Nitrogênio, 94,8 % m/m de Carbono e os 4,8 % m/m restantes de ferro encapsulado.
Figura 25 - Imagens da microscopia eletrônica de transmissão do NTC híbrido N-dopado. Adaptado [75].
Esses mNTC híbridos possuem uma parte hidrofílica (dopada com nitrogênio), que favorecem a dispersão em meios aquosos, enquanto que a seção hidrofóbica não dopada tem forte afinidade com moléculas orgânicas. O caráter anfifílico combinado com as propriedades magnéticas facilitam a separação e retirada dos mNTC das amostras aquosas através de um imã o que possibilita aplicações inovadoras na extração de analitos. A utilização desses mNTC apresentou uma recuperação de 80 a 100 % em um trabalho anterior do grupo utilizando-os para sorção de HPA [75].
28 Estudos realizados nos anos de 2014 e 2015 utilizam diversos dispositivos para sorção dos analitos com os NTC, Jiping Ma e colaboradores [36] utilizaram um cartucho. Zainal Abidin e colaboradores [76] utilizaram uma membrana formando uma espécie de bolsa contendo os nanotubos. Chuanshan Yu e colaboradores [77] utilizaram nanotubos com dispositivo QuEChERS modificado. Estes estudos apresentam bons resultados de extração, no entanto, outros materiais além dos nanotubos foram utilizados, além do mais, são sistemas complexos, e podem ser utilizados apenas uma vez. Portanto, a utilização dos mNTC possui inúmeras vantagens quando comparadas com esses métodos, já que é uma técnica que não necessita a montagem de um dispositivo, além da rapidez, praticidade, baixo custo do método e possibilidade de reutilização.
Alguns trabalhos sobre a remoção e adsorção de agrotóxicos utilizando nanotubos de carbono encontram-se resumidas na Tabela 8. Existem ainda muitos desafios nessa área, e pesquisas são essenciais para a preparação de novos nanotubos otimizando a capacidade de sorção e dessorção.
Tabela 8 – Trabalhos utilizando nanotubos para amostragem e pré-concentração de substâncias tóxicas.
Método de
extração
Analitos Análise LQ LD Ref.
SPE Carbamatos HPLC - 0,58 a 2,06 μg kg-1 [78]
SPE 16 Fungicidas LC-ESI-MS/MS 10 μg kg-1 - [79]
QuEChERS Pirimifos-metil e deltametrina
ECD e GC-FPD
0,01 a 0,06 μg kg-1
- [77]
SPE Carbamatos HPLC - 9,7 a 12,0 μg kg-1 [80]
QuEChERS 25 Agrotóxicos LC– ESI-MS/MS
1 a 25 µg kg-1 - [81]
QuEChERS 104
agrotóxicos
LC-MS/MS - 0,2 a 40,0 µg kg-1 [82]
SPE 8 agrotóxicos LC-MS 1,6 a 45,2 ng L-1
0,3 a 9,5 ng L-1 [83]
QuEChERS 37 Agrotóxicos HPLC 0,46 a 28,57 µg kg-1
29 2 OBJETIVOS
2.1 Objetivo geral
Desenvolver um método para amostragem passiva de agrotóxicos em águas utilizando nanotubos de carbono e determinação por cromatografia gasosa com detector de espectrometria de massas.
2.2 Objetivos específicos
Fazer um levantamento da venda de agrotóxicos mais comercializados em Minas Gerais.
Selecionar os agrotóxicos para os estudos de extração com os nanotubos de carbono.
Desenvolver um método de extração por fase sólida com nanotubos de carbono (SPE-mNTC)
Desenvolver método GC/MS para determinação dos agrotóxicos selecionados para o estudo.
Validar o método SPE-mNTC-GC/MS desenvolvido.
30 3 PARTE EXPERIMENTAL
Este trabalho foi realizado no Departamento de Química da Universidade Federal de Minas Gerais em Belo Horizonte, Minas Gerais.
Foram estabelecidas 4 etapas de estudo para que pudesse ser desenvolvido um procedimento analítico capaz de identificar e quantificar agrotóxicos em amostras ambientais. Os procedimentos adotados foram baseados em métodos descritos na literatura.
Foi feita uma revisão bibliográfica na primeira etapa, obtendo o maior número de informação a respeito do procedimento de extração com nanotubos e dos métodos de cromatografia líquida e gasosa acoplada a espectrometria de massas, para análise de agrotóxicos.
A segunda etapa constituiu no desenvolvimento do método GC/MS para determinação dos agrotóxicos e consequentemente validar o método desenvolvido.
Na terceira etapa, os nanotubos foram purificados com ácido sulfúrico e na sequencia foi desenvolvido um método de extração por fase sólida com os nanotubos de carbono (SPE-mNTC).
Na última etapa, foi aplicado o método validado para a identificação e quantificação de agrotóxicos em amostras reais.
3.1 Instrumentação
1. Sistema de purificação de água ELGA Purelab Classic (São Paulo, SP, Brasil), Modelo UVMK2;
2. GC/MS Shimadzu QP2010S – Plus, Shimadzu Corporation, (Kyoto, Japão), equipado com um quadrupolo como analisador e fonte de ionização por impacto eletrônico (Eletronic Impact – EI).
3. Ultra-som, UltraSonic Cleaner 1400, Unique (Indaiatuba, SP, Brasil), Modelo USC-2800 com frequência de 40 kHz e potência de 120 Watts;
4. Congelador Vertical, Consul (Santa Catarina, Brasil), Modelo CVU18; 5. Refrigerador, Consul (Santa Catarina, Brasil), Modelo CRC28;
31 7. Micropipeta automática Finnpipette F1, com faixa de trabalho 10 a 100 µL, Thermo
Scientific (Franklin, Estados Unidos);
8. Micropipeta automática Finnpipette F1, com faixa de trabalho 100 a 1000 µL, Thermo Scientific (Franklin, Estados Unidos);
9. Chapa de aquecimento com controle de temperatura e agitador magnético, Marconi (Piracicaba, SP, Brasil), Modelo MA085;
10.Agitador Vortex, Biomixer (São Paulo, SP, Brasil), Modelo QL-901;
11.Balança analítica, com resolução de 0,00001 g, Shimadzu (Kyoto, Japão), Modelo AUW220D;
12.Estufa Biomatic Aparelhos Científicos Ltda. (Porto Alegre, RS, Brasil);
13.Origin versão 8.0 da OriginLab Corp. (Northampton, MA, Estados Unidos) para verificação da normalidade dos dados e curvas de calibração;
3.2 Reagentes e materiais
1. Acetonitrila grau HPLC, pureza 99,98 %, J.T.Baker (Center Valley, PA, USA); 2. Nitrogênio comprimido Industrial, Air Products;
3. Detergente neutro, Extran MA 02 neutro da Merck (Rio de Janeiro, Brasil);
4. Água ultra pura obtida do purificador de água Elga Purelab Classic (São Paulo, Brasil); 5. Metanol grau cromatográfico Merck KGaA (Darmstadt, Alemanha), com grau de pureza
de 99,9 %;
6. Ácido sulfúrico pureza ≥95%, Sigma-Aldrich (St. Louis, MO, USA). 7. Balões volumétricos de 10,0, 25,0, 50,0, 100,0 e 1000,0 mL;
8. Espátulas metálicas;
9. Béqueres de 10, 50, 100, 1000 e 2000 mL; 10.Vidraria para destilação;
11.Proveta de 100 e 1000 mL;
12.Frascos de vidro de 2 mL com tampa e septos de silicone ou teflon (PTFE); 13.Imã;
32 15.Padrões de agrotóxicos da Sigma-Aldrich (St. Louis, MO, USA).
3.3 Análise por cromatografia gasosa acoplada a espectrometria de massas
A extração dos agrotóxicos utilizando nanotubos foi feita para determinar os agrotóxicos por cromatografia gasosa com detecção por espectrometria de massas. O GC/MS utilizado foi um Shimadzu QP2010S – Plus equipado com um quadrupolo como analisador e fonte de ionização por impacto eletrônico (Eletronic Impact – EI), ilustrado na Figura 26.
Figura 26 – Equipamento GC/MS utilizado Shimadzu QP2010S – Plus
Foi utilizada coluna capilar de fase da Agilent Technologies DB-200 (35 % trifluorpropil, 65% metil polidimetilsiloxano ligada quimicamente a sílica fundida), com 30 m de comprimento, 0,25 mm de diâmetro interno e espessura do filme de 0,25 µm.
33 Tabela 9 – Concentrações das soluções estoque de agrotóxicos.
Agrotóxicos Concentração mg L-1
Alacloro 1286,6
Benalaxil 1260,7
Buprofenzina 1124,9
Clorfenapir 1245,0
Clorotalonil 1062,5
Cresoxim metílico 1157,2
Dissulfotom 1413,0
Espiromesifeno 1051,9
Fenamidona 1093,0
Fenpropatrina 1385,5
Fentoato 1136,3
Metalaxil-M 1269,6
Pendimetalina 2157,8
Procimidona 1000,0
Terbufós 896,2
Trifloxistrobina 1411,6
Zoxamida 1006,5
Cadusafós 1212,5
Trifluralina 1184,4
A partir dos padrões, foram preparadas soluções estoque com concentração de 2,0 mg L-1 utilizando como solvente a acetonitrila. Para essas soluções foram injetados 1,0 µ L utilizando uma seringa no cromatógrafo a gás acoplado a espectrometria de massas a 70 eV de energia de ionização, usando o modo de varredura (SCAN) para as relações massa/carga entre 45 e 550 m/z. O comportamento e as áreas dos picos foram avaliados utilizando software GC/MS Solution Ver 2.5 da Shimadzu.
34 As condições cromatográficas foram estabelecidas com o objetivo de obter uma maior sensibilidade para identificação dos agrotóxicos. Foram injetadas no cromatógrafo, uma solução padrão multiresíduo de agrotóxicos em acetonitrila na concentração de 2,0 mg L-1 onde as seguintes variáveis foram estudadas: volume de injeção, tamanho da coluna cromatográfica, temperatura do injetor, modo de injeção (splitless e split), rampa de temperatura da coluna, temperatura da interface, temperatura da fonte de ionização do espectrômetro de massas e velocidade linear do gás de arraste. Após o teste com as variáveis, a melhor relação sinal/ruído calculada através do software GC/MS Solutions para os compostos selecionados foi obtida, onde o método está descrito na Tabela 10.
Tabela 10 - Parâmetros do GC/MS – Método empregado na análise dos agrotóxicos.
Equipamento GC/MS - Shimadzu QP2010S – Plus equipado com um quadrupolo como analisador e fonte de ionização por impacto eletrônico (Eletronic Impact – EI)
Coluna Agilent Technologies DB-200 - (35 % trifluorpropil, 65% metil polidimetilsiloxano, 30 m, 0,25mm, 0,25 μm)
Gás de arraste Hélio
Velocidade do gás de arraste 45,1 cm seg-1
Injeção 1,00 μL, modo splitless por 0,75 min; purga do septo a 10 mL min-1
Temperatura do forno da coluna 80 ºC Temperatura do injetor 275 ºC Temperatura da Interface 280 ºC Temperatura da fonte de íons 230 ºC
Voltagem do detector 70 eV
Programação da temperatura no forno da coluna
80 ⁰C aumentando 20 ⁰C/min até 160 ⁰C, aumentando 5 ⁰C/min até 255 ⁰C, aumentando 20 ⁰C/min até 280 ⁰C e mantendo por 3 min. Tempo total 27,25 min
35 de espectros do National Institute of Standards and Technology (NIST) [86] e do Shimadzu e confirmados pelos seus respectivos tempos de retenção obtidos nessas bibliotecas.
As soluções analíticas para o estabelecimento das curvas analíticas foram preparadas a partir das soluções padrões, de forma a obterem-se soluções nas concentrações entre 0,5 mg L-1 a 4,0 mg L-1.
3.4 Validação do método analítico
Para a validação do método, foram seguidos os critérios e recomendações da
Analytical Chemistry in Europe (EURACHEM) [87]. Os principais parâmetros de
desempenho são seletividade, linearidade e sensibilidade, limite de detecção, limite de quantificação, recuperação e precisão.
A seletividade avalia o grau de interferência de espécies que possam estar presentes, onde o método pode quantificar a substância a analisar com precisão na presença de interferentes [88].
Para o método de análise multiresíduo de agrotóxicos por GC/MS, a seletividade foi atribuída aos tempos de retenção determinados para os compostos estudados, e os espectros de massas da biblioteca NIST [86].
Para avaliar a linearidade de um procedimento, deve-se verificar a homocedasticidade dos dados, observando as variâncias das respostas, se elas permanecem constantes ao longo da concentração, os dados são homocedásticos e a regressão pode ser feita pelo método dos mínimos quadrados ordinários. Caso contrário, há heterocedasticidade, e o ajuste deve ser feito pelo método dos mínimos quadrados ponderado.
Para estimar a qualidade do ajuste, pode-se utilizar o coeficiente de determinação (R2) ou o de correlação (r), onde valores próximos de 1 para o coeficiente de determinação, indicam um melhor ajuste.
Para o método analítico estudado, a linearidade foi avaliada pelas curvas de calibração, em acetonitrila para análise multiresíduo de agrotóxicos por GC/MS com seis níveis de concentração, 0,5 mg L-1, 1,2 mg L-1, 1,9 mg L-1, 2,6 mg L-1, 3,3 mg L-1 e 4,0 mg L-1.
36 A precisão é a medida da dispersão dos valores experimentais repetidos de ensaios independentes de uma mesma amostra sob condições já definidas, e pode ser expressa através do coeficiente de variação (CV%) ou do desvio padrão relativo (DPR).
Para avaliar a precisão foram analisadas 5 replicatas dos padrões estudados em acetonitrila com concentrações de 0,5 mg L-1, 2,6 mg L-1 e 4,0 mg L-1, repetindo o procedimento por 3 dias consecutivos.
Para avaliar a exatidão de um método, os processos mais utilizados são: comparação de métodos, materiais de referência, ensaios de recuperação e adição de padrão [89]. A recuperação representa o método mais utilizado para a validação, através dela, obtém-se a quantidade de determinado analito, recuperado no processo, em relação a quantidade real presente na amostra.
A recuperação foi feita utilizando uma amostra de água fortificada (matriz branca com adição do analito multiresíduo com concentração de 0,15 mg L-1). Após a realização do método de adsorção e dessorção com os mNTC, foi feita a analise através do GC/MS, com o resultado, é calculada a recuperação de acordo com a formula 3.1.
Recuperação (%) = (C1 / C2) x 100 (3.1)
Onde:
C2 = concentração do analito adicionada na amostra fortificada;
C1 = concentração do analito recuperada após o método de adsorção/dessorção com mNTC.
3.5 Nanotubos de carbono
37 Figura 27 – Representação esquemática do nanotubo de carbono dopado com nitrogênio.
3.5.1 Purificação e magnetismo
38 Figura 28 – Dispositivo para purificação dos nanotubos de carbono.
As propriedades magnéticas dos mNTC também são muito importantes, e foram verificadas pesando 2,0 mg do material em um frasco com 4,00 mL de água ultra pura e agitando no vortex por 1 minuto. Em seguida, o frasco é deixado sobre um imã por 5 minutos, onde ao final pode-se observar a separação de fases conforme mostrado na Figura 28.
3.5.2 Extração dos agrotóxicos
Para otimizar o método de extração dos agrotóxicos com os mNTC foram realizados os experimentos que se seguem.
3.5.2.1 Adsorção dos agrotóxicos