CATALISADORES BIFUNCIONAIS À BASE DE
SILICOALUMINOFOSFATO E FOSFATOS DE NIÓBIO PARA
EMPREGO EM REAÇÕES DE HIDROISOMERIZAÇÃO E
HIDROCRAQUEAMENTO DO N-HEXADECANO
Íria Almeida Leal Bassan
_________________________________________________________
Tese de Doutorado
ÍRIA ALMEIDA LEAL BASSAN
CATALISADORES BIFUNCIONAIS À BASE DE
SILICOALUMINOFOSFATO E FOSFATOS DE NIÓBIO PARA
EMPREGO EM REAÇÕES DE HIDROISOMERIZAÇÃO E
HIDROCRAQUEAMENTO DO N-HEXADECANO
Defesa de Tese apresentada ao Programa de Pós-Graduação em Química da Universidade Federal do Rio Grande do Norte, como parte dos requisitos necessários para obtenção do título de Doutor em Química.
Orientadores: Profª. Dra. Sibele Berenice Castellã Pergher Dr. Antonio Chica Lara
Divisão de Serviços Técnicos Catalogação da Publicação na Fonte. UFRN Biblioteca Setorial do Instituto de Química
Bassan, Íria Almeida Leal.
Catalisadores bifuncionais à base de silicoaluminofosfato e fosfatos de nióbio para emprego em reações de hidroisomerização e hidrocraqueamento do n-hexadecano / Íria Almeida Leal Bassan. – Natal, RN, 2016.
157 f. : il.
Orientadora: Sibele Berenice Castellã Pergher. Co-orientador: Antonio Chica Lara
Tese (Doutorado em Química) - Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação em Química.
– – –
Agradeço aos meus pais, Lurdinha e Albano, por todo carinho, educação, conselhos e valores morais que foram transmitidos ao longo da minha existência. Dedico a vocês a conclusão de mais esta etapa da minha vida, por todo apoio dispendido que foi fundamental para essa conquista. Agradeço aos meus irmãos, Vinícius e Gustavo, pelo carinho, companheirismo e por estarem sempre na torcida.
Agradeço às minhas filhas, Júlia e Manoela, pela compreensão nos momentos de ausência ou de recusa para fazer uma brincadeira ou passeio, porque a mamãe tinha que estudar. Filhas, não me canso de dizer: vocês já me concederam o maior título da vida.
Agradecimentos
À minha orientadora, Profª Drª Sibele Pergher, pelas discussões técnicas valorosas, pela ajuda e compreensão nos momentos difíceis, pela amizade, pelos momentos de descontração e ótimas risadas e, principalmente, pela confiança em que depositou em mim.
Ao meu co-orientador, Dr Antonio Chica, pela excelente receptividade na minha chegada ao ITQ-UPV, mas, principalmente, pelo enorme aprendizado que me proporcionou abrindo as portas dessa instituição de referência mundial e transmitindo valorosos conhecimentos.
Aos amigos Mariele de Mello, Lindiane Bieseki, Francine Bertella e Christian Witee pelo acolhimento durante os períodos em que passei em Valência - ES. Com o carinho e a companhia de vocês foi bem mais fácil superar a distância de casa.
Aos amigos do ITQ, Javier da Costa e Eva Lopes, por todos os ensinamentos e por terem sido incansáveis em me ajudar.
Ao programa de Pós-Graduação em Química da UFRN, que me proporcionou a oportunidade de realizar o Doutorado em Química.
À CAPES pela bolsa concedida durante parte do estudo.
Agradeço aos professores Katia Gusmão, Filipe Mattel e Tatiana Bicudo por aceitarem o convite para participação da banca de exame de Doutorado.
A todos os amigos que fiz durante o período em que passei pela UFRN, em especial para Aneliese Longuinho e para os amigos do LABPEMOL.
RESUMO
Os lubrificantes e cortes de destilados médios possuem, normalmente, grandes quantidades de n-parafinas que lhes confere valores de pontos de congelamento e de fluidez mais elevados. Nesse sentido, a remoção de n-parafinas de cadeias longas de
óleos lubrificantes e do diesel é essencial para se obter um produto com boas
propriedades de fluxo a frio. O desenvolvimento de novos catalisadores que apresentem estabilidade térmica e atividade catalítica frente à reação de hidroisomerização ainda é um desafio. Sendo assim, silicoaluminofosfatos (SAPO) foram sintetizados por diferentes rotas. Utilizou-se, também, tratamento pós-síntese para obtenção de estruturas híbridas e realizou-se sínteses com direcionadores de
estrutura mesoporosa (soft templates e hard templates). Sendo assim, os SAPOs
foram impregnados com solução H2PtCl6 pelo método de umidade incipiente. Em
seguida, as avaliações das atividades catalíticas em reações de hidroisomerização e hidrocraqueamento do hexadecano foram realizadas. Além dos SAPOs, fosfatos de nióbio (NbP) também foram impregnados com platina e avaliados na referida reação. Após a impregnação, os catalisadores foram caracterizados por difração de Raios X (DRX), adsorção de nitrogênio, espectroscopia no infravermelho com piridina adsorvida (IV-PY), microscopia eletrônica de varredura (MEV) e ressonância
magnética nuclear do 29Si (29Si-RMN). Os resultados de caracterização por DRX
mostraram que foi possível a obtenção de SAPOs mesoestruturados. No entanto, para
as sínteses com soft template houve colapso da estrutura após a remoção dos
direcionadores orgânicos. Mesmo assim, esses catalisadores apresentaram atividade catalítica. Foi possível a obtenção de materiais híbridos por meio das sínteses do
SAPO-11 realizadas com hard templates e também quando empregou-se tratamentos
pós-síntese em amostras de SAPO-11. Ademais, os NbP apresentaram DRX característicos de materiais amorfos, com alta acidez e foram ativos na conversão do n-hexadecano.
PALAVRAS-CHAVES:
ABSTRACT
Lubricants and cutting middle distillates typically have large amounts of n-paraffins to
increase its freezing point and fluidity.Accordingly, the removal of n-paraffins of long
chain lubricants oils and diesel is essential to get a product with good cold flow properties. The development of new catalysts, which exhibit thermal stability and
catalytic activity for the hydroisomerization reaction is still a challenge. Thus,
silicoaluminophosphates (SAPO) were synthesized by different routes. Have been used also post-synthesis treatment for obtaining hybrid structures and others synthesis have been carried out with mesoporous template (soft and hard-template). Therefore,
SAPO have been impregnated with H2PtCl6 solution by the incipient wetness method.
Then assessments of catalytic activities in hydroisomerization and hydrocracking reactions of hexadecane have been held. Besides SAPO, niobium phosphate - NbP - were also impregnated with platinum and evaluated in the same reaction. After impregnation, these catalysts have been characterized by X-ray diffraction (XRD), nitrogen adsorption, infrared spectroscopy with adsorbed pyridine (IV-PY), scanning
electron microscopy (SEM) and resonance nuclear magnetic 29Si (29Si-NMR). The
characterization results by XRD have shown that it has been possible to obtain mesoporous SAPOs. However, for the syntheses with soft template there was collapse of the structure after removal of the organic template. Even so, these catalysts have been actives. It was possible to obtain hybrid materials through the synthesis of SAPO-11 made with hard templates and by means of post-synthesis treatments samples of SAPO-11. Moreover, NbP has shown characteristic XRD of amorphous materials, with high acidity and were active in the conversion of hexadecane.
Keywords:
LISTA DE FIGURAS
Figura 1: Esquema da difusão de produtos e reagentes pelo poro da zeólita ZSM-5
(BELLUSSI, CARATI, CLERICI, 2001). ... 21
Figura 2: Esquema das vias bifuncionais de hidroisomerização e craqueamento de n-parafinas (adaptado de YADAV & SAKTHIVEL, 2014). ... 23
Figura 3: Etapas de troca iônica para a geração de acidez de Brønsted e desidratação para geração de acidez de Lewis: (a) troca do íon sódio pelo íon amônio; (b) decomposição do íon amônio com liberação da amonia e geração do sítio ácido de Brønsted; e (c) desidratação de sítio ácido de Brønsted para geração de sítio ácido de Lewis (MORENO & RAJAGOPAL, 2002) ... 27
Figura 4: Estruturas de: a. SAPO-5 e b. SAPO-11 (MASCARENHAS, 2001). ... 28
Figura 5: Esquema da geração de sítio ácido de Brønsted (MASCARENHAS, 2001). ... 29
Figura 6: Esquema da fotociclização catalítica do azobenzeno (MASCARENHAS, 2001). ... 30
Figura 7: Mecanismos de inserção de silício na rede ALPO (YADAV, SAKYHIVEL, 2014). ... 31
Figura 8: Distrubuição de Si, Al e P em uma rede SAPO. A) Si isolado; b) ilha com 5Si; c) ilha com 11 Si; d) fase Si-Al com 1Al na ilha de silício (PASTORE, H.O.; COLUCCIA, S.; MARCHESE, L., 2005). ... 33
Figura 9: DRX (A) Amostras sintetizadas com (a) sílica fumegante (b) TEOS; (B) DRX das amostras (a) com sílica fumegante, extraída com ácido, (b) com TEOS, extraída com ácido; (c) com TEOS, extraída com base, (d) com TEOS, extraída com base e calcinada (Adaptado de OLIVEIRA & PASTORE, 2002). ... 35
Figura 10: Fluxograma de síntese do SAPO-11 – IB 01 ... 46
Figura 11: Fluxograma de síntese do SAPO-11 – IB 02 ... 48
Figura 12: Esquema de apresentação das sínteses dos SAPOs mesoporosos. ... 49
Figura 13: Fluxograma de síntese da amostra IB 07. ... 53
Figura 14: Fluxograma de síntese das amostras IB 08. ... 54
Figura 16: Fluxograma do procedimento sintético da síntese dos fosfatos de nióbio
mesoporosos a partir de NbCl5 e H3PO4. ... 60
Figura 17: Adsorção de piridina nos sítios de Brønsted.... 63
Figura 18: Adsorção de piridina nos sítios de Lewis. ... 63
Figura 19: Fotografia do microscópio eletrônico de varredura utilizado neste trabalho. ... 65
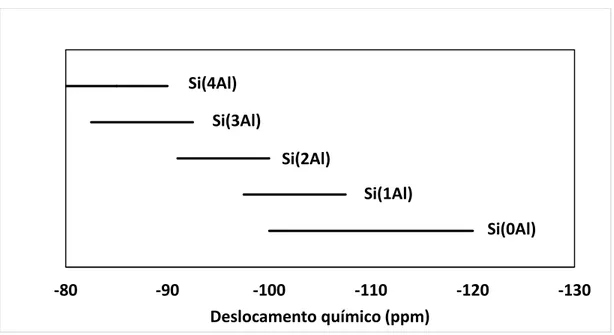
Figura 20: Intervalos de deslocamento químico de 29Si para distintos ambientes
químicos (MENEZES,1995). ... 67
Figura 21: Sistema de reação utilizado na hidroisomerização do hexadecano. ... 68
Figura 22: Fotos do reator utilizado nos estudos de hidroisomerização do hexadecano. ... 69
Figura 23: (a) DRX do ALPO-11 (IZA – database), (b) DRX das amostras de IB 01
(SAPO-11); (c) DRX da amostra IB 02 (SAPO-11). ... 73
Figura 24: (a) DRX das amostras de SAPO 11 calcinado; (b) DRX da amostra de SAPO-11 que sofreu tratamento com ácido clorídrico a 0,1 mol/L; e, (c) DRX da
amostra de SAPO 11 tratada com ácido clorídrico a 1 mol/L. ... 74
Figura 25: (a) DRX das amostras de SAPO 11 (IB 02); (b) DRX da amostra de
SAPO-11 tratada com DEA. ... 75
Figura 26: Isoterma de adsorção de N2 das amostras IB 02 e IB 02-DEA. ... 77
Figura 27: Espetros no infravermelho com piridina adsorvida da amostra IB 02. ... 78
Figura 28: Espectros no infravermelho com piridina adsorvida da amostra IB 02-DEA. ... 79
Figura 29: Espectro de 29Si RMN da amostra IB 02. ... 81
Figura 30: Deconvolução do espectro de 29Si-RMN apresentado por BLASCO et al,
2006. A simulação indica os picos referentes aos ambientes químicos dos silícios presentes na rede. São eles: 1- Si(4Al), 2- Si(3Al,1Si), 3- Si(2Al, 2Si), 4- Si(1Al, 3Si),
5- Si(4Al). ... 82
Figura 31: Conversão total do hexadecano para as amostras IB 01, IB 01-HCl, IB 02
e IB 02-DEA. ... 85
Figura 32: Seletividade para isomerização nas amostras IB 01, IB 01-HCl, IB 02 e IB
Figura 33: Seletividade a craqueamento do hexadecano para as amostras IB 01, IB
01-HCl, IB 02 e IB 02-DEA. ... 87
Figura 34: Conversões do hexadecano com IB 01 a 300 ºC. ... 87
Figura 35: Conversões do hexadecano com IB 01 a 350ºC... 88
Figura 36: Conversões do hexadecano como IB 01 a 400ºC. ... 89
Figura 37: Conversões do hexadecano como IB 01 a 450ºC. ... 89
Figura 38: Conversões do hexadecano como IB 01-HCl a 300ºC. ... 90
Figura 39: Conversões do hexadecano como IB 01-HCl a 350ºC. ... 91
Figura 40: Conversões do hexadecano como IB 01-HCl a 400ºC. ... 92
Figura 41: Conversões do hexadecano como IB 01-HCl a 450ºC. ... 92
Figura 42: Conversões do hexadecano com o IB 02 a 300ºC. ... 93
Figura 43: Conversões do hexadecano como IB 02 a 350ºC. ... 94
Figura 44: Conversões do hexadecano como IB 02 a 400ºC. ... 94
Figura 45: Conversões do hexadecano como IB 02 a 450ºC. ... 95
Figura 46: Conversões do hexadecano como IB 02 a 500ºC. ... 95
Figura 47: Conversões do hexadecano como IB 02-DEA a 300ºC. ... 97
Figura 48: Conversões do hexadecano como IB 02-DEA a 350ºC. ... 97
Figura 49: Conversões do hexadecano como IB 02-DEA a 400ºC. ... 98
Figura 50: Conversões do hexadecano como IB 02-DEA a 450ºC. ... 99
Figura 51: Conversões do hexadecano como IB 02-DEA a 500ºC. ... 100
Figura 52: DRX das amostras de SAPO sintetizadas com o CTMABr como agente direcionador. ... 103
Figura 53: DRX das amostra de SAPO IB 07A e IB 07B sem calcinar. ... 104
Figura 54: DRX das amostras IB 07 A, tempo de envelhecimento 0h, e IB 08, envelhecido por 24h. ... 105
Figura 55: DRX das amostras IB 08 (a) e IB 08 calcinada (b). ... 106
Figura 57: DRX da amostra IB 08 calcinada e da amostra IB 08 depois de passar por
extração em soxhlet, impregnação e calcinação. ... 108
Figura 58: Conversão do hexadecano empregando catalisadores SAPO mesoporosos. ... 110
Figura 59: Seletividade a isômeros do hexadecano para amostras de SAPO mesoporosas. ... 112
Figura 60: Seletividade a craqueamento do hexadecano para as amostras de SAPO mesoporosas. ... 112
Figura 61: Conversões do hexadecano com IB 07A a 300ºC. ... 113
Figura 62: Conversões do hexadecano com IB 07A a 350ºC. ... 114
Figura 63: Conversões do hexadecano com IB 07A a 400ºC. ... 114
Figura 64: Conversões do hexadecano com IB 07B a 300ºC. ... 115
Figura 65: Conversões do hexadecano com IB 07B a 350ºC. ... 116
Figura 66: Conversões do hexadecano com IB 07B a 400ºC. ... 116
Figura 67: Conversões do hexadecano com IB 07B a 450ºC. ... 117
Figura 68: Conversões do hexadecano com IB 07B a 500ºC. ... 118
Figura 69: Conversões do hexadecano com IB 08 Ext a 300ºC. ... 119
Figura 70: Conversões do hexadecano com IB 08 Ext a 350ºC. ... 119
Figura 71: Conversões do hexadecano com IB 08 Ext a 400ºC. ... 120
Figura 72: Conversões do hexadecano com IB 08 Ext a 450ºC. ... 120
Figura 73: Conversões do hexadecano com IB 08 Ext a 500ºC. ... 121
Figura 74: DRX das amostra IB 02 (SAPO-11), SAPO-11-BP e da SAPO-11-BPC (calcinada). ... 124
Figura 75: Isoterma de adsorção/dessorção de N2 da amostra SAPO-11-BPC. ... 126
Figura 76: Imagens de microscopia eletrônica de varredura (MEV) da amostra SAPO-11 BPC. ... 128
Figura 78: Deconvolução do espectro de 29Si-RMN apresentado por BLASCO et al,
2006. A simulação indica os picos referentes aos ambientes químicos dos silícios presentes na rede. São eles: 1- Si(4Al), 2- Si(3Al,1Si), 3- Si(2Al, 2Si), 4- Si(1Al, 3Si),
5- Si(4Si). ... 130
Figura 79: DRX das amostras SAPO-11 preparada com poliestireno antes de calcinar (SAPO-11 PS), calcinada (SAPO-11 PSC) e de SAPO-11 preparada de forma
convencional (IB 02). ... 131
Figura 80: Isoterma de adsorção/dessorção de N2 da amostra SAPO-11 PSC. ... 132
Figura 81: Imagens de microscopia eletrônica de varredura (MEV) da amostra
SAPO-11 PSC. ... 134
Figura 82: 29Si-RMN da amostra de SAPO-11-PSC. ... 135
Figura 83: Deconvolução do espectro de 29Si-RMN apresentado por BLASCO et al,
2006. A simulação indica os picos referentes aos ambientes químicos dos silícios presentes na rede. São eles: 1- Si(4Al), 2- Si(3Al,1Si), 3- Si(2Al, 2Si), 4- Si(1Al, 3Si),
5- Si(4Al). ... 136
Figura 84: Conversão total do hexadecano empregando os catalisadores SAPO-11
BPC, SAPO-11 PSC e IB 02. ... 137
Figura 85: Seletividade a isômeros do hexadecano para os catalisadores SAPO-11
BPC, SAPO-11 PSC e IB 02. ... 138
Figura 86: Seletividade a craqueamento do hexadecano para os catalisadores
SAPO-11 BPC, SAPO-SAPO-11 PSC e IB 02. ... 139
Figura 87: Rendimento dos hidrocarbonetos obtidos com o catalisador SAPO-11 BPC
nas temperaturas estudadas. ... 140
Figura 88: Rendimento dos hidrocarbonetos obtidos com o catalisador SAPO-11 PSC
nas temperaturas estudadas. ... 141
Figura 89: DRX das amostras (a) NbP – 1; (b) NbP – 2; (c) NbP – 3 e (d) NbP – C.
... 142
Figura 90: Conversão total do hexadecano empregando catalisadores NbP-1 e
Pt-NbP-3 mesoporosos. ... 145
Figura 91: Seletividade total a isomerização do hexadecano empregando
catalisadores Pt-NbP mesoporosos. ... 146
Figura 92: Seletividade para craqueamento do hexadecano empregando
Figura 93: Distribuição das porcentagens de hidrocarbonetos obtidos com Pt-NbP-1 a
300 ºC, 350 ºC, 400 ºC e 450 ºC. ... 147
Figura 94: Distribuição das porcentagens de hidrocarbonetos obtidos com Pt-NbP-3 a
LISTA DE TABELAS
Tabela 1: Propriedades texturais, composição e força ácida dos fosfatos de nióbio
(OKAZAKI & WADA, 1993) ... 40
Tabela 2: Tipos de catalisadores sintetizados. ... 45
Tabela 3: Condições do tratamento ácido em amostras de SAPO-11. ... 49
Tabela 4: Parâmetros de síntese para os SAPOs mesoporosos sintetizados com soft template. ... 50
Tabela 5: Metodologias de calcinações sob fluxo. ... 56
Tabela 6: Metodologia de calcinação estática. ... 56
Tabela 7: Catalisadores sintetizados com NbCl5 e H3PO4. ... 61
Tabela 8: Condições de medida do espectro de RMN de 29Si. ... 67
Tabela 9: Dados de área específica e volume de poros obtidos por adsorção de nitrogênio. ... 76
Tabela 10: Concentração de sítios ácidos de Lewis e Brønsted das amostras IB 02 e IB 02-DEA. ... 80
Tabela 11: Códigos dos produtos de craqueamento e isomerização do hexadecano. ... 83
Tabela 12: Dados de conversão e rendimento para isomerização do hexadecano com a amostra IB 01. ... 90
Tabela 13: Dados de conversão e rendimento para isomerização do hexadecano com IB 01-HCl. ... 93
Tabela 14: Dados de conversão e rendimento para isomerização do hexadecano com IB 02. ... 96
Tabela 15: Dados de conversão e rendimento para isomerização do hexadecano com IB 02-DEA. ... 100
Tabela 16: Teores encontrados na análise elementar da amostra IB 08 Ext. ... 107
Tabela 17: Dados de concentração dos sítios ácidos em amostras de SAPO. ... 109
Tabela 19: Dados de conversão e seletividade para isomerização do hexadecano com
SAPO meso IB 07A. ... 115
Tabela 20: Dados de conversão e seletividade para isomerização do hexadecano com
IB 07B. ... 118
Tabela 21: Dados de conversão e rendimento para isomerização do hexadecano com
IB 08 Ext/Imp/Calc. ... 121
Tabela 22: Dados de conversão e rendimento para isomerização do hexadecano com
SAPO meso IB 08. ... 122
Tabela 23: Dados de área específica e volume de poros obtidos por adsorção de
nitrogênio. ... 125
Tabela 24: Números de sítios ácidos obtidos por IV-PY para as amostras de
SAPO-11 preparada com carvão (SAPO-SAPO-11-BPC) e SAPO-SAPO-11 convencional (IB 02). ... 126
Tabela 25: Dados de área específica e volume de poros obtidos por adsorção de
nitrogênio. ... 132
Tabela 26: Números de sítios ácidos obtidos por IV-PY para as amostras de
SAPO-11 preparada com poliestireno (SAPO-SAPO-11-PSC) e SAPO-SAPO-11 convencional (IB 02). 133
Tabela 27: Propriedades texturais dos catalisadores NbP estudados antes e após a
impregnação com Pt. ... 143
Tabela 28: Resultados de acidez das amostras de NbP obtidos por IV-PY. ... 144
Tabela 29: Porcentagem dos produtos obtidos na conversão do hexadecano
empregando-se o catalisados Pt-NbP-1. ... 148
Tabela 30: Porcentagem dos produtos obtidos na conversão do hexadecano
SUMÁRIO
1 INTRODUÇÃO ... 18
2 REVISÃO DA LITERATURA ... 20
2.1 Hidroisomerização ... 20
2.2 Zeólitas como catalisadores ... 24
2.2.1 Composição e estrutura ... 25
2.3 Fosfatos de Silício e Alumínio ... 28
2.3.1 Incorporação de silício a uma rede ALPO ... 30
2.3.2 SAPOs mesoporosos ... 33
2.4 Fosfatos de Nióbio ... 37
2.4.1 Histórico sobre o Nióbio ... 37
2.4.2 Fosfatos de nióbio como catalisadores ... 39
3 MATERIAIS E MÉTODOS ... 44
3.1 Materiais de síntese dos silicoaluminofosfatos (SAPO)... 44
3.2 Síntese dos catalisadores SAPOs... 45
3.2.1 Síntese do SAPO -11 ... 45
3.2.1.1 Síntese do SAPO-11 – amostra IB 01 - adaptado de DINIZ (2000) ... 45
3.2.1.2 Síntese do SAPO-11 – IB 02 - BLASCO (2006) ... 47
3.2.2 Síntese dos SAPOs mesoporosos ... 48
3.2.2.1 Tratamento pós-síntese para abertura de mesoporos ... 49
3.2.2.1.1 Metodologia de tratamento pós-síntese ácido ... 49
3.2.2.1.2 Metodologia de tratamento pós-síntese básico ... 49
3.2.2.2 Sínteses dos SAPOs mesoporoso com CTMABr (soft template) ... 50
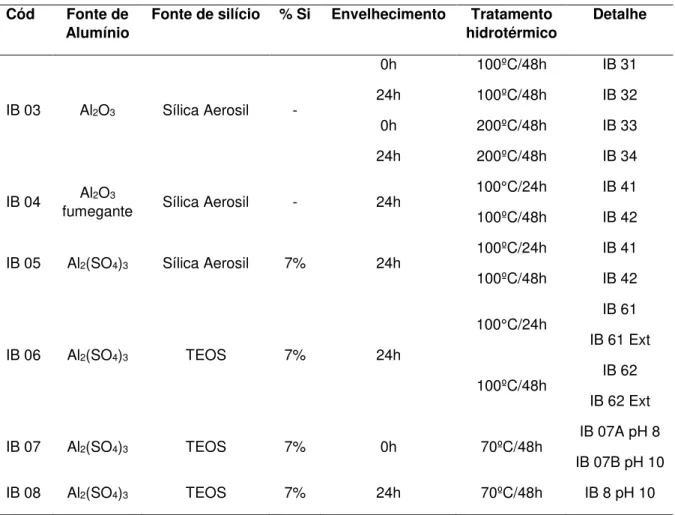
3.2.2.2.1 Metodologia de síntese do IB 03 ... 50
3.2.2.2.2 Metodologia de síntese do IB 04 ... 51
3.2.2.2.3 Metodologia de síntese do IB 05 ... 51
3.2.2.2.4 Metodologia de síntese do IB 06 ... 52
3.2.2.2.5 Metodologia de síntese do IB 07. ... 52
3.2.2.2.6 Metodologia de síntese do IB 08 ... 53
3.2.2.3 Sínteses dos SAPOs mesoporosos com hard template ... 54
3.2.2.3.1 Síntese do SAPO mesoporoso com carvão ... 54
3.2.2.3.1 Síntese do SAPO mesoporoso com poliestireno ... 55
3.3.1 Extração em soxhlet ... 55
3.3.2 Calcinação... 55
3.4 Fosfato de nióbio - Nbp ... 57
3.4.1 Materiais de síntese do NbP ... 57
3.4.2 Sínteses dos catalisadores NbP ... 58
3.5 Incorporação de platina ... 61
3.6 Caracterização dos catalisadores ... 61
3.6.1 Adsorção e dessorção de nitrogênio ... 62
3.6.2 Difração de Raios X (DRX) ... 62
3.6.3 Espectroscopia no infravermelho com piridina adsorvida (IV-PIRIDINA) ... 62
3.6.4 Microscopia Eletrônica de Varredura (MEV) ... 64
3.6.5 Ressonância Magnética Nuclear de Sólidos ... 65
3.7 Sistema de reação Catalítica ... 68
3.8 Análises dos produtos de reação ... 70
4 RESULTADOS E DISCUSSÃO ... 72
4.1 Materiais silicoaluminofosfatos - SAPO ... 72
4.1.1 SAPO-11 ... 72
4.1.1.1 Caracterização dos catalisadores ... 73
4.1.1.2 Avaliação Catalítica ... 82
4.1.1.3 Conclusão Parcial ... 100
4.1.2 SAPO mesoporoso (sintetizado com soft template) ... 102
4.1.2.3 Avaliação Catalítica para amostras de SAPO mesoporosos. ... 110
4.1.2.4 Conclusão Parcial ... 122
4.1.3 SAPO hierárquico (hard template) ... 123
4.1.3.1 SAPO-11 com carvão ... 123
4.1.3.2 SAPO-11 com poliestireno ... 130
4.1.3.3 Avaliação Catalítica para amostras de SAPO com hard templates. ... 136
4.1.3.4 Conclusão Parcial ... 141
4.2 Fosfatos de nióbio – NbP ... 142
4.2.1 Caracterizações das amostras de NbP mesoporosos... 142
4.2.2 Avaliação Catalítica para amostras de Pt - NbP mesoporosos. ... 144
4.2.3 Conclusão Parcial ... 149
6 SUGESTÕES PARA TRABALHOS FUTUROS ... 152
1 INTRODUÇÃO
Há algumas décadas iniciou-se uma ampliação da utilização de ácidos na indústria. Muitos dos processos industriais, tais como craqueamento, desidratação, isomerização, alquilação e desproporcionamento envolvem a utilização de ácidos como catalisadores. As reações catalisadas por ácidos, sejam sólidos ou líquidos, estão, sem dúvida, entre as mais importantes e as mais estudadas da química.
Pela facilidade operacional, maior estabilidade térmica, menor dificuldade de separação dos produtos dos catalisadores e maior seletividade, tem sido crescente a tendência em tornar processos industriais homogêneos em heterogêneos. Além das vantagens já citadas, os ácidos sólidos podem ser reutilizados, reciclados e geram produtos mais puros. Em contrapartida, nas reações catalisadas em meio líquido, os ácidos se tornam um passivo ambiental de maior custo de tratamento, sendo que o seu manuseio é mais complicado e perigoso, além de causar corrosão em equipamentos (MASCARENHAS, 2001).
Por outro lado, a hidroisomerização é uma rota que tem crescido de importância nos últimos anos, motivada pela demanda por combustíveis de maior qualidade. Essa reação pode ser definida como a conversão catalítica, em presença de hidrogênio, de parafinas lineares em parafinas ramificadas.
Os catalisadores normalmente utilizados nos processos de hidroisomerização contêm uma fase desidrogenante (sendo mais comum o uso de Pt, Pd, Ni ou combinações destes elementos) sobre um suporte com propriedades ácidas, que podem ser zeólitas, sílico-aluminas ou aluminas modificadas com halogenetos (sendo mais comum o cloreto). Embora haja semelhanças na composição dos catalisadores, estes devem ser otimizados, enfocando a aplicação e, considerando-se, dentre outros fatores, reações secundárias de hidrocraqueamento, que podem ocorrer e que formarão produtos leves indesejados.
Pode-se considerar como processos de hidroisomerização, consolidados na prática industrial, as rotas de produção de isobutano, a partir do n-butano, para posterior manufatura de gasolina, pelo processo de alquilação e a produção de gasolina de alta octanagem, a partir da hidroisomerização de parafinas C5 a C6 (pentano, hexano).
produção de óleos lubrificantes de alto índice de viscosidade, a partir de parafinas de alta massa molecular.
Com a utilização de peneiras moleculares do tipo SAPO, ou zeólitas do tipo H-ZSM-22, foi possível obter um elevado rendimento em parafinas ramificadas, maiores do que n-C6, o que levou ao aparecimento de novos processos industriais,
como o “Isodewaxing” da Chevron (MILLER, 1994; MILLER et al, 1995).
Apesar da demanda por novos processos de produção de gasolina e lubrificantes ter motivado um crescente aumento no estudo dos catalisadores de hidroisomerização, existe ainda forte controvérsia na literatura sobre vários aspectos fundamentais dessas reações, tais como o mecanismo de reação e o efeito da estrutura e da acidez da zeólita sobre a atividade e a seletividade. Em relação ao papel da acidez, por exemplo, ZHANG E SMIRNIOTIS (1999) propõem que o aumento da força ácida das zeólitas acarreta o aumento da seletividade e o grau de ramificação dos isômeros; enquanto outros autores (CORMA et al,1997) sugerem que um aumento da força ácida favorece o aumento das reações de craqueamento, reduzindo a seletividade.
A investigação sobre a força ácida é de fundamental importância no desenvolvimento de novos catalisadores de hidroisomerização. O papel da acidez, bem como de vários aspectos fundamentais das reações de hidroisomerização de parafinas maiores do que n-hexano - o mecanismo de reação, e o efeito da estrutura do suporte e acessibilidade dos poros - devem ser considerados.
Nesse sentido, esse trabalho se propõe a estudar a reação de hidroisomerização e hidrocraqueamento do n-hexadecano, empregando diferentes catalisadores fosfáticos impregnados com platina. São eles:
- SAPO-11;
- SAPO mesoporoso, sendo a mesoporosidade gerada durante a síntese, com
“soft template” e “hard template”, ou pós-síntese, com tratamentos ácidos e básicos; - fosfatos de nióbio mesoporosos sintetizados com diferentes direcionadores
de mesoporos (Plurônic 123, dodecil sulfato de sódio – SDS – e brometo de
2 REVISÃO DA LITERATURA
A seguir, será apresentada uma revisão bibliográfica sobre as principais metodologias empregadas para a desparafinação do óleo diesel e de óleos lubrificantes, bem como sobre as sínteses e caracterizações dos catalisadores estudados neste trabalho: SAPO-11, SAPO mesoporosos e Fosfatos de Nióbio.
2.1 HIDROISOMERIZAÇÃO
Legislações ambientais e especificações de qualidade mais restritivas têm impulsionado o desenvolvimento de tecnologias visando melhorias nas propriedades do diesel e óleos lubrificantes.
Os lubrificantes e cortes de destilados médios possuem, normalmente, grandes quantidades de n-parafinas que lhes conferem valores de pontos de congelamento e de fluidez mais elevados. Neste sentido, a remoção de n-parafinas de cadeias longas
de óleos lubrificantes e do diesel é essencial para se obter um produto com boas
propriedades de fluxo a frio (BLASCO, 2006).
A desparafinação pode ser efetuada das seguintes formas:
extração por solvente;
craqueamento seletivo;
hidrocraqueamento seletivo;
isomerização de n-parafinas a parafinas ramificadas.
A desparafinação feita com extração por solvente proporciona ao produto final as características a seguir: diminuição da quantidade de parafina, aumento do teor de aromáticos, diminuição do ponto de fluidez e índice de viscosidade, aumento da concentração de nitrogênio e enxofre. Este processo apresenta altos custos de investimento e operacionais (SEQUEIRA, 1994).
Segundo TAYLOR (1994), o processo de desparafinação catalítica (CDW – do
lineares ou pouco ramificadas (FIGURA 1). Os compostos impedidos de acessar os poros são as parafinas altamente ramificadas, compostos cicloalifáticos e aromáticos de maior tamanho. As n-parafinas são removidas com eficiência neste processo, no entanto, quanto maior suas concentrações, menor será o rendimento do produto desparafinado, o que pode inviabilizar o processo economicamente (TAYLOR & PETTY, 1994; BLASCO et al, 2006).
Figura 1: Esquema da difusão de produtos e reagentes pelo poro da zeólita ZSM-5 (BELLUSSI, CARATI, CLERICI, 2001).
Sendo assim, a isomerização é o método preferível. Este processo exerce um papel muito importante na indústria do petróleo (HUANG, 2004). Este tipo de reação, normalmente, acontece na presença de hidrogênio e, nesse caso, é referenciado como hidroisomerização (GENG et al, 2004). A hidroisomerização em cadeias carbônicas na faixa entre C4-C6 são realizadas para aumentar a octanagem da
gasolina (MÉRIAUDEAU et al, 1997). Isomerização de hidrocarbonetos entre C7-C15
são aplicadas para aumentar o número de cetano e melhorar as propriedades de fluxo a frio, como viscosidade, ponto de fluidez e ponto de congelamento (BLASCO, 2006). Além disso, essas reações em hidrocarbonetos acima de C15 são realizadas para melhorar as propriedades de fluxo e viscosidade de óleos lubrificantes (BLASCO, 2006). O processo de desparafinação por hidroisomerização pode ser empregado na produção de óleos lubrificantes básicos de alta qualidade, transformando ceras e n-parafinas em isômeros ramificados que têm alto índice de viscosidade e baixo ponto de congelamento. Este processo pode utilizar matéria prima inferior com alto rendimento do óleo. Além disso, apresenta vantagens como flexibilidade operacional e alto valor dos subprodutos (LING, WANG, SHEN, 2009).
consecutiva, a qual é favorecida por alcanos multirramificados. Sendo assim, faz-se necessário limitar as multirramificações.
A hidroisomerização e hidrocraqueamento de parafinas de cadeias longas,
n-C16 e n-C28 como compostos modelos, sob catalisadores bifuncionais, foram
estudados em detalhes nas duas últimas décadas (LING, WANG, SHEN, 2009). A reação de ramificação ocorre nos sítios ácidos do catalisador, que estão localizados próximos a entrada dos poros. Isso indica que a localização e distribuição dos sítios ácidos devem ser de primordial importância para o efeito de hidroisomerização (LING, WANG, SHEN, 2009). Essa função ácida é oferecida, normalmente, pelo suporte, tais como:
- óxidos amorfos ou misturas de óxidos (exemplos: Al2O3 tratada com HF, SiO2
-Al2O3, ZrO2/SO42-);
- Zeólitas (Y, Beta, Mordenita, ZSM-5, ZSM-22);
- Silicoaluminofosfatos (SAPO-11, SAPO-31, SAPO-41);
- materiais mesoporosos (MCM-41, Al-MCM-41).
DELDARE (2005) afirma que na reação de hidroisomerização a função hidrogenante/desidrogenante ocorre em sítios metálicos. Os mais comumente usados são o Pd, Pt ou sulfetos bimetálicos (ex: Ni/Co, Ni/W, Ni/Mo).
De acordo com DELDARI (2005), no mecanismo clássico para isomerização a desidrogenação ocorre nos sítios metálicos e produz olefinas que são protonadas pelos sítios ácidos de Brønsted, correspondendo aos íons alquilcarbênio. Este íon
carbênio sofre um rearranjo e uma β-cisão seguida por desprotonação e hidrogenação sobre os sítios metálicos, gerando uma isoparafina. Os passos deste mecanismo são os seguintes:
(i) desidrogenação pelo metal;
(ii) protonação das olefinas nos sítios ácidos de Brønsted com a formação
de um alquilcarbênio secundário;
(iii) rearranjo do íon alquilcarbênio via formação do alquilcarbênio cíclico no
estado de transição;
(iv) desprotonação; e
A Figura 2 apresenta o mecanismo bifuncional de hidroisomerização e craqueamento das n-parafinas.
Figura 2: Esquema das vias bifuncionais de hidroisomerização e craqueamento de n-parafinas (adaptado de YADAV & SAKTHIVEL, 2014).
A: Hidrogenação-desidrogenação sobre sítios metálicos B: Protonação-desprotonação sobre sítios ácidos
C: Adição de próton para formação de íon carbênio sobre sítio ácido D: Desidrogenação para formar o íon alquilcarbênio
E: Adsorção/dessorção competitiva do alqueno e íon carbênio sobre sítios ácidos
F: Rearranjo do íon alquilcarbênio G: Craqueamento do íon alquilcarbênio
Esse mecanismo clássico para hidroisomerização/hidrocraqueamento de
parafinas CnH2n+2 prediz a formação de produtos na faixa de n até n-3 átomos de
denominado “dimerization cracking (DC)”. BLOSMA e colaboradores (1996), estudando a conversão de n-heptano sobre Pd/H-Beta, verificaram que este mecanismo é favorecido para baixos teores de fase metálica, baixa atividade da função metálica ou elevada acidez da zeólita.
O catalisador ideal para seletividade a hidroisomerização deve ter tanto seletividade para isomerização, os quais vêm do equilíbrio entre acidez e atividade de hidrogenação, quanto seletividade para reagir só com n-parafinas, que é proveniente do tamanho da abertura dos poros da peneira molecular. Entretanto, ao lado do metal usado na síntese do catalisador bifuncional, o tipo de suporte e suas características, tais como tamanho de poro, acidez, área e distribuição da força ácida têm um importante papel no desempenho dos catalisadores bifuncionais.
2.2 ZEÓLITAS COMO CATALISADORES
A primeira zeólita, a estilbita, foi descoberta pelo Barão Axel Crönsted, um mineralogista sueco, em 1756. Ele nomeou esses minerais como zeólitas, das
palavras gregas, zeo (ferver) e lithos (pedra), porque eles liberavam vapor d’água
quando suavemente aquecidos. As zeólitas são formadas por alteração hidrotérmica da lava depositada, isto é, sob a ação da água em altas temperaturas. As alterações geológicas que originam as zeólitas são reações muito lentas, ocorrendo ao longo de milhares de anos, porque a cristalização desses materiais é controlada pela dissolução das rochas matrizes em soluções salinas ou alcalinas, em altas
temperaturas (MASCARENHAS et al, 2001).
Os minerais porosos formam-se nessas condições: altas temperaturas e pressões. Entretanto, é preciso estabilizar os canais e cavidades desses minerais, pois, de outra forma, a pressão acabaria por destruir a rede porosa em formação. Essa estabilização também é efetuada pela água, que se incorpora aos sólidos e preenche os canais. (BARRER, 1982).
e têm, em sua composição, átomos de silício e alumínio, ligados por átomos de oxigênio, arranjados em uma estrutura cristalina. As zeólitas apresentam poros com aberturas de até 20 Å e, por isso, são consideradas microporosas.
As primeiras sínteses em laboratório tentavam imitar as condições naturais, sendo realizadas em altas temperaturas e pressões, por longos períodos de tempo (meses). Em pouco tempo, essas condições drásticas foram substituídas por materiais de partida mais reativos, que produziam os materiais de interesse em pouco tempo, e
em condições mais brandas (MASCARENHAS et al, 2001).
A partir do século XIX ampliou-se sobremaneira a utilização dos ácidos na indústria, como na catálise de reações químicas, com participação em diversos processos essenciais, tais como craqueamento, desidratação, isomerização, alquilação e desproporcionamento. As reações catalisadas por ácidos, sejam sólidos ou líquidos, estão indubitavelmente dentre as mais importantes e as mais estudadas da química (MORENO & RAJAGOPAL, 2002).
2.2.1 Composição e estrutura
As zeólitas são aluminossilicatos cuja fórmula estrutural é:
Mx/m(m+) [AlxSi2-xO4]nH2O
sendo M o cátion de compensação de carga, pois a estrutura é aniônica, e a
quantidade de alumínio pode variar entre os limites 0 ≤ x ≤ 1.
As zeólitas são cristais inorgânicos formados por unidades básicas estruturais
chamadas PBU (“primary buiding units”), que são tetraedros de TO4 (T= Si, Al). Estes
tetraedros se unem entre si, compartilhando vértices e seguindo as seguintes regras:
a) dois tetraedros diferentes se unem entre si compartilhando só um oxigênio;
b) não há ligações do tipo Al – O – Al. Ou seja, tetraedros do tipo AlO4 só estarão
unidos com outros tetraedros do tipo SiO4.
indústria de refino de petróleo. O grupo doador de prótons é usualmente representado
de forma simplificada como um H+ ligado a um átomo de oxigênio (-OH), em
superfícies de óxidos, e é chamado de sítio ácido de Brønsted ou BAS (Brønsted acid
site). Nestes materiais, os grupos básicos são os íons oxigenados (O-) resultantes da
dissociação do próton ou gerados por desidratação de duas hidroxilas terminais
(X-OH + X-(X-OH X-O- + H2O). A acidez de Lewis comumente está associada aos
sistemas não próticos, resultantes da interação com metais, principalmente os metais
de transição através de seus orbitais d incompletos, capazes de receber elétrons.
Frequentemente, estes metais formam catalisadores, homogêneos ou heterogêneos, com a habilidade de processar com eficiência diversas reações químicas (MORENO & RAJAGOPAL, 2002).
Uma das principais dificuldades da utilização de sistemas ácidos heterogêneos é que no meio sólido, usualmente, é necessário um esforço adicional para incrementar
e estabilizar a acidez superficial. A superfície da sílica (SiO2), por exemplo,
praticamente não produz sítios ácidos de Lewis, pois forma com facilidade silanóis (Si-OH), que são considerados sítios ácidos de Brønsted, e estes cobrem a superfície interna e externa do sólido. No entanto, em termos de força, a acidez dos silanóis é normalmente fraca ou no máximo moderada (MORENO & RAJAGOPAL, 2002).
Figura 3: Etapas de troca iônica para a geração de acidez de Brønsted e desidratação para geração de acidez de Lewis: (a) troca do íon sódio pelo íon amônio; (b) decomposição do íon amônio com liberação da amonia e geração do sítio ácido de Brønsted; e (c) desidratação de sítio ácido de Brønsted para geração de sítio ácido de Lewis (MORENO & RAJAGOPAL, 2002)
A acidez destes materiais depende essencialmente da localização e do conteúdo de alumínio na estrutura do silicato, além do estado de coordenação do alumínio, sendo frequentemente desejável, no caso das zeólitas, a coordenação
tetraédrica (AlO4-) (MORENO & RAJAGOPAL, 2002).
No final da década de 70, alguns laboratórios industriais colocaram-se à procura de uma nova geração de materiais porosos. A estratégia envolvia a exploração de novas composições estruturais, além das já bastante conhecidas de silicatos e aluminossilicatos.
Os princípios da química de cristalização e da química de óxidos estendidos indicavam que os primeiros elementos a serem explorados como cátions estruturais tetraédricos eram o alumínio e o fósforo. Os esforços iniciais resultaram nos
aluminofosfatos, ALPO – estruturas que contêm em suas redes átomos de alumínio e
de fósforo interligados por átomos de oxigênio.
2.3 FOSFATOS DE SILÍCIO E ALUMÍNIO
Mais de 20 anos se passaram desde a primeira publicação sobre a síntese de silicoaluminofosfatos. Ainda hoje, novas descobertas sobre a química e a estrutura desses materiais continuam a aparecer (PASTORE et al, 2005).
As estruturas dos dois materiais mais estudados nessa família, as estruturas SAPO-5 e SAPO-11, estão representadas na Figura 4 (MASCARENHAS, 2001). Nessas estruturas, cada vértice representa um átomo tetraédrico de Si, Al ou P e no meio das arestas há um átomo de oxigênio.
O SAPO-11 possui estrutura do tipo AEL formada pela combinação de anéis de quatro e seis átomos alternadamente ao longo de uma direção. Esses canais encontram-se delimitados por um terceiro, de dez membros com, aproximadamente,
6,3 x 3,9 Å (MASCARENHAS, 2001).
Figura 4: Estruturas de: a. SAPO-5 e b. SAPO-11 (MASCARENHAS, 2001).
A força dos sítios ácidos de Brønsted de uma peneira molecular pode ser modelada de acordo com a composição do sólido, como mostrado na Figura 5.
Figura 5: Esquema da geração de sítio ácido de Brønsted (MASCARENHAS, 2001).
Na estrutura do Esquema 5a, é mostrado um sítio silanol, Si-OH, no qual um par eletrônico do átomo de oxigênio ocupa um orbital vazio de M, enquanto na
estrutura b do Esquema 5, o par eletrônico do oxigênio interage fracamente com o H+.
Essas estruturas mostram, também, que a ligação O-H será mais fraca quanto mais forte for a ligação M-O e, portanto, a zeólita será mais ácida quanto maior for a acidez de Lewis de M.
O mesmo raciocínio, quanto à origem da acidez, vale para os aluminofosfatos substituídos, com a diferença de que no caso dessas peneiras moleculares, a presença dos átomos de fósforo, com seus orbitais 3d de baixa energia, imprime um caráter covalente mais pronunciado às ligações. Essa mudança afeta fortemente a acidez desses materiais, tornando-os ácidos de Brønsted mais fracos (PASTORE, 1996), porém com acidez modulável.
hidroisomerização de n-alcanos podem ocorrer reações paralelas ou secundárias quando se empregam catalisadores com alta acidez, levando a diminuição da seletividade.
Figura 6: Esquema da fotociclização catalítica do azobenzeno (MASCARENHAS, 2001).
Hoje em dia, há 53 estruturas de aluminofosfatos e, por consequência silicoaluminofosfatos, com 18 zeólitas análogas naturais ou sintéticas. A maioria é composta de peneiras moleculares microporosas com pequenos, médios e grandes poros, mas algumas destas estruturas possuem poros extragrandes, porém com entradas limitadas por anéis de 12 átomos T (tetraedro).
Há um grande interesse no estudo de SAPOs indicado pelo número de publicações. Dados obtidos em 2005 por PASTORE indicaram que, nos cinco anos anteriores, foram feitas mais de 350 publicações sobre esses materiais. A grande maioria consiste na aplicação em catálise.
2.3.1 Incorporação de silício a uma rede ALPO
A introdução de átomos de silício na estrutura de rede ALPO leva a geração de acidez de Brønsted relevantes para reações catalisadas por ácidos, tais como
produção de olefinas, a partir de metano (MTO – do inglês “Methane to Olefines”),
1 - Mecanismo MSI: introdução de 1 Si em hipotética substituição ao Al; 2 - Mecanismo MSII: introdução de 1 Si em hipotética substituição ao P;
3 - Mecanismo MSIII: introdução simultânea de 2 Si, um em uma hipotética posição de Al e outro em uma hipotética posição de P.
Estes mecanismos estão graficamente representados na FIGURA 7.
Figura 7: Mecanismos de inserção de silício na rede ALPO (YADAV, SAKYHIVEL, 2014).
.
Todos os estudos realizados em SAPO mostram que existem apenas os mecanismos SM II e SM III, ambos geram cargas líquidas negativas (CHICA, 2002). Segundo PASTORE (2005), a acidez de Brønsted em SAPOs é gerada por meio da substituição de átomos de fósforo por átomos de silício, os quais levam a carga
negativa nas redes que são compensadas por prótons ligados a pontes Si – O – Al,
pelo mecanismo de substituição denominado SM II (PASTORE, COLUCCIA &
MARCHESE, 2005). Jamais foram encontradas ligações do tipo Si – O – P em SAPO,
Sendo assim, a carga líquida negativa em SAPOs é proporcional a fração molar do Si incorporado via mecanismo SM II, já que o SM III é um processo eletrostaticamente neutro (CHICA, 2002).
Assim como nas zeólitas, os sítios ácidos de Brønsted em SAPOs são
constituídos por unidades Si – O(H) – Al. Entretanto, a acidez desses materiais pode
variar muito, mesmo nos sistemas estruturalmente similares. O principal fator para isso é o ambiente atômico em torno dos centros ácidos. A primeira esfera de coordenação em torno dos átomos T de alumínio é formada apenas por Si em zeólitas, enquanto Si e P podem estar presentes em SAPOs. Além disso, a formação de ilhas de Si em SAPOs leva a um maior número de sítios ácidos, fazendo com que a acidez em SAPOs seja mais modulável, já que a inserção de silício pode ser controlada (PASTORE, COLUCCIA & MARCHESE, 2005).
Com a ajuda de um esquema planar (FIGURA 8) para representar a distribuição de Si, Al e P em redes SAPOs, BARTHOMEUF e colaboradores (1994, apud
PASTORE, 2005) mostraram que a ocupação por esses átomos na primeira e
Figura 8: Distrubuição de Si, Al e P em uma rede SAPO. A) Si isolado; b) ilha com 5Si; c) ilha com 11 Si; d) fase Si-Al com 1Al na ilha de silício (PASTORE, H.O.; COLUCCIA, S.; MARCHESE, L., 2005).
A força ácida aumenta à medida que a primeira esfera contém mais Si e a segunda mais fósforo. A presença de ilhas de Si leva a formação de sítios ácidos mais fortes pela formação de espécies Si(nAl) (n < 4) nas bordas das ilhas.
2.3.2 SAPOs mesoporosos
Nas últimas décadas, o SAPO-11, que consiste em um sólido poroso com poros formados por anéis elípticos de 10 membros de diâmetro de 0,39 x 0,63 nm, foi considerado o mais adequado para reações de isomerização de n-alcanos de cadeia longa (PARK & IHM, 2000). No entanto, o desempenho do catalisador pode ser seriamente limitado devido à sua estrutura microporosa que restringe a acessibilidade dos reagentes volumosos (ou maiores que o tamanho dos poros) para o interior dos poros. Algumas possíveis soluções foram exploradas para melhorar a acessibilidade em zeólitas. Uma delas consiste em diminuir o tamanho dos cristais zeolíticos, que
pode ser obtido por síntese em H2O-Surfactante-Álcool (BLASCO et al, 2006),
dessilicação (BERNASCONI et al, 2003)(GROEN et al, 2004). No entanto, segundo LIANG & HUANG (2011), a melhor opção para gerar mesoporos é por meio da introdução de carbono como direcionador, durante a cristalização. Os mesoporos são gerados durante e após a calcinação, pois mantêm a alta cristalização e é de fácil recuperação do material.
Além disso, alguns trabalhos que tratam da geração de mesoporos em SAPOs, por meio da utilização de direcionadores orgânicos durante a síntese, foram publicados. Entretanto, ainda hoje, pouco se conhece sobre a geração de mesoporos em SAPOs. A seguir, serão apresentados alguns trabalhos sobre essas sínteses.
SAPOs mesoporosos, com estrutura hexagonal, foram preparados por OLIVEIRA & PASTORE, em 2002, utilizando ácido fosfórico, sulfato de alumínio e sílica fumegante ou tetraetilortossilicato (TEOS), como fontes de P, Al e Si, respectivamente. O brometo de hexadeciltrimetilamônio (CTMABr) foi o agente direcionador de poros. O hidróxido de tetrametilamônio foi utilizado para ajustar o pH. A composição do gel foi:
Al2O3:1,27P2O5:0,76SiO2:2CTMABr:7,35TMAOH:409,6H2O.
Foram realizados estudos de remoção do agente direcionador de poros, por meio de extração em soxhlet com solução de ácido clorídrico em etanol/heptano (50/50), e outra com uma solução de isopropilamina em etanol.
Figura 9: DRX (A) Amostras sintetizadas com (a) sílica fumegante (b) TEOS; (B) DRX das amostras (a) com sílica fumegante, extraída com ácido, (b) com TEOS, extraída com ácido; (c) com TEOS, extraída com base, (d) com TEOS, extraída com base e calcinada (Adaptado de OLIVEIRA & PASTORE, 2002).
Além disso, os autores concluíram que a extração em meio ácido causa o completo colapso da estrutura na amostra preparada com sílica fumegante, enquanto que o produto obtido com TEOS teve a estrutura preservada parcialmente. Uma parcial desorganização, também, se observa nas amostras extraídas em meio alcalino, já que há apenas um sinal (100) nos difratogramas de Raios X (FIGURA 9B). Em 2010, CECOWSKI e colaboradores prepararam películas finas e xerogel de aluminofosfatos mesoporosos com arranjo tridimensional de poros modificados com silício e manganês. A mistura reacional do aluminofosfato teve como agente direcionador de poros o polímero não iônico Plurônic F127.
As análises por difratogramas de Raios X a baixo ângulo revelaram que os filmes finos calcinados de silicoaluminofosfato (SAPO) e o silicoaluminofosfato de manganês (MnSAPO) preparados possuem mesoestruturas altamente ordenadas, que permanecem estáveis até 400ºC. Medidas obtidas por espalhamento de Raios-X
a baixo ângulo – SAXS (do inglês “Small-Angle Scattering of X-Rays”) revelaram que
os materiais têm estrutura cúbica, sendo essa conclusão confirmada pelas imagens obtidas por TEM, SEM e AFM.
como o MnSAPO xerogéis continham muito menos defeitos que os mesmos filmes finos (CECOWSKI et al, 2010).
Efeitos dos parâmetros de síntese do SAPO-5 mesoporoso com estrutura do tipo AFI, via radiação de microondas, usando os precursores alumatrano e silatrano como fontes de alumínio e silício, respectivamente, foram estudados por UTCHARIYAJIT & WONGKASEMJIT, 2010.
Nessa síntese, o agente direcionador utilizado foi o TEA (sigla em inglês para representar o tetraetilamônio). Os autores evidenciam que a técnica de aquecimento com microondas é mais vantajosa, pois utiliza 1-2h, em contraposição com as convencionais, que requerem aquecimento de 190ºC por 4 dias. Além disso, as amostras obtidas são mesoporosas com distribuição de tamanho e partículas mais estreitas que as obtidas por métodos convencionais.
Todas as amostras apresentaram uma estrutura externa hexagonal reveladas por imagens de SEM, sendo que os difratogramas de Raios X correspondem com estruturas do tipo AFI (UTCHARIYAJIT & WONGKASEMJIT, 2010).
Recentemente, um método de síntese do SAPO microcristalino com alto
conteúdo de silício e sistema bimodal de poros, utilizando um “template” de
ciclohexilamina para criar microporosidade, foi desenvolvido por DANILINA et al,
2010. Esse método foi estudado como procedimento alternativo para síntese de SAPO
mesoporosos, utilizando-se cinco moldes diferentes. São eles: soft-template com
organosilano, soft-template contendo moléculas de fósforo, soft-template contendo
moléculas de alumínio, soft- template com moléculas anfifílicas e hard-template de
carvão (Black Pearls 2000, CABOT). As propriedades estruturais e catalíticas dessas
estruturas hierárquicas foram estudadas e comparadas com o SAPO-5 microcristalino
e um H-ZSM-5 comercial (DANILINA et al, 2010).
A dessorção a temperatura programada de n-propilamina, a isomerização do 2-metil-2-penteno e o craqueamento monomolecular do propano indicaram que o SAPO mesoporoso, sintetizado com molde de organosilano, possui um grande número de sítios ácidos de Brønsted e alta reatividade, similar ao SAPO microcristalino. Já, a atividade do SAPO-5 mesoporoso foi muito superior na alquilação do benzeno com álcool benzílico (98%), quando comparado com o SAPO
Os outros quatro sólidos sintetizados não tiveram suas atividades catalíticas avaliadas, pois resultaram em materiais impuros, amorfos, com ausência de mesoporo e baixa acidez (DANILINA et al, 2010).
Na literatura consultada, não há estudos sobre a atividade catalítica de SAPOs
mesoporosos em reações de hidroisomerização do n-hexadecano.
2.4 FOSFATOS DE NIÓBIO
2.4.1 Histórico sobre o Nióbio
O elemento 41 foi descoberto na Inglaterra em 1801, por Charles Hatchett, que, na época, o denominou de colúmbio. Posteriormente, o químico alemão Heinrich Rose, pensando haver encontrado um novo elemento ao separá-lo do metal tântalo, deu-lhe o nome de nióbio em homenagem a Níobe, filha do mitológico rei Tântalo (CBMM, 2013).
As informações mais antigas sobre o uso de nióbio datam de 1925, referindo-se à substituição do tungstênio na produção de ferramentas de aço. No início da década de 1930, o nióbio passou a ser utilizado na prevenção de corrosão intergranular em aços inoxidáveis (CBMM, 2013).
Até a descoberta quase simultânea de depósitos de pirocloro no Canadá (Oka) e no Brasil (Araxá), na década de 1950, o uso do nióbio era restringido pela oferta limitada (era um subproduto do tântalo) e custo elevado. Com a produção primária de nióbio, o metal tornou-se abundante e ganhou importância no desenvolvimento de materiais de engenharia (CBMM, 2013).
Na década de 1950, com o início da corrida espacial, aumentou muito o interesse pelo nióbio, o mais leve dos metais refratários. Ligas de nióbio, como Nb-Ti, Nb-Zr e Nb-Ta-Zr foram desenvolvidas para utilização nas indústrias espacial e nuclear, como também para fins relacionados à supercondutividade. Os tomógrafos de ressonância magnética para diagnóstico por imagem utilizam magnetos supercondutores feitos com a liga NbTi (CBMM, 2013).
à utilização em grande escala do conceito de microliga, com grandes vantagens econômicas para a engenharia estrutural, para a exploração de óleo e gás e para a fabricação de automóveis (CBMM, 2013).
Atualmente, os aços microligados respondem por 75% do consumo de nióbio. São materiais sofisticados, desenvolvidos a partir de princípios de metalurgia física, que refletem o esforço conjunto da pesquisa e desenvolvimento conduzidos na indústria e nos laboratórios de universidades (CBMM, 2013).
O nióbio é um metal de alto ponto de fusão (2468ºC), que se destaca pelas
seguintes características: densidade pouco superior a do ferro (8,57 g/cm3) e elevada
resistência ao ataque por certos ácidos, como o clorídrico (até 35%), o sulfúrico (até 95%), o nítrico concentrado, o fosfórico, o crômico e os orgânicos. Possui, também, baixa resistência à oxidação e supercondutividade a temperaturas inferiores a -264ºC. O óxido de nióbio hidratado, também conhecido como ácido nióbico, representa 13% do mercado mundial de nióbio e é a matéria-prima para fabricação de produtos especiais como: ferronióbio de alta pureza, níquel-nióbio, óxidos especiais de nióbio (grau ótico e grau cristal) e nióbio metálico e suas ligas (CBMM, 2013)
Segundo dados de 1999 do Departamento Nacional da Produção Mineral
-DNPM - o Brasil é o líder mundial em reservas conhecidas de pirocloro (Nb2O5), com
uma participação de 88,0%, seguido do Canadá com 9,0%. Como não poderia ser diferente, ocupa a primeira colocação mundial em oferta de nióbio com 94,5% e o Canadá com participação de apenas 5,1%. As reservas brasileiras estão localizadas nos estados de Minas Gerais (96,3%), Amazonas (2,7%) e Goiás (1,0%) e em termos de produção interna, Minas Gerais responde por 78,3% e Goiás por 21,6% restantes. O conhecimento científico se revelou essencial para o elemento 41. Os avanços conseguidos até aqui ampliaram o raio de aplicação do nióbio em aços, superligas, materiais intermetálicos e ligas de Nb, bem como em compostos, revestimentos, nanomateriais, dispositivos optoeletrônicos e catalisadores.
isoladamente ou combinados em certas proporções, podem conferir características próximas e altamente substitutivas do nióbio em diversos produtos (CBMM, 2013).
O pentóxido de nióbio (Nb2O5) é um sólido branco, estável, insolúvel em água.
Quando hidratado (Nb2O5.nH2O) apresenta forte acidez, com sítios de Bronsted e de
Lewis. O fosfato de nióbio (NbOPO4) possui acidez mais elevada que o óxido
hidratado, pois os grupos P-OH se comportam como sítios de Brønsted (SUN; AUROUX & SHEN, 2006)
Sendo assim, é de extrema importância para a indústria brasileira o desenvolvimento de novos materiais à base de nióbio, a fim de promover uma ampliação de sua aplicação.
2.4.2 Fosfatos de nióbio como catalisadores
Uma das primeiras referências à síntese de fosfatos de nióbio foi realizada por Hahn em 1951. Os autores partiam de uma solução de hexaniobato de potássio, pentóxido de nióbio dissolvido em ácido fluorídrico, todas tratadas com excesso de ácido nítrico e fosfórico, para sintetizarem o fosfato de nióbio. Os autores concluíram
que a fórmula deste composto poderia ser descrita como NbOPO4, sem qualquer outra
informação sobre acidez ou atividade catalítica (HAHN, 1951).
CANTERO et al (1993) reagiram o fosfato de nióbio com hidrazina e obtiveram um sólido amorfo com alta estabilidade térmica. Acima de 600ºC, a hidrazina é liberada e, de acordo com os autores, é obtido o fosfato de nióbio amorfo livre de
cátions interferentes (K+ e Na+) presentes em outras rotas de síntese (CANTERO et
al, 1993).
A avaliação do fosfato de nióbio comercial no processo de descarboxilação de ácidos carboxílicos foi realizada por REGUERA (2001). O fosfato de nióbio utilizado,
ADF/28, apresentou área específica de 119 m2/g (temperatura de pré-tratamento de
3500C), força ácida superior a do ácido nióbico e melhores resultados de conversão e
seletividade na descarboxilação (REGUERA, 2001).
Em 2003, MAL & FUJIWARA relataram a síntese de fosfato de nióbio microporoso. Os fosfatos foram sintetizados com auxílio de surfactantes neutros e catiônicos. O fosfato resultante apresentou uma área específica da ordem de 480
na hidroxilação do fenol. Os autores ralatam seletividade acima de 85% a 95,3% para
a 4-naftoquinona dependendo do solvente utilizado (MAL et al, 2003).
OKAZAKI & WADA (1993) estudaram as propriedades texturais e catalíticas do fosfato de nióbio (ADF/01) e do fosfato preparado a partir do niobato de potássio. Os resultados obtidos pelos autores para as propriedades texturais, composição e força ácida dos dois fosfatos, estão descritos na Tabela 1 (OKAZAKI & WADA, 1993).
Tabela 1: Propriedades texturais, composição e força ácida dos fosfatos de nióbio (OKAZAKI & WADA, 1993)
Amostrasa S
(m2/g)
Força Ácida (H0) Composição (%)
Nb P O
Razão P/Nb
Sintetizado 240 ≤ -8,2 14,2 12,0 73,8 0,84
ADF/01 205 ≤ -8,2 14,3 12,0 73,7 0,84
a: Pré-tratamento da amostra a 400ºC por 3 horas, imediatamente anterior às medidas
Foi relatada uma diminuição da atividade catalítica do fosfato de nióbio na conversão do álcool terc-butílico com metanol em metil terc-butil éter (MTBE) com
aumento da concentração de íons K+ não removidos no processo de síntese. Os
fosfatos de nióbio amorfos não cristalizam abaixo de 800ºC e exibem alta atividade catalítica, mesmo em condições de pré-tratamento de 500ºC. Além da síntese de MTBE, o fosfato de nióbio mostrou-se ativo na esterificação do ácido acético com vários alcoóis e na alquilação do benzeno com olefinas e alcoóis (OKAZAKI & WADA, 1993).
A avaliação dos sítios ácidos de diversos catalisadores à base de nióbio foi estudada por ARMAROLI e colaboradores (2000). O fosfato de nióbio (ADF/25)
apresentou área específica de 180 m2/g sem calcinar e de 150 m2/g calcinado a 255ºC.
Os autores caracterizaram a acidez de Brønsted como sendo devida às hidroxilas ligadas ao fósforo, mais ácidas, e ao nióbio. O fosfato de nióbio proporcionou a desidratação da frutose em 5-hidroximetil-2-furaldeído com boa seletividade e
desempenho (ARMAROLI et al, 2000).
até atingir pH 4, seco em ar e aquecido em diferentes temperaturas por 2 h (DA SILVA
et al, 2005).
Os resultados estruturais e térmicos indicam que o aumento da razão P/Nb realça a formação da fase cristalina do fosfato de nióbio. A quantidade de potássio é inversamente associada à razão P/Nb e controle da acidez. À medida que a temperatura de tratamento da amostra aumenta, a estrutura passa de triclínica para
tetragonal α-NbOPO4. A formação dessa fase é irreversível e se dá entre 760 e 840ºC
após completa desidroxilação e colapso da estrutura lamelar (DA SILVA et al, 2005).
LACHTER e PEREIRA caracterizaram o fosfato de nióbio (ADF-30) e avaliaram sua atividade catalítica na alquilação do anisol e tolueno com 1-octen-3-ol. A reação foi processada em fase líquida a 120ºC para o anisol e 110ºC para o tolueno com uma razão molar aromático/álcool de 10. A influência da temperatura de pré-tratamento (110, 200, 300, 400, 500 e 600ºC) na atividade catalítica do fosfato de nióbio na alquilação do anisol com álcool alílico foi estudada. Os melhores resultados foram obtidos quando se empregou temperatura de 400º C no pré-tratamento. A conversão do álcool foi de 100% na reação com anisol e 57% com tolueno. A atividade catalítica do fosfato de nióbio foi superior a do ácido nióbico na reação com anisol e a seletividade para produtos de monoalquilação foram maiores que 80% (LACHTER & PEREIRA, 2004).
Estudos de preparação, de caracterização e de atividade catalítica de fosfatos de nióbio sintetizados e comerciais foram realizados por LA CRUZ, 2004.
Para a síntese dos fosfatos foram utilizados ácido nióbico e HF. O material obtido é cristalino, possui baixa área específica e apresentou desempenho catalítico inferior aos dos fosfatos de nióbio comerciais em reações de alquilação de compostos aromáticos (LA CRUZ, 2004).
La Cruz afirma que, tanto para os fosfatos comerciais como para os sintetizados, a acidez está relacionada com a área específica (LA CRUZ, 2004).
SARKAR E PRAMANIK (2009) sintetizaram o oxofosfato de nióbio mesoporoso
com alta área específica (427 m2/g) e estreita distribuição de tamanho de poro (3-15
Um novo híbrido orgânico-inorgânico mesoporoso foi sintetizado por MAL et al
(2006). O oxofenilfosfato de nióbio mesoporoso teve como materiais de partida o ácido fenilfosfônico e pentaclorato de nióbio, como fontes de fósforo e nióbio, respectivamente, e o dodecil sulfato de sódio (SDS), utilizado como agente direcionador de estrutura mesoporosa. Além disso, realizaram caracterizações neste
sólido por diversas técnicas e verificaram que possui área específica de 169 m2/g e
distribuição de volume de poro de 0,168 cm3/g. Os autores não apresentaram estudo
catalítico deste material (MAL et al, 2006).
ROCHA et al,2008, avaliaram o desempenho catalítico de quatro amostras de
fosfato de nióbio, obtidos por diferentes métodos, em reações de alquilação do anisol com álcool benzílico.
Os fosfatos de nióbio estudados foram: um comercial calcinado (NbP-Com); um comercial recristalizado (NbP-Rec); um cristalino sintetizado por uma rota com HF (NbP-HF) e um microporoso preparado por um método que utiliza um surfactante como agente direcionador (NbP-Mic).
O fosfato de nióbio microporoso foi o mais ativo na reação empregada. Esse
desempenho foi atribuído a sua maior área específica (373 m2/g) e sua forte natureza
ácida, além dos sítios ácidos de Brønsted serem predominantes em relação aos de
Lewis (ROCHA et al, 2008).
2.5 Objetivo
3 MATERIAIS E MÉTODOS
A seguir, serão apresentadas as rotas de síntese utilizadas para obtenção dos catalisadores estudados. Para facilitar o desenvolvimento da discussão, os catalisadores foram divididos em quatro séries. São elas:
- SAPO – 11
- SAPO – 11 tratado
- SAPO mesoporoso (sintetizado com direcionadores de mesoporos)
- Fosfatos de Nióbio - NbP
Posteriormente, serão apresentadas as técnicas de caracterização desses materiais, bem como a metodologia utilizada para avaliar o desempenho desses catalisadores na reação de hidroisomerização do hexadecano.
3.1 MATERIAIS DE SÍNTESE DOS SILICOALUMINOFOSFATOS (SAPO)
Fontes de silício:
Fontes de Alumínio
Fonte de fósforo H3PO4 (85%, Merck)
Direcionadores de estrutura
Agente Mineralizante TMAOH (Solução aquosa 25% p/p, Sigma Aldrich)
TEOS (Merck – 99%)
Sílica - SiO2 (Aerosil 200, Degussa)
Sílica Gel – SiO2
Pseudobohemita (Vista 69,2% de Al2O3
Alumina pirolisada
Al2(SO4)3
Di-isopropilamina – DIPA (98% - Merck)
3.2 SÍNTESE DOS CATALISADORES SAPOS
Nesse trabalho, foram sintetizadas algumas amostras de SAPOs utilizando-se metodologias distintas e/ou diferentes direcionadores de estrutura. As metodologias dessas sínteses serão apresentadas sucintamente na Tabela 2, e de forma mais detalhada, ao longo desta seção.
Tabela 2: Tipos de catalisadores sintetizados.
Nome Metodologia Direcionador de
estrutura Tratamento pós síntese
SAPO-11
microporoso Direcionador de estrutura DPA/DIPA -
SAPO mesoporoso
Direcionador de estrutura
(soft template) CTMABr -
Direcionador de estrutura (hard template)
Carvão
Poliestireno -
Tratamento pós síntese em
SAPO-11 microporoso -
Ácido Básico
De acordo com a tabela 2, pode-se verificar que dentre os SAPOs mesoporosos
há três grupos: um mesoporoso de síntese com soft template, outro de síntese com
hard template e o terceiro mesoporoso por tratamento pós-síntese do SAPO-11
(microporoso).
3.2.1 Síntese do SAPO -11
Para síntese do SAPO-11, foi empregada a metodologia descrita por DINIZ (2000) e BLASCO (2006).
3.2.1.1 Síntese do SAPO-11 – amostra IB 01 - adaptado de DINIZ (2000)
O SAPO-11 sintetizado apresenta a seguinte composição molar:
1Al2O3:1P2O5:0,5SiO2:1DIPA:80H2O
Para obtenção do gel com a referida composição, adicionou-se 17,19 g de pseudobohemita em 100 g de água destilada sob agitação magnética por 30 minutos.