Universidade Federal do Rio Grande do Norte
Centro de Ciˆ
encias Exatas e da Terra
Departamento de F´ısica Te´
orica e Experimental
Programa de P´
os-Graduac
¸˜
ao em F´ısica
Dissertac
¸˜
ao de Mestrado
ASPECTOS DIN ˆ
AMICOS DA ´
AGUA VERSUS ´
ALCOOL E
ACETONA POR T´
ECNICAS DE CONGELAMENTO
por
Neymar Pereira da Costa
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIˆENCIAS EXATAS E DA TERRA
DEPARTAMENTO DE F´ISICA TE ´ORICA E EXPERIMENTAL PROGRAMA DE P ´OS-GRADUAC¸ ˜AO EM F´ISICA
ASPECTOS DIN ˆ
AMICOS DA ´
AGUA VERSUS
´
ALCOOL E ACETONA POR T ´
ECNICAS DE
CONGELAMENTO
NEYMAR PEREIRA DA COSTA
Orientador: Prof. Dr. CARLOS CHESMAN DE ARA ´UJO FEITOSA
Disserta¸c˜ao de mestrado apresentada ao Departamento de F´ısica Te´orica e
Experimental da Universidade Federal do Rio Grande do Norte como requisito parcial `a
obten¸c˜ao do grau de MESTRE em
F´ISICA.
`
A minha Fam´ılia
e aos
“On the first part of the journey I was looking at all the life There were plants and birds and rocks and things
There was sand and hills and rings The first thing I met was a fly with a buzz
And the sky with no clouds
The heat was hot and the ground was dry But the air was full of sound...
I’ve been through the desert on a horse with no name... After nine days I let the horse run free ’cause the desert
had turned to sea
There were plants and birds and rocks and things There was sand and hills and rings The ocean is a desert with its life underground
And a perfect disguise above
Under the cities lies a heart made of ground But the humans will give no love...”
A Horse With No Name
Agradecimentos
Em primeiro lugar, agrade¸co aos meus pais, Simi˜ao e Itanalda, que sempre me
apoiaram nas minhas escolhas, me confortaram nos momentos dif´ıceis desta jornada, cada um a sua maneira, e que mesmo distantes sempre fizeram me sentir pr´oximo. Aos
meus irm˜aos, Fernando e Thompson, pelo companheirismo e respeito ao longo dos anos. Agrade¸co a todos os familiares, em especial aos meus av´os Aldo (in memorian) e
Itamar, aos tios Manuel, Terezinha, das Dores e Ita´ecia, ao “irm˜ao” F´abio e a “mam˜ae” Neves que sempre me acolheram e apoiaram de forma incondicional.
A todos os amigos que, direta ou indiretamente contribuiram para a conclus˜ao deste trabalho, aos companheiros do Laborat´orio, Thatyara, M´arcio, Jos´e Am´erico e Charlie
Salvador.
Ao Prof. Carlos Chesman, que me deu seu cr´edito de confian¸ca e me orientou nesta
jornada, meu muito obrigado.
Agrade¸co ao Departamento de F´ısica Te´orica e Experimental, aos Professores, que
contribu´ıram para minha forma¸c˜ao acadˆemica, aos funcion´arios pela presta¸c˜ao de servi¸cos e convivˆencia amistosa.
Ao Programa de Educa¸c˜ao Tutorial (PET) pelas grandes li¸c˜oes de vida, propiciadas em seu ˆambito.
Resumo
A ´agua ainda representa, em suas propriedades cr´ıticas e transi¸c˜oes de fase, um
pro-blema de interesse cient´ıfico atual, em conseq¨uˆencia das in´umeras quest˜oes em aberto e da insuficiˆencia dos modelos te´oricos existentes, principalmente relacionados `as diferentes
fases s´olidas e l´ıquidas que esta substˆancia possui. Por exemplo, das 13 formas cristalinas conhecidas, a ´agua exibe diferentes fases amorfas, sendo que uma delas, o gelo amorfo de
muito alta densidade (VHDA), foi observada apenas recentemente. Outro exemplo ´e o comportamento anˆomalo na densidade que apresenta um m´aximo a 277 K. Para
investi-gar experimentalmente o comportamento de uma das transi¸c˜oes de fase l´ıquida-s´olida da ´agua, a anomalia na sua densidade e tamb´em a metaestabilidade, usamos trˆes
diferen-tes sistemas de refrigera¸c˜ao e empregamos como sistemas de compara¸c˜ao, os solvendiferen-tes: acetona e ´alcool et´ılico. O primeiro sistema de refrigera¸c˜ao usa uma placa Peltier, um
dispositivo relativamente novo, que usa pequenos cubos semicondutores para trocar calor entre duas superf´ıcies; o segundo foi um refrigerador comum, semelhante aos residenciais,
uma geladeira. Finalmente o nitrogˆenio l´ıquido, que ´e usado para refrigerar as amostras num container de duas maneiras, uma muito r´apida e outra, quase est´atica. Nesses trˆes
sistemas foram utilizados trˆes beckers de alum´ınio (com volume de 80 ml, cada), contendo ´agua, ´alcool e acetona, fechados e mantidos `a press˜ao atmosf´erica. Dentro de cada becker
foram arranjados trˆes termopares, dispostos ao longo do eixo vertical dos beckers, um pr´oximo a superf´ıcie inferior, outro ao n´ıvel m´edio e o ´ultimo pr´oximo a superf´ıcie
supe-rior. Um sistema de aquisi¸c˜ao de dados foi montado via instrumenta¸c˜ao virtual usando como equipamento central um Data-Acquisitions. Com isso, foram coletados os dados
transi¸c˜oes das fases l´ıquido-s´olidas nos trˆes l´ıquidos, com ocorrˆencia da fase metaest´avel tanto para a ´agua quanto para o ´alcool e acetona, indicando a dinˆamica da ´agua nos
Abstract
Water still represents, on its critical properties and phase transitions, a problem of
current scientific interest, as a consequence of the countless open questions and of the inadequacy of the existent theoretical models, mainly related to the different solid and
liquid phases that this substance possesses. For example, there are 13 known crystalline forms of water, and also amorphous phases. One of them, the amorphous ice of very high
density (VHDA), was just recently observed. Other example is the anomalous behavior in the macroscopic density, which presents a maximum at the temperature of 277 K. In order
to experimentally investigate the behavior of one of the liquid-solid phase transitions, the anomaly in its density and also the metastability, we used three different cooling
techniques and, as comparison systems, we made use of the solvents: acetone and ethyl alcohol. The first studied cooling system employ a Peltier plate, a device recently
deve-loped, which makes use of small cubes made up of semiconductors to change heat among two surfaces; the second system is a commercial refrigerator, similar to the residential
ones. Finally, the liquid nitrogen technique, which is used to refrigerate the samples in a container, in two ways: a very fast and other one, almost static. In those three systems,
three Beckers of aluminum were used (with a volume of 80 ml, each), containing water, alcohol and acetone. They were closed and maintained at atmospheric pressure. Inside
of each Becker were installed three thermocouples, disposed along the vertical axis of the Beckers, one close to the inferior surface, other to the medium level and the last one close
the superior surface. A system of data acquisition was built via virtual instrumentation using as a central equipment a Data-Acquisition board. The temperature data were
solid phases in the three liquids, with occurrence of the metastable phase for water, as well as for the alcohol and acetone, indicating the dynamics of the freezing water in the
Sum´
ario
Resumo iv
Abstract vi
1 INTRODUC¸ ˜AO 1
Referˆencias Bibliogr´aficas . . . 4
2 A ´AGUA 5 2.1 A MOL´ECULA . . . 6
2.1.1 Composi¸c˜ao e Energia da Mol´ecula de ´Agua . . . 6
2.1.2 Estrutura Geom´etrica da Mol´ecula de ´Agua . . . 7
2.2 FASE S ´OLIDA DA ´AGUA . . . 10
2.2.1 Estrutura do geloIh . . . 10
2.2.2 Fase s´olida da ´agua em baixas temperaturas . . . 13
2.2.3 Fases s´olidas a alta press˜ao . . . 14
2.3 NUCLEAC¸ ˜AO DO GELO . . . 15
2.3.1 Tipos de nuclea¸c˜ao . . . 15
2.3.2 Nuclea¸c˜ao homogˆenea . . . 16
2.3.3 Teoria Macrosc´opica da nuclea¸c˜ao heterogˆenea . . . 21
2.4 CRESCIMENTO DO GELO . . . 24
2.4.1 Forma¸c˜ao do gelo crescido a partir de ´agua super-resfriada . . . 24
2.4.2 Taxas de crescimento em ´agua super-resfriada . . . 25
3 PROCEDIMENTOS EXPERIMENTAIS 29
3.1 SISTEMA DE AQUISIC¸ ˜AO DE DADOS . . . 29
3.2 DISPOSITIVOS TERMOEL´ETRICOS . . . 31
3.2.1 Termopares . . . 31
3.2.2 Placas Peltier . . . 35
3.3 O SISTEMA TERMOEL´ETRICO . . . 38
3.3.1 Descri¸c˜ao e Procedimento . . . 38
3.4 O SISTEMA CONVENCIONAL . . . 41
3.4.1 Descri¸c˜ao e Procedimento . . . 43
3.5 O SISTEMA CRIOGˆENICO . . . 44
3.5.1 Liquefa¸c˜ao do Nitrogˆenio . . . 44
3.5.2 Descri¸c˜ao da Montagem e do ProcedimentoQuenching . . . 47
3.5.3 Descri¸c˜ao da Montagem e do Procedimento do Banho T´ermico . . . 48
Referˆencias Bibliogr´aficas . . . 51
4 RESULTADOS 52 4.1 MEDIDAS EM ´AGUA . . . 52
4.1.1 Resfriamento . . . 52
4.1.2 Aquecimento . . . 56
4.2 MEDIDAS: ´ALCOOL ET´ILICO E ACETONA . . . 60
4.2.1 Resfriamento . . . 60
4.2.2 Aquecimento . . . 64
4.3 ALGUMAS OBSERVAC¸ ˜OES SOBRE OS APARATOS E MEDIDAS . . . 65
4.3.1 Influˆencia do Porta-Amostras e Fatores Externos . . . 65
4.3.2 Rela¸c˜ao Entre os Sistemas de Refrigera¸c˜ao . . . 71
4.4 MEDIDAS DE VELOCIDADE DE CRESCIMENTO DA FASE S ´OLIDA EM L´IQUIDOS SUPER-RESFRIADOS . . . 72
4.5 COMPARAC¸ ˜AO DOS RESULTADOS EM ´AGUA, ´ALCOOL ET´ILICO E ACETONA . . . 73
5 CONCLUS ˜OES E PERSPECTIVAS 77
5.1 CONCLUS ˜OES . . . 77
Lista de Figuras
2.1 Esbo¸co da estrutura geom´etrica da mol´ecula de ´agua. O´e o ´atomo de oxigˆenio com
massa m2, H´e o ´atomo de hidrogˆenio com massa m1, r ´e o comprimento da liga¸c˜ao e
2θ ´e o angulo entre as liga¸c˜oes. O centro de coordenadas est´a localizado no centro de
massa da mol´ecula (a qual n˜ao est´a em escala). . . 7 2.2 a)Disposi¸c˜ao dos ´atomos de oxigˆenio no geloIh vista perpendicular ao eixo c. b)
Estru-tura vista ao longo do eixo c mostrando a base hexagonal. . . 11 2.3 C´elula unit´aria do geloIh (os hidrogˆenios foram omitidos). . . 12
2.4 Elementos de simetria do gelo Ih: a) Planos especulares normais ao eixo c. b) Planos
especular e deslizante. c) Representa¸c˜ao do plano deslizante. . . 13 2.5 Arranjo estrutural do gelo c´ubico ouIc. . . 14 2.6 Diagrama de fase da fase s´olida da ´agua, a linha s´olida ´e a linha est´avel medida, a
linha ponto tracejada ´e a linha metaest´avel medida, a linha tracejada ´e a linha est´avel
estimada e a pontilhada ´e uma extrapola¸c˜ao da linha metaest´avel cite/hobbs1. . . 16 2.7 Mudan¸ca na energia livre ∆GLS devido a forma¸c˜ao de uma semente de gelo contendo i
mol´eculas. . . 19 2.8 Esquema de uma semente prism´atica sobre um substrato plano.. . . 22
3.1 Diagrama da Lista de Varredura para 6 canais . . . 30 3.2 (a) Termopar formado pelos condutores A e B com suas jun¸c˜oes nos reservat´orios
t´ermicos as temperaturas T e TR. (b) N´ıveis de energia entre os metais A e B e as
energias de Fermi em cada jun¸c˜ao. . . 32 3.3 Esquema do circuito para a medida da diferen¸ca de potencial de Seebeck no termopar
3.4 Par termoel´etrico composto pelos semicondutores Telureto de Bismuto (Bi2Te3) tipos P
e N em um circuito el´etrico. . . 36 3.5 Ilustra¸c˜ao de uma placa Peltier evidenciando o circuito t´ermico, em paralelo e o circuito
el´etrico em s´erie. . . 37
3.6 Esquema em corte transversal da montagem do sistema de refrigera¸c˜ao termoel´etrico. . 38 3.7 Esquema da disposi¸c˜ao padr˜ao dos termopares no porta-amostras de volume 80 mℓ. . . 40
3.8 Superf´ıcies de contato t´ermico entre o porta-amostras e a placa Peltier. . . 40 3.9 Diagrama do sitema de refrigera¸c˜ao de compress˜ao de g´as. . . 42
3.10 Conjunto de porta-amostras utilizados nas medidas de temperatura dos l´ıquidos . . . . 43 3.11 Porta-amostras dispostos no interior do congelador. . . 44
3.12 Diagrama de fases de uma mistura de Nitrogˆenio e Oxigˆenio . . . 45 3.13 Esquema de um liquefator de nitrogˆenio, as setas mostram os fluxos dos gases nas fases
l´ıquida e de vapor envolvidos no processo . . . 46 3.14 Montagem do equipamento para a t´ecnica criogˆenica com o procedimentoquenching . . 48
3.15 Banho t´ermico em ambiente de nitrogˆenio l´ıquido. . . 49
4.1 Medidas de temperatura em ´agua destilada por t´ecnicas de refrigera¸c˜ao em: (a)Sistema
Termoel´etrico, (b) Sistema Convencional e (c) Sistema Criogˆenico com procedimento
em banho t´ermico. . . 53 4.2 Amplia¸c˜ao da medida de temperatura em ´agua destilada no sistema criogˆenico, os
intervalos delimitados pelas linhas verticais indicam a evolu¸c˜ao das anomalias, fase
metaest´avel e taxa de crescimento do gelo no porta-amostras. . . 54 4.3 Seq¨uˆencia da evolu¸c˜ao do gelo, formado a partir da fase l´ıquida, nos instantes destacados
no gr´afico da Figura 4.2. . . 56 4.4 Medida de resfriamento de ´agua. (a) Procedimento Quenching e (b) Amplia¸c˜ao da
regi˜ao de transi¸c˜ao de fase. . . 57 4.5 Medida de aquecimento da ´agua. (a) Ap´os o resfriamento no sistema termoel´etrico,
(b)amplia¸c˜ao da regi˜ao de transi¸c˜oes do gr´afico (a),(c)ap´os o resfriamento em banho
t´ermico e(d)amplia¸c˜ao da regi˜ao de transi¸c˜ao em (c). . . 58
4.6 Comportamento t´ermico do ´alcool et´ılico no: (a) sistema termoel´etrico, (b) sistema
4.7 Comportamento t´ermico da acetona no: (a)sistema termoel´etrico,(b)sistema
conven-cional e(c)sitema criogˆenico com procedimento em banho t´ermico.. . . 62 4.8 Comportamento t´ermico, sem transi¸c˜oes, do ´alcool e da acetona. Gr´aficos (a1) e (a2):
sistema termoel´etrico, (b1) e (b2): sistema convencional, respectivos `as amostras de
´
alcool e acetona. . . 63 4.9 Transi¸c˜ao de fase do ´alcool a TF (-114
0
C ou 159 K). Os instantes destacados indicam
a nuclea¸c˜ao do ´alcool super-resfriado (tN) e tC, o momento da solidifica¸c˜ao do ´alcool na
posi¸c˜ao dos termopares. . . 64
4.10 Transi¸c˜ao de fase da acetona a TF (-94,6 0C ou 178,4 K). O t0 ´e o instante em que se
inicia o super-resfriamento da acetona. A nuclea¸c˜ao ocorre em (tN). Os instantes tC1,
tC2e tC3 mostram o crescimento da fase s´olida ao longo do porta-amostras. . . 65 4.11 Medidas de resfriamento usando a t´ecnica criogˆenica Quenching em amostras de: (a)
´
alcool et´ılico e (b)acetona. . . 66 4.12 Medidas de aquecimento ap´os o resfriamento, em banho t´ermico, em amostras de: (a)
´alcool et´ılico e (b)acetona. . . 67 4.13 Seq¨uˆencia de medidas de resfriamento em uma amostra de ´agua destilada, sem
substi-tui¸c˜ao, no sistema termoel´etrico. . . 68 4.14 Seq¨uˆencia de medidas de resfriamento em uma amostra de ´agua destilada, sem
substi-tui¸c˜ao, no sistema criogˆenico. . . 69 4.15 Medidas de resfriamento em ´agua destilada, exibindo o efeito da convec¸c˜ao nos sistemas
(a)termoel´etrico,(b)convencional e(c)criogˆenico. . . 70 4.16 Dependˆencia da densidade da ´agua com a temperatura [1]. . . 71
4.17 Taxa de crescimento m´edio do gelo na ´agua super-resfriada. . . 72 4.18 Medidas de resfriamento no sistema criogˆenico em banho t´ermico em amostras de (a1)
e (a2), ´agua destilada, (b1) e (b2), ´alcool et´ılico, (c1) e (c2) acetona. . . 74 4.19 Taxas m´edias de crescimento das fases s´olidas a partir das fases l´ıquidas super-resfriadas,
5.1 a) Diferentes dom´ınios est´aveis e metaest´aveis de temperatura para a ´agua `a press˜ao
atmosf´erica. A regi˜ao entre as curvas de nuclea¸c˜ao homogˆenea TH e a temperatura de
cristaliza¸c˜ao TX, chamada deno man´s land [3] ´e uma faixa onde experiˆencias na fase
l´ıquida n˜ao podem ser executadas. As temperaturas 333 K, 319 K , 293 K e 277 K
s˜ao, respectivamente, o conjunto de anomalias na velocidade do som, na
compressibili-dade, na viscosidade e na densicompressibili-dade, onde TM D representa a temperatura de densidade
m´axima. TM ´e o ponto de fus˜ao, TBo ponto de ebuli¸c˜ao e Tga temperatura de transi¸c˜ao
Cap´ıtulo 1
INTRODUC
¸ ˜
AO
´
E desnecess´ario dizer o quanto ´e importante o papel que a ´agua desempenha em nossas
vidas. Um dos elementos Aristot´elicos que desde os prim´ordios intriga o homem, com seus singulares fenˆomenos, que desafiam a l´ogica dos modelos atuais para uma substˆancia
simples, e que se comporta de forma anˆomala. Isto ´e o que at´e os dias de hoje leva a busca de sua compreens˜ao.
H´a v´arios pontos que tornam o assunto da ´agua algo desafiador e interessante, um dos mais atuais ´e o seu perfil a baixas temperaturas, pois ´e neste campo que se encontram
todas as suas fases s´olidas conhecidas, e cujos esfor¸cos em pesquisas te´oricas [1] e experi-mentais se empenham. A exemplo da recente descoberta de uma nova fase amorfa de alta
densidade (VHDA) [2] podem elucidar enigmas ainda sem explica¸c˜ao, como por exmeplo, a presen¸ca de duas fases l´ıquidas, peculiares apenas a esta substˆancia.
O trabalho experimental que ser´a dissertado aqui, tem como principal objeto de es-tudo a ´agua a baixas temperaturas. O ponto de partida foi o desenvolvimento de um
prot´otipo, integrante do projeto de constru¸c˜ao de sistemas de refrigera¸c˜ao termoel´etrica. Inicialmente, o objetivo era observar o desempenho do dispositivo em funcionamento
uti-lizando amostras de l´ıquidos padr˜oes. Posteriormente surgiu o interesse em comparar os resultados com o sistema de refrigera¸c˜ao dom´estico convencional e, com a
disponibili-dade de nitrogˆenio em sua forma l´ıquida em nosso laborat´orio, desenvolvemos um sistema criogˆenico tamb´em com o intuito de compara¸c˜ao. A partir dos resultados, cujo parˆametro
Esta disserta¸c˜ao est´a dividida em trˆes partes principais: A primeira parte, da qual se dedica o Cap´ıtulo 2, compreende, do ponto de vista estrutural, algumas das principais
caracter´ısticas da ´agua, desde a forma¸c˜ao de suas mol´eculas at´e as estruturas das fases s´olidas a baixas temperaturas. E em seguida apenas `a t´ıtulo de informa¸c˜ao, as estruturas
das fases s´olidas a altas press˜oes. Nesta parte, duas se¸c˜oes abordar˜ao a teoria de forma¸c˜ao do gelo a partir da fase l´ıquida, sendo uma para a ´agua pura e a outra, para a ´agua em
contato com outros materiais e part´ıculas. Estas teorias relacionam o sistema ´agua com temperaturas abaixo do ponto de fus˜ao, este estado da ´agua ´e denominado metaest´avel.
Por fim, a ´ultima se¸c˜ao ser´a um breve coment´ario sobre a dinˆamica de crescimento do gelo a partir da fase l´ıquida, sob aspectos pertinentes aos aparatos experimentais.
A segunda parte, que compreende o Cap´ıtulo 3, abrange a parte descritiva das t´ecnicas utilizadas. Inicialmente ser´a mostrado como os dados das medidas s˜ao obtidos e
armazena-dos pelo sistema de aquisi¸c˜ao de daarmazena-dos. Na seq¨uˆencia, ser´a revisada a teoria dos dispo-sitivos termoel´etricos, enfatizando os termopares, sensores de temperatura que s˜ao pe¸cas
fundamentais do sistema de aquisi¸c˜ao de dados, em seguida, uma breve apresenta¸c˜ao das placas Peltier, dispositivos relativamente novos, que apresentam uma vasta gama
de aplica¸c˜oes devido a sua grande simplicidade e dimens˜oes reduzidas [3]. A partir das pr´oximas se¸c˜oes ser˜ao descritos com detalhes, a t´ecnica termoel´etrica, que tem como pe¸ca
central a placa Peltier, em seguida a t´ecnica convencional, com uma pequena introdu¸c˜ao aos sistemas de conpress˜ao de g´as e, por ´ultimo, ser´a descrita a t´ecnica criogˆenica, com
uma abordagem inicial da obten¸c˜ao do nitrogˆenio l´ıquido a partir do ar atmosf´erico. O nitrogˆenio l´ıquido ´e utilizado como fonte fria dos dois procedimentos da t´ecnica criogˆenica,
um deles ´e o procedimento em banho t´ermico, que permite um resfriamento a taxas pe-quenas, e o outro ´e o procedimentoQuenching que significa temperar ou mergulhar, com
o intuito de baixar a temperatura rapidamente.
A terceira parte, Cap´ıtulo 4 cont´em informa¸c˜oes gr´aficas de todas as medidas
reali-zadas, em tempo real, sob as t´ecnicas referenciadas no Cap´ıtulo 3. A abordagem ´e feita inicialmente mostrando os resultados das medidas em ´agua destilada para o resfriamento
nos trˆes sistemas, primeiro comparando os sistemas do ponto de vista qualitativo quanto a capacidade frigor´ıfica e com respeito as taxas de transferˆencia de calor. Logo mais,
em seguida seja apresentado o resultado do procedimento Quenching e, finalizando para a ´agua, s˜ao mostrados os resultados das medidas sob os procedimentos de aquecimento.
A mesma seq¨uˆencia de apresenta¸c˜ao de medidas, ´e adotada para os dois solventes mais comuns em laborat´orios, que s˜ao o ´alcool et´ılico (C2H5OH) e a acetona (C3H6O) ambos
de alta pureza (99,99%). Ainda nesta parte, analisados os efeitos que os fatores externos exercem sobre os resultados de medidas deste tipo em amostras de ´agua destilada para
todos os sistemas, levando em considera¸c˜ao tamb´em, suas caracter´ısticas de constru¸c˜ao e de disposi¸c˜ao. Estas caracter´ısticas de disposi¸c˜ao serviram para a medida de velocidade de
crescimento da fase s´olida, a partir da fase l´ıquida das amostras estudadas. Finalizando esta terceira parte, comparamos o comportamento das trˆes amostras sob as condi¸c˜oes
impostas pelos sistemas.
Por fim, apresentamos as conclus˜oes e perspectivas, comentando acerca do
Referˆ
encias Bibliogr´
aficas
[1] Giovambattista, N., Stanley, H. E., and Sciortino, F. (2005), Phase diagram of amorphous solid water: Low-density, high-density, and very-high-density amorphous ices - Phys. Rev. E,72, 031510.
[2] Loerting, T., Salzmann, C., Kohl, I., Mayer, E. and Hallbrucker, A. (2001).A second distinct structural “state”of high-density amorphous ice at 77 K and 1 bar - J. chem. Phys., 3, 5355-7.
Cap´ıtulo 2
A ´
AGUA
A ´agua tem a maior diversidade de fases s´olidas quando comparada a qualquer outra
substˆancia conhecida. Dependendo dos processos dinˆamicos que envolvem troca de calor e transi¸c˜oes de fase a diferentes temperaturas e press˜oes, a ´agua pode apresentar at´e 13
formas cristalinas conhecidas, sendo 9 est´aveis em certa escala de temperatura e press˜ao [1]. Se a ´agua l´ıquida for resfriada ou vapor de ´agua for depositado, em condi¸c˜oes normais
de press˜ao atmosf´erica, em temperaturas entre 193 K e 273 K (−80 0
C e 0 0
C), suas mol´eculas se arranjam em um s´olido com estrutura cristalina de simetria hexagonal, esta
forma ´e chamada degelo ordin´ario ougelo Ih, j´a para temperaturas em torno de 193 K a 143 K (−800
C a−1300
C), por deposi¸c˜ao, forma-se tamb´em um s´olido mas com estrutura
diferente. Neste caso, a simetria ´e c´ubica e o s´olido recebe o nome de gelo Ic. Quando a ´agua ´e resfriada a altas press˜oes outras formas s´olidas se apresentam, que s˜ao os gelos II ao
IX, os quais s˜ao denominados de gelos polimorfos de alta press˜ao. Se a ´agua for resfriada r´apido o suficiente (106
K/s), o congelamento forma um s´olido n˜ao cristalino, a esta fase
v´ıtrea da ´agua ´e denominada glassy water. Al´em dessas, existem um grande n´umero de estruturas conhecidas como hidratos de clatrina (Clathrate hydrates) [2], que s˜ao formas
s´olidas de ´agua, as quais apresentam cavidades onde s˜ao aprisionadas mol´eculas inertes de gases como xenˆonio, argˆonio e ´oxidos de etileno. Portanto a diversidade das formas
que a ´agua apresenta, est´a diretamente ligada a sua hist´oria termodinˆamica e da presen¸ca de outras substˆancias em seu meio.
dinˆamicos da forma¸c˜ao do gelo a partir da fase l´ıquida sejam abordados.
2.1
A MOL´
ECULA
2.1.1
Composi¸c˜
ao e Energia da Mol´
ecula de ´
Agua
A ´agua ´e formada por dois elementos, o hidrogˆenio e o oxigˆenio. Isto ´e observado
quando se decomp˜oe o l´ıquido por eletr´olise e ent˜ao se identificam os gases. S˜ao obtidos 11% de hidrogˆenio e 89% de oxigˆenio em rela¸c˜ao `a massa de ´agua l´ıquida. Segundo a
hip´otese de Avogadro duas mol´eculas de hidrogˆenio reagem com uma mol´ecula de oxigˆenio para produzir duas mol´eculas de vapor de ´agua desta forma,
2H2+O2 →2H2O (2.1)
Como a massa atˆomica do oxigˆenio ´e 16 e a do hidrogˆenio ´e 1,0080 a massa molecular
da ´agua pura deve ser 18,0160, a massa de uma mol´ecula de ´agua ´e, portanto, sua massa molecular dividida pelo n´umero de mol´eculas em uma mol´ecula-grama, isto ´e, o n´umero
de Avogadro NA. A massa da mol´ecula de ´agua ´e 2,992×10−23
kg.
A energia de forma¸c˜ao da mol´ecula de ´agua (teoricamente a 0 K) ´e definida como a
energia liberada quando dois ´atomos de hidrogˆenio e um ´atomo de oxigˆenio s˜ao unidos para formar uma mol´ecula de ´agua. Duas mol´eculas de ´agua podem se formar desta
maneira:
2(H+H+O)→2(H2+O)→2H2+O2 →2H2O (2.2)
As energias dos trˆes passos acima s˜ao obtidas a partir de dados em espectroscopia [3].
Quando duas mol´eculas de hidrogˆenio se unem a uma mol´ecula de oxigˆenio para formar duas mol´eculas de ´agua, a energia liberada ´e de 4,951 eV. A energia de forma¸c˜ao de uma
mol´ecula de ´agua a 0 K ´e, portanto, a metade da energia liberada nas etapas acima, ou seja, 9,510 eV.
Assim a energia total para dissociar uma mol´ecula de ´agua em seus ´atomos nesta temperatura ´e de 9,51 eV, a energia necess´aria para dissociar o primeiro hidrogˆenio ´e
de 5,11 eV, como isso modifica o estado da mol´ecula, a nova configura¸c˜ao requer uma parcela menor de energia (4,40 eV) para a dissocia¸c˜ao da outra liga¸c˜ao entre o oxigˆenio e
o hidrogˆenio.
2.1.2
Estrutura Geom´
etrica da Mol´
ecula de ´
Agua
A partir de estudos feitos em gases sujeitos a a¸c˜ao de campos el´etricos, pode-se inferir sobre a distribui¸c˜ao eletrˆonica das mol´eculas e conhecer a natureza destas. A mol´ecula
de ´agua ´e polar, e pode ser representada como na Figura 2.1
Figura 2.1: Esbo¸co da estrutura geom´etrica da mol´ecula de ´agua. O´e o ´atomo de oxigˆenio com massa
m2, H´e o ´atomo de hidrogˆenio com massa m1, r ´e o comprimento da liga¸c˜ao e 2θ ´e o angulo entre as
liga¸c˜oes. O centro de coordenadas est´a localizado no centro de massa da mol´ecula (a qual n˜ao est´a em
Do esquema da Figura 2.1 podemos calcular os momentos de in´ercia principais da mol´ecula de ´agua, em fun¸c˜ao do comprimento da liga¸c˜aor. Mas antes, para simplificar,
vamos deslocar a mol´ecula pelo eixoz at´e que o ´atomo de oxigˆenio se encontre na origem do sistema de coordenadas. Com isso encontramos a posi¸c˜ao do centro de massa pela
express˜ao
~r= 1
m
n X
i=1
mi ~ri (2.3)
o que nos fornece
~r= 2m1
m rcosθ zˆ (2.4)
ondem´e a massa total da mol´ecula. Este resultado ´e tamb´em a distˆancia do deslocamento
paralelo dos eixos x e y em rela¸c˜ao ao centro de massa. O momento de in´ercia ´e definido como
I = n X
i=1
mi r2i (2.5)
os momentos em rela¸c˜ao aos eixos coordenados s˜ao
Ix = 2m1r 2
(2.6)
Iy = 2m1r 2
cos2
θ (2.7)
Iz = 2m1r 2
sen2
θ (2.8)
agora transladando a mol´ecula novamente para que seu centro de massa se localize na
origem das coordenadas aplicando oteorema dos eixos paralelos
I =Ic +m h
2
aos eixos x e y, sendo h o deslocamentos paralelo, dado pela Equa¸c˜ao 2.4. Dessa forma, obtemos:
Ix = 2mr2k1(1−2k1cos 2
θ) (2.10)
Iy = 2mr2k1k2cos 2
θ (2.11)
Iz = 2mr2k1sen 2
θ (2.12)
onde:
m= 2m1+m2
k1 =m1/m= 1/18
k2 =m2/m= 16/18
(2.13)
das Equa¸c˜oes 2.13, 2.11 e 2.12, obtemos:
tan2
θ = 8 9
Iz
Iy
(2.14)
que ´e a rela¸c˜ao entre os momentos principais de in´ercia e o ˆangulo das liga¸c˜oes da mol´ecula de ´agua. Tamb´em podemos eliminar θ a partir das Equa¸c˜oes 2.11 e 2.12, chegando a:
mr2
= Iy+k2Iz 2k1k2
(2.15)
A seguir veremos como o espectro de infravermelho pode nos dar informa¸c˜oes sobre os momentos de in´ercia.
Campos el´etricos oscilantes, que integram uma radia¸c˜ao eletromagn´etica, exercem influˆencia em mol´eculas polares e em gases. As mol´eculas podem absorver ou emitir
radia¸c˜ao dependendo dos seus n´ıveis de energia vibracional e rotacional. Negligenciando qualquer excita¸c˜ao eletrˆonica, mudan¸cas nos estados de energia das mol´eculas s˜ao causadas
por excita¸c˜oes rotacionais e vibracionais.
Sob estas condi¸c˜oes, a radia¸c˜ao absorvida ou emitida est´a na faixa do infravermelho
(1,00×103
µm a 7,69×10−1
radia¸c˜oes com comprimento de onda maiores que cerca de 16µm. O espectro do infraver-melho da mol´ecula de ´agua ´e muito extenso e complexo. O espectro rotacional apresenta
um pico de intensidade em torno de 50µm e decresce at´e aproximadamente 15,38µm. Por extrapola¸c˜ao do espectro rotacional de uma hipot´etica mol´ecula de ´agua de baixa rota¸c˜ao
e sem vibra¸c˜ao [4] obt´em -se:
Ix = 2,9376×10−47 kg m
2
Iy = 1,8384×10−47 kg m
2
Iz = 3,8340×10−47 kg m
2 (2.16)
A partir destes valores, podemos substitu´ı-los nas Equa¸c˜oes 2.14 e 2.15 que nos d˜ao
r = 9,5718×10−11
m ( 0,95718 ˚A) e 2θ = 104,5230
para o caso hipot´etico de uma
mol´ecula de ´agua de baixa rota¸c˜ao e sem vibra¸c˜ao. Para o caso real, estes valores podem mudar consideravelmente.
2.2
FASE S ´
OLIDA DA ´
AGUA
Nesta se¸c˜ao ser˜ao relatados os polimorfismos estruturais das fases est´aveis e metaest´aveis da ´agua, como tamb´em, o poliamorfismo da fase v´ıtrea.
2.2.1
Estrutura do gelo
Ih
Esta forma s´olida do gelo ´e a mais comum, pois se manifesta a partir das condi¸c˜oes
oferecidas em fenˆomenos naturais na superf´ıcie da Terra. A an´alise do padr˜ao de difra¸c˜ao de raios-X fornece o arranjo geom´etrico do s´olido cristalino que ´e o gelo Ih. Neste, cada
´atomo de oxigˆenio est´a situado aproximadamente no centro de gravidade dos seus quatro ´atomos de oxigˆenio vizinhos [5]. A estrutura que se forma a partir deste arranjo ´e ilustrada
na Figura 2.2. As mol´eculas se arrumam por pontes de hidrogˆenio de maneira tetra´edrica e isso faz surgir no cristal uma simetria hexagonal. Outra caracter´ıstica do gelo Ih ´e que
Figura 2.2: a)Disposi¸c˜ao dos ´atomos de oxigˆenio no geloIh vista perpendicular ao eixo c. b) Estrutura vista ao longo do eixo c mostrando a base hexagonal.
Na Figura 2.3 est´a representada a c´elula unit´aria, a partir da qual toda a estrutura do cristal pode ser constru´ıda apenas repetindo as c´elulas por transla¸c˜ao dos eixos face a
face nas trˆes dire¸c˜oes.
Cada um dos oito ´atomos de oxigˆenio, situados nos v´ertices da c´elula s˜ao
compartilha-dos por mais oito c´elulas unit´arias, enquanto os quatro ´atomos das arestas s˜ao comparti-lhados por quatro c´elulas, sendo que dois ´atomos ficam completamente dentro da c´elula.
Assim uma c´elula unit´aria possui (8/8) + (4/4) + 2 = 4 mol´eculas de ´agua. Como o ˆangulo de uma estrutura tetra´edrica ´e 1090
28’, e rsendo a distancia entre um
´atomo de oxigˆenio e seu vizinho pr´oximo, podemos estimar o volume da c´elula unit´aria. Conforme ilustrado na Figura 2.3, ao longo do eixo c a proje¸c˜ao do ´atomo Z ´ersenθ′ ,
ondeθ′
´e o angulo entre o raio que liga os ´atomos S e Z e o plano base da c´elula unit´aria, sendo θ′
= 1090
28′
−900
= 190
28′
. A proje¸c˜ao do ´atomo Y no eixo c tamb´em ´e rsen θ′ ,
entre estas proje¸c˜oes, temos r, que ´e a distˆancia entre os ´atomos Y e Z. Por ´ultimo, a distˆancia r entre os ´atomos W e O completam o parˆametro c0 que ´e:
c0 = 2r(1 + sen 19 0
28′
) (2.17)
Se projetarmos o ´atomo Z na base da c´elula, o seu m´odulo ser´a dercosθ′
, esta proje¸c˜ao,
devido a simetria, forma um ˆangulo de 300
(rcosθ′
) cos 300
, o parˆametro a0 ´e metade deste resultado, ent˜ao mudando cos 19028′ ·
cos 300
para sen 540
44′
podemos escrever:
a0 = 2rsen 54 0
44′
(2.18)
a base da c´elula unit´aria ser´a ent˜ao a0 ·a0 sen 60 0
= 4r2
sen2
540
44′
sen 600
. Portanto o volume da c´elula ´e 8r3
(1 + sen 190
28′ ) sen2
540
44′
sen 600
, como a massa da ´agua ´e
2,992×10−26
kg, a densidade ´e dada por:
ρ= 4×2.992×10 −26
8r3(1 + sen 19028′) sen254044′ sen 600 (2.19)
Com o valor de ρ = 0,9167 Mg m−3
[6], podemos estimar o valor de r a 273 K como sendo 2,76 ˚A, este valor fornece um perfeito arranjo tetra´edrico.
Figura 2.3: C´elula unit´aria do geloIh (os hidrogˆenios foram omitidos).
Os v´arios elementos de simetria que os ´atomos de oxigˆenio exibem na estrutura
cristalina do geloIh, analisados por reflex˜ao e espalhamento de raios-X podem ser repre-sentados em cristalografia pelo s´ımbolo de espa¸co de grupo. Estes s´ımbolos podem ajudar
a interpretar os padr˜oes de espalhamento. Para o gelo Ih o s´ımbolo mais apropriado ´e o de Hermann-Mauguin, o P63/mmc [7]. O P indica que o espa¸co da c´elula unit´aria ´e
primitivo, o 63 indica que a rede ´e hexagonal com simetria ao longo do eixo c. O primeiro
se referem a um conjunto de planos de simetria paralelos ao eixo c os quais s˜ao planos especulares e planos deslizantes (Figura 2.4).
Figura 2.4: Elementos de simetria do gelo Ih: a) Planos especulares normais ao eixo c. b) Planos especular e deslizante. c) Representa¸c˜ao do plano deslizante.
2.2.2
Fase s´
olida da ´
agua em baixas temperaturas
A forma como a ´agua se apresenta depende das condi¸c˜oes de temperatura e press˜ao e de como os processos s˜ao realizados, como taxas de deposi¸c˜ao, atomiza¸c˜ao de got´ıculas,
emuls˜oes e m´etodos de observa¸c˜ao. A ´agua pode apresentar outras estruturas cristalinas al´em da fase hexagonal quando ´e resfriada sob press˜ao atmosf´erica, como o geloIc(c´ubico)
al´em da fase amorfa ou v´ıtrea. Esta ´ultima pode se apresentar em v´arias formas: o gelo amorfo de baixa densidade (LDA), o amorfo de alta densidade (HDA) e o gelo amorfo de
muito alta densidade (VHDA) [8].
A estrutura do gelo Ic ´e a mesma do diamante ou do germˆanio, a 143 K o parˆametro
de rede fica em torno de 6,35 ˚A, como ´e mostrado na Figura 2.5.
Se vapor de ´agua for depositado em uma superf´ıcie resfriada, a forma s´olida ser´a
determinada pela temperatura deste substrato.
Quando vapor de ´agua residual ´e condensado em um col´oide no interior de uma cˆamara
de difra¸c˜ao de el´etrons, os padr˜oes se mostram difusos `a 103 K (−1700
C) por´em, quando aquecido at´e 133 K (−1400
Figura 2.5: Arranjo estrutural do gelo c´ubico ouIc.
(grupo cristalogr´aficoFd3m) e acima de (−800
C), corresponde a estrutura hexagonal.
Os primeiros estudos de espalhamento de raios-X em vapor de ´agua depositado [9], revelaram padr˜oes que, abaixo de 163 K (−1100
C) apresentam um padr˜ao de poeira,
semelhante ao da ´agua l´ıquida, este padr˜ao define a chamada fase v´ıtrea ou gelo amorfo. A temperaturas pr´oximas e abaixo de 193 K (−800
C), o padr˜ao se mostra difuso, acima
deste o padr˜ao ´e o do gelo Ih. T´ecnicas mais modernas foram utilizadas para observar este comportamento e constataram fase v´ıtrea apenas a temperaturas abaixo de 113 K
(−1600
C) e quando aquecido at´e 143 K (−1300
C), se transforma irreversivelmente em gelo Ic (c´ubico), por´em nunca totalmente puro, sempre com percentagens relevantes de
gelo amorfo, e a partir desta temperatura 143 K ocorre a forma¸c˜ao de geloIh [10]. Estas diferen¸cas s˜ao devidas `a hist´oria t´ermica das amostras de gelo na fase v´ıtrea e
na fase c´ubica [11].
Outra forma de se obter gelo Ic com menos concentra¸c˜oes de gelo Ih ´e preparando
amostras de gelo II, III ou V em altas press˜oes, resfriando-as a temperatura do nitrogˆenio l´ıquido, reduzindo suas press˜oes at´e a press˜ao atmosf´erica para em seguida aquecˆe-las.
2.2.3
Fases s´
olidas a alta press˜
ao
Quando a ´agua ´e resfriada sob press˜oes que ultrapassam 2 kbar, suas mol´eculas podem
representadas em diagrama de fase, com exce¸c˜ao da fase v´ıtrea e do gelo Ic, o ponto triplo tamb´em n˜ao aparece por se manifestar a 6,113 × 10−3
bar, ficando muito abaixo
da escala. O campo indicado com IV se refere a um estado metaest´avel dentro da regi˜ao de estabilidade do gelo V, conseguido com ´agua pesada (D2O).
Os gelos tipo II e III foram os primeiros obtidos (1912), a partir de geloIh submetido a uma press˜ao de 2,2 kbar. O gelo Ih ´e a ´unica forma s´olida que se torna l´ıquida quando
a press˜ao ´e aumentada em certa faixa de temperatura. As outras transi¸c˜oes foram de-scobertas sempre que surgiam pequenas varia¸c˜oes de volume e densidade em amostras
quando a sua press˜ao ´e aumentada, com exce¸c˜ao do gelo VII e o IX que s˜ao caracteriza-dos por um ordenamento de seus ´atomos de hidrogˆenio. Algumas fases podem coexistir
dentro de outras faixas de estabilidade, como o III e o V que podem ocorrer na regi˜ao de estabilidade do gelo II.
2.3
NUCLEAC
¸ ˜
AO DO GELO
O gelo pode se formar a partir da deposi¸c˜ao do vapor de ´agua em uma superf´ıcie
resfriada ou pelo congelamento da pr´opria ´agua l´ıquida. Em ambos os casos, a fase inicial do gelo se d´a pela nuclea¸c˜ao de pequenas sementes de gelo. A nuclea¸c˜ao ´e a cristaliza¸c˜ao
localizada de um l´ıquido a partir destas sementes, que aumentam em n´umero e tamanho at´e que todo o volume se torne s´olido.
2.3.1
Tipos de nuclea¸c˜
ao
Embora n˜ao seja poss´ıvel refrigerar grandes quantidades de ´agua a temperaturas
abaixo de 273 K sem iniciar o congelamento, pequenas gotas e at´e mesmo amostras signi-ficativamente grandes (50 ml) de ´agua pura, podem ser resfriadas at´e temperaturas bem
abaixo de 273 K, e continuarem no estado l´ıquido. ´Agua l´ıquida abaixo de 273 K ´e dita
super-resfriada, e este estado ´e denominado metaest´avel.
Figura 2.6: Diagrama de fase da fase s´olida da ´agua, a linha s´olida ´e a linha est´avel medida, a linha ponto tracejada ´e a linha metaest´avel medida, a linha tracejada ´e a linha est´avel estimada e a pontilhada
´e uma extrapola¸c˜ao da linha metaest´avel cite/hobbs1.
recipiente, ou de um porta amostras, o gelo ´e dito formado pornuclea¸c˜ao heterogˆenea. Se
tais agentes n˜ao desempenham um papel na nuclea¸c˜ao, a fase s´olida se inicia a partir de
combina¸c˜oes de mol´eculas de ´agua se aglomerando e formando as sementes, estas podem crescer espontaneamente. Neste caso, o gelo ´e dito formado pornuclea¸c˜ao homogˆenea ou
espontˆanea.
2.3.2
Nuclea¸c˜
ao homogˆ
enea
dade que est˜ao associadas a um importante parˆametro de controle, a temperatura. As flutua¸c˜oes est˜ao associadas a cont´ınua forma¸c˜ao e desintegra¸c˜ao de sementes dentro da
fase l´ıquida. Por´em se certa semente de gelo tiver um tamanho maior que o cr´ıtico, esta forma ´e termodinamicamente mais vantajosa, e ent˜ao esta semente continua a aumentar
seu tamanho at´e formar um cristal de gelo microsc´opico.
Uma express˜ao aproximada para o n´umero de sementes de geloJLS que podem crescer
espontaneamente em uma unidade de volume por unidade de tempo pode ser constru´ıda da seguinte forma:
Supondo que mol´eculas de ´agua se agrupem dentro de ´agua super-resfriada para formar uma semente de gelo de volume υ e superf´ıcie A. Existem contribui¸c˜oes para GLM, a
energia livre do sistema, associada aos volumes das fases distintas e de suas interfaces. Portanto a energia livre para este caso, aumenta de:
∆GLS =nS(µs−µL)υ+σSLA (2.20)
onde ns ´e o n´umero de mol´eculas de ´agua no gelo por unidade de volume, µs e µL s˜ao
os potenciais qu´ımicos por mol´ecula nas fases l´ıquida e s´olida respectivamente, e σSL ´e a energia livre interfacial entre ´agua e gelo. Como o gelo apresenta v´arias fases s´olidas, o
n´umero de mol´eculas ´e o parˆametro que relaciona a propor¸c˜ao dos arranjos cristalinos com o volume, ou seja, quanto mais mol´eculas, mais compacta ser´a a estrutura, requerendo
mais energia para se formar. Os potenciais associam as energias livres de cada fase. Dada a rela¸c˜ao de Gibbs-Duhem
dµ=−s dT +υ dP (2.21)
podemos integr´a-la `a temperatura constante
µ= Z
υ dP +φ(T) (2.22)
de integra¸c˜ao. Se assumirmos um dado valor para o potencial qu´ımico na fase l´ıquida podemos estabelecer o valor do potencial qu´ımico na fase s´olida a partir da Equa¸c˜ao 2.22
µs−µL= Z S
L
υ(P)dP (2.23)
substituindo nesta express˜ao a equa¸c˜ao dos gases P υ = kT, obtemos a express˜ao entre parˆenteses da Equa¸c˜ao 2.20
µs−µL=−kTln(pL/pS) (2.24)
onde pL e pS s˜ao as press˜oes de vapor saturadas sobre as superf´ıcies da ´agua e do gelo a
temperatura T e k ´e a constante de Boltzmann.
Se considerarmos a aproxima¸c˜ao de uma semente de gelo para uma esfera, seu volume
e ´area de superf´ıcie, ser˜ao 4 3πr
3
α e 4πr2
β, respectivamente e os termos α e β s˜ao fatores maiores que a unidade.
Substituindo a express˜ao 2.24 na Equa¸c˜ao 2.20, obtemos:
∆GLS =− 4 3πr
3
αnSkTln(pL/pS) + 4πr
2
βσSL (2.25)
ou podemos reescrevˆe-la na forma geral da teoria da nuclea¸c˜ao:
∆GLS
kT =A0i
2/3
−B0i (2.26)
onde i ´e o n´umero de mol´eculas de ´agua na semente de gelo, A0 e B0 s˜ao quantidades
relacionadas a energia livre na superf´ıcie da interface ´agua-gelo e da diferen¸ca da energia livre do volume entre ´agua super-resfriada e gelo respectivamente [13].
A varia¸c˜ao de ∆GLS com i pela Equa¸c˜ao 2.26 ´e mostrada na Figura 2.7. Pode-se observar que a energia necess´aria para formar uma semente inicialmente cresce com o
n´umero de ´atomos na semente at´e um valor cr´ıtico, a partir deste i∗
Figura 2.7: Mudan¸ca na energia livre ∆GLS devido a forma¸c˜ao de uma semente de gelo contendo i
mol´eculas.
Podemos obter o raio cr´ıtico r∗
LS das sementes de gelo quando encontramos a
∂∆GLS/∂r = 0 da Equa¸c˜ao 2.25, a qual nos fornece:
r∗ LS =
2βσSL
αnSkTln(pL/pS)
(2.27)
onde a energia critica correspondente ´e:
∆G∗ LS =
16πσ3
SL(β
3
/α2
) 3[nSkT ln(pL/pS)]2
(2.28)
A partir da express˜ao de Boltzmann
S =k ln Ω (2.29)
ondeS´e a entropia do sistema e o Ω ´e o n´umero de sementes de tamanho cr´ıtico acess´ıveis, escrevemos Ω = n∗
nL, onde n
∗
unidade de volume e nL ´e o n´umero de mol´eculas por unidade de volume no l´ıquido. Utilizando a Fun¸c˜ao Generalizada de Massieu para a entropia [14]
S 1 T, P T
=S− 1
TU − P
T · V =− G
T (2.30)
onde G ´e a energia livre de Gibbs. Podemos substituir esta express˜ao na Equa¸c˜ao 2.29 e encontrar o n´umero de sementes de tamanho cr´ıtico por unidade de volume:
n∗
≈nLexp −
∆G∗ LS
kT
(2.31)
A taxa de nuclea¸c˜ao ´e determinada pela taxa com a qual uma semente de tamanho cr´ıtico incorpora a mol´ecula que desencadeia o processo de descida da rampa da Figura
2.7, crescendo livremente no sistema. Esta ´e definida por [13]:
J =n
kT h exp
−∆g kT
(2.32)
ondeh´e a constante de Planck, n´e a concentra¸c˜ao dispon´ıvel de mol´eculas na fase s´olida,
ou neste caso ser´a o n´umero de sementes de tamanho cr´ıtico por unidade de volume e ∆g
´e a energia de ativa¸c˜ao quando uma mol´ecula ´e transferida da ´agua para o gelo atrav´es
da superf´ıcie da semente.
Portanto a taxa de nuclea¸c˜ao ´e aproximadamente
JLS ≈
nLkT
h exp − ∆g kT exp − ∆G∗
LS
kT
(2.33)
Esta teoria foi levemente modificada por Hoffman e Buckle [15], de acordo com esse tratamento a taxa de forma¸c˜ao de n´ucleos pode ser expressa por
Ω =
β υm2/3
βσLSkT 9π
12 n
L
h
exp
−∆g
kT
(2.35)
K =−4β 3
σ3
LST
4
m 27kL2
m
(2.36)
e
τ = [T2
sT
3
]−1
(2.37)
onde υm ´e o volume molecular na fase s´olida, Tm ´e a temperatura do ponto de fus˜ao,Lm ´e o calor de fus˜ao `a Tm, eTs ´e a temperatura de super-resfriamento.
2.3.3
Teoria Macrosc´
opica da nuclea¸c˜
ao heterogˆ
enea
Esta ´e uma aproxima¸c˜ao da nuclea¸c˜ao heterogˆenea, baseada na nuclea¸c˜ao homogˆenea,
mas n˜ao considera os mecanismos microsc´opicos, em seu lugar ser˜ao inclu´ıdos os efeitos de um parˆametro macrosc´opico.
No caso em que temos o resfriamento da ´agua a partir da fase l´ıquida, a nuclea¸c˜ao heterogˆenea devido a impurezas, pode aumentar consideravelmente a temperatura a partir
do ponto onde ocorre a nuclea¸c˜ao homogˆenea.
A modelagem ´e, neste caso, constru´ıda tratando o crescimento da semente de gelo em
uma superf´ıcie nucleadora, esta pode ser um gr˜ao, cristal ou superf´ıcie de um recipiente ou outro objeto imerso na ´agua.
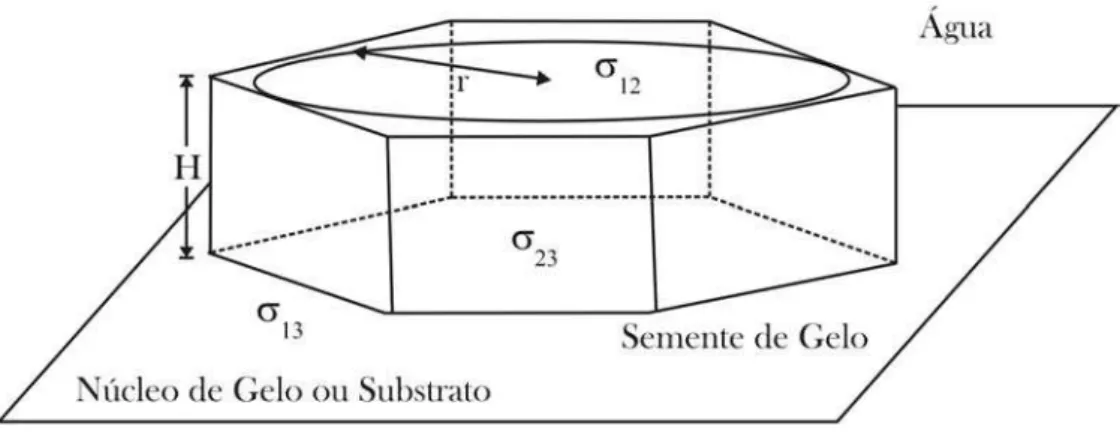
A superf´ıcie de energia livre da semente geralmente estar´a em seu m´ınimo de energia quando a forma da semente for um poliedro prism´atico de alturaH, com raio inscritor e
contendon faces prism´aticas (Figura 2.8). Quando a semente se forma em uma superf´ıcie plana, o aumento da energia livre do sistema ´e [16]
∆G=πr2ζH∆GV +πr
2
ζ(σ23−σ13) + (πr 2
Figura 2.8: Esquema de uma semente prism´atica sobre um substrato plano.
onde ∆GV ´e a diferen¸ca de energia livre por unidade de volume de gelo entre as fases
l´ıquida e s´olida,σij ´e a energia livre da interface entre as fases i e j, sendo que a fase 1 ´e a l´ıquida, a fase 2 ´e s´olida e a fase 3 ´e o material do substrato. Por ´ultimo,
ζ = n
π tan
π
n
(2.39)
Se definirmos a disparidade entre a semente de gelo e o substrato como:
γ = (σ12−σ13+σ23)/σ12 (2.40)
ent˜ao a Equa¸c˜ao 2.38 se simplifica para:
∆G=πr2ζ∆GV +πr
2
γζσ12+ 2πrζHσ12 (2.41)
Em ´agua super-resfriada ∆GV ´e negativo e 0 ≤ γ ≤ 2. Portanto o valor de ∆G inicialmente aumenta com o incremento de r e H, mas depois de certo tamanho cr´ıtico,
∂∆G
∂H = 0 e
∂∆G
∂r = 0 (2.42)
as quais d˜ao
r∗
= 2σ12 ∆GV
(2.43)
H =rγ (2.44)
e
∆G∗
= 4πζσ
3 12
∆G2
V
(2.45)
onder∗
´e o raio inscrito da semente de gelo de tamanho cr´ıtico e ∆G∗
´e a barreira cr´ıtica
de energia livre. A Equa¸c˜ao 2.44 fornece a forma de equil´ıbrio da semente de gelo. O n´umero de sementes de gelo de tamanho cr´ıtico por unidade de ´area do substrato ´e
dado aproximadamente por
n1exp
−∆G
∗
kT
(2.46)
onden1 ´e o n´umero de mol´eculas de ´agua absorvidas por unidade de ´area do substrato. A
taxa (de aumento de ´area superficial) com a qual as sementes de tamanho cr´ıtico ganham
uma mol´ecula adicional de ´agua para que a barreira de energia ∆G∗
seja ultrapassada, ´e a taxa de nuclea¸c˜ao a qual ´e dada por
J =A1n1exp
−∆G
∗
kT
(2.47)
A1 ´e a taxa de rede com a qual uma semente de tamanho cr´ıtico ganha uma mol´ecula de
´agua atrav´es de intera¸c˜oes com a fase l´ıquida da ´agua. Para a nuclea¸c˜ao a partir da fase
A1 =
kT h exp
−∆G
kT
(2.48)
onde ∆G´e a energia de ativa¸c˜ao necess´aria para transferir uma mol´ecula de ´agua atrav´es da superf´ıcie de contorno do gelo e da ´agua. Neste casoA1 ´e da ordem de 1031 m−2 s−1,
mesmo assimJ ´e determinado pela exponencial da Equa¸c˜ao 2.47.
2.4
CRESCIMENTO DO GELO
2.4.1
Forma¸c˜
ao do gelo crescido a partir de ´
agua super-resfriada
Em ´agua levemente resfriada contida em um pequeno recipiente, cuja temperatura fica em torno dos 272,5 K (−0,50
C), a nuclea¸c˜ao pode ocorrer de duas maneiras: A
primeira consiste em nuclea¸c˜ao por semente de gelo depositada na superf´ıcie, e a segunda, em permitir que a ´agua congele naturalmente. No segundo caso, h´a forma¸c˜ao de cristais
em formato de agulhas que crescem a partir da extremidade do recipiente em dire¸c˜ao ao centro. Quando um pequeno cristal de gelo ´e depositado na superf´ıcie da ´agua, um disco
circular, muito fino e claro, e agulhas cristalinas a´ı se formam. As agulhas se formam
isoladamente ou ao redor dos discos, e quando est˜ao em fase de crescimento, desenvolvem pequenas ramifica¸c˜oes que lhes confere a aparˆencia da estrutura de uma pena. Outras
formas de elipses deformadas tamb´em s˜ao comuns, mas a temperaturas abaixo de 172,1 K (−0,90
C) a forma predominante ´e a de agulhas e dendridos. Estas forma¸c˜oes tamb´em
s˜ao muito comuns em ´aguas de lagos e po¸cos de gelo derretido em geleiras, pois pequenos cristais podem se formar na atmosfera e quando caem na superf´ıcie da ´agua d˜ao in´ıcio ao
processo de nuclea¸c˜ao.
Em ´agua resfriada em temperaturas mais baixas, at´e 270,3 K (−2,7 0
C), pode-se
duas pirˆamides ocas ligadas `a semente pelos seus ´apices cujas faces s˜ao os seguimentos prim´arios. Em temperaturas abaixo de 267,5 K (−5,50
C), o crescimento de segmentos
secund´arios fica evidente e a partir de temperaturas mais baixas, as estruturas crescidas se tornam extremamente complexas.
2.4.2
Taxas de crescimento em ´
agua super-resfriada
O crescimento de estruturas cristalinas a partir de ´agua super-resfriada ´e determinado
por dois fatores dif´ıceis de separar, s˜ao elas a cin´etica de deposi¸c˜ao e a dissipa¸c˜ao do calor latente de fus˜ao. E outro problema ligado a estes fatores ´e a determina¸c˜ao da temperatura
da interface entre a ´agua e do gelo. Devido a estes fatores e da teoria do crescimento de cristais a partir do l´ıquido ainda ser pouco entendida n˜ao ´e poss´ıvel interpretar com certeza
alguns dados experimentais.
Existem trabalhos experimentais sobre a taxa de crescimento do gelo pela cuidadosa
deposi¸c˜ao de sementes de gelo com dire¸c˜oes preferenciais dos eixos c e a e a partir dos dendridos. O estudo do crescimento a parir de dendridos sem dire¸c˜ao preferencial ´e
dividido em duas classes: a da ´agua super-resfriada contida em tubos, que se refere a taxa linear de cristaliza¸c˜ao, e a segunda se refere a cristaliza¸c˜ao do gelo livre no volume de
´agua.
Medidas de velocidade de crescimento em dendridos formados no volume de ´agua
super-resfriada [18] entre 271 K e 266,5 K (−2 e −6.50
C) mostram que a velocidade de crescimento V pode ser expressa empiricamente por
V = 0,000028(Ts)
2,39
(2.49)
onde V est´a em unidades de m s−1
e Ts ´e a temperatura de super-resfriamento da ´agua.
At´e agora, nos casos apresentados acima, o calor latente de congelamento passa da superf´ıcie gelo-´agua para a ´agua super-resfriada elevando sua temperatura em alguns
por condu¸c˜ao pelo gelo rec´em formado, a superf´ıcie remanesce suave. Esta modalidade recebe o nome de crescimento planar [19]. Em rios e lagos o congelamento da ´agua se
d´a de cima para baixo a partir da superf´ıcie devido a transferˆencia de calor para o ar a partir da superf´ıcie congelada por nuclea¸c˜ao.
Mais adiante no Cap´ıtulo 4 ser˜ao mostrados os resultados experimentais que eviden-ciam o crescimento das fases s´olidas da ´agua e de outras substˆancias nos aparatos
Referˆ
encias Bibliogr´
aficas
[1] Debenedetti, P. G. e Stanley, H. E., Mysteries of water. physics today 40, june (2003)
[2] Buffett, B. A.(2000). Clathrates hydrates.Annu. Rev. Earth Planet. Sci. 28, 477-507.
[3] Wagman, D. D., Evans, W. H., Halow, I., Parker, V. B., Bailey, S. M., e Schumm, R. H. (1965). Selected values of chemical thermodynamic properties. I. Tables for the first twenty three elements in standard order of arrement, p. 124. Natn. Bur. Stand. Tech. Notes 270-1.
[4] Benedict, W. S., Gailer, N., e Plyler, E. K.(1956). Rotation-vibration spectra of deuteriated water vapor.J.chem.Phys. 24, 1139-65.
[5] Bragg, W. H.(1922). The crystal structure of ice.Proc. phys. Soc. 34, 98-103. [6] Ginnings, R. M. and Coulson, R. J.(1947). An improves ice calorimeter–the
de-termination of its calibration factor and the density of ice at 00
C.J. Res. natn Bur.
Stand. 38, 583-91.
[7] Rousseau, D.L., Bauman, R. P. e Porto, S. P. S.(1981) Journal of Raman Spec-troscopy, Vol.10, 253.
[8] Stanley, H. E.(1999), Liquid water: a very complex fluid.Pramana- J. phys Vol.53. [9] Burton, E. F. e Oliver, W. F.(1935). The crystal structure of ice at low
[10] Dowell, L. G. e Rinfret, A. P.(1960). Low-temperature forms of ice as studied by X-ray difraction.Nature, Lond. 188, 1144-8.
[11] Bertie, J. E. e Whalley, E. (1964). Infrared spectra of ice II, III e IV in the range 4000-350 cm−1
. J. chem. Phys. 40, 1646-59.
[12] Hobbs, P. V., Ice Physics – Claredon Press. Oxford (1974).
[13] Turnbull D, e Fsher, J. C. (1949). Rate of nucleation in condensed systems. J. chem. Phys. 17, 71-3.
[14] Callen, H. B. (1985) Thermodynamics and introduction to thermostatistics – John Wiley & Sons, Inc. 2nd Edition.
[15] Hoffman, J. D. (1958). Thermodynamic driving force in nucleation and growth process. J. chem. Phys. 29, 1192-3.
[16] Fletcher, N. H. (1960). Nucleation an growth of ice crystals upon crystalline sub-strates. Aust. J. Phys., 16, 408-18.
[17] Macklin, W. C. and Ryan, B. F. (1965). The structure of ice grown in bulk super-cooled water. J. atmos. Sci. 22, 452-9.
[18] Lindenmeyer, C. S. (1959). The solidification of supercolled aqueous solutions, p.117. Ph.D Thesis, Havard University.
Cap´ıtulo 3
PROCEDIMENTOS
EXPERIMENTAIS
Neste cap´ıtulo ser˜ao descritos os aparatos de medidas que foram utilizados para a inves-tiga¸c˜ao do comportamento t´ermico dos l´ıquidos: ´agua destilada, ´alcool et´ılico (C2H5OH)
e acetona ((CH3)2OH). As ´ultimas com alto grau de pureza (99,9%).
Foram utilizadas trˆes t´ecnicas distintas: termoel´etrica, convencional e criogˆenica,
com a finalidade de observar o comportamento das amostras em diferentes regimes ter-modinˆamicos e identificar os aspectos das suas transi¸c˜oes.
Para cada t´ecnica foi elaborado um procedimento, a menos na t´ecnica criogˆenica, que foi procedida de duas maneiras, relevando a influˆencia de detalhes de condi¸c˜oes de
contorno e seus efeitos no fluxo de calor no sistema do porta-amostras. Em todas as t´ecnicas os porta-amostras s˜ao idˆenticos.
Nas pr´oximas se¸c˜oes ser˜ao abordados os processos de refrigera¸c˜ao com a descri¸c˜ao das t´ecnicas, mas antes ser´a descrito brevemente o sistema de aquisi¸c˜ao de dados com uma
introdu¸c˜ao aos dispositivos termoel´etricos.
3.1
SISTEMA DE AQUISIC
¸ ˜
AO DE DADOS
equipa-mento d´a suporte `a programa¸c˜ao remota, permitindo o seu controle externo por um computador via interfaceamento GPIB (General Purpose Interface Bus). Como o
Data-Acquisition ´e um Data Loger(registrador de dados), os dados de uma medida podem ser armazenados em um banco de dados via software. O equipamento ´e integrado a uma
unidade seletora (Switch Unit), possuindo 20 canais com isolamento interno. Cada canal pode fazer medidas diretas de temperatura al´em de outras como voltagem, corrente e
freq¨uˆencia [1].
Quando em opera¸c˜ao, o Data-Acquisition realiza leituras numa seq¨uˆencia chamada
Lista de Varredura (scan list). Nesta seq¨uˆencia programam-se quantos e quais canais ser˜ao utilizados. Em medidas de temperatura cada canal acessa um termopar por interm´edio
de um rel´e. Durante uma medida, cada rel´e fica ativado durante 16 ms, neste intervalo chamado de tempo de integra¸c˜ao, o sistema acessa o termopar selecionado e armazena a
leitura de temperatura em arquivo de banco de dados. Entre duas leituras consecutivas existe um tempo de espera pre-determinado de 2 ms que ´e o delay do canal (Channel
Delay). Este intervalo se faz necess´ario porque durante a abertura e fechamento dos rel´es podem ocorrer repiques, os quais ocasionariam erros nas medidas. No diagrama da Figura
3.1 est´a representado uma Lista de Varredura de 6 Canais. H´a tamb´em a possibilidade de se programar um tempo (Delay) entre varreduras.
Neste trabalho todas as medidas foram programadas para que a soma dos tempos entre a Lista de varredura e oDelay fosse de 1 s.
3.2
DISPOSITIVOS TERMOEL´
ETRICOS
Os dispositivos termoel´etricos existentes, concebidos para aplica¸c˜oes em medidas de temperatura, de fluxo de calor e tamb´em na refrigera¸c˜ao, s˜ao realiza¸c˜oes que tiveram in´ıcio
quando Seebeck (1821) observou que em jun¸c˜oes de metais dissimilares, sob aquecimento, pronunciavam-se fenˆomenos el´etricos.
S˜ao cinco os efeitos termoel´etricos: o efeito Seebeck, o Joule, o Fourier, o Peltier e o
Thomson. Dentre eles, dois em especial s˜ao os empregados nos dispositivos para os fins acima citados e logo mais ser˜ao discutidos com detalhes.
Apesar de estes fenˆomenos surgirem ao mesmo tempo nos dispositivos, seus efeitos
podem ser balanceados por fatores de constru¸c˜ao como o arranjo e o tipo de jun¸c˜ao, al´em da escolha dos materiais. Estes fatores s˜ao caracter´ısticas da natureza dos materiais
utilizados, como por exemplo, os semicondutores, que apresentam baixa condutividade t´ermica, como os isolantes, por´em sob certa diferen¸ca de potencial el´etrico, os
semicon-dutores conduzem corrente el´etrica como os metais. Estas caracter´ısticas conferiram aos dispositivos um rendimento razo´avel, o que torna poss´ıvel a refrigera¸c˜ao termoel´etrica.
3.2.1
Termopares
Os termopares s˜ao dispositivos formados por dois metais ou ligas met´alicas cujas
ex-tremidades s˜ao unidas numa jun¸c˜ao. Quando esta jun¸c˜ao ´e aquecida surge entre os metais uma diferen¸ca de potencial el´etrico que ´e proporcional a esta temperatura, este ´e oefeito
Seebeck. A Figura 3.2 mostra um esquema para explicar o efeito. As jun¸c˜oes do termopar formado pelos condutores A e B est˜ao em contato com dois reservat´orios de calor
diferen-tes, a jun¸c˜ao de teste est´a `a temperatura mais alta T, enquanto a jun¸c˜ao de referˆencia est´a `aTR. Nesta situa¸c˜ao pronuncia-se no circuito uma for¸ca eletromotrizεAB. Em cada
material existem bandas e n´ıveis de energia permitidas de valˆencia e de condu¸c˜ao, onde os portadores de carga se distribuem. Para uma jun¸c˜ao, os n´ıveis deFermi dos dois metais
Figura 3.2: (a) Termopar formado pelos condutores A e B com suas jun¸c˜oes nos reservat´orios t´ermicos as temperaturas T e TR. (b) N´ıveis de energia entre os metais A e B e as energias de Fermi em cada
jun¸c˜ao.
superior a barreira, h´a um desn´ıvel e as densidades nos condutores s˜ao diferentes pro-movendo um fluxo de el´etrons de A para B. Na jun¸c˜ao a T o n´ıvel de Fermi ´e maior que
a barreira, desta forma os el´etrons em B podem fluir para o metal A. com isso a difus˜ao dos portadores nos dois metais gera um movimento l´ıquido de cargas que n˜ao ´e devido a
um campo eletrost´atico de uma bateria externa.
Para um dado valor de TR, εAB ´e uma fun¸c˜ao de T. Para um outro valor constante
de TR a rela¸c˜ao entre εAB e T continua a mesma, a menos de uma constante. Logo, a
potˆencia termoel´etrica ´e ∂ε
∂T, pois depende apenas dos materiais A e B e da temperatura
T.
Onsager [6] mostrou que a varia¸c˜ao da diferen¸ca de potencial por unidade de varia¸c˜ao
de temperatura, a corrente el´etrica nula, ´e
ǫ =−
dε dT
I=0
(3.1)
onde oǫ ´e conhecido como coeficiente de Seebeck.
mantida a uma temperatura T, enquanto que as duas jun¸c˜oes c e d, ambas com fios de cobre C s˜ao mantidas a uma temperatura de referˆencia (que pode ser a do gelo em fus˜ao
ou a temperatura de um circuito eletrˆonico calibrado dedicado a manter sua temperatura a um valor rigorosamente conhecido).
Figura 3.3: Esquema do circuito para a medida da diferen¸ca de potencial de Seebeck no termopar formado pelos metais A e B.
Estas jun¸c˜oes geralmente s˜ao as liga¸c˜oes entre os contatos el´etricos das trilhas de cobre dos circuitos dos equipamentos de medidas e os fios do termopar. Os fios de cobre s˜ao
ligados aos terminais a e b (mantidos a mesma temperatura T0) de um potenciˆometro
para compensar a diferen¸ca de potencial el´etrico, mantendo a correnteI = 0. Aplicando
a Equa¸c˜ao 3.1 aos fios A, B e C integrando entre os extremos de cada um temos:
εa−εc = Z TR
T0
ǫC dT (3.2)
εc−εe = Z T
TR
ǫA dT (3.3)
εe−εd= Z TR
T
ǫB dT (3.4)
εd−εb = Z T0
TR
somando as Equa¸c˜oes 3.2 a 3.5, obtemos a diferen¸ca de potencial entre os metais A e B (εa− εb = εAB):
εAB = Z T
TR
(ǫA−ǫB)dT (3.6)
Dependendo dos metais e da escala de temperatura, o coeficiente ´e independente de
T. Ent˜ao a Equa¸c˜ao 3.6 se torna
εAB =ǫAB(T −TR) (3.7)
onde ǫAB ´e o coeficiente Seebeck entre os dois metais.
Existem hoje muitos tipos de termopares, eles s˜ao classificados de acordo com os materiais de que s˜ao constitu´ıdos e por seus limites de temperatura dentro de ambientes
que tamb´em podem interagir quimicamente com eles.
Tipo Fio Positivo Fio Negativo Faixa de Temperatura
B Platina-30% R´odio Platina-60% R´odio 523 K 2093 K (2500
C−18200
C)
J Ferro Constantan 63 K 1473 K (−2100
C−12000
C)
K Niquel-Cromo Niquel-Alim´ınio 73 K 1643 K (−2000
C−13700
C)
T Cobre Constantan 73 K 673 K (−2000
C−4000
C)
E Niquel-Cromo Constantan 73 K 1273 K (−2000
C−10000
C)
N Niquel-Cromo-Silicio Niquel-Silicio-Magn´esio 63 K 1473 K (−2100
C−12000
C)
R Platina-13% R´odio R´odio 223 K 2033 K (−500
C−17600
C)
S Platina-10% R´odio Platina 223 K 2033 K (−500
C−17600
C)
Tabela 3.1: Tipos de Termopares
Neste trabalho os termopares utilizados s˜ao todos do tipo J, pares de fios de ferro e
3.2.2
Placas Peltier
As placas Peltier s˜ao dispositivos baseados em um efeito termoel´etrico que recebe o
nome de seu descobridor, Jean Charles Peltier, que o observou em 1834.
O efeito Peltier ocorre quando se aplica uma diferen¸ca de potencial el´etrico em um
circuito formado por dois condutores ou semicondutores, isto gera uma corrente el´etrica que atravessa suas jun¸c˜oes, onde se observa uma diferen¸ca de temperatura que n˜ao ´e
devido ao efeito Joule. ´
E observado experimentalmente que calor absorvido ou liberado em uma jun¸c˜ao, menos
a contribui¸c˜ao do o efeito Joule, ´e proporcional a corrente aplicada
q=π·I (3.8)
onde π ´e o coeficiente Peltier.
Com o desenvolvimento e dom´ınio de t´ecnicas de crescimento de semicondutores, a partir de 1960, foi poss´ıvel desenvolver jun¸c˜oes entre materiais semicondutores e metais,
isto possibilitou a constru¸c˜ao de pares termoel´etricos cujo coeficiente Peltier ´e centenas de vezes maior que numa jun¸c˜ao entre metais. A Figura 3.4 mostra o esquema de um
par termoel´etrico formado por semicondutores de Telureto de Bismuto (Bi2Te3), com
dopagens do tipo P e N, estes tipos se referem aos portadores de cargas majorit´arios em
cada semicondutor. Os Semicondutores apresentam-se como pequenos paralelep´ıpedos com dimens˜oes da ordem de 1 a 1,5 mm.
Na realidade, na parte superior assim como na parte inferior da unidade
represen-tada na Figura 3.4 existem, em cada uma, duas jun¸c˜oes: uma semicondutor-metal e outra metal-semicondutor, enquanto que na outra parte h´a uma metal-semicondutor e
semicondutor-metal, respectivamente. Neste arranjo o calor flui pelos materiais com o sentido de acordo com a corrente el´etrica dos portadores de carga, ou seja, no
semicon-dutor tipo P a corrente t´ermica tem o mesmo sentido da corrente el´etrica convencional, enquanto que no semicondutor tipo N a corrente t´ermica tem sentido oposto ao da corrente
Figura 3.4: Par termoel´etrico composto pelos semicondutores Telureto de Bismuto (Bi2Te3) tipos P e
N em um circuito el´etrico.
A conex˜ao do Efeito Peltier com o efeito Seebeck, ambos revers´ıveis e considerados
efeitos opostos, pode ser feita quando a partir da jun¸c˜ao superior da Figura 3.4, em uma dada temperatura, se pronunciam correntes de calor (IqN e IqP), levadas pelas correntes
el´etricas dos portadores de cargas. Como a jun¸c˜ao apresenta uma resistˆencia el´etrica R, calor surge na jun¸c˜ao por efeito Joule devido a corrente I, ent˜ao para manter a
tempera-tura constante na jun¸c˜ao, uma quantidade de calor ´e absorvida do ambiente, designada porIq, portanto
Iq=I2R−IqN −IqP (3.9)
da Equa¸c˜ao 3.8
πN PI =Iq−I
2
R (3.10)
usando a Equa¸c˜ao 3.9 obtemos
πN PI =−IqN −IqP (3.11)
IqN =−IT ǫN (3.12a)
IqP =IT ǫP (3.12b)
o sinal negativo na Equa¸c˜ao 3.12a se refere ao sentido contr´ario ao da corrente
conven-cional da corrente dos portadores de carga no semicondutor N que s˜ao os el´etrons. Agora substituindo as Equa¸c˜oes 3.12 na 3.11
πN P =T(ǫN −ǫP) (3.13)
que ´e a equa¸c˜ao que relaciona o coeficiente Peltier dos semicondutores com seus coeficientes
Seebeck.
Na pr´atica uma placa Peltier ´e composta por uma s´erie de pares termoel´etricos que
s˜ao dispostos em s´erie entre duas lˆaminas de material cerˆamico (Alumina), estas lˆaminas s˜ao eletricamente isolantes por´em, s˜ao ´otimas condutoras t´ermicas. Isto ´e importante,
pois os pares de semicondutores s˜ao arranjados de forma que suas jun¸c˜oes, as quais s˜ao intermediadas por pequenos condutores laminares, fiquem acomodadas como mostrado
na Figura 3.5, com isso a corrente el´etrica circula em todos os blocos num circuito em s´erie, somando seus efeitos t´ermicos como em uma liga¸c˜ao em paralelo.
3.3
O SISTEMA TERMOEL´
ETRICO
A t´ecnica termoel´etrica aqui apresentada se utiliza de uma cˆamara (porta-amostras) acoplada a um m´odulo termoel´etrico, que propicia um fluxo t´ermico da amostra para o
ambiente, enquanto isso a temperatura da amostra ´e medida em fun¸c˜ao do tempo atrav´es de termopares por um sistema de aquisi¸c˜ao de dados.
3.3.1
Descri¸c˜
ao e Procedimento
O aparato ´e composto por duas partes principais, a primeira ´e um pequeno becker
(porta-amostras) de alum´ınio, com 45 mm de diˆametro, 52 mm de altura e com capacidade para 80 mℓ, revestido externamente por uma camada de 2,0 cm de espessura de espuma
de poliestireno (isopor) que propicia um ´otimo isolamento t´ermico. Este revestimento forma um cubo ao longo do becker deixando as extremidades expostas. As partes s˜ao